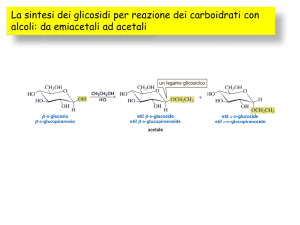
Reazioni di Idrolisi
Trasformazioni idrolitiche di esteri e ammidi (proteasi
(proteasi,, esterasi,
esterasi,
lipasi)
Vantaggi: assenza di cofattori sensibili, disponibilità
disponibilità di un largo
numero di enzimi non altamente specifici.
Ampio utilizzo in sintesi organica (2/3 delle biotrasformazioni)
biotrasformazioni)
Meccanismi e aspetti cinetici
Meccanismo di idrolisi enzimatica di ammidi e esteri
Attacco nucleofilo da parte di un gruppo attivo dell’
dell’enzima alla gruppo
carbonilico dell’
dell’estere o ammide (idrolisi basica)
Gruppo attivo: -OH (serina)
serina) esterasi di fegato di maiale, lipasi microbiche
-COO- (acido aspartico)
aspartico) pepsina
-SH (cisteina)
cisteina) papaina
Meccanismo serina idrolasi
Meccanismo serina idrolasi
Idrolisi di proteine enzima catalizzata
istidina
serina
Acido aspartico
Enzima
Chimotripsina (serina proteasi)
proteasi)
Substrato
Complesso EnzimaEnzima-Substrato
Intermedio tetraedrico
Nuovo peptide N-terminale
In ambienti con basse concentrazioni di acqua
altri nuclofili competono con l’acqua:
9Acil transfer: reazione di un altro alcol (trans
-esterificazione)
(transesterificazione)
9Amminolisi:
N-sostituita)
Amminolisi: reazione di RNH2 (ammide N9Reazione con H2O2 (peracidi, RCOOOH)
9Reazione con tioli (tioesteri)
tioesteri) non avviene
Sintesi enzimatica stereoselettiva
(substrati achirali)
achirali)
Sintesi enzimatica stereoselettiva (substrati achirali)
achirali)
Si genera un nuovo stereocentro grazie
alla tautomeria cheto enolica
Sintesi enzimatica stereoselettiva (substrati achirali)
achirali)
Reagisce preferenzialmente uno dei gruppi enantiotopici
Si genera una nuova unità stereogenica
Sintesi enzimatica stereoselettiva (substrati achirali)
achirali)
Processo ad uno stadio (diesteri
(diesteri))
Idrolisi dell diestere dell’acido malonico α,α-disostituito ad opera
dell’
dell’α-chimotripsina o dell’
dell’esterasi di fegato di maiale (PLE)
La reazione si ferma dopo l’
l’idrolisi del primo gruppo poiché
poiché il
prodotto è fortemente idrato in ambiente acquoso e non viene più
più
accettato dall’
dall’idrolasi
Cosa accade se la reazione procede? (seconda idrolisi)
Sintesi enzimatica stereoselettiva (substrati achirali)
achirali)
Processo a due stadi (diacetato
(diacetato))
Il prodotto di monomono-idrolisi,
idrolisi, monoacetato,
monoacetato, è meno polare per cui si ottiene
anche il secondo processo che porta nuovamente ad un prodotto achirale.
achirale.
La velocità però è inferiore (processo meno favorito) quindi si può
recuperare il monoestere chirale ad elevati ee
Sintesi enzimatica stereoselettiva (substrati achirali)
achirali)
Composti meso (meso
-trick)
(mesotrick)
Sintesi enzimatica stereoselettiva (substrati achirali)
achirali)
Composti meso (meso
-trick)
(mesotrick)
Processo a doppio stadio, diacetato
Cinetiche processi a singolo stadio
(reazione in ambiente acquoso, processo irreversibile)
Selettività
S= substrati achirale con gruppi enantiotopici
o composto meso
P,Q= prodotti enantiomerici
L’ ee dipende dal rapporto k1/k2, che è costante nel corso di tutta la reazione
Quindi l’ee
l’ee non varia al variare della conversione, è costante
Cinetiche processi a doppio stadio
(reazione in ambiente acquoso, processo irreversibile)
Il secondo processo è una risoluzione
cinetica. Solitamente la selettività
dell’enzima è la stessa, per cui se k1>k2 k4
sarà maggiore di k3.
Con la conversione si otterrà un aumento
nell’ee
nell’ee del prodotto, mentre la resa in
prodotto diminuisce
Conversione
Cinetiche processi a doppio stadio
(reazione in ambiente acquoso, processo irreversibile)
Resa chimica dipende da:
Selettività dipende da:
Per avere alte rese in prodotto [Q+P]
Per avere alte stereoselezioni in prodotto [P]
Cinetiche processi a doppio stadio
(reazione in ambiente acquoso, processo irreversibile)
Enzimi come Biocatalizzatori
PLE pig liver esterase,
esterase, PPL porcine pancreatic lipase
Cambiando enzima si ottiene opposta stereoselezione
(eePLE= 42%, eePPL=89%)
La risoluzione cinetica aumenta l’ee
l’ee
Risoluzione cinetica
Primo esempio riportato risale al 1903
Nelle biobio-trasformazioni le risoluzioni cinetiche sono 4 volte più
frequenti delle trasformazioni stereoselettive
Risoluzione cinetica
Resa massima teorica: 50%
In alcuni casi kS>>k
>>kR, si trasforma solo uno dei due enantiomeri
Cinetiche di risoluzioni enzimatiche (Sih
(Sih))
Selettività di una risoluzione = E = Enatiomeric Ratio
Eutomero:
Eutomero: enantiomero con la massima reattività
Distomero:
Distomero: enantiomero con bassa reattività o indesiderata
Risoluzione cinetica enzimatica
Costanti cinetiche sono
difficili da misurare
Si preferisce utilizzare
gli ee e la conversione
Dipendenza del valore di ee contro la conversione
Processo di risoluzione enzimatica a due stadi
I stadio: la reazione viene
bloccata al 40% per il quale il
prodotto ha un ee/resa
ee/resa
massimizzata (vicini al punto
X)
II stadio: il substato viene
idrolizzato nuovamente fino
ad una conversione
complessiva del 60%, con un
recupero di reagente ee/resa
ee/resa
ottimale. Si sacrifica il 20%
di prodotto
Processo di risoluzione enzimatica reversibile
L’ee
L’ee del substrato varia ha un profilo diverso rispetto a quello delle
delle
reazioni irreversibili.
Ad alti livelli di conversione la reazione inversa diventa più importante.
importante.
Ovviamente sarà lo stesso enantiomero a reagire preferenzialmente,
preferenzialmente,
portanto ad una diminuzione dell’ ee globale del substrato.
Per cui si deve operare in condizioni in cui la reazione sia irreversibile
irreversibile
(per esempio aumentando la concentrazione del nucleofilo)
Risoluzione biocatalitica sequenziale
Il substrato racemo ha due siti di reazione uguali, per cui la reazione
reazione
procede due volte con la formazione di un mono estere intermedio
In pratica il substrato deve coordinarsi al sito attivo e reagire
reagire due volte
Si ottengono selettività molto alte
Etot rappresenta la selettività che
un singolo processo dovrebbe avere
per ottenere questi ee
Risoluzione enzimatica sequenziale: idrolisi - esterificazione
Meccanismo
L’acetato racemo A e B viene idrolizzato per dare gli alcoli P e Q in un mezzo
organico contenente il minimo quantitativo di acqua.
Per cui, per azione della stessa lipasi, si ha l’esterificazione degli alcoli P e Q
ad opera dell’acido cicloesanoico presente nella miscela di reazione.
Il processo avviene quindi due volte con un notevole incremento della
stereoselezione del processo
Nel caso specifico si ottiene una Eapparente=400 utilizzando processi che hanno
E1=8 (idrolisi) e E2=97 per l’esterificazione di P/Q con l’acido cicloesanoico
Deracemizzazioni
Risoluzione cinetica: svantaggi
-Massima resa del 50%. Scarsa importanza dell’enantiomero
dell’enantiomero non voluto
-Separazione del substrato dal prodotto può essere complessa e costosa
costosa
-Eccesso enantiomerico dei prodotti non ottimale
Per evitare questi svantaggi si possono utilizzare varie strategie:
strategie:
Risoluzione Ripetuta
Inversione inin-situ
Risoluzione Dinamica
Risoluzione Ripetuta
L’enantiomero
), dopo separazione, viene racemizzato
L’enantiomero non voluto (distomero
(distomero),
e riutilizzato nel successivo ciclo di risoluzione cinetica
Approccio importante in processi industriali (sistemi in continuo)
continuo)
Conversione totale nel prodotto voluto (virtuale)
Ciclo
Eutomero (%)
Distomero (%)
1
50
50
2
25
25
3
12.5
12.5
6.25
6.25
93.75
6.25
4
Dopo 4 cicli teorica resa del ca 94%
Rese reali più basse a causa delle condizioni energiche richieste
richieste per la racemizzazione
Uso di racemasi
Racemasi
In generale riescono a racemizzare:
racemizzare:
-sistemi che contengono stereocentri con un protone
-sistemi nei quali il protone è vicino ad un gruppo elettron attrattore
attrattore
ammino acidi
HR
H2N
HR
COOH
HO
COOH
α-idrossiacidi
idrossiacidi,,
Classificazione in base ai siti basici nel sito attivo
Enzimi oneone-base (alanina
(alanina racemasi)
racemasi)
Richiedono il piridossil fosfato (PLP) come cofattore
Enzimi twotwo-base (proline,
proline, idantoina racemasi)
racemasi)
Meccanismo di azione non ancora chiarito
Racemasi e relativi substrati
Inversione inin-situ
Utilizzabile con molecole che contengono un singolo stereocentro.
stereocentro.
A seguito di una risoluzione cinetica il reagente e il prodotto vengono
ottenuti nelle due forme enantiomeriche.
enantiomeriche. Il reagente o il prodotto,
opportunamente modificato, viene trasformato mediante un processo
processo
stereospecifico,
stereospecifico, portando ad un derivato del prodotto o del reagente con
la stessa configurazione assoluta.
Esempio: idrolisi di esteri
In una reazione di idrolisi, l’alcol che si ottiene viene trasformato
trasformato
in tosilato o triflato che viene poi idrolizzato con inversione di
configurazione. Nelle stesse condizione l’estere a opposta
configurazione viene idrolizzato con ritenzione di configurazione
configurazione
Inversione inin-situ
Poiché eeS e eeP dipendono dalla conversione,
la conversione deve essere calcolata in funzione del valore di E
(usualmente intorno al 50%)
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
Alogenuri metilici, primari e molti secondari reagiscono con nucleofili
attraverso un processo bimolecolare.
bimolecolare.
Processo a 10 ee-, improbabile per un carbonio elettrofilo
Meccanismo concertato
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
Cinetica
Reazione elementare
S N2
Decorso stereochimico di una reazione SN2
Produzione di prodotti a configurazione opposta a partire da reagenti
reagenti
enantiopuri
Paul Walden
Quale è il prodotto principale per le due reazioni?
Indicare la configurazione assoluta dei prodotti
Reattività degli alcoli
OH- è un cattivo gruppo uscente
perché è una base forte
L’OH- deve essere trasformato in un miglior
gruppo uscente
Mediante reazione acidoacido-base
si genera l’alcol protonato
H2O è un buon gruppo uscente perché
è una base debole
Solo HBr e HI forniscono sostituzioni nucleofile con alcoli primari
HCl in presenza di ZnCl2
ESTERI SOLFONICI
O
O
Me
O
S
OR
O
F3C
O
S
OR
Sintesi
O
S
OR
Sostituzione intermolecolare
Sostituzione intramolecolare
alcol
solfonato
alcol
prodotto di sostituzione
prodotto di sostituzione
Vantaggi dell’uso di solfonati:
solfonati:
• La reazione è stereospecifica (alcoli secondari)
• Si evita la formazione di carbocationi intermedi e
quindi eventuali riarrangiamenti
• Si possono usare molti nucleofili
Come effettuereste la seguente trasformazione?
Risoluzione Dinamica
La risoluzione avviene in condizioni nelle quali il substrato racemizza rapidamente.
Diverse reazioni avvengono contemporaneamente:
9 L’enzima deve avere un’elevata specificità per uno degli enantiomeri (kS>>k
>>kR o
kR>>k
>>kS).
9 L’idrolisi non catalizzata deve essere trascurabile
9 La racemizzazione del substrato deve avvenire a velocità uguali e maggiori della
reazione enzimatica (k
(kracSub≥kR o kS) al fine di consentire concentrazioni
sufficienti di enantiomero buono
9 La racemizzazione del prodotto deve essere trascurabile
Risoluzione Dinamica
diminuzione di eeP
a causa delle
risoluzione cinetica
Risoluzione Dinamica
con la risoluzione dinamica si possono ottenere elevati
valori di eePP solo per elevate stereoselezioni
E=19 eePP=90%; E=40 eePP=95%; E=100 eePP=98%
Idrolisi del legame ammidico
Idrolisi del legame ammidico
L’idrolisi delle ammidi è naturalmente legato al mondo
dei peptidi e ammino acidi
Produzione mondiale superiore ai 0.5 milioni di tonellate
Ammino acidi più importanti:
Acido LL-glutammico
L-lisina
D,L
D,L-methionina
Prodotti per fermentazione o per via sintetica
Idrolisi del legame ammidico
D e L ammino acidi vengono prodotti con metodi enzimatici
Idrolisi del legame ammidico
Metodi più importanti per la produzione di ammino acidi
Risoluzione
proteasi, esterasi e
Risoluzione di
di substrati
substrati racemi
racemi via
via idrolisi
idrolisi con proteasi,
lipasi:
lipasi: metodo
metodo più usato perché
perché facile
facile ed
ed economico
economico
Criteri generali
Idrolisi del legame ammidico
Generalmente il substrato con configurazione L viene accettato
dall’enzima e trasformato mentre il D non reagisce e viene recuperato
recuperato
dal mezzo di reazione.
Se l’enantiomero
l’enantiomero D è il prodotto desiderato lo si può ottenere
utilizzando opportuni gruppi protettori.
Con opportuni enzimi (idantoinasi
(idantoinasi)) sono disponibili anche enzimi che
accettano preferenzialmente l’enantiomero
l’enantiomero D.
I due enantiomeri si separano agevolmente sfruttando le diverse
caratteristiche del reagente e del prodotto, per esempio solubilità
solubilità a
diversi pH.
pH. Questo consente la separazione via estrazioni o
cromatografie con resine a scambio ionico.
Generalmente questi enzimi accettano solo ammino acidi α-sostituiti
Idrolisi del legame ammidico
Riciclo enantiomero non desiderato via racemizzazione
Il prodotto non voluto viene generalmente racemizzato come estere
per via termica (150°(150°-170°C).
Le ammidi possono essere racemizzate via trasformazioni in basi di
Shiff con aldeidi aromatiche (benzaldeide, aldeide salicilica), metodo
metodo
più blando
Possono essere usati enzimi quali le racemasi
Risoluzioni con esterasi o proteasi
La risoluzione avviene per azione di una esterasi
idrolizzare solamente una funzione esterea)
esterea) o di
(che è in grado di
una proteasi
La funzione amminica è solitamente protetta R2=Ac, Z, Boc per
evitare reazioni collaterali.
R1 è una catena alifatica corta per consentire velocità di reazioni
reazioni
ragionevoli.
α-chimotripsina
Idrolisi del legame ammidico
Sistema molto studiato e di cui si conosce bene il meccanismo di azione.
Risolve l’
l’enantiomero L
Idrolisi del legame ammidico
Risoluzione dinamica con una proteasi
PLP può essere sostituito
dall’analogo derivato non
fosforilato o dall’aldeide
salicilica
Risoluzioni con amidasi
Idrolisi del legame ammidico
Le amidasi possono essere ottenute da reni e pancreas di mammiferi
o da microorganismi (Pseudomonas,
Pseudomonas, Aspergillus o Rhodococcus sp.)
Risoluzioni con acilasi
Idrolisi del legame ammidico
Sintesi di prodotti naturali (feromoni
(feromoni,, penicilline)
Idrolisi del legame ammidico
Risoluzioni con idantoinasi
Risoluzioni con lattamasi
Idrolisi del legame ammidico
Idrolisi del legame ammidico