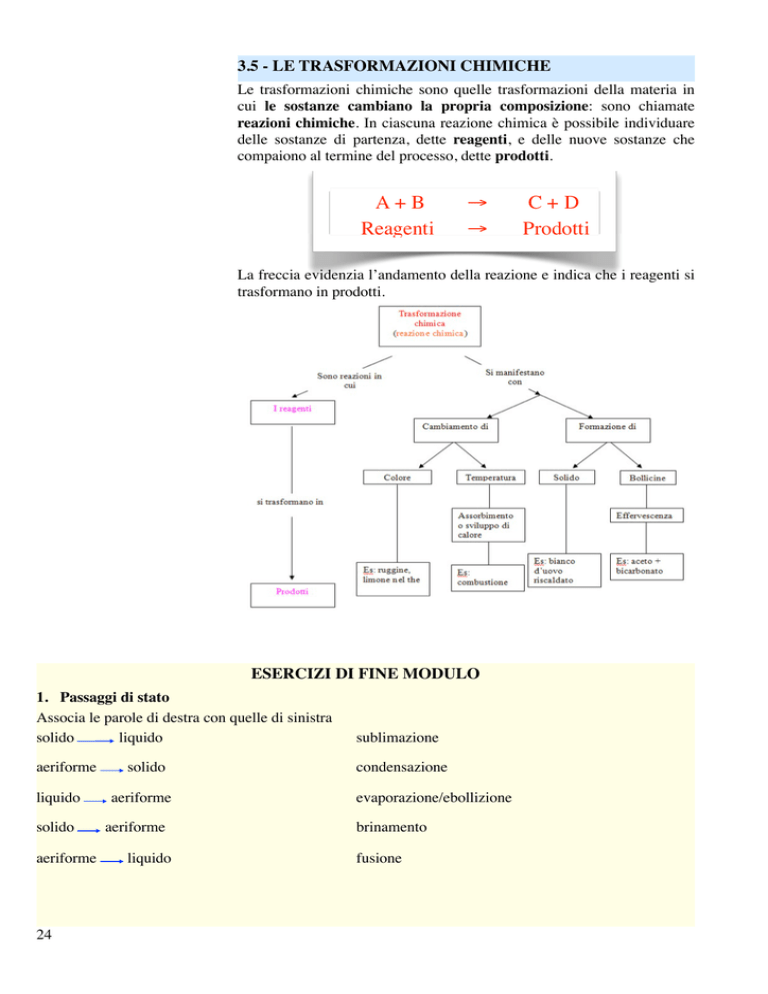
3.5 - LE TRASFORMAZIONI CHIMICHE
Le trasformazioni chimiche sono quelle trasformazioni della materia in
cui le sostanze cambiano la propria composizione: sono chiamate
reazioni chimiche. In ciascuna reazione chimica è possibile individuare
delle sostanze di partenza, dette reagenti, e delle nuove sostanze che
compaiono al termine del processo, dette prodotti.
A + B Reagenti
→ → C+D
Prodotti
La freccia evidenzia l’andamento della reazione e indica che i reagenti si
trasformano in prodotti.
ESERCIZI DI FINE MODULO
1. Passaggi di stato
Associa le parole di destra con quelle di sinistra
solido
liquido
sublimazione
aeriforme
solido
condensazione
liquido
aeriforme evaporazione/ebollizione
solido
aeriforme brinamento
liquido
fusione
aeriforme
24
2. Esegui i seguenti esperimenti, classificali in trasformazioni fisiche e chimiche e riporta le
osservazioni in tabella. Cosa accade? Si formano nuove sostanze? Si tratta di processi
reversibili?
Esperimento
Trasf. Trasf.
Fisica chimica
Osservazioni
Versare dell’aceto sul
bicarbonato
Mettere del sale nell’acqua
Ebollizione dell’acqua
Combustione di un gas ai
fornelli
Tagliare una pera
Succo di limone nel tè
Un cucchiaio di bicarbonato
nel vino rosso
Cuocere un uovo
3. Come è fatta la materia
Riempi gli spazi vuoti con la parola giusta
1) I materiali che hanno un volume proprio ma non forma propria sono _______________
2) I materiali _______________ hanno forma e volume proprio
3) Tutto ciò che ha una massa ed occupa un certo volume si definisce _______________
4) Quando un corpo passa dallo stato solido a quello aeriforme (come ad esempio la naftalina) si ha un
passaggio di stato detto _____________________
5) La _____________________ è il passaggio dallo stato aeriforme a quello liquido
6) I materiali puri vengono chiamati dai chimici con il nome di _______________
7) La limatura di ferro e lo zolfo in polvere costituiscono un miscuglio _____________________
4. Miscugli eterogenei, miscugli omogenei, sostanze pure.
Indica per ciascun materiale di cosa si tratta con la sigle indicate di seguito:
Miscuglio eterogeneo ME
Miscuglio omogeneo MO
Sostanza pura SP
Nebbia
Marmo
Acqua distillata
Ghiaccio
Coca Cola
Ottone (lega rame-zinco)
Diamante
Latte
Acqua minerale
Ossigeno
Schiuma
Spremuta di arancia
25
5. Miscugli eterogenei e miscugli omogenei
Indica per ciascuna caratteristica se si riferisce ad un miscuglio omogeneo M.O. o eterogeneo M.E.
I componenti si mescolano così bene che non si distinguono più
Hanno le stesse proprietà in qualsiasi punto
I componenti si separano cambiando lo stato di aggregazione o sfruttando la diversa solubilità
I componenti possono essere separati mantenendo immutate le loro proprietà
I componenti mantengono le proprie caratteristiche e si possono individuare
Le proprietà possono risultare diverse nelle diverse parti del miscuglio
6. Miscugli e sostanze
Indica se le affermazioni sono vere V o false F
La cromatografia è un metodo per separare i diversi soluti presenti in un miscuglio omogeneo
Il passaggio di stato solido -aeriforme si chiama sublimazione
L'aria che respiriamo è un miscuglio omogeneo
Per rendere limpido il vino si può far ricorso alla decantazione
Il fumo è materia, l'aria non lo è
I miscugli eterogenei liquido-solido possono essere separati per filtrazione
La miscela del motorino è una soluzione liquido-liquido
Il suono non è materia
Nei miscugli omogenei i componenti mescolandosi perdono alcune delle loro proprietà
7. Proprietà estensive ed intensive della materia
Indica se le proprietà sotto descritte sono estensive oppure intensive:
inserisci PE per proprietà estensiva - inserisci PI per proprietà intensiva
densità
temperatura
concentrazione di una soluzione
peso specifico
volume
massa
peso
calore (energia termica posseduta da un corpo)
26
8. Separazione dei miscugli
Le affermazioni sulla sinistra si riferiscono ciascuna ad un metodo di separazione tra quelli elencati:
gascromatografia - decantazione - estrazione con solvente - Completa la tabella.
I vapori che si formano vengono convogliati nel condensatore
dove il raffreddamento li trasforma nuovamente in liquido che si
raccoglie goccia a goccia
Tramite un opportuno solvente si separa o recupera uno dei
componenti del miscuglio (con questo metodo si prepara per es. il
caffè decaffeinato)
le particelle solide si depositano lentamente e spontaneamente sul
fondo
le particelle solide(soluto) vengono trattenute mentre il solvente
passa distillazione
il componente a densità maggiore si ritrova in fondo alla provetta
filtrazione
con questo metodo si analizzano (separano) i componenti
inquinanti dell'aria flottazione
mediante l’azione di un flusso di aria o acqua è possibile separare
per esempio le pepite d'oro dalla sabbia levigazione
in un miscuglio finemente polverizzato i componenti vengono
separati in base alle loro proprietà idrofile o idrofobe
centrifugazione
Nei miscugli omogenei i componenti si mescolano così bene che
perdono alcune delle loro proprietà
9. Fenomeni chimici e fisici
Indica trai i sottostanti fenomeni quali sono reazioni chimiche e quali non lo sono
inserisci FC per Fenomeno chimico - inserisci FF per Fenomeno fisico
l’arrugginimento di un chiodo
le nubi che si trasformano in pioggia
lo sbriciolamento di un sasso
la sublimazione della naftalina
le batterie del walkman che si consumano
la digestione di un panino
l’arcobaleno dopo la pioggia
la legna che brucia
la produzione del sale dall’acqua di mare
la fermentazione del mosto
la trasformazione del vino in aceto
l’ammuffimento del limone
27
10. Reazioni chimiche
Associa le sigle di destra con le parole di sinistra
sostanza aeriforme sostanza in soluzione acquosa sostanza solida sostanza in soluzione qualsiasi sostanza liquida (aq)
(s)
(sol)
(l)
(g)
11. Il linguaggio della chimica: sostanze elementari e sostanze composte
Inserisci i termini mancanti scegliendoli dall’elenco.
alfabeto atomo combinazione composizione composti elementi formula nucleari simbolo Miscugli e
sostanze
Le sostanze che sono scomponibili in altre sostanze si chiamano _____________, quelle che non sono
scomponibili in altre sostanze sono chiamate _____________.
Gli ______________ sono poco più di un centinaio; tra questi solo 89 sono presenti in natura, gli altri
sono prodotti artificialmente attraverso particolari trasformazioni dette reazioni ______________.
Gli elementi costituiscono una specie di _____________ della materia, dalla _____________ dei loro
atomi si sono formati tutti i milioni di composti presenti in natura o fabbricati dall'uomo.
Ad ogni sostanza (elementare o composta) è stata assegnata una _____________ chimica che ne
rappresenta la _____________ chimica a livello elementare (indica cioè dagli atomi di quali elementi
chimici è composta).
Quando la più piccola particella che identifica un elemento è l’_____________, la formula chimica
coincide con il _____________ stesso dell'elemento.
12. Velocità di una reazione
Metti in ordine le reazioni chimiche dalla più lenta 1 alla più veloce 8
28
combustione di un foglio di carta
digestione di una piatto di lasagne
arrugginimento del telaio di una bicicletta
corrosione dei monumenti a causa delle
piogge acide
formazione dei giacimenti di petrolio
scoppio di un petardo
stagionatura di un prosciutto
cottura di un uovo
MODULO 4 - LA MATERIA:
LEGGI QUANTITATIVE E TEORIE ATOMICHE
Si possono riconoscere due tipologie diverse di proprietà della
materia: le proprietà macroscopiche e quelle microscopiche.
Le proprietà macroscopiche sono così definite perché sono
caratteristiche della materia e le possiamo percepire con i sensi o
misurare con gli strumenti che abbiamo studiato. Esse caratterizzano
rilevanti porzioni di materia, formate da numerosissime particelle, ma
non sono attribuibili alle singole particelle (atomi, ioni o molecola): ad
esempio è corretto dire che l’acqua è liquida, ma non è vero che le
singole molecole d’acqua sono liquide; è corretto affermare che l’oro di
un anello è giallo, ma non che siano gialli i singoli atomi d’oro.
Tra le principali proprietà macroscopiche possiamo citare la densità, la
temperatura di fusione e quella di ebollizione, la lucentezza, il colore, lo
stato fisico.
Le proprietà microscopiche sono le proprietà chimiche attribuibili
alle singole particelle che formano i materiali: atomi, ioni e molecole.
Tra le proprietà microscopiche vi è ad esempio la capacità di un atomo di
formare legami con altri atomi, la tendenza di un atomo a perdere o
acquistare elettroni, la tendenza di due molecole di acqua a legarsi tra di
loro o a legare altre molecole ad esse affini.
4.1 - LE LEGGI QUANTITATIVE
Vediamo insieme le principali leggi quantitative della chimica.
4.1.1 - Legge della conservazione della massa
Antoine-Laurent de Lavoisier nei suoi studi nel 1789 si occupò di
reazioni chimiche e, utilizzando una bilancia, pesò i reagenti e i prodotti
di numerose e diverse reazioni chimiche, scoprendo che la massa
complessiva di tutti i reagenti era esattamente uguale alla massa totale di
tutti i prodotti. Poiché questo risultato si ripresentava in tutte le prove
ripetute, Lavoisier riuscì a tradurre in legge le sue osservazioni.
La LEGGE della CONSERVAZIONE della MASSA
afferma che nelle reazioni chimiche la somma delle masse dei
reagenti è uguale alla somma delle masse dei prodotti.
In Laboratorio: possiamo provare a costruire dei modelli molecolari
delle molecole rappresentate in figura e possiamo provare a mettere sulla
bilancia le molecole così ottenute, prima tutti i reagenti, annotando il
valore della massa, poi tutti i prodotti, registrando il valore ottenuto:
possiamo constatare che i due valori sono esattamente uguali. Ciò
conferma quanto scoperto da Lavoisier.
Nota bene. Rispetto a Lavoisier noi abbiamo ipotizzato una entità di cui
diamo per scontata l’esistenza ma anche la modalità di rappresentazione.
Quale secondo voi?
Antoine-Laurent de Lavoisier
(1743-1794), chimico
francese, enunciò la legge di
conservazione della massa,
riconobbe e battezzò
l’ossigeno (nel 1778).
Era anche un esattore delle
tasse privato per conto dello
Stato e per le sue scelte fu
ghigliottinato.
Fonte Wikipedia
29
4.1.2 - Legge delle proporzioni definite e costanti
Joseph Luis Proust nel 1799 fece un’altra serie di esperimenti per
trovare la “ricetta” che consentisse a chiunque di costruire dei composti
che avessero esistenza reale. Fece in pratica quello che gli autori di
ricette di cucina fanno tutt’oggi, quando preparano un piatto particolare e
stabiliscono le dosi ottimali dei vari ingredienti, così che, una volta
pubblicate, possano consentire a chiunque di sperimentare.
Sempre a proposito di ricette, sappiamo tutti che, se dovessimo fare una
torta che richieda 400g di farina, 200g di zucchero, 200g di burro e 4
uova e nella nostra dispensa avessimo solo 300g di farina, basterebbe
ridurre gli altri ingredienti proporzionalmente e la torta riuscirebbe lo
stesso: un po’ più piccola, ma ugualmente buona.
Proust scoprì che questa regola vale anche per i composti. Per esempio se
dobbiamo preparare il composto CuS (solfuro rameico)...
Joseph Luis Proust
(1754-1826), chimico
francese, enunciò la legge
delle proporzioni definite e
costanti.
Fonte Wikipedia
dobbiamo mescolare 64 grammi di Rame e 32 grammi di Zolfo (S). Se,
per caso, abbiamo solo 50 grammi di Rame dobbiamo utilizzare 25
grammi di Zolfo, l’importante è che il rapporto tra la quantità di Rame e
quella di Zolfo sia di 2:1 (si legge di due a uno), più semplicemente la
massa del Rame deve essere sempre il doppio di quella dello Zolfo.
La LEGGE delle PROPORZIONI DEFINITE e COSTANTI
afferma che in un composto allo stato puro
il rapporto tra le masse dei costituenti è definito e costante.
Definito significa che per ogni composto il rapporto è stato determinato
ed è noto, costante significa che tale rapporto non cambia al variare per
esempio dello sperimentatore o del laboratorio in cui il composto viene
preparato.
4.1.3 - Legge delle proporzioni multiple
John Dalton nel 1808 scoprì che atomi di due elementi diversi si
possono legare in modo diverso per dare più di un composto: per
esempio atomi di Carbonio (C) e di Ossigeno (O) possono formare due
composti, il monossido di carbonio (CO) e il biossido di carbonio o
anidride carbonica (CO2).
30
Dalton scoprì la ricetta per ottenere questi due composti: riuscì a produrre
il primo mescolando 1 grammo di Carbonio e 1,33 grammi di Ossigeno,
e a ottenere il secondo mescolando 1 grammo di Carbonio e 2,66 grammi
di Ossigeno. Egli noto, inoltre, che le due quantità di Ossigeno erano la
seconda il doppio della prima. Ripetendo l’esperienza con altri composti,
riscontrò che, se manteneva fissa la quantità del primo elemento, le masse
del secondo elemento erano sempre multiple della quantità più piccola
utilizzata.
Dalton definì questa regolarità legge delle proporzioni multiple.
La LEGGE delle PROPORZIONI MULTIPLE
Quando atomi di due elementi formano più composti,
le diverse masse dell’uno che si combinano
con la stessa massa dell’altro
sono in un rapporto di numeri piccoli interi.
John Dalton (1766-1844)
chimico e fisico inglese a
dodici anni già insegnava.
Pubblicò i suoi studi nel
1803.
Dopo aver acquistato calzini
rossi invece che marroni, si
accorse di avere un
problema alla vista e
descrisse per la prima volta il
“daltonismo”: un problema
alla vista che impedisce di
distinguere i colori.
Fonte Wikipedia
Nell’illustrare le tre leggi abbiamo dato per scontato che le diverse
sostanze siano formate da atomi (i pallini colorati) e che gli atomi di uno
stesso elemento siano sempre uguali tra loro.
Tutto ciò non era affatto scontato ai tempi di Lavoisier e di Proust.
Soltanto Dalton, dopo aver formulato la sua legge, cercò di motivare il
comportamento delle sostanze che tutti e tre i chimici avevano osservato.
Le conclusioni cui giunse sono contenute nella teoria atomica che porta il
suo nome.
4.2 - LE TEORIE SULLA STRUTTURA ATOMICA
Vediamo ora come sono nate le teorie sulla struttura degli atomi.
4.2.1 - La teoria atomica di Dalton
Le tre leggi sopra enunciate sono valide solo se si ipotizza che:
✴ la materia è formata di atomi, piccolissimi, indivisibili e
indistruttibili,
✴ tutti gli atomi di uno stesso elemento chimico sono identici e hanno
la stessa massa,
✴ nelle reazioni chimiche gli atomi non si creano né si distruggono, ma
si combinano in modo diverso nei prodotti rispetto ai reagenti,
✴ gli atomi di un dato elemento chimico si combinano soltanto con un
numero intero di atomi di un altro elemento chimico.
Se si osservano attentamente le figure delle pagine precedenti, ci si può
rendere conto che tutte presuppongono queste considerazioni.
La teoria di Dalton ha offerto nuovi spunti per le sperimentazioni e nuove
possibilità di interpretazione dei risultati di importanti esperimenti.
Infatti, poco più tardi, altri due personaggi, Joseph Louis Gay Lussac e
Amedeo Avogadro, utilizzarono la teoria di Dalton per interpretare i
risultati di esperimenti sui gas e arrivarono ad una importante
conclusione: la distinzione tra atomi e molecole.
31
Se scriviamo: O, C, N, H intendiamo atomi di ossigeno, carbonio,
azoto, idrogeno
Se scriviamo: O2, N2, H2; H2O intendiamo molecole di ossigeno, azoto,
idrogeno, acqua.
Democrito (460 a.C.- 360
a.C.), filosofo greco
antico, con altri ha
proposto la teoria
atomista considerata
dopo secoli la visione “più
scientifica” della realtà.
Fonte Wikipedia
32
4.2.2 - Uno schema riassuntivo
✴ evidenze sperimentali suggeriscono la presenza di particelle
subatomiche
• elettrizzazione dei corpi
• conducibilità elettrica delle soluzioni
• radioattività spontanea
• esperimenti volti alla ricerca delle particelle subatomiche
✴ modelli di struttura atomica
• modello di Thomson
• modello di Rutherford
• modello di Bohr
✴ i parametri che identificano e distinguono gli atomi
• numero atomico
• numero di massa e isotopi
✴ la classificazione degli atomi
• la moderna tavola periodica degli elementi
✴ la nostra esperienza e la struttura degli atomi suggeriscono
l’esistenza di legami tra gli atomi.
• legame ionico
• legame covalente
✴ i legami tra le molecole: l’acqua e il legame a idrogeno
Come abbiamo visto, a Dalton va il merito di aver formulato per primo
una vera propria teoria che interpretava la natura della materia,
sostenendo che se tentiamo di smontare un corpo materiale fino a ridurlo
ai suoi costituenti più piccoli, ci troveremmo ad un certo punto ad avere a
che fare con particelle non più smontabili, molto piccole, che Dalton ha
chiamato atomi, riprendendo il termine, che una ventina di secoli prima,
aveva coniato Democrito.
Verso la fine del secolo XIX, le indagini dei chimici si orientarono verso
aspetti della natura della materia che non erano stati ancora indagati.
Questo perché, come spesso succede nell’ambito scientifico, alcune
nuove scoperte e le nuove tecnologie a disposizione sollecitano la
curiosità degli scienziati.
Perciò, poiché non c’erano ormai più dubbi che i costituenti ultimi della
materia fossero gli atomi, alcuni fenomeni noti da tempo e alcune nuove
evidenze sperimentali, stimolarono le osservazioni e le ricerche volte a
scoprire la struttura degli atomi.
4.2.3 - La scoperta delle particelle subatomiche
La scoperta delle particelle subatomiche - in ordine di scoperta: protoni,
elettroni e neutroni - è stata la conseguenza dello studio di fenomeni
diversi apparentemente non correlati tra loro: vediamoli di seguito.
4.2.3.1 - L’elettrizzazione
E’ noto a tutti che se strofiniamo una biro su un maglione di lana, essa è
poi in grado di attirare dei piccoli pezzi carta oppure che quando ci
sfiliamo un indumento di pile, in particolare durante una giornata con
clima secco, i nostri capelli vengono attirati dal nostro viso o dalle nostre
mani. Questo fenomeno è stato chiamato elettrizzazione.
L’elettrizzazione di questi materiali particolari è causata dallo strofinio:
questo fa sì che alcune cariche elettriche già presenti nell’oggetto si
spostino temporaneamente vicino alla sua superficie.
Successivamente si è scoperto che esistevano due tipi di elettrizzazione,
cioè che i corpi potevano elettrizzarsi nello stesso modo o in modo
diverso. Quindi, per convenzione, si è indicata con il segno + (più) un
tipo di elettrizzazione e con il segno - (meno) l’altro tipo: di
conseguenza, oggi noi parliamo di corpi elettrizzati con carica positiva o
carica negativa.
Quando altri oggetti vengono avvicinati agli oggetti elettrizzati, le
cariche elettriche di questi ultimi inducono, attirandole, la comparsa di
cariche elettriche di segno opposto sulla superficie degli oggetti
inizialmente non elettrizzati: un oggetto, quindi, può essere elettrizzato
per strofinio, o semplicemente avvicinandolo a un oggetto elettrizzato.
Questo fenomeno riguarda anche l’acqua: possiamo deviare con
una bacchetta di vetro elettrizzata un filo di acqua che scende da
una buretta munita di rubinetto.
4.2.3.2 - Correnti elettriche e particelle cariche
Un altro esperimento volto a dimostrare la presenza di cariche
elettriche nei corpi prevede di costruire un piccolo circuito
elettrico, collegato ad un trasformatore e ad una lampadina. Il
circuito è munito di due elettrodi di grafite montati su di un
supporto che li mantiene distanziati, in modo tale che la corrente
non possa passare.
Se si immergono i due elettrodi in un bicchiere che contiene
acqua distillata, la lampadina non si accende; se, invece,
immergiamo gli elettrodi in una soluzione di acqua e sale o di
acqua e acido cloridrico, la lampadina si accende e la sua
luminosità aumenta se aumento la concentrazione della sostanza
33
disciolta nell’acqua.
Per quale motivo ciò accade? Evidentemente, nella soluzione ci sono
delle particelle con carica elettrica positiva e negativa che, spostandosi
verso l’elettrodo di carica opposta, chiudono il circuito così che la
lampadina si accende.
4.2.3.3 - La radioattività spontanea
Un fenomeno naturale che ha suggerito ai chimici l’esistenza di particelle
subatomiche, cioè di particelle più piccole dell’atomo e in esso
contenute, è la radioattività spontanea.
In laboratorio abbiamo avuto una semplice dimostrazione che essere
radioattivo significa emettere “qualcosa”, che non è possibile identificare
nelle condizioni in cui abbiamo operato, ma che può essere rilevato con
uno strumento piuttosto semplice, costituito da un display e da un oggetto
simile ad un microfono, che si chiama contatore Geiger. Esso non ci dice
nulla riguardo alle radiazioni, ne rileva solo la quantità. Con altri
strumenti più sofisticati è stato possibile distinguere tre tipi di radiazioni:
radiazioni alfa (α), costituite da particelle positive, radiazioni beta (β),
formate da particelle negative, e radiazioni gamma (γ), prive di carica.
Queste radiazioni escono dagli atomi, quindi le particelle di cui sono
costituite si trovano dentro gli atomi.
4.2.3.4 - L’individuazione delle particelle subatomiche
Nei primi anni del XX secolo i chimici non si sono più accontentati di
analizzare fenomeni spontanei, ma hanno costruito strumenti speciali allo
scopo di indurre la liberazione di particelle subatomiche dagli atomi e di
caratterizzarle meglio. Hanno così scoperto gli elettroni, molto piccoli,
carichi negativamente e piuttosto veloci, che chiamarono inizialmente
raggi catodici.
Successivamente i protoni, positivi, 1836 volte più grandi degli elettroni
e, parecchi anni più tardi, anche i neutroni, privi di carica e grandi
quanto i protoni.
Possiamo concludere dicendo che gli atomi sono formati da tre tipi di
particelle subatomiche:
✓ protoni, di carica positiva e massa unitaria, indicati con p+,
✓ neutroni, di carica nulla e massa unitaria, indicati con n
✓ elettroni, di carica negativa e massa 1836 volte più piccola di quella
di protoni e neutroni, indicati con e-.
34
4.3 - MODELLI DI STRUTTURA ATOMICA
La questione che ha suscitato la curiosità e l’ingegno dei chimici ha
riguardato poi la collocazione delle particelle subatomiche all’interno
dell’atomo; naturalmente non è stato possibile entrare direttamente
nell’atomo, ma le informazioni sono state ottenute da prove indirette. Si
sono elaborati, quindi, dei modelli atomici che, nel tempo, hanno subito
un’evoluzione grazie all’apporto di nuove conoscenze e alla disponibilità
di nuove tecnologie. In ogni caso restano modelli, cioè delle
rappresentazioni della realtà, ma non delle riproduzioni di una realtà,
che, per motivi tecnici (gli atomi sono estremamente piccoli, 0,1
miliardesimi di metro, e ancora più piccolo è ciò che sta al loro interno),
non si può osservare direttamente.
4.3.1 - Il modello di THOMSON
In ordine temporale il primo modello atomico fu quello di J.J. Thomson
(fine 1800), noto come modello “a panettone”, che ipotizzava che
protoni ed elettroni fossero distribuiti all’interno dell’atomo del tutto
casualmente e omogeneamente, come le uvette e i canditi dentro il
panettone.
!
4.3.2 - Il modello di RUTHEFORD
Successivamente
E.
Rutherford,
sfruttando l’emissione di radiazioni alfa
da parte di un elemento radioattivo,
allestì un ingegnoso esperimento che
suggerì che i protoni fossero concentrati
in uno spazio piuttosto piccolo al centro
dell’atomo, che egli chiamò nucleo.
Riuscì anche a determinare il rapporto tra
il raggio dell’atomo e quello del nucleo,
stimando che valesse 105: il raggio
dell’atomo è 100 000 volte più grande di
quello del nucleo.
!
Gli elettroni dovevano girare intorno al nucleo, ma egli non precisò
come.
Joseph John Thomson
(1856-1940), fisico
britannico, scopritore
dell’elettrone.
Fonte Wikipedia
35
Daniel Rutherford
(1749-1819), chimico
scozzese, da studente
studiò “l’aria fissa”, oggi
detta anidride carbonica, e
descrisse un nuovo
componente “l’aria
flogistificata”, oggi chiamato
azoto.
Fonte Wikipedia
4.3.3 - Il modello di BOHR
Nel 1913 Niels Bohr rielaborò il modello di Rutherford, precisando
meglio la distribuzione degli elettroni intorno al nucleo.
Egli eseguì i suoi studi sull’atomo di Idrogeno: è vero che questo atomo
ha un solo elettrone e quindi non potrebbe essere paragonato ad altri che
contengono 80 o 90 elettroni, ma è prassi collaudata nel mondo
scientifico costruire modelli o studiare meccanismi in situazioni semplici
o semplificate, per poi estendere i risultati a situazioni più complesse.
Bohr partì da una considerazione: egli notò che gli atomi comunemente
non emettono energia. Questo significa che gli elettroni che si muovono
intorno al nucleo non cadono su di esso, perché se lo facessero, in
seguito all’attrazione elettrica e gravitazionale esercitata dal nucleo,
durante la caduta e
conseguentemente
all’incontro con il
nucleo emetterebbero
energia.
Questo implica che
gli
elettroni
si
muovono intorno al
nucleo
a
certe
distanze ben precise
e con velocità tali da
contrastare la forza
attrattiva del nucleo
stesso.
!
Per riassumere i risultati dei suoi esperimenti formulò due postulati.
1° POSTULATO - dello STATO STAZIONARIO
gli elettroni si muovono su orbite prestabilite a determinate
distanze dal nucleo, cui sono associati determinati valori di
energia, senza allontanarsene spontaneamente. Tali orbite a cui
corrispondono precisi livelli di energia sono complessivamente
sette
Niels Henrik David Bohr
(1885-1962), fisico e
matematico danese, premio
Nobel per la fisica nel 1922.
In suo onore è stato
chiamato l’elemento chimico
Bohrio e un asteroide, 3948
Bohr.
Anche il figlio Aage Niels
Bohr (1922-2009) è stato
premio Nobel per la fisica,
nel 1975.
Fonte Wikipedia
36
.
2° POSTULATO - dello STATO ECCITATO
si può allontanare un elettrone dalla sua orbita, soltanto fornendo
una determinata quantità di energia. L’elettrone successivamente
torna al livello energetico di partenza emettendo luce (energia).
L’energia e il tipo di luce emessa dipendono dalla differenza di energia
tra il livello finale raggiunto dall’elettrone e quello di partenza.
E’ inoltre possibile fornire una quantità di energia sufficiente per
strappare definitivamente l’elettrone ad un atomo, così da produrre una
nuova particella: uno ione. Poiché l’energia fornita genera uno ione, essa
prende il nome di energia di ionizzazione.
Un paragone interessante
Possiamo illustrare in maniera semplice quanto teorizzato da Bohr con un
esempio curioso. È possibile paragonare paragonare la situazione degli
elettroni di un atomo a quella degli spettatori riuniti in un teatro romano,
con il palcoscenico, che rappresenta il nucleo, al centro e le gradinate,
che rappresentano i diversi livelli di energia potenziale, disposti tutto
intorno.
Gli spettatori sono seduti o su un anello o su quello consecutivo, mai
sospesi nell’aria tra un gradino e l’altro. Inoltre, a mano a mano che ci
allontaniamo dal palcoscenico, gli spettatori presenti sulle gradinate
aumentano, perché aumenta il diametro dell’anello che li ospita. La
stessa cosa si può pensare per gli elettroni: sul secondo livello energetico
ci potranno essere più elettroni che sul primo, sul terzo più elettroni che
sul secondo.
C’è tuttavia una sostanziale differenza tra gli spettatori del teatro e gli
elettroni: i primi sono fermi al loro posto, gli elettroni, invece, ruotano su
se stessi, ruotano intorno al nucleo e in più hanno tutti una carica
negativa e, se si trovano abbastanza vicini, si respingono.
Questo impone un limite al numero di elettroni che possono stare
contemporaneamente su un livello: sul primo livello vi sono al più due
elettroni, sul secondo livello al massimo otto, sul terzo livello al massimo
diciotto, ecc.
37
In laboratorio
E’ possibile effettuare un esperimento che conferma quanto osservato da
Bohr: il saggio alla fiamma.
Abbiamo posto sulla fiamma di un fornellino ad alcool, servendoci di una
bacchetta di vetro sulla quale era fissata un’ansa di platino, sali composti
da elementi diversi. La fiamma si è colorata in maniera evidentemente
diversa a seconda del tipo di sale utilizzato: questo suggerisce che atomi
di elementi diversi hanno elettroni distribuiti su livelli diversi; essi
possono spostarsi su livelli energetici più lontani dal nucleo e tornare,
successivamente, sui livelli di partenza, caratteristici per ogni elemento.
In questo modo è possibile spiegare le differenti colorazioni:
✓ Rosso per il Litio (Li)
✓ Verde azzurro per il Rame (Cu)
✓ Giallo intenso per il Sodio (Na)
✓ Violetto per il Potassio (K)
✓ Rosso Vivace per lo Stronzio (Sr)
4.3.4 - Evoluzione del modello di Bohr
Il modello atomico di Bohr ha, nel tempo, subito rimaneggiamenti, che
però hanno sostanzialmente confermato l’intuizione originaria.
E’ necessaria, però, una precisazione: fino ad ora abbiamo usato
indifferentemente i termini orbita e livello energetico.
In realtà, i dati raccolti successivamente e relativi agli elettroni e alla
tipologia del loro movimento ci impongono di utilizzare esclusivamente
il termine livello energetico e non orbita, ogniqualvolta vogliamo
indicare la distanza media dal nucleo alla quale si trovano gli elettroni e il
loro livello di energia potenziale.
38
LA TAVOLA PERIODICA
DEGLI ELEMENTI
39
MODULO 5 - LA MATERIA:
ELEMENTI CHIMICI E SOSTANZE ELEMENTARI
5.1 - LA SIMBOLOGIA CHIMICA
Attenzione!
Elenco degli errori
più comuni.
F fosforo? no, fluoro
P potassio? no, fosforo
K kripton? no, potassio
Agli inizi dell’800 erano già stati identificati una cinquantina di sostanze
elementari. Il chimico svedese J.J. Berzelius (1779 – 1848) raccolse già
nel 1818 in una tabella i corrispondenti elementi chimici.
Lo stesso Berzelius propose di adottare una simbologia chimica, che è
ancora oggi in uso, dove a ciascun elemento chimico viene
univocamente associato un simbolo che, in genere, corrisponde
all’iniziale del suo nome latino (o alle prime due lettere se vi è possibilità
di equivoco con altri elementi). Ad esempio Ag è l’Argento, Ba il Bario,
Li il Litio, O l’Ossigeno, Fe il Ferro.
I simboli rappresentano sia gli elementi chimici che i relativi atomi.
Così H rappresenta l’elemento Idrogeno, ma anche un atomo di Idrogeno.
A azoto? no, non esiste!
N azoto
Z zolfo? no, non esiste!
S sodio? no, zolfo
Na sodio
RICORDA
Quando si scrive il simbolo di un elemento chimico,
la prima lettera è sempre maiuscola,
la seconda lettera - se presente - è sempre minuscola
C calcio? no, carbonio
Ca calcio
Dmitrij Ivanovič Mendeleev
(1834-1907)
Fonte Wikipedia
40
5.2 - MENDELEEV E LA TAVOLA PERIODICA
Oggi in totale sono conosciuti ben 116 elementi chimici: la maggior
parte di essi si trovano in natura, alcuni di essi sono stati ottenuti in
laboratorio dall’uomo e sono definiti artificiali o transuranici.
Molte delle corrispondenti sostanze elementari sono note fin dalla
preistoria, il Ferro, il Rame, l’Argento, il Piombo, lo Stagno e il
Mercurio. Durante il Medioevo, quando non esisteva la Chimica come
scienza, alcune sostanze elementari sono state alla base dell’Alchimia e
sono state associate ai pianeti noti: l’Oro al Sole, l’Argento alla Luna, e
così via. Ricordi i loro simboli chimici?.
Tutti le altre sostanze elementari - e i corrispondenti elementi chimici sono state scoperte nei secoli seguenti.
Durante il XIX secolo il numero di sostanze elementari e di elementi
chimici scoperti crebbe in modo esponenziale ed un chimico russo
Dmitrij Ivanovič Mendeleev nel 1869 riuscì a prevedere l’esistenza di
elementi non ancora conosciuti, descrivendo esattamente le
caratteristiche chimiche e fisiche delle corrispondenti sostanze
elementari. Come fece?
Abbiamo visto che ogni atomo è contraddistinto da un nucleo, costituito
da un certo numero di neutroni e di protoni. Quest’ultimi determinano
anche il numero di elettroni, a loro volta organizzati secondo una propria
configurazione elettronica che caratterizza la reattività dell’atomo stesso.
APPROFONDIMENTO STORICO
Il merito più sensazionale di Mendeleev è che lasciò nella sua tavola periodica degli elementi, dei buchi vuoti
affermando che si trattava di elementi ancora da scoprire, anticipandone però le caratteristiche. Chiamò questi
elementi Eka-boro, Eka-alluminio, Eka-silicio. Il mondo della chimica rimase scettico. Intanto però Gustav
Robert KIRCHOFF 1824-1887 e Robert BUNSEN 1811-1899 (inventore del becco bunsen) costruirono il primo
spettroscopio che permetteva una capacità di ricerca fino ad allora inimmaginabile. Nel 1860 trovarono il Cesio,
nel 1861 il Rubidio. Altri chimici utilizzarono lo spettroscopio e Lecoq 1838-1912 scoprì nel 1875 il Gallio, che
appena preparato in quantità sufficienti per poterlo studiare, venne riconosciuto da Mendeleev come il suo Ekaalluminio. Nel 1879 il chimico svedese Lars NILSON 1840-1899 scoprì lo Scandio che assomigliava all’ Ekaboro e successivamente Clemens WINKLER 1838-1904 scoprì il Germanio risultato essere l’Eka-silicio. Il
valore delle affermazioni di Mendeleev era FORMIDABILE.
5.2.1 - La classificazione degli elementi chimici
Attualmente i vari tipi di atomi, ossia gli elementi chimici, sono
individuati per mezzo di due soli numeri che, insieme al simbolo chimico
dell’elemento, ne costituiscono una specie di carta d’identità:
!
A
Z
X
€
Ogni atomo, quindi, avendo una struttura elettronica caratteristica
costituisce un individuo chimico a sé.
Tuttavia si è scoperto che atomi diversi che posseggano lo stesso
numero di elettroni nell’ultimo livello energetico hanno
caratteristiche chimiche simili: sono proprio quegli elettroni, infatti,
che sono coinvolti nelle reazioni chimiche.
È stato proprio il chimico russo Mendeleev che, grazie a questa
intuizione, è riuscito ad evidenziare le affinità tra le caratteristiche
chimiche, ma anche fisiche, degli elementi che allora erano noti,
concludendo con la seguente legge: “Le proprietà degli elementi variano
con cadenza periodica all’aumentare della massa atomica dei loro
atomi”:
41
Ciò gli permise di pubblicare la sua prima tavola periodica, ottenuta
ordinando gli elementi allora noti in successioni orizzontali dette
periodi, ponendo l’uno sotto l’altro gli elementi i cui atomi possedevano
lo stesso numero di elettroni nell’ultimo livello; si formarono così delle
colonne - gruppi - che contenevano elementi i cui atomi possedevano
proprietà chimiche e fisiche simili.
5.2.2 - La moderna tavola periodica
Nel corso degli anni, la tavola degli elementi ha preso il nome di Tavola
Periodica. Rispetto alla versione originale di Mendeleev, è stata
modificata e completata e si è giunti ad una sua interpretazione più
completa e corretta:
Le proprietà degli atomi dei vari elementi chimici variano
periodicamente in funzione dei numeri atomici
(anziché delle masse atomiche, come aveva pensato Mendeleev)
Infatti la reattività chimica degli atomi di ciascun elemento, e quindi la
loro configurazione elettronica - è individuata dalla sua posizione nella
Tavola Periodica quindi dal Periodo e dal Gruppo di appartenenza.
IUPAC International Union
of Pure and Applied
Chemistry:
E’ la nomenclatura ufficiale,
internazionale, introdotta a
partire dagli anni ’70.
42
Guardando attentamente la Tavola Periodica si nota che:
✓ ogni elemento chimico è scritto in una casella ed è caratterizzato da
una serie di parametri,
✓ il Numero Atomico determina il posto che ciascun elemento occupa
nella tavola periodica,
✓ vi sono 18 colonne che formano i gruppi; essi sono ordinati con la
numerazione romana: da IA a VIIIA per le colonne laterali, da I B a
VIII B per i gruppi centrali (in certe tavole, seguendo le norme
IUPAC, la numerazione va da 1 a 18),
✓ vi sono 7 righe che formano i periodi; essi sono indicati con numeri
cardinali (da 1 a 7),
!
✓ i colori possono indicare lo stato di aggregazione di ogni elemento
nelle sue condizioni standard (P=1atm e T=25°C), la presenza di
elementi artificiali.
È importante ricordare che nella Tavola Periodica:
✴ gli elementi appartenenti allo stesso gruppo A sono formati da atomi
con lo stesso numero di elettroni esterni; possiamo quindi dire che
essi hanno le stesse caratteristiche chimiche e fisiche poiché hanno lo
stesso numero di elettroni di valenza
✴ per gli elementi appartenenti allo stesso periodo, gli elettroni di
valenza degli atomi - quelli del livello energetico più esterno - si
trovano nel livello energetico corrispondente al numero del
periodo.
Quindi, il valore numerico del Gruppo A, corrisponde al numero degli
elettroni di valenza (quelli più esterni), mentre il valore numerico del
Periodo, corrisponde al livello energetico occupato dagli elettroni di
valenza.
MEMORIZZA
✴ nel gruppo I A tutti gli atomi posseggono 1 elettrone esterno,
✴ nel gruppo II A tutti gli atomi posseggono 2 elettroni esterni, e così
via
MEMORIZZA
✴ nel periodo 1 tutti gli atomi posseggono elettroni nel 1° livello,
✴ nel periodo 2 tutti gli atomi posseggono elettroni nel 1° e 2° livello,
✴ nel periodo 1 tutti gli atomi posseggono elettroni nel 1°, 2° e 3°
livello, e così via
43
In sintesi:
!
ESERCIZIO
Osserva tutti gli elementi della Tavola Periodica: quali sono quelli che conosci
per la tua esperienza personale? Scrivi sul quaderno perché li conosci, e ricerca
in rete gli usi più comuni.
5.3 - GLI ELEMENTI CHIMICI PIÙ COMUNI
Ti ritrovi con gli elementi che conosci ?
Forse avrai considerato anche altri che magari sono più rari, come l’Oro
(Au), l’Argento (Ag), il Rame (Cu), hai visto che si trovano tutti nello
stesso Gruppo?
Nel Gruppo successivo ci sono altri metalli che avrai sentito sicuramente
nominare: il Mercurio (Hg), l’unico metallo liquido a temperatura
ambiente, il Cadmio (Cd) presente nelle batterie che utilizzi, insieme al
Nichel (Ni) che invece si trova nel gruppo precedente.
Proviamo ora a considerare alcuni gruppi importanti.
Il Gruppo IA è detto anche Gruppo dei metalli alcalini. Vi si trovano
l’Idrogeno (H) e sei metalli: Litio (Li), Sodio (Na), Potassio (K), Rubidio
(Rb), Cesio (Cs), e Francio (Fr). Gli atomi di questi elementi hanno un
solo elettrone nel livello energetico più esterno.
Il Gruppo IIA è detto anche Gruppo dei metalli alcalino-terrosi: si
tratta di sei elementi - Berillio (Be), Magnesio (Mg), Calcio (Ca),
Stronzio (Sr), Bario (Ba), e Radio (Ra) - i cui atomi, come si può
L’elemento più comune sulla terra è il Ferro
(Fe, Z=26), che costituisce più di un terzo
della massa del pianeta.
L’elemento più raro è l’Astato (At, Z=85)
L’atmosfera è costituita per 3/4 di
Azoto molecolare, di formula N2
(N, Z=7).
Nel cosmo l’elemento
predominante è l’Idrogeno,
seguito dall’Elio (He, Z=2)
44
Il 99.25% della crosta terrestre e dei
mari è costituito da soli nove elementi
chimici, oltre al ferro tra i più
importanti ci sono
• l’Ossigeno (O, Z=8),
• il Silicio (Si, Z=14),
• l’Idrogeno (H, Z=1),
• l’Alluminio (Al, Z=13),
• il Magnesio (Mg, Z=12),
• il Sodio (Na, Z=11)
• il Cloro (Cl, Z=17)
osservare nella Tavola Periodica, hanno solo due elettroni nel livello più
esterno
Le sostanze i cui atomi fanno parte del Gruppo IA e il Gruppo IIA sono
tutti metalli; alcuni di essi sono molto reattivi e si combinano più o meno
facilmente con l’ossigeno dell’aria, quindi è assai raro osservarli allo
stato puro, come metalli.
Il Gruppo VIIA è detto anche Gruppo degli alogeni: si tratta di cinque
elementi - Fluoro (F), Cloro (Cl), Bromo (Br), Iodio (I) e Astato (At) - i
cui atomi hanno sette elettroni nel livello più esterno. Le sostanze
corrispondenti sono dei non-metalli molto reattivi.
Il Gruppo VIII è definito Gruppo degli gas nobili: si tratta dell’Elio
(He) - i cui atomi hanno due elettroni nel livello più esterno - e di altri
cinque elementi - Neon (Ne), Argon (Ar), Kripton (Kr), Xenon (Xe) e
Radon (Rn) - i cui atomi hanno otto elettroni nel livello più esterno. Le
sostanze corrispondenti sono dei gas che hanno una scarsissima tendenza
a reagire, visto che i loro atomi hanno l’ultimo livello completo. dei gas
per niente reattivi.
Oltre Cloro al (Cl) avrai sentito parlare del Fluoro (F), si trovano tutti e
due nel settimo gruppo insieme al Bromo (Br) ed allo Iodio (I)
Il Silicio (Si) si trova insieme al Carbonio (C) nel IV Gruppo e l’Azoto
(N) insieme al Fosforo (P) nel V (sai perché sono importanti?).
Insieme all’Elio (He) c’è anche il Neon (Ne), il gas che si utilizza nelle
lampade a basso consumo; con l’Argon (Ar), il Kripton (Kr) - da non
confondere con la “kriptonite” che non esiste, lo Xeno (straniero) ed il
Radon appartengono tutti all’ultimo gruppo, l’VIII.
Nel settimo Periodo c’è un elemento che sicuramente avrai sentito
nominare perché è stato studiato durante i primi esperimenti sulla
radioattività, il Radio, Ra88
ESERCITAZIONE
DIVERTIAMOCI CON LA TAVOLA PERIODICA
Adesso che conosciamo il segreto della Tavola Periodica proviamo:
Il Neon (Ne) ha 2 elettroni sul ___ livello e appartiene al ____ periodo
l’Argon (Ar)) ha 2 elettroni sul ___ livello e appartiene al ____ periodo
il Kripto (Kr) ha 2 elettroni sul ___ livello e appartiene al ____ periodo
… come avrai capito questi elementi si trovano tutti nello stesso Gruppo,
l’VIII, ma in Periodi diversi.
Vedi la Tavola periodica interattiva: http://www.ptable.com/?lang=it
45
Come sono distribuiti gli elettroni di un atomi, come ad esempio lo
Iodio?
Proviamo a verificare: lo Iodio si trova nel VII Gruppo e nel 5° Periodo,
il suo numero atomico Z è ____, quindi ha in totale ____ elettroni, due
sul primo livello, otto sul secondo e sette sul terzo.
Esempio
Consideriamo adesso il Ca che ha 20 elettroni, il suo numero atomico è
Z=20, qual è il suo posto nella Tavola? Naturalmente si troverà nel II
Gruppo e nel 4° Periodo.
Esempio
La caratteristica di tutti gli elementi dei Gruppi B è che hanno elettroni in
un livello più esterno senza avere completato del tutto i livelli precedenti
Tutti gli elementi appartenenti al blocco centrale della Tavola Periodica,
indicati come elementi del Gruppo B, sono detti METALLI DI
TRANSIZIONE perché costituiscono il passaggio relativo al
riempimento di orbitali in livelli più interni ma con energia più alta
rispetto all’orbitale esterno
Considerando ora gli elementi di transizione successivi al Bario (Ba,
Z=56), il Lantanio (La, Z=57) e l’Afnio (Hf, Z=72); si tratta di elementi
pesanti, come era prevedibile visto che si trovano nel 6° Periodo, ma ti
sarai accorto che c’è un apparente errore, mentre i numeri atomici dei
primi due elementi si differenziano di una sola unità come previsto, tra il
secondo ed il terzo elemento c’è una differenza di 15 unità.
Probabilmente avrai intuito che tra questi due elementi devono essercene
altri, precisamente quattordici, ed è effettivamente così.
Questi elementi sono i LANTANIDI: appartengono alle cosiddette Terre
Rare e sono difficilmente separabili perché presentano caratteristiche
chimiche e fisiche molto simili.
Il primo elemento di questa serie è il lantanio, il suo nome proviene dal
greco λαντανειν (lantanein) e vuol dire sono nascosto, sfuggo
l’osservazione, a sottolinearne la rarità di questi elementi e le difficoltà
trovate per arrivare a separarli tramite purificazione chimica.
Gli Attinidi sono 14 elementi radioattivi con numero atomico compreso
tra 90 e 103, raggruppati intorno all’Uranio. La serie comprende in
ordine di numero atomico crescente, i radioattivi naturali Attinio, Torio,
Protoattinio, Uranio e i radioattivi artificiali, detti transuranici: Nettunio,
Plutonio, Americio, Cu-rio, Berkelio, Californio, Einsteinio, Fermio,
Mendelevio, Nobelio e Laurenzio
46
ESERCIZIO
Individua gli elementi in base alla posizione in tabella e indica il numero
di elettroni presenti sul livello più esterno dei loro atomi.
simbolo elemento
numero di elettroni
II gruppo A e 4° periodo
III gruppo A e 6° periodo
VI gruppo A e 5° periodo
III gruppo B e 5° periodo
III gruppo B e 6° periodo
V gruppo B e 4° periodo
5.4 - GLI ISOTOPI
Ogni elemento comprende atomi con lo stesso numero atomico, ossia
numero di protoni. Si definiscono atomi isotopi, o semplicemente
isotopi, atomi con lo stesso numero atomico ma diverso numero di
neutroni.
Il nome isotopo (stesso posto) scaturisce proprio dalla Tavola Periodica,
in quanto gli atomi con lo stesso numero atomico occupano la stessa
posizione. Naturalmente nella Tavola viene indicato l’isotopo
dell’elemento con maggiore percentuale di abbondanza relativa.
Ad esempio tra i tre isotopi dell’Idrogeno (Prozio, Deuterio e Trizio),
sulla Tavola Periodica è indicato 1 1H che dei tre Isotopi è quello più
abbondante.
ESERCIZIO
Ricerca gli isotopi dello Iodio, dell’Azoto, dell’Uranio, del Cloro,
dell’Ossigeno e del Carbonio, evidenziando il loro eventuale impiego.
Indica inoltre qual è il rispettivo numero di massa.
Il Silicio è una sostanza di
colore grigio scuro con
riflessi bluastri. L’isotopo più
comune è 28-Si.
Fonte Wikipedia
47
5.5 - LE PROPRIETA’ PERIODICHE
Abbiamo visto che la posizione di un elemento nella Tavola Periodica è
determinata dalla configurazione elettronica e che proprio per questo
esiste una periodicità nella reattività chimica.
E’ possibile individuare delle proprietà comuni agli elementi e
prevederne la variazione in base alla posizione che l’elemento occupa
nella Tavola Periodica?
Ad esempio tutti gli atomi hanno lo stesso raggio? Tutti gli atomi
possono diventare cationi e anioni allo stesso modo?
Evidentemente no, le dimensioni, la capacità di cedere uno o più
elettroni. e diventare un catione, o invece di attrarli diventando anioni,
dipendono dalla configurazione elettronica.
La tavola periodica diventa quindi un utile strumento per prevedere
l’andamento di queste proprietà.
!
5.5.1 - Raggio atomico
Come si possono misurare i raggi atomici? Teniamo presente che mentre
la massa di un atomo è determinata dal nucleo (protoni e neutroni)
perché la massa degli elettroni è trascurabile, le dimensioni di un atomo
sono legate allo spazio occupato dai suoi elettroni in movimento (ricorda
l’esperimento di Rutheford).
Dato che è praticamente impossibile determinare i raggi atomici di atomi
isolati essi sono stati ricavati in base alle distanze interatomiche in
molecole in cui sono coinvolti atomi dello stesso tipo. L’ordine di
grandezza del raggio atomico è di 10-12 m (picometri)
Per definizione quindi,
il raggio atomico è la metà della distanza minima
di avvicinamento fra i nuclei
di due atomi di uno stesso elemento.
48
Il raggio atomico dipende dallo spazio occupato dagli elettroni e quindi
dalla configurazione elettronica.
Ma come varia tra gli elementi, scendendo lungo il Gruppo e scorrendo
da sinistra a destra nel Periodo?
Consideriamo elementi che appartengono allo stesso Gruppo:
scendendo aumenta il Periodo quindi gli elettroni esterni si trovano su
livelli sempre più distanti dal nucleo. Da ciò consegue che
il raggio atomico aumenta
scendendo nel Gruppo.
Scendendo nel Gruppo il raggio atomico aumenta: ciò significa che gli
elettroni di valenza sono sempre più lontani dal nucleo. Poiché la forza
con cui gli elettroni sono trattenuti dal nucleo diminuisce all’aumentare
della loro distanza dal nucleo stesso.
Consideriamo, adesso, elementi che appartengono allo stesso Periodo:
andando da sinistra verso destra, il livello di riempimento è lo stesso ma
aumenta il numero atomico e quindi aumentano i protoni nel nucleo e gli
elettroni nel livello più esterno. Da ciò consegue che c’è un aumento
della forza di attrazione tra nucleo ed elettroni che porta ad una
contrazione della nube elettronica. Pertanto:
il raggio atomico diminuisce
nel periodo spostandosi da sinistra verso destra.
.
!
49
5.5.2 - L’energia di ionizzazione
Un atomo può formare un catione se perde elettroni o un anione se
acquista elettroni.
Per trasformare un atomo in un catione, occorre “strappare” almeno un
elettrone dall’atomo stesso, ma per far questo occorre impiegare energia.
Si definisce energia di prima ionizzazione la quantità
di energia necessaria per allontanare uno degli elettroni
più esterni di un atomo allo stato gassoso.
L’unità di misura è KJ/mol.
Agas + energia → A+ gas + eDa un atomo si possono allontanare più elettroni (mai i protoni); ciò
accade quando si impiegano quantità di energia sempre più elevate. Si
definisce pertanto, oltre all’energia di prima ionizzazione, anche
l’energia di seconda ionizzazione, di terza ionizzazione, ecc.
Ovviamente, il valore di energia aumenta ad ogni ionizzazione
successiva.
Scendendo nel Gruppo diventa via via più facile strappare elettroni,
quindi l’energia di ionizzazione è via via più bassa, poiché, come detto,
il raggio atomico aumenta e diminuisce la forza di attrazione tra il nucleo
e gli elettroni più esterni.
Lungo il Periodo, da sinistra verso destra aumenta il numero atomico,
ossia il numero di elettroni, che tuttavia si trovano sempre nello stesso
livello energetico. Questi elettroni, pertanto, risentono di una forza di
attrazione sempre maggiore da parte del nucleo all’interno del quale va
aumentando il numero di protoni. Risulta quindi più difficile allontanarli
e da ciò consegue che l’energia di ionizzazione è via via più alta da
sinistra verso destra lungo il Periodo.
!
Se ci soffermiamo sulla definizione di Energia di Ionizzazione (o
Potenziale di Ionizzazione) ci rendiamo conto che avere un elemento con
bassa energia di ionizzazione vuol dire che bisogna fornire un piccola
quantità di energia per allontanare un elettrone, quindi gli elementi che
hanno una bassa energia di ionizzazione tendono facilmente a
trasformarsi in cationi.
Questa è una caratteristica tipica della reattività chimica dei metalli, per
cui questa grandezza può essere considerata una misura diretta del
carattere metallico di un elemento.
50
!
5.5.3 - Affinità elettronica
Un atomo può anche formare anioni, cioè acquistare elettroni; questo
processo comporta una stabilizzazione complessiva del sistema atomo-
elettrone perché l’elettrone da solo rappresenta un sistema altamente
energetico e quindi instabile. Di conseguenza quando un atomo
acquista un elettrone si libera una certa quantità di energia chiamata
affinità elettronica; un incremento dell’energia liberata è associato ad un
aumento della stabilizzazione dell’anione che si è formato.
51
L’affinità elettronica è l’energia che si libera
quando un atomo di un elemento allo stato
gassoso cattura un elettrone.
L’unità di misura è kJ/mol
Agas + e- → A-gas + energia
Scendendo nel gruppo, gli elettroni esterni si trovano in livelli sempre
più lontani dal nucleo per cui risentono meno dell’attrazione del nucleo
quindi l’affinità elettronica diminuisce.
Lungo il Periodo, da sinistra verso destra, il numero atomico aumenta
ma aumenta, come abbiamo già detto, la forza di attrazione che attira gli
elettroni di valenza quindi l’affinità elettronica aumenta andando verso
numeri atomici maggiori.
!
Può essere più facile interpretare questa grandezza se si associa l’affinità
elettronica alla capacità di attrarre elettroni da parte di un atomo.
Considerata da questo punto di vista, questa grandezza rappresenta la
tendenza a formare anioni; questa caratteristica non è affatto tipica dei
metalli ma evidenzia un comportamento caratteristico dei cosiddetti nonmetalli.
Qual’è la configurazione dello ione I- ? Ha un elettrone in più nell’ultimo
livello, quindi possiede 54 elettroni, corrispondenti al numero di elettroni
del gas nobile più vicino, lo Xeno.
Lo ione I- quindi ha la configurazione elettronica dello Xe e dal punto di
vista della reattività, presenta la stessa stabilità del gas nobile e questo
spiega viceversa la forte reattività dell’atomo di Iodio e di tutti gli
alogeni.
L’elevata stabilità dello ione formatosi spiega anche l’alta affinità
elettronica dello Iodio, visto che l’energia che si libera nel corso della
trasformazione è molto alta.
52
RIFLETTI
Lo Iodio come tutti gli elementi del settimo Gruppo possiede ben sette elettroni di valenza ed è alla ricerca di
un altro elettrone per completare l’ultimo livello. Insieme al Cloro, al Bromo, al Fluoro, ed al meno conosciuto
Astato, tutti i componenti del Gruppo degli ALOGENI, tende con molta facilità a formare ioni negativi: hanno
tutti, infatti, elevati valori di affinità elettronica.
5.5.4 - Il Raggio Ionico
Quali sono le dimensioni che assume uno ione una volta che si è
formato? Naturalmente la situazione è differente a seconda che si tratti di
un anione o di un catione.
Ricordando che il volume di un atomo corrisponde essenzialmente allo
spazio a disposizione degli elettroni per il loro movimento, l’acquisto di
uno o più elettroni con la formazione di un anione, aumenta il raggio
ionico e viceversa la perdita di uno o più elettroni con la formazione di
un catione diminuisce il raggio ionico.
Per avere un’idea più chiara di quanto abbiamo detto osserva l’immagine
alla pagina seguente, dove sono messi a confronto le dimensioni del
raggio atomico e di quello ionico, per gli elementi del primo e per quelli
del settimo gruppo.
Trovandosi agli estremi della Tavola Periodica il comportamento chimico
dei due gruppi è naturalmente opposto, per cui i metalli alcalini tendono a
cedere il proprio elettrone diventando dei cationi e diminuendo il loro
raggio mentre tutti gli alogeni tendono a diventare degli anioni e quindi
aumentano il proprio raggio.
5.5.5 - L’Elettronegatività
L’elettronegatività è un’altra proprietà dell’atomo legata alla sua
struttura elettronica ed al suo comportamento nell’interazione con altri
atomi, misura infatti la tendenza di un atomo ad attrarre elettroni nel
legame con altri atomi (definizione di elettronegatività relativa di
Pauling) ed è chiaramente collegata alle altre due proprietà
precedentemente definite.
L’elettronegatività, quindi, permette di prevedere nel caso di formazione
di un legame chimico tra atomi di elementi diversi qual è l’atomo che
tendenzialmente acquista elettroni e quello che tendenzialmente li
cede.
53
A sinistra è rappresentato il raggio medio degli atomi degli elementi del
primo gruppo e dei rispettivi ioni positivi.
A destra è rappresentato il raggio medio degli atomi degli elementi del
settimo gruppo e dei rispettivi ioni negativi. Il disegno è in scala.
Lungo il Periodo da sinistra verso destra l'elettronegatività aumenta,
poiché la carica nucleare aumenta e di conseguenza gli atomi hanno
maggiore tendenza ad attrarre a sé gli elettroni; quando si passa al
Periodo successivo il valore di elettronegatività crolla e poi riprende a
crescere.
Scendendo nel Gruppo l’elettronegatività diminuisce, poiché il nucleo
esercita una forza di attrazione sugli elettroni esterni sempre minore, dato
che la distanza nucleo-elettrone esterno aumenta; inoltre aumenta anche
l’azione di schermo da parte degli elettroni interni.
Ci sono diverse scale di elettronegatività. La più diffusa è la scala di
Linus Pauling che indica il Fluoro come l’elemento più elettronegativo
(4,0) e il Francio e il Cesio come quelli meno elettronegativi (0,7). Gli
altri elementi hanno valori intermedi.
Esaminando i valori di elettronegatività riportati nella precedente tavola
si può evidenziare che:
✓ Il I ed il II Gruppo presentano i range più bassi di elettronegatività
✓ Ci sono solo tre elementi con un elettronegatività compresa tra 3.00 e 4.0 e
sono l’Ossigeno, il Cloro e l’Azoto (in ordine decrescente)
54
✓ L’ossigeno è quindi il secondo elemento più elettronegativo dopo il Fluoro
✓ La maggior parte degli elementi ha un’elettronegatività compresa nel range
tra 1,50 e 2,90
✓ L’idrogeno pur trovandosi per la sua configurazione elettronica nel I
gruppo, presenta un valore di elettronegatività relativamente elevato,
giustificabile con la sua particolare condizione (un solo elettrone)
RIFLETTI
Secondo te, quale sarà il valore di elettronegatività per i gas nobili?
Come probabilmente avrai intuito, dato che l'elettronegatività riguarda la forza
di attrazione di un atomo verso gli elettroni di valenza cioè quelli impegnati in
un legame, e i gas nobili normalmente non formano legami con altri atomi, la
loro elettronegatività viene considerata nulla
55
ESERCIZI
1. Procedendo dal sodio al cloro il volume atomico ____________. Perché?
2. Confronta e spiega le diversità delle energie di ionizzazione e del raggio atomico di due elementi del
periodo 4, potassio e bromo.
3. Occorre più energia ad allontanare l’elettrone dall’atomo di litio o di fluoro? Perché?
4. Ordina i seguenti gruppi di atomi in ordine crescente secondo la loro elettronegatività:
primo gruppo
Elettronegatività crescente
secondo gruppo
bromo
cloro
cobalto
calcio
carbonio
ferro
magnesio
carbonio
fluoro
fluoro
sodio
potassio
Elettronegatività decrescente
5. Classifica i seguenti elementi come metalli, non metalli, semimetalli o gas nobili. Quando possibile
indica se appartengono a una famiglia particolare:
Elementi
Me NMe
SMe GasN
Idrogeno
Famiglia
Elementi
Me NMe
SMe GasN
Famiglia
Calcio
Neon
Fluoro
Carbonio
Fosforo
Azoto
Silicio
Cloro
Magnesio
Sodio
Ossigeno
6. Quale atomo ha maggiore affinità elettronica tra Li, Na, K, Cl?
_____________________________________________________________________________________
7. La carica dello ione sodio è ____
8. Quale atomo tra Na, Al, S, Si richiede meno energia per formare ioni positivi? Perché?
_____________________________________________________________________________________
56
5.6 - L’IMPORTANZA DELLA TAVOLA PERIODICA
Conoscere le caratteristiche degli atomi in relazione alla loro posizione
nella Tavola Periodica ci permette di poter prevedere il comportamento
chimico degli atomi stessi in modo veloce: ad esempio la reattività
chimica degli atomi si può così schematizzare:
Energia di
ionizzazione
Affinità
elettronica
Elettronegatività
formano
bassa
bassa
bassa
cationi
alta
alta
alta
anioni
✓ gli atomi degli elementi che presentano valori bassi di energia di
ionizzazione, affinità elettronica e quindi di elettronegatività,
reagendo con altri atomi tenderanno a cedere elettroni, assumendo
totale o parziale carica positiva,
✓ gli atomi degli elementi che presentano valori alti di energia di
ionizzazione, affinità elettronica e quindi di elettronegatività,
reagendo con altri atomi tenderanno ad acquistare elettroni,
assumendo totale o parziale carica negativa
Possiamo classificare gli elementi raggruppandoli in tre famiglie:
✓ metalli
✓ semimetalli o metalloidi
✓ non metalli
Degli elementi a tutt’oggi noti, la grande maggioranza (più di 80)
appartiene alla famiglia dei metalli, individuati sulla tavola periodica A
SINSTRA della linea spezzata che va dal Boro all’Astato, Questa linea
separa tutti quegli elementi che, per le loro caratteristiche e per la loro
reattività, sono definiti metalli da quelli che si trovano A DESTRA e che
presentando caratteristiche e reattività opposte sono chiamati non metalli.
Gli elementi che si trovano a ridosso della linea sono chiamati
semimetalli o metalloidi.
I metalli, si distinguono dal punto di vista fisico, per essere buoni
conduttori del calore e dell’elettricità, malleabili (si possono ridurre in
lamine sottili) e duttili (si possono ridurre in fili sottili) in fase solida;
mostrano una lucentezza metallica ma sono opachi, sono molto densi e
solidi a temperatura ambiente (ad eccezione del Mercurio). Dal punto di
vista chimico la loro reattività si può riassumere dicendo che sono
metallici quegli elementi che nelle reazioni tendono a cedere elettroni,
trasformandosi in ioni positivi (cationi).
I non metalli invece dal punto di vista fisico presentano caratteristiche
opposte ai metalli: non sono duttili, né malleabili, non sono lucenti e
generalmente non sono buoni conduttori né di elettricità, né di calore.
Possono essere, solidi e liquidi ma la maggior parte è gassosa. Dal punto
di vista chimico sono caratterizzati dalla tendenza ad acquistare elettroni
ed a formare ioni negativi (anioni).
I semimetalli sono generalmente dei semiconduttori e presentano
caratteristiche variabili comportandosi da metalli quando si combinano
con i non metalli e da non metalli quando reagiscono con i metalli.
Il NIchel è un metallo duro,
duttile e malleabile utilizzato
per produrre acciaio inox.
Fonte Wikipedia
57
5.7 - UTILIZZAZIONE E DIFFUSIONE DELLE SOSTANZE
ELEMENTARI
L’Arsenico. Sia il metallo
che molti dei composti che
contengono As sono potenti
veleni.
Metalli, non metalli, semimetalli non sono solo “caselle” della Tavola
Periodica ma sono diffusi nel nostro mondo, si trovano nelle rocce,
nell’aria, nei vegetali, tantissimi nel nostro corpo, sono utilizzati per la
produzione di medicinali e manufatti.
Ecco qualche esempio: Argento, azione battericida ed antisettica; Silicio,
semiconduttore utilizzato nella produzione della componentistica
elettronica, insieme al Boro, all’Arsenico e all’Antimonio; Piombo,
utilizzato negli accumulatori elettrici, per rivestire i cavi e nel campo
della radiologia data la sua impermeabilità alle radiazioni, inoltre è
utilizzato nell'industria vetraria; Nichel, necessario all’attività degli Acidi
Nucleici, potenziatore di insulina, utilizzato nelle batterie; Rame, uno
degli “elementi traccia” del nostro organismo, essenziale per processi
biochimici, insieme al Manganese, lo Zinco, il Ferro, lo Iodio ed il
Fluoro, deve essere assunto tramite l’alimentazione. Mercurio, viene
utilizzato in certi processi chimici industriali e, inoltre, è impiegato
nell'industria elettrica, nell'industria farmaceutica e in alcuni apparecchi
scientifici (termometri e barometri) anche se è in corso di sostituzione;
Fosforo, presente nelle cellule è coinvolto in molte funzioni
dell’organismo. E’ infatti indispensabile per il metabolismo dell’energia,
la sintesi del DNA, l’assimilazione e
Il Fosforo assume colorazioni diverse a
seconda della forma cristallina: incolore,
giallo, rosso, scarlatto, violetto, nero.
Fonte Wikipedia
Il Cadmio Sia il metallo che i suoi composti sono tossici
perfino a basse concentrazioni e tendono ad accumularsi
negli organismi e negli ecosistemi.
La maggior parte del cadmio estratto viene utilizzato nelle
pile al nichel cadmio, il resto è usato per produrre pigmenti,
rivestimenti e stabilizzanti per le materie plastiche.
Fonte Wikipedia
Il Rame è un metallo rosso arancio. A destra la
miniera di rame a cielo aperto di El Chino nel
Nuovo Messico.
Fonte Wikipedia
58
l’utilizzazione del calcio, essenziale per la formazione delle ossa (circa
l’80% del fosforo si trova infatti distribuito tra le ossa e i denti); Cadmio,
utilizzato per le pile, presente nelle batterie per auto, fumo della sigaretta,
ecc.
5.8 - ALCUNE SITUAZIONI PARTICOLARI
Consideriamo ora l’Idrogeno, con solo un elettrone ed un protone nel
nucleo è l’atomo più leggero e questo lo rende unico dal punto di vista
della reattività chimica.
Se controlliamo le sue caratteristiche vediamo che presenta, come
previsto, un’affinità elettronica superiore agli altri elementi del Gruppo e
che il suo potenziale di ionizzazione è molto più alto e come
conseguenza la sua elettronegatività è intermedia, avvicinandosi a quella
di metalli come il piombo o a non metalli come il fosforo.
Nonostante la presenza di un solo protone nel nucleo l’effetto di
attrazione è esaltato dalla mancanza dell’azione schermante di altri
elettroni.
Esaminiamo ora la reattività.
Cedendo un elettrone diventa un catione molto particolare visto che
rimane solo il protone “nudo”
H + energia → H+ + eLo ione H+ è chiamato infatti “PROTONE”
Questo rappresenta il comportamento più frequente ma non è la sola
possibilità dell’idrogeno che potrà anche acquistare un elettrone da
elementi meno elettronegativi per trasformarsi nello IONE IDRURO H-,
stabile visto che ha raggiunto la configurazione dell’Elio.
H + e- → H- + energia
L’Idrogeno quindi pur trovandosi nel I Gruppo per la presenza di un
elettrone di valenza ha un comportamento che sicuramente non è
metallico (ricorda la definizione chimica di metallo) e non appartiene al
Gruppo dei Metalli Alcalini
Consideriamo ora il IV ed il V gruppo, sono i gruppi centrali della Tavola
periodica non allungata ed infatti sono gli unici che al loro interno
presentano la contemporanea presenza di non metalli, metalloidi e
metalli.
Sai spiegarti il perché?
Probabilmente avrai capito che dipende dal numero intermedio di
elettroni quattro (e cinque) presenti nell’ultimo livello, per cui i rispettivi
elementi hanno, teoricamente, la stessa probabilità di cedere o acquistare
elettroni. In realtà il loro comportamento è a questo punto determinato
dal raggio atomico.
Elementi pesanti come il Piombo e lo Stagno, in cui gli elettroni di
valenza si trovano molto lontani dal nucleo (5° e 6° Periodo) tenderanno
a comportarsi da METALLI, mentre il Carbonio, con raggio atomico
basso, (2° Periodo) è un NON METALLO, il Silicio ed il Germanio che
59
sono intermedi come grandezza presentano un comporta-mento da SEMI
METALLI.
APPROFONDIMENTO - IL PIOMBO
Il Piombo (Pb) è stato uno dei primi elementi metallici noti, agli Egizi, ai Fenici, dopo ai Cinesi, e infine
ai Romani, i quali lo impiegavano su larga scala per condutture d'acqua.
Dagli alchimisti fu associato al pianeta Saturno da qui il nome “saturnismo” per indicarne le
intossicazioni croniche dovute al fatto che Il piombo e i suoi composti sono molto tossici per l'uomo e gli
animali in quanto danno luogo a fenomeni di accumulo nell'organismo.
In natura è un elemento relativamente poco abbondante (0,0015% circa della crosta terrestre), si presume
che tutto il piombo esistente sia derivato dal decadimento dell'uranio (U238) che si trasforma in piombo.
Il Piombo è un metallo bianco-azzurro, lucente in superficie, a bassa durezza e basso punto di fusione,
molto duttile e malleabile. E' un cattivo conduttore del calore e dell'elettricità; possiede elevata densità e
alto potere assorbente delle radiazioni.
A temperatura ambiente allo stato compatto si ossida superficialmente all'aria assumendo così il
caratteristico colore grigio opaco.
5.9 - CONCLUSIONI
Come hai immaginato, dato che procedendo lungo il Periodo,il numero di
elettroni da allontanare per assumere la configurazione del gas nobile
precedente aumenta, si richiede una quantità di energia sempre crescente
per poterli allontanare tutti.
La reattività dei metalli diminuisce fino a che il comportamento degli
elementi addirittura si inverte. Infatti dal punto di vista energetico diventa
conveniente attirare elettroni piuttosto che allontanarli, per raggiungere la
configurazione del gas nobile successivo all’elemento considerato.
L’elemento assume così un comportamento da non metallo. A questo
punto la reattività dei non metalli tenderà ad aumentare man mano che
aumenta il numero di elettroni nell’ultimo livello. A questo punto si può
fare una previsione sull’andamento della reattività degli elementi nella
Tavola Periodica?
Sintetizzando in due frasi si può senz’altro affermare che
Il carattere metallico di un elemento diminuisce lungo il
Periodo, andando da sinistra verso destra e aumenta
scendendo lungo il Gruppo.
Il carattere non metallico di un elemento aumenta lungo il
Periodo, andando da sinistra verso destra e diminuisce
scendendo lungo il Gruppo
60
Ma quando parliamo di reattività che cosa intendiamo? Si tratta della
tendenza di un atomo a cedere o ad accettare elettroni per
raggiungere una configurazione elettronica più stabile di quella di
partenza, durante l’interazione con altri atomi dello stesso o di
diverso tipo.
RIFLETTI
La maggior parte degli elementi, che nella Tavola Periodica sono
rappresentati nella loro forma atomica, esistono in natura in forme
diverse che derivano proprio dalla loro tendenza a raggiungere una
configurazione elettronica stabile.
I gas nobili, data la loro scarsa reattività, sono gli unici elementi che
esistono in forma stabile sotto forma di atomi singoli; tutti gli altri
elementi o si trovano sotto forma di composti, cioè combinati con altri
elementi diversi o se sono puri, con atomi dello stesso tipo, formando
piccoli o grossi aggregati di atomi, molecole o macromolecole.
ESERCIZIO
Dati i seguenti elementi: Calcio, magnesio, sodio cloro, ossigeno,
zolfo,carbonio, potassio, bario, iodio, silicio, azoto, fosforo, bismuto,
stagno.
1. Senza guardare sulla Tavola periodica prova a scrivere i rispettivi
simboli
2. Indica il numero di elettroni sul livello più esterno in base alla loro
posizione nella Tavola Periodica.
3. Riporta la rispettiva reattività (metalli, non metalli).
4. Prevedi il tipo di ioni che tenderanno a formare per stabilizzarsi,
evidenziando la quantità di carica.
5. Fai una ricerca per verificare la capacità di formare più ioni con
cariche differenti e cerca di dare una spiegazione.
6. Memorizzali.
Per soddisfare la tua curiosità ed ampliare la conoscenza sulle caratteristiche e la reattività degli elementi,
visita i siti riportati, ti divertirai con le Tavole Periodiche Interattive:
http://www.tavolaperiodica.it/index;
html/www.chim1.unifi.it/dida/mendel.
htm/www.dayah.com/periodic/
www.lenntech.com/italiano/tavolaperiodica.htm;
http://www.profmokeur.ca/chimica/chimica.htm
61
ESERCIZI DI FINE MODULO
1. Osservando la Tavola Periodica, individua:
a. un elemento del III gruppo appartenente al quinto periodo
b. l’alogeno nel terzo periodo
c. un elemento del quarto periodo simile all’elemento con Z = 10
d. un elemento del sesto periodo simile al Se
2. I gruppi IA e IIA della Tavola periodica sono costituiti da:
a. metalli di transizione
b. alogeni
c. metalli alcalini
3. Gli alogeni sono:
a. Be, Mg, Ca, Sr, Ba
b. F, Cl, Br, I, At
c. O, S, Se, Te, Po
d. N, P, As, Sb, Bi
4. Indica a quale gruppo di elementi corrisponde una configurazione elettronica del livello esterno
con 2 elettroni:
a. metalli alcalini
b. metalli alcalino-terrosi
c. alogeni
d. gas nobili
5. Indica a quale gruppo di elementi corrisponde una configurazione elettronica del livello esterno
con 8 elettroni:
f. metalli di transizione
g. metalli alcalino-terrosi
h. gas nobili
i. lantanidi
10. Stabilisci, in base al gruppo di appartenenza, quale dei seguenti elementi ha sei elettroni nel livello
esterno:
a. Ba
b. S
c. Si
d. F
11. Le dimensioni atomiche generalmente:
a. rimangono costanti lungo un periodo e lungo un gruppo
b. diminuiscono lungo un periodo da sinistra verso destra e diminuiscono lungo un gruppo dall’alto
verso il basso
c. aumentano lungo un periodo da sinistra verso destra ed aumentano lungo un gruppo dall’alto verso il
basso
d. diminuiscono lungo un periodo da sinistra verso destra ed aumentano lungo un gruppo dall’alto verso
il basso
62
5. Per ciascuna delle seguenti coppie indica quale elemento ha dimensioni maggiori
a. Br-As
b. Sr-Mg
c. Ne-Xe
d. C-O
e. Hg-Cl
6. Disponi le seguenti specie in ordine di dimensioni crescenti:
RAGGIO CRESCENTE
Ar
K+
Cl S2Ca2+
7. Individua tra gli ioni seguenti quelli tra loro isoelettronici.
Fe2+, Sc3+, K+, Br-, Co2+, Co3+, Sr2+, O2-, Zn2+, Al3+
8. Indica il simbolo dell’elemento:
SIMBOLO ELEMENTO
del gruppo IV che ha atomi di dimensioni
minori
del quinto periodo che ha gli atomi di
dimensioni maggiori
del gruppo VII che ha la più bassa energia
di ionizzazione
9. Disponi i seguenti atomi in ordine di energia di prima ionizzazione crescente:
ORDINE DI PRIMA
IONIZZAZIONE CRESCENTE
As,
Sn
Sr
Br
63
10. Considerando il numero di elettroni sul livello più esterno, prevedere la carica dei principali
ioni degli elementi zolfo, calcio ferro, argento, alluminio, zinco, stagno
11. Scrivere il nome degli elementi del quarto periodo e dell’VIII gruppo B
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
12. Il carattere metallico, in genere:
a.diminuisce lungo un periodo da sinistra verso destra e diminuisce lungo un gruppo dall’alto verso il
basso
b.aumenta lungo un periodo da sinistra verso destra ed aumenta lungo un gruppo dall’alto verso il
basso
c.diminuisce lungo un periodo da sinistra verso destra ed aumenta lungo un gruppo dall’alto verso il
basso
d.aumenta lungo un periodo da sinistra verso destra e diminuisce lungo un gruppo dall’alto verso il
basso
16. Indica l’elemento con carattere metallico più spiccato:
a. Na
b. Ca
c. Al
17. Quale dei seguenti ioni è isoelettronico
dell'argo?
d. Cs
20. Fra i seguenti elementi, quale ha la minore
affinità elettronica?
a. P3+
a. fluoro
b. Al3+
b. bromo
c. F-
c. iodio
d.
S2-
18. Quale tra i seguenti è l’elemento meno
rappresentato negli organismi viventi?
a. idrogeno
b. sodio
c. azoto
d. ossigeno
19. Quale delle seguenti proprietà degli alogeni
aumenta procedendo dal fluoro allo iodio?
a. l’energia di ionizzazione
b. la lunghezza di legame nella molecola
c. l’elettronegatività
d. il potere ossidante
d. cloro
21. Quale affermazione non è corretta,
relativamente agli elementi del gruppo VA?
a. sono in parte non metalli
b. sono tutti solidi, tranne uno
c. tutti formano ossidi acidi
d. uno di essi è un costituente essenziale delle
Proteine
22. In quale delle seguenti liste gli elementi sono
disposti in ordine di energia di ionizzazione
crescente?
a. Li, Na, K
b. Al, Mg, Na
c. N, O, F
d. F, Ne, Na
64
23. L’energia di quale dei seguenti processi è data dall’elettronegatività del cloro?
a. Cl(g) + 1 e− → Cl− (g)
b. Cl(g) → Cl+ (g) + 1 e−
c. Cl(aq) + 1 e− → Cl− (aq)
d. nessuno di questi, l’elettronegatività è definita in maniera convenzionale e ci sono scale diverse per
misurarla
24. Scrivere i simboli ed i nomi dei semimetalli ed individua i gruppi di appartenenza
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
65
MODULO 6 - LA MATERIA:
I COMPOSTI INORGANICI
6.1 - IL MONDO DELLE SOSTANZE COMPOSTE
Dallo studio del capitolo precedente e dall’esame del comportamento di
degli atomi di tanti elementi sarai arrivato ad una conclusione molto
importante e di carattere generale: gli atomi degli elementi che
possiedono otto elettroni nel livello energetico più esterno sono
particolarmente stabili - inerti - nel senso che manifestano pochissima
tendenza a reagire con altri elementi chimici.
Gli atomi degli altri elementi, che possiedono configurazioni elettroniche
diverse da quella dei gas nobili, tendono a perdere o ad acquistare
elettroni per raggiungere tale configurazione particolarmente stabile e
questo comportamento influisce direttamente sull’andamento di molte
reazioni chimiche
Gilbert Newton Lewis
(1875-1946).
Fonte Wikipedia
6.1.1 - La regola dell’ottetto
Agli inizi del 900, il chimico tedesco Gilbert Newton Lewis, dall’esame
della reattività e della periodicità degli elementi arrivò più o meno alle
stesse conclusioni a cui sei arrivato tu, guidato dalle tue conoscenze
sull’atomo, sulla con-figurazione elettronica e sulla periodicità degli
elementi dei capitoli precedenti.
Dato che non aveva ancora i mezzi tecnici per dimostrare ciò che aveva
intuito, formulò dei postulati, qui di seguito sintetizzati, relativamente
alla capacità di reazione degli atomi dei vari elementi e cioè alla
possibilità che tali atomi possano legarsi tra di loro attraverso gli
elettroni più esterni per formare dei composti:
1. in tutti gli atomi c’è una parte più interna (nucleo) che rimane
inalterata nei comuni cambiamenti chimici,
2. gli atomi sono composti dal nucleo e da una parte esterna (shell) che
contiene un numero di elettroni, variabile da zero a otto,
3. ciascun atomo tende a contenere un numero costante di elettroni nello
shell, tale numero è costituito da otto elettroni,
4. gli elettroni possono passare rapidamente da uno shell ad un altro,
tuttavia sono tenuti nelle loro posizioni da vincoli più o meno forti, e
la natura e l’intensità di queste forze sono determinate sia dalla natura
degli atomi che dalla combinazione con altri.
In seguito gli enunciati furono sintetizzati in una semplice regola
empirica chiamata la regola dell’ottetto (Langmuir):
Gli atomi formano legami coinvolgendo gli elettroni di valenza
perdendo, acquistando o mettendo in comune elettroni, per poter
assumere una configurazione elettronica esterna chiusa a otto elettroni,
particolarmente stabile e simile a quella dei gas nobili.
66
Il risultato più importante di questa affermazione è che il legame
chimico è dovuto ad una coppia di elettroni. La particolare stabilità
che Lewis attribuisce al “doppietto” elettronico, evidenziata dai quattro
doppietti dei gas nobili, anticipa di un decennio il principio di esclusione
di Pauli, che prevede la presenza di due soli elettroni su ogni orbitale.
6.1.2 - Un’utile rappresentazione: le strutture di Lewis
Nella maggior parte dei casi gli elettroni coinvolti nelle reazioni
chimiche sono gli 8 elettroni presenti nel livello energetico più
esterno.
Tali elettroni sono convenzionalmente rappresentati utilizzando un
metodo, introdotto appunto da Lewis, in cui il nucleo e gli elettroni
interni sono rappresentati dal simbolo dell’elemento mentre gli elettroni
più esterni sono indicati come punti o coppie di punti disposte ai
quattro lati del simbolo.
Ad esempio, se consideriamo lo zolfo, che ha 6 elettroni di valenza, la
sua rappresentazione secondo Lewis è:
Una rappresentazione di questo tipo della configurazione elettronica
dell’ultimo livello è molto comoda perché evidenzia immediatamente la
reattività dell’elemento indicando il numero totale degli elettroni di
valenza ed esplicitando quante sono le coppie di elettroni e quanti gli
elettroni spaiati, cioè quelli presenti da soli in un orbitale.
Per maggior chiarezza consideriamo la configurazione di Lewis o
struttura di Lewis di tutti gli elementi appartenenti al 2° periodo.
Sia lo zolfo sia l’ossigeno hanno la stessa struttura di Lewis: questa è una
Elemento
Configurazione
di Lewis
Elemento
Configurazione
di Lewis
Elemento
Litio
Berillio
Boro
Carbonio
Azoto
Ossigeno
Fluoro
Neon
Configurazione
di Lewis
conseguenza del fatto che con questa simbologia l’attenzione è
focalizzata solo sugli elettroni di valenza senza considerare il raggio
atomico ed il diverso comportamento degli atomi dovuto a questa
proprietà, che però influisce direttamente sul modo con cui gli atomi si
legano.
67
Esempio
Consideriamo ora il Neon, la configurazione elettronica dei suoi atomi è
identica a quella degli atomi di tutti gli altri gas nobili, escludendo
naturalmente l’elio i cui atomi possiedono solamente due elettroni:
queste sono le configurazioni a cui fare riferimento quando si dovrà
considerare la possibilità di formare un legame tra atomi di due elementi.
Esempio
6.1.3 - Numero di legami di un atomo e strutture di Lewis
Partendo dalla configurazione di Lewis è possibile prevedere il
numero di legami che un atomo può attuare, poiché esso dipende da
quanto la configurazione dell’atomo di quell’elemento si allontana da
quella di un gas nobile.
Il Fosforo, esso appartiene al quinto gruppo e quindi i suoi atomi
posseggono cinque elettroni esterni; la loro configurazione di Lewis sarà
pertanto la seguente:
Facendo riferimento alle configurazioni degli atomi dei gas nobili
precedentemente rappresentate è evidente che agli atomi di fosforo
mancano tre elettroni per completare l’ottetto, quindi sono tre i legami
che essi tenderanno a formare con atomi degli elementi con cui
reagiscono, utilizzando gli elettroni spaiati e tendendo ad acquistare gli
elettroni di cui hanno bisogno.
A questo punto sai prevedere qual’è il numero di legami che possono
formare gli atomi di Azoto? Chiaramente non hai avuto neanche bisogno
di rappresentare la configurazione: poiché l’Azoto si trova nello stesso
gruppo, i suoi atomi hanno la capacità di formare lo stesso numero di
legami.
Esempio
Esempio
68
Consideriamo ora un altro elemento molto comune, l’Ossigeno:
Anche l’ossigeno è un non metallo e i suoi atomi hanno
bisogno di due elettroni, per raggiungere la configurazione
dei gas nobili quindi essi tenderanno a formare due legami,
attirando verso di sé i due elettroni.
Vediamo ora il comportamento dell’Alluminio, un tipico metallo del
terzo gruppo
Negli atomi di Alluminio gli elettroni esterni sono solo tre e
come sappiamo il loro comportamento da metallo prevede che
i suoi atomi tendano ad assumere la configurazione del gas
nobile che lo precede nella tavola periodica, cedendo gli
elettroni; il numero di legami che potranno formare sarà quindi
pari a tre.
Possiamo ora trarre una prima regola generale, che poi allargheremo, da
applicare a questo tipo di rappresentazione schematica:
il numero di legami che gli atomi di un elemento
possono formare è rappresentato dal numero di
elettroni spaiati in essi presenti.
A questo punto avrai naturalmente capito però che il modo con cui si
formano i legami è differente a secondo del tipo di elementi considerati,
ad esempio sia l’alluminio che il fosforo possono formare tre legami ma
la loro reattività è differente quindi il tipo di legame sarà molto diverso.
ESERCIZIO
Riscrivere le strutture di Lewis per tutti gli elementi dei Gruppi A del 2° e
3° Periodo e individuare per ogni atomo il numero di legami che può
formare ed il massimo numero di elettroni che può impegnare.
6.1.4 - Strutture di Lewis e zone orbitali
Prima di continuare ad utilizzare la configurazione di Lewis conviene
sottolineare che è solo un modo empirico e comodo per rappresentare una
configurazione elettronica e non una rappresentazione veritiera.
In realtà, ad ogni puntino o coppia di puntini corrisponde una ben
determinata zona dello spazio, detta zona orbitale, in cui esiste la
massima probabilità di trovare gli elettroni così rappresentati.
Le zone orbitali sono centrate sul nucleo degli atomi hanno forme
diverse. Anche le loro dimensioni sono diverse: crescono con
l’aumentare del livello energetico.
6.2 - I LEGAMI CHIMICI
Abbiamo visto che gli atomi tendono a legarsi spontaneamente fra loro
per formare delle strutture più grandi, attraverso legami chimici ogni qual
volta questo processo permette loro di raggiungere una condizione di
maggiore stabilità energetica, quindi
A e B vicini
A e B legati
energia del sistema A + B > energia del sistema A―B
Quindi possiamo dire che si ha un legame chimico quando due atomi si
uniscono tra loro mettendo in compartecipazione elettroni, in un
processo la cui forza motrice è una diminuzione dell’energia globale del
sistema formato dalle due particelle.
Cosa succede agli atomi quando si avvicinano? in realtà essendo formati
da cariche negative e positive si formeranno sia forze repulsive che
attrattive secondo il seguente schema
69
Se per un determinato aggregato atomico esiste una distanza particolare
in cui si raggiunge una situazione di equilibrio a cui corrisponde un
minimo di energia, allora si potranno formare dei legami stabili che
determineranno l’esistenza di aggregati di atomi legati tra loro.
Una volta che il legame si è formato, gli elettroni dei due atomi coinvolti
verranno condivisi; il tipo di condivisione varia a seconda del tipo di
reattività, come in parte abbiamo già visto.
6.2.1 - Tipi di legami chimici
Consideriamo ora tre casi emblematici.
Il Cloro appartiene agli Alogeni (Gruppo VIIA) quindi la sua struttura di
Lewis è quella indicata in figura.
Il simbolismo è chiaro, il cloro ha sette elettroni nel livello
più esterno: tre doppietti, accoppiati in ciascun orbitale e un
elettrone spaiato; potrà quindi formare un legame, ma di che
tipo?
Avendo un’alta affinità elettronica, tenderà ad attrarre un
elettrone ma lo acquisterà del tutto, trasformandosi in uno ione, o solo
parzialmente?
Come avrai sicuramente capito il tipo di legame dipende anche dall’altro
atomo con cui sta formando il legame.
Primo esempio
Legame tra due atomi di cloro
Se consideriamo la possibilità di reagire con un altro atomo di cloro,
sebbene gli atomi che si stanno unendo siano di per sé molto reattivi, essi
presentano la stessa tendenza ad acquistare elettroni e l’unico modo per
raggiungere una situazione di stabilità energetica è quella di raggiungere
un compromesso “da buoni amici”.
Si dice che gli elettroni sono messi in completa compartecipazione, cioè
egualmente condivisi tra i due nuclei (nube gialla nella figura a fianco), in
modo che entrambi gli atomi risentano della loro presenza e possano
raggiungere la configurazione otteziale dell’Ar.
In realtà quello che avviene è simile a quanto succede tra due contendenti
nel tiro alla fune: se i due ragazzi coinvolti hanno la stessa forza, la fune
sarà ugualmente condivisa, raggiungendo una situazione di equilibrio.
70
Si ottiene quindi una molecola biatomica che si rappresenta con la
formula Cl2.
Il legame in questo caso si dice covalente puro o anche covalente
omeopolare poiché, essendo gli elettroni perfettamente condivisi,
non c’è nessuna separazione di cariche.
La zona orbitale in cui si trovano gli elettroni di legame, ossia
quelli condivisi tra i due atomi, si estende nella direzione della
“linea” che unisce i due atomi, detta asse internucleare.
Legame tra un atomo di Cloro e un atomo di Idrogeno
Se invece il Cloro si lega con l’Idrogeno, cosa accade?
Ti ricorderai benissimo che sebbene si trovi nel I gruppo, l’idrogeno non
è un metallo ed anzi ha un comportamento particolare, caratterizzato da
un valore di elettronegatività intermedia. In questo caso, esso si lega al
cloro che, pur essendo fortemente elettronegativo, non riesce a
strappargli del tutto l’elettrone.
Secondo esempio
Entrambi gli elettroni di legame sono messi in compartecipazione anche
se il cloro rappresenta il “prepotente” della situazione e li sposta verso il
proprio nucleo: nella figura a fianco puoi osservare che la nube gialla è
asimmetrica).
Anche in questo caso il doppietto di elettroni appartiene ad entrambi gli
atomi per cui l’Idrogeno raggiunge la configurazione dell’Elio ed il Cloro
quella dell’Argon. Anche in questo caso si forma una molecola
rappresentabile con la formula HCl.
Il legame che si forma in casi simili a quello appena descritto è di tipo
covalente polare.
Il legame in questo caso si dice covalente polare o anche
covalente eteropolare poiché, essendo gli elettroni non
perfettamente condivisi, c’è una separazione di cariche.
Anche in questo caso, la zona orbitale in cui si trovano gli
elettroni di legame, si estende nella direzione
dell’asse internucleare.
Le cariche quindi si differenziano con la formazione di una parziale
carica negativa (δ-) sul cloro ed una parziale carica positiva (δ+)
sull’idrogeno: si forma un dipolo. Un dipolo è una molecola che, pur
essendo neutra poiché il numero complessivo dei protoni è uguale a
quello degli elettroni, presenta una zona carica positivamente e una carica
negativamente.
71
Riprendendo l’esempio del tiro alla fune, questa situazione corrisponde
ad una mancanza di equilibrio tra forze, in cui non c’è però una totale
prevalenza di uno sull’altro per cui si ottiene solo uno spostamento, più o
meno accentuato, verso uno dei due contendenti.
Terzo esempio
Legame tra un atomo di Cloro e un atomo di Sodio
Consideriamo infine ciò che succede quando il Cloro si lega con il Sodio
Il legame in questo caso è un tipico esempio di legame tra atomi di
elementi in cui la tendenza di uno dei due a cedere l’elettrone è
complementare alla forte tendenza dell’altro ad acquistarlo: il risultato è
un completo trasferimento dell’elettrone del Sodio sull’atomo di Cloro.
Entrambi gli atomi si ionizzano, stabilizzandosi, in quanto il primo
assume la configurazione del Neon ed il secondo quella dell’Argon. Gli
atomi di Sodio carichi positivamente - cationi - si indicano con il simbolo
Na+ e quelli di cloro carichi negativamente - anioni - con il simbolo Cl-.
La formula chimica nel caso di atomi uniti con un legame ionico,
rappresenta un rapporto numerico tra ioni positivi e ioni negativi.
Il rapporto di combinazione è quindi di 1 ad 1 e il composto che si forma,
non è costituito da molecole, ma da una regolare alternanza di cationi
Sodio e anioni Cloro, è rappresentabile con la formula NaCl.
La forza che tiene insieme gli ioni di carica opposta è di tipo
elettrostatico, poiché con il passaggio di elettroni dagli atomi di Sodio a
quelli di Cloro si sono formati dei veri e propri ioni di carica opposta.
Il legame in questo caso si dice ionico poiché, essendoci stato un
trasferimento di elettroni da un atomo all’altro, si assiste alla
formazione di ioni di carica opposta.
In questo caso, non vi è una zona orbitale comune. Ogni ione
Cloro (negativo) tenderà a circondarsi con il massimo numero di
ioni Sodio (positivi) e viceversa e il legame si estenderà in ogni
direzione dello spazio in cui ci siano ioni di carica opposta.
72
In determinati casi le interazioni tra gli atomi possono coinvolgere dei
doppietti solitari.
Nella chimica tradizionale il legame in cui il doppietto di elettroni
condiviso proviene da un solo atomo si chiama covalente di tipo
dativo. In realtà, una volta messi in comune, gli elettroni diventano
indistinguibili ed è impossibile capire a quale atomo originariamente
appartenessero. Oggi si preferisce parlare di legame di coordinazione.
RICAPITOLANDO
✴ Gli elettroni esterni, di valenza, sono implicati nel legame chimico
✴ Tra gli elettroni di valenza distinguiamo gli elettroni singoli ed i
doppietti solitari:
i primi sono i più reattivi e sono impegnati immediatamente
✓
nella formazione del legame,
i secondi generalmente non sono coinvolti perciò vengono
✓
anche chiamati doppietti di non legame,
✴ Gli atomi tendono ad assumere la configurazione elettronica dei gas
nobili attraverso l’interazione con altri atomi con cui scambiano o
mettono in compartecipazione gli elettroni secondo la regola
dell’ottetto,
✴ Gli elettroni messi in compartecipazione sono chiamati coppia
(doppietto) di legame,
✴ Se gli elettroni vengono completamente trasferiti da un atomo
all’altro si ha un legame ionico,
✴ Se gli elettroni sono in compartecipazione si ha un legame covalente
che potrà essere puro o polare,
✴ In alcune situazioni quando gli elettroni singoli sono già stati
impegnati anche i doppietti solitari possono essere messi in
compartecipazione con altri atomi, trasformandosi in doppietto di
legame e formando un legame covalente dativo.
RIFLETTI
Il numero di legami che un atomo può formare influisce sul rapporto con cui gli atomi si combinano tra
loro ed in ultima analisi sul tipo di sostanza e sulla formula che la rappresenta.
Nei casi, in cui l’atomo coinvolto possegga dei doppietti solitari, può impegnarli formando dei legami di
tipo dativo, di conseguenza il numero di legami che esso può formare aumenta e questo comporta che
possono esistere composti con gli stessi elementi ma presenti in rapporti differenti ad esempio HClO ma
anche HClO2, HClO3, HClO4.
Naturalmente, come verificherai in modo più approfondito in seguito, in questi casi il composto che si
forma dipende dalla quantità di ossigeno presente nell’ambiente di reazione.
ESERCIZI
1. Indica le differenze tra i vari tipi di legami che hai studiato
2. individua i tipi di legame che si formano nelle seguenti molecole:
H2O, KOH, KI, NH3, KH, NaCl, I2, O2,
73
6.2.2 - La polarità del legame
Per poter interpretare davvero il comportamento di una sostanza e
quindi classificarla, è indispensabile conoscere non solo il numero di
legami presenti, in modo da individuare il rapporto con cui gli atomi
sono legati tra loro, ma anche il tipo di legame formatosi.
In realtà questa distinzione così netta non esiste, come vedrai quando
approfondirai il concetto di legame nei prossimi anni, e sarebbe più
opportuno parlare di predominanza del carattere ionico o
predominanza del carattere covalente del legame, visto che quelle
rappresentate sono delle condizioni estreme. Tuttavia, questa
interpretazione è comoda e non comporta grossi errori se il livello di
approccio all’argomento non diventa troppo approfondito.
Secondo questa interpretazione il parametro più utilizzato per
individuare facilmente le proprietà del legame caratteristico di una
sostanza è la differenza di elettronegatività che più di ogni altra
2
100%
IONICO
COVALENTE
PURO
proprietà indica immediatamente il comportamento relativo degli atomi
coinvolti.
Possiamo a questo punto riuscire a prevedere velocemente, senza
complicati calcoli matematici, sia il numero sia il tipo di legami che gli
atomi possono formare: il trasferimento di un elettrone da un atomo
all’altro avverrà quanto più bassa è l’energia di ionizzazione (primi
Gruppi della Tavola Periodica) di un elemento e quanto più alta è
l’affinità elettronica dell’altro (ultimi Gruppi della Tavola Periodica) o in
altri termini quanto maggiore è la loro differenza di elettronegatività
(∆EN).
74
In linea di massima è possibile prevedere che:
➡ il carattere di un legame covalente puro si assume quando ∆EN = 0
➡ la polarità del legame cresce col crescere del ∆EN
➡ iI legame è covalente polare fino a ∆EN = 2;
➡ si ha un legame prevalentemente ionico quando ∆EN > 2;
➡ il carattere di un legame si assume ionico quando ∆EN > 3.
Come al solito la Tavola Periodica, evidenziando le proprietà degli
elementi coinvolti nel legame, ci permette di prevederne il
comportamento chimico degli atomi coinvolti, cioè la loro reattività, e
quindi anche le caratteristiche della sostanza che si formerà.
ESERCIZI
1. Stabilire quale è il legame più polare tra C–F, N–F e O–F.
2. Prevedere come varia il valore del momento dipolare del legame X–
Cl, passando da X = Al a X = S
3. Distinguere tra i seguenti composti quali hanno un legame ionico e
quali solo legami covalenti LiOH, CH3ONa, CH3OH, H2S, Mg(OH)2,
CHCl3
4. Distinguere all’interno della singola molecola i legami in ordine di
polarità
6.3 - IL NUMERO DI OSSIDAZIONE
Nella chimica, il linguaggio simbolico è molto importante: per
velocizzare l’interpretazione del comportamento chimico di una sostanza,
ci si serve di un comodo metodo basato sull’utilizzo di un numero che
individua, per ogni elemento all’interno di un composto,
contemporaneamente il numero di elettroni impiegati ed il suo
comportamento. Si tratta del numero di ossidazione.
Proviamo ad interpretare meglio il concetto espresso da questa
definizione attraverso degli esempi rappresentativi.
Riferendoci come al solito al Cloro, proviamo ad indicare con il numero
di ossidazione, i diversi comportamenti che questo atomo può assumere,
a secondo dell’elemento con cui è legato e del suo rapporto di
combinazione.
Il numero di ossidazione rappresenta la carica reale
o formale che l’atomo di un elemento assumerebbe,
all’interno di una molecola, se gli elettroni coinvolti
nei legami si attribuissero completamente
all’elemento più elettronegativo
75
Esempio
76
Nelle sostanze studiate, il Cloro ha mostrato comportamenti diversi e ciò
è evidenziato simbolicamente dal diverso numero di ossidazione (N.O.),
mentre l’Idrogeno ha sempre impegnato un solo elettrone, tendendo a
cederlo (N.O.=+1) e l’Ossigeno ha sempre attirato le coppie di elettroni
di legame (N.O.= -2).
In linea generale quindi possiamo affermare che:
✓ il valore assoluto del numero di ossidazione indica il numero di
elettroni impegnati dall’atomo nella molecola studiata,
✓ il segno positivo indica che nella molecola l’atomo è meno
elettronegativo e quindi che gli elettroni di legame si allontanano,
✓ il segno negativo indica che nella molecola l’atomo è più
elettronegativo e quindi tende ad attirare gli elettroni di legame,
✓ il valore nullo per il numero di ossidazione indica che nella molecola
la differenza di elettronegatività tra gli atomo impegnati nel legame è
nulla e quindi gli elettroni sono perfettamente condivisi.
Ricordando le caratteristiche del legame covalente omeopolare, possiamo
affermare che
Gli atomi di tutte le sostanze
elementari hanno Numero di
Ossidazione uguale a zero.
e che
Gli atomi di uno stesso elemento possono
possedere Numeri di Ossidazione diversi se
manifestano differenti comportamenti
Naturalmente non dobbiamo mai dimenticare che questi, che sembrano
degli automatismi, in realtà sono il risultato della configurazione
elettronica dell’atomo che influenza la reattività di tutti gli elementi.
Per questo motivo nella tavola periodica sono riportati i numeri di
ossidazione di tutti gli elementi ed è subito evidente che gli elementi che
hanno la stessa reattività dovuta ad un’identica distribuzione degli
elettroni nell’ultimo livello, hanno numeri di ossidazione identici.
Infatti gli elementi del I gruppo - un elettrone nell’ultimo livello - hanno
tutti il numero di ossidazione pari a +1, i metalli alcalino terrosi - due
elettroni nell’ultimo livello - hanno tutti il numero di ossidazione +2, gli
alogeni - sette elettroni nell’ultimo livello - hanno tutti il numero di
ossidazione -1 e così via.
77
Nella tabella sottostante sono riportati i numeri di ossidazione di alcuni
tra gli elementi più comuni della Tavola Periodica, per gli atomi con più
valori il primo rappresenta il comportamento chimico più frequente.
I
1°
II
III
IV
V
VI
VII
O
-2/-1
F
-1
H
+1/-1
2°
Li +1
Be
+2
B
+3
C
+4/+2
N
+5/+3
+4/+2+1
-2/-3
3°
Na
+1
Mg
+2
Al
+3
Si
+4
P
+5/+3
S
+6/+4
-2
Cl
+7/+5/+3/+1
-1
4°
K
+1
Ca
+2
Ga
+3
Ge
+4
As
+5/+3
Se
+6/+4
-2
Br
+5/+3/+1
-1
5°
Rb
+1
Sr
+2
6°
Cs
+1
Ba
+2
I
+7/+5/+1
-1
Pb
+2/+4
Per gli elementi di transizione si faccia riferimento alla Tavola Periodica
completa allegata nel capitolo precedente.
Esistono delle regole empiriche che permettono di ricavare il numero di
ossidazione di un elemento all’interno di una molecola se non lo si
conosce, ma ne rimandiamo la trattazione al paragrafo successivo, perché
ormai abbiamo tutte le conoscenze per classificare e dare un nome
all’enorme numero di composti che caratterizzano quella che viene
chiamata la Chimica Inorganica.
ESERCIZIO
Ricavare i numeri di ossidazione per gli atomi di tutte le molecole di cui
avete rappresentato le configurazioni di Lewis nelle esercitazioni
precedenti.
78
6.4 - COME SI CHIAMANO LE SOSTANZE
I composti chimici attualmente conosciuti sono circa 5 milioni e il loro
numero aumenta di circa 500 mila ogni anno.
Un numero così grande di sostanze, ha necessariamente bisogno di essere
organizzato secondo regole semplici, chiare ed universalmente condivise.
Lo scopo della nomenclatura è quello di fornire regole per individuare
un composto, attribuendogli in modo chiaro e univoco un nome e una
formula.
6.4.1 - Tipologie di nomenclatura
Vi sono essenzialmente due tipologie di Nomenclatura:
La Nomenclatura Tradizionale: essa prevede l’uso di prefissi e suffissi,
in base al numero di ossidazione dei vari elementi
La Nomenclatura IUPAC (International Union of Pure and Applied
Chemistry): si tratta della nomenclatura ufficiale, introdotta a partire
dagli anni ’70 del secolo scorso, che sta progressivamente soppiantando
la nomenclatura tradizionale
Le regole della nomenclatura sono affidate a Commissioni Permanenti
della IUPAC, sono in continua evoluzione e seguono di pari passo lo
sviluppo stesso della chimica.
La nomenclatura IUPAC prevede l’indicazione del numero di atomi di
ogni elemento presente all’interno del composto ed in alcuni casi il
numero di ossidazione viene indicato tra parentesi a fianco del nome del
composto.
Alcuni nomi tradizionali, fortemente radicati nell’uso comune, quali
acqua H2O, ammoniaca (NH3) o metano (CH4), sono stati accettati
come internazionalmente validi.
In questo lavoro è stata privilegiata la Nomenclatura Tradizionale in
quanto ancora molto in vigore nella didattica chimica e solo in alcuni casi
sono stati ripresi alcuni composti e rinominati con la Nomenclatura
Ufficiale.
6.4.2 - Regole convenzionali per l’attribuzione dei N di ossidazione
Le principali regole per l'attribuzione dei numeri di ossidazione (nox)
sono le seguenti:
1. il nox delle sostanze elementari (H2, O2, Na, Fe etc) è sempre zero
poiché ci troviamo di fronte ad atomi di uno stesso elemento, aventi
perciò la stessa elettronegatività; più in generale quando in una
molecola due atomi di uno stesso elemento si uniscono con legame
covalente, gli elettroni di legame non vanno attribuiti a nessuno dei
due atomi;
2. il nox di uno ione è uguale alla sua carica
Mg2+ (nox = +2);
Cl1- (nox = -1),
3. l'idrogeno presenta sempre nox +1 tranne che nei composti in cui si
lega direttamente con i metalli alcalini (elementi del I gruppo A) e
79
alcalino-terrosi (elementi del II gruppo A), che risultano essere gli
unici elementi più elettropositivi dell'idrogeno: in tali composti l'H ha
nox -1,
4. l'ossigeno ha sempre nox -2 tranne che:
a. nei composti dove l'ossigeno impegna uno dei suoi due
elettroni per legarsi ad un altro atomo di ossigeno. Secondo
quanto previsto dalla regola numero 1 in questo caso gli
elettroni del legame tra atomi uguali non vanno attribuiti,
mentre viene attribuito all'ossigeno l'altro elettrone utilizzato
per legarsi ad altri elementi: un esempio di questi composti è
il perossido di idrogeno o acqua ossigenata H2O2
H−O−O−H
pertanto in questo caso il nox dell’ossigeno sarà -1;
b. quando l’ossigeno si lega con il Fluoro, l’unico elemento più
elettronegativo dell’ossigeno, ed in questo caso il suo numero
di ossidazione nox = +2,
5. il Fluoro, essendo l'elemento più elettronegativo della tabella
periodica, ed avendo bisogno di un solo elettrone per raggiungere
l'ottetto, ha sempre nox -1,
6. gli altri elementi del VII gruppo A hanno anch'essi nox -1, tranne
quando si legano con elementi più elettronegativi, come ad esempio
l'ossigeno, in tal caso presentano nox positivi,
7. in generale il nox più elevato di un elemento corrisponde al
numero del gruppo a cui appartiene: così gli elementi del primo
gruppo presentano nox +1, quelli del secondo +2, quelli del terzo +3
e così via fino agli elementi del settimo gruppo i cui elementi
presentano come nox più elevato +7; ciò è valido per i Gruppi A
mentre per quelli B non esistono regole generali ma saranno attribuiti
seguendo la loro distribuzione elettronica ed in particolare la
tipologia di composti che gli stessi elementi dei Gruppi B possono
dare sperimentalmente,
8. gli elementi del VII gruppo A oltre al nox +7 possono presentare nox
+5, +3, +1, -1 ed in taluni casi +4,
gli elementi del VI gruppo A oltre al nox + 6 possono presentare nox
+4, +2, -2 ed in taluni casi +3,
gli elementi del V gruppo A oltre al nox + 5 possono presentare nox
+3, -3 ed in taluni casi +1,+2, +4,
gli elementi del IV gruppo A altre al nox +4 possono presentare nox
+2,
9. in una specie chimica neutra la somma dei nox di tutti gli atomi che
la compongono deve sempre essere nulla cioè pari a zero,
10. in uno ione poliatomico (formato da più atomi) la somma dei nox dei
diversi atomi deve sempre essere pari alla carica totale dello ione.
80
La conoscenza dei numeri di ossidazione ci permette di costruire in modo
semplice i principali composti chimici, che divideremo in composti
Binari e composti Ternari
Esempi
1) Per calcolare il numero di ossidazione dello zolfo nell'anidride
solforica SO3, si procederà in questo modo:
Esempio
a) ciascun atomo di ossigeno presenta nox -2 (regola n° 4);
b) complessivamente i tre atomi presentano nox -6;
c) affinché la somma dei nox sia zero,
lo zolfo deve presentare nox + 6.
-
Esempio
2) Per calcolare il nox dello zolfo nello ione poliatomico HSO4 si
procederà in questo modo:
a) i quattro atomi di ossigeno presentano complessivamente nox – 8
(regola 4 – nox di ciascun ossigeno -2)
b) l'idrogeno presenta nox + 1 (regola n° 3).
c) sommando il nox degli ossigeni e dell'idrogeno si ottiene - 7
d) affinché la somma di tutti i nox dia la carica complessiva dello
ione -1, lo zolfo deve presentare nox +6.
Per costruire un composto chimico è necessario
conoscere i numeri di ossidazione degli
elementi componenti.
In base alla tipologia degli elementi componenti una sostanza, possiamo
distinguere i composti in binari, ternari, quaternari etc..
6.5 - I COMPOSTI BINARI
I composti binari sono formati da atomi di due soli elementi chimici.
Convenzionalmente si scrivono ponendo per primo l'elemento meno
elettronegativo, seguito dall'elemento più elettronegativo.
Il simbolo di ciascun elemento è seguito da un numero a pedice, detto
indice. Gli indici indicano il rapporto numerico tra gli atomi dei vari
elementi che costituiscono il composto.
Per determinare gli indici in modo semplice, è sufficiente utilizzare il nox
del primo elemento come indice del secondo e viceversa.
Vogliamo, ad esempio, scrivere la formula di un composto binario
formato da atomi dell’elemento A il cui numero di ossidazione sia +2 e
da atomi dell’elemento B il cui numero di ossidazione sia -3:
✓ scriviamo i simboli dei due elementi uno vicino all’altro
! +3 −2
e sopra il simbolo scriviamo il nox
AB
€
81
✓ poi “incrociamo i numeri”: scriviamo il nox
(senza segno) del primo elemento (A) in basso
a destra del secondo elemento (B) e viceversa.
AB
!
2
3
Si noti che l'elemento con il numero di ossidazione negativo (il più
elettronegativo) è stato scritto per secondo.
€
Tale metodo di costruzione dei composti binari garantisce la neutralità
della molecola. Infatti nella molecola sono presenti 3 atomi di A per un
totale di 6 cariche positive e 2 atomi di B per un totale di 6 cariche
negative.
Suggerimento
Qualora, dopo aver calcolato gli indici, questi
risultino divisibili per uno stesso numero, gli indici
vanno semplificati, tranne alcuni casi particolari
Ad esempio nella molecola di acqua ossigenata H2O2 non si opera alcuna
semplificazione.
Vogliamo, ad esempio, costruire un composto binario partendo dagli
elementi X con numero di ossidazione +4 e Y con numero di ossidazione
-2, si otterrà
! +4
−2
XY
Esempio
€
!X 2Y 4
!X
Y
2
6.5.1 - Idruri dei metalli
Sono composti binari formati da Idrogeno legato con atomi di metalli
€ In tali composti€ l'idrogeno presenta nox -1 (ione
più elettropositivi.
idruro H-) e quindi nella formula va scritto per secondo.
Gli idruri dei metalli alcalini (I gruppo A) che presentano nox +1, hanno
formula generale
Me H
Gli idruri dei metalli alcalino terrosi (II gruppo A), che presentano tutti
nox +2, hanno formula generale
MeH2
Il loro nome è formato dal termine "idruro" seguito dal nome del
metallo:
NaH (idruro di sodio)
MgH2 (idruro di magnesio).
Gli idruri sono altamente reattivi. Reagiscono con l’acqua generando
idrogeno. Oggi gli idruri sono studiati al fine di essere usati nei serbatoi
delle automobili alimentate ad idrogeno; come spugne, capaci di
consentire uno stoccaggio di carburante e quindi facilitarne l’utilizzo
diretto a richiesta; oppure per garantire alle automobili alimentate a celle
combustibili una elevata autonomia.
82
6.5.2 - Idruri dei non-metalli e semi-metalli
Sono composti binari dell’idrogeno con i semimetalli e non metalli.
Si tratta di gas spesso infiammabili all’aria.
Formula
Nome comune
Nomenclatura IUPAC
CH4
Metano
Tetraidruro di carbonio
SiH4
Silano
Tetraidruro di silicio
NH3
Ammoniaca
PH3
Fosfina
Triidruro di fosforo
AsH3
Arsina
Triidruro di arsenico
Triidruro di azoto
Esempio
L’idruro di sodio è un
solido cristallino
incolore.
Fonte: Wikipedia
6.5.3 - Idracidi
Gli idracidi sono composti binari formati da un non metallo e
dall’idrogeno.
I principali idracidi si formano dall'unione dell'idrogeno con i non metalli
del VII gruppo A (alogeni) e con lo zolfo (non metallo del VI gruppo A).
Il nome degli idracidi secondo la nomenclatura tradizionale si forma
facendo seguire al sostantivo "acido" l’aggettivo costruito prendendo il
nome del non metallo, seguito dalla desinenza -idrico.
La Nomenclatura Ufficiale IUPAC chiama questi composti ponendo il
suffisso –uro al nome del non-metallo seguito da idrogeno a sua volta
preceduto dal prefisso (1 mono; 2 di oppure bi; 3 tri; 4 tetra; 5 penta; 6
esa; 7 epta) che indica il numero di idrogeni presenti.
Ad esempio, la notissima formula chimica HCl rappresenta, secondo la
nomenclatura tradizionale, l’Acido Cloridrico; con la nomenclatura
IUPAC si chiamerà Cloruro di monoIdrogeno.
Formula
composto
Esempio
Nomenclatura tradizionale Nomenclatura IUPAC
HF
acido fluoridrico
HCl
acido cloridrico
H2S
acido solfidrico
HBr
acido bromidrico
HI
acido iodidrico
fluoruro di
monoidrogeno
cloruro di
monoidrogeno
solfuro di diidrogeno
bromuro di
monoidrogeno
ioduro di monoidrogeno
N.B.: Esiste un idracido nei composti ternari: HCN (acido cianidrico)
83
6.5.4 - Ossidi o Ossidi Basici
Sono composti binari formati da atomi di un metallo che si legano
con l'ossigeno (nox -2).
Si formano per la reazione di un metallo con l'ossigeno molecolare:
Metallo + O2 → Ossido
La reazione avviene velocemente con i metalli dei primi gruppi, che
presentano forte carattere metallico ed è più lenta con gli altri metalli.
Secondo la nomenclatura tradizionale, il nome degli Ossidi è formato
dalla parola "ossido" seguito dal nome del metallo; se il metallo presenta
diversi nox a quello maggiore viene attribuita la desinenza –ico, a quello
con nox minore la desinenza –oso.
Normalmente i metalli che formano ossidi non presentano un numero di
nox superiore a due unità.
In sintesi:
Me (Metallo) nox = + x
Esempio
Esempio
Me2Ox (Ossido di “nome del Metallo”)
Ricorda che per la scrittura di tutti i composti binari vale la regola
dell’incrocio studiata nel paragrafo 3.5.
Esempi:
Na (+1) Na2O (ossido di sodio)
Me(Metallo) nox = +x oppure +y con x <y
Me2Ox (Ossido nome del Metallo –oso)
Me2Oy (Ossido nome del Metallo –ico)
Cu (+1, +2)
Cu2O ossido rameoso
CuO ossido rameico
Secondo la nomenclatura ufficiale, il nome degli Ossidi è formato dalla
parola "ossido" preceduto dal prefisso (1 –mono; 2 –di; 3 –tri; 4 – tetra; 5
–penta;6 –esa; 7 –epta) che indica il numero di ossigeni presenti e seguito
dal nome del metallo, anch’esso preceduto dal prefisso che indica il
numero di atomi del metallo presenti nella formula.
Elemento
Li
Ca
Cu
L’ossido ferroso (sopra)
è una polvere nera.
L’ossido ferrico (sotto)
è il principale
componente della
ruggine.
Fonte: Wikipedia
84
Fe
Sn
nox
+1
+2
+1
+2
+2
+3
+2
+4
Formula Nome tradizionale Nome IUPAC
Li2O
Ossido di litio
Ossido di litio
CaO
Ossido di calcio Ossido di calcio
Cu2O
Ossido rameoso Ossido di dirame
CuO
FeO
Fe2O3
SnO
SnO2
Ossido rameico
Ossido ferroso
Ossido ferrico
Ossido stannoso
Ossido tannico
Ossido di rame
Ossido di ferro
Triossido di ferro
Ossido di stagno
Diossido di stagno
6.5.5 - Anidridi o Ossidi Acidi
Le anidridi sono composti binari formati da atomi di non metalli
legati con l'ossigeno.
Si formano per la reazione di un non-metallo con l'ossigeno molecolare:
Non Metallo + O2 → Anidride
La reazione è rapida con i non metalli che presentano forte carattere nonmetallico, più lenta con gli altri non-metalli.
Secondo la Nomenclatura Tradizionale il nome delle Anidridi è
formato dalla parola "anidride" seguito dal nome del non-metallo; se il
non-metallo presenta diversi nox a quello maggiore viene attribuita la
desinenza –ica, a quello a nox minore la desinenza –osa.
I non-metalli che formano anidridi presentano diversi nox e normalmente
non superiori a quattro valori
NMe (Non-Metallo) nox = + x Me2Ox (Anidride Non-Metallo-ica)
Esempio:
Boro (+3)
B2O3 (Anidride Borica)
NMe(Non-Metallo) nox = +x, oppure +y con x <y
N2Ox (Anidride Non-Metallo –osa)
N2Oy (Anidride NonMetallo –ica)
Esempio
Esempio:
Zolfo (+4, +6)
+4 < +6
SO2 (Anidride Solforosa) con lo zolfo +4
SO3 (Anidride Solforica) con lo zolfo +6
NMe(Non-Metallo) nox = +x, +y, +t con x valore minore rispetto a y ed y
valore minore rispetto a t (x<y<t)
NMe2Ox (Anidride ipo – NonMetallo –osa)
NMe2Oy (Anidride del Metallo –osa)
NMe2Ot (Anidride del Non-Metallo –ica)
Esempio
Esempio:
Iodio (+1, +5, +7)
I2O (Anidride ipoIodosa) I2 O5 (Anidride Iodica)
I2 O7 (Anidride Iodica o perIodica)
NMe(Non-Metallo) nox = +x, +y, +t, +z con x valore minore rispetto a y;
y valore minore rispetto a t e t valore minore rispetto a z (x<y<t<z)
NMe2Ox (Anidride ipo – NonMetallo –osa)
NMe2Oy (Anidride del NonMetallo –osa)
NMe2Ot (Anidride del NonMetallo –ica)
NMe2Oz (Anidride per- NonMetallo –ica
Esempio
85
Esempio
Esempio:
Cloro (+1,+3, +5, +7)
Cl2O (Anidride ipoClorosa) Cl2 O5 (Anidride Clorica) Cl2 O3 (Anidride Clorosa)
Cl2 O7 (Anidride perClorica)
Secondo la Nomenclatura Ufficiale IUPAC il nome delle Anidridi è
formato parola "ossido" preceduto dal prefisso (1 mono; 2 di; 3 tri; 4
tetra; 5 penta; 6 esa; 7 epta) che indica il numero di ossigeni presenti e
seguito dal nome del metallo, anch’esso preceduto dal prefisso che indica
il numero di atomi del metallo presenti nella formula.
Riassumendo:
Elemento nox Formula Nome tradizionale
B
C
S
P
Cl
+3
+4
+2
+4
+6
+3
+5
+1
+3
+4
+5
+7
B2O3
CO2
CO
SO2
SO3
P2O3
P2O5
Cl2O
Cl2O3
ClO2
Cl2O5
Cl2O7
Anidride borica
Anidride carbonica
Anidride carboniosa
Anidride solforosa
Anidride solforica
Anidride fosforosa
Anidride fosforica
Anidride ipoclorosa
Anidride clorosa
Diossido di cloro
Anidride clorica
Anidride perclorica
Nome IUPAC
Triossido di Boro
Diossido di carbonio
Monossido di carbonio
Diossido di zolfo
Triossido di zolfo
Triossido di difosforo
Pentossido di difosforo
Monossido di diCloro
Triossido di diCloro
Diossido di cloro
Pentossido di diCloro
Eptossido di diCloro
6.5.6 - Composti binari minori
Un tipo particolare di composti con ossigeno sono i Perossidi e i
superossidi
I perossidi sono composti in cui è presente il “gruppo perossido” (− O −
O −) unito ad elementi più elettropositivi. Nei perossidi ciascun atomo di
ossigeno presenta nox -1.
Il loro nome è formato dalla parola "perossido" seguito dal nome
dell'elemento legato.
Esempio
Perossido di idrogeno H2O2 (commercialmente chiamata acqua
ossigenata)
N. B: Esistono perossidi anche nei composti ternari: H2SO5
perossosolforico e K2 S2 O8 perossodisolfato
I superossidi sono composti contenenti lo ione superossido: O2l'Ossigeno ha nox di ossidazione -½ come ad esempio nel superossido di
potassio: KO2
86
SINTESI
87
6.6 - I COMPOSTI TERNARI
I composti ternari sono formati da atomi di tre elementi chimici.
Due importanti classi di composti ternari, gli idrossidi e gli acidi
ossigenati o ossiacidi, si formano per reazione tra gli Ossidi e le Anidridi
e l'acqua. Questi nuovi composti oltre a contenere ossigeno contengono
anche idrogeno.
Un composto ternario che contenga
idrogeno e ossigeno viene scritto in modo
diverso a seconda che presenti un
carattere acido o basico.
se si tratta di un acido vengono messi in evidenza gli atomi di idrogeno,
scrivendo per primo l'idrogeno seguito dal simbolo chimico del non
metallo X ed infine dall'ossigeno.
ACIDO OSSIGENATO HxXyOz
se si tratta di un idrossido vengono messi in evidenza i gruppi ossidrili
(-OH), scrivendo per primo il simbolo dell'elemento metallico Y seguito
da tanti gruppi ossidrili racchiusi tra parentesi tonde, quanti ne richiede il
numero di ossidazione "n" del metallo.
IDROSSIDO Y(OH)n
Alcuni composti possono comportarsi come acido o come base, a
seconda delle sostanze con cui reagiscono e per questo sono detti
composti anfoteri. La loro formula chimica può essere quindi scritta
come quella di un acido o come quella di un idrossido in relazione al
particolare comportamento che presentano in una data reazione.
6.6.1 - Idrossidi
Gli idrossidi sono composti ternari formati da un metallo, da ossigeno
e da idrogeno.
Essi si formano quando un ossido reagisce con una o più molecole
d'acqua:
L’Idrossido rameico è
un solido blu chiaro.
Fonte: Wikipedia
88
Ossido + acqua → Idrossido
Queste sostanze hanno carattere basico più o meno spiccato: questo
significa che esse, quando vengono poste in acqua, tendono a liberare
ioni ossidrile - OH-. Questo comportamento, è legato alla presenza, nella
molecola, di atomi di un metallo che rendono polare il legame con i
gruppi ossidrilici (OH-).
Sull'atomo di ossigeno dell'ossidrile si intensifica in tal modo la parziale
carica negativa, mentre sul metallo si forma una parziale carica positiva,
che, una volta in acqua, ne facilita la liberazione come catione e la
separazione dei gruppi OH-.
Secondo la Nomenclatura Tradizionale il nome degli Idrossidi si
ottiene da quello dell'ossido corrispondente, sostituendo il termine
"idrossido" al termine "ossido".
NaOH
Fe(OH)2
Idrossido di Sodio
Idrossido Ferroso il Fe ha nox = +2
Fe(OH)3 Idrossido Ferrico il Fe ha nox = +3
Esempio
Secondo la Nomenclatura Ufficiale IUPAC il nome degli Idrossidi è
formato dalla parola "idrossido"preceduto dal prefisso (1 mono; 2 di; 3
tri; 4 tetra; 5 penta;6 esa; 7 epta) che indica il numero di ossidrili
presenti, seguito dal nome del metallo.
NaOH monoIdrossido di Sodio, il sodio ha nox +1
Fe(OH)2 diIdrossido di Ferro, il ferro ha nox +2
Fe(OH)3 triIdrossido di Ferro il ferro ha nox +3
Esempio
Per costruire la formula di un idrossido, è sufficiente far seguire al
simbolo del metallo tanti gruppi ossidrile quanti ne richiede il numero di
ossidazione del metallo.
Ad esempio dall'ossido di sodio si ottiene l'idrossido di sodio
Esempi
(Na nox=+1)
Na2O + H2O → 2NaOH
mentre dall'ossido di calcio si ottiene l'idrossido di calcio
(Ca nox=+2)
CaO + H2O → Ca(OH)2
e dall'ossido rameico si ottiene l'idrossido rameico
(Cu nox= +1;+2)
Cu2O + H2O → 2Cu(OH)2
6.6.2 - Acidi Ossigenati o Ossiacidi
Gli idrossidi sono composti ternari formati da un non-metallo, da
ossigeno e da idrogeno.
Essi si formano si formano facendo reagire un'anidride con una o più
molecole d'acqua.
Anidride + acqua → Acido
89
Queste sostanze hanno carattere acido più o meno spiccato: questo
significa che esse, quando vengono poste in acqua, tendono a liberare
ioni idrogeno - H+.
Questo comportamento è legato alla presenza nella molecola di atomi di
un non metallo, elemento elettronegativo che attirando gli elettroni di
legame li allontana dagli atomi di idrogeno, indebolendo quindi il
legame. Sugli atomi di idrogeno si forma una parziale carica positiva che
ne facilita la liberazione in acqua come ioni H+. Per questo si parla di
acidi quando essi sono presenti in acqua.
Esempi
Esempi:
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
Secondo la Nomenclatura Tradizionale il nome degli Ossiacidi si
ottiene da quello dell'anidride corrispondente, sostituendo il termine
"acido" al termine "anidride".
H2SO3
Acido Solforoso, lo zolfo ha nox = +4
Secondo la Nomenclatura Ufficiale IUPAC il nome degli Ossiacidii è
formato dalla parola "acido" seguito da “osso” a sua volta preceduto dal
prefisso (1 mono; 2 di; 3 tri; 4 tetra; 5 penta;6 esa; 7 epta) che indica il
numero di atomi di ossigeno presenti, seguito dal nome del non-metallo
sempre con il suffisso -ico, a cui si pone tra parentesi il numero di
ossidazione del non-metallo scritto con numero romano.
H2SO3 Acido triossoSolforico (IV), lo zolfo ha nox = +4
H2SO4 Acido tetraossoSolforico (VI), lo zolfo ha nox = +6
Acidi meta - piro - orto
Le anidridi di alcuni elementi non metallici, come fosforo, arsenico,
antimonio, boro, silicio, possono reagire con un diverso numero di
molecole di acqua e formare ossiacidi che sono indicati con i prefissi
meta, piro, orto.
In particolare si usa il prefisso
✓ meta se all'anidride si aggiunge 1 molecola di acqua,
✓ piro se si aggiungono 2 molecole d'acqua,
✓ orto se se ne aggiungono 3 molecole d'acqua
Esempi
Esempi:
P2O3 + H2O → H2P2O4 = 2HPO2 acido metafosforoso
acido diossoFosforico (III)
P2O3 + 2H2O → H4P2O5 90
acido pirofosforoso
acido pentossodiFosforico (III)
P2O3 +3H2O → H6P2O6 = 2H3PO3 acido ortofosforoso
acido triossoFosforico (III)
P2O5 + H2O → H2P2O6 = 2HPO3 acido metafosforico
acido triossoFosforico(V)
P2O5 + 2H2O → H4P2O7 acido pirofosforico
acido eptaossodiFosforico(V)
N.B.
L’acido ortofosforico è
utilizzato come correttore
di acidità nelle bevande
gassate come quelle a
base di cola.
P2O5 +3H2O → H6P2O8 = 2H3PO4
acido ortofosforico
acido tetraossoFosforico(V)
B2O3 + H2O → H2B2O4 = 2HBO2 acido metaborico
acido diossoBorico (III)
B2O3 +3H2O → H6B2O6 = 2H3BO3 acido ortoborico
acido triossoBorico (III)
SiO2 + H2O → H2SiO3 acido metasilicico
acido triossoSilicico (IV)
SiO2 + 2 H2O → H4SiO4 L’acido borico in
soluzione acquosa
diluita al 3-5% è
utilizzato come
disinfettante.
Fonte: Wikipedia
acido ortosilicico (eccezione)
acido tetraossoSilicico(IV)
Poliacidi
Si possono considerare derivati dalla reazione tra due o più molecole
di anidridi con una o più molecole di acqua.
La nomenclatura tiene conto del numero di atomi del non metallo che
caratterizza il composto
Esempi:
2 CrO3 + H2O → H2Cr2O7 acido bicromico
acido eptaossodiCromico (VI)
Esempi
3 SiO2 + 2H2O → H4Si3O8 acido trisilicico
acido ottaossotriSilicico (IV)
2 B2O3 + H2O → H2B4O7 acido tetraborico
acido eptaossotetraBorico (III)
91
6.7 - DISSOCIAZIONE E IONIZZAZIONE
6.7.1 - Dissociazione di un idrossido (Base)
Un idrossido nella cui formula è presente un solo gruppo ossidrile è detto
monoprotico, se i gruppi ossidrili sono due è detto biprotico etc.
Un idrossido monoprotico come l'idrossido di potassio si dissocia in
acqua in questo modo:
KOH + H2O → K+acq + OH-acq
con la scrittura “acq” (oppure “aq”) posta in basso a destra, si indica che
gli ioni sono attorniati da molecole di acqua, cioè sono in soluzione
acquosa.
Un idrossido poliprotico presenta tante dissociazioni quanti sono i gruppi
ossidrile contenuti nella sua molecola.
L'idrossido di calcio può dare teoricamente due dissociazioni
Ca(OH) 2 + H2O → CaOH+acq + OH -acq
CaOH+acq + H2O → Ca2+acq + OH -acq
Gli idrossidi (basi) “forti” sono dei composti che in acqua si dissociano
completamente: l’idrossido di calcio è una base forte, è totalmente
dissociato, quindi la reazione di dissociazione si scriverà in forma
sintetica:
Ca(OH)2 + H2O → Ca2+acq + 2OH -acq
L’idrossido di rame, invece, è una base meno forte: quando si scrive la
reazione di dissociazione è meglio scrivere entrambe le singole
dissociazioni:
Cu(OH)2 + H2O → CuOH+acq + OH -acq
CuOH+acq + H2O → Cu2+acq + OH -acq
Un idrossido si dice forte quando in
soluzione acquosa è completamente o quasi
completamente dissociato in cationi e ioni;
un idrossido si dice debole quando la
dissociazione è solo parziale.
La forza di un idrossido si può prevedere in linea di massima,
osservando se il metallo appartiene o meno ad uno dei primi gruppi
chimici.
In generale un idrossido è forte quando il metallo che lo forma è un
metallo alcalino o alcalino-terroso: così mentre l'idrossido di rame è
debole, l'idrossido di sodio o quello di calcio è forte
92
6.7.2 - Ionizzazione di un acido
Un acido le cui molecole sono formate da un solo atomo di idrogeno è
detto monoprotico, se gli atomi di idrogeno sono due è detto biprotico
etc.
Un acido monoprotico come l'acido nitrico si ionizza in acqua nel modo
seguente:
HNO3 + H2O → H+acq + NO3-acq
Un acido poliprotico presenta invece tante ionizzazioni quanti sono gli
atomi di idrogeno contenuti nella sua molecola. L'acido carbonico, ad
esempio, può dare due ionizzazioni:
H2CO3 + H2O→ H+acq + HCO3-acq
HCO3- + H2O→ H+acq + CO32-acq
Naturalmente è possibile scrivere l'intera ionizzazione in forma sintetica:
H2CO3 + H2O → 2H+acq + CO32-acq
Un acido si dice forte quando in soluzione
acquosa è molto o completamente
dissociato in anioni e ioni H+,
un acido si dice debole quando la
ionizzazione non è completa.
La forza di un acido si può prevedere osservando il numero di atomi di
idrogeno e di ossigeno presenti nella sua molecola. In generale, può
ritenersi forte quando la differenza tra il numero di atomi di ossigeno ed
il numero di atomi di idrogeno è uguale o maggiore di due, debole in
caso contrario. Così mentre l'acido carbonico H2CO3 (3 - 2 = 1) è debole,
l'acido nitrico HNO3 (3 - 1 = 2) è forte.
6.8 - I SALI
I sali sono composti chimici che derivano dagli acidi per sostituzione
di uno o più ioni H+ con cationi metallici.
I sali sono composti che possono presentare solubilità diverse in acqua:
alcuni sono molto solubili, altri poco solubili ma la frazione di un sale
che si scioglie in acqua è comunque totalmente dissociata negli ioni che
lo costituiscono.
Per costruire la formula chimica di un sale è necessario:
1. procedere alla ionizzazione dell'acido,
2. sostituire agli ioni H+ il catione metallico,
3. scrivere gli opportuni indici, in modo da rendere neutra la molecola
(si utilizzerà il nox del metallo come indice dell'anione e viceversa),
4. procedere alla eventuale semplificazione degli indici.
93
Esempio
Esemplifichiamo la procedura costruendo il sale di sodio dell'acido
cloridrico
1. ionizziamo l'acido cloridrico
HCl → H+ + Cl2. lo ione sodio Na+ va a prendere il posto degli atomi di idrogeno
Na Cl
3. il nox del sodio (+1) diventa l'indice dell'anione, mentre il nox
dell'anione (-1) diventa l'indice del catione.
Il sale di sodio dell’acido cloridrico sarà quindi NaCl
Esempio
Proviamo ora a costruire il sale di calcio dell'acido solforico
1. ionizziamo l'acido solforico
H2SO4 → 2H+ + SO42-
Il solfato di calcio CaSO4
è chiamato anche gesso.
Fonte: Wikipedia
2. lo ione calcio Ca2+ va a prendere il posto degli atomi di idrogeno
CaSO4
3. il nox del calcio (+2) diventa l'indice dell'anione, mentre il nox
dell'anione (-2) diventa l'indice del catione.
Ca2(SO4)2
4. si procede quindi alla semplificazione
CaSO4
Il sale di calcio dell’acido solforico sarà quindi CaSO4
I sali si possono formare sia utilizzando un anione proveniente da un
acido completamente dissociato, ed in tal caso sono detti sali neutri, sia
da un acido parzialmente dissociato. In tal caso l'anione possiede ancora
atomi di idrogeno nella sua molecola e il sale che si forma è detto sale
acido.
Esempio
Ad esempio l'acido ortofosforico può formare tre tipi di sali utilizzando
gli anioni provenienti dalle tre ionizzazioni successive
H3PO4 → H+ + H2PO4- anione biacido
H2PO4- → H+ + HPO42- HPO42- → H+ + PO43-
anione monoacido
anione neutro
Se vogliamo costruire i tre sali di alluminio utilizzando i tre anioni,
sapendo che Al ha nox + 3
La fluorite è un minerale
formato da fluoruro di
calcio CaF.
Fonte: Wikipedia
94
Al(H2PO4)3 Al2(HPO4)3 Al3(PO4)3 sale biacido
sale monoacido
sale neutro
Nella Nomenclatura Tradizionale i nomi dei sali derivano dagli anioni
derivanti dalle possibili ionizzazioni degli acidi corrispondenti, ai quali si
devono cambiare le desinenze, secondo lo schema seguente:
- IDRICO
▶
- URO
- OSO
- ICO
▶
▶
- ITO
- ATO
ed aggiungendo il nome del metallo con l’uso del suffisso –oso oppure –
ico se il metallo stesso ha diversi nox: in particolare nox minore (suffisso
–oso) nox maggiore (suffisso –ico)
NaCl
L’anione Cl- deriva dall’acido Cloridrico, quindi è chiamato Cloruro: il
sale si chiamerà Cloruro di sodio
Esempi
FeCl2
L’anione Cl- deriva dall’acido Cloridrico, quindi è chiamato Cloruro: il
sale si chiamerà Cloruro Ferroso in quanto il Ferro ha nox +2
FeCl3
L’anione Cl- deriva dall’acido Cloridrico, quindi è chiamato Cloruro: il
sale si chiamerà Cloruro Ferrico in quanto il Ferro ha nox +3
CaSO3
L’anione SO3-- deriva dall’acido Solforoso, quindi è chiamato Solfito:
il sale si chiamerà Solfito di Calcio
FeSO3
L’anione SO3-- deriva dall’acido Solforoso, quindi è chiamato Solfito: il
sale si chiamerà Solfito Ferroso in quanto il Ferro ha nox +2
Fe2(SO3)3
L’anione SO3-- deriva dall’acido Solforoso, quindi è chiamato Solfito: il
sale si chiamerà Solfito Ferrico in quanto il Ferro ha nox +3
K2CO3
L’anione CO3-- deriva dall’acido Carbonico, quindi è chiamato
Carbonato: il sale si chiamerà Carbonato di Potassio
SnCO3
L’anione CO3-- deriva dall’acido Carbonico, quindi è chiamato
Carbonato: il sale si chiamerà Carbonato Stannoso; in quanto lo Stagno
ha nox +2
95
Esempio
Sn(CO3)2
L’anione CO3-- deriva dall’acido Carbonico, quindi è chiamato
Carbonato: il sale si chiamerà Carbonato Stannico; in quanto lo Stagno
ha nox +4
Secondo la Nomenclatura Ufficiale IUPAC i nomi dei sali si formano
dagli anioni derivanti dalle possibili dissociazioni degli acidi
corrispondenti cambiando le desinenze secondo lo schema seguente:
✴ si indica il numero di ossidazione del non- metallo
✴ si antepone, nel caso di Sali contenenti ossigeno, la parola
“osso”preceduta dal prefisso (1 mono; 2 di; 3 tri; 4 tetra; 5 penta;6
esa; 7 epta) che indica il numero di ossigeni presenti
✴ si aggiunge il nome del metallo preceduto dal prefisso numerico che
indica il numero di metalli presenti con l’indicazione del nox dello
stesso metallo.
Esempi
NaCl
l’anione Cl- deriva dall’acido Cloridrico, quindi è chiamato Cloruro: il
sale si chiamerà monoCloruro di sodio
FeCl2
l’anione Cl- deriva dall’acido Cloridrico, quindi è chiamato Cloruro: il
sale si chiamerà diCloruro di Ferro (II)
FeCl3
l’anione Cl- deriva dall’acido Cloridrico, quindi è chiamato Cloruro: il
sale si chiamerà triCloruro di Ferro (3)
CaSO4
l’anione SO4-- deriva dall’acido Solforico, quindi è chiamato Solfato: il
sale si chiamerà triossoSolfato (4) di Calcio
FeSO3
l’anione SO3-- deriva dall’acido Solforoso, quindi è chiamato Solfato: il
sale si chiamerà triossoSolfato (IV) di Ferro (II)
Fe2(SO4)3
l’anione SO4-- deriva dall’acido Solforico, quindi è chiamato Solfato: il
sale si chiamerà triossoSolfato (IV) di diFerro (II)
K2CO3
l’anione CO3-- deriva dall’acido Carbonico, quindi è chiamato
Carbonato: il sale si chiamerà triossoCarbonato(4)di diPotassio
96
SnCO3
l’anione CO3-- deriva dall’acido Carbonico, quindi è chiamato
Carbonato: il sale si chiamerà triossoCarbonato (4) di Stagno (2)
Sn(CO3)2
l’anione CO3-- deriva dall’acido Carbonico, quindi è chiamato
Carbonato: il sale si chiamerà triossoCarbonato (4) di Stagno (4)
Per gli anioni non neutri (sali acidi in quanto non tutti gli atomi di
Idrogeno sono stati allontanati dall’acido), derivanti da acidi poliprotici
la loro nomenclatura sarà:
Nomenclatura Tradizionale (che indicheremo con N.T.)
Nomenclatura Ufficiale (IUPAC)(che indicheremo con N.U.)
KHCO3 l’anione deriva dall’acido Carbonico: HCO3-
Esempi
IdrogenoCarbonato di Potassio (N.T.)
triossoIdrogenoCarbonato (4) di Sodio(N.U.)
Fe(HSO3)2 l’anione deriva dall’acido Solforoso: HSO3IdrogenoSolfito Ferroso (N.T.)
monoIdrogenotriossoSolfato (4) di Ferro (2) (N.U.)
Fe(H2PO4)3 anione derivante (dall’acido ortoFosforico)H2PO4
IdrogenoortoFosfatoFerrico (N.T.)
diIdrogenotetraossoFosfato(5)di Ferro(3) (N.U.)
Alcuni sali acidi utilizzano ancora la vecchia denominazione.
Ad esempio il carbonato monoacido di sodio NaHCO3 è detto anche
bicarbonato di sodio
Il solfato ferroso
FeSO4 (sopra) è un
solido blu-verde
inodore. E’ nocivo.
Il solfato ferrico (sotto)
Fe2(SO4)3 è un solido
bruno-giallo, inodore.
Fonte: Wikipedia
97
SINTESI
98
ESERCIZI DI FINE MODULO
1. Associare i prefissi con i numeri
epta
tetra
mono
deca
esa
tri
di
penta
2. Scrivere i nomi dei seguenti ossidi con la Nomenclatura Tradizionale e IUPAC
Formula
Nome Tradizionale
Nome IUPAC
Na2O
CaO
FeO
Fe2O3
Al2O3
K2O
CuO
Cu2O
3. Dare il nome Tradizionale e IUPAC alle seguenti Anidridi
Formula
Nome Tradizionale
Nome IUPAC
SO2
SO3
Cl2O
Cl2O3
Cl2O5
Cl2O7
CO
CO2
N2O3
N2O5
As2O5
99
4. Associa i seguenti idrossidi con i relativi nomi.
Formula
Nome Tradizionale
Nome IUPAC
Pb(OH)2
Idrossido Rameoso
diidrossido di Rame
Fe(OH)2
Idrossido Ferrico
monoidrossido di Rame
Fe(OH)3
Idrossido Piomboso
diidrossido di Rame
CuOH
Idrossido Rameico
diidrossido di Piombo
Cu(OH)2
Idrossido Ferroso
diidrossido di Ferro
5. Dare il nome Tradizionale e IUPAC ai seguenti idracidi
Formula
Nome Tradizionale
Nome IUPAC
HCl
HF
HBr
HI
H2S
6. Associa i seguenti Acidi Ossigenati con il relativo nome attraverso o nome attraverso la
nomenclatura universale (IUPAC)
Formula
Nome Tradizionale
Nome IUPAC
H2SiO3
acido Fosforico
acido tetraossoFosforico(V)
H2CO3
acido Solforico
acido triossoSilicico (IV)
H2SO4
acido Carbonico
acido triossoCarbonico (IV)
H3PO3
acido Nitrico
acido triossoNitrico (V)
H2SO3
acido Solforoso
acido triossoSolforico (IV)
H3PO4
acido Fosforoso
acido triossoFosforico (III)
HNO3
acido Nitroso
acido diossoNitrico (III)
HNO2
acido Silicico
acido triossoSilicico (IV)
7. L'ossido di potassio, reagendo con l'acqua, forma:
a. un sale
b. una soluzione basica
c. una soluzione acida
d. potassio libero
e. non avviene nessuna reazione
100
8. Negli ossiacidi inorganici:
a. gli atomi di idrogeno acidi sono legati sempre all'atomo centrale
b. gli atomi di idrogeno acidi presentano legami ionici con gli atomi di ossigeno
c. gli atomi di idrogeno acidi sono legati in modo covalente agli atomi di ossigeno
d. il legame tra idrogeno e ossigeno è un legame a ponte di idrogeno
e. l'atomo centrale ha carattere spiccatamente metallico
9. Il nitrito ferrico si ottiene dalla reazione tra:
a. acido nitrico + idrossido ferroso
b. acido nitrico + idrossido ferrico
c. acido nitroso + idrossido ferroso
d. acido nitroso + ossido ferroso
e. acido nitroso + idrossido ferrico
10. ESERCIZIO GUIDATO
In ciascun enunciato c’è qualcosa di sbagliato. Indicare il nome o la formula corretti
nome corretto
formula corretta
BaCl è detto cloruro di bario
Il solfuro di sodio ha la
formula (Na)2SO3
Il solfato di ferro (II) ha la
formula Fe2(SO4)3
Il carbonato di cesio ha la
formula Cs2(CO3)
a)
b)
c)
d)
Risoluzione:
La carica dello ione Ba2+ quindi dovrà essere neutralizzata da 2 ioni ClVi sono due errori. Lo ione sodio è monoatomico e quindi non richiede parentesi. Lo ione solfuro è
S2-, non SO32- (detto “solfito”). La formula corretta è Na2S.
I numeri in parentesi si riferisce alla carica dello ione, non al numero di ioni nella formula.. Fe2+ è il
catione; è quindi necessario 1 ione SO42- per neutralizzare la sua carica. La formula corretta è FeSO4.
Le parentesi non sono necessarie quando è presente soltanto una specie di ione poliatomico. La
formula corretta è Cs2CO3.
11. Scrivere le formule per i nomi, o i nomi per le formule, dei seguenti acidi:
Formula
Nome Tradizionale
Nome IUPAC
acido clorico
HF
acido nitroso
acido solforoso
HBrO
101
12. Spiegare perché la seconda parte di ciascun enunciato è sbagliata e correggerla:
CORREZIONE
Il fosfato di Litio è (Li)4PO4
L’idrossido di alluminio è AlOH3
Mg(HCO3) è il carbonato di manganese(II)
Cr(NO3)3 è il nitruro cromico(III)
Ca(NO2)2 è il nitrato di cadmio
13. ESERCIZIO GUIDATO
Determinare i nomi dei seguenti anioni e i nomi e le formule degli acidi da cui derivano:
IONE
NOME DELL’ANIONE
FORMULA DELL’ACIDO
BrIO3CNSO42NO2Risoluzione:
a) L’anione è lo ione bromuro; l’acido è l’acido bromidrico HBr.
b) L’anione è lo ione iodato; l’acido è l’acido iodico HIO3.
c) L’anione è lo ione cianuro; l’acido è l’acido cianidrico HCN.
d) L’anione è lo ione solfato; l’acido è l’acido solforico H2SO4.
e) L’anione è lo ione nitrito; l’acido è l’acido nitroso HNO2
14. ESERCIZIO GUIDATO
Rispondere alle seguenti domande:
a) Qual è la formula del disolfuro di carbonio?
b) Qual è il nome di PCl5?
c) Si scrivano il nome e la formula del composto le cui molecole sono costituite da 2 atomi di N e da 4
atomi di O.
Risoluzione:
a) Il prefisso di- significa “due”. La formula è CS2.
b) P è il simbolo del fosforo; ci sono 5 atomi di cloro, che sono indicati dal prefisso penta-. Il nome è
pentacloruro di fosforo.
c) L’azoto (N) è scritto per primo nella formula (numero del gruppo più basso). La formula del composto
è N2O4; il nome è tetraossido di diazoto (ipoazotide).
102
15. Scrivere il nome o la formula:
Formula
Nome Tradizionale
Nome IUPAC
SO3
monossido di diazoto
SiO2
anidride nitrica
16. ESERCIZIO GUIDATO
Spiegare cosa c’è di sbagliato nel nome o nella formula nella seconda parte di ciascun enunciato e la
si corregga:
a) SF4 è il pentafluoruro di monozolfo.
b) La formula dell’eptaossido di dicloro è Cl2O6.
c) N2O3 è il diazotriossido.
Risoluzione:
a) Vi sono due errori. Il prefisso per “quattro” è tetra-, non penta-; il prefisso mono- non è necessario se
c’è soltanto un atomo del primo elemento. Il nome corretto è tetrafluoruro di zolfo.
b) Il prefisso epta- indica “sette”, non “sei”. La formula corretta è Cl2O7.
c) È necessario il nome completo del primo elemento nella formula, che deve comparire per secondo nel
nome del composto. Il nome corretto è triossido di diazoto.
17. Spiegare cosa c’è di sbagliato nella seconda parte dell’enunciato e correggerla:
CORREZIONE
S2Cl2 è il dicloruro disolforoso
La formula del monossido di azoto è N2O
BrCl3 è il bromuro di tricloro
18. Dare i nomi ai seguenti composti:
Formula
Nome Tradizionale
Nome IUPAC
CaS
NaF
AlBr3
Mg2C
103
19. Dare i nomi ai seguenti composti sia con il vecchio metodo sia con il sistema IUPAC:
Formula
Nome Tradizionale
Nome IUPAC
CrCl3
Mn2O3
Hg2Cl2
CuO
SnO2
PbS
P2O5
20. Dare il nome ai seguenti composti sia con il vecchio metodo sia con il sistema IUPAC:
Formula
Nome Tradizionale
Nome IUPAC
NaNO2
K3PO4
FeCO3
KMnO4
BaSO4
Fe2(CO3)3
21. Dare il nome ai seguenti composti sia con il vecchio metodo sia con il sistema IUPAC:
Formula
Nome Tradizionale
SiO2
ClF3
XeF4
N2O5
22. Individuare la formula dell'acido ipocloroso:
a) HClO
b) HClO2
c) HClO3
d) HClO4
23. La formula NO3 rappresenta il composto: a) anidride nitrosa
b) anidride nitrica
c) ossido di azoto
d) ossido di stagno
104
Nome IUPAC
24. Scrivere le formule o i nomi negli spazi bianchi:
Formula
Nome Tradizionale
Nome IUPAC
fosfato monosodico
seleniuro di litio
ioduro di sodio
solfato cromico
cianuro di nichel (II)
ossido di manganese(III)
solfuro stannico
pentafluoruro di antimonio
25. Qual è la formula dell'idrossido mercuroso? 27. Individuare la formula errata fra le seguenti
proposte
a) Hg(OH) 2
a) Na3PO3
b) Hg(OH)
b) Li2SO3
c) HgOH
c) Hg2O
d) Hg(OH)4
d) HCO3
26. Individuare l’acido piro
28. Individuare il sale che non esiste
a) H3CO3
a) Carbonato acido di Sodio
b) HBO2
b) Nitrito basico di Calcio
c) H4P2O7
c) Solfuro acido di Calcio
d) H3AsO4
d) Cloruro basico d’Argento
29. ESERCIZIO GUIDATO
Determinare i nomi per le formule, o le formule per i nomi, dei seguenti composti:
a) Fe(ClO4)2
b) Solfito di sodio
c) Ba(OH)2 · 8H2O
Risoluzione:
a) ClO4- è lo ione perclorato; poiché ha carica -1, il catione deve essere Fe2+. Il nome è perclorato di
ferro (2) oppure con nomenclatura ufficiale tetraossoClorato(7) di Ferro(2). (Il nome comune è
perclorato ferroso).
b) Lo ione sodio è Na+; lo ione solfito è SO32-. Perciò, 2 ioni Na+ neutralizzano 1 ione SO32-. La formula
è Na2SO3.
c) Ba2+ è lo ione bario; OH- è lo ione idrossido. In ciascuna unità formula vi sono 8 (octa- oppure otta-)
molecole d’acqua. Il nome è idrossido di Bario octa oppure ottaidrato.
105
30. Scrivere le formule o i nomi negli spazi bianchi:
Formula
Nome Tradizionale
Nome IUPAC
nitrato di alluminio
solfuro stannoso
carbonato di potassio
solfato cromico
solfuro di molibdeno (IV)
tricloruro di boro
fosfuro di calcio
cloruro di stagno (IV)
tetraossosolfato (VI) di rame (II)
triossocarbonato (IV) di ferro (II)
triossocarbonato (IV) di ferro (II)
triossosolfato (IV) di disodio
diossoclorato (III) di potassio
tetraossosolfato (IV) di di rame (I)
Sn(BrO4)4
KClO
CaCO3
Cu2SO4
Na2SO4
Sn(BrO)2
anidride nitrica
carbonato di calcio
ossido mercurico
perclorato di potassio
diidrossido di magnesio (II)
solfuro di stronzio (II)
cloruro rameico
106
MODULO 7 - TRASFORMAZIONI CHIMICHE:
REAZIONI CHIMICHE E BILANCIAMENTO
7.1 - LE REAZIONI CHIMICHE
Nel capitolo riguardante la nomenclatura sono state viste alcune reazioni
attraverso le quali è stata spiegata la formazioni dei composti della
chimica inorganica.
Lo scopo di questa trattazione è quello di classificare le reazioni e di
capire esattamente il loro significato dal punto di vista qualitativo e
quantitativo.
È necessario innanzitutto fare delle precisazioni.
7.1.1 - Reagenti e prodotti
Tutto quello che noi scriviamo utilizzando simboli alfabetici, numerici e
grafici è solo una rappresentazione, definita equazione chimica, di quella
che potrebbe essere una reazione chimica e quindi di una trasformazione
reale che avviene in natura.
Supponiamo di avere la seguente generica equazione chimica:
(1)
In questa equazione, le lettere A, B, C, D sono le formule chimiche
delle sostanze che partecipano alla reazione. Le formule poste a
sinistra della freccia - A e B - rappresentano i reagenti, mentre quelle a
destra della freccia - C e D - rappresentano i prodotti della reazione.
A, B, C e D ci danno informazioni sul tipo, ossia sulla qualità delle
sostanze che partecipano alla reazione.
Nella stessa equazione, i caratteri a, b, c, d si definiscono coefficienti
stechiometrici. Si tratta di numeri, che ci danno informazioni sulla
quantità delle sostanze coinvolte nella reazione. I caratteri a e b sono i
coefficienti dei reagenti, mentre c e d sono i coefficienti dei prodotti.
Questi numeri vengono ottenuti dal bilanciamento dell’equazione
chimica, il percorso teso a far rispettare la “Legge di Lavoisier” sulla
conservazione della massa.
Prendiamo adesso in esame l’equazione chimica che descrive la
reazione che porta alla formazione dell’anidride carbonica:
(2)
!
e proviamo a leggerla correttamente.
Nell’equazione chimica (2) troviamo che un atomo di carbonio (C)
reagisce (segno +) con una molecola di ossigeno (O2) per ottenere
(freccia verso destra) una molecola di anidride carbonica (CO2).
107
Esercizio svolto n° 1
Leggere correttamente la seguente equazione chimica, già bilanciata:
!
Soluzione
Due molecole di azoto reagiscono con cinque molecole di ossigeno per
ottenere due molecole di pentossido di diazoto (anidride nitrica).
Esercizio svolto n° 2
Leggere correttamente la seguente equazione chimica già bilanciata:
Soluzione
Una “molecola” di idrossido di calcio reagisce con due molecole di acido
cloridrico per dare una “molecola” di cloruro di calcio e due molecole di
acqua.
Nota bene. In questo esempio il termine molecola è posto tra virgolette
per l’idrossido di calcio e il cloruro di calcio. Si tratta in entrambi i casi
di sostanze ioniche. In questi casi a rigore non ha senso parlare di
molecole: si utilizza questo termine solo per semplicità.
Le lettere poste a pedice della formula indicano gli stati di
aggregazione dei reagenti e dei prodotti. Quindi le lettere (g), (l), (s) e
(aq) sono usate per indicare rispettivamente sostanze in fase gassosa,
liquida, solida e in soluzione acquosa.
7.2 - CLASSIFICAZIONE DELLE REAZIONI CHIMICHE
Una prima classificazione è basata sul fatto che nella trasformazione dei
reagenti in prodotti il numero di ossidazione degli atomi coinvolti possa
variare o meno. Vi sono quindi due categorie generali di reazioni
chimiche:
✓ reazioni senza trasferimento di elettroni - in questi casi il numero
di ossidazione degli elementi nel passaggio da reagenti a prodotti non
varia; le equazioni chimiche di questo tipo di reazioni vengono
generalmente bilanciate conteggiando solo gli atomi e cioè rendendo
uguale il numero di atomi di ciascun elemento tra reagenti e prodotti.
✓ reazioni con trasferimento di elettroni, dette anche reazioni di
ossidoriduzione o redox - in questi casi il numero di ossidazione
degli elementi nel passaggio da reagenti a prodotti varia; il processo
di bilanciamento per questo tipo di reazioni è più complesso e sarà
oggetto di una trattazione successiva.
Le reazioni chimiche, possono essere classificate in:
1. reazioni di sintesi,
1. reazioni di decomposizione,
2. reazioni di scambio semplice,
3. reazioni di doppio scambio.
108
Nelle reazioni sotto riportate a titolo di esempio sono visibili delle frecce
rivolte verso l’alto, che stanno ad indicare la formazione di composti
gassosi, o frecce rivolte verso il basso, che indicano la formazione di
sostanze solide che si depositano in fondo al recipiente di reazione, in
termini tecnici, la formazione di un precipitato solido.
7.2.1 - Reazioni di sintesi
Sono dei processi mediante i quali due o più sostanze, elementari o
composte, reagiscono tra loro per dare un solo composto finale, chiamato
il prodotto di reazione. Lo schema generale è rappresentato qui sotto:
!
Esempi di reazione di sintesi
Reazione di sintesi dell’acqua:
2H 2(g) + O 2(g) →2H 2O(l)
Esempi
due molecole di idrogeno (stato aeriforme) e una molecola di ossigeno
(stato aeriforme) reagiscono tra loro e formano due molecole di acqua
(stato liquido).
Reazione di sintesi dell’anidride solforosa:
!
un’atomo di zolfo (stato solido) e una molecola di ossigeno (stato
aeriforme) reagiscono tra loro e formano una molecola di anidride (stato
aeriforme).
Reazione di sintesi dell’ossido di sodio:
quattro atomi di sodio (stato solido) e una molecola di ossigeno (stato
aeriforme) reagiscono tra loro e formano due “molecole” di ossido di
sodio (stato solido).
Reazione di sintesi del cloruro
d’ammonio:
una molecola di ammoniaca (stato aeriforme) e una molecola di acido
cloridrico (stato aeriforme) reagiscono tra loro e formano una “molecola”
di cloruro di ammonio (stato solido).
7.2.2 - Reazioni di decomposizione
Sono dei processi mediante i quali partendo da una sola sostanza
composta si ottengono sostanze più semplici, elementari o composte.
Sono l’inverso delle reazioni di sintesi. Lo schema generale è il seguente:
!
Il cloruro d’ammonio
(sopra) è un solido
cristallino bianco dal sapore
piccante. Esso viene
prodotto per reazione tra
ammoniaca e acido
cloridrico, due sostanze
aeriformi o liquide molto
volatili e incolori.
Fonte: Wikipedia
109
Esempio
Esempi di reazione di decomposizione
Reazione di decomposizione
dell’ossido mercurico:
una “molecola” di ossido mercurico (stato solido) si decompone in due
atomi di mercurio metallico (stato liquido) e una molecola di ossigeno
(stato aeriforme).
Reazione di decomposizione
del perossido di idrogeno:
una molecola di perossido di idrogeno (stato liquido) si decompone in 2
atomi di mercurio e una molecola di ossigeno.
Il Mercurio, è un metallo
pesante, liquido a
temperatura ambiente.
Fonte: Wikipedia
!
Reazione di decomposizione
del carbonato di calcio:
una “molecola” di carbonato di calcio (stato solido) si decompone in una
“molecola” di ossido di calcio (stato solido) e una molecola di anidride
carbonica (stato aeriforme).
7.2.3 - Reazioni di scambio semplice o di spostamento
Sono processi mediante i quali gli atomi un elemento contenuto in una
sostanza vengono sostituiti da atomi di un altro elemento, secondo il
seguente schema generale:
!
Esempi
Esempi di reazioni di scambio semplice
Reazione di scambio semplice tra zinco e cadmio:
Reazione di scambio semplice tra zinco e ferro:
Reazione di scambio semplice tra ferro e idrogeno:
Il cloruro di zinco è un
solido bianco inodore.
Fonte: Wikipedia
!
Reazione di scambio semplice tra sodio e idrogeno:
!
110
7.2.4 - Reazioni di doppio scambio
Sono dei processi mediante i quali partendo da due composti si realizza
un doppio scambio tra gli ioni che costituiscono i composti stessi. Lo
schema generale è il seguente:
!
Esempi
Esempi di reazioni di doppio scambio:
Reazione di doppio scambio tra ferro e idrogeno:
!
Reazione di doppio scambio tra potassio e piombo:
Reazione di doppio scambio tra ferro e sodio:
7.3 - BILANCIAMENTO DELLE REAZIONI CHIMICHE
In natura nel corso di una qualsiasi reazione chimica la massa
complessiva si conserva e il numero e tipo di atomi non varia. Ciò
che cambia è solo il tipo di sostanze.
Se vogliamo che un’equazione chimica rappresenti in maniera corretta
una reazione chimica, occorre procedere al già menzionato
bilanciamento.
Il bilanciamento consiste nel porre davanti alle formule di reagenti e
prodotti nell’equazione chimica dei numeri, detti coefficienti
stechiometrici, in grado di “far tornare i conti”, ossia di far sì che sia
rispettata l’uguaglianza tra atomi di ciascun elemento tra reagenti e
prodotti.
In questa fase ci occuperemo, solo del bilanciamento di equazioni di
reazioni non redox, ossia in cui non si ha variazione del numero di
ossidazione degli elementi.
Va sottolineato che nel bilanciamento delle reazioni in cui non varia il
nox degli elementi, poiché non esistono delle regole precise, riveste un
ruolo molto importante l’esperienza, che può essere acquisita solo
attraverso un’adeguata esercitazione.
Vengono qui riportati degli esempi commentati di bilanciamento di
reazioni.
Esempio
L’idrossido di calcio,
calce idrata o ”spenta”, si
utilizza in edilizia per
produrre malte, intonaci
Fonte: Wikipedia
111
Esercizio svolto n° 3
Bilanciare la seguente equazione chimica:
!
SUGGERIMENTO
Guardando l’equazione, vediamo che a destra, tra i prodotti, ci sono due
atomi di cloro nella formula del cloruro di calcio che vanno bilanciati
aggiungendo il coefficiente 2 prima della formula dell’acido cloridrico
che si trova a sinistra, tra i reagenti.
L’equazione diventa:
Esempio
Il calcio risulta bilanciato ma non sono bilanciati né gli atomi di ossigeno
né quelli di idrogeno. In particolare, troviamo quattro atomi di idrogeno
tra i reagenti e due tra i prodotti per cui, anteponendo il coefficiente 2 alla
formula dell’acqua, questi risultano bilanciati.
L’equazione diventa
!
Possiamo ora facilmente verificare che, con quest’ultima operazione,
risultano bilanciati anche gli atomi di ossigeno.
Due indicazioni:
1. nel bilanciamento, conviene sempre partire da un metallo o da un non
metallo e lasciare il bilanciamento di idrogeno e ossigeno, se presenti,
alla fine;
2. è importante sottolineare che i coefficienti vanno inseriti prima delle
formule e non dentro le formule: l’introduzione di numeri all’interno
della formula chimica ne provocherebbe l’alterazione e quindi
farebbe cambiare l’informazione quantitativa che la formula stessa ci
fornisce.
Esercizio svolto n° 4
Bilanciare la seguente equazione chimica:
!
Si parte dal bilanciamento degli atomi di berillio, anteponendo il
coefficiente 3 alla formula del suo idrossido
Successivamente si bilancia il fosforo, anteponendo il coefficiente 2 alla
formula dell’acido ortofosforico
!
112
Gli atomi di ossigeno tra i reagenti sono adesso 14, mentre tra i prodotti,
escluso l’atomo di ossigeno contenuto nell’acqua essi sono solo 8. Gli
atomi di ossigeno si bilanciano anteponendo il coefficiente 6 alla formula
dell’acqua
Esempio
Andando ora a verificare il numero di atomi di idrogeno nei reagenti si
vede che questo è uguale al numero di atomi di idrogeno nei prodotti.
L’equazione è dunque bilanciata.
Esercizio svolto n° 5
Bilanciare la seguente equazione chimica:
Quello che qui osserviamo è che a sinistra (tra i reagenti) abbiamo un
atomo di calcio così come a destra (tra i prodotti), mentre è l’ossigeno ad
essere sbilanciato in quanto a sinistra troviamo due atomi mentre a destra
ce n’è solo uno.
Proviamo a bilanciare l’ossigeno mettendo il coefficiente 2 prima della
formula dell’ossido di calcio
Abbiamo bilanciato l’ossigeno, ma sbilanciato il calcio e, quindi, per
rimediare, mettiamo il coefficiente 2 prima della formula del calcio
!
C’è da sottolineare che è stato possibile bilanciare agevolmente anche
questa equazione, pur trattandosi dell’equazione di una reazione redox.
7.4 - LA MOLE
Uno dei problemi che il chimico ha dovuto affrontare (ma che è stato
risolto da tempo efficacemente) è stato quello di conoscere le quantità
pesabili di sostanze che reagiscono e che si formano in una reazione.
Prendiamo in esame l’equazione della reazione che porta alla formazione
dell’acqua, opportunamente bilanciata:
Esempio
(3)
Per quanto detto precedentemente, vediamo che 2 molecole di idrogeno
reagiscono con una molecola di ossigeno per ottenere 2 molecole di
acqua.
Ma sappiamo anche che molecole e atomi sono entità troppo piccole
per poter essere pesate con bilance analitiche anche se molto sensibili.
113
Quindi la strada migliore è quella di pesare quantità di sostanza
conoscendo il numero esatto di atomi o molecole che questa contiene.
Esaminiamo ora la tabella seguente:
!
2
1
2
4
2
4
100
50
100
2N
N
2N
I numeri in tabella indicano dei rapporti stechiometrici tutti validi tra
reagenti e tra reagenti e prodotti. Ma cosa rappresenta il numero N che
troviamo nell’ultima riga?
N, intanto, potrebbe essere un numero qualsiasi e per qualsiasi valore di
questo i rapporti stechiometrici sarebbero sempre e comunque rispettati
perché preceduti dai coefficienti stechiometrici originari.
Tutto ciò e assolutamente in accordo con la Legge di Avogadro secondo
la quale
Volumi uguali di gas diversi nelle stesse condizioni di temperatura
e di pressione contengono lo stesso numero di particelle”.
Infatti, se supponiamo che N sia il numero di molecole contenute in un
certo volume di gas, allora possiamo facilmente constatare che i rapporti
stechiometrici valgono, oltre che in termini di numero di molecole, anche
come rapporti tra i volumi, misurati sempre nelle stesse condizioni di
pressione e temperatura, dei reagenti in fase gassosa.
Ma il numero N può rappresentare anche qualcos’altro !!!
Supponiamo, per esempio, di voler calcolare il numero di atomi di
carbonio contenuti in una massa di carbonio esattamente uguale alla sua
massa atomica relativa, 12 uma.
Poiché noi sappiamo che l’atomo di carbonio di numero di massa 12,
possiede infatti 6 protoni, 6 neutroni e 6 elettroni, ed essendo la massa
del protone circa uguale a quella del neutrone, pari a 1,6603 x 10-24
grammi (la massa degli elettroni è trascurabile rispetto alle altre due),
possiamo concludere che la massa assoluta di un atomo di carbonio 12
sarà circa uguale a:
114
Se vogliamo ora calcolare il numero di atomi di C contenuti in 12
grammi di sostanza basta semplicemente dividere la massa in esame (12
g) per la massa di ogni singolo atomo.
Il numero di atomi di carbonio risulta quindi:
!
Proviamo ora a ripetere lo stesso calcolo con l’idrogeno (H2), tenendo
presente che la massa relativa di una molecola di idrogeno è di circa 2
uma.
Per calcolare la massa assoluta della molecola di idrogeno prendiamo in
considerazione solo la massa dei due protoni che costituiscono la
molecola essendo sempre trascurabile la massa degli elettroni.
La massa assoluta di una molecola di idrogeno sarà quindi:
Da questa il numero di molecole di idrogeno contenute in 2 g risulta:
Quello che osserviamo è che
il numero di atomi contenuti in 12 g di carbonio è esattamente
uguale al numero di molecole contenute in 2 g di idrogeno.
Lo stesso risultato (6,023x1023) si ottiene ripetendo il calcolo per
qualsiasi sostanza partendo da una massa numericamente uguale alla sua
massa atomica o molecolare relativa.
Questo numero particolare si definisce Numero di Avogadro
Il Numero di Avogadro è stato determinato attraverso vari metodi
sperimentali e gli è stato assegnato il valore di
.
Generalizzando possiamo quindi affermare che
Se si considera una quantità espressa in grammi di una qualsiasi
sostanza pura numericamente uguale al valore della sua massa
relativa, il numero di atomi o molecole contenute è costante e
prende il nome di Numero di Avogadro (N0)
115
Il numero di Avogadro rappresenta il numero di entità contenute in quella
che nel Sistema Internazionale costituisce l’unità di misura della quantità
di materia: la mole.
7.4.1 - Definizione di mole
La mole è una grandezza fondamentale nel S.I.)
Una MOLE è una quantità di materia
✓ che ha una massa numericamente uguale alla
massa atomica o molecolare relativa, espressa
però in grammi
✓ che contiene al un Numero di Avogadro
6,022x1023 di particelle
Le particelle possono essere atomi o molecole, ma anche ioni o elettroni;
l’importante è che siano tutte della stessa natura.
Esempi
Vediamo ora alcuni esempi:
1. Una mole di ossigeno molecolare - O2 - contiene 6,022x1023
molecole. Una mole di ossigeno pesa 32 grammi, poiché una
molecola ha massa pari a 32 uma.
2. Una mole di calcio Ca contiene 6,022x1023 atomi. Una mole di
calcio pesa 40 grammi, poiché un atomo ha massa pari a 40 uma.
Esercizio svolto n°6
Calcolare il numero di moli presenti in 500 g di acqua.
Per prima cosa dobbiamo valutare la massa molecolare dell’acqua. Nella
Tavola Periodica troviamo che la massa atomica relativa dell’idrogeno
(arrotondata per difetto) è 1 uma e la massa atomica relativa
dell’ossigeno è 16 uma.
La massa molecolare dell’acqua risulta quindi: 1 uma x 2 + 16 uma =
18 uma essendo l’acqua composta da due atomi di idrogeno e un atomo
di ossigeno. Pertanto, in ragione di quanto descritto nella parte teorica, la
massa di una mole di acqua è pari a 18 g. Quindi, la massa molare
dell’acqua è 18 g/mol.
Proviamo ora a impostare una semplice proporzione:
Il risultato si ottiene svolgendo il seguente calcolo:
116
La determinazione del numero di moli può essere agevolato introducendo
una formula, derivante direttamente dalla proporzione dell’esempio
precedente:
!
(5)
Dove n è il numero di moli, m è la massa della quale dobbiamo calcolare
le moli ed MM è la massa molare della sostanza in esame.
Risulta chiaro, che se volessimo calcolare la massa corrispondente ad un
certo numero di moli di una sostanza, potremmo applicare la formula
inversa:
!
(6)
Discorso analogo può essere fatto anche per il calcolo della massa molare
conoscendo la massa della sostanza e il numero di moli corrispondenti:
(7)
!
Esercizio svolto n°7
Calcolare la massa e il numero di molecole di HCl corrispondenti a
2,5 moli.
Soluzione
1. calcolare la massa di una mole di HCl:
andando a guardare in tabella troviamo per l’idrogeno (H) il valore 1 uma
e per il cloro (Cl) il valore 35.45 uma.
Quindi la massa molare (MM) del HCl sarà la seguente:
MM = (1+35.45) g/mol e cioè 36.45 g/mol.
2. calcolare la massa di 2,5 moli di HCl:
applicando la formula (6) si ottiene:
m(g) = n (mol)xMM(g/m) = 2,5 mol x 35,45 g/mol = 91,12 g
Quindi la massa di 2,5 moli di HCl è di 91,13 g.
3. calcolare il numero di molecole:
per il calcolo del numero di molecole, sapendo che ogni mole ne contiene
6,022x1023 basta effettuare la seguente operazione:
Esempio
Esercizio svolto n°8
Calcolare la massa corrispondente a 1,2x10-2 moli di CO2.
Soluzione
1. la massa molare della CO2 è:
MM=(12 + 16 x 2) g/mol= 44 g/mol
Esempio
117
2. applicando la formula (6) si ottiene:
!
La massa di 1,2x10-2 moli di CO2 è dunque pari a 0,53 g.
Esempio
Esercizio svolto n°9
Calcolare il numero di moli corrispondenti a 1400 g di glucosio
(C6H12O6).
Soluzione
1. La massa molare del glucosio è la seguente:
MM(g/mol)=(12 x 6 + 1 x 12 + 16 x 6)(g/mol)=180(g/mol)
2. Il numero di moli sarà quindi pari a:
!
7.5 - LA STECHIOMETRIA
Quale è l’utilità pratica derivante dall’utilizzo della mole?
Una prima applicazione è la derivazione della formula minima di una
sostanza e successivamente, conoscendone la massa molecolare, anche
della formula bruta, partendo dalla percentuale in massa dei diversi
elementi che costituiscono un composto.
La formula minima di un composto
indica quali sono gli elementi i cui
atomi formano il composto e il
rapporto numerico tra gli stessi..
La formula bruta di un composto
indica invece quali sono gli elementi i
cui atomi formano il composto, ma
anche il rapporto numerico tra gli atomi
di ciascun elemento che formano la
sostanza
Esempio
118
Esercizio svolto n°10
Trovare la formula minima e la formula bruta di un composto con
PF=180 uma che ha dato all’analisi elementare la seguente
composizione: C 40 %, H 6,7 %, O 53,3 %.
Soluzione
Prendendo, per esempio, 100 g di sostanza le percentuali rappresentano
la massa di ciascun elemento all’interno della stessa.
Si possono quindi calcolare le moli corrispondenti:
!
Per trovare la formula minima, ossia il rapporto in moli tra gli atomi
dei diversi elementi, si divide per il numero di moli con valore minore (in
questo caso 3,33):
!
La formula minima risultante della sostanza è quindi: CH2O.
Per trovare la formula bruta, si calcola la massa molare di una mole di
sostanza, supponendo che la formula bruta sia esattamente uguale alla
sua formula minima:
!
Ci si accorge, invece, che il valore della massa molare così calcolata è
diverso del valore vero e quindi si può calcolare il numero di volte che la
massa molare della formula minima è contenuta nella massa molare della
formula vera:
!
Per ottenere quindi la formula bruta bisognerà moltiplicare i coefficienti
della formula minima per 6. La formula bruta risultante è: C6H12O6
(corrisponde alla formula di un monosaccaride, per esempio il glucosio).
L’utilità dell’introduzione di questa grandezza è evidente poiché adesso
si può operare con quantità pesabili di materia e sapere esattamente
quante particelle, atomi, molecole, ioni, sono in questa contenute.
119
Esempio
Riproponiamo ora la reazione di formazione dell’acqua.
!
2
1
2
4
2
4
100
50
100
2N
N
2N
Se immaginiamo che N sia esattamente uguale al numero di Avogadro
(N0), poiché questo rappresenta il numero di molecole contenute in una
mole, allora la reazione può anche essere letta nel seguente modo: due
moli di idrogeno reagiscono con una mole di ossigeno per ottenere due
moli di acqua.
Le equazioni chimiche, opportunamente
bilanciate con i coefficienti stechiometrici,
possono essere lette in termini di moli.
NOTA BENE: è errato, invece, leggerle in
termini di grammi.
Sapendo che le moli possono essere agevolmente convertite in grammi, a
questo punto possiamo senz’altro affermare che
!
4 grammi di idrogeno (massa di 2 moli di idrogeno) reagiscono con
32 grammi di ossigeno (massa di una mole di ossigeno) per ottenere
36 grammi di acqua
Esempio
Esercizio svolto n°11
Calcolare la massa di cloro che reagisce con 25 g di idrogeno e la
massa di acido cloridrico che si forma.
Soluzione
La reazione chimica bilanciata è la seguente:
Il numero di moli di idrogeno è pari a:
!
120
Poiché il rapporto stechiometrico tra idrogeno e cloro è 1:1, allora il
numero di moli richieste di cloro sarà esattamente uguale al numero di
moli di idrogeno (12,5 moli).
La massa di cloro che reagisce con 25 g di idrogeno sarà quindi:
!
!
La massa di acido cloridrico che si forma si può calcolare sommando
la massa dell’idrogeno e quella del cloro (essendoci un unico prodotto e
nel rispetto della Legge di Lavoisier) oppure, tenendo conto del rapporto
stechiometrico che intercorre tra idrogeno e acido cloridrico, attraverso
una semplice proporzione:
nella quale i primi termini dei due membri si riferiscono all’idrogeno
mentre i secondi termini all’acido cloridrico.
Risolvendo la proporzione si ha:
La massa di acido cloridrico che si forma si ottiene usando la formula:
!
La massa delle 25 moli di acido cloridrico è:
Esercizio svolto n°12
Calcolare la massa di acido nitrico che reagisce con 5 g di nitrato
ferroso e la massa di acqua prodotta nella seguente reazione già
bilanciata:
Esempio
!
Soluzione
Si determinano per prima cosa le moli di nitrato ferroso
!
Si imposta e si risolve la proporzione per conoscere le moli di acido
nitrico che reagiscono con le 2,78 x 10-2 moli di nitrato ferroso:
il cui risultato è
!
121
Partendo dal numero di moli così ottenuto, si determina il numero di
grammi moltiplicando per la massa molare dell’acido nitrico:
Lo stesso procedimento viene seguito per calcolare la quantità di nitrato
ferrico, ossido di azoto e acqua che si formano.
Si imposta e si risolve la proporzione per calcolare, per esempio, le moli
di acqua partendo dalle moli di nitrato ferroso:
risolvendo la proporzione si ottiene il numero di moli:
e dal numero di moli si calcola la massa dell’acqua moltiplicando per la
sua massa molare:
ESERCIZIO
Con lo stesso procedimento e con i dati usati nell’esercizio svolto n° 12
calcolare le moli e le masse di nitrato ferrico e di ossido di azoto che si
formano dalla reazione e completare i campi vuoti della tabella seguente:
!
!
!
moli reagite
(mol)
massa
reagita (g)
!
moli
ottenute
(mol)
massa
prodotta
(g)
Negli esempi precedenti si è visto come vengono calcolate le “giuste”
quantità di sostanze che reagiscono tra loro nonché le quantità di prodotti
che si formano dalla reazione. Risulta chiaro allora che
i reagenti si consumano tutti e si
trasformano completamente nei prodotti
122
Ciò può essere verificato applicando la legge di Lavoisier.
Quando questo si verifica si dice che i reagenti sono stati messi in
quantità stechiometrica.
Utilizzando ora la reazione dell’esercizio svolto n° 11 vediamo cosa
succede quando i reagenti sono posti in quantità non stechiometrica.
Esercizio svolto n° 13
Partendo da 15 g di idrogeno e 25 g di cloro, calcolare le masse di
queste sostanze che reagiscono e le masse dei prodotti che si formano
secondo la seguente reazione già bilanciata:
Esempio
!
La prima operazione da fare è quella di trasformare le masse a nostra
disposizione (15 g di idrogeno e 25 g di cloro) in numero di moli.
Applicando la consueta formula si ha:
Ora, tenendo conto del rapporto stechiometrico 1:1 tra idrogeno e cloro,
si imposta e si risolve la proporzione per sapere quante moli di cloro sono
richieste nella reazione da 7,5 moli di idrogeno
7,5 × 1
x = _______________ = 7,5(mol)
1
Il risultato ottenuto è ovvio visto il rapporto stechiometrico 1:1.
Quindi 7,5 sono le moli di cloro, richieste per la reazione, da 7,5 moli di
idrogeno.
Le moli di cloro, invece, che noi abbiamo praticamente a disposizione
sono solo 0,35 che risultano quindi insufficienti per reagire con tutte le
moli di idrogeno.
La quantità del cloro limita il consumo totale dell’idrogeno e per
questo il cloro, in questo caso, si comporta come reagente limitante.
L’altro reagente, e cioè l’idrogeno, è il reagente in eccesso.
Il reagente limitante, consumandosi esso stesso completamente, limita
la quantità che si consuma del reagente in eccesso.
123
Una volta stabilito quale è il reagente limitante (nel nostro caso il cloro)
si calcola ora la quantità di idrogeno che reagisce con le 0,35 moli di
cloro sempre attraverso la proporzione:
Quindi per l’idrogeno sono 0,35 le moli che reagiscono e la parte
rimanente calcolata come (moli iniziali – moli reagite) rimane come
moli non reagite e cioè in eccesso.
Le moli di prodotto che si formano si calcolano tenendo conto del
rapporto stechiometrico tra il reagente limitante e il prodotto stesso e
questo costituisce una regola generale.
Il calcolo delle moli dei prodotti
viene effettuato partendo dalle
moli del reagente limitante.
La tabella seguente è esplicativa di tutto quanto detto fino ad ora:
H2
Cl2
moli iniziali (mol)
7,5
0,35
moli reagite (mol)
0,35
0,35
moli in eccesso (mol)
7,15
moli dei prodotti (mol)
124
0,70
massa iniziale (g)
15
24,85
massa reagita (g)
0,7
24,85
massa in eccesso (g)
14,30
massa dei prodotti (g)
HCl
25,55
ESERCIZI DI FINE MODULO
Esercizi sul bilanciamento delle equazioni chimiche
1. Bilanciare le seguenti equazioni chimiche:
(nei risultati sono stati omessi alcuni dei coefficienti stechiometrici)
Equazioni da bilanciare
Risultato
!
{R.: 1,..,1,2}
!
{R.: 1,..,1,2}
{R.: 1,1,1,..}
!
{R.: 1,2,..,1}
!
{R.:..,2,1}
{R.: 2,..,1,2}
{R.: 3,..,1,6}
!
{R.: 1,1,..,2}
{R.: 2,3,1,..}
{R.: 1,..,2,1,1}
!
{R.: 2,..,1,1}
{R.: 1,..,2,1,2}
2. Completare e bilanciare le seguenti reazioni:
!
!
!
125
Esercizi sul numero di Avogadro e sulla mole
1. Calcolare il numero di atomi di ferro contenuti in 1,3x10-2 moli di ferro.
2. Calcolare il numero di molecole di acido bromidrico contenute in 8,7x102 moli dello stesso acido.
3. Calcolare quante sono le moli corrispondenti a 1,25x1019 molecole di cloro.
4. Calcolare il numero di moli di idrossido di alluminio corrispondenti ad una massa di 158 g.
5. Avendo a disposizione una massa di cloruro di calcio di 0,76 g, calcolare il numero di molecole in
essa contenute e il numero di moli corrispondenti.
6. Determinare il numero di moli e la massa di 8,9x1022 molecole di acqua.
7. Quante sono le moli equivalenti a 120 g di una sostanza che ha peso molecolare 58,5 u.m.a.?
8. Determinare il numero di moli e il peso molecolare di un composto sapendo che 43,7 g del composto
stesso contengono 4,5x1023 molecole.
9. Stabilire se contengono più molecole 18 g di acqua o 18 g di acqua ossigenata.
10. Calcolare la massa in kg di 9x1024 molecole di un composto con peso molecolare 238 uma.
Esercizi sul calcolo della formula minima e della formula bruta
(le percentuali sono tutte intese come percentuali in massa)
1. Dall’analisi elementare è risultato che un composto è costituito per il 38,6% da potassio, per il 13,9%
da azoto e per la parte rimanente da ossigeno. Individuare la formula del composto.
2. Determinare la formula minima e la formula molecolare di un composto costituito dal 34,3% di sodio,
dal 17,9% di carbonio e dal 47,8% di ossigeno sapendo che il suo peso molecolare è di 134 uma.
3. Determinare la formula minima e la formula molecolare del composto costituito dal 30,4% di azoto e
dal 69,6% di ossigeno sapendo che il suo peso molecolare è di 92 uma.
4. Determinare la formula molecolare del composto costituito dal 13,1% di litio, dal 46,9% di arsenico e
dal 40,0% di ossigeno.
5. Le percentuali in massa degli elementi in un composto sono le seguenti: idrogeno 1,18%, cloro
42,01%, ossigeno 56,81%. Stabilire a quale tra gli ossiacidi del cloro corrisponde questa
composizione.
6. Calcolare la percentuale in massa degli elementi presenti nelle molecole di: acido solforico, nitrato di
calcio, fosfato ferroso, clorato di magnesio, bicarbonato di sodio.
.
126
Esercizi sui rapporti stechiometrici
1. Nella sintesi dell’ammoniaca sotto riportata:
partendo da 10 g di azoto calcolare la massa di idrogeno che occorre per la reazione e la massa di
ammoniaca che si forma.
2. Per la seguente reazione (da bilanciare):
!
calcolare la massa di acido solfidrico che reagisce con 0,25 g di idrossido di ferro. Calcolare, inoltre, le
masse di solfuro ferrico e di acqua che si formano.
3. Bilanciare la seguente reazione:
HClO4 + Mg(OH) 2 → Mg(ClO4 ) 2 + H 2O
e determinare reagente limitante, reagente in eccesso, le masse di perclorato di magnesio e di acqua che si
formano ponendo a reagire 150 g di acido perclorico con 127 g di idrossido di magnesio.
€
4. Per la seguente reazione (già bilanciata):
ponendo a reagire 25 g di permanganato di potassio con 100 g di solfato ferroso e acido solforico in
eccesso determinare il reagente limitante, il reagente in eccesso e le masse di tutti i prodotti che si
formano.
5. Calcolare le masse di acido nitrico e di idrossido di bario che reagiscono tra loro per ottenere 128 g di
nitrato di bario. Calcolare, inoltre, la massa di acqua che si forma dalla reazione.
6. Facendo reagire del carbonato di calcio con 1,7 moli di acido cloridrico si sviluppano 22 g di anidride
carbonica e si producono, inoltre, acqua e cloruro di calcio. Scrivere correttamente la reazione,
calcolare la quantità di carbonato di calcio reagito e la quantità in eccesso di acido cloridrico.
7. 0,7 g di idrossido di sodio vengono fatti reagire con 2,9 g di acido solforico. Dopo aver scritto e
bilanciato correttamente la reazione determinare le quantità dei prodotti ottenute e la quantità del
reagente in eccesso.
127
PER RIPASSARE I TERMINI CHIAVE…
128
129
130
131












