IL MUSCOLO SCHELETRICO
• Acqua (circa il 75%)
• Proteine (circa il 20%) le più
importanti sono la miosina e l’actina
• Glucidi (0.5-1.5%) il più importante è
il glicogeno
• Grassi, colesterolo e fosfolipidi
• Sali minerali (5%)
• Enzimi
• Creatina, urea, acido lattico
• Mioglobina (deposito di Ossigeno)
Costituito da MIOCITI o fibre muscolari: cellule polinucleate di forma allungata
Numerosi miociti si associano in fasci paralleli. Il muscolo origina da un gran numero di fasci
paralleli cementati da tessuto connettivo interstiziale
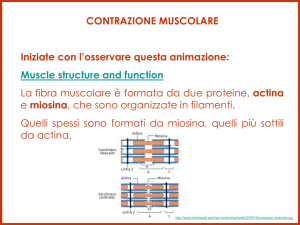
Miofibrilla: una serie continua di unità contrattili detti SARCOMERI contiene filamenti spessi e
filamenti sottili
Ogni miofibrilla è circondata dal reticolo sarcoplasmatico o sarcolemma, un sistema di
vescicole membranose
Proteine della miofibrilla
• proteine a funzione contrattile
(actina e miosina, costituiscono il 70% delle proteine totali)
• proteine con funzione regolatoria
(tropomiosina e troponina)
• proteine strutturali sono parte del citoscheletro cellulare
(actinine, desmina, nebulina, titina, distrofina, etc.)
• proteine enzimatiche che sostengono il metabolismo
muscolare
(mioglobina, catalasi, citocromi, perossidasi, enzimi glicolitici,
enzimi del ciclo degli acidi tricarbossilici)
LE MIOSINE
Famiglia di proteine motrici che legano l’actina e idrolizzano l’ATP ad
ADP + Pi.
Miosina II: scoperta nel muscolo scheletrico, è la più abbondante ed è
presente in molti tipi cellulari
(1 molecola miosina ogni 100 di actina).
Miosina I proteina motrice a basso peso molecolare associata alle
membrane cellulare; sembra coinvolta nelle interazioni membranamembrana
Miosina V coinvolta nel trasporto di organuli e molecole.
Presente in tutti i neuroni encefalici
Miosina VI nella maggior parte dei tessuti la sua mutazione causa
problemi all’udito per deficit motori alle ciglia delle cellule
dell’orecchio interno.
La miosina II (60-70%) PM 540000 sei subunità:
2 catene pesanti identiche con teste globulari N-terminali (PM 230 kDa)
4 catene leggere (PM 20 kDa)
ELC catene leggere essenziali
RLC catene leggere regolatrici
Ad andamento sinistrorso
Nella testa della miosina è presente:
- Sito di legame per ATP
- Attività ATPasica
- Sito di legame per la actina
- La regione della testa per
trattamento con papaina
produce il frammento S-1
La trasformazione dell’energia
chimica in lavoro meccanico
dipende:
1. da cambiamenti conformazionali
indotti dal legame dell’ATP
2. dalla idrolisi dell’ATP
3. dalla liberazione di Pi e ADP
Frammento S1: 2 domini con ruolo funzionale nella contrazione.
Collo: contiene un dominio di 20 kD di catena pesante associato a 2 catene
leggere con funzione regolatoria e stabilizzatrice.
Dominio motore: di 70 kD con 3 sottodomini
1. sito di attività ATPasica, lega l'ATP e i suoi prodotti di idrolisi
4 siti di regolazione dell’attività enzimatica: switch I e II; LOOP1, p-LOOP
4 siti di interazione con l'actina
3. sito convertitore che a seguito dell'idrolisi dell'ATP imprime al collo un
2.
movimento rotatorio che trascina l'actina ancorata.
Struttura di un filamento spesso
Diverse centinaia di molecole di miosina: le code fibrose
Interagiscono fra loro, le teste sono proiettate verso l’esterno
L’actina: presente in tutte le cellule eucariotiche, 20-25% delle proteine muscolari
G-Actina: molecola globulare monomerica PM 42Kd
le molecole di actina G si aggregano a due a due in lunghi polimeri per formare l’actina
fibrosa o Actina
F
FUNZIONI:
1) interagire con le teste di miosina
2) Stimolare l’attività ATP-asica della miosina (200 volte)
Sintesi dei microfilamenti di actina
Dominio 1 e 2 (estremità N- e C-terminale)
coinvolto nelle interazioni con la testa della miosina.
Domini 3 e 4 coinvolti nelle interazioni con altri
monomeri di actina G.
All'interno della struttura è presente una tasca: Sito
di legame per l’ATP ed uno ione metallico (Mg2+ o
Ca2+) richiesti entrambi per la polimerizzazione della
molecola.
n-actina-G + nATP + nCa2+ → n-actina-ATP-Ca2+
n-actina-G-ATP-Ca2+ → actina-F-ADPn + nCa2+ + nPi
Dopo la polimerizzazione, l’ATP si idrolizza ad ADP,
che resta intrappolato nel polimero.
Il complesso actina G-ATP-Ca2+ si aggrega
velocemente per formare Actina F.
I filamenti di actina sono polari, con un’estremità positiva (+) a crescita
veloce ed una negativa (-), inerte ed a crescita lenta.
La conformazione complessiva dell’actina F è elicoidale (doppia elica
destrorsa).
n-actina-G + nATP + nCa2+ → n-actina-ATP-Ca2+
n-actina-G-ATP-Ca2+ → actina-F-ADPn + nCa2+ + nPi
Nelle cellule muscolari i filamenti di actina sono stabili
Nelle cellule non muscolari formano complessi facilmente dissociabili
e ricostituibili con ruolo strutturale o per il movimento
Struttura di un FILAMENTO SOTTILE
• Actina F
• tropomiosina un avvolgimento
avvolto di due subunità α-elicoidali;
• troponina in cui le sfere azzurre sono
gli ioni Ca2+
• TROPOMIOSINA: PM 67.000, proteina dimerica con
catene α e β due α-eliche avvolte.
• I filamenti di tropomiosina alloggiano lungo la
scalanatura delle 2 catene di actina F, ogni molecola
di tropomiosina contatta 7 monomeri di actina.
• azione regolatrice sulla interazione actina-miosina
nella contrazione.
• Funzione: maschera o espone i siti di legame per la
miosina sui filamenti di actina con meccanismo calciodipendente;
TROPONINA: Si trova legata alla tropomiosina ad intervalli
periodici di circa 40 nm.
PM 76.000, 3 subunità:
• Troponina C (TnC): simile alla calmodulina con 4 siti di legame
per il calcio, regola le interazioni delle altre due subunità con le
proteine del filamento sottile.
• Troponina I (TnI): inibisce l'interazione actina-miosina
• Troponina T (TnT): interagisce con tropomiosina
Funzione: inibire la contrazione muscolare quando i livelli di
Calcio intracellulare sono bassi e attivarla quando i livelli di
calcio aumentano
Struttura tridimensionale della troponina C:
conformazione a manubrio.
Contiene 4 siti di legame per gli ioni
metallici bivalenti:
- 2 nella regione C-terminale con elevata
affinità per Ca2+
- 2 nella regione N-terminale che legano
Ca2+ quando la sua concentrazione aumenta
(dopo l’eccitazione)
Ogni monomero di G-actina lega una testa di una miosina
Sistema Tropomiosina-troponina:
MODIFICAZIONE CONFORMAZIONALE Ca++ DIPENDENTE
TROPOMIOSINA: si lega ai filamenti sottili di actina e blocca il legame con
le teste di miosina
TROPONINA lega ioni Ca++ (alla subunità C)
MODIFICAZIONE CONFORMAZIONALE: vengono esposti i siti di
interazione tra actina e testa di miosina
il processo di contrazione inizia
Sarcomero é l’unità ripetitiva funzionale contrattile:tra due linee Z contigue
Banda A: formata dai miofilamenti spessi intercalati con una parte dei miofilamenti sottili
Banda H: costituisce la parte centrale della Banda A
Banda I: costituisce la parte non sovrapposta dei filamenti sottili
Linea M: formata da proteine strutturali cui si agganciano i filamenti spessi (coda-coda)
Linea Z : proteine strutturali dove si agganciano i filamenti sottili e divide a metà la banda I
PROTEINE STRUTTURALI
Interagiscono con la actina in
corrispondenza con la linea Z:
• a-actinina
• Desmina
• Filamina
• Vimentina
• Proteina Z
Interagiscono con la miosina in
corrispondenza della linea M:
Proteina M
Miomesina
Proteina H
TITINA (struttura elastica)
NEBULINA (struttura inestensibile)
Connettono le linee Z con le catene miosiniche impedendo
dopo una eccessiva tensione lo sfibramento del sarcomero.
PROTEINE CHE CONNETTONO
IL SARCOLEMMA con l’apparato contrattile
DISTROFINA
contatta l'actina F, con la laminina
Complesso distrofina-glicoproteine di membrana
Funzioni:
stabilizza la membrana sarcoplasmatica durante i cicli di
contrazione/decontrazione;
mantiene ferma la topologia delle proteine di membrana durante
l'attività contrattile;
correla la forza contrattile generata dalla fibra con l'ambiente
extracellulare.
Mancanza di distrofina o distrofina anomala provoca
Miodistrofia degenerativa di Duchenne
Organizzazione dei filamenti spessi e dei filamenti sottili- tipico
aspetto striato
Microfotografia di una fibra muscolare
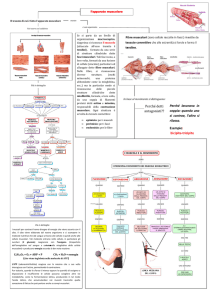
CONTRAZIONE MUSCOLARE
Per la contrazione muscolare sono necessarie tre ATPasi:
1. Na+ /K+ -ATPasi
2. Ca+ ATPasi (nel reticolo sarcoplasmatico)
3. ATPasi miosinica (nella testa della miosina)
L’energia per la contrazione muscolare è fornita dall’idrolisi dell’ATP
La concentrazione intracellulare di ATP durante l’attività fisica non varia
Processo di contrazione muscolare a livello di un singolo sarcomero
Ca+ ATPasi
MIOSINA ENERGIZZATA
ACTOMIOSINA
ACTOMIOSINA-ADP + Pi
“COLPO DI FORZA”
Reticolo sarcoplasmatico
MECCANISMO DELLA CONTRAZIONE
Tappe della reazione
• Miosina-ATP + H20 → Miosina (energizzata)-ADP-Pi + H+
• Miosina (energizzata)-ADP-Pi + Actina → Actomiosina-ADP-Pi
• Actomiosina-ADP-Pi → Actomiosina-ADP + Pi
L'energia di idrolisi dell'ATP, intrappolata sotto forma di miosina
energizzata, viene utilizzata per la contrazione.
• Actomiosina-ADP + ATP → Actina + Miosina-ATP + ADP
ADP viene sostituito con una nuova molecola di ATP.
LE TESTE DI MIOSINA SCORRONO SUI FILAMENTI DI ACTINA.
In risposta al legame, idrolisi di ATP e rilascio di fosfato
LA CONCENTRAZIONE DI ATP IN UNA CELLULA MUSCOLARE
RIMANE COSTANTE
•Due enzimi:
• CREATINA FOSFOCHINASI:
Fosfocreatina + ADP
ATP + creatina
• ADENILATO CHINASI:
2ADP
ATP + AMP
Per l’esaurimento di ATP e di Ca2+ la miosina resta legata all’actina
(rigor mortis)
ATP favorisce la dissociazione del complesso actina-miosina
I meccanismi energetici che sintetizzano l’ATP per la
contrazione muscolare sono:
• 1. Sistema Creatina- fosfocreatina
• 2. Metabolismo aerobio attraverso la fosforilazione
ossidativa
• 3. Glicolisi anaerobia
Contrazioni brevi ad elevato rilascio di energia
Il muscolo scheletrico può mantenere una elevata intensità di forza
solo per un breve periodo di tempo tramite:
1.
Elevata ATPasi miosinica
- Formazione del complesso miosina-ADP
2.
La dissociazione del complesso richiede altro ATP
3.
Rapida sintesi di ATP tramite fosforilazione a livello del
substrato che si avvale di fosfocreatina
La concentrazione di ATP rimane costante durante l’esercizio
muscolare
(prestazione fisica rapida ed intensa)
Creatina fosfochinasi (CK): creatina-P +ADP
Adenilato chinasi: 2ADP
creatina + ATP
ATP + AMP
L'attività ATPasica della miosina produce ADP che attiva la CK
La creatina è sintetizzata nel fegato e nel rene dall’arginina e dalla glicina.
Attraverso il circolo raggiunge il muscolo dove viene fosforilata
reversibilmente da CK in creatina-P (10-30 mM) composto ad elevata energia
capace di rigenerare ATP da ADP in una reazione reversibile.
MUSCOLO A RIPOSO
INTENSA ATTIVITA’ METABOLICA
“Tampone” per l’ ATP
CK proteina dimerica di cui sono noti tre isoenzimi
Subunità M (muscle); subunità B (brain).
MM (muscolo scheletrico), BB (cervello), MB (tessuto cardiaco)
Costante di equilibrio ≈ 1: sensibile a piccole variazioni di
reagenti/prodotti (fosfocreatina 10-30 mM).
Dopo i primi minuti di contrazione ad elevato rilascio di energia la forza
di contrazione si riduce rapidamente:
I depositi di creatina-P diminuiscono
fosfofruttochinasi-1
Aumento di Calcio citoplasmatico
Attivazione allosterica
AMP
GLICOLISI
ADRENALINA
fosforilasi chinasi
(fosforilasi b in fosforilasi a)
GLICOGENOLISI MUSCOLARE: principale fonte di energia
Reazione di emergenza catalizzata dalla adenilato chinasi:
2 ADP ↔ ATP + AMP
REGOLAZIONE: AMP stimola allostericamente la fosfofruttochinasi
e la glicogeno fosforilasi
GLUT-4
AMP
5'-nucleotidasi (sarcolemma)
AMP + H2O → ADENOSINA + Pi
L'adenosina si lega ai recettori cellulari, provoca vasodilatazione.
Aumento del flusso ematico: maggiore apporto di O2 e substrati
ossidabili
+
AMP deaminasi
AMP + H2O → IMP + NH3
IMP + Aspartato + GTP → adenilsuccinato → AMP + Fumarato + GDP + Pi
L'NH3 tampona la riduzione di pH per la produzione di ac.lattico
il fumarato entra nel ciclo di Krebs.
Contrazioni di bassa intensità e lunga durata
Dopo i primi 15-30’ di esercizio fisico
Glicogeno muscolare
Deplezione di fosfocreatina, accumulo
di lattato con riduzione pH: FATICA
glicolisi
LATTATO
glucosio
Gluconeogenesi epatica
Si passa dal metabolismo glicogenolitico
e glicolitico aerobio
Metabolismo ossidativo
degli acidi grassi
FATICA MUSCOLARE
L’affaticamento dopo pochi secondi di un
esercizio molto intenso è dovuto all’abbassamento
del pH per eccessiva produzione di acido lattico
La fatica muscolare è causata dai protoni liberati dall'acido lattico
1) Diminuzione dell’attività della Fosfofruttochinasi
2) Riduzione nella liberazione di Ca++ dal reticolo sarcoplasmatico
3) Spiazzamento del Ca++ dal suo sito di legame sulla Troponina
4) Riduzione dell'attività ATPasica miosinica
5) Rallentamento dell’interazione actina-miosina
Debito di ossigeno
CICLO DI CORI
Il “debito di ossigeno”, viene pagato
dopo uno sforzo; serve per
riossigenare Hb ed Mb e per la
gluconeogenesi da lattato.
Il lattato prodotto dalle fibre rapide bianche va
al fegato ove viene trasformato in glucosio:
ciclo di Cori.
Il senso di fatica o di spossatezza che segue
un esercizio rapido ed intenso (anaerobiotico)
è dovuto alla deplezione di fosfocreatina e
all’acidificazione del sangue da acido lattico.
METABOLITI DURANTE L’ESERCIZIO FISICO
Attività muscolare prolungata (resistenza)
Quando il consumo di ATP supera la sua velocità di sintesi (Affaticamento)
Es: quando il contenuto di glicogeno muscolare si azzera il maratoneta si ferma
Gligogeno epatico
Glicolisi
Glucosio
Gluconeogenesi epatica
Apporto dietetico
Ossidazione acidi grassi
piruvato
Acetil-CoA
Corpi chetonici
beta-idrossibutirrato
REAZIONE ANAPLEROTICA
(Piruvato decarbossilasi)
ossalacetato
Ciclo di Krebs
LA MOBILIZZAZIONE DEL GLICOGENO PER PRODURRE
GLUCOSIO, UNA SORGENTE DI ENERGIA PER QUESTI
CORRIDORI
Effetti benefici dell’esercizio fisico
Il metabolismo delle proteine e degli Amminoacidi
•Alanina e Glutammina
sono neosintetizzati dal
muscolo, sono ceduti al sangue e trasportano al
fegato e al rene l’azoto derivante dalla degradazione
degli amminoacidi
•Le proteine muscolari durante il digiuno prolungato sono
degradate trasportate al fegato ed utilizzate a scopi
energetici
Le proteine muscolari
durante il DIGIUNO
PROLUNGATO
sono degradate,trasportate
al fegato ed utilizzate a
scopi energetici
CICLO GLUCOSIO-ALANINA
METABOLISMO ENERGETICO DEI MUSCOLI
Consumo di ATP
Carburanti
• Glucosio, acidi grassi, corpi chetonici
Depositi energetici
• Creatina fosfato (basta per pochi secondi)
• Glicogeno (2%)
Fonti di ATP
• Fosfocreatina
• Fosforilazione ossidativa
• Glicolisi aerobia/anaerobia
• Adenilato chinasi o miochinasi
FONTI ENERGETICHE PER LA CONTRAZIONE
MUSCOLARE
• Creatina fosfato
• Il glicogeno muscolare può trasformarsi in acido lattico
• Il glicogeno muscolare può trasformarsi in CO2 e H2O
• Il glicogeno epatico può trasformarsi in CO2 e H2O
• Gli acidi grassi del tessuto adiposo possono trasformarsi
in CO2 e H2O
• Corpi chetonici
Fibre muscolari rosse I
(ricche di mioglobina e mitocondri)
Contrazione lenta → grande capacità ossidativa, richiesta di ATP continua
ATP
ossidazione di piruvato, ciclo di Krebs,
β-ossidazione acidi grassi,
fosforilazione ossidativa mitocondriale
Livelli di fosfocreatina bassi
La glicolisi anaerobica solo nel periodo iniziale dell’esercizio:
• rifornimento di O2 non adeguato
• richiesta di ATP superiore alla produzione aerobica (elevata irrorazione)
Reazione LDH favorita: lattato → piruvato;
NAD+/NADH: rapporto elevato, favorisce lattato → piruvato;
Fibre muscolari bianche IIa IIb (mitocondri scarsi)
Contrazione rapida e intensa → grande capacità glicogenolitica e glicolitica
ATP
Glicogeno muscolare (glicogenolisi/glicolisi)
Livelli di fosfocreatina abbondanti
Glicolisi anaerobica
•NAD+/NADH: rapporto basso, favorisce piruvato → lattato;
•acido lattico ossidato durante la fase di riposo: debito di
ossigeno;
FIBRE BIANCHE
FIBRE ROSSE
Contrazione rapida e
intensa
Contrazione lenta
Substrati utilizzati
glucosio
Ac.grassi, glucosio
Prodotti finali
Ac. lattico
CO2 e H2O
Attività ATPasi
miosinica
elevata
bassa
mitocondri
Pochi
Molti
Dipendenza da
ossigeno
bassa
elevata
Attività glicolitica
alta
bassa
Fosfocreatina
notevole
bassa
Contributo relativo di ciascuna via variabile in
relazione al tipo di esercizio e di muscolo.
Es. muscolo con prevalenza di fibre rosse:
•esercizio intenso-breve: ATP dalla glicolisi anaerobica
sostenuta principalmente dal glicogeno muscolare;
•esercizio intenso-intermittente: ATP dalla via
ossidativa sostenuta dal glicogeno epatico e acidi
grassi;
•esercizio moderato-continuo: ATP dalla via ossidativa
che utilizza poco glucosio, molti acidi grassi e in misura
minore corpi chetonici e amminoacidi.
Nei muscoli scheletrici → fibre di tutti i tipi ma in proporzioni diverse
fibre II prevalgono negli strati superficiali, Fibre I in strati profondi;
fibre II prevalgono in soggetti che effettuano esercizio intenso-rapido
(scattisti);
fibre I esercizio lento-prolungato (maratoneti).
L’allenamento anaerobico trasforma le fibre I in fibre II, l’allenamento
aerobico induce la trasformazione opposta.