Classe 4^ - Tecnologie mecc. di proc. e prod. - UdA n° 1: Materiali metallici, costituzione, trattamenti Diagrammi di equilibrio delle leghe ferrose - Struttura delle leghe, distribuzione dei componenti
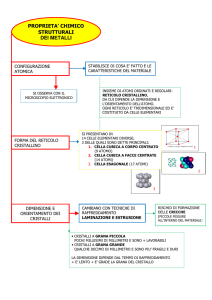
STRUTTURA DELLE LEGHE METALLICHE
In una lega possiamo avere tre tipi di cristalli:
1) CRISTALLI SEMPLICI
Sono formati da un grandissimo numero di celle elementari di un determinato componente
puro (per esempio elemento A) riunite in un reticolo cristallino più o meno uniforme.
2) CRISTALLI DI COMPOSTI CHIMICI
Sono costituiti da composti chimici C = Ax By formati dai
componenti originari A e B non più distinguibili.
Gli atomi di A e di B sono disposti in un rapporto preciso. Per
esempio, nel caso del carburo di ferro Fe3 C (cementite), si hanno tre
atomi di Ferro per ogni atomo di Carbonio.
Nelle leghe il composto chimico è detto “Composto intermetallico”.
3) CRISTALLI DI SOLUZIONI SOLIDE (CRISTALLI MISTI)
Sono costituiti da soluzioni solide tra componenti puri A e B oppure
tra un componente puro A ed un composto chimico C = Ax By.
Possiamo avere:
-
A disciolto in B
B disciolto in A
A (o B) disciolto in C = Ax By
Il metallo preponderante è detto SOLVENTE, l’elemento aggiunto è detto SOLUTO.
DISTRIBUZIONE DEI COMPONENTI NELLE LEGHE
Nel passaggio dallo stato liquido allo stato solido, i componenti possono distribuirsi fra loro
in tre modi: per miscuglio semplice, per combinazione chimica, per soluzione solida.
1) MISCUGLIO SEMPLICE
Questo tipo di leghe sono formate dai singoli componenti del sistema A, B … cristallizzati
separatamente perché insolubili allo stato solido.
Si può avere anche una certa solubilità del componente B in A e/o di A in B. In tal caso le
due soluzioni si separano fra loro nei rispettivi cristalli misti α (poco B disciolto in A) e β (poco
A disciolto in B).
Si ottiene la cosiddetta LEGA EUTETTICA, costituita da una mescolanza intima con
caratteristica distribuzione adiacente, di cristalli semplici, ciascuno dei quali è formato da un
solo componente, elemento (A o B …) o composto chimico (C = Ax By), o di cristalli di
soluzioni solide diverse (α o β).
Ogni insieme di cristalli dello stesso tipo forma una fase.
Il nome di “Eutettico” (che significa “scorre bene”) indica che la lega possiede il più basso
punto di fusione:
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
Pag. 1
Classe 4^ - Tecnologie mecc. di proc. e prod. - UdA n° 1: Materiali metallici, costituzione, trattamenti Diagrammi di equilibrio delle leghe ferrose - Struttura delle leghe, distribuzione dei componenti
La lega eutettica fonde ad una temperatura costante, inferiore alla temperatura di fusione dei
due componenti.
Le leghe eutettiche, per la loro struttura, sono fragili, hanno scarsa resistenza a trazione e
sono poco duttili e malleabili; sono però adatte ad ottenere getti di fusione.
2) COMBINAZIONE CHIMICA
Questo tipo di leghe sono formate da tutti cristalli uguali dei relativi composti chimici C =
Ax By i cui atomi sono disposti nel reticolo cristallino secondo una percentuale ben precisa.
Il composto chimico costituisce una sola fase.
La distribuzione può essere ordinata o no.
3) SOLUZIONE SOLIDA
Tali leghe si hanno quando i componenti sono solubili sia allo stato liquido sia allo stato
solido e sono formati da cristalli misti tutti uguali tra loro.
•
Se la solubilità è completa si ha una sola fase
•
Se la solubilità è parziale si ricade nel miscuglio fra cristalli misti diversi α e β e
quindi si hanno due fasi.
Le soluzioni solide, presentando una struttura più omogenea, posseggono caratteristiche
meccaniche e soprattutto chimiche (resistenza alla corrosione) migliori di quelle possedute dalle
leghe eutettiche.
Si distinguono soluzioni solide di sostituzione e soluzioni solide interstiziali.
a)
Nel caso delle SOLUZIONI SOLIDE DI SOSTITUZIONE, gli atomi hanno
all’incirca le stesse dimensioni e cristallizzano secondo lo stesso reticolo. Gli atomi del
soluto sostituiscono alcuni atomi del solvente.
Si può avere:
- Distribuzione casuale, se la distribuzione degli atomi del soluto
(elemento aggiunto) è disordinata. Il numero di atomi nel reticolo può
variare.
- Distribuzione ordinata, se gli atomi del soluto si distribuiscono
ordinatamente nel reticolo del solvente (metallo preponderante). Le
due specie di atomi sono presenti secondo i loro rapporti.
b)
Nel caso di SOLUZIONI SOLIDE INTERSTIZIALI, gli
atomi di soluto sono inseriti negli spazi interreticolari del
solvente senza spostarne gli atomi dalle posizioni fondamentali.
Necessariamente il diametro atomico del soluto deve essere
inferiore a quello del solvente. L’inserimento è casuale.
Gli atomi del soluto finiscono in realtà per distorcere il reticolo
cristallino rendendo la lega meno plastica e più resistente.
Questo tipo di soluzione avviene in presenza di un metallo (per esempio il ferro) e di un non
metallo (per esempio il carbonio) e la presenza di quest’ultimo è sempre modesta ma tale da
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
Pag. 2
Classe 4^ - Tecnologie mecc. di proc. e prod. - UdA n° 1: Materiali metallici, costituzione, trattamenti Diagrammi di equilibrio delle leghe ferrose - Struttura delle leghe, distribuzione dei componenti
deformare il reticolo e rafforzare il legame metallico fornendo elettroni agli atomi circostanti
(divenendo così ioni positivi).
Per effetto di questi legami supplementari, vi è un maggior ostacolo allo scorrimento dei
piani reticolari e di conseguenza la lega migliora le sue caratteristiche meccaniche e aumenta la
durezza e la fragilità.
Solubilità del Carbonio nel Ferro
Fra i pochi elementi che danno luogo alle soluzioni
interstiziali il più importante è il carbonio i cui atomi si
inseriscono tra quelli del ferro nei suoi vari stati allotropici.
L’atomo di carbonio ha un raggio di 0,70 Å.
Nel sistema C.C.C., rimangono tra le facce degli interstizi,
i più grandi dei quali hanno un raggio di 0,36 Å.
Nel sistema C.F.C., si formano invece degli interstizi di raggio
0,52 Å al centro di ogni cella.
I reticoli suddetti, quindi, non subiscono deformazioni se negli
interstizi ricevono atomi rispettivamente ≤ di 0,36 o 0,52 Å.
L’atomo di carbonio, che ha un raggio di 0,70 Å, provoca
quindi una piccola deformazione nella struttura del Fe γ, provoca
invece una distorsione più sensibile nel reticolo del Fe α.
Il carbonio è perciò solubile nel Fe γ in quantità superiore che
nel Fe α, formando soluzioni solide interstiziali.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
Pag. 3