Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
Unità 3. I composti organici
La chimica è una scienza fondamentale e sperimentale: l’esperimento deve costituire la base dell’attività
didattica. Nell’insegnamento si partirà da un progetto conoscitivo che indichi i progressivi campi d’indagine,
i problemi da porre, le ipotesi da formulare. Questa guida per il docente si limita a esporre concetti ed
esperimenti di chimica, in rapporto al tema di biologia L’uomo: un sistema in relazione con l’ambiente 1.
Le cellule dell’organismo umano, come quelle degli altri organismi, hanno le stesse strutture fondamentali e
la stessa composizione chimica. La maggior parte delle sostanze che le costituiscono, le sostanze organiche,
contengono l’elemento carbonio. Nonostante la sua complessità la chimica organica è una scienza molto
sistematica che può essere ridotta a classi di sostanze e a tipi di reazioni.
In questa unità si studieranno tre classi di sostanze, i glucídi, i lipídi, i protídi, e un tipo di reazione, l’idrolisi.
I glucídi, i lipídi, i protídi sono sostanze complesse che reagiscono con l’acqua in condizioni energiche (con
sostanze molto reattive e ad alta temperatura) e formano sostanze semplici. Nell’organismo umano, grazie
agli enzimi, queste reazioni avvengono a 37°C.
Gli esperimenti saranno svolti in modo qualitativo (cambiamento di colore o di solubilità o di stato
d’aggregazione delle sostanze); anche le formule e le equazioni chimiche (semplici o semplificate) saranno
introdotte nell’ottica qualitativa. Cosí si costruirà un ponte tra la chimica minerale (qualitativa) della classe II
e la chimica generale (quantitativa) della classe IV. Gli esperimenti saranno eseguiti di persona dagli allievi,
in gruppi di 2 o 3 con la metà classe.
Piano orario ed esperimenti esemplari
3.
I composti organici
3.1. I glucídi *
E 3.1. Analisi del glucosio
E 3.2. Idrolisi dell’amido
12 o 4 ore-lezione
3.2. I lipídi *
E 3.3. Analisi dell’olio d’oliva
E 3.4. Idrolisi dell’olio d’oliva
4 o 12 ore-lezione
3.2. I protídi *
E 3.5. Analisi dell’albumina
4 o 12 ore-lezione
E 3.6.
*
1
Idrolisi dell’albumina
uno degli argomenti, a scelta, sarà svolto in modo sperimentale durante 12 ore-lezione.
L’esposizione di concetti ed esperimenti di chimica organica non esclude lo studio, in un’ottica chimica, di alcuni
alimenti.
Unità 3:I composti organici
1
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
Concetti importanti
- Le cellule degli organismi hanno le stesse strutture fondamentali e la stessa composizione chimica. La
maggior parte delle sostanze che le costituiscono, chiamate sostanze organiche, contengono l’elemento
carbonio. I glucídi, i lipídi e i protídi sono sostanze organiche.
- L’idrolisi è la reazione di scissione di una sostanza per opera dell’acqua.
- Gli acidi e le basi reagiscono con l’acqua formando particelle dotate di carica elettrica, dette ioni. Un
acido in acqua libera ioni H+, una base acquista ioni H+. Il pH è una grandezza che esprime il grado di
acidità o basicità di una soluzione acquosa.
- I glucídi, i lipídi e i protídi sono sostanze complesse che reagiscono con l’acqua formando sostanze piú
semplici.
- Una sostanza che agevola una reazione chimica senza essere modificata è detta catalizzatore. Una
sostanza che facilita una reazione chimica in un organismo è chiamata enzima.
- I glucídi sono sostanze organiche naturali contenenti C, H, O. La loro funzione principale è di fornire
energia agli organismi.
- L’amido reagisce con l’acqua in condizioni energiche (soluzione molto acida, alta temperatura) e
si trasforma in glucosio. Nell’organismo umano, in presenza di un enzima contenuto nella saliva,
l’amilasi,
l’idrolisi avviene in condizioni blande (soluzione neutra, 37°C).
- I lipídi sono sostanze organiche naturali insolubili in acqua e contenenti C, H, O e a volte N, P. Essi
svolgono diverse funzioni, soprattutto come componenti strutturali delle membrane e come materiale di
riserva per la produzione di energia.
- I gliceridi sono lipídi costituiti di glicerolo e di acidi grassi. Gli acidi grassi sono insolubili in acqua, ma i
loro sali di sodio e potassio, detti saponi, in acqua formano micelle che vi si disperdono.
- Un grasso o un olio è costituito di una miscela di gliceridi. I gliceridi reagiscono con l’acqua in
condizioni energiche (soluzione molto basica, alta temperatura) e si trasformano in glicerolo e in sale di
sodio o di potassio di acidi grassi. Nell’organismo umano, grazie a enzimi prodotti dal pancreas, detti
lipasi, l’idrolisi avviene in condizioni blande (soluzione un poco basica, 37°C).
- I protídi sono sostanze organiche naturali che contengono C, H, O, N e talvolta S. Essi sono di
primaria importanza per la struttura, il funzionamento e la riproduzione degli organismi.
- I protídi reagiscono con l’acqua in condizioni energiche (soluzione molto acida, alta temperatura) e
vengono scissi in amino acidi. Nell’organismo umano, in presenza di un enzima contenuto nello
stomaco, la pepsina, l’idrolisi avviene in condizioni blande (soluzione acida, 37°C).
Unità 3:I composti organici
2
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
E. 3.1. Analisi del glucosio
I glucídi (dal greco glykýs, dolce), detti anche carboidrati, sono sostanze organiche naturali contenenti C, H,
O. I piú comuni sono d’origine vegetale, quali la cellulosa, l’amido e i diversi zuccheri (glucosio, fruttosio,
saccarosio). Il nome carboidrato deriva dalla formula chimica, che spesso può essere scritta Cn(H2O)n. La loro
funzione principale è di fornire energia agli organismi.
Con questo esperimento si vuol confermare che scomponendo il glucosio (dal greco glykýs, dolce) si ottiene
carbonio e acqua. Si procede in due tappe: (a) scomposizione del glucosio per mezzo del calore, (b)
combustione del prodotto della scomposizione.
a) Scomposizione del glucosio
C6H12O6 (s) -----------→ 6 C (s) + 6 H2O (g)
L’acqua è saggiata con una cartina al cloruro di cobalto:
6 H2O (l)
+ CoCl2 (s) ------------→ CoCl2.6 H2O (s).
cloruro di cobalto
cloruro di cobalto esaidrato
(color blu)
(color rosa)
b) Combustione del carbonio
cenere
C (s) + O2 (g) ----------------→ CO2 (g)
La cenere facilita la combustione del carbonio (e del glucosio). Una sostanza come la cenere che agevola una
reazione chimica senza risultare alla fine modificata è detta catalizzatore (da greco katá, conforme a, e lýsis,
dissoluzione).
Il diossido di carbonio è saggiato con una soluzione satura di idrossido di calcio:
CO2 (g)
+ Ca(OH)2 (aq) ---------------→ CaCO3 (s) + H2O
idrossido di calcio
carbonato di calcio
(incolore)
(color bianco)
E. 3.2. Idrolisi dell’amido
L’idrolisi (dal greco hýdor, acqua, e lýsis, dissoluzione) è la reazione di scissione di una sostanza per opera
dell’acqua. Per esempio, gli acidi e le basi reagiscono con l’acqua formando particelle dotate di carica
elettrica, dette ioni (dal greco ión, che va [verso un polo elettrico]). Un acido, non solo ha un sapore aspro,
ma in acqua libera ioni H+; una base, non solo è untuosa al tatto, ma acquista ioni H+. Il pH (o pH+, cioè il
potenziale degli ioni H+), è una grandezza che esprime il grado di acidità o basicità di una soluzione acquosa.
Il pH neutro, di valore 7, segna il limite tra le soluzioni acide, di valore inferiore, e le soluzioni basiche, di
valore superiore.
Unità 3:I composti organici
3
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
L’amido (dal greco ámylon, [farina] non macinata) 2 reagisce con l’acqua in condizioni energiche (soluzione
molto acida, alta temperatura) e si trasforma in glucosio. Nell’organismo umano, in presenza di una sostanza
contenuta nella saliva, l’amilasi (-asi, suffisso usato per indicare gli enzimi, dal greco diástasis, separazione),
l’idrolisi avviene in condizioni blande (soluzione neutra, 37°C). Una sostanza come l’amilasi che facilita una
reazione chimica in un organismo è chiamata enzima (dal greco en, in e zýme, fermento).
a) Saggio dell’amido (o saggio di J. G. A. Lugol)
Lo iodio forma un complesso con l’amido 3:
(C6H10O5)n (aq) + I2.KI (aq, alc) ---------→ (C6H10O5)n . I2 (aq) + KI (aq)
iodio-ioduro di potassio
iodio-amido
(color marrone)
(color blu)
b) Saggio del glucosio (o saggio di H. Fehling)
Il rame (tartrato di rame II) è ridotto (ossido di rame I) e il glucosio è ossidato (gluconato di sodio) 4:
C6H12O6 (aq) + 2 CuC4H4O6 (aq) + 5 NaOH (aq) -----→ NaC6H11O7 (aq) + Cu2O (s) + 2 Na2C4H4O6 (aq) + 3 H2O
glucosio
tartrato di rame II
gluconato di sodio ossido di rame I tartrato di sodio
(color blu)
(color rosso)
c) Idrolisi acida dell’amido
HCl (aq)
(C6H10O5)n (aq) + n H2O ----------------→ n C6H12O6 (aq)
amido
glucosio
d) Idrolisi enzimatica dell’amido
amilasi
(C6H10O5)n (aq) + n H2O --------------→ n C6H12O6 (aq)
amido
glucosio
2
L’amido è formato di due polimeri, l’amilosio, un poli-α-glucoside lineare (M = 1’000-500’000), e l’amilopectina, un
poli-α-glucoside ramificato (M > 1’000’000). L’amilosio, detto anche amido «solubile», mescolato con l’acqua forma
una dispersione colloidale.
3
Uno ione ioduro è legato a molecole di iodio in una catena la cui lunghezza dipende dalla lunghezza della catena del
glucíde sulla quale è disposta. L’elettrone singolo è delocalizzato su tutti gli atomi di iodio lungo la catena. Piú lunga è
la catena, minore è la frequenza della banda d’assorbimento. I complessi con molecole grandi assorbono nel rosso e
hanno un colore blu, quelli con molecole medie assorbono nel blu e hanno un colore rosso, quelli con molecole
piccole assorbono nell’ultraviola e sono incolori.
4
I semiacetali e i semichetali sono ossidabili; perciò glucosio e fruttosio sono riducenti. Nel maltosio (α-D-glucosio-αD-glucosio) un gruppo carbonile del glucosio si trova come cetale e l’altro, come semiacetale; il maltosio è riducente.
Invece, nel saccarosio (α-D-glucosio-β-D-fruttosio) il gruppo carbonile del glucosio è presente come cetale e quello
del fruttosio, come chetale; il saccarosio non è riducente.
Unità 3:I composti organici
4
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
E. 3.3. Analisi dell’olio d’oliva
I lipídi (dal greco lípos, grasso) sono sostanze organiche naturali insolubili in acqua e contenenti C, H, O e a
volte N, P. Essi sono presenti negli organismi e svolgono diverse funzioni, soprattutto come componenti
strutturali delle membrane e come materiale di riserva per la produzione di energia.
I gliceridi sono lipidi costituiti di glicerolo (dal greco glykýs, dolce) e di acidi grassi. Gli acidi grassi sono
insolubili in acqua, ma i loro sali di sodio e potassio, detti saponi, in acqua formano piccole particelle
chiamate micelle (dal latino micam, briciola) che vi si disperdono. Per di piú i saponi hanno la proprietà di
emulsionare (dal latino e[x]mulgere, mungere, spremere fuori) goccioline d’olio o di grasso, disperdendole
anch’esse nell’acqua.
In genere un grasso o un olio è costituito di una miscela di gliceridi. L’olio d’oliva è formato di 83% di
gliceridi costituiti d’acido oleico.
L’olio d’oliva reagisce con l’ossigeno formando diossido di carbonio e acqua:
[C, H, O] (l) + O2 (g) ------→ CO2 (g) + H2O (g).
E. 3.4. Idrolisi dell’olio d’oliva
L’olio d’oliva reagisce con l’acqua in condizioni energiche (soluzione molto basica, alta temperatura) e si
scinde in glicerolo e acidi grassi, soprattutto acido oleico. Nell’organismo umano, grazie a un enzima
prodotto dal pancreas, detto [triacilglicerol]lipasi, l’idrolisi avviene in condizioni blande (soluzione un poco
basica [pH 8], 37°C).
a) Saggio dell’olio d’oliva
Il rosso scarlatto (C24H20N4O) è una sostanza di colore rosso solubile nei lipidi e poco solubile in acqua.
b) Saggio dell’acido oleico
Il sale di sodio della fenolftaleina («fenolftaleinato» di sodio) reagisce con un acido e si forma fenolftaleina e
un sale di sodio dell’acido:
C20H13O4Na(aq) + CH3(CH2)7CH=CH(CH2)7COOH(alc) --→ C20H13O4H(alc) + CH3(CH2)7CH=CH(CH2)7COONa(‘aq’)
«fenolftaleinato»
di sodio
(color rosa)
acido oleico
fenolftaleina
oleato di sodio
(incolore)
c) Idrolisi alcalina dell’olio d’oliva
C3H5O3(COR)3 (l) + 3 NaOH (aq) ---→ C3H5(OH)3 (aq) + 3 RCOONa (‘aq’)
gliceride
idrossido di sodio
glicerolo
sale di sodio d’acido grasso
Unità 3:I composti organici
5
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
d) Idrolisi enzimatica dell’olio d’oliva
C3H5O3(COR)3 (‘aq’) + 3 H2O
gliceride
lipasi
------------------→
C3H5(OH)3 (aq) + 3 RCOOH (‘aq’)
glicerolo
acido grasso
E. 3.5. Analisi dell’albumina
I protídi (dal greco próteos, primario) contengono C, H, O, N e talvolta S. I protídi sono costituiti di unità di
aminoacido (da ammoniaca, a sua volta dal greco ammoniakós, perché presso il tempio di Ammone in Libia
si raccoglieva un sale d’ammonio) legate fra loro. Essi sono di primaria importanza per la struttura, il
funzionamento e la riproduzione degli organismi.
L’albumina (dal latino albumen, albume, a sua volta da albus, bianco) è scomposta per mezzo del calore:
[C, H, O, N, S] --------→ C(s) + H2O (g) + NH3 (g) + H2S (g)
Il carbonio e l’acqua sono saggiati come in E. 3.1.
L’ammoniaca à saggiata con una cartina al tornasole, estratto da licheni, la cui sostanza colorante è l’orcina:
NH3 (g) + C7H8O2 (aq) --------→ NH4C7H7O2 (aq)
ammoniaca orcina
orcinato [d’ammonio]
(color rosso)
(color blu)
Il solfuro d’idrogeno è saggiato con una cartina all’acetato di piombo:
H2S (g) + Pb(CH3COO)2 (aq) ---------→ PbS (s) + 2 CH3COOH (aq)
solfuro d’idrogeno acetato di piombo
solfuro di piombo acido acetico
(color nero)
E. 3.6. Idrolisi dell’albumina
I protídi reagiscono con l’acqua in condizioni energiche (soluzione molto acida, alta temperatura) e vengono
scissi in aminoacidi. Nell’organismo umano, in presenza di un enzima contenuto nello stomaco, la pepsina
(dal greco pépsis, digestione), l’idrolisi avviene in condizioni blande (soluzione acida [pH 1-2], 37°C).
a) Saggio di un protíde (o saggio del biureto)
Il solfato di rame in soluzione basica forma un complesso di color viola con un protíde:
n CuSO4 (aq) + protíde (aq) --------→ (protíde.Cun)(SO4)n (aq)
(color blu)
(color viola)
Unità 3:I composti organici
6
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
b) Saggio di un aminoacido
La ninidrina reagisce con un aminoacido e forma un composto azotato di color viola:
2 C9H4O2(OH)2 + NH2CHRCOOH -------→ C9H4O2=N-C9H4O2H + RCHO + CO2 + 3 H2O
ninidrina
aminoacido
composto azotato
(color viola)
c) Idrolisi acida
HCl (aq)
NH2-...-CO-NH-CHRi-CO-NH-...-COOH + n H2O ------------------→ n NH2-CHRi-COOH
protíde
aminoacidi
con i = 1, 2, ... 20.
d) Idrolisi enzimatica
pepsina
NH2-...-CO-NH-CHRi-CO-NH-...-COOH + n H2O -----------------→ n NH2-CHRi-COOH
protíde
aminoacidi
con i = 1, 2, ... 20.
Unità 3:I composti organici
7
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
E. 3.1.a. Analisi del glucosio
Scopo
Scomponendo il glucosio per mezzo del calore si ottiene carbonio e acqua.
Materiale
-
occhiali
bicchiere, 250 cm3
sostegno, morsetto, pinza
provetta di vetro borosilicato, 16x130 mm (Merck, nr. 30’324.07)
provetta di vetro borosilicato, 12x100 mm (Merck, nr. 30’324.05)
portaprovette
capsula di Petri
pipette Pasteur (Merck, nr. 27’910.01)
cappuccio di gomma
bicchiere, 50 cm3
vetro d’orologio
spatola
pinzetta
forbici
asciugacapelli
essiccatore con gel disidratante
carta da filtro
riga millimetrata
bilancia, ± 0,01 g
bruciatore
- glucosio monoidrato (Merck, nr. 104’074)
- [glucosio anidro (Merck, nr. 108’337)]
- cloruro di cobalto esaidrato (Merck, nr. 102’539)
Procedimento
a) Valutazione della capacità della pipetta Pasteur e del volume di una goccia d’acqua
1.
2.
3.
4.
5.
Misurare la massa del bicchiere.
Riempire la pipetta con acqua. Misurare l’altezza della colonna d’acqua (escluso il capillare).
Versare l’acqua nel bicchiere, contando le gocce.
Misurare la massa del bicchiere con l’acqua. Determinare la massa dell’acqua.
Determinare (a) la capacità della pipetta, (b) l’altezza della colonna d’acqua corrispondente a 1 mL,
(c) il volume di una goccia d’acqua.
Unità 3:I composti organici
8
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
b) Preparazione delle cartine al cloruro di cobalto
1. Tagliare carta da filtro in strisce di 10 x 600 mm.
2. Versare nella provetta una punta di spatola (circa 1 g) di cloruro di cobalto e 4 mL d’acqua. Mescolare e
versare la soluzione nella capsula di Petri.
3. Immergere nella soluzione le cartine e porle nel bicchiere.
4. Essiccare le cartine con l’asciugacapelli e conservarle nell’essiccatore.
5. Mettere una goccia d’acqua sulla cartina e osservare il cambiamento di colore. Essiccare la cartina e
rimetterla nell’essiccatore.
b) Scomposizione del glucosio
1.
2.
3.
4.
5.
6.
Fissare in modo perpendicolare la provetta grande al sostegno.
Versare nella provetta grande due punte di spatola (circa 2 g) di glucosio.
Scaldare il fondo della provetta grande con il bruciatore.
Quando il vapore condensa porre il vetro d’orologio sull’apertura della provetta grande.
Lasciar condensare il vapore sul vetro d’orologio e saggiare il liquido con la cartina al cloruro di cobalto.
Osservare il residuo sul fondo della provetta grande.
cartina al cloruro di cobalto ⇒ color rosa ⇒ H2O
residuo color nero ⇒ C
c) Combustione del carbonio (omesso)
Unità 3:I composti organici
9
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
E. 3.1.b. Analisi del glucosio
Scopo
Scomponendo il glucosio per mezzo del calore si ottiene carbonio e acqua.
Materiale
-
occhiali
sostegno, 2 morsetti, 2 pinze
provetta di vetro borosilicato, 25x200 mm (Merck, nr. 30’324.13)
matraccio per filtrazione, 250 cm3
3 tubi essiccatori di polietene (Merck, nr. 4’525.000)
tappo di gomma con 1 foro nr. 5
tappo di gomma con 2 fori nr. 5
tubo di vetro, ø 6 mm
tubo di gomma
tubo di gomma da vuoto
pompa ad acqua
spatola
ovatta di cotone
vetro d’orologio
bicchiere, 250 cm3
pinzetta
forbici
carta da filtro
asciugacapelli
bruciatore
-
glucosio anidro (Merck, nr. 108’337)
cenere
cloruro di cobalto (Merck, nr. 102’539)
cloruro di calcio per essiccatore (Fluka, nr. 21’085)
idrossido di sodio su supporto granulato (Merck, nr. 101’564)
idrossido di calcio (Merck, nr. 102’047)
azoto (bombola)
Unità 3:I composti organici
⇒ cartina al cloruro di cobalto
⇒ soluzione satura di Ca(OH)2
10
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
Procedimento
a) Scomposizione del glucosio
1.
2.
3.
4.
5.
6.
Montare l’apparecchio come nella fig. 1.
Versare nella provetta due punte di spatola (circa 2 g) di glucosio.
Far passare nella provetta, per alcuni secondi, un flusso di azoto.
Scaldare il fondo della provetta con il bruciatore.
Quando il vapore condensa porre il vetro d’orologio sull’apertura della provetta.
Lasciar condensare il vapore sul vetro d’orologio e saggiare il liquido con la cartina al cloruro di cobalto.
cartina al cloruro di cobalto ⇒ color rosa ⇒ H2O
b) Combustione del prodotto della scomposizione
1.
2.
3.
4.
Dopo la scomposizione del glucosio, montare l’apparecchio come nella fig. 2.
Aggiungere una punta di spatola (circa 1 g) di cenere al prodotto della scomposizione.
Azionare la pompa ad acqua e scaldare con il bruciatore fino a combustione completa.
Osservare il contenuto del matraccio per filtrazione.
precipitato bianco ⇒ CO2 ⇒ C
Unità 3:I composti organici
11
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
E. 3.2. Idrolisi dell’amido (amilosio)
Scopo
L’amido (amilosio) reagisce con l’acqua in soluzione molto acida e ad alta temperatura e si trasforma in
glucosio. La stessa reazione avviene in soluzione neutra a 37°C in presenza di α-amilasi.
Materiale
-
occhiali
provetta di vetro borosilicato, 16x130 mm (Merck, nr. 30’324.07)
4 provette di vetro borosilicato, 12x100 mm (Merck, nr. 30’324.05)
provetta di vetro comune, 10x100 mm (Merck, nr. 27’400.05) ⇒ ampolla di raffreddamento
portaprovette
parafilm
pipette Pasteur con cappuccio di gomma
bacchetta di vetro
pinza di legno
3 bicchieri, 1000 mL (bagno d’acqua, bagno di ghiaccio, bagnomaria 5)
pietrina per distillazione
-
iodio (Merck, nr. 104’761)
⇒ soluzione di Lugol
ioduro di potassio (Merck, nr. 105’040)
⇒ soluzione di Lugol
etanolo (Merck, nr. 818’761)
⇒ soluzione di Lugol
solfato di rame pentaidrato (Merck, nr. 102’787)
⇒ soluzione di Fehling I
tartrato di potassio e di sodio tetraidrato (Merck, nr. 108’085) ⇒ soluzione di Fehling II
acido cloridrico 32% (Merck, nr. 100’313)
⇒ soluzione di HCl 2 mol/L
idrossido di sodio (Merck, nr. 106’462)
⇒ soluzione di NaOH 2 mol/L
glucosio monoidrato (Merck, nr. 104’074)
⇒ soluzione di glucosio 10 g/L
fosfato di sodio dodecaidrato (Merck, nr. 106’578)
⇒ soluzione di fosfato 0,02 mol/L pH 7
amido «solubile» (Merck, nr. 101’252)
⇒ soluzione d’amido 10 g/L
α-amilasi (Merck, nr. 116’312)
⇒ soluzione di α-amilasi 0,04 g/L
cartina indicatrice universale pH 1-10 (Merck, nr. 109’525)
5
Un bagnomaria (composto di bagno + Maria, sorella di Mosè, che secondo la leggenda fu anche un’alchimista) è un
recipiente contenente acqua a diretto contatto con una fonte di calore; la sua temperatura corrisponde alla temperatura
d’ebollizione dell’acqua (100°C a pressione standard). Un bagno di ghiaccio è un recipiente contenente ghiaccio e
acqua; la sua temperatura corrisponde a quella di fusione del ghiaccio (0°C a pressione standard). A rigor di termini,
un bagno d’acqua è un recipiente contenente acqua alla temperatura maggiore di quella di fusione dell’acqua e minore
di quella d’ebollizione dell’acqua.
Unità 3:I composti organici
12
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
Procedimento
Soluzione di Lugol
Aggiungere a 10 mL d’acqua 14 g di I2, 10 g di KI e diluire con etanolo fino a 200 mL.
Soluzione di Fehling I (Soluzione di solfato di rame II)
Sciogliere 34,66 g di CuSO4.5H2O in acqua e diluire fino a 500 mL.
Soluzione di Fehling II (Soluzione alcalina di tartrato di potassio e di sodio)
Sciogliere 173 g di KNaC4H4O6.4H2O e 50 g di NaOH in acqua e diluire con acqua fredda fino a 500 mL.
Soluzione tampone di fosfato 0,02 mol/L pH 7
Sciogliere 3,8 g di fosfato di sodio dodecaidrato in circa 450 mL di acqua, aggiungere acido cloridrico 6
mol/L fino a pH 7 e completare con acqua fino a 500 mL. Conservare a circa 4°C.
Soluzione d’amido 10 g/L (in fosfato di sodio 0,02 mol/L pH 7)
Sciogliere 2,5 g d’amido in 250 mL di soluzione di fosfato 0,02 mol/L pH 7. Scaldare 3-4 minuti a circa
90°C. Conservare a circa 4°C.
Soluzione di α-amilasi 0,04 g/L (in fosfato di sodio 0,02 mol/L pH 7)
Sciogliere 10 mg di α-amilasi in 250 mL di soluzione di fosfato 0,02 mol/L pH 7. Conservare a circa 4°C.
Ampolla di raffreddamento
Soffiare una bolla di ø 20-25 mm in mezzo a una provetta di vetro comune di ø 10 mm. Per l’impiego,
riempire a metà il raffreddatore con acqua demineralizzata.
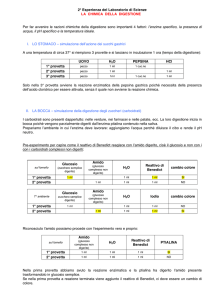
a) Saggio dell’amido
1. Versare nella provetta A 2 mL di soluzione d’amido; nella provetta B, 2 mL di soluzione di glucosio; nella
provetta C, 2 ml d’acqua.
2. In ogni provetta aggiungere 2 gocce di soluzione di Lugol e osservare il colore.
con amido ⇒ color blu
b) Saggio del glucosio
1. Versare nella provetta A 2 mL di soluzione di glucosio; nella provetta B, 2 mL di soluzione d’amido; nella
provetta C, 2 mL d’acqua.
2. In ogni provetta aggiungere 1 mL di soluzione di Fehling I e 1 mL di soluzione di Fehling II 6.
3. Scaldare a bagnomaria per circa 2 minuti e osservare il cambiamento.
con glucosio ⇒ precipitato color rosso
6
«Ho osservato e poi trovato conferma nella letteratura che le due soluzioni di Fehling possono essere mescolate nel
rapporto 1:1 prima di essere aggiunte alle soluzioni di carboidrati. Consegnando agli allievi una sola soluzione,
permette loro di capire meglio la successione delle reazioni chimiche» (Valeria Lardelli Bianchi, Balerna).
Unità 3:I composti organici
13
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
c) Idrolisi acida
1.
2.
3.
4.
Introdurre nella provetta grande 4 mL di soluzione d’amido 10 g/L e 4 mL di soluzione d’acido
cloridrico 2 mol/L.
Mescolare e misurare il pH.
Prendere 2 mL di soluzione, versarla nella provetta A e coprire con parafilm.
Coprire la provetta grande con l’ampolla di raffreddamento e metterla nel bagnomaria. Mescolare di
tanto in tanto con la bacchetta di vetro.
Dopo 30 minuti raffreddare la soluzione della provetta grande, prelevare 2 mL e versarli nella provetta
5.
B.
6. Alle soluzioni nelle provette A e B aggiungere, goccia a goccia, la soluzione d’idrossido di sodio 2
mol/L fino a pH 7 o poco superiore.
7. Versare la metà del contenuto della provetta A nella provetta A1.
8. Far la stessa cosa con il contenuto della provetta B nella provetta B1.
9. Saggiare l’amido nelle provette A e B.
10. Saggiare il glucosio nelle provette A1 e B1.
d) Idrolisi enzimatica «in vitro»
1.
2.
3.
4.
5.
6.
7.
8.
9.
Mettere la provetta grande e le provette A e B nel bagno di ghiaccio.
Introdurre nella provetta grande 4 mL di soluzione d’amido 10 g/L e 4 mL di soluzione di α-amilasi 0,04
g/L. Mescolare.
Prendere 2 mL di soluzione, versarla nella provetta A e coprire con parafilm.
Coprire la provetta grande con parafilm e metterla nel bagno d’acqua (circa 37°C).
Dopo 5 minuti mettere la provetta grande nel bagno di ghiaccio, prelevare 2 mL e versarli nella provetta
B.
Versare la metà del contenuto della provetta A nella provetta A1.
Far la stessa cosa con il contenuto della provetta B nella provetta B1.
Saggiare l’amido nelle provette A e B.
Saggiare il glucosio nelle provette A1 e B1.
e) Idrolisi enzimatica «in vivo»
1.
2.
3.
4.
5.
6.
7.
Mettere la provetta A nel bagno di ghiaccio e introdurre in essa 1 mL di soluzione d’amido 10 g/L e 1
mL di saliva 7 e coprire con parafilm 8.
Con un cucchiaio, introdurre nella bocca, senza inghiottire, 1 mL di soluzione d’amido 10 g/L.
Dopo 5 minuti sputare nella provetta B raffreddata nel bagno di ghiaccio.
Versare la metà del contenuto della provetta A nella provetta A1.
Far la stessa cosa con il contenuto della provetta B nella provetta B1.
Saggiare l’amido nelle provette A e B.
Saggiare il glucosio nelle provette A1 e B1.
La quantità di α-amilasi nella saliva è indotta dal consumo d’amido. Perciò è opportuno masticare un pezzo di pane
prima dell’esperimento (Alberto Robustelli, Biasca).
8
La soluzione d’amido può essere sostituita con una briciola di mollíca di pane (Francesco Gendotti, Ambrí).
7
Unità 3:I composti organici
14
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
E. 3.3. Analisi dell’olio d’oliva
Scopo
L’olio d’oliva, bruciando, reagisce con l’ossigeno e si sviluppa luce, calore, diossido di carbonio, acqua.
Materiale
-
occhiali
sostegno, morsetto, pinza
imbuto
matraccio per filtrazione, 250 mL
tappo di gomma con un foro
tubo di vetro, ø 6 mm
tubo di gomma
tubo di gomma da vuoto
pompa ad acqua
lucerna
capsula di porcellana
bruciatore
- olio d’oliva
- idrossido di calcio (Merck, nr. 102’047)
- cloruro di cobalto (Merck, nr. 102’539)
⇒ soluzione satura di Ca(OH)2
⇒ cartina al cloruro di cobalto
Procedimento
1. Voltare di sotto in su l’imbuto, collegarlo con il matraccio per filtrazione e questo con la pompa ad acqua
(fig. 2).
2. Versare nel matraccio per filtrazione circa 50 mL di soluzione satura d’idrossido di calcio.
3. Mettere la lucerna sotto l’imbuto, far funzionare la pompa e accendere la lucerna.
4. Dopo alcuni minuti fermare la pompa e spegnere la lucerna.
5. Saggiare con la cartina al cloruro di cobato il liquido condensato nell’imbuto.
6. Osservare il contenuto nel matraccio per filtrazione.
cartina al cloruro di cobalto ⇒ color rosa ⇒ H2O
precipitato bianco ⇒ CO2 ⇒ C
Unità 3:I composti organici
15
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
E. 3.4. Idrolisi dell’olio d’oliva
Scopo
L’olio d’oliva reagisce con l’acqua in soluzione molto basica e ad alta temperatura e si scinde in glicerolo e
acidi grassi, soprattutto acido oleico. In presenza di [triacilglicerol]lipasi l’idrolisi avviene in soluzione un
poco basica e a 37°C.
Materiale
-
occhiali
provetta di vetro borosilicato, 16x130 mm (Merck, nr. 30’324.07)
2 provette di vetro borosilicato 12x100 mm (Merck, nr. 30’324.05)
provetta di vetro comune, 10x100 mm (Merck, nr. 27’400.05) ⇒ ampolla di raffreddamento
portaprovette
tappo di gomma
parafilm
bacchetta di vetro
pipette Pasteur con cappuccio di gomma
vaschetta di vetro con termostato
3 bicchieri, 1000 mL (bagno d’acqua, bagno di ghiaccio, bagnomaria)
pietrina per distillazione
centrifuga
-
olio d’oliva
soluzione di sapone Boutron-Boudet (Merck, nr. 109’150)
acido oleico (Merck, nr. 100’471)
⇒ soluzione alcolica 50 g/L
rosso scarlatto (Fluka, nr. 84’650)
⇒ soluzione alcolica 2 g/L
soluzione di fenolftaleina 10 g/L (Merck, nr. 107’227)
acido cloridrico 32% (Merck, nr. 100’313)
⇒ soluzione di HCl 6 mol/L
idrossido di sodio (Merck, nr. 106’462)
⇒ soluzione di NaOH 2 mol/L; idem 0,1 mol/L
ammoniaca 32% (Merck, nr. 105’426)
⇒ soluzione tampone ammonio 0,1 mol/L pH 8
pancreatina (Fluka, nr. 76’190)
⇒ soluzione di pancreatina 20 g/L 9
sali biliari (Fluka, nr. 48’305)
⇒ soluzione di sali biliari 50 g/L
cloruro di calcio diidrato (Merck, nr. 102’380)
⇒ soluzione di CaCl2 0,8 mol/L
cartina indicatrice universale pH 1-10
9
La pancreatina è un preparato grezzo di lipasi ottenuto per estrazione con acetone dal pancreas (di maiale, per
esempio) liofilizato e polverizzato.
Unità 3:I composti organici
16
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
Procedimento
Per il docente
Soluzione tampone d’ammonio 0,1 mol/L pH 8
Aggiungere a circa 980 mL d’acqua 6 mL di NH3 32%, HCl 6 M fino a pH 8 e completare a 1000 mL con
acqua.
Soluzione di pancreatina (lipasi) 20 g/L
2 g di pancreatina in 100 mL di soluzione tampone d’ammonio 0,1 mol/L pH 8, mescolare e separare per
centrifugazione le sostanze insolubili. Conservare a 0°C.
a) Saggio dell’olio d’oliva
1. Versare nella provetta A 4 mL d’acqua e 0,5 mL d’olio; nella provetta B, 4 mL di soluzione di sapone;
nella provetta C, 4 mL d’acqua.
2. In ogni provetta aggiungere 2 gocce di soluzione di rosso scarlatto. Mescolare.
3. Osservare le fasi e il loro colore.
acqua + olio ⇒ due fasi: color rosso scarlatto nella fase dell’olio
acqua + sapone ⇒ una fase: color rosso tenue
acqua ⇒ una fase: color rosso tenue
b) Saggio dell’acido oleico
1. Versare nella provetta A 2 mL d’acqua; nella provetta B, 2 mL di soluzione d’idrossido di sodio 0,1
mol/L.
2. In ogni provetta aggiungere 2 gocce di soluzione di fenolftaleina. Mescolare e osservare il colore.
3. In ogni provetta aggiungere 2 mL di soluzione d’acido oleico 50 g/L. Mescolare e osservare il colore.
acqua + fenolftaleina ⇒ incolore
acqua + fenolftaleina + acido oleico ⇒ incolore
soluzione d’idrossido di sodio + fenolftaleina ⇒ color rosa
soluzione d’idrossido di sodio + fenolftaleina + acido oleico ⇒ incolore
c) Idrolisi alcalina
1.
2.
3.
4.
5.
6.
Introdurre nella provetta grande 0,5 mL d’olio e 8 mL di soluzione d’idrossido di sodio 1 mol/L.
Prendere una goccia della miscela, diluirla in 10 mL d’acqua e misurare il pH.
Prendere 2 mL della miscela, versarla nella provetta A e coprire con parafilm.
Coprire la provetta grande con l’ampolla di raffreddamento e introdurla nel bagnomaria. Mescolare di
tanto in tanto con la bacchetta di vetro.
Dopo 60 minuti raffreddare la soluzione della provetta grande, prendere 2 mL e versarli nella provetta B.
Saggiare le miscele A e B con il rosso scarlatto.
Unità 3:I composti organici
17
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
d) Idrolisi enzimatica 10
1. Introdurre nella provetta grande 0,5 mL d’olio e 4 mL di soluzione di sali biliari 50 g/L.
2. Scaldare nel bagnomaria, chiudere con il tappo e agitare con forza fino ad avere un’emulsione
omogenea;
raffreddare a temperatura ambiente, agitando con delicatezza.
3. Aggiungere goccia a goccia all’emulsione, agitando con delicatezza, 1 mL di soluzione tampone
d’ammonio 0,1 mol/L, poi, nello stesso modo, 1 mL di soluzione di cloruro di calcio 0,8 mol/L.
4. Osservare il colore rosa dell’emulsione; prendere una goccia dell’emulsione e misurare il pH.
5. Aggiungere 2 mL di soluzione di pancreatina 20 g/L.
6. Coprire la provetta grande con parafilm e introdurla nel bagno d’acqua (circa 37°C). Mescolare di tanto
in tanto con la bacchetta di vetro.
7. Dopo 10 minuti prendere una goccia dell’emulsione e misurare il pH; aggiungere goccia a goccia la
soluzione d’idrossido di sodio 2 mol/L finché appare il colore rosa.
8. Dopo 20 minuti ripetere la medesima operazione.
10
Alcune condizioni sono necessarie per massimizzare l’attività dell’enzima. (a) Bisogna aumentare la concentrazione
effettiva del substrato, e poiché i trigliceridi di massa molecolare alta sono insolubili in acqua, essi devono esser
emulsionati con sali biliari. (b) È necessario aggiungere ioni di calcio per precipitare gli acidi grassi liberi man mano
che si formano durante l’idrolisi. (c) Si impiega una soluzione tampone d’ammonio pH 8 (l’attività ottimale delle
lipasi è ottenuta a pH 8-9); gli ioni d’idrogeno prodotti durante l’idrolisi sono neutralizzati con idrossido di sodio (J.
M. CLARCK, ed., Experimental biochemistry, San Francisco 1964, pp. 55-58).
Unità 3:I composti organici
18
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
E. 3.5. Analisi dell’albumina
Scopo
Scomponendo l’albumina per mezzo del calore si ottiene (in piú del carbonio e dell’acqua) ammoniaca e
solfuro d’idrogeno.
Materiale
-
occhiali
bicchiere, 250 cm3
pipette Pasteur con cappuccio di gomma
sostegno, morsetto, pinza
provetta di vetro borosilicato, 16x130 mm (Merck, nr. 30’324.07)
provetta di vetro borosilicato, 12x100 mm (Merck, nr. 30’324.05)
portaprovette
capsula di Petri
spatola
pinzetta
forbici
asciugacapelli
essiccatore con gel disidratante
carta da filtro
bruciatore
-
albumina (Fluka, nr. 5’461)
cartina al tornasole rosso (Merck, nr. 109’517.0001)
ammoniaca 32% (Merck, nr. 105’426)
acetato di piombo triidrato (Merck, nr. 107’375)
solfuro di sodio (Fluka, nr. 71’975)
⇒ soluzione d’ammoniaca 1 mol/L
⇒ soluzione d’acetato di piombo 1 mol/L
⇒ soluzione di solfuro di sodio 1 mol/L
Procedimento
a) Preparazione delle cartine all’acetato di piombo e saggio del solfuro
1.
2.
3.
4.
5.
Tagliare carta da filtro in strisce di 10 x 600 mm.
Versare nella capsula di Petri 4 mL di soluzione d’acetato di piombo.
Immergere nella soluzione le cartine e porle nel bicchiere.
Essiccare le cartine con l’asciugacapelli e conservarle nell’essicatore.
Mettere una goccia di soluzione di solfuro di sodio sulla cartina e osservare il cambiamento di colore.
b) Saggio dell’ammoniaca
1. Mettere una goccia di soluzione d’ammoniaca sulla cartina al tornasole rosso e osservare il cambiamento
di colore.
Unità 3:I composti organici
19
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
c) Scomposizione dell’albumina
1.
2.
3.
4.
Fissare in modo verticale la provetta grande al sostegno.
Versare nella provetta grande un punta di spatola (circa 1 g) d’albumina.
Scaldare il fondo della provetta grande con il bruciatore.
Quando il vapore si condensa, porre le cartine al tornasole e all’acetato di piombo (imbevute di una goccia
d’acqua) sull’apertura della provetta grande.
5. Osservare il cambiamento di colore delle cartine.
cartina al tornasole rosso ⇒ color blu ⇒ base ⇒ NH3 ⇒ N
cartina all’acetato di piombo ⇒ color nero ⇒ PbS ⇒ S
Unità 3:I composti organici
20
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
E. 3.6. Idrolisi dell’albumina
Scopo
L’albumina reagisce con l’acqua in soluzione molto acida e ad alta temperatura e si trasforma in aminoacidi.
La stessa reazione avviene in soluzione acida e a 37°C in presenza di pepsina.
Materiale
-
occhiali
provetta di vetro borosilicato, 16x130 mm (Merck, nr. 30’324.07)
4 provette di vetro borosilicato, 12x100 mm (Merck, nr. 30’324.05)
2 provette di vetro comune, 13x100 mm Merck, nr. 27’400.06)
provetta di vetro comune, 10x100 mm (Merck, nr. 27’400.05) ⇒ ampolla di raffreddamento
portaprovette
parafilm
pipette Pasteur con cappuccio di gomma
bacchetta di vetro
carta da filtro
3 bicchieri, 1000 mL (bagno d’acqua, bagno di ghiaccio, bagnomaria)
pietrina per distillazione
bicchiere, 500 mL
vetro d’orologio
2 bicchieri, 50 mL
tagliavetro
bruciatore
stufa con termostato
-
acido cloridrico 32% (Merck, nr. 100’313)
⇒ soluzione di HCl 0,1 mol/L; idem 6 mol/L
idrossido di sodio (Merck, nr. 106’462)
⇒ soluzione di NaOH 6 mol/L
albumina (Fluka, nr. 5’461)
⇒ soluzione d’albumina 20 g/L
alanina (Fluka, nr. 5’150)
⇒ soluzione d’alanina 20 g/L
pepsina (Fluka, nr. 77’163)
⇒ soluzione di pepsina 0,2 g/L
reagente al biureto (Merck, nr. 110’307)
2-propanolo (Merck, nr. 109’634)
ninidrina (Merck, nr. 106’762)
⇒ soluzione di ninidrina in 2-propanolo 2 g/L
cartina indicatrice universale pH 1-10 (Merck, nr. 109’525)
Unità 3:I composti organici
21
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
Procedimento
Soluzione d’albumina 20 g/L
Sciogliere 2 g d’albumina in 60 mL di soluzione d’acido cloridrico 0,1 mol/L e diluire con acqua fino a 100
mL. Conservare a circa 4°C.
Soluzione d’alanina 20 g/L
Sciogliere 2 g d’alanina in 60 mL di soluzione d’acido cloridrico 0,1 mol/L e diluire con acqua fino a 100
mL. Conservare a circa 4°C.
Soluzione di pepsina 0,2 g/L
Sciogliere 20 mg di pepsina in 60 mL di soluzione d’acido cloridrico 0,1 mol/L e diluire con acqua fino a 100
mL. Conservare a circa 4°C.
a) Saggio di un protíde
1.
2.
Versare nella provetta A 1 mL di soluzione d’albumina 20 g/L; nella provetta B, 1 mL di soluzione di
alanina; nella provetta C, 1 ml d’acqua.
In ogni provetta aggiungere 2 gocce di reagente al biureto e osservare il colore.
con albumina ⇒ color viola
b) Saggio di un aminoacido
1.
2.
3.
4.
Dividere in modo ideale una carta da filtro in tre parti e tracciare con la matita tre cerchi assegnando loro
le lettere A, B, C.
In A mettere una goccia di soluzione d’alanina; in B, una goccia di soluzione d’albumina; in C, una
goccia d’acqua. Essiccare la carta con l’asciugacapelli.
Aggiungere una goccia di soluzione di ninidrina sulle parti della carta corrispondenti ai cerchi.
Essiccare e scaldare la carta con l’asciugacappelli e osservare il colore.
con alanina ⇒ color viola
c) Idrolisi acida a pressione normale
1.
2.
3.
4.
5.
B.
Introdurre nella provetta grande 4 mL di soluzione d’albumina 20 g/L e 4 mL di soluzione d’acido
cloridrico 6 mol/L. Mescolare.
Prendere 2 mL di soluzione, versarla nella provetta A e coprire con parafilm.
Coprire la provetta grande con l’ampolla di raffreddamento e introdurla nel bagnomaria. Mescolare di
tanto in tanto con la bacchetta di vetro.
Prendere una goccia della soluzione della provetta A, diluirla in 10 mL d’acqua e misurare il pH.
Dopo 60 minuti raffreddare la soluzione della provetta grande, prelevare 2 mL e versarli nella provetta
Unità 3:I composti organici
22
Guida per il docente al programma di scienze naturali della classe III
6.
7.
6
8.
9.
anno 1998-1999
Versare la metà del contenuto della provetta A nella provetta A1. Far la stessa cosa con il contenuto della
provetta B nella provetta B1.
Alle soluzioni nelle provette A, B, A1, B1 aggiungere, goccia a goccia, la soluzione d’idrossido di sodio
mol/L fino a pH 7 o poco superiore.
Saggiare l’albumina nelle provette A e B.
Saggiare l’alanina nelle provette A1 e B1.
d) Idrolisi acida ad alta pressione
1.
2.
3.
4.
5.
la
6.
7.
8.
9.
10.
11.
12.
13.
Introdurre nella provetta grande 4 mL di soluzione d’albumina 20 g/mL e 4 mL di acido cloridrico 6
mol/L.
Prendere 2 mL di soluzione, versarla nella provetta A e coprire con parafilm.
Dividere la soluzione rimasta nella provetta grande in due provette di vetro comune.
Chiudere alla fiamma l’estremità delle due provette 11.
Porre le provette in un bicchiere coperto con un vetro d’orologio e scaldare nella stufa a 120°C durante
notte.
Con un tagliavetro aprire le provette e versare il contenuto in un bicchiere di 50 mL.
Introdurre tre punte di spatola (circa 3 g) di carbonato di sodio in un altro bicchiere di 50 mL.
Porre i due bicchieri di 50 mL in un bicchiere coperto con un vetro d’orologio e scaldare nella stufa a
120°C durante la notte 12.
Aggiungere 2 mL d’acqua al residuo contenuto nel bicchiere e mescolare.
Dividere la soluzione cosí ottenuta nelle provette B e B1.
Versare la metà del contenuto della provetta A nella provetta A1.
Saggiare l’albumina nelle provette A e B.
Saggiare l’alanina nelle provette A1 e B1.
e) Idrolisi enzimatica
1.
2.
3.
4.
5.
B.
6.
7.
8.
9.
11
12
Introdurre nella provetta grande 4 mL di soluzione d’albumina 20 g/L e 4 mL di soluzione di pepsina 0,2
g/L. Mescolare.
Prendere 2 mL di soluzione, versarla nella provetta A e coprire con parafilm.
Coprire la provetta grande con parafilm e introdurla nel bagno d’acqua (circa 37°C). Mescolare di tanto
in tanto con la bacchetta di vetro.
Prendere una goccia della soluzione della provetta A, diluirla in 10 mL d’acqua e misurare il pH.
Dopo 30 minuti raffreddare la soluzione della provetta grande, prelevare 2 mL e versarli nella provetta
Versare la metà del contenuto della provetta A nella provetta A1. Far la stessa cosa con il contenuto della
provetta B nella provetta B1.
Alle soluzioni nelle provette A, B, A1, B1 aggiungere, goccia a goccia, la soluzione di idrossido di sodio
fino a pH 7 o poco superiore.
Saggiare l’albumina nelle provette A e B.
Saggiare l’alanina nelle provette A1 e B1.
Si divide la soluzione in due provette per evitare di perderla tutta se la chiusura di una provetta dovesse rompersi in
seguito all’aumento della pressione del vapore acqueo (circa 2 bar, a 120°C).
Il carbonato di sodio reagisce con il cloruro d’idrogeno: Na2CO3 (s) + 2 HCl (g) → 2 NaCl (s) + H2O (g) + CO2 (g).
(6 mL HCl 6 mol/L → 36 mmol HCl → 18 mmol Na2CO3 → 1,9 g Na2CO3).
Unità 3:I composti organici
23
Guida per il docente al programma di scienze naturali della classe III
anno 1998-1999
Figura 1. Apparecchio per l’analisi del glucosio
Unità 3:I composti organici
24
Guida per il docente al programma di scienze naturali della classe III
olio d’oliva
anno 1998-1999
Ca(OH2)(aq)
Figura 2. Apparecchio per l’analisi dell’olio d’oliva
Figura 3. Ampolla di raffreddamento
Unità 3:I composti organici
25