Anatomia patologica del
muscolo
Prof.ssa Serenella Papparella
Dip. Patologia e Sanità animale
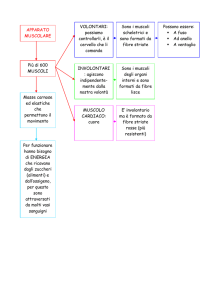
Il muscolo scheletrico svolge numerose funzioni
nell’ organismo quali: il mantenimento della postura , il movimento,
inclusa la locomozione. La contrazione ritmica dei muscoli respiratori
(intercostali e diaframma), essenziale per la vita.
Importanti per l’omeostasi corporea , per il metabolismo del glucosio
e nella regolazione della temperatura corporea.
La funzione del muscolo scheletrico è strettamente correlata alla
funzione del sistema nervoso periferico. Le caratteristiche fisiologiche
di una fibra muscolare- la sua capacità di contrazione ed il tipo di
metabolismo (ossidativo, anaerobio o misto)- non sono determinate
dalla cellula muscolare stessa, ma dal neurone responsabile della
sua innervazione.
Le cellula delle corna
anteriori, il suo assone
e le fibre muscolari
innervate rappresentano
una unità motoria.
I nervi sono costituiti da
fibre mielinizzate e hanno
origine nelle cellule delle
corna anteriori del midollo
spinale.
Le cellule muscolari sono cellule multinucleate di
considerevole lunghezza, che in alcuni animali possono
essere lunghe 1 metro.
I mionuclei sono posti perifericamente alla fibra
muscolare.
Si ritiene che i mionuclei non abbiano, o quasi, la
capacità di dividersi e quindi di rigenerare.
Alle miofibre sono associate le cellule
satelliti, note anche come mioblasti a
riposo. Queste cellule sono situate fra
la membrana plasmatica
(sarcolemma) e la lamina basale ed
accompagnano la fibra muscolare per
tutta la sua lunghezza.
Le cellule satelliti muscolari sono
capaci di dividersi, di fondersi e di
riformare miofibre mature. Perciò, in
condizioni favorevoli, le cellule
muscolari (miofibre), sono capaci di
riparare completamente il danno
subito.
Ogni miofibra è circondata da una lamina basale e, al di fuori
di questa, dall’endomisio, un esile strato di tessuto connettivo
contenente capillari.
Le miofibre si organizzano in fasci circondati dal perimisio,
uno strato di tessuto connettivo lievemente più robusto .
Il muscolo intero è avvolto da una fascia protettiva che si
fonde con i tendini muscolari, l’epimisio.
Tipologia Delle Fibre
Muscolari
La
maggior
parte
dei
muscoli
dei
mammiferi è costituita da un mosaico di
fibre, aventi caratteristiche funzionali
e metaboliche differenti.
Le proprietà metaboliche possono essere
determinate mediante degli indicatori
delle capacità ossidative e glicolitiche,
quelle contrattili attraverso l’attività
ATP-asica miosinica delle miofibrille.
Tipologia Delle Fibre Muscolari
Le fibre muscolari sono state distinte in
fibre di Tipo I o fibre rosse
(ad alto contenuto di mioglobina),
a contrazione lenta,
ridotta capacità di immagazzinare
glicogeno
sistemi enzimatici glicolitici poco
sviluppati.
intensa attività ossidativa
bassa attività ATPasica.
Tali fibre hanno un metabolismo
aerobico e consentono esercizi di
lunga durata, ma poco intensi.
ATP-ase pH9.4 fibre 1 (chiare);
fibre 2 (Scure)
Tipologia Delle Fibre Muscolari
fibre Tipo IIA fibre bianche, a contrazione rapida,
ossidative, apparato glicolitico notevolmente
sviluppato,
ridotto numero di mitocondri; alta
attività ATPasica miosinica.
fibre Tipo IIB sfibre a contrazione rapida,
non ossidative, notevole capacità di immagazzinare
glicogeno, apparato glicolitico ben sviluppato, numerosi
mitocondri.
Tali fibre hanno un metabolismo anaerobico e sono impegnate
negli sforzi intensi ma di breve durata.
ATPase pH 4,6 permette di
differenziare le fibre di tipo 2 in
2A (bianche) 2B (grigie). Le fibre 1
sono scure
Tipologia Delle Fibre Muscolari
Le fibre ad elevata attività ossidativa presentano un
maggior numero di mitocondri sub - sarcolemmatici ed
intermiofibrillari di quelle a bassa attività
ossidativa.
Nelle fibre a contrazione lenta sono presenti
abbondanti depositi di goccioline lipidiche, che
appaiono invece scarsi in quelle a contrazione rapida
ed alta attività ossidativa.
Tipologia Delle Fibre Muscolari
fibre di Tipo IIC
probabilmente rappresentano
un tipo primitivo di fibre
capace di differenziarsi in
fibre tipo I o II.
Si tratta di fibre di
transizione, numerose nei
soggetti giovani, rare negli
adulti.
La percentuale delle fibre
può essere modificata in modo
sostanziale con l’allenamento
e le fibre IIA e IIB sono
suscettibili di
interconversione.
Tipologia Delle Fibre Muscolari
Nel cane determinati muscoli:
temporali
masseteri
pterigoidei
tensori del velo palatino
tensori del timpano
Sono composti da un sottotipo di miofibre di tipo I,
da una speciale variante di miofibre di tipo II –
miofibre di tipo II M – che contengono una
particolare isoforma di miosina che li differenzia
dagli altri muscoli scheletrici.
La percentuale di ogni tipo di fibra varia da muscolo a
muscolo.
Le fibre di tipo 1 (a contrazione lenta, resistenti allo sforzo
protratto, ossidative) sono numerose in quei muscoli la cui
principale funzione è caratterizzata da una attività lenta e
prolungata, come quelli della postura. I muscoli di tipo 1,
posturali, sono spesso posti in profondità nell’arto. Nello
stesso muscolo, la percentuale di fibre di tipo 1 spesso
aumenta nelle porzioni più profonde.
I muscoli che si contraggono velocemente e per brevi
periodi di tempo, come quelli utilizzati per i movimenti
improvvisi, hanno più fibre di tipo 2B. Raramente ci sono
muscoli con un solo tipo di fibre (es. il vasto intermedio
ovino ha solo fibre di tipo 1).
Localizzare il disordine:
Muscolo, Nervo o Giunzione Neuromuscolare
NMJ
MUSCOLO
NERVO
MYASTHENIA GRAVIS
GNM normali
Esterase stain
GNM piccole
PATOLOGIE MUSCOLARI
Miopatie neuropatiche (Miopatie neurogene) determinate
secondariamente dagli effetti o dall’assenza
dell’innervazione.
Miopatie miopatiche (Miopatie propriamente dette)
determinate da alterazioni aventi come sede primaria le
miofibre
Segni Clinici della Malattia
Muscolare
Atrofia muscolare
Ipertrofia muscolare
Rigonfiamento Muscolare
Debolezza
Spasmo muscolare
Passo anomalo
Disfunzione esofagea (cane, camellidi)
DIAGNOSI DEI DISORDINI MUSCOLARI - MIOPATIE
La scelta di esaminare più attentamente il muscolo, sia con esami di
prelievi bioptici che con l’esame necroscopico, comporta il
riconoscimento degli indicatori di disfunzione neuromuscolare.
QUADRI CLINICI
La malattia muscolare si manifesta con quadri clinici variabili .
Le manifestazioni più comuni sono rappresentate da variazioni delle
masse muscolari, debolezza, e andatura anomala.
A secondo della natura del disordine, i segni clinici possono essere
localizzati, multifocali, o generalizzati.
Variazioni della massa muscolare sono facilmente identificabili con un
attento esame fisico.
L’ atrofia unilaterale si apprezza meglio comparando i muscoli di
entrambi i lati del corpo. Nei casi di atrofia generalizzata, è importante
ricordare la normale muscolatura della razza.
REPERTI CLINICO-PATOLOGICI
Il parametro più comunemente usato è
quello della creatinchinasi (CK), prima
chiamata creatinfosfochinasi (CPK).
Anche l’ aspartato amino transferasi (AST),
in passato conosciuta come transaminasi
glutammico ossalacetica, e la lattico
deidrogenasi sono rilasciate , ma non sono
indicatori specifici del danno muscolare,
poiché sono presenti in altri tessuti.
Poichè il CK ha una bassa soglia renale , esso è
escreto velocemente nelle urine.
L’emivita del CK circolante varia fra le specie , ma in
genere si aggira sulle 6-12 ore.
L’emivita della AST e LDH nel siero è molto più lunga,
e le concetrazioni sieriche di AST e LDH sono elevate
anche diversi giorni dopo l’insulto muscolare.
Anche la concentrazione sierica della alanino amino
transferasi (ALT) aumenterà in tutte le specie a causa
di un insulto di tipo necrotico del muscolo.
L’esame macroscopico del muscolo prevede una
valutazione del volume del muscolo (atrofico,
ipertrofico, o normale), del colore e della tessitura..
Le modificazioni del colore sono comuni. L’intensità del
colore rosso del muscolo varia secondo il tipo di
muscolo, l’età e la specie dell’animale, e l’estensione
della perfusione ematica.
Muscoli pallidi possono indicare necrosi o
denervazione ,ma anche i muscoli degli animali giovani
o anemici sono pallidi.
Strie chiare del muscolo spesso riflettono necrosi
miofibrale e mineralizzazione o presenza di collagene
o infiltrazione di tessuto adiposo e sono tra le lesioni
più significative all’esame anatomopatologico .
Infiltrazione di tessuto adiposo
NUTRITIONAL MUSCULAR DYSTROPHY
A VIT E/SE RESPONSIVE DISEASE
Una screziatura rosso scura del muscolo può indicare congestione,
emorragie, necrosi emorragica, infiammazione o diffusione di mioglobina in
seguito ad un danno massivo del muscolo o può dipendere dalla stasi
conseguente alla morte (congestione ipostatica). Strie emorragiche nel
diaframma spesso si osservano in animali morti per dissanguamento.
MIOSITE DA CLOSTRIDIUM CHAUVOEI
BLACKLEG
SINDROME COMPARTIMENTALE
L’accumulo di lipofuscina negli animali vecchi, specie nel bovino, può
determinare una colorazione marrone scuro del muscolo.
Aree nerastre a livello della fascia sono osservabili nei vitelli con
melanosi come reperto occasionale e nei cavalli vecchi a mantello
grigio per localizzazione di metastasi di melanomi dermici alla fascia
muscolare.
I parassiti dei muscoli possono essere macroscopicamente evidenti come
aree di piccole dimensioni, tondeggianti o ovalari, pallide e più compatte.
Un colore verdastro può essere dovuto alla presenza di una flogosi
eosinofila o a putrefazione avanzata.
CISTICERCOSI
SARCOSPORIDIOSI
Molto importante è l’esame della tessitura. Infiltrazione di grasso o necrosi
portano ad una minore consistenza del muscolo. Il tono muscolare può
essere diminuito o aumentato in seguito a denervazione. Una minore
consistenza può essere legata anche ad una non idonea conservazione del
muscolo o ad autolisi postmortem.
Per identificare le lesioni muscolari è spesso necessario l’esame
microscopico di più muscoli.
Nei casi di sospetta malattia neuromuscolare, prelievi bioptici
muscolari dovrebbero essere eseguiti dai muscoli attivi (lingua,
diaframma, muscoli intercostali e masticatori), dai muscoli prossimali
(tricipite laterale, bicipite femorale, semimembranoso, semitendinoso,
gluteo), e dai muscoli distali (estensore radiale del carpo, il tibiale
craniale).
Per eseguire il prelievo bioptico è più facile campionare alcuni muscoli
(es., tricipite laterale, bicipite femorale, tibiale craniale,
semimembranoso, e semitendinoso) grazie all’orientamento parallelo
delle miofibre.
La scelta del muscolo dal quale eseguire il prelievo bioptico dipende
dal disordine sospettato es.: i muscoli temporali e masseteri per la
diagnosi della miosite dei muscoli masticatori dei cani e miopatia dei
masseteri dei cavalli.
Per una corretta fissazione ed orientamento del
campione, si preferisce prelevare un cilindro di
muscolo di non più di 1 cm di diametro, con miofibre
disposte longitudinalmente.
Il muscolo mantiene la sua capacità di contrarsi anche
dopo la morte, per un tempo variabile, dipendente dallo
stato fisiologico del muscolo al momento della morte e
dall’intervallo post-mortem.
La contrazione del muscolo a contatto con il fissativo
causa l’artefatto più comune – le bande di contrazione.
La contrazione può essere prevenuta o almeno ridotta
usando delle pinze muscolari o ponendo il campione
su una superficie rigida, fissando gli estremi del
campione con suture, graffette, o pinze prima di
immergerlo nel fissativo
La diagnosi istologica
Appena prelevato, il muscolo
viene congelato immergendolo
in azoto liquido
(a una temperatura di -180
gradi).
Artefatti del congelamento
Muscolo fissato in formalina
I campioni non devono essere immersi in formalina o
in soluzione fisiologica, né devono essere
congelati, per evitare gravi danni alle fibre
muscolari (artefatti).
Il campione deve essere inviato al laboratorio
accompagnato da una mattonella refrigerante e da
una accurata scheda di segnalamento ed anamnesi
Vie di infezione
DIRETTA
Ferite penetranti
Iniezioni intramuscolari
Frattura ossea
Pressione esterna che causa
danno
EMATOGENA
Patogeni nel sangue, tossine,
autoanticorpi e complessi
immuni
Linfociti citotossici che causano
un danno immunomediato
Altre cellule infiammatorie
Altre cause di Disfunzione
Muscolare
FISIOLOGICHE
Eccessiva tensione che causa la rottura
del muscolo
Danno causato dall’esercizio
Perdita di innervazione o di apporto
ematico
Anomalie endocrine o elettrolitiche
GENETICHE
Errori congeniti del metabolismo
Difetti genetici delle componenti
strutturali delle miofibre
Difetti di sviluppo
NUTRIZIONALI/TOSSICHE
Deficit di selenio e/o vitamina E
Piante tossiche o prodotti delle piante
Additivi degli alimenti (ionofori)
MECCANISMI DI DIFESA
L’ epimisio che avvolge molti muscoli protegge dalle ferite penetranti e
dalla possibilità di estensione diretta di una infezione vicina.
Questa fascia può, comunque, danneggiare il muscolo nelle condizioni
che portano ad un aumento della pressione intramuscolare, causando
ipossia (sindrome compartimentale).
I macrofagi tissutali non si osservano nel muscolo normale, ma derivano
dai monociti circolanti e possono attraversare anche la membrana
basale intatta, fagocitare i detriti derivanti da parti di miofibre
danneggiate, permettendo così una rapida sostituzione dei miociti con le
cellule satelliti attivate.
I neutrofili e le altre cellule infiammatorie sono reclutate anch’esse dal
torrente ematico in risposta ad un insulto o ad una infezione.
L’estesa rete vascolare del muscolo include circoli collaterali estensivi
che rendono il muscolo relativamente resistente al danno ischemico
causato da trombosi e da tromboembolismo.
NECROSI E RIGENERAZIONE
La necrosi delle miofibre si osserva in diverse patologie.
Poiché le miofibre sono cellule multinucleate , la necrosi
segmentale è un evento frequente, con coinvolgimento di
uno o più segmenti contigui nella cellula.
La necrosi totale della fibra, per tutta la sua lunghezza, si
verifica solo in presenza di una pressione prolungata di
tutto il muscolo, per un trauma da compressione, o per
ischemia diffusa dovuta a pressione, o tromboembolismo di
una arteria di grosso calibro.
PATOLOGIA DEL TESSUTO MUSCOLARE
Miopatie miopatiche - aspetti morfologici:
Degenerazione
delle miofibre con
rigonfiamento,
perdita della
striatura,
formazione di
masserelle amorfe
nel sarcoplasma
PATOLOGIA DEL TESSUTO MUSCOLARE
Miopatie miopatiche - aspetti morfologici:
Necrosi
Necrosi (ialina) segmentale (degenerazione di Zenker)
1.
2.
3.
4.
È un processo di necrosi coagulativa che interessa il
sarcoplasma preservando il sarcolemma; è quindi
possibile la rigenerazione.
Sono considerati diversi gradi di questa necrosi:
Necrosi delle miofibrille (rabdomiolisi)
Necrosi delle miofibrille e del sarcoplasma
Necrosi che lascia indenni solo i nuclei delle cellule
satelliti e la lamina basale.
Necrosi che coinvolge il sarcolemma (es. ischemia) –
NON E’ POSSIBILE LA RIGENERAZIONE.
Degenerazione
ialina – fibre a
palloncino
PATOLOGIA DEL TESSUTO MUSCOLARE
Miopatie miopatiche - aspetti morfologici:
Necrosi segmentale (degenerazione di Zenker)
L’aumento del calcio intracellulare è il
meccanismo di innesco comune della necrosi in
tutte le cellule, e le miofibre contengono un alto
livello di ioni calcio nel reticolo sarcoplasmico.
Perciò le miofibre possono essere molto sensibili
alla necrosi calcio-indotta sia come risultato del
danno al sarcolemma che determina afflusso di
calcio extracellulare, sia dal danno al reticolo
sarcoplasmico
con
rilascio
dei
depositi
intracellulari di calcio.
Le miofibre mineralizzate, macroscopicamente, appaiono
come strie biancastre, gessose e istologicamente si
osservano depositi di una sostanza granulare o
cristallina, basofila all’interno delle miofibre.
Grossi focolai di calcificazione possono indurre una
reazione granulomatosa da corpo estraneo.
La mineralizzazione delle fibre deve essere considerata una
lesione aspecifica, indicativa solo della necrosi fibrale.
La mineralizzazione delle miofibre può essere confermata da
metodiche istochimiche come il rosso di alizarina e la von
Kossa.
Necrosi e fagocitosi(sarcoclastosi)
Poichè i mionuclei non possono dividersi, la
rigenerazione muscolare è possibile grazie
all’attivazione delle cellule satelliti.
Perciò, quando i macrofagi fagocitano i detriti
citoplasmatici, le cellule satelliti si attivano e
cominciano a dividersi per rigenerare le
miofibre necrotiche. Se la lamina basale della
fibra è ancora integra, rimarrà uno spazio
vuoto cilindrico o “tubo sarcolemmale”.
Rigenerazione
Se intatta, la lamina basale formerà una guaina cilindrica
per guidare i mioblasti proliferanti ed evitare l’ingresso di
fibroblasti.
In poche ore, i mioblasti rigeneranti di un frammento di
fibra si fonderanno con quelli della parte opposta per
formare miotubuli e in alcuni giorni saranno prodotti
filamenti spessi e sottili che matureranno formando
miofibre e ripristineranno l’integrità delle miofibre.
Se la lamina basale non è integra, i miotubi possono
riparare se la discontinuità non è superiore ai 2-4 mm , se i
due monconi sono più lontani la riparazione avverrà per
fibrosi
In sintesi, la possibilità che i processi rigenerativi si verifichino dipende:
(1) dalla presenza di una lamina basale integra e (2) dalla presenza di
cellule satelliti vitali.
Pertanto, le miofibre con necrosi segmentale e con lamina basale
integra, come nelle miopatie metaboliche, nutrizionali, tossiche,
rigeneranno con successo.
Se invece come nel caso di lesioni da calore, flogosi intensa, o infarto,
vengono distrutte le cellule satelliti, la riparazione avverrà
principalmente per fibrosi.
Se la lesione muscolare è tale da creare un danno alla lamina basale
della miofibra, ma non alle cellule satelliti, la rigenerazione sarà
sempre inefficace. Poiché la lamina basale non è integra, non c’è il
miotubulo che guiderà i mioblasti che proliferano da ciascun moncone.
La proliferazione dei mioblasti, in queste condizioni, porterà alla
formazione di cellule muscolari giganti .
Le citochine rilasciate dalle miofibre attivano quei
segnali che portano all’ infiltrazione dei macrofagi e
alla rigenerazione, ma contribuiscono anche all’
attivazione dei fibroblasti interstiziali.
Il collageno è anelastico, e quindi aree vaste di fibrosi
riducono inevitabilmente la capacità del muscolo a
contrarsi e a stendersi.
La fibrosi dei muscoli della locomozione spesso porta
ad una evidente irregolarità dell’andatura.
Poichè la necrosi segmentale e la rigenerazione sono il
risultato comune di un’ampia varietà di insulti (es.
sforzo, deficit di selenio, e lesioni tossiche), una
diagnosi istologica di “necrosi segmentale” non aiuta a
definire la causa della malattia.
La classificazione della lesione sulla base della
distribuzione (focale, multifocale, localmente estensiva,
e diffusa e la durata (acuta, subacuta, cronica) è
risultata molto utile per determinare la possibile causa
della necrosi segmentale.
la necrosi in monofasica e multifasica. Le lesioni
monofasiche sono allo stesso stadio ed indicative di unico
insulto.
Le lesioni polifasiche indicano un processo degenerativo
attivo. In tal modo una lesione focale monofasica potrebbe
essere il risultato di un singolo evento traumatico, come una
iniezione intramuscolare . Una lesione monofasica multifocale
potrebbe dipendere da uno sforzo muscolare prolungato
(miopatia da sforzo) o da una tossina assunta con il cibo.
Invece, se l’insulto è ripetuto o continuo, come accade nelle
distrofie muscolari, nel deficit da selenio, o nell’assunzione
continua di una sostanza tossica, nuove lesioni (necrosi
segmentale) coesisteranno con il processo rigenerativo;
quindi la malattia sarà multifocale e polifasica
Il termine “rabdomiolisi” si incontra spesso , soprattutto in ambito
clinico, e in associazione a lesioni derivate dall’esercizio
(rabdomiolisi da sforzo) negli uomini, cavalli, e cani.
Tecnicamente, rabdomiolisi significa semplicemente necrosi (lisi)
del muscolo striato. Questo termine fu coniato anni fa per
sostituire quello di mioglobinuria, entità clinica caratterizzata da un
grave danno muscolare associato al rilascio di mioglobina che
determina una colorazione rosso scura delle urine.
Pertanto con il termine rabdomiolisi generalmente si indica la
presenza di una grave miopatia degenerativa con necrosi massiva
delle fibre muscolari .
Nei cavalli, è descritta una entità clinica ben conosciuta, la
rabdomiolisi da sforzo, nella quale il danno muscolare è indotto
dall’esercizio . Nella rabdomiolisi da sforzo ricorrente il danno
muscolare deriva da insulti ripetuti durante l’ esercizio.
VARIAZIONI DEL DIAMETRO FIBRALE
Il diametro normale delle miofibre è variabile e dipende dal tipo di
fibra, dal muscolo esaminato, dalla specie, e dall’età dell’animale.
In alcune specie (es. il cavallo, gatto, uomo) si distinguono tre tipi
di fibre sulla base dei diametri.
Le fibre di tipo 1 sono le più piccole, le fibre di tipo 2B sono le più
grosse, e quelle di tipo 2 A hanno diametri intermedi.
I differenti diametri in parte riflettono il fabbisogno ossidativo delle
fibre; l’ossigeno diffonde più facilmente all’interno di fibre di
diametro piccolo. Nel cane, tutti i tipi di fibre sono ossidative e il
diametro delle fibre è di gran lunga più uniforme.
ATROFIA
Si intende per atrofia sia la riduzione del diametro di un
muscolo nel suo complesso sia la riduzione del diametro
di una singola miofibra.
L’ atrofia delle fibre muscolari può dipendere da processi
fisiologici e metabolici, e da denervazione. Nella maggior
parte dei casi, l’atrofia muscolare è reversibile, purchè la
causa sia risolta.
Il tipo di fibra che va incontro ad atrofia varia e dipende
dalla causa, perciò la tipizzazione delle fibre è necessaria
per una diagnosi definitiva.
le fibre di tipo 2 sono maggiormente soggette ad atrofia in
molteplici condizioni
ATROFIA MUSCOLARE FISIOLOGICA
La riduzione del diametro fibrale, e quindi di tutta la
massa muscolare, è una risposta fisiologica alla
inattività (atrofia da disuso), alla cachessia, e
all’invecchiamento.
Le fibre di tipo 2 sono preferenzialmente affette .
L’atrofia da disuso è un processo che evolve
lentamente e si osserva solo nei muscoli che non si
contraggono normalmente, come si verifica nelle
zoppie gravi , o in un arto immobilizzato o ingessato.
L’atrofia da disuso è spesso asimmetrica.
L’atrofia dovuta a cachessia può essere marcata, specie nei casi
in cui è associata a cancro, poiché gli alti livelli circolanti di tumor
necrosis factor alterano il metabolismo muscolare, favorendo i
processi catabolici piuttosto che quelli anabolici.
Anche l’ atrofia da cachessia si sviluppa lentamente e causa una
atrofia muscolare simmetrica.
L’atrofia muscolare senile può essere considerata una forma più
lieve di cachessia. Starvazione, malnutrizione, ed anche malattie
renali e cardiache croniche possono causare atrofia.
ATPasi PH 9,4
ATROFIA DA DISENDOCRINOPATIE
L’atrofia delle fibre di tipo 2, che causa atrofia simmetrica, si
osserva generalmente in varie disendocrinopatie.
Le più comuni sono l’ipotiroidismo e l’ipercortisolismo nei cani. I
cavalli anziani con disfunzioni ipofisarie o tumori (che portano a
sindrome di Cushing ) spesso sviluppano atrofia muscolare,
prevalentemente delle fibre di tipo 2.
I meccanismi patogenetici che portano all’atrofia delle fibre di tipo
2 non sono chiari, ma le miofibre posseggono numerosi recettori
sulla superficie per diversi ormoni.
ATROFIA DA DENERVAZIONE
conosciuta con il termine improprio di “atrofia
neurogena” è piuttosto comune in medicina veterinaria.
Il normale diametro delle fibre dipende da fattori trofici
generati dal nervo associato, integro.
La perdita dell’impulso nervoso porta rapidamente ad
atrofia del muscolo, e in poche settimane il muscolo,
completamente denervato, può perdere circa la metà
della massa muscolare.
Questo effetto trofico non dipende dall’attività contrattile
perché l’ atrofia da denervazione non si osserva nei
disordini della giunzione neuromuscolare, come il
botulismo e la miastenia grave.
In questi disordini, c’è un disturbo della trasmissione
neuromuscolare, ma il nervo è integro; perciò il muscolo
risulta innervato.
Neuropatie generalizzate o neuronopatie
determineranno un’atrofia estesa e simmetrica.
Generalmente, in presenza di un danno ad uno
specifico nervo, si osserva atrofia muscolare
asimmetrica. Un esempio è l’emiplegia laringea
dell’equino (corneggio) secondaria ad una lesione del
nervo laringeo ricorrente sinistro .
DEFICIT NUTRIZIONALI
Comuni negli animali da reddito, come bovini, cavalli,
pecore e capre
Sebbene si pensi che la miopatia nutrizionale degli animali
da reddito sia dovuta ad un deficit di vitamina E e selenio,
nella maggior parte dei casi la degenerazione delle
miofibre è causata da deficit di selenio.
Il selenio è un elemento vitale del sistema glutatione
perossidasi, che aiuta a proteggere le cellule dal danno
ossidativo. L’alto fabbisogno di ossigeno associato
all’ attività contrattile del muscolo rende il muscolo striato,
sia scheletrico che cardiaco, particolarmente sensibile al
danno ossidativo.
Si pensa che questa miopatia sia dovuta ad un
consumo dei sistemi enzimatici per una continua
produzione intracellulare di radicali liberi, più che ad un
deficit.
Le membrane cellulari perdono la capacità di
mantenere un gradiente differenziale per uno o più ioni.
Aumenta il flusso di ioni Ca dal compartimento
extracellulare al citosol. Tale sovraccarico di Ca
determina necrosi segmentale.
I neonati, che dipendono dalle riserve di selenio
accumulate durante la gestazione, sono spesso affetti
da questa miopatia.
I muscoli appaiono pallidi per la necrosi , da qui il nome
della patologia “malattia del muscolo bianco”.
L’osservazione di un muscolo pallido non identifica la
necrosi causata da deficit nutrizionale; perciò si preferisce
la denominazione di miopatia nutrizionale.
I bovini ed i giovani vitelli, sono suscettibili a miopatie
nutrizionali dovute a deficit di selenio o (più raramente) a
deficit di vitamina E.
Nei cavalli si osserva il coinvolgimento dei muscoli
masseteri e temporali, (“miosite del mascellare”).
Nel bovino sono più comunemente colpiti i muscoli della
postura ed i muscoli della locomozione.
I muscoli dei bovini affetti, mostrano aree rosa pallido bianche, spesso irregolarmente distribuite.
MIOSITI BATTERICHE
Le infezioni batteriche del muscolo non sono frequenti, soprattutto negli
animali da reddito.
I batteri possono causare lesioni suppurative e necrotizzanti,
suppurative e sclerosanti, emorragiche, o granulomatose .
Le infezioni batteriche possono derivare da impianto diretto di piogeni
in ferite penetranti o con iniezioni, per via ematogena, o per diffusione
da una lesione adiacente suppurativa come una cellulite, fascite,
tendinite, artrite o osteomielite .
Diversi batteri del genere Clostridi, soprattutto il Clostridium
perfringens, Clostridium chauvoei, Clostridium septicum, e Clostridium
novyi, producono tossine che causano un danno alle miofibre e ai
vasi intramuscolari, con conseguenti lesioni necrotiche emorragiche .
In genere si sviluppa uno stato tossiemico, spesso letale. La miosite da
Clostridi è comune nei bovini e nei cavalli.
La miosite da Clostridi nel cavallo è chiamata gangrena gassosa e
carbonchio sintomatico (“blackleg”) nel bovino .
I batteri piogeni nel muscolo di solito causano una lesione suppurativa
localizzata e necrosi delle miofibre. La lesione può guarire o si può
formare un ascesso.
In alcuni casi, l’infezione può diffondersi ai piani fasciali . Ad esempio,
una iniezione intramuscolare non sterile, nei muscoli glutei del bovino,
può causare un’infezione che si estende alla fascia muscolare del
femore e della tibia e fistolizzarsi sulla superficie del tarso.
Streptococcus zooepidemicus (cavalli), Arcanobacterium pyogenes
(bovino e pecora), e Corynebacterium pseudotuberculosis (cavalli,
pecora e capra) sono agenti eziologici di ascessi muscolari.
Dopo una ferita penetrante, i gatti possono andare incontro ad una
cellulite causata da Pasteurella multocida che si estende ai muscoli
vicini.
Miositi da clostridi (edema maligno, gangrena gassosa)
La miosite da Clostridi, nel cavallo, è spesso un disordine fatale.
causato da tossine, prodotte da diverse specie di clostridi, grossi
bacilli anaerobi, Gram-positivi.
Clostridium septicum è l’agente eziologico che più comunemente
causa miosite nel cavallo, ma anche Clostridium perfringens tipo A
ed E, Clostridium chauvoei, Clostridium novyi possono causare
infezioni. L’infezione può dipendere anche da più specie di clostridi.
I Clostridi sono organismi ubiquitari che formano spore nel suolo e
nel tratto gastroenterico.
A differenza del bovino, dove un trauma, anche non penetrante,
che causa un ematoma muscolare e condizioni di anaerobiosi
possono attivare le spore di clostridi già presenti nel muscolo, nel
cavallo , la miosite da clostridi è virtualmente sempre secondaria
alla penetrazione di un corpo estraneo.
Molto spesso la miosite insorge in corrispondenza del sito di
iniezione di una sostanza non antibiotica, ma infezioni sono
possibili anche in corrispondenza di punture inferte da legni e di
composti irritanti somministrati per via endovenosa che provocano
vasculopatie .
È probabile che i clostridi, dal tratto gastroenterico, possano
colonizzare il muscolo danneggiato. Ciò spiegherebbe la
frequente osservazione di una sintomatologia colica, prima dello
sviluppo di miositi da clostridi.
I segni clinici sono caratterizzati da una presentazione acuta con
calore, gonfiore e dolore di un gruppo muscolare prossimo alla
fascia, con febbre, depressione, disidratazione e anoressia.
Se c’è necrosi muscolare, la concentrazione nel siero di CK e AST
può essere debolmente o moderatamente aumentata.
La morte per tossiemia e /o setticemia spesso subentra nelle 48
ore.
I muscoli affetti e la fascia attigua sono rigonfi e spesso
emorragici, con edema, flogosi suppurativa, e necrosi, ed inoltre
può essere presente gas .
Non si osserva vasculite. I bacilli Gram + , caratteristici di
Clostridium spp., sono generalmente dimostrabili nei tessuti
danneggiati.
Carbonchio sintomatico (“blackleg”)
Questa malattia, dovuta a Clostridium chauvoei, è economicamente
enormemente importante perché è la più comune nei bovini da carne.
Il carbonchio sintomatico può colpire anche le bovine da latte, in
particolare quelle allevate in stalle all’aperto.
Clostridium chauvoei è un bacillo anaerobio, Gram-positivo, sporigeno.
Le sue spore sono ubiquitarie nel suolo e, dopo l’ingestione, le spore
sono capaci di attraversare la mucosa intestinale, entrare nel circolo
sanguigno, ed essere trasportate ai muscoli scheletrici. Le spore
rimangono dormienti fino a quando un trauma muscolare, anche
localizzato, nei box o per traumi in mangiatoie affollate, determina
danno muscolare ed ipossia localizzata. L’ anaerobiosi, presente
nell’area dell’insulto, permette alle spore di attivarsi e ai batteri di
proliferare e produrre tossine (Table 15-4) con lesioni a livello dei capillari
ed emorragie, edema e necrosi delle miofibre .
La presentazione più comune è la morte acuta. I segni
prima della morte sono riferibili a tossiemia; alla
presenza di gruppi muscolari aumentati di volume,
caldi e crepitanti alla palpazione, e alla febbre. I valori
sierici di CK e AST risultano aumentati. I muscoli , la
fascia muscolare e il tessuto sottocutaneo mostrano
emorragie ed edema localmente esteso, spesso con
crepitii dovuti a bolle di gas. Le fibre muscolari
necrotiche si presentano di colore rosso scuro , rossonerastro. Le lesioni appaiono o umide ed essudative
(lesioni iniziali) o asciutte (lesioni tardive)
Ci può essere coinvolgimento del miocardio . È
tipico un caratteristico odore di burro rancido,
dovuto all’acido butirrico. Le emorragie e
l’edema si possono osservare anche in altre
parti del corpo e sono dovute alla tossiemia. Le
carcasse affette vanno rapidamente in autolisi,
verosimilmente dovuto agli effetti delle tossine
prodotte dai clostridi sui tessuti e alle alte
temperature corporee prima della morte.
Batteri piogeni
I bovini sono predisposti allo sviluppo di ascessi causati da batteri
piogeni, più comunemente l’ Arcanobacterium pyogenes.
Gli ascessi nel muscolo si osservano più generalmente nell’arto
posteriore. L’ arto affetto è gonfio e dolente per la presenza di
una cellulite e di una miosite necrotizzante diffusa.
Arcanobacterium pyogenes è un batterio ubiquitario che può
infettare il muscolo attraverso due vie di infezione: con
contaminazione diretta di ferite e delle sedi di iniezioni e per via
ematogena.
I batteri si possono ritrovare nell’apparato riproduttivo dei bovini e
nel rumine, e si pensa che Arcanobacterium pyogenes , per una
batteriemia transitoria dopo il parto o in seguito a lesioni della
parete del rumine, possa colonizzare il muscolo leso.
Le lesioni possono variare e dipendono dalla virulenza del
batterio e dal tempo di insorgenza. Infatti sono osservabili o degli
ascessi incapsulati intramuscolari adiacenti al sito di iniezione o
una cellulite purulenta diffusa che si estende coinvolgendo i
tessuti e i piani fasciali.
La cellulite può essere molto grave tanto da coinvolgere la
maggior
parte
della
muscolatura
dell’
arto
affetto.
Macroscopicamente, gli ascessi sono ripieni di pus denso, di
colore giallo-verdastro, con odore putrido.
In caso di cellulite, il pus infiltra i piani fasciali e le guaine
perimisiali dei muscoli.
L’infiammazione si estende alle miofibre vicine portando a
mionecrosi e successivamente sostituzione con tessuto fibroso. Il
colore verdastro dell’essudato è caratteristico e spesso, nelle
sezioni dei tessuti, e nei preparati citologici sono osservabili
piccoli batteri pleomorfi Gram positivi.
L’ Arcanobacterium pyogenes è facilmente isolabile in culture in
aerobiosi.
E’ anche possibile che gli anticorpi per la proteina M dello streptococco
crossreagiscano con la miosina dei muscoli scheletrici e cardiaci e
causino un danno diretto.
Segni di miopatie spesso accompagnano i segni sistemici della
porpora streptococcica nei cavalli ( per esempio depressione, febbre,
edema , petecchie ed ecchimosi, leucocitosi, aumento del fibrinogeno
sierico ed anemia), ma la miopatia può anche essere la prima
presentazione clinica della malattia.
I cavalli affetti sono deboli, possono mostrare passo corto e decubito.
Spesso si osserva mioglobinuria e si accompagna a valori molto alti
nel siero di CK ed AST.
Molti muscoli sono coinvolti (all’ opposto della miosite da Clostridi che
ha una estensione locale), e i muscoli affetti presentano emorragie
multifocali o localmente estese ed edema, che disseca le fibre
muscolari necrotiche.
Le lesioni macroscopiche sono simili a quelle viste nella miosite da
clostridi , ma le lesioni non contengono bolle di gas.
Pochi sono i batteri agenti causali di lesioni granulomatose,
singole o multiple (miosite focale o multifocale granulomatosa).
Generalmente si tratta di lesioni causate da Mycobacterium bovis
(tuberculosis), nel bovino e nei maiali.
La miosite cronica nodulare sclerosante dei muscoli della lingua
nel bovino è causata dall’ Actinobacillus lignieresii (lingua di legno)
o dall’ Actinomyces bovis, agente eziologico dell’ Actinomicosi
(“lumpy jaw”).
Una lesione simile è causata dallo Staphylococcus aureus,
conosciuta come botriomicosi, si può osservare nei cavalli e nei
maiali. Essa generalmente è dovuta ad una ferita e ha molte
localizzazioni.