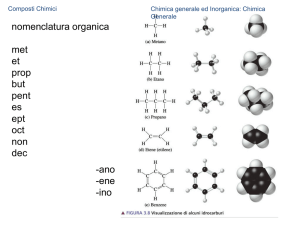
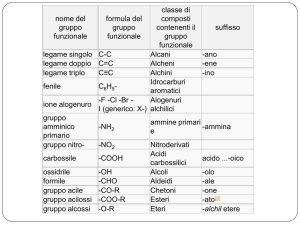
Chimica Sistematica:
Calcogeni
Chimica Generale ed Inorganica
Chimica Inorganica 1
prof. Dario Duca
Chimica Sistematica: Calcogeni
Chimica Generale ed Inorganica: Chimica Inorganica 1
gruppo 16
aspetti generali
• O2, incolore, costituisce ca. il 20% dell’atmosfera terrestre e il 46% in peso
della crosta terrestre
• anche lo S, giallo, è un elemento molto diffuso
• il Se è usato in xerografia, nell’industria dei semiconduttori, delle celle
fotoelettriche della gomma e del vetro (colorato)
• il Se è un elemento particolarmente tossico ma in tracce è essenziale per gli
esseri viventi (enzima glutationoperossidasi)
• il Te è di minore importanza commerciale - ha applicazioni nell’industria della
gomma, dei vetri (colorati), in catalisi e nell’industria metallurgica nella
formazione di leghe
• tutti gli isotopi radioattivi del Po sono radioattivi - è usato come additivo nei
propellenti missilistici (ha un decadimento particolarmente esotermico)
• lo S era chiamato “pietra di fuoco” già nella bibbia - è stato un elemento
fondamentale nelle applicazioni alchemiche
• la polvere da sparo si ottiene mescolandolo con KNO3 e C.
Chimica Sistematica: Calcogeni
Chimica Generale ed Inorganica: Chimica Inorganica 1
gruppo 16
aspetti generali
• l’O2 viene isolato nel 1770 da Scheele e Priestley per arrostimento di HgO
• Te e Se sono isolati nel 1782 e 1817
• il Po è scoperto (1898) da M. Curie - da minerali di U
• il Se e il Te hanno diverse forme allotropiche
• il Se non è un buon è un foto-conduttore
• il Po è un metallo e ha 2 forme allotropiche
Chimica Sistematica: Calcogeni
Chimica Generale ed Inorganica: Chimica Inorganica 1
gruppo 16
ossigeno
• in natura esiste O2 e in tracce O3
• l’O3 è un agente ossidante secondo solo a F2
• O2 è paramagnetico allo stato fondamentale e diamagnetico allo stato eccitato
• l’O2 si porta allo stato eccitato per assorbimento di fotoni durante la collisione
di due molecole - allo stato liquido il fenomeno è evidente e dato l’assorbimento
a 631 e 474 nm si ha una corrispondente colorazione azzurrognola
• O2 è essenziale alla vita di “quasi” tutti gli esseri viventi
• O3 assorbe nell’ultravioletto (200 e 360 nm) costituisce uno schermo dalle
radiazioni cosmiche - ozonosfera (parte della stratosfera)
Chimica Sistematica: Calcogeni
Chimica Generale ed Inorganica: Chimica Inorganica 1
gruppo 16
ossigeno
nell’alta atmosfera l’ozono si forma dall’ossigeno che viene
ripristinato per effetto della radiazione ultravioletta - il ciclo determina
un equilibrio
per effetto di inquinanti (ad es.
NO2 o i derivati fotolitici di CFC)
viene catalizzata la
decomposizione di O3
accanto, è riportato un “modello di
laboratorio” della decomposizione
catalitica dell’ozono
Chimica Sistematica: Calcogeni
Chimica Generale ed Inorganica: Chimica Inorganica 1
gruppo 16
ossigeno
Chimica Sistematica: Calcogeni
Chimica Generale ed Inorganica: Chimica Inorganica 1
gruppo 16
allotropi dello zolfo
• lo S è l’elemento che mostra il maggior numero di allotropi
• il più stabile e la specie S8-α
Chimica Sistematica: Calcogeni
Chimica Generale ed Inorganica: Chimica Inorganica 1
gruppo 16
viscosità dello zolfo
• lo S al riscaldamento mostra caratteristiche variazioni della viscosità e colore
(dal giallo al rosso)
• la lunghezza della catena è
proporzionale all’aumento di
viscosità
• alla cuspide si hanno catene
di ca. 200000 atomi
• sopra i 180°C si comincia ad
avere rottura delle catene e si
forma S3 - rosso
• il fuso gettato in acqua
produce un materiale
gommoso malleabile
• il materiale
torna giallo sostanzialmente
formato da S8-α
Chimica Sistematica: Calcogeni
Chimica Generale ed Inorganica: Chimica Inorganica 1
gruppo 16
acido solforico
• l’acido solforico H2SO4 è il più diffuso prodotto industriale del mercato
americano
• oggi la sua sintesi comincia con la sintesi dell’anidride solforosa SO2
• l’anidride solforosa viene ossidata (su V2O5 a riciclo) ad anidride solforica SO3
• l’idratazione dell’anidride solforica porta alla formazione di acido solforico
Chimica Sistematica: Calcogeni
Chimica Generale ed Inorganica: Chimica Inorganica 1
gruppo 16
acido solforico
l’acido solforico
• formato su acqua si nebulizza
• un processo più efficiente prevede l’assorbimento dell’anidride solforica su acido
solforico - questo processo porta alla formazione dell’acido disolforico H2S2O7 - da
non confondere con l’acido ditionico H2S2O6
• l’idratazione dell’acido disolforico porta finalmente all’acido solforico
l’acido solforico:
• reagisce esotermicamente con l’acqua - e con tutto ciò che la contiene
(carbonizza gli zuccheri)
• è un ottimo solvente anidro:
Chimica Sistematica: Calcogeni
Chimica Generale ed Inorganica: Chimica Inorganica 1
gruppo 16
composti contenenti ossigeno e zolfo
tavola periodica moderna
Chimica Generale ed Inorganica
Chimica Inorganica 1
prof. Dario Duca