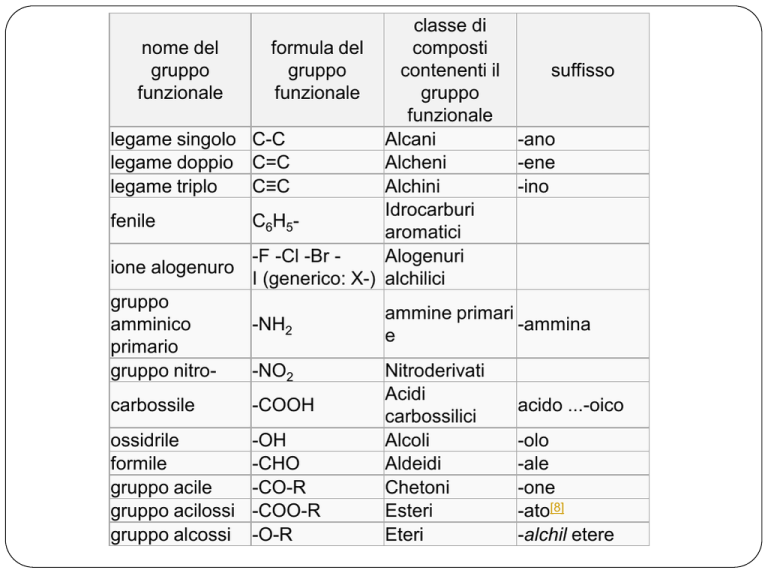
classe di
composti
contenenti il
suffisso
gruppo
funzionale
legame singolo C-C
Alcani
-ano
legame doppio C=C
Alcheni
-ene
legame triplo
C≡C
Alchini
-ino
Idrocarburi
fenile
C6H5aromatici
-F -Cl -Br Alogenuri
ione alogenuro
I (generico: X-) alchilici
gruppo
ammine primari
amminico
-NH2
-ammina
e
primario
gruppo nitro-NO2
Nitroderivati
Acidi
carbossile
-COOH
acido ...-oico
carbossilici
ossidrile
-OH
Alcoli
-olo
formile
-CHO
Aldeidi
-ale
gruppo acile
-CO-R
Chetoni
-one
gruppo acilossi -COO-R
Esteri
-ato[8]
gruppo alcossi -O-R
Eteri
-alchil etere
nome del
gruppo
funzionale
formula del
gruppo
funzionale
Reazioni Chimiche
Chimica generale ed Inorganica: Chimica Generale
Reazione tra ossido di ferro ed alluminio metallico
Fe(III) + Al ➝ Al(III) + Fe
Reazioni Chimiche
Chimica generale ed Inorganica: Chimica Generale
evidenza dell’occorrenza di una reazione
FIGURA 4-1 Precipitazione del cromato d’argento
Reazioni Chimiche
Chimica generale ed Inorganica: Chimica Generale
evidenza dell’occorrenza di una reazione
FIGURA 4-1 Precipitazione del cromato d’argento
Equazione chimica
Monossido di azoto + ossigeno biossido di azoto
NO + O2 NO2
Reazioni Chimiche
Equazione bilanciata
bilancio di una equazione
coefficienti stechiometrici
Chimica generale ed Inorganica: Chimica Generale
Reazioni Chimiche
Chimica generale ed Inorganica: Chimica Generale
Equazione bilanciata
fattore stechiometrico
Reazioni Chimiche
Equazione bilanciata
Chimica generale ed Inorganica: Chimica Generale
altre notazioni
(sv)
Reazioni Chimiche
Chimica generale ed Inorganica: Chimica Generale
dissoluzione di un metallo in acido
FIGURA 4-4 La reazione 2 Al(s)+6 HCl(aq) →2 AlCl3(aq)+3 H2(g)
Al ( s ) HCl( aq) AlCl 3( aq) H 2 ( g )
Al ( s ) 3HCl( aq) AlCl 3( aq) H 2 ( g )
3
Al ( s ) 3HCl( aq) AlCl 3( aq) H 2 ( g )
2
2 Al( s ) 6 HCl( aq) 2 AlCl 3( aq) 3H 2 ( g )
Reazioni Chimiche
Chimica generale ed Inorganica: Chimica Generale
FIGURA 4-6 Preparazione di K2CrO4 0.250 M - L’Esempio 4-9 illustrato
Reazioni Chimiche
Chimica generale ed Inorganica: Chimica Generale
FIGURA 4-7 Visualizzando la diluizione di una soluzione
diluizione:
MiVi=ni=nf=MfVf
Reazioni Chimiche
Chimica generale ed Inorganica: Chimica Generale
Reazioni Chimiche
Chimica generale ed Inorganica: Chimica Generale
agente
limitante
FIGURA 4-10 Determinazione del reagente limitante per la reazione
resa teorica
reale
percentuale
Reazioni Chimiche
Chimica generale ed Inorganica: Chimica Generale
Bilanciare le seguenti equazioni chimiche
Esercizio 108
Na2SO4(s) + C(s) Na2S(s) + CO(g)
HCl(g) + O2(g) H2O(l) + Cl2(g)
PCl5(s) + H2O(l) H3PO4(aq) + HCl(aq)
PbO(s) + NH3(g) Pb(s) + N2(g) + H2O(l)
Mg3N2(s) + H2O Mg(OH)2(s) + NH3(g)
1. Il ferro metallico reagisce con il cloro gassoso producendo cloruro ferrico.
Quante moli di cloruro ferrico si ottengono quando 7.26 moli di cloro gassoso
reagiscono con un eccesso di ferro?
2. Che massa in grammi di O2 si ottiene dalla decomposizione 43.4g. Di
KClO3?
KClO3 KCl + 3O2












