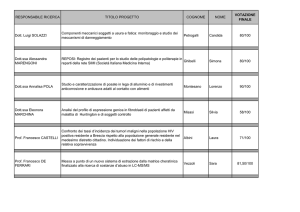
CONSIDERAZIONI SULLA PRESENZA DI COMPOSTI DI ZINCO E RAME IN RIFIUTI
COSTITUITI DA CENERI PESANTI DA TERMOVALORIZZATORE RSU .
VALUTAZIONI SU CLASSE H8/H4.
Analisi del ciclo produttivo e tipologie di residui prodotti
A seguito del processo di combustione dei rifiuti solidi urbani , vengono generati diversi materiali residui
allo stato liquido o solido, insieme ad effluenti gassosi.
I residui da incenerimento o termovalorizzazione dei rifiuti comprendono:
• Ceneri pesanti o scorie di fondo (bottom ash), che consistono principalmente di materiale grossolano non
combustibile e materia organica, raccolte all’uscita della camera di combustione in un recipiente di
raffreddamento;
• Ceneri dalla griglia (grate siftings), che includono materiale relativamente fine passante attraverso le
maglie delle griglie e raccolto al di sotto della camera di combustione in apposite tramogge. Sono
solitamente combinate alle ceneri pesanti, pertanto nella maggior parte dei casi non è possibile separare i
due flussi; assieme alle ceneri pesanti costituiscono il 20-30% in massa del rifiuto iniziale su base umida;
• Ceneri da caldaia e ceneri dell'economizzatore (boiler and economizer ash), che rappresentano la frazione
grossolana del particolato trasportato dai gas di scarico dalla camera di combustione e raccolto nella
sezione di recupero del calore. Questa corrente può costituire fino al 10% del rifiuto iniziale su base umida;
• Ceneri leggere o volanti (fly ash), particolato fine rimasto nei gas effluenti al di sotto delle unità di
recupero del calore, vengono rimosse prima di ulteriori trattamenti degli effluenti gassosi. La quantità di
ceneri leggere prodotta da un inceneritore è dell’ordine dell’1-3% della massa di rifiuto in ingresso su base
umida;
• ceneri volanti dal trattamento fumi, che includono il materiale particolato catturato dopo l’iniezione del
reagente nelle unità di trattamento del gas prima dello scarico in atmosfera, talvolta comprendono anche
fly ash. Questo residuo può essere solido, liquido o fangoso, a seconda che i processi adottati siano a secco,
a semi -secco o ad umido. Tali residui sono generalmente compresi in un intervallo del 2-5% del rifiuto
iniziale su base umida.
Da un punto di vista qualitativo le caratteristiche di principale interesse ambientale riguardano la differente
distribuzione di metalli pesanti e microinquinanti organoclorurati nelle diverse frazioni di residui, nonché le
mobilità dei contaminanti rilasciati in ambiente acquoso.
[Riferimento(1)]
Rabe2.1: Presenza di metalli pesanti nelle scorie (metallo As Cd Cr Hg Ni
meta
Il fattore discriminante le diverse frazioni di residui è rappresentato dalla differente distribuzione di metalli
pesanti.
Gli elementi meno volatili caratterizzati dalle temperature di ebollizione più elevate rimangono nelle ceneri
pesanti e nelle ceneri di griglia. Al contrario, a causa della volatilizzazione degli elementi con temperature di
ebollizione più basse (Cd, Hg, As, Pb e Zn) e conseguente condensazione, le ceneri di caldaia, le ceneri
leggere e i residui di abbattimento fumi mostrano elevate concentrazioni di metalli pesanti tossici, sali e
micro-inquinanti organici.
Le ceneri pesanti da termovalorizzazione sono generalmente caratterizzate da una miscela di scorie, metalli
ferrosi e non ferrosi, ceramiche ed altri materiali incombusti (IAWG, 1997). La frazione non metallica
presenta composti e caratteristiche simili ai materiali naturali di origine ignea; ha natura in parte scoriacea
poco densa ed in parte compatta e amorfa, ben visibile soprattutto nei materiali a pezzatura più grande, ed
è costituita da composti chimici complessi con predominanza di silicati e sali di calcio. Sono presenti , in
intervallo compreso tra frazioni di mg/kg e qualche migliaio di mg/kg, metalli pesanti quali piombo, nichel,
mercurio, cadmio, arsenico e zinco in quantità funzionali, per singolo elemento, alla consistenza di detti
metalli nel rifiuto originario ed al comportamento chimico fisico degli stessi nelle condizioni di esercizio
dell’impianto. Data la natura amorfa di questi materiali sono difficilmente individuabili strutture
riconducibili a specie definite.
I residui prodotti nella camera di combustione vengono generalmente raccolti e inviati a raffreddamento
rapido in acqua. In ambiente acquoso ha luogo l’idratazione degli ossidi di metalli alcalini ed alcalino terrosi
responsabile del pH tipicamente alcalino (a volte anche superiore a 12 unità pH) caratteristico delle scorie,e
,di formazione degli idrossidi per idrolisi degli ossidi metallici. Il passaggio in acqua determina altresì la
lisciviazione delle specie solubili come NaCl, CaCl 2 , CaSO 4 .
Per maturazione, nel tempo ha luogo il processo complessivo di carbonatazione, spiccatamente
dell’idrossido di Calcio a Carbonato di Calcio [ da Ca(OH) 2 a CaCO3 ], con successivo abbassamento del pH.
Le ceneri pesanti sono caratterizzate da due specie predominanti: la parte a base in silice (espressa come
SiO2) e quella in calcio (espresso come CaO). La percentuale di SiO2 è maggiore nelle frazione grossolana (>
50%) mentre la frazione a base di CaO è più presente nella frazione a grani più piccoli (˜ 40% ).
Escludendo i materiali di grosse dimensioni (>10 cm), la dimensione delle particelle è piuttosto uniforme e
le ceneri pesanti possono essere classificate come un materiale eterogeneo di pezzatura variabile tra la
sabbia e la ghiaia.
La solubilità complessiva delle ceneri pesanti è principalmente dovuta ai sali di calcio e sodio, ad es. NaCl,
CaCl 2 e CaSO4 (IAWG, 1997).
Ulteriore elemento individuabile nelle scorie è l’alcalinità a seguito dell’idratazione della calce viva nel
processo di raffreddamento in vasca.
Infatti generalmente i residui prodotti nella camera di combustione (bottom ash e grate siftings) vengono
generalmente raccolti insieme e inviati a raffreddamento rapido in acqua.
Occorre tener presente che poiché tali residui sono generati da processi a temperature elevate, essi sono
termodinamicamente instabili a condizioni ambientali. Ciò li rende altamente reattivi, soprattutto a
condizioni umide; pertanto variano le loro caratteristiche fisico-chimiche così come il loro comportamento
ambientale finchè non vengono raggiunte condizioni di equilibrio termodinamico con l'ambiente
circostante.
Il contenuto di umidità può variare piuttosto considerevolmente a seconda dei processi di raffreddamento.
Una volta idratate mostrano la natura alcalina, con valori di pH che vanno da 9.5 a > 12 e contengono
elementi alcalini ed alcalino-terrosi misti a fasi derivanti dalle reazioni chimiche coinvolgenti ossidi
metallici alle condizioni ambientali in essere .
Inoltre il raffreddamento in acqua attua un primo processo di lisciviazione delle specie più solubili.
Valutazioni in merito alla classe di pericolo “Corrosivo” e “Irritante”
Nel caso dei rifiuti la norma fa esplicito riferimento al fatto che un rifiuto diviene pericoloso solo se
“contiene sostanze pericolose” in grado di conferire allo stesso le proprietà di pericolosità di cui all’allegato
I. Di qui la necessità di applicare nella valutazione il metodo di calcolo previsto dalla direttiva 45/99 sulle
miscele (preparati).
Per semplificare prendiamo in considerazione un esempio: una soluzione 1M di idrato sodico NaOH
(pH=14) corrisponde di fatto ad una concentrazione del 4% di sostanza, tale per classificarla ai sensi della
67/548/CEE come “corrosiva” con frase di rischio R34 (2% = C < 5%). Per concentrazioni comprese tra 0,5%
= C < 2% la sostanza viene classificata “irritante ”, con frase di rischio R36/38. Un rifiuto contenente NaOH in
concentrazione inferiore a 0,5%, non va classificato né “corrosivo” né ” irritante” secondo la 67/548/CEE ed
il regolamento 1272/2008, risultando detta concentrazione inferiore alla soglia di esclusione nonostante
corrisponda ad un pH estremo (pH = 13,09). Pertanto il riferimento al solo valore di pH estremo, quando
questo è superiore a 11,5 non può essere la condizione sufficiente per definire il rifiuto pericoloso anche a
solo titolo cautelativo.
Come dianzi esposto, nel caso delle scorie la basicità del pH misurabile (test di cessione UNI EN 24572:2004; S/L 10:1) è il risultato delle reazioni di idratazione degli ossidi di metalli alcalini ed alcalino terrosi e
di idrolisi degli ossidi metallici durante il processo di spegnimento in acqua e raffreddamento ove è
preponderante la frazione calcica in considerazione delle quantità determinate all’analisi. Pertanto nel
rifiuto finale è ipotizzabile la presenza prevalente di Idrossido di Calcio e/o Carbonato di Calcio. Entrambi i
composti non sono inseriti nella norma di riferimento 67/548/CEE e s.m.i. e quindi non sono da ritenere
associabili ad alcuna caratteristica di pericolo.
Tuttavia, poichè le scorie presentano valori di pH compresi tra 11,5 -12,6 unità pH, a titolo cautelativo, è
necessario determinare la concentrazione di ioni OH- ed esprimere l’alcalinità come g NaOH/100g di scoria .
Va precisato che, in base ai limiti di concentrazione riportati nella 548/67 per la sostanza NaOH,
indipendentemente dal valore di pH, un valore di concentrazione inferiore al 2% è condizione sufficiente
per escludere la proprietà di corrosività della specie e un valore di concentrazione inferiore allo 0,5% è
condizione sufficiente per escludere la proprietà di irritabilità. Mediamente i valori di riserva alcalina
misurati su scorie raffreddate in acqua si attestano tra 0,3-0,6 gNaOH/100g di rifiuto; effettuando il calcolo
l’indice di “corrosivo” e di “irritante” secondo il metodo di Young, si può classificare il rifiuto non rientrante
nella classe H8 ed H4 .
Comportamento nella matrice
In generale, la mobilizzazione dei costituenti dei residui inorganici nel mezzo lisciviante dipende
dall'interazione tra diversi fattori chimici e fisici. I fattori chimici includono la composizione del residuo e la
mineralogia, la temperatura, il pH, il potenziale redox e l a presenza di agenti complessanti, mentre i fattori
fisici sono rappresentati dalla superficie specifica, dimensione delle particelle, rapporto L/S, porosità,
gradiente idraulico e conduttività idraulica.
L'influenza del pH sulla lisciviabilità dei contaminanti è fortemente influenzata dalla natura del
contaminante stesso e dalle fasi minerali a cui è legato. Il rilascio di specie altamente solubili (ad es. Na, Cl e
K, sali alcalini) è di fatto quasi indipendente dal pH; al contrario, per un certo numero di contaminanti può
essere osservata una netta dipendenza della solubilità dalle condizioni di pH che si snaturano nel mezzo
lisciviante.
I diversi costituenti di interesse possono essere raggruppati nelle seguenti classi:
• specie che formano cationi e ioni metallici non anfoteri (ad esempio Cd), la cui concentrazione in
soluzione è elevata per pH <4, decresce per pH da 8 a 9 e rimane pressoché costante per valori di pH
maggiori;
• metalli anfoteri (che includono Al, Pb, Zn), la cui solubilità è elevata sia in campo fortemente acido che in
ambiente fortemente alcalino;
• elementi che formano ossianioni (ad es. As, Cr, Mo, V, B, Sb), in cui la solubilità decresce in
corrispondenza degli intevalli alcalini (pH>10).
A seguito della progressiva lisciviazione, si osserva in genere una diminuzione dell’alcalinità del sistema, che
comporta una riduzione nella capacità tampone del materiale nel tempo.
Un altro parametro in grado di influenzare la mobilizzazione dei contaminanti è rappresentato dalla
quantità di liquido a contatto con la matrice solida, solitamente espresso mediante il cosiddetto rapporto
liquido-solido (L/S).
L’invecchiamento è un processo che avviene in natura, a seguito di diversi fattori come pH, potenziale
redox, temperatura e condizioni di umidità, oltre alla concentrazione di alcuni componenti (ad es. CO2) nel
sito di applicazione. È il risultato di una complessa serie di diversi processi correlati fra loro, che includono
idrolisi, idratazione, dissoluzione/precipitazione, carbonatazione, formazione di complessi con agenti
complessanti organici ed inorganici, complessazione superficiale, assorbimento, formazione di soluzioni
solide e ossidazione/riduzione; essa comporta il verificarsi di lenti cambiamenti mineralogici nel tempo, che
possono alterare la lisciviazione di metalli in traccia dal materiale nel medio o lungo termine.
In generale, le scorie sono caratterizzate da solubilità più modeste rispetto alle ceneri, tanto nei valori
globali che relativamente ai singoli metalli pesanti.
Comportamento degli ossidi anfoteri nelle condizioni di gestione delle ceneri pesanti
Si fa innanzi tutto presente che i composti di metalli di interesse ai fini dell’utilizzo nella formula di calcolo
dell’indice di ecotossicità, sono presenti in quantità inferiori ai limiti di rilevabilità o ancor meno di
quantificazione propri di strumentazione analitica specifica per la caratterizzazione delle fasi solide (es.
XRD) e comunque di più facile disponibilità presso laboratori di media caratura; pertanto si è proceduto a
valutazioni sulla base del comportamento chimico e chimico fisico delle sostanze .
Come dianzi ricordato, le ceneri pesanti vengono inviate a raffreddamento rapido in acqua o mediante
irrorazione di quest’ultima sul materi ale o per diretta immersione nella massa liquida. In dette condizioni, si
stabiliscono condizioni nuove di equilibrio ove i costituenti presenti nella matrice sono soggetti ad
interazioni che conducono alla formazione di specie chimiche termodinamicamente compatibili e favorite
dalle condizioni ambientali del sistema .
In particolare ci riferiamo ai composti di metalli definiti anfoteri (Al, Zn , Pb) il cui comportamento chimico è
prettamente influenzato dalle condizioni dell’intorno, potendosi comportare rispettivamente come acidi e
basi di Lewis , nel senso di capacità di accettare o cedere una o più coppie di elettroni.
In soluzione acquosa i cationi di elementi tipicamente anfoteri in soluzione si trovano sotto forma di
acquocationi ; prendendo in considerazione lo Zinco, in soluzione acquosa non è presente la specie Zn 2+
ma l’acido di Bronsted Zn (H2O)4 2+ (struttura tetraedrica) che si dissocia a stadi secondo le reazioni :
Zn(H2O)42+
Ac1
+
H2O
Bas2
Zn(H2O)3(OH) + + H3O+
Bas1
Ac2
=
Zn(H2O)3(OH) + + H2O
Ac1
Bas2Bas1
=
Zn(H2O)2(OH)2 (s) + H3O+
Ac2
Zn(H2O)42+
=
Zn(H2O)2(OH)2(s) + 2 H3O+
+
2 H2O
A sua volta l’idrossido Zn(H2O)2(OH)2(s) può comportarsi oltre che da base , anche da acido, secondo le
reazioni :
Zn(H2O)2(OH) 2(s) + H2O
Ac1
Bas2
=
Zn(H2O)(OH) 3- + H3O+
Bas1
Ac2
Zn(H2O)(OH) 3Ac1
=
Zn (OH) 42Bas1
+ H2 O
Bas2
Zn(H2O)2(OH)2(s) + 2 H2O
=
Zn (OH) 42-
H3O+
Ac2
+
+ 2H3O+
L’idrossido di zinco Zn(H2O)2(OH) 2(s) quindi può venire solubilizzato in ambiente acido come Zn(H2O)42+
per spostamento a sinistra dell’equilibrio , mentre in ambiente alcalino lo stesso idrossido si comporterà da
acido e passerà in soluzione come Zn (OH)42- , idrossimetallato .
Dalla Chimica Analitica è possibile determinare l’equazione che permette di calcolare la solubilità
dell’idrossido di zinco in funzione del pH, noti i valori di Ka, Kb e K (solubilità intrinseca = quantità di
sostanza che si scioglie in forma molecolare)
s = Ka/ [H+] + Kb[H+] /Kw + K
= 3,2 · 10-7
Zn(OH) 2(s)
= Zn(OH) 2 soluzione
Zn(OH) 2(s) + H2O
= Zn(OH) 3- +
H+
Ka1 = 6,3 · 10-18 (moli/l) 2
Zn(OH) 3-
= Zn(OH) 42- +
H+
Ka2 = 1,6 · 10-13 moli/l
Zn(OH) 2(s)
= Zn(OH) +
+
OH-
Kb1 = 1,0 · 10-12 (moli/l) 2
Zn(OH) +
= Zn2+
+
OH-
Kb2 = 1,0 · 10-5 moli/l
+ H2O
K
moli/l
La somma dei valori così ottenuti fornisce, in base al bilancio di massa , il numero di moli di Zn(OH) 2
presenti in soluzione acquosa :
s = [Zn(OH) 3- ] +
[Zn(OH) 42- ] + [ Zn(OH) 2 soluzione ]+ [ Zn(OH) + ]+
[ Zn2+ ]
Ricordiamo a questo punto che nelle ceneri pesanti idratate è presente in quantità significativa Ca(OH) 2 ,
conferente spiccata reazione alcalina all’ambiente e che l’acqua interstiziale può fungere da solvatante
delle specie chimiche.
Se prendiamo in considerazione la specie ZnO (ossido di Zinco) , dato che ad idrossidi anfoteri
corrispondono ossidi anfoteri, quest’ultima in quanto acido di Lewis , è soggetta alla reazione seguente :
ZnO + 2OH- + H2 O = Zn (OH) 42determinata dalla disponibilità di ioni OH- e soggetta all’equilibrio sopra descritto in funzione del pH.
In sostanza le specie chimiche, sia sali solubili (ZnCl2 e ZnSO4 ) sia lo ZnO , alle condizioni dell’intorno
determinatesi non possono sussistere in quanto tali ma come ioni complessi (zincati o idrossozincati) .
In corrispondenza della formazione di dette specie chimiche generalmente si osserva una diminuzione del
pH a seguito della sottrazione agli equilibri in soluzione di ioni ossidrile OH - .
Per quanto riguarda il Rame , il metallo può essere presente presente in forma solubile ragionevolmente
nelle specie CuCl 2 e CuSO4 e, nella forma insolubile nelle fasi ossido, idrossido e carbonato (a seguito di
invecchiamento) e metallo ( a seguito di eventuale riduzione ad opera di altri metalli come Zn, Fe, Cd, Co,
Ni, Sn, Pb ed in quanto infusibile (punto di fusione : 1083 °C) alle temperature di gestione d’impianto). La
valutazione circa la presenza di composti di Cu(II) e l’esclusione di quelli di Cu(I) è effettuata sulla base delle
condizioni del ciclo produttivo, ossia l’ambiente ossidante in cui ha luogo la te rmodistruzione dei rifiuti ed i
potenziali normali delle specie di interesse secondo le seguenti reazioni in ambiente alcalino [OH-]=1:
2Cu + 2 OH -
=
Cu2 O + H2 O + e-
E= -0,36 V
Cu + 2 OH -
=
Cu(OH)2 + 2e-
E= -0,224 V
Cu + 2 OH -
=
Cu O
Cu2 O + 2 OH - + H 2 O =
+ H2 O + 2e-
E= -0,258 V
2 Cu(OH)2 +2e-
E= - 0,080 V
Si rileva che i composti rameosi sono poco stabili ( se non complessati) tendendo ad ossidarsi a sali rameici;
inoltre tutti i sali di rame tendono ad idrolizzarsi a sali basici e danno con estrema facilità ioni complessi.
Conclusioni
Nel settore analitico relativo alla chimica inorganica, strumentazione e metodiche in uso presso i
laboratori accreditati non consentono la speciazione delle sostanze ma la determinazione di soli elementi
(XRF) o di specie ioniche siano esse cationi (ICP-OES) od anioni (IC), pur a livelli di rivelabilità e
quantificazione adeguati alle reali concentrazioni presenti nella matrice; la diffrazione a raggi X(XRD),
tecnica strumentale più accessibile per costi , specifica per la determinazione di fasi solide allo stato
cristallino, come indicato in letteratura, consente di raggiungere livelli di quantificazione pari all’1%, valore
molto più elevato rispetto ai limiti di riferimento previsti dalla normativa , nel caso più favorevole pari a
2500 mg/kg.
Pertanto, in corso di classificazione del rifiuto, diventa fondamentale affrontare la questione attraverso la
disamina del ciclo produttivo che ha dato luogo al rifiuto stesso e ricorso a trattazione della problematica
sulla base di valutazioni teoriche di carattere chimico analitico, chimico fisico nonché ad informazioni
reperibili in letteratura.
Come precedentemente discusso mediante valutazione degli aspetti chimico analitici circa il
comportamento degli ossidi di metalli anfoteri , complessati in matrice a base alcalina nella forma
idrossometallati , è corretto su basi teoriche escludere la presenza della specie chimica Zinco Ossido nel
rifiuto ( “Slag”) ottenuto dal raffreddamento in acqua delle ceneri pesanti da TU . Tra l’altro in condizioni
di pH basico è compatibile che i composti idrati semplici formino complessi insolubili (soprattutto
alluminati) e la presenza di silicati e di calcio determini la formazione di idrossidi complessi (ad esempio
Ca[Zn(OH)3 ·H2O]2, come indicato dalla BAT relativa agli impianti di inertizzazione rifiuti , nel caso dello
zinco ).
Teoricamente è corretto escludere in base al principio di elettroneutralità ( un anione come
l’idrossozincato non può essere associato ad un altro anione) anche le specie ZnCl 2 e Zn SO 4 , ipotizzabili
esclusivamente in relazione allo scenario maggiormente conservativo e ricavabili dal calcolo stechiometrico
mediante conoscenza del valore dello ione zinco in soluzione dal test di lisciviazione .
Nel contempo è corretto escludere la presenza di composti di Rame(non complessati) nello stato di
ossidazione + 1 , oltre che sulla base del processo produttivo di formazione svolto in ambiente ossidante ,
dalla valutazione dei potenziali normali in ambiente basico tabulati e relativi alle coppie redox possibili
dopo idratazione e processi di idrolisi degli ossidi metallici nel rifiuto in fase di raffreddamento con acqua.
RIFERIMENTI
1)STUDIO SULLE POTENZIALITA’ DELLA CARBONATAZIONE DI MINERALI E RESIDUI
INDUSTRIALI PER LO STOCCAGGIO DI ANIDRIDE CARBONICA PRODOTTA DA IMPIANTI DI
PICCOLA/MEDIA TAGLIA
R. Baciocchi, G. Costa, D. Zingaretti (Università di Roma Tor Vergata)
M. Cazzotti, M. Werner (ETH Zurich – Politecnico Federale di Zurigo)
A. Polettini, R. Poma, M. Falasca (Università di Roma La Sapienza)
Settembre 2010
Report Ricerca di Sistema Elettrico
Accordo di Programma Ministero dello Sviluppo Economico – ENEA
Area: Produzione e fonti energetiche
Tema: Centrali elettriche per la coproduzione di energia elettrica e idrogeno
2)SEPARAZIONE E RECUPERO DEI METALLI E VALORIZZAZIONE
DELLE SCORIE DI COMBUSTIONE DEI RIFIUTI URBANI
A cura del Dipartimento di Ingegneria Idraulica, Ambientale,
Infrastrutture Viarie, Rilevamento del Politecnico di Milano
In collaborazione con Federambiente
Maggio 2010
3) SITO UNECE su GHS : http://www.unece.org/trans/danger/publi/ghs/ghs rev03/03files e.html
4) SITO BMU (Bundesministerium für Umwelt, 01.02.2007, 2nd PDF file :
http://www.bmu.de/files/english/waste management/downloads/application/pdf/h
5) SITO AGENZIA DELL’AMBIENTE BRITANNICA
http://www.enviroment-agency.gov.uk/business/topics/waste /32200.aspx
6)D.M. 29.1.2007
7) A.Crea-L.Falchet : CHIMICA ANALITICA -1992
8) M.Giordani : CORSO ANALISI CHIMICA SEMIMICROQUALITATIVA - 1960