Il dolore
June 23, 2011
Il dolore è una submodalità della sensibilità somatosensitiva e non è da considerarsi sinonimo di nocicezione,
in quanto l'elaborazione dei segnali dai nocicettori può essere incosciente e non provocare dunque il dolore. La
sensazione dolorica è particolare in quanto in natura non esiste il dolore ma solamente stimoli in grado di provocarlo:
avvertiamo dolore non solo quando vengono attivati i nocicettori ma anche in modo indipendente, situazione comune
a molte patologie. La risposta agli stimoli nocicettivi è molto complessa rispetto alle altre e si parla infatti di
risposta globale al dolore, divisa in tre componenti:
•
•
•
Componente discriminativa-sensoriale, che localizza la sede dello stimolo e la sua natura
Componente aettiva-emozionale, che conferisce allo stimolo una natura spiacevole
Componente motoria, che crea le risposte meccaniche dell'organismo al dolore, ad esempio retrazione o
immobilizzazione
La sfera del dolore presenta inoltre una grande plasticità: uno stesso stimolo non solo non provoca la stessa
sensazione in soggetti diversi, ma spesso neanche nello stesso soggetto in tempi diversi. Uno dei contributi maggiori
alla plasticità del dolore è la motivazione dell'individuo ad arontarlo: le donne partorienti ad esempio avvertono
meno il dolore del parto.
I nocicettori sono terminazioni nervose libere con bre di tipo A delta o C, quindi sia mieliniche che
amieliniche. Questi recettori si dividono in tre categorie: termici, meccanici e polimodali. Uno stimolo lesivo
per i tessuti genera la liberazione di sostanze quali serotonina, bradichinina, prostaglandine e ioni potassio
le quali sono in grado di attivare i nocicettori e avviare la trasmissione del segnale verso il SNC. Le bre doloriche
sono in grado di liberare glutammato e sostanza P sia in periferia che a livello centrale. A livello centrale il
glutammato è usato come neurotrasmettitore mentre la sostanza P è un neuropeptide che tende a far durare il
dolore più a lungo dello stimolo e a mantere uno stato di eccitazione centrale. A livello periferico la sostanza P è
invece in grado di attivare i mastociti i quali liberano istamina, un potente attivatore dei nocicettori: si crea così
un circuito autoalimentato in grado anch'esso di mantere la sensazione di dolore.
Un secondo eetto della sostanza P è quello di vasodilatazione, alla base dell'edema che compare a seguito di una
lesione. In sostanza l'applicazione locale di sostanza P è in grado di produrre i segni cardinali dell'inammazione:
rubor (rossore), calor, tumor (edema) e dolor. La zona circostante a quella lesionata diventa più sensibile agli
stimoli dolorosi, si ha cioè iperalgesia; le prostaglandine sono tra le principali molecole sensibilizzanti, e infatti
l'azione antidolorica dei FANS è dovuta al blocco di sintesi di queste sostanze.
1
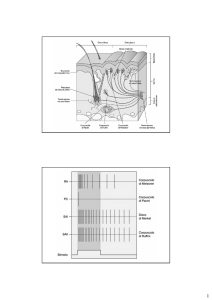
Le bre di tipo A delta terminano principalmente nella lamina I del midollo spinale, detta anche strato
marginale; le altre lamine interessate sono quelle anteriori, soprattutto la IV, la V e la VI. Le bre amieliniche
terminano quasi solo nella lamina II o sostanza gelatinosa, una struttura composta quasi solo da interneuroni
che deviano le informazioni alle lamine anteriori e posteriori. Un ruolo importante è svolto dalla lamina V, popolata
da neuroni ad ampio spettro dinamico che ricevono informazioni sia di natura dolorosa che non: questi hanno
fornito una base anatomica per la spiegazione del dolore riferito. A partire dal corno dorsale del midollo spinale
iniziano le vie del sistema anterolaterale che convogliano le informazioni doloriche (ma anche termiche); si
riconoscono tre proiezioni ascendenti principali:
•
•
•
Via spinotalamica
Via spinoreticolare
Via spinomesencefalica
La via spinotalamica è suddivisa in una via paleospinotalamica che raggiunge il talamo indirettamente con uno
stop alla formazione reticolare bulbopontina, e una via neospinotalamica che è invece diretta.
Dal Kandel
La via spinotalamica è divisa in paleo- e neo- a seconda del nucleo talamico cui si dirigono le proiezioni. La via
neospinotalamica si dirige ai nuclei VPL e VPM ed è sviluppata nei primati: il suo ruolo è quello di localizzare con
precisione il dolore. La via paleospinotalamica si dirige invece ai nuclei intralaminari e centrolaterali ed è quella
con le interruzioni alla formazione reticolare; il suo ruolo è più legato ad una generica attivazione corticale.
La via spinomesencefalica raggiunge il tetto del mesencefalo e ha ruolo di controllo dello stato di vigilanza ma
soprattutto di controllo del dolore in quanto si porta alla sostanza grigia periacqueduttale.
La via spinoreticolare raggiunge la formazione reticolare e ha ruolo nell'attivazione corticale aspecica in caso di
sensazioni doloriche.
2
La stazione talamica è ampiamente coinvolta, in quanto vengono raggiunti diversi nuclei: VPL, VPM, nuclei
posteriori e nuclei della linea mediana. I nuclei VPL e VPM sono importanti per la componente discriminativa,
mentre per quella aettiva emozionale sembrano essere coinvolti soprattutti i nuclei della linea mediana (o intralaminari). Il nucleo VPL ha evidenziato una segregazione modale dei suoi neuroni: la porzione centrale riceve
informazioni tattopressorie mentre quella periferica propriocettive; i neuroni interessati all'elaborazione del dolore
sarebbero quelli più superciali. La corteccia invece non è ben compresa per quanto riguarda il dolore, in quanto
non esiste un'area dolorica primaria o tantomeno una mappa del dolore: i centri del dolore sono dunque ancora
da identicare.
L'esperienza comune insegna che stimoli in grado di attivare recettori non nocicettivi hanno eetto analgesico:
soando un dito scottato si attivano i meccanocettori e si sente meno dolore. La prima ipotesi per spiegare questo
tipo di eetto prese il nome di gate control theory.
3
La teoria prevede che i neuroni di proiezione che danno origine alle vie del sistema anterolaterale siano sotto
controllo sia di bre nocicettive, che di bre non nocicettive che di interneuroni inibitori. L'attivazione delle bre
doloriche C porterebbe all'eccitazione del neurone di proiezione e all'inibizione del neurone inibitorio, quindi ad
una rimozione dell'inibizione: in questo caso la proiezione sarebbe libera di dirigersi verso il SNC. L'attivazione di
bre non doloriche porterebbe all'eccitazione sia del neurone di proiezione che dell'interneurone: in questo caso il
cancello si chiuderebbe e impedirebbe al segnale di trasmettersi. Questa ipotesi era convincente sulla carta, ma in
realtà la circuiteria così descritta non esiste.
Il controllo del dolore è in realtà un fenomeno centrale e lo si è scoperto per tramite di esperimenti di stimolazione
di varie regioni; i risultati sperimentali evidenziarono che alcune strutture se stimolate provocano una profonda
analgesia, e le principali aree vennero identicate nel grigio periacqueduttale e nel grigio periventricolare. Gli eetti
analgesici delle stimolazioni sono estermamente mirati: non si ottiene anestesia, cioè totale mancanza di qualsiasi
sensazione, ma solo analgesia, quindi assenza di dolore.
4
La sostanza grigia periacqueduttale riceve la via spinomesencefalica ma non riproietta indietro al midollo spinale:
le proiezioni principali sono dirette al nucleo rafemagno e al nucleo coeruleus. Il nucleo rafemagno emette una
via rafespinale serotoninergica mentre il nucleo coeruleus ne emette una noradrenergica. Esistono dunque vie
discendenti monoaminergiche che si portano al midollo spinale per generare un'analgesia; queste vie decorrono nel
funicolo dorsolaterale che infatti se lesionato causa la scomparsa dell'eetto analgesico. L'analgesia si ottiene per
inibizione dei neuroni del corno dorsale del midollo spinale; l'inibizione è dovuta al reclutamento da parte delle vie
discendenti di neuroni encefalinergici che liberano il peptide inibitorio encefalina, con eetti sia presinaptici che
postsinaptici. Una scoperta importante fu quella che tutti i siti la cui stimolazione porta ad analgesia sono sensibili
alla morna, cioè un'iniezione locale produce lo stesso eetto. La morna è un alcaloide vegetale con struttura
simile a sostanze endogene dette oppioidi i quali si legano ai recettori omonimi e agiscono come neuromodulatori
o neurotrasmettitori. Il naloxone è un antagonista naturale dei recettori per oppioidi ed è in grado di eliminare
l'analgesia indotta da morna e altri oppiacei o oppioidi. I recettori per oppioidi sono riconducibili a tre famiglie,
delle quali la famiglia µ è quella legata al controllo del dolore; le altre due famiglie sono abbondanti in strutture
non legate al dolore: in altre parole gli oppioidi hanno altri ruoli ancora da scoprire.
5