Argomenti di ACTA otorhinolaryngologica italica 2007; 1: 13-28
S.I.O. - Società Italiana di Otorinolaringoiatria e Chirurgia Cervico-Facciale
Presidente: Michele de Benedetto
Linee guida in tema di protesizzazione acustica
dei pazienti affetti da ipoacusia non rimediabile
con la terapia medica e/o chirurgica
Coordinatore del documento:
Prof. Carlo Giordano
Ordinario di Otorinolaringoiatria, Università di Torino
Autori principali:
Prof. Roberto Albera
Straordinario di Otorinolaringoiatria, Università di Torino
Dott. Corrado Canovi
Audioprotesista – Segretario CETA - AEA
Prof. Delfo Casolino
Primario di Otorinolaringoiatria, Ospedale di Ravenna
Prof. Domenico Cuda
Primario di Otorinolaringoiatria, Ospedale di Piacenza
Prof. Roberto FilipoOrdinario di Otorinolaringoiatria, Università di Roma, Policlinico Umberto I
Prof. Carlo GiordanoOrdinario di Otorinolaringoiatria, Università di Torino
Prof. Gaetano PaludettiOrdinario di Otorinolaringoiatria, Università di Roma, Policlinico Gemelli
Prof. Nicola Quaranta
Associato di Otorinolaringoiatria, Università di Bari
Indice
Introduzione
C. Giordano
1. Premesse fisiopatologiche e cliniche dell’apparato uditivo
R. Albera, A. Canale, G.C. Pecorari
2.Incidenza e distribuzione della Sordità in Italia e nel Mondo in rapporto alla rimediazione protesica e medico chirurgica: Stato attuale dell’arte
N. Quaranta, G. Arcieri, A. Quaranta
3.Gli accertamenti clinico strumentali per il bilancio audiometrico in funzione della prescrizione protesica
C. Giordano, R. Boggero, M. Garzaro
4. Quale dovrebbe essere un corretto e moderno protocollo diagnostico strumentale per la protesizzazione acustica?
A. Fetoni, G. Plaudetti, W. Di Nardo, B. Martina, G. Conti
5. Quali sono e quali dovrebbero essere i principali parametri clinico audiologici, sociali ed economici per la scelta sia
del tipo di protesi da applicare sia del paziente da protesizzare
R. Filipo, E. De Seta
6.L’approccio protesico più idoneo nei casi cosiddetti “impegnativi”
D. Cuda
7.Le protesi uditive oggi: le modalità di prescrizione ed il ruolo e la responsabilità del dottore in Audioprotesi
C. Canovi, C. Clerici, J. Nadalin
8.Il percorso per la prescrizione e l’applicazione protesica
C. Giordano
9.La protesizzazione delle sordità professionali lievi, medie e gravi
M. Bisceglia, G. Cimaglia
10.Il counseling audioprotesico: l’importanza di questo momento informativo e di supporto psicologico emotivo nella
riabilitazione protesica
D. Padovani, M. Dal Pane, M. Limarzi, D. Salsi, D. Casolino
Conclusioni
C. Giordano
13
Argomenti di ACTA Otorhinolaryngologica Italica
Introduzione
Scopo e finalità del lavoro
C. Giordano
14
Il documento d’indirizzo che vogliamo proporre si prefigge lo scopo di creare una “Consensus Italiana” in tema
di protesizzazione acustica delle ipoacusie non rimediabili
con la terapia medica e/o chirurgica. Questa necessità deriva dal fatto che in Italia, attualmente, non esiste alcun
lavoro specifico su questo importante problema clinico e
socioeconomico.
Questo studio, patrocinato dalla Società Italiana di Otorinolaringoiatria (S.I.O.) e coordinato dal sottoscritto, si
pone come obiettivo quello di realizzare un preliminary
report sullo stato attuale delle conoscenze clinico scientifiche italiane e mondiali in questo campo specifico al fine
di realizzare un primo documento di indirizzo, possibilmente condiviso dal maggior numero di esperti italiani del
settore, finalizzato alla stesura di Linee Guida su queste
specifiche problematicità.
Il documento, dopo alcune brevi premesse aggiornate di
ordine fisiopatologico, clinico ed epidemiologico sul tema
delle ipoacusie dell’età pediatrica e di quella adulta, affronta e cerca di approfondire i più significativi aspetti
delle problematiche della protesizzazione.
In particolare, viene presa in considerazione l’importanza
degli accertamenti strumentali in essere per il bilancio audiometrico e viene anche proposto un corretto ed adeguato
protocollo diagnostico strumentale che prevede anche i
requisiti minimi per la prescrizione protesica.
Nel documento gli autori analizzano ed approfondiscono
altri aspetti, meno noti ma molto importanti ai fini della protesizzazione, quali quelli sociali ed economici per
operare la scelta sia del paziente sia del tipo di protesi da
applicare. Questo percorso non può prescindere dalle aggiornate conoscenze delle protesi uditive oggi in essere
sul mercato mondiale e dall’informazione delle persone
che operano in questo settore su quelli che sono i corretti
approcci prescrittivi, applicativi e riabilitativi; infine, ma
certamente non per ultimo come importanza, viene anche
affrontato il capitolo del counseling audioprotesico che è
considerato attualmente come insostituibile supporto psicologico-emotivo nella riabilitazione protesica.
A corollario di quanto esposto nel presente documento,
viene anche inserito un breve capitolo sul problema della protesizzazione dell’ipoacusia professionale, problema
che è stato sufficientemente stressato in apposite Linee
Guida elaborate con i consulenti specialisti dell’INAIL.
Questo documento d’indirizzo è destinato ai medici specialisti ORL ed Audiologi, ai medici specialisti dell’INAIL,
agli audioprotesisti e a tutti coloro che per lavoro o per
passione si occupano di queste problematiche.
1.Premesse fisiopatologiche e cliniche
R. Albera, A. Canale, G.C. Pecorari
Dipartimento di Fisiopatologia Clinica, Sezione di ORL,
Università di Torino
L’organo dell’udito sotto il profilo anatomo-funzionale
può essere suddiviso in tre parti:
- apparato di trasmissione dell’energia meccani-
ca-vibratoria: costituito dall’orecchio esterno,
dall’orecchio medio, dai liquidi labirintici e dalle
strutture membranose dell’orecchio interno;
- apparato di trasduzione dell’energia meccanica-vibratoria in energia nervosa: costituito dalle cellule
cigliate dell’organo di Corti;
- apparato di trasferimento dell’energia nervosa e
di trasformazione in sensazione acustica: costituito dalle fibre nervose del nervo acustico, dalla via
acustica centripeta e dai suoi nuclei.
Apparato di trasmissione
La funzione dell’apparato di trasmissione è di condurre
la vibrazione acustica alle cellule neurosensoriali con la
minor perdita possibile di pressione.
II padiglione auricolare esercita un’azione di convogliamento dell’energia meccanica vibratoria nel condotto
uditivo esterno, concentrandola in un’area più ristretta
con conseguente incremento della pressione sonora. Le
patologie riguardanti l’orecchio esterno, responsabili di
deficit uditivo di tipo trasmissivo, sono comunemente risolvibili con terapia medica e raramente necessitano della
terapia protesica. Rare sono le eccezioni nel caso di patologie malformative (atresia auris congenita) che possono
richiedere un intervento protesico.
La membrana timpanica viene posta in vibrazione dal
sopraggiungere dell’onda sonora e, a sua volta, pone in
vibrazione la catena degli ossicini, dal martello fino alla
platina della staffa. L’onda pressoria viene quindi trasmessa alla perilinfa della scala vestibolare. A livello dell’apparato di trasmissione dell’orecchio si verifica, pertanto, la
trasmissione dell’onda sonora da un mezzo gassoso (aria),
ad un mezzo solido (membrana timpanica e catena ossiculare) e ad un mezzo liquido (perilinfa).
La funzione dell’orecchio medio è di garantire un adeguato passaggio di pressione acustica dal mezzo aereo a quello liquido. Il massimo deficit uditivo che può verificarsi in
presenza di alterazioni a carico dell’orecchio medio è pari
a circa 60 dB.
Le vibrazioni acustiche giunte alla platina della staffa vengono trasmesse alla perilinfa della scala vestibolare che,
a sua volta, le trasmette alle strutture membranose e alla
perilinfa della sottostante scala timpanica.
Le patologie dell’orecchio medio, generalmente su base
osteodistrofica o flogistica, sono responsabili di un deficit uditivo misto o trasmissivo. Nelle patologie flogistiche croniche l’intervento terapeutico prevede in primo
luogo la risoluzione del processo flogistico per mezzo di
terapia medica e/o chirurgica. Successivamente, qualora
l’intervento medico-chirurgico non abbia determinato un
recupero funzionale soddisfacente, può essere valutata la
prescrizione di protesi acustiche convenzionali o, in casi
selezionati, di protesi impiantabili nell’orecchio medio.
Nelle patologie su base osteodistrofica (otosclerosi) la terapia può essere di tipo chirurgico o protesico.
Apparato di trasduzione
L’apparato di trasduzione svolge la funzione di trasformare un evento meccanico, quale è la vibrazione delle molecole di un mezzo fisico (aereo, solido e liquido), in un
segnale bioelettrico che possa essere inviato e analizzato
da parte dei centri nervosi per dare origine alla sensazione
acustica.
Linee guida in tema di protesizzazione acustica
La funzione di trasduzione è svolta dall’organo di Corti
che analizza il segnale acustico definendone frequenza ed
intensità.
Il segnale analizzato dalla coclea viene frammentato nelle
sue componenti frequenziali e per ognuna di esse ne viene
definita l’intensità (analisi spettrale). Così decodificato il
segnale acustico è quindi trasmesso ai centri nervosi ove,
ai vari livelli, viene riassemblato e trasformato in sensazione acustica vera e propria.
La trasduzione del segnale acustico avviene grazie all’attivazione delle cellule cigliate interne dell’organo di
Corti.
L’attivazione delle cellule cigliate e delle fibre del nervo
acustico determina i seguenti fenomeni elettrici:
- microfonico cocleare: variazione del potenziale di
riposo che segue esattamente la morfologia della
forma d’onda acustica;
- potenziale di sommazione: variazione della carica
elettrica endococleare conseguente ad una modificazione della carica elettrica dei liquidi labirintici
perstimolatoria;
- potenziale d’azione: molto più ampio dei precedenti ed espressione della depolarizzazione delle
fibre del nervo acustico.
Le patologie dell’orecchio interno determinano ipoacusia
di tipo neurosensoriale e la terapia è di tipo protesico. In
funzione delle esigenze, dell’età del soggetto e dell’entità
del deficit uditivo possono essere utilizzate protesi convenzionali, protesi impiantabili nell’orecchio medio o impianto cocleare.
Apparato di trasferimento dell’energia nervosa e di trasformazione in sensazione acustica
L’apparato di trasferimento dell’energia nervosa è costituito dalle fibre del nervo acustico che inviano il segnale
ai nuclei cocleari.
A livello dei centri nervosi posti lungo la via acustica
centrale ha luogo la trasformazione dello stimolo nervoso in sensazione acustica o percezione uditiva.
Accanto alla via acustica afferente esiste anche una via
acustica efferente che origina dal complesso olivare superiore, ma che è comunque sottoposta ad un controllo
più alto. Essa giunge alle cellule cigliate ponendosi in
sinapsi principalmente con il corpo cellulare delle cellule cigliate esterne e con le fibre afferenti che assumono
sinapsi con le cellule cigliate interne. La via efferente
manifesta prevalentemente un effetto inibitorio che si
concretizza con una ridotta sensibilità dell’organo di
Corti modulando la percezione acustica in presenza di
rumori forti o disturbanti.
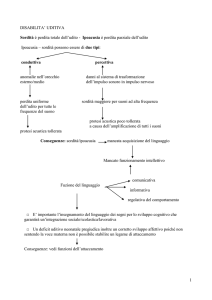
2. Incidenza e distribuzione della Sordità
in Italia e nel Mondo in rapporto
alla rimediazione protesica e medico
chirurgica: Stato attuale dell’arte
N. Quaranta, G. Arcieri, A. Quaranta
Clinica Otorinolaringoiatrica “G. Lugli”, Microchirurgia
Otologica e Otoneurologica, Dipartimento di Oftalmologia e Otorinolaringoiatria, Università di Bari.
L’ipoacusia è un problema frequente nella società moderna dovuto agli effetti combinati di tossicità ambientale in
termini di rumore e danno metabolico-ossidativo, invecchiamento, malattia ed ereditarietà.
Gli studi condotti negli ultimi anni, alla stregua di quelli
meno recenti, hanno evidenziato come la prevalenza della
sordità nella popolazione dipenda dal tipo e dal grado della perdita uditiva, dall’esposizione al rumore ed in modo
predominante dall’età.
Epidemiologia dei problemi uditivi nella popolazione
adulta
La prevalenza dei problemi uditivi in Italia negli adulti è
stata valutata nella prima metà del 1990. Il disegno usato è
stato quello di uno studio trasversale multicentrico su 3000
soggetti selezionati casualmente in cinque aree italiane e
prevedeva per ciascun soggetto la somministrazione di un
questionario per l’autovalutazione della funzione uditiva,
l’otoscopia e l’esame audiometrico tonale.
Questionario di autovalutazione.
Dei 2216 soggetti intervistati 493 riferivano di avere “udito non normale” (22%). La percentuale di soggetti con
“udito non normale” risultava aumentare progressivamente con l’avanzare dell’età e, per classi d’età > 60 anni, era
più alta nei maschi che nelle femmine. I rami di attività
economica associati più frequentemente a “udito non normale” erano le trasformazioni industriali (32%), i trasporti
(30%) e l’agricoltura (28,3%).
Valutazione audiometrica.
La valutazione audiometrica (500, 1000 e 2000 Hz) dei
2216 soggetti “campione”, metteva in evidenza un deficit
uditivo bilaterale in 403 soggetti (18,1%) e monolaterale
in 236 (10,7%). La percentuale dei soggetti con ipoacusia
risultava aumentare progressivamente con l’avanzare dell’età e, per quasi tutte le fasce d’età , era di poco più alta
nei maschi che nelle femmine.
La prevalenza della sordità in Italia non si discosta da
quanto riportato nel mondo industrializzato (Stati Uniti
d’America, Inghilterra Australia, Giappone, Danimarca
e Olanda.
In Italia un rischio relativo (RR) di ipoacusia > 1 è stato
riscontrato in soggetti impiegati nel ramo delle costruzioni, mentre i soggetti impiegati nei servizi sembrano
avere un RR < 1. Numerose patologie internistiche (diabete, displipidemie, malattie cardiovascolari, ipertensione) sono risultate associate ad un aumentato rischio
di ipoacusia, mentre il fumo di sigaretta sembra avere
un effetto protettivo.
Studi effettuati su gruppi di popolazioni diversamente
distribuite sul territorio con differenti caratteristiche
geografiche e di sviluppo tecnologico, ha evidenziato
che non vi sono sostanziali differenze tra le comunità
urbane e quelle rurali, o popolazioni residenti in zone
montane e quelle residenti in pianura. La principale forma di sordità nella popolazione adulta italiana è quella
neurosensoriale (22,2%).
Lo studio epidemiologico della sordità consente di individuarne prevalenza e distribuzione, ma soprattutto
permette di identificare i soggetti che potrebbero beneficiare del trattamento protesico o chirurgico e i criteri
utili per la scelta del trattamento.
15
Argomenti di ACTA Otorhinolaryngologica Italica
Il criterio utilizzato dalla maggior parte degli studiosi
per l’indicazione alla protesizzazione acustica è il deficit uditivo uguale o maggiore a 40 dB bilaterale o nell’orecchio migliore.
Da numerosi studi emerge però che dei soggetti che
potrebbero realmente beneficiare della protesizzazione,
soltanto una piccola percentuale vi ricorre. In Italia il
4,4% della popolazione è candidata all’applicazione
di una protesi acustica la quale invece viene utilizzata
solo dall’1% dei soggetti. Anche negli Stati Uniti, su
un campione di 1629 adulti, di età compresa tra 48 e 92
anni, la percentuale dei soggetti che utilizza le protesi
è del 14,6%, contro il 55% dei soggetti candidati. Da
uno studio condotto in Australia emerge invece che del
6,9% della popolazione di età ≥ 18 anni (941.000 persone) candidata alle protesi per deficit uditivo ≥ 35 dB,
soltanto il 38% le utilizza regolarmente.
La bassa prevalenza dell’utilizzo delle protesi acustiche
in soggetti ipoacusici deve far riflettere i clinici e gli
audioprotesisti: lo sviluppo tecnologico delle protesi,
la possibilità di “provare” gli apparecchi acustici e lo
sviluppo di sistemi di trasmissione a distanza contribuiscono alla maggiore accettazione della protesi acustica
nella popolazione.
16
Epidemiologia delle ipoacusie neurosensoriali nell’infanzia
I dati presenti in letteratura indicano che un bambino su
mille nasce ipoacusico e che nei paesi in via di sviluppo
questa percentuale è molto più alta. Nei paesi industrializzati meno del 2 per mille dei bambini ha un deficit
uditivo neurosensoriale bilaterale di almeno 50 dB e in
Italia tale percentuale è del 0,88 per mille.
Il rischio di ipoacusia si è dimostrato 6 volte maggiore
nei neonati ricoverati in un reparto di terapia intensiva
neonatale e di 14 volte nei neonati con storia familiare
di ipoacusia.
Approssimativamente il 50% delle ipoacusie dell’infanzia è acquisito, legato cioè a fattori ambientali che
agiscono in epoca pre-, peri- e post-natale, mentre il
restante 50% è da ricondurre a cause genetiche, sindromiche nel 30% dei casi (oltre 400 sindromi classificate)
e non sindromiche nel 70%.
Sordità Acquisite
I fattori responsabili delle ipoacusie infantili acquisite
possono agire in epoca prenatale (durante la vita intrauterina), perinatale (durante il parto e/o subito dopo
la nascita) o postnatale (dopo la nascita). Le infezioni
del complesso TORCH, ed in particolare le infezioni da
citomegalovirus, rappresentano ancora la causa più comune di ipoacusia acquisita in epoca pre-natale, meno
frequenti cause tossiche esogene (antibiotici ototossici,
diuretici, salicilati, radiazioni ionizzanti, etc.) e tossiche endogene (diabete, insufficienza renale). In epoca
peri natale le cause principali di sordità perinatale invece sono l’ipossia neonatale, l’ittero neonatale e l’assunzione di farmaci ototossici. L’ipossia neonatale riconosce cause materne (anemia, insufficienza cardiaca,
patologia placentare), cause fetali (grave ipovolemia,
insufficienze cardio-circolatorie, disturbi respiratori da
pre- o immaturità ) e fattori estrinseci (traumi da parto,
iperdosaggio di anestetici alla madre). Le cause più co-
muni di sordità postnatale infine sono rappresentate da
infezioni batteriche e virali nella prima infanzia, parotite nella seconda e terza infanzia. I progressi tecnologici
in ambito neonatologico con l’introduzione dei reparti
di terapia intensiva neonatale (NICU) hanno tuttavia incrementato il numero di sordità peri e post-natali per il
sempre maggior tasso di sopravvivenza di neonati prematuri o con problemi di asfissia neonatale.
Sordità ereditarie
Si stima che nel 40% dei casi di sordità genetica, l’ipoacusia sia presente alla nascita (congenita); in un altro
40% compaia nella primissima infanzia (precoce); nel
restante 20%, negli anni successivi (ritardata). I deficit
uditivi su base genetica sono prevalentemente legati a
mutazioni nel DNA e seguono una ereditarietà di tipo
mendeliana. Allo stato attuale sono stati mappati oltre 100 loci e identificati e sequenziati più di 50 geni
uditivi. Tra le forme genetiche, quelle maggiormente
implicate nella sordità infantile, sono le forme non sindromiche (70%). Queste possono essere suddivise, in
base al tipo di trasmissione, in autosomiche dominanti
(deafness A, DFNA), autosomiche recessive (deafness
B, DFNB), legate al cromosoma X (DFN, 1%), mitocondriali (< 1%), Y-linked (DFNY).
La identificazione precoce dell’ipoacusia infantile mediante programmi di screening permette una precoce riabilitazione del soggetto sordo mediante protesi acustiche
tradizionali o impianto cocleare in presenza di un deficit
uditivo profondo. Non è facile tuttavia reperire dati epidemiologici sulla protesizzazione acustica in età pediatrica.
Dati recenti che fanno riferimento all’anno 2002 nella
regione Campania provengono dal gruppo Scec Hearing
Group Campania (comunicazione personale). Secondo
questi dati, l’applicazione di protesi acustiche in età pediatrica rappresenta l’8% del totale delle protesizzazioni
acustiche. Il 50% dei soggetti di età inferiore a 18 anni
che vengono protesizzati presenta ipoacusia profonda e
il 19% grave. La protesizzazione delle ipoacusie gravi
o profonde si verifica prevalentemente nei primi 3 anni
di vita, mentre le ipoacusie moderate iniziano ad essere
trattate dopo i 4 anni. Queste rappresentano il 22% delle ipoacusie protesizzate tra i 4 e 6 anni, il 62% tra i 7
e 12 anni ed il 100% oltre i 13 anni. Nella popolazione
pediatrica il tipo di protesi applicata è in oltre i due terzi
dei casi analogica retroauricolare. L’utilizzo di protesi
programmabili o digitali si verifica dopo i 6 anni di vita
e quello delle protesi endoaurali dopo i 12 anni di vita.
3.Gli accertamenti clinico strumentali
per il bilancio audiometrico in
funzione della prescrizione protesica
C. Giordano, R. Boggero, M. Garzaro
Dipartimento di Fisiopatologia Clinica, Sezione di ORL,
Università di Torino
La prescrizione protesica deve essere effettuata unicamente dallo specialista ORL e/o audiologo che deve seguire un
percorso clinico diagnostico e strumentale molto articolato ma indispensabile per una corretta indicazione protesica. La visita specialistica ORL e/o audiologica è la condi-
Linee guida in tema di protesizzazione acustica
zione essenziale richiesta per la prescrizione protesica in
quanto il sanitario, attraverso questa procedura, valuterà
la presenza o meno dell’ipoacusia e la natura professionale o extra professionale della medesima. La visita si basa
sulla raccolta, rigorosa ed accurata dei dati anamnestici.
L’anamnesi familiare e patologica deve essere completata
da quella, altrettanto accurata, di tipo lavorativo-ambientale che consente di valutare i tipi di lavorazione e la reale
esposizione del lavoratore al rumore dell’ambiente di lavoro. La raccolta dei dati anamnestici viene completata
dalla diagnosi differenziale, passaggio clinico fondamentale per la prescrizione e la concessione della protesi.
La procedura prescrittiva si basa anche su una serie di esami audiometrici strumentali fra i quali l’audiometria tonale risulta essere quello di primo approccio.
La base per la prescrizione, cioè per il calcolo delle necessità protesiche del singolo paziente, fonda il suo razionale
sull’analisi delle soglie psicoacustiche di base e cioè sulla
valutazione della:
- soglia uditiva;
- soglia del disagio.
Nell’ambito degli accertamenti clinico strumentali necessari alla prescrizione protesica devono essere prese in
considerazione oltre all’audiometria tonale liminare e sopraliminare anche le prove di audiometria vocale. L’uso
di metodiche obiettive (impedenzometria, BERA, etc.)
può essere particolarmente indicato nella prescrizione,
nell’adattamento e nella valutazione delle protesizzazioni
difficili (soggetti non collaboranti) mentre le prove audiometriche vocali sono fondamentali nella fase di prescrizione protesica, nella fase di adattamento e di collaudo.
A. Audiometria tonale liminare
Innanzitutto si esegue la ricerca della soglia per via aerea
iniziando dall’orecchio migliore, con metodica in discesa
o in salita.
La soglia uditiva è definita come il minimo livello di intensità acustica, espressa in dB, al quale il paziente risponde
almeno due volte dopo una presentazione di quattro stimoli. Si procede quindi alla determinazione della soglia alle
altre frequenze secondo il seguente ordine: 2000-30004000-6000-8000-1000-500-250 (125).
Quando la differenza di soglia tra la via aerea dell’orecchio
peggiore e la via ossea dell’orecchio migliore è superiore
a 40 dB si deve provvedere al mascheramento dell’orecchio migliore per impedirne la possibilità di percezione
transcranica.
Le frequenze esaminate per via ossea sono: 250, 500,
1000, 2000, 3000, 4000 Hz.
Classificazione delle curve audiometriche
In rapporto al livello di soglia audiometrica il deficit uditivo può essere classificato in:
- normoacusia: soglia < 20 dB;
- lieve: soglia compresa tra 21 e 40 dB;
- medio: soglia compresa tra 41 e 55 dB;
- medio-grave: soglia compresa tra 56 e 70 dB;
- grave: soglia compresa 71 e 90 dB;
- profondo: soglia superiore a 90 dB;
L’ipoacusia viene classificata in:
- forma trasmissiva: diminuzione di soglia per la
sola via aerea con soglia della via ossea normale;
- forma neurosensoriale (o recettiva): diminuzione della
soglia audiometrica identica per via aerea e ossea;
- forma mista: diminuzione della soglia audiometrica sia per via aerea che ossea ma più accentuata
per la via aerea.
Sospetto di simulazione o di accentuazione
La non corretta collaborazione da parte del soggetto esaminato in corso di audiometria tonale può presentarsi sotto
forma di:
- simulazione: cioè tentativo di dimostrare la presenza di un deficit uditivo in una situazione in realtà
normale;
- accentuazione: cioè tentativo di dimostrare la presenza di un deficit uditivo più grave di quello realmente esistente;
- dissimulazione di un deficit uditivo realmente esistente: cioè tentativo di dimostrare una condizione
uditiva il più vicino alla normalità in presenza di
un deficit uditivo.
Le prime due tipologie sono caratteristiche dei soggetti
che hanno interesse nel poter essere riconosciuti come affetti da ipoacusia al fine di averne vantaggi di tipo economico (riconoscimento dell’invalidità in ambito INAIL ed
assicurativo e nella concessione di protesi) o professionale
(al fine di essere adibiti a mansioni diverse, in genere in
ambienti meno rumorosi).
Esistono alcune prove che consentono di dimostrare la non
corretta collaborazione all’esame: test delle soglie ripetute, test di Stenger, prova di Lombard, test di Azzi, associazione della ricerca del recruitment e della ricerca della
soglia del riflesso stapediale.
B. Audiometria sopraliminare
Raggruppa una serie di test di audiometria tonale convenzionale che vengono eseguiti con stimolazioni acustiche
di intensità superiore alla soglia. Questi test consentono di
definire, in caso di ipoacusia neurosensoriale, se un deficit
sia secondario ad una sofferenza cocleare o retrococleare
(cioè a carico del nervo acustico).
Sono rivolti alla ricerca del:
a) recruitment: fenomeno presente in caso di lesione cocleare;
b) adattamento: fenomeno presente in caso di lesione retrococleare.
Attualmente questi test sono meno utilizzati di una volta nella diagnostica audiologica in quanto sostituiti dalle
prove obiettive (impedenzometria e studio dei potenziali
evocati uditivi), caratterizzati da una sensibilità ed una
specificità superiori e da una più rapida esecuzione.
C. Audiometria vocale
L’audiometria vocale rappresenta una prova strumentale importante per la valutazione globale della funzionalità uditiva,
intesa come mezzo di comunicazione e quindi come capacità
non soltanto di percepire i suoni ma anche di memorizzarli,
integrarli, analizzarli e, in ultima analisi, comprenderli.
Questa indagine audiometrica svolge un ruolo fondamentale per quanto riguarda:
- la valutazione dell’indicazione e dell’efficacia della terapia protesica;
- lo studio delle cosiddette “sordità centrali”;
- la valutazione della sordità in tema di audiologia
industriale e medico-legale.
L’esame viene seguito inviando al soggetto dei segnali acustici di tipo verbale attraverso una cuffia o in campo libero.
17
Argomenti di ACTA Otorhinolaryngologica Italica
18
D. Audiometria oggettiva
Sono prove che si caratterizzano per la possibilità di essere
eseguite senza la collaborazione del paziente.
1.Impedenzometria
L’esame consente di definire la rigidità , o meglio il suo
reciproco e cioè la compliance, dell’apparato timpano-ossiculare, nonchè la ricerca dei riflessi stapediali.
2. Potenziali evocati uditivi
Con il termine di potenziale evocato uditivo si intende la risposta elettrica che origina dalla via acustica in seguito ad una
stimolazione sonora. Il segnale registrato è costituito dalla
modificazione della differenza di potenziale elettrico esistente tra due elettrodi applicati al capo del soggetto in esame.
In relazione alla latenza con cui si manifestano i potenziali
evocati uditivi possono essere suddivisi in:
- elettrococleografia (EcoG);
- potenziali evocati uditivi del tronco cerebrale
(ABR, BAEP, BERA, BSER);
- potenziali uditivi a media latenza (MLR);
- potenziali evocati uditivi corticali (SVR).
L’ABR rappresenta, tra i potenziali evocati uditivi, la metodica di più comune utilizzo.
I principali ambiti di utilizzo dell’ABR sono:
- diagnosi di sordità infantile;
- determinazione oggettiva della soglia audiometrica;
- diagnosi differenziale tra ipoacusia cocleare e retrococleare;
- diagnosi di patologie centrali.
Nell’ambito della diagnostica per l’ipoacusia professionale la metodica più utilizzata è l’SVR (Slow Vertex Responses), espressione dell’attivazione delle aree corticali
primarie e secondarie. In ambito audiologico trova il principale campo di applicazione nella determinazione oggettiva della soglia audiometrica.
3.Emissioni otoacustiche
Sono costituite da segnali acustici di bassa intensità prodotti
dall’orecchio interno, spontaneamente o in seguito a stimolazioni acustiche, e misurabili mediante un microfono posto
nell’apertura del condotto uditivo esterno. Rappresentano
l’espressione acustica dell’attività contrattile delle cellule
cigliate esterne. In ambito clinico le più utilizzate sono le
emissioni otoacustiche evocate transitorie (TOAEs) ed i
prodotti di distorsione (DPOAEs).
Lo studio delle emissioni otoacustiche trova oggi il suo
principale impiego nello screening della sordità congenita.
condurre alla diagnosi e prescrizione con il minor dispendio di risorse economiche e umane.
Il ruolo della batteria di test audiologici nella indicazione
protesica può essere cosi schematizzato:
4.Quale dovrebbe essere un corretto
e moderno protocollo diagnostico
strumentale per la protesizzazione
acustica?
Nell’adulto il corretto protocollo diagnostico è cosi sintetizzabile:
Fetoni A, Di Nardo W, Martina B M, De Carlini M,
Conti G, Paludetti G.
Istituto di Clinica ORL, Università Cattolica di Roma
I notevoli progressi tecnologici hanno reso le protesi in
grado di compensare in modo ottimale la maggior parte
dei deficit uditivi.
Una moderna protesizzazione non può prescindere da una
corretta diagnosi audiologica basata sull’adozione di un
protocollo diagnostico-strumentale mirato, in grado di
Diagnosi audiologica
(definizione dei caratteri dell’ipoacusia)
- Entità del deficit uditivo
- Tipizzazione (natura)
- Configurazione audiometrica
- Determinazione del campo dinamico
⇓
Protesizzazione acustica
Ogni metodica contribuisce alla definizione dell’ipoacusia ed
alla determinazione del campo dinamico che costituisce l’elemento diagnostico fondamentale nell’indicazione protesica.
Le indicazioni fornite dalla batteria audiologica riguardo
la protesizzazione comprendono:
- tipo di protesizzazione;
- il guadagno elettroacustico;
- la banda di frequenza da amplificare;
- la regolazione dell’uscita massima.
a. Definizione del deficit uditivo
- audiometria soggettiva;
- audiometria obiettiva (predizione di soglia).
b. Tipizzazione dell’ipoacusia
- test sopraliminari;
- audiometria vocale;
- potenziali evocati uditivi;
- timpanometria e soglia del riflesso cocleostapediale;
- otoemissioni acustiche evocate.
c. Configurazione audiometrica
- audiometria soggettiva;
- potenziali evocati uditivi;
- soglia del riflesso cocleostapediale.
d. Determinazione del range dinamico
- soglia del fastidio;
- soglia del riflesso cocleostapediale;
- potenziali evocati uditivi.
Anammesi
Esame obiettivo
-
-
-
Audiometria soggettiva:
Audiometria tonale
Audiometria vocale
Test sopraliminari
-
-
-
Audiometria obiettiva:
Impedenzometria
Potenziali evocati uditivi
Otoemissioni acustiche
Linee guida in tema di protesizzazione acustica
Sordità infantili:
Le fasi dell’intervento audiologico nella diagnosi delle ipoacusie infantili costituisce un processo dinamico e di affinamento
dei risultati nel tempo con la crescita del bambino e con la possibilità di applicazione di tutta una batteria audiologica.
Anamnesi
Valutazione clinica
Osservazione informale
0-5 mesi
6-24 mesi
- Audiometria
- Audiometria
obiettiva:
obiettiva
- Impenzometria
- Potenziali evocati - Audiometria
uditivi
comportamentale
- Otoemissioni
(con rinforzo
acustiche evocate
visivo)
> 25 mesi
- Audiometria
comportamentale
(play audiometry)
- Audiometria
obiettiva
Audiometria comportamentale
I metodi diagnostici di audiometria comportamentale, indicati per bambini fra 6 e 36 mesi, se adeguatamente utilizzati, forniscono informazioni rilevanti e affidabili sulla
soglia uditiva e sulle abilità uditive del bambino. Le tecniche più utilizzate sono: audiometria condizionata, audiometria comportamentale con rinforzo visivo e metodiche
di audiometria-gioco (play audiometry).
5.Quali sono e quali dovrebbero
essere i principali parametri clinico
audiologici, sociali ed economici
per la scelta sia del tipo di protesi
da applicare sia del paziente da
protesizzare
R. Filipo, E. De Seta
Università di Roma, Policlinico Umberto I
I parametri clinico-audiologici per la scelta della protesi
in relazione al paziente da protesizzare sono in continua
evoluzione, sia perchè la tecnologia ci propone soluzioni
protesiche sempre nuove, sia, in misura minore, perchè
cambiano nel tempo le esigenze e gli orientamenti comunicativi del paziente ipoacusico.
Protesi analogiche
L’utilizzo di questi apparecchi è limitato ai casi di sordità
trasmissiva o nei casi in cui il contenimento dei costi rimane l’esigenza primaria (ad es. totale carico delle ASL).
Protesi programmabili digitalmente
Apparecchi dotati di circuiti analogici per l’elaborazione
del segnale, tuttavia regolabili in modo digitale tramite un
computer esterno. Preferibili alle protesi tradizionali perché bene adattabili alle esigenze di ascolto del paziente.
Protesi digitale
Con le protesi digitali, veri e propri computer acustici, è
possibile intervenire su 15-30 parametri diversi che definiscono modalità e tipo di elaborazione del suono.
Le caratteristiche delle protesi digitali sono la massima
adattabilità alle esigenze audiologiche del paziente, l’elevata qualità di riproduzione, la completa riprogrammabilità delle caratteristiche elettroacustiche mediante software.
Dal 2001 sono disponibili protesi digitali di ultima generazione che offrono il controllo automatico adattativo
dell’effetto Larsen. Inoltre, l’analisi a lungo termine del
segnale consente di individuare la presenza della voce e
di adattare le modalità di amplificazione allo scopo di migliorare la comprensione vocale nel rumore e ridurre la
sovrastimolazione acustica in assenza di parlato. Questa
ultima possibilità è particolarmente importante nei bambini, che solitamente frequentano ambienti molto rumorosi.
I vantaggi delle protesi digitali sono: elevatissime possibilità di regolazione, riduzione del rumore ambientale,
minor distorsione, maggiore risoluzione in frequenza,
controllo automatico dell’effetto Larsen, compatibilità
elettromagnetica (assenza d’interferenze nell’uso del telefono cellulare).
Per le protesi analogiche il costo viene a coincidere con
quello del rimborso del SSN (550 euro) e sono di fatto
le uniche a completo carico del SSN, una volta accertata
l’invalidità del paziente. Le protesi programmabili digitalmente variano dai 1000 ai 1500 euro in relazione al tipo.
Per quanto riguarda infine le protesi digitali dobbiamo distinguere tre fasce: quella di base (1500 euro circa) a due
canali; la fascia media (1800-2000 euro circa) con quattro-otto canali e le digitali top (circa 2500 euro circa) con
dodici-sedici canali. Vi è da notare che tali costi hanno un
valore indicativo, in quanto soggetti ad ampia variabilità
in relazione alla posizione geografica (nord-sud) e ad esigenze di marketing.
Per tali motivi in primo luogo è importante definire i prezzi al pubblico a livello nazionale dei singoli apparecchi
acustici (come si fa già per i farmaci) per limitare l’eccessiva discrezionalità dovuta in qualche caso a motivi puramente speculativi.
Per quanto riguarda i pazienti in età evolutiva i criteri e le
modalità attuali sono tutti condivisibili, ma bisognerebbe
aumentare ulteriormente la quota rimborsabile portandola
a coprire totalmente il costo delle protesi digitali di fascia
intermedia.
Per quanto riguarda gli adulti si dovrebbe a nostro parere
sganciare la rimborsabilità delle protesi dal discorso della
invalidità civile, in considerazione del fatto che soprattutto
in alcune regioni spesso si è soliti peggiorare artificiosamente la soglia uditiva per poter usufruire del rimborso del
SSN. Si potrebbe portare il limite dagli attuali 65 dB a 60
dB, introducendo contemporaneamente il fattore reddito
(rimborso massimo per i livelli di reddito minimi, fino a
zero per quelli più elevati). Tutte le altre norme potrebbero
rimanere invariate.
Dovrebbe essere posta, infine, maggiore cura nell’esecuzione dei controlli e del training post-protesizzazione e
follow-up che attualmente, anche se previsto, è fortemente
trascurato o addirittura assente, almeno nell’adulto.
Per quanto riguarda le sordità profonde in età infantile sarebbe opportuno che alcuni centri nazionali di
valutazione, con caratteristiche di maggior esperienza
e un livello scientifico e clinico/organizzativo elevato,
fungessero da riferimento per indicazione all’impian-
19
Argomenti di ACTA Otorhinolaryngologica Italica
to cocleare. Tali centri potrebbero svolgere attività
di consulenza anche per l’applicazione, soltanto nell’adulto, dei nuovi dispositivi impiantabili dell’orecchio medio.
6.L’approccio protesico più idoneo nei
casi cosiddetti “impegnativi”
D. Cuda
Unità Operativa di ORL, Ospedale “G. da Saliceto”,
Azienda USL, Piacenza
Le persone con deficit uditivo costituiscono una popolazione estremamente eterogenea. Allo stesso profilo audiometrico possono infatti corrispondere differenti danni
anatomopatologici e conseguenze percettive variegate.
La protesizzazione acustica rappresenta pertanto per
definizione un atto difficile, un processo dove solo una
piccola parte delle variabili in gioco risulta esattamente
controllabile.
Soglia alte frequenze: < 60 dB
In particolare verranno qui considerate tre specifiche
situazioni cliniche che più di altre richiedono una stretta collaborazione fra medico e tecnico audioprotesista
per via delle alternative oggi disponibili. Si tratta delle
perdite uditive con accentuata pendenza audiometrica,
delle perdite uditive con patologia dell’orecchio medio
e della protesizzazione acustica dei lattanti con grave
sordità.
1. Le perdite uditive con pendenza audiometrica accentuata
Sono i casi in cui è presente una ipoacusia neurosensoriale
alle alte frequenze da media a profonda con una sensibilità
uditiva relativamente conservata alle basse frequenze. Gli
elementi di complessità che ci si trova ad affrontare sono
l’occlusione del condotto, il feedback acustico e le aree di
coclea morta (che determinano distorsioni indesiderate se
amplificate).
I dispositivi protesici disponibili sono le protesi retroauricolari con accoppiamento classico, le protesi retroauri-
Soglia alte frequenze: 60-90 dB
Soglia alte frequenze: > 90 dB
20
Area di coclea
‘morta’?
NO
SI
Retroauricolare ‘open air’
(LF norm, HF < 70dB)
Retroauricolare accoppiamento
classico o ‘open air’
con amplificazione ‘selettiva’
sui medi
Endoauricolare
(LF < 40, HF < 70dB)
Retroauricolare accoppiamento
(LF < 40, HF > 70dB)
Buon beneficio?
Impianto ‘ibrido’:
impianto cocleare e stimolazione
acustica ipsilaterale (EAS).
Solo in forme non pogressive
NO
SI
STOP
Fig. 1.
Linee guida in tema di protesizzazione acustica
colari con accoppiamento aperto (le open air fitting), le
protesi endoauricolari, le protesi semi-impiantabili nell’orecchio medio e gli impianti cocleari “ibridi”.
Per quanto riguarda la strategia clinica da adottare, sul
piano pratico, è utile ricorrere ad alcune semplificazioni e
considerare tre differenti casi riportati nella Figura 1.
2. Le perdite uditive con patologie dell’orecchio medio
È noto che la prognosi delle applicazioni protesiche nelle
ipoacusie trasmissive è molto soddisfacente; tuttavia vi
sono alcune situazioni cliniche che comportano non pochi problemi protesici applicativi come le cavità chirurgiche aperte o le perforazioni croniche secernenti della
membrana timpanica.
I dispositivi protesici disponibili sono le protesi retroauricolari con accoppiamento classico, le protesi retroauricolari con accoppiamento aperto a ricevitore distale, le
protesi indossabili per via ossea, le protesi ossee impiantabili (BAHA) e le protesi semi-impiantabili nell’orecchio medio. La strategia clinica, a livello pratico, viene
riassunta nella Figura 2.
3. La protesizzazione acustica dei lattanti con grave sordità
Affinché la riabilitazione sia efficace deve essere precoce e rientrare nel cosiddetto “periodo critico” per lo
sviluppo del linguaggio, oggi identificato nei primi mesi
di vita. La difficoltà maggiore consiste nel confermare
con certezza una diagnosi di sordità sospettata con lo
Perforazione
Cavità chirurgica
Altri esiti sfavorevoli
Ipoausia bilaterale
21
SI
PTA > 60
dB HL
NO
Retroauricolare convenzionale
con protocollo di ventilazione
Applicazione ‘open’
con ricevitore distale
NO
STOP
Irritazione
Secrezione
SI
Vibratore su Occhiali (VO normale)
BAHA compact (VO < 40 dB)
BAHA cordelle (VO < 60 dB)
Vibrant MedEl (cavità; VO < 60 dB)
Fig. 2.
Argomenti di ACTA Otorhinolaryngologica Italica
screening. La batteria per la diagnosi delle sordità infantili comprende audiometria comportamentale, ABR,
elettrococleografia, impedenzometria ed emissioni otoacustiche. Le problematiche successive si incontrano nella
fase dell’adattamento protesico per l’allestimento delle
chiocciole e nella regolazione delle caratteristiche elettroacustiche poiché inizialmente non si conoscono i dati
audiometrici per le singole frequenze. Le misure di beneficio protesico nel bambino piccolo presentano notevoli
difficoltà perché le abilità da misurare sono infatti in via
di sviluppo e gli strumenti di cui disponiamo sono legati
a risposte comportamentali.
7.Le protesi uditive oggi: le modalità
di prescrizione ed il ruolo e la
responsabilità del dottore in
Audioprotesi
C. Canovi, C. Clerici, J. Nadalin*
*
Dipartimento di Fisiopatologia Clinica, Sezione di ORL,
Università di Torino
22
Il tipo di protesi: stato attuale del device
A fronte di elementi di complessità esposti nelle pagine precedenti, va segnalato che da un punto di vista clinico la situazione è oggi abbastanza soddisfacente in funzione non solo
dei progressi tecnologici ma anche della migliore conoscenza
della fisiopatologia del danno cocleare e dei meccanismi centrali implicati nella riabilitazione dell’ipoacusia.
La tecnologia avanzata (ibrida, ma soprattutto digitale) ha
introdotto sensibili ulteriori miglioramenti riconducibili a:
- migliore qualità delle componenti degli apparecchi
che si traduce in una stabilità molto più prolungata
delle caratteristiche elettroacustiche del prodotto;
- programmabilità con migliore adattamento delle caratteristiche elettroacustiche alle differenti configurazioni audiometriche specie in caso di situazioni atipiche:
questo grazie anche a filtri con azioni molto più pronunciate (fino a 200 dB/oct);
- disponibilità di memorie multiple con allestimento e
verifica di differenti configurazioni elettroacustiche;
- programmabilità delle caratteristiche della compressione con ottimizzazione degli aspetti sopraliminari
dell’amplificazione;
- disponibilità di algoritmi di riconoscimento e riduzione del rumore e di controllo del feedback;
- disponibilità di algoritmi di riconoscimento ed enfatizzazione del parlato;
- disponibilità di collegamento inter-aurale wireless per
un continuo e costante allineamento del modus operandi dei due apparecchi;
- disponibilità di un database interno sul funzionamento
dell’apparecchio al fine di meglio gestire l’applicazione per una migliore client satisfaction;
- possibilità di protesi con funzione anche di otoprotettore.
Sintesi dei device attualmente disponibili
Tipologia
Device
endoauricolare
Device
retroauricolare
Commento
Analogico
Digitale
Fitting bilaterale per
ipoacusie professionali lievi
Open fitting Per perdite uditive con deficit
più accentuato sui toni acuti
e/o per sordità gravi
Device ad occhiale
Attualmente in disuso o in
alternativa a protesi endo e
retroauricolari con feedback
incontrollabile
Device impiantabile
Buona estetica e CUE pervio
Device ad
impianto osseo
In alternativa gli apparecchi
acustici per via ossea e
maggior resa protesica
Impianto cocleare
Per ipoacusie profonde
VSB
Per ipoacusia difficilmente
protesizzabili o per fallimento
di pregressa protesizzazione
Formule prescrittive
Con l’avvento degli apparecchi acustici programmabili
e successivamente digitali, le formule prescrittive sono
profondamente mutate: mentre con gli apparecchi convenzionali (analogici) le formule predittive erano essenzialmente statiche, con l’avvento dei programmabili dotati di
compressioni a largo spettro d’azione e successivamente
dei digitali con parametri di funzionamento dinamici, le
formule predittive hanno subito un profondo mutamento.
Le formule prescrittive (o predittive) consistono in quei
metodi che, mediante formule matematiche, determinano
la costruzione di una curva target che rappresenta, secondo l’estensore della formula, il modo ottimale di ascolto
dell’utente di Apparecchi Acustici simulando il riscontro
dell’MCL (Most Confortable Level). Un elenco dei metodi più conosciuti comprende: NAL, POGO, BERGER,
KELLER, FIG-6, DSL I/O, LIBBY 1/3, LIBBY 1/2, LIBBY 2/3. A questi metodi internazionalmente conosciuti
ed usati si affiancano poi metodi originati dalle varie case
costruttrici e che nascono specificatamente per la taratura
di specifici apparecchi o per sfruttarne particolari prestazioni: abbiamo allora il SAS per l’applicazione di alcuni
prodotti Widex, abbiamo lo ScalAdapt per l’applicazione
di prodotti GnResound, etc.
In linea di massima volendole applicare in modo tale da
aver dei risultati validi, si dovranno usare formule che si
reggono sulla regola del terzo di guadagno per perdite uditive che non superano i 50 dB, formule che si reggono
sulla regola del mezzo guadagno per perdite uditive fra i
50 e i 75 dB e formule basate su regole superiori al mezzo guadagno per perdite uditive superiori ai 75 dB. Tale
assunto vale però specificamente per gli apparecchi analogici, mentre per gli apparecchi digitali formule tipo NAL
– NL1 paiono di carattere più universale.
Le formule per la prescrizione delle caratteristiche elettroacustiche salienti della protesi acustica (Guadagno, Risposta In Frequenza, Uscita Massima) sono solitamente
basate sui dati audiometrici del paziente. Le formule più
utilizzate sono quelle derivate dalle soglie uditive (soglia
di minima udibilità HTL e soglia del disagio LDL).
Linee guida in tema di protesizzazione acustica
Si basano su 2 assunti:
- l’entità del guadagno globale è correlata all’entità dell’ipoacusia;
- esiste una correlazione fra pendenza dell’audiogramma e pendenza della risposta in frequenza ottimale
dell’apparecchio acustico (AA).
Le varie formule prescrittive forniscono un valore di
“guadagno reale” ovvero il guadagno che l’AA, a volume
d’uso, dovrà erogare nel singolo soggetto.
Le metodiche possibili per verificare se il guadagno reale
corrisponde a quello prescritto sono 2:
- il guadagno funzionale è dato dalla differenza delle
soglie uditive ottenute in campo libero senza e con gli
AA;
- il guadagno di inserzione è invece dato dalla differenza
di pressione sonora generata da un campo acustico e
registrata con un microfono-sonda al piano della membrana timpanica in assenza ed in presenza di AA.
8.Il percorso per la prescrizione e
l’applicazione protesica
nalizzato in rapporto alle necessità del paziente.
- Controllo: è la verifica dell’efficacia della terapia sia
con test audiometrici e psicoattitudinali sia con una
valutazione globale dei miglioramenti comunicazionali ottenuti; il controllo deve essere effettuato dallo
specialista ORL e Audiologo eventualmente con il
supporto dell’audioprotesista.
Un aspetto da tenere in particolare considerazione riguarda la
valutazione degli eventuali effetti dell’utilizzazione delle protesi acustiche nell’ambiente lavorativo rumoroso e cioè i livelli
di rumore cui potrà essere esposto il lavoratore protesizzato.
Misurazioni reali su pazienti portatori di protesi acustiche e
simulazioni su manichino antropometrico hanno evidenziato
livelli di dBA superiori a quello di rischio anche con apparecchi di lieve e media potenza (18). Per questi motivi un soggetto
protesizzato non può lavorare in ambiente rumoroso.
A tal fine sono ormai in fase avanzata di studio i cosiddetti
“otoprotettori protesici attivi” e cioè D.P.P.I. capaci di fungere da ausilio protesico per il paziente ipoacusico e contemporaneamente da dispositivo di protezione sul danno
cocleare che il lavoro rumoroso può creare sulla funzione
uditiva del lavoratore.
C. Giordano
Dipartimento di Fisiopatologia Clinica, Sezione di
ORL, Università di Torino
9.La protesizzazione delle sordità
professionali lievi, medie e gravi
Il protocollo di applicazione audioprotesica prevede la
definizione della disabilità uditiva attraverso:
- Visita ORL completa e compilazione di questionari
specifici.
- Accertamenti strumentali audiometrici:
- rilevazione del campo dinamico (audiometria tonale in cuffia ed in cabina silente);
- rilevazione risposta vocale (audiometria vocale in
cabina silente e/o in campo libero;
- rilevazione conduzione via ossea (audiometria tonale V.O.);
- test audiometrici obiettivi (impedenzometria, potenziali evocati, otoemissioni) solo in casi selezionati.
- Colloquio con il paziente audioleso: valutazione riguardo le eventuali problematiche psicologiche e le
aspettative anche mediante test specifici quali Sander,
Denver, Aphab.
Una volta accertata la necessità di una protesi acustica,
e rispettati i criteri di esclusione, il percorso protesico
si articola in 3 fasi:
- Prescrizione: lo specialista ORL e/o audiologo, dopo
aver valutato che la terapia protesica è la più indicata
ed è accettata dal paziente, deve fornire all’audioprotesista le informazioni sulla capacità psico-uditiva del
soggetto e deve discutere con lui sulle caratteristiche
delle protesi da fornire (tipo di protesi, filtri, guadagno, uscita massima etc.). Inoltre deve spiegare al paziente i vantaggi ed limiti che potrà rilevare durante il
percorso riabilitativo audioprotesico.
- Adattamento: è una fase di stretta pertinenza dell’audioprotesista. Questa fase prevede l’attuazione pratica
di quanto richiesto in fase di prescrizione, le prove di
selezione della protesi ottimale e l’adattamento perso-
M. Bisceglia, G. Cimaglia
INAIL – Roma
L’ipoacusia da rumore, come ampiamente noto, è una
patologia dell’orecchio interno caratterizzata da un andamento audiometrico tipico: ipoacusia di tipo percettivo,
bilaterale e simmetrica, più accentuata a 3000 e 4000 Hz
in fase iniziale. Il danno ha esordio subdolo ed andamento
ingravescente nel tempo. La sensazione soggettiva di ipoacusia, specie nelle forme più lievi, può non essere affatto
percepita come un problema da alcuni pazienti e viceversa
essere vissuta con estremo disagio da altri.
Gli strumenti necessari all’inquadramento dei soggetti
“protesizzabili” sono l’audiometria tonale liminare, che
indica sostanzialmente il grado di impairmant, l’audiometria vocale e la somministrazione di questionari, strumenti
semplici ma utili per lo studio della disability uditiva e
dell’eventuale handicap uditivo del paziente.
Molti sono i questionari proposti nella letteratura scientifica, a titolo di esempio si riporta il questionario elaborato
da Giordano ed altri (2005) che viene qui di seguito sintetizzato:
Le domande del questionario prevedono 5 risposte computate con punteggio crescente da 1 a 5 ove 1 rappresenta
l’eventualità “mai” e 5 l’eventualità “sempre”.
1. Avere difficoltà nel seguire i programmi alla TV o alla
radio
2. Avere difficoltà a percepire le voci sussurrate
3. Sentirsi escluso dalle conversazioni di famiglia
4. Avere difficoltà a seguire le funzioni religiose
5. Avere difficoltà ad ascoltare l’autoradio
6. Avere difficoltà di ascolto quando fa visita a parenti,
amici
7. Sentirsi limitato nella sua vita personale
23
Argomenti di ACTA Otorhinolaryngologica Italica
8.Dover assumere particolari posizioni per ascoltare
9 Avere difficoltà nei locali pubblici con camerieri e baristi
10.Avere difficoltà al cinema a seguire i dialoghi dei film
11.Avere difficoltà a comunicare quando va a fare acquisti
12.Sentirsi in qualche modo limitato o insicuro
13.Trovarsi a disagio perché sente diversamente con le
due orecchie
14.Dover chiedere alle persone di ripetere ciò che hanno
detto
15.Avere dei malintesi/fraintendimenti con parenti/amici
Attraverso la lettura dei risultati di questi questionari si
valuta il grado di disability e/o di handicap.
24
Come protesizzare
La protesizzazione di un’ipoacusia da rumore è uno dei
compiti più impegnativi per l’audiologia riabilitativa. Il
primo obiettivo da raggiungere nella strategia protesica
dell’ipoacusia da rumore è quello di migliorare il rapporto
segnale/rumore. Con l’avvento della tecnologia digitale è
possibile separare la voce dal rumore perché non si ha un
unico canale di amplificazione ma una suddivisione in bande dello spettro frequenziale. In questo modo, individuando
i canali dove il rumore è predominante, può essere elaborato
un algoritmo apposito che riduca il guadagno solo in corrispondenza di queste bande lasciando inalterato, o incrementando, il livello sonoro per la banda ove la voce predomina. Il recruitment come noto, è un fenomeno pressocché
onnipresente nelle cocleopatie; nella patologia uditiva da
rumore l’utilizzo di amplificatori non lineari rende l’amplificazione del segnale acustico simile alla normale dinamica
compressiva della coclea, riducendo significativamente le
distorsioni da abnorme incremento della loudness.
Altro problema ben risolto dagli apparecchi acustici digitali è l’adattamento del feedback (effetto Larssen), cioè
quel suono acuto che si genera quando un residuo sonoro
torna dal ricevitore verso il microfono.
La bilateralità dell’applicazione protesica digitale è essenziale ai fini di una buona intelligibilità verbale, essendo
dimostrato che l’amplificazione selettiva per gli acuti a
livello binaurale migliora decisamente le performances
uditive in confronto all’amplificazione monoaurale.
Ipoacusie professionali di grado lieve e medio
Nelle ipoacusie da rumore non è generalmente necessario
utilizzare apparecchi acustici di particolare potenza tranne
rari casi; quello che è essenziale è che tali apparecchi abbiano una buona selettività di frequenza e che si possano
limitare i fenomeni distorsivi tipici dell’ipoacusia professionale, da qui la scelta degli apparecchi acustici sviluppati con tecnologia digitale.
Tutte le tipologie di protesi acustiche possono essere utilizzate per la protesizzazione delle ipoacusie da rumore,
sia le protesi retroauricolari che le endoauricolari anche in
considerazione delle esigenze estetiche e non ultimo della
manualità dei pazienti.
Nel caso di ipoacusie di grado lieve e medio gli apparecchi
acustici più rispondenti alle necessità del paziente sono:
-Endoauricolari
- Sistemi open-fitting
Ipoacusie professionali di grado grave
Le protesi acustiche retroauricolari sono senza dubbio le
più indicate per la protesizzazione delle ipoacusie professionali di grado grave.
In questo caso è necessaria l’utilizzazione di apparecchi
acustici forniti di un buon incremento di potenza in termini di guadagno uditivo.
Anche per le protesi retroauricolari è auspicabile l’adozione di chiocciole aperte quando possibile e di sistemi digitali per il controllo del feedback e della selettività frequenziale come per le altre tipologie di protesi prima descritte.
Gli apparecchi acustici retrococleari sono di più semplice
utilizzo da parte del paziente per cui se ne consiglia l’utilizzo soprattutto nei pazienti più anziani affetti da ipoacusie medio-gravi.
10.Il Counseling audioprotesico:
l’importanza di questo momento
informativo e di supporto
psicologico emotivo nella
riabilitazione protesica
D. Padovani 1, M.G. Dal Pane 2, M. Limarzi 3, Daria Salsi 1, Casolino Delfo 1
1
Azienda USL di Ravenna, Ospedale S. Maria delle Croci, Ravenna; 2 Azienda USL di Ravenna, Ospedale per gli
Infermi di Faenza, Centro Audiometrico; 3Azienda USL di
Cesena, Ospedale Bufalini, Cesena
Counseling è un sostantivo inglese che può essere genericamente tradotto come “parere” o “consiglio”; in ambito
audiologico prevale la più ampia accezione di complesso
comunicativo tra il malato (ipoacusico), il terapeuta (counselor) e chi ha interazione con essi (genitori, insegnanti,
logopedisti, educatori, etc.).
Le informazioni possono riguardare sia ambiti prettamente tecnici (dalla clinica a suggerimenti riabilitativo-protesici), a implicazioni psicologico e/o emotivo-comportamentale.
Gli obiettivi primari del counseling audio-protesico consistono pertanto nel migliorare l’autonomia e la qualità della
vita del soggetto ipoacusico, grazie a chiare informazioni,
alla vanificazione di dubbi e alla correzione di errori, alla
comprensione dell’utilizzo della strumentazione e infine
al supporto tecnico e psicologico.
La responsabilità di un corretto counseling è opera del
counselor, che può essere definito come chi, in modo acritico ed equo, aiuta a comprendere le sensazioni, ad accettare la malattia e ad affrontare le responsabilità , tramite
scelte informate.
Dal punto di vista pratico il ruolo del counselor in
campo audio-protesico non viene svolto da un singolo,
bensì da un pool multidisciplinare, che permette l’interazione e l’interrelazione tra le diverse professionalità (medici, audiprotesisti, audiometristi, logopedisti,
infermieri …).
L’avvento delle protesi digitali (veri e propri computer
acustici miniaturizzati) ha comportato la necessità di modificare la flow-chart di counseling audioprotesico suggerita da autorevoli Autori, tramite un nuovo approccio al
soggetto da protesizzare.
Linee guida in tema di protesizzazione acustica
Infatti rispetto alle protesi analogiche, dotate di regolazioni più limitate, le protesi digitali possono consentire
un adattamento maggiormente adeguato alle personali e
specifiche esigenze dell’utente: ciò richiede tuttavia una
attenta preparazione tecnica e audiologica del personale
che effettua l’applicazione, senza la quale si rischia di vanificare le potenzialità offerte dalla tecnologia innovativa.
Appare utile indicare come importante sia il rapporto con
l’audioprotesista, poiché è la figura di riferimento per il
paziente per tutti i problemi tecnici che potranno presentarsi nell’utilizzo della protesi e colui che trascorre più
tempo a contatto con il paziente, nell’ambito dei periodici
controlli prescritti dal piano di applicazione della protesi.
La metodologia per la verifica dell’efficacia di una protesizzazione acustica non è codificata, ma sulla scorta delle
indicazioni della Letteratura, appare opportuno verificare
il corretto funzionamento protesico in termini strumentali
e clinici prevedendo una valutazione soggettiva ed oggettiva che consenta di verificare l’effettivo guadagno conseguito soprattutto in termini di comprensione verbale e di
misurazione del reale beneficio soggettivo.
In tutte le occasioni di incontro con il paziente, a partire
dal momento dell’indicazione alla terapia protesica fino
alle fasi successive di applicazione e di controllo, gli interventi di counseling rivestono importanza fondamentale
per il successo terapeutico. Tali interventi sono centrati
sulla persona e rivolti alla soluzione dei problemi audiologici ed extra-audiologici connessi all’uso delle protesi,
così da comprendere, limitare e trattare i diversi gradi di:
disability, handicap, beneficio e soddisfazione.
Il rilievo del grado di soddisfazione “soggettiva” percepita
dal paziente dopo riduzione della disabilità e dell’handicap
può essere ottenuta durante il counseling attraverso l’utilizzo
di metodiche psicometriche; esse permettono di quantificare
il beneficio offerto dal presidio nel normale uso quotidiano,
di verificare se i risultati conseguiti coincidono con le aspettative dell’utente e di verificare l’adeguatezza delle indicazioni del medico prescrittore. Grazie a tali tests si ottiene un
giudizio globale sull’efficacia dell’intervento di Counseling
e permettono anche di identificare a che “livello” possono
essere avvenuti fraintendimenti o incomprensioni (a livello
informativo, emotivo, tecnico e di supporto).
I due test più conosciuti, adattati alla lingua italiana da
Burdo e Senise (1977) e Burdo e Pezzullo (1979) sono la
Scala di Denver ed il Test di Sanders.
Più recentemente sono stati sono stati messi a punto strumenti di quantificazione della disabilità e dell’handicap.
Si tratta di questionari di autovalutazione, oppure somministrati dall’esaminatore, basati su risposte a scelta multipla, indicati con il termine di “misure di disabilità ” che
indagano sugli effetti dell’ipoacusia nelle situazioni di vita
quotidiana. Le risultanti performance individuali e i dati
psicometrici relativi, vengono così utilizzati nelle varie
fasi della protesizzazione, in particolare prima e dopo il
trattamento protesico per misurare gradi diversi di beneficio e soddisfazione.
Tra i più conosciuti:
HHIE – Hearing Handicaps Inventory for Elderly (Ventry
e Weistein, 1982)
HAPI – Hearing Aid Performance Inventory - “Il questionario sulle prestazioni dell’apparecchio acustico”
(Walden, 1984).
A/PHAB/P – Abbreviated/Profile of Hearing Aid Benefit/
Performance “Profilo di beneficio e performance dell’apparecchio acustico” (Cox e Gilmore, 1990).
MPHAB – Modified Profile of Hearing Aid Benefit (Dillon, 1992).
SHAPIE – Shortned Hearing Aid Performance Inventory
for Elderly (Dillon, 1994).
GAS – Goal Attainement Scaling - Scala di Raggiungimento degli Obiettivi (Dillon, 1991).
COSI – Client Oriented Scale of Improvement - National
Acoustic Laboratories in Australia (Dillon H, et al.
1997; Stephens D, 2002).
Conclusioni
C. Giordano
Il documento di indirizzo che desideriamo proporre alla
vostra attenzione costituisce il primo lavoro scientifico
italiano elaborato da esperti nazionali in campo audioprotesico (Professori Universitari ed Ospedalieri - Dottori in
Scienze Audioprotesiche) coordinato dal sottoscritto sotto
l’alto patrocinio della SIO.
In questo elaborato sono stati trattati gli aspetti più significativi della sordità (fisiopatologia e clinica della sordità ,
incidenza e distribuzioni del fenomeno in Italia e nel mondo
etc.), ma specialmente sono stati individuati i percorsi clinico-scientifici e burocratico-amministrativi che dovrebbero
costituire l’elemento “fondante” di un moderno protocollo
diagnostico-strumentale per una corretta protesizzazione
acustica.
In questo contesto sono stati approfonditi e chiariti elementi erroneamente considerati dalla maggior parte di noi
specialisti come scontati, ma anche, per la prima volta,
sono stati affrontati alcuni temi quali la scelta del tipo di
protesi (in relazione alla evoluzione tecnologica ed alle
mutate esigenze ed orientamenti comunicativi del paziente
ipoacusico), il costo delle protesi (in rapporto alla tipologia ed alla tecnologia attualmente in essere), il follow-up
del paziente protesizzato (attraverso un counseling audioprotesico uniforme e condiviso).
Inoltre è stato altresì impostato e semplificato il percorso
per la prescrizione e l’applicazione protesica finalizzata
alla soluzione dei problemi audiologici ed extra-audiologici connessi all’uso della protesi attraverso l’adozione di
questionari opportunamente elaborati per questo fine.
Nell’intenzione degli autori, questo documento d’indirizzo, dovrebbe contribuire a costituire il presupposto per
una “consensus” condivisa dal maggior numero dei colleghi italiani esperti del settore al fine di realizzare e favorire un più omogeneo e corretto approccio al problema
della protesizzazione fondato sulla autorevole simbiosi fra
lo specialista ORL e/o Audiologo e il dottore in Scienze
Audioprotesiche. Il sottoscritto, nel ringraziare con affetto
e stima il presidente della SIO Prof. Michele De Benedetto
e tutti gli amici colleghi che hanno permesso, con il loro
“prezioso, insostituibile e faticoso” lavoro, la realizzazione di questo documento, si augura che la lettura di questo
elaborato, voluto e sostenuto dalla SIO, possa essere apprezzato ed accolto favorevolmente dagli operatori e dai
cultori della materia, contribuendo ad una maggiore soddisfazione dei fruitori delle protesi acustiche.
25
Argomenti di ACTA Otorhinolaryngologica Italica
Bibliografia
Capitolo 1, Premesse
Parving A, Boisen G. In the canal hearing aids. The use and benefit in
the younger and elderly hearing-impaired. Scand Audiol 1990;19:2530.
Albera R, Schindler O. Audiologia e Foniatria. Torino: Minerva Medica 2003.
Parving A, Hein H. Epidemiology of hearing disorders. Scand Audiol
1993;22:101-7.
Davis H. An active process in cochlear mechanics. Hear Res
1983;9:79-90.
Parving A. Hearing in the elderly > 80 years of age. Scand Audiol
1997;26:99-106.
Luxon L. Textbook of Audiological Medicine. London: Martin Dunitz
2003.
Popelka MM, Cruickshanks KJ. Low prevalence of hearing aid use
among older adults with hearing loss: the epidemiology of hearing
loss study. J Am Geriatr Soc 1998;46:1075-8.
Lynn PA, Sayers BM. Cochlear innervation, signal processing and
their relation to auditory time-intensity effects. J Acoust Soc Am
1970;47:525-533.
Capitolo 2, Incidenza
Abutan BB, Hoes AW. Prevalence of hearing impairment and hearing complaints in older adults: a study in general practice. Fam
Pract 1993;10:391-5.
Quaranta A, Assennato G, Feri GM, Bellini V, Corrado V, Porro A.
Epidemiologia dei problemi uditivi nella popolazione adulta italiana
(EPUPAI). Audiologia Italiana 1991;8:300-54.
ACMG. Genetics Evaluation Guidelines for the etiologic diagnosis
of congenital hearing loss. ACGM statement 2002;4:162-71.
Quaranta A, Fiorella R. Manuale di Otorinolaringoiatria. Milano:
McGraw-Hill 1998, pp. 89-92.
Biering-Sorensen M. The Valby project: a survery of hearing in the
elderly > 80 years of age not provided with hearing aids. Scand Audiol 1997;26:33-41.
Quaranta A. Prevalenza delle ipoacusie neurosensoriali dell’infanzia. Orl Ped 1992;3:123-6.
Cassandro E, Gallo LV, Catalano M, Lopolito M, Chiarella G. Epidemiologia delle ipoacusie ereditarie. In: Martini A, ed. Genetica
della funzione uditiva normale e patologica. Torino: Omega Edizioni
2006, pp. 95-111.
Davis AC. The prevalence of hearing impairment and reported
hearing disability among adults in Great Britain. Int J Epidemiol
1989;18:911-7.
Denoyelle F, Marlin S, Weil D. Clinical features of the prevalent form
of childhood deafness, DFNB1, due to a connexin-26 gene defect:
implications for genetic counselling. Lancet 1999;353:1298-303.
26
Prasansuk S, Siriyananda C. Report of the prevalence of hearing disability and ear diseases in Thailand. Otological Center: Bangkok
Unit, 1991.
Flamme GA, Mudipalli VR. Prevalence of hearing impairment in a
rural midwestern cohort: estimates from the Keokuk county rural study, 1994-1998. Ear Hear 2005;26:350-60.
Fortnum HM, Davis A. Epidemiology of permanent childhood
hearing impairment in Trent Region, 1985-1993. Br J Audiol
1997;31:409-46.
Hansson GK, Holm J. Accumulation of IGG and complement factor
C3 in human arterial endothelium and arteriosclerotic lesions. Acta
Path Microbiol Immun Scand 1984;92:429-35.
Henrichsen J, Noring E. In the ear hearing aids. The use and benefit
in the elderly hearing-impaired. Scand Audiol 1988;17:209-12.
Jacobsen SD, Gronskov K, Brondum-Nielsen K. Is there a relationship between U shaped audiograms and mutations in Connexin 26?
Scandinavian Audiology 2001;30:184-8.
Johansson MS, Arlinger SD. Prevalence of hearing impairment in a
population in Sweden. Int J Audiol 2003;42:18-28.
Kaewboonchoo O, Morioka I. Hearing impairment among young
Chinese in a urban area. Public Health 1998;112:143-6.
Karlsmose B, Lauritzen T. Prevalence of Hearing impairment and
subjective hearing problems in a rural Danish population aged 31-50
years. Br J Audiol 1999;33:395-402.
Kelsell DP, Dunlop J, Stevens HP. Connexin 26 mutations in hereditary non-syndromic sensorineural deafness. Nature 1997;387:80-3.
Kristensen BO, Petersen GB. Association between coronary heart
disease and the C3F-gene in essential hypertension. Circulation
1978;58:622-5.
Lefebvre PP, van De Water TR. Connexins, hearing and deafness:
clinical aspects of mutations in the connexin 26 gene. Brain Res Rev
2000;32:159-62.
Leske MC. Prevalence estimates of communicative disorders in the
US: language, hearing and vestibular disorders. ASHA 1981;23:22937.
Lundborg T. Routine rehabilitation procedures in auditory communication handicap. Scand Audiol 1983;18:1.
Niskar AS, Kieszak SM. Prevalence of hearing loss among children
6 to 19 years of age: the third national health and nutrition examination survey. JAMA 1998;279:1071-5.
Roux AF, Pallares-Ruiz N, Vielle A. Molecular epidemiology of
DFNB1 deafness in France. BMC Med Genet 2004;6:1-5.
Sindhusake D, Mitchell P. Validation of self-reported hearing loss.
The Blue Mountains Hearing study. Int J Epidemiol 2001;30:13718.
Sorensen H, Dissing J. Association between the C3 F-gene and atherosclerotic vascular diseases. Hum Hered 1975;25:279-88.
Uchida Y, Nakashima T. Prevalence of self-perceived auditory problems and their relation to audiometric thresholds in a middle-aged
to elderly population. Acta Otolaryngol 2003;123:618-26.
Williams W, Purdy S. Hearing loss and perceptions of noise in
the workplace among rural Australians. Aust J Rural Health
2004;12:115-9.
Wilson DH, Walsh PG. The epidemiology of hearing impairment in
an Australian adult population. Int J Epidemiol 1999;28:247-52.
Capitolo 3, Accertamenti
Arlinger S. Manual of practical Audiometry. London: Whurr 1990
(Vol. 1); 1991 (Vol. 2).
Dobie RA. Medical Legal Evaluation of Hearing Loss. New York:
Van Nostrand Reinhold 1993.
Giordano C, Albera R, Beatrice F. Audiometria Clinica. Torino: Minerva Medica 2003.
Glasberg B, Moore B. Psycoacoustics abilities of subjects with unilateral and bilateral cochlear hearing impairments and their relationship to the ability to understand speech. Scand Audiol Suppl
1989;32:1-25.
Hall DE. Basic Acoustics. Krieger US 1993.
Hinchcliffe R, Littler TS. The detection and measurement of conductive deafness. J Laryngol Otol 1961;75:201-15.
Kemp DT. Otoacoustic emissions, travelling waves and cochlear
mechanism. Hear Res 1986;22:95-104.
Luxon L. Textbook of Audiological Medicine. London: Martin Dunitz
2003.
Martin M. Speech Audiometry, 2nd edn. London: Whurr 1997.
Jewett DL, Romano MN, Williston JS. Human auditory evoked potentials: possible brainstem components detected on the scalp. Science 1970;167:1517-8.
Capitolo 4, Protocollo diagnostico
Arslan E, Conti G. I potenziali evocati uditivi troncoencefalici nella diagnosi delle ipoacusie infantili. Audiologia Italiana 1994;11:210-24.
Cassandro E, Sequino L, Lombardo N, De Clemente M. L’impedenzometri in Audiologia infantile. Audiologia Italiana 1994;11:92-130.
Colletti V. Impedenzometria. Milano: CRS Amplifon 1974.
Katz J. Handbook of clinical audiology. 5th Edn. Philadelphia: Lippincott Williams and Wilkins Ed. 2000.
Lupi G, Arslan E, Rosignoli M, Canu G, Magnavita V. Elettrococleo-
Linee guida in tema di protesizzazione acustica
grafia. Audiologia Italiana 1994;11:224-48.
Maurizi M, Conti G. Strategie nella valutazione delle ipoacusie infantili. Audiologia Italiana 1994;11:248-60.
Maurizi M. Audiovestibologia Clinica. Napoli: Idelson-Grocchi
2000.
Orzan E, Bonaconsa A, Giacomelli C, Turato R, De Benedittis M, De
Santi R, et al. La protesizzazione acustica delle ipoacusie infantili
severe e profonde. Riv Pediatr 2001;27:195-203.
Prosser S. Audiometria comportamentale. In: Martini A, Schindler O.
La sordità preverbale. Torino: Omega Edizioni 2004, pp. 213-238.
Prosser S. La protesizzazione nell’infanzia. In: Martini A, Schindler O. La sordità preverbale. Torino: Omega Edizioni 2004, pp 213238.
Roeser RJ, Valente M, Hosford-Dunn H. Audiology Diagnosis. New
York: Thieme 2000.
Capitolo 6, Approccio Protesico
Adunke O, Kiefer J, Unkelbach MH, Lehnert T, Gstoettner W.
Development and evaluation of an improved cochlear implant
electrode design for Elecctric Acoustic Stimulation. Laryngoscope
2004;114:1237-41.
Alvord LS, Doxey GP, Smith DM. Hearing aids worn with tympanic membrane perforation: complications and solutions. Am J Otol
1989;10:277-80.
Arslan E, Genovese E, Orzan E, Turrini M. Valutazione della percezione verbale nel bambino ipoacusico. Bari: Ecumenica editrice
1997.
Beauchaine KL, Donaghy KF. Amplification selection considerations
in the pediatric population. In: FH Bess, JS Gravel, AM Tharpe,
eds. Amplification for children with auditory deficits. Nashville: Bill
Wilkerson center Press 1996.
Colletti V, Soli SD, Carner M, Colletti L. Treatment of mixed hearing
losses via implantationof a vibratory transducer on the round window. Int J Audiol 2000;45:600-8.
Cuda D. Le protesi acustiche nella sordità infantile. Audiol Ital
1994;11:284-319.
Dieroff HG. Late-onset auditory inactivity (deprivation) in persons
with bilateral essentially simmetric and conductive hearing impairment. J Am Acad Audiol 1993;4:347-50.
Govaerts PJ, Daemeres K, Yperman M, De Beukelaer C, De Saegher
G, De Ceuleaer G. Auditory Speech Sound Evaluation (A§E): a new
test to assess detection, discrimination, and identification in hearing
impairment. Coclear Impl International 2006;7:92-106.
Fortnum HM, Davis A. Epidemiology of permanent childhood
hearing impairment in Trent Region, 1985-1993. Br J Audiol
1997;31:409-46.
Hartwein J. The acoustics of the open mastoid cavity (so-called “radical cavity) and its modification by surgical measures. I. Physical principles, experimental studies. Laryngorhinotoologie 1992;71:401-6.
Hartwein J. The acoustics of the open mastoid cavity (so-called “radical cavity”) and its modification by surgical measures. II. Clinical
studies. Laryngorhinootologie 1992;71:453-61.
Kiefer J, Pok M, Adunka O, Sturzebecher E, Baumgartner W, Schmidt
M, et al. Combined electric and acoustic stimulation of the auditory
system: Results of a Clinical Study. Audiol Neurotol 2005;10:134-44.
Lenarz T, Weber BP, Issing PR, Gnadeberg D, Ambjornsen K, Mack
KF, Winter M. Vibrant Sound Bridge System. A new kind hearing prosthesis for patients with sensorineural hearing loss. 2. audiological
results. Laryngorhinootologie 2001;80:370-80.
Kishon Rabin L, Taitelbaum-Swead R, Ezrati-Vinacour R, Hildesheimer M. Prelexical vocalization in normal hearing and hearing
impaired infannts before and after cochlear implantation and its relation to early auditory skills. Ear Hearing 2005;26:17S-29S.
Macnamara M, Phillips D, Proops DW. The bone anchored hearing
aid (BAHA) in chronic suppurative otitis media (CSOM). J Laryngol
Otol Suppl 1996;21:38-40.
Moore BC, Huss M, Vickers DA, Glasberg BR, Alcantara JL. A
test for the diagnosis of dead regions in the cochlea. Br J Audiol
2000;34:205-24.
Moryl CL, Danhauer JL, DiBartolomeo JR. Real ear unaided responses in ears with tympanic membrane perforations. J Am Acad Audiol
1992;3:60-5.
Nikolopoulos TP, Archbold S, Gregory S. Young deaf children with
hearing aids or cochlear implants: early assessment package for monitoring progress. Int J Ped Otorhinolaryngol 2005;69:175-86.
Pediatric Working group: Amplification for infants and children with
hearing loss. Am J Audiol 1996;5:53-66.
Ross M. Amplification for children: the process begins. In: Amplification for children with auditory deficits. Nashville: Bill Wilkerson
Center Press 1996.
Saito T, Kimura Y, Yamada T, Kono Y, Tanaka N, Shibamori Y,
et al. Efficacy of middle ear surgery for patients with hearing
aids and middle ear disease. Nippon Jibiinkoka Gakkai Kaiho
1999;102:347-53.
Seewald RC. The desired Sensation level (DSL) Method for hearing
aid fitting in infants and children. Phonak Focus 1995;20.
Seewald RC, Moodie KS, Sinclair ST, Cornelisse LE. Traditional
and theorical approaches to selecting amplification for infants and
young children. In: Amplification for children with auditory deficits.
Nashville: Bill Wilkerson Center Press 1996.
Sininger Y, Doyle FJ, Moore JK. The case for early identification od
hearing loss in children: auditory system development, experimantal
auditory deprivation and development of speech perception an hearing. Pediatric Clinics of North America 1999;4:1-14.
Stelmachowicz PG. Hearing aid outcome measures for children. J
Am Acad Audiol 1999;10:14-25.
Tait M, Lutman ME, Nikolopulos TP. Communication development
in young deaf children: review of the video-analysis method. Int J
Pediatr Otorhinolaryngology 2001;61:105-12.
Terzis TF, Robinson JM. Use of hearing aids by patients with closed
mastoid cavity. J Laryngol Otol 1991;105:174-7.
Tolley NS, Ison K, Mirza A. Experimental studies on the acoustic
properties of mastoid cavities. J Laryngol Otol 1992;106:597-9.
Yoshinaga I, Allison LS, Couler DK, Mehl AL. Language of early and later indentified children with hearing loss. Pediatrics
1998;102:1161-71.
Capitolo 7, Protesi uditive: modalità di prescrizione
Bagatto M, Scollie S, Moodie S, Seewald R. Strategies for fitting
hearing aids to infants. Atlanta, GA 2005.
Barker C, Dillon H, Newall P. Fitting low ratio compression to people
with severe and profound hearing losses. Ear Hear 2001;22:130-41.
Byrne D, Cotton S. Evaluation of the National Acoustic laboratories’ new hearing aid selection procedure. J Speech Hear Res 1998;
31:178-86.
Byrne D, Dillon H. Future directions in hearing aid selection and
evaluation. In: Valente M, Hosford-Dunn H, Roeser RJ, eds. Audiology: Treatment. New York: Thieme 2000.
Byrne D, Dillon H, Ching T, Katsch R, Keidser G. The NAL-NL1 procedure for fitting non-linear hearing aids: characteristics and comparisons with other procedures. J Am Acad Audiol 2001;12:37-51.
Ching T, Dillon H, Katsch R, Byrne D. Maximising effective audibility in hearing aid fitting. Ear Hear 2001;22:212-24.
Ching T, Hill M. Hearing aid outcome measures in children: how effective is amplification in real life. Paper presented at the Hearing aid
outcome measures meeting, CHARTT, Indiana University 2001.
Dillon H. Fitting a wide dynamic range of speech into a narrow
dynamic range of hearing. In: Seewald RC, ed. A sound foundation
through early identification. Stafa (Switzerland): Phonak 2000; pp.
65-76.
Dillon H. NAL-NL1: A new prescriptive fitting procedure for nonlinear hearing aids. Hearing J 1999;52:10-6.
Dillon H, Birtles G, Lovegrove R. Measuring the outcomes of a national rehabilitation program: Normative data for the Client Oriented Scale of Improvement (COSI) and the Hearing Aid Users Questionnaire (HAUQ). J Amer Acad Audiol 1999;10:67-79.
Fabry DA. Clinical and communication access through amplifi-
27
Argomenti di ACTA Otorhinolaryngologica Italica
cation for a medical student with severe hearing loss: case report.
1993;4:426-31.
Jerram JCK, Purdy SC. Technology, expectations, and adjustment to
hearing loss: predictors of hearing aid outcome. J Am Acad Audiol
2001;12:64-79.
Keidser G, Brew C, Peck A (CMU). How proprietary fitting algorithms compare to each other and to some generic algorithms. Hear
Jour 2003;56:28-38.
Keidser G, Grant F. Comparing Loudness Normalisation (IHAFF)
with Speech Intelligibility Maximization (NAL-NL1) when implemented in a Two-channel Device. Ear Hear 2001;22:501-15.
Keidser G, Grant F. Fitting loudness normalization and speech intelligibility maximization to clients with flat and steeply sloping loss: differences in aim, clinical issues, and preferences. Hear Rev 2003, 14-22.
Albera R, Beatrice F. Audiometria in sede penale: dalla diagnosi all’obbligo di referto. Audiometria in medicina del lavoro e medicina
legale. Quaderni monografici di aggiornamento 2002.
Beatrice F, Albera R. Il trauma acustico cronico di natura professionale. Audiometria in medicina del lavoro e medicina legale. Quaderni
monografici di aggiornamento 2002.
Del Bo M, Giaccai F, Grisanti G. Manuale di audiologia. Milano:
Masson 1995.
Flynn MC. Opening ears: the scientific basis for an open ear acoustic
system. Hear Rev 2003;10:34-36.
Giordano C, Albera R, Beatrice F. Audiometria Clinica. Torino: Minerva Medica 2003.
Keidser G, Grant F. The preferred number of channels (one, two, or four)
in NAL-NL1 prescribed WDRC devices. Ear Hear 2001;22:516-27.
Marcato M. Stato dell’arte delle strategie audioprotesiche dall’analogico al digitale. IV Congresso Nazionale Associazione Italiana di
audiologia clinica e vestibologia. 14-16 Novembre 2002, Torino.
Keidser G, Katsch R, Grant F, Dillon H. Relative loudness perception
of low and high frequency speech bands, including the influence of
bandwidth and input levels. J Acoust Soc Am 2002;111:669-71.
Precerutti G. L’evoluzione morfologica e temporale del trauma acustico cronico. La valutazione multidisciplinare dei danni uditivi da
rumore. Atti del Convegno 12-13 Marzo 1999, Torino.
Kochkin S. Binaural hearing aids: the fitting of choice for bilateral
loss subjects. Itasca 2000. Schilling JR, Miller RL, Sachs MB, Young ED. Frequency-shaped
amplification changes the neural representation of speech with noiseinduced hearing loss. Hear Research 1998;117:57-70.
Moore BCJ, Alcantara JI, Marriage J. Comparison of three procedures for initial fitting of compression hearing aids. I. Experienced
users, fitted bilaterally. 2004;43:3-14.
28
Capitolo 9, Protesizzazione
Capitolo 10, Counselling
Punch JL. Matching commercial hearing aids to prescriptive gain and
maximum output requirements. J Speech Hear Disord 1987;52:76-83.
Sweetow R, Bingea B. Fitting strategies for noise-induced hearing
loss. In: Valente M, ed. Strategies for selecting and verifying hearing
aid fittings. 2nd Edn. New York: Thieme, Medical Publishers 2002,
pp. 176-202.
Abrams HB, Hnath-Chisolm T, Guerreiro SM, Ritterman SI. The effects of intervention strategy on self-perception of hearing handicap.
Ear Hear 1992;13:371-7.
Dillon H, James A, Ginis J. Client Oriented Scale of Improvement
(COSI) and its relationship to several other measures of benefit and satisfaction provided by hearing aids. J Am Acad Audiol 1997;8:27-43.
Sweetow R, Palmer CV. Efficacy of individual auditory training
in adults: a systematic review of the evidence. J Am Acad Audiol
2005;16:498-508.
Giordano CAR, Beatrice F. Audiometria clinica. Applicazioni in
Medicina del Lavoro e Medicina Legale. Torino: Edizioni Minerva
Medica 2003.
Sweetow R, Pirzanski C. The occlusion effect and ampclusion effect.
Seminars in Hearing 2003;24:333-43.
Gray OP. The Denver scale. Dev Med Child Neurol 1972;14:666-7.
Sweetow RW, Sabes JH. The case for LACE, individualized listening and auditory communication enhancement training. Hear Jour
2004;57:32-40. Sweetow RW, Sabes JH. The need for and development of an adaptive listening and communication enhancement
(lace™) program. J Am Acad Audiol 2006;17:538-58.
Hawkins DB. Effectiveness of counseling-based adult group aural
rehabilitation programs: a systematic review of the evidence. J Am
Acad Audiol 2005;16:485-93.
Kyle JG, Wood PL. Changing patterns of hearing-aid use and level
of support. Br J Audiol 1984;18:211-6.
Sweetow RW. An analysis of entry-level, disposable, instant-fit, and
implantable hearing aids. Hear Jour 2001;54:28-43.
Laplante-Levesque A, Kathleen Pichora-Fuller M, Gagne JP. Providing
an internet-based audiological counselling programme to new hearing
aid users: A qualitative study. Int J Audiol 2006;45:697-706.
Sweetow RW, Bingea B. Hearing aid technology. Current Opinions
in Otolaryngology & Head and Neck Surgery 2000;8:426-30.
Luterman D, Kurtzer-White E. Identifying hearing loss: parents’ needs. Am J Audiol 1999;8:13-8.
Sweetow RW, Luckett E. Selecting the ‘best’ hearing aid for you or
your child. Volta Voices 2001;8;18-21.
Luterman D. Counseling families with a hearing-impaired child.
Otolaryngol Clin North Am 1999;32:1037-50.
Venema TH. The NAL-NL1 fitting method. Ontario, Canada: Audiology Education & Training Manager, Unitron Industries Ltd., Kitchener 2001.
Luterman D. Il counseling per i genitori dei bambini audiolesi. Milano: Tecniche CRS Amplifon 1983.
Capitolo 8, Prescrizione e applicazione protesica
Cuda D. Possibilità di protesizzazione acustica nel trauma acustico
cronico. La valutazione multidisciplinare dei danni uditivi da rumore. Atti del Convegno 12-13 Marzo 1999, Torino.
Giordano C, Albera R, Argentero P, Boggero R, Garzaro M, Nadalin J, et
al. Trauma acustico cronico e protesizzazione. L’Audioprotesista 2006;9.
Mueller HG, Bentler RA. Fittine hearing aids using clinical measures of loudness discomfort leveels: an evidence based review of
effectiveness. J Am Acd Audiol 2005;16:461-72.
Saunders GH, Forsline A. The Performance-Perceptual Test (PPT)
and its relationship to aided reported handicap and hearing aid satisfaction. Ear Hear 2006;27:229-42.
Tuley MR, Mulrow CD, Aguilar C, Velez R. Ear Hear 1990;11:56-61.
Vuorialho A, Karinen P, Sorri M. Counselling of hearing aid users is
highly cost-effective. Eur Arch Otorhinolaryngol 2006;263:988-95.
Vuorialho A, Sorri M, Nuojua I, Muhli A. Changes in hearing aid use over the past 20 years. Eur Arch Otorhinolaryngol
2006;263:355-60.
Printed in September 2007
by Industrie Grafiche Pacini Editore S.p.A.
Via A. Gherardesca • 56121 Ospedaletto • Pisa • Italy
Tel. +39 050 313011 • Telefax +39 050 3130300
Internet: http://www.pacinieditore.it