USO DEGLI ANIMALI nella
RICERCA SCIENTIFICA
L’ANIMALE DA LABORATORIO
Ha avuto ed ha un ruolo essenziale per la
conoscenza:
Dei fondamentali processi metabolici
Delle funzioni fisiologiche
Delle cause e dei meccanismi di insorgenza di
molte malattie
Di strumenti farmacologici e chirurgici utili
nella terapia di molte patologie
Russel e Burch: La regola delle tre R
sull’impiego di animali nella ricerca
RESTRICTION
Limitazione del numero di animali
REFINEMENT
Miglioramento delle metodologie
REPLACEMENT
Sostituzione con altri modelli biologici o computerizzati
• Le norme UE sul benessere degli animali
stabiliscono che un esperimento scientifico su
un animale è contro la legge se esiste un
metodo scientifico alternativo. Per quanto
riguarda le ricerche finanziate dall'Unione
europea, la sperimentazione animale è
consentita solo se gli esecutori del progetto
possono chiaramente dimostrare che non
esistono alternative all'uso degli animali e che i
potenziali vantaggi derivanti dalla
sperimentazione animale superano le eventuali
sofferenze causate agli animali stessi.
CVAM - Centro europeo per la
validazione di metodi alternativi
• L'ECVAM è stato istituito dalla Commissione europea
nel 1990 per coordinare lo sviluppo e la validazione
delle alternative ai metodi di sperimentazione
animale.
• Il Centro, che fa parte del Centro comune di ricerca
dell'UE, organizza seminari periodici e unità
temporanee incaricate di esaminare la situazione in
corso delle prove alternative e dà consulenza in
merito alla promozione dell'integrazione nei processi
normativi delle prove in vitro e di altri metodi.
“ANIMAL CARE”
La scienza dell’animale da laboratorio
si propone:
• Regolamentazione della sperimentazione
• Preparazione professionale del personale e
certificazione di qualifiche
• Diffusione dell’informazione
• Aggiornamento sulle moderne tecnologie per
garantire il benessere dell’animale
• Educazione alla ricerca di tecniche alternative
per ridurre l’uso degli animali
LE FIGURE
PROFESSIONALI NELLA
SPERIMENTAZIONE
ANIMALE
Cat. A: addetti all'animal care
Cat. B: personale tecnico addetto
alla sperimentazione
Cat. C: ricercatori responsabili
del progetto e della conduzione
dell'esperimento
Cat. D: esperti in "scienza
dell'animale da laboratorio.
• La sperimentazione animale, condotta secondo
rigidi principi etico-scientifici e in ottemperanza
alle disposizioni legislative non è
VIVISEZIONE
Dalle più recenti statistiche emerge che:
• Il maggior numero di animali è utilizzato in
esperimenti dedicati alla valutazione rischio/
beneficio dei prodotti chimici cui sempre più
uomo ed animali sono esposti.
• La maggior parte degli esperimenti non
richiede anestesia, perché le procedure non
comportano dolore o sofferenza.
DECRETO LEGISLATIVO
27 gennaio 1992 n° 116
Attuazione della direttiva n°
86/609/CEE in materia di protezione
degli animali utilizzati a fini sperimentali
o ad altri fini scientifici
Dall’esame dei testi emerge che il D. Lgs.
è una modifica, in senso restrittivo della
norma europea
Il decreto legislativo definisce i termini di:
a) Animale (da esperimento, da allevamento)
b) Esperimento
c) Stabilimento (di allevamento, fornitore,
utilizzatore)
e precisa nei dettagli le condizioni di lavoro,
di stabulazione, ecc. nella sperimentazione
animale
In particolare:
• La tipologia degli esperimenti per i quali è consentito
l’uso degli animali
• La figura del responsabile della specifica ricerca
• La figura del medico veterinario consulente
• La tipologia delle sperimentazioni che richiedono una
specifica autorizzazione preventiva
• I requisiti ambientali richiesti per la stabulazione
• L’obbligo della registrazione degli animali utilizzati
• Le procedure per la comunicazione delle esperienze
agli organi competenti
• Le procedure per ottenere l’autorizzazione a
stabilimento utilizzatore
• La legge impone obblighi da rispettare, stabilisce
divieti, sancisce punizioni per inadempienze, ma
non fornisce le modalità operative per
ottemperare alle disposizioni.
• Pertanto i ricercatori applicano le norme, secondo
un codice etico professionale
• Il team di animal care and use è affiancato da
un Comitato Etico (IACUC = Institutional
Animal Care Unit Committee), in cui esperti di
veterinaria, legislazione, clinica, di solito esterni
all’istituzione, hanno funzione di revisione dei
progetti e dei protocolli, di ispezione dell’
esecuzione, di valutazione dei criteri adottati per
rispettare il benessere degli animali
ANIMALI UTILIZZATI A FINI
SPERIMENTALI (D.L. 27-1-1992 n. 116)
•La stabulazione degli animali deve
avvenire in condizioni ottimali;
•Le condizioni ambientali devono essere
controllate e la dieta deve avere
composizione costante e nota durante
tutta la sperimentazione;
•La relazione deve menzionare le misure
adottate per realizzare queste condizioni.
MOVIMENTAZIONE DEI MATERIALI E
DEGLI ANIMALI
Animali da
allevamenti
esterni
allevamento
anim
Stoccaggio
materiale pulito:
lettiera, mangime
giacenza
anim
quarantena
lavaggio e
ie sterilizzazione
b
b
ga
anim
isolamento
ga
bb
ie
sperimentazione
eutanasia
Struttura di uno stabulario
corridoio sporco
area di lavaggio
sporco
pulito
corridoio pulito
ai
laboratori
corridoio sporco
Fattori che possono influenzare il risultato
sperimentale
Fattori
fisici
Fattori
chimici
Fattori
biologici
Fattori
comportamentali
Temperatura
Umidità
Ventilazione
Ciclo luce-buio
Illuminazione
Rumore
Alimentazione
Lettiera
Odori, polveri,
gas
Insetticidi,
disinfettanti
Animali
malati
Insetti
Uomo
N° di animali
per gabbia
Presenza di
animali di specie
o sesso diversi
Manipolazione
TEMPERATURA OTTIMALE NEI
LOCALI DI STABULAZIONE per
alcune specie di laboratorio
20-28 °C
20-24 °C
15-21 °C
10-24 °C
Primati del
Nuovo
mondo
Topo
Ratto
Criceto
Gerbillo
Cavia
Primati del
Vecchio
mondo
Coniglio
Gatto
Cane
Maiale
riduzione assunzione cibo
(g/die)
Effetto del rumore sull’assunzione di cibo
controllo
esposti a rumore
0
1
3
4
giorni
5
6
La composizione e le modalità con cui
si somministra una dieta influenzano lo
stato di salute le prestazioni ed il
metabolismo dell’animale.
NUTRIENTI
•
•
•
•
•
•
GRASSI
FIBRE
PROTEINE
ZUCCHERI
MINERALI ed oligoelementi
VITAMINE
DIETE
• NATURALI a formula chiusa o aperta.
Costituite da farine di avena, mais, pesce, soia.
• PURIFICATE formulate miscelando
ingredienti naturali, sostanze purificate ed
ingredienti che hanno subito vari gradi di
raffinazione
• CHIMICAMENTE DEFINITE contengono
nutrienti purificati, come aminoacidi liberi al
posto delle proteine, zuccheri specifici, ecc.
Oggi il termine “ANIMALE DA
LABORATORIO” è stato sostituito con
“MODELLO ANIMALE”
definito come:
un organismo vivente con un processo
patologico trasmesso geneticamente,
spontaneamente acquisito o indotto, che in
uno o più aspetti ha stretta similitudine con lo
stesso fenomeno che si verifica nell’uomo
Che cosa è un organismo modello?
• Nel secolo scorso le ricerche condotte su un numero ristretto di
organismi sono state cruciali nel consentire l’avanzamento nella
comprensione di numerosi processi biologici. Questo perché
sotto molti aspetti le caratteristiche biologiche di base della
maggior parte degli organismi sono simili, ma spesso è più
semplice studiare un particolare aspetto in un organismo
piuttosto che in un altro. Questi organismi più frequentemente
adoperati sono definiti ”organismi modello”, dal momento
che ciascuno possiede uno o più caratteristiche che lo rendono
adatto a determinati studi di laboratorio. Gli organismi modello
più diffusi presentano numerosi vantaggi ai fini sperimentali,
come rapido sviluppo e breve ciclo vitale, taglia ridotta, pronta
disponibilità, manipolabilità e diventano sempre più utili nel
momento in cui sono adottati da un crescente numeroso di
studiosi. Questi organismi forniscono un grande numero di dati,
utilizzabili per l’analisi dei processi evolutivi, di regolazione
genica, delle malattie genetiche.
MODELLI NON MAMMIFERI
• molti organismi non mammiferi sono
utilizzabili per lo studio di processi
biologici di mammiferi e per la maggior
parte degli studi di genomica
http://www.ncbi.nlm.nih.gov/About/model/mammal.html
Gli Archaea sono fra gli organismi viventi più interessanti.
Storicamente, sono stati considerati fra i batteri, ma i lavori più
recenti dimostrano numerose differenze. Gli Archaea sono
unici per due motivi.
Essi rappresentano gli organismi più primitivi finora studiati e
presentano numerose similitudini con alcuni fossili.
Essi vivono in ambienti estremi, da cui il nome di “estremofili”.
Gli studi sulle molecole che consentono agli estremofili di vivere
si sono rivelati molto interessati in campi quali la
bioremediation, i cambiamenti climatici globali, le biotecnologie
e la produzione di energia. Inoltre, nonostante le somiglianze
con i batteri e con i geni dei batteri, essi presentano
caratteristiche geniche simili agli eucarioti e caratteristiche di
unicità. Gli studi su questi geni unici possono fornire
informazioni sull’evoluzione della vita sulla terra.
I Microbi rappresentano più del 60% della biomassa
terrestre. Essi sono sopravvissuti e si sono evoluti per più di
3.7 miliardi di anni e sono in grado di vivere in quasi tutti gli
ambienti.
La diversità ed la varietà di adattamenti ambientali
indicano che I microbi hanno “risolto” già parecchio tempo
fa’ problemi per i quali scienziati cercano da tempo delle
soluzioni. Inoltre la maggior parte dei microbi non sono
patogeni per gli uomini, gli animalin o le piante. Quindi lo
studio e la comprensione dei diversi gruppi di microbi a
livello genomico potrebbe dare delle risposte a sfide tuttora
aperte in ambito medico, agricolo, ambientale, di processi
industriali, della produzione ed uso di energia.
L’ameba Dictyostelium discoideum è un potente e
versatile organismo modello, grazie alla rapidità del
suo ciclo vitale ed alla facilità di mantenimento, in
molti ambiti della biologia cellulare e molecolare. Le
cellule di Dictyostelium crescono come organismi
unicellulari ma, in assenza di nutrimento, si aggregano e
formano un tessuto pluricellulare, capace di differenziarsi
in diversi tipi cellulari. Nel corso di questo programma di
sviluppo, le amebe si servono di molti processi cellulari
(chemiotassi, riarrangiamento del citoscheletro,
trasduzione del segnale), formando alla fine un corpo
fruttifero con spore. Dal momento che il ciclo vitale
consiste di fasi unicellulari e pluricellulari, Dictyostelium
fornisce preziose informazioni sui processi necessari alla
pluricellularità.
Saccharomyces cerevisiae, il comune lievito, è
adoperato in diversi settori di ricerca già da parecchio
tempo. Il genoma del ceppo da laboratorio S288C è stato
completamente sequenziato nella primavera del 1996. Il
lievito è quindi il primo organismo eucariotico di cui sia
stato sequenziato il genoma, fornendo gli strumenti per la
conoscenza del genoma umano e di altri eucarioti.
Caenorhabditis elegans è un piccolo nematode del
suolo ed èl’animale multicellulare meglio caratterizzato a
livello genomico, genetico, embriologico, di biologia
cellulare e neurobiologigia. Il suo genoma è stato
completamente sequenziato. Una caratteristica peculiare
di C. elegans, fra tutti gli organismi modello, è che può
essere mantenuto e manipolato geneticamente con la
stessa facilità e velocità di un microrganismo, pur
possedendo le proprietà di un organismo animale
completo. C. elegans ha un completo assetto di organi e
sistemi, un complesso sistema sensorio, un
comportamento coordinato e si distingue per il fatto che
è possibile tracciare ognuna delle circa 1000 cellule che
lo costituiscono. Inoltre sono state mappate nei dettagli
la morfologia, lo sviluppo e le funzionidi tutte le sue
cellule.
Il moscerino della frutta, Drosophila melanogaster, è
stato usato nella ricerca biologica per oltre un secolo ed è
considerato un interessante sistema di studio per diverse
ragioni.
E’ facile manipolare I suoi caratteri genetici,
relativamente economico e presenta una complessità
biologica paragonabile a quella di un mammifero. Molti
sistemi organici nei mammiferi hanno omologhi ben
conservati in Drosophila, e le ricerche su Drosophila
hanno già permesso interessanti scoperte su alcune
forme tumorali, su malattie degenerative, sul
comportamento, l’immunità, l’invecchiamento,
l’ereditarietà, lo sviluppo.
• Il pesce zebra Danio rerio, è usato come organismo
modello per le sue piccole dimensioni, il suo breve ciclo
vitale, la facilità di allevamento e la capacità di presentare
rapide mutazioni, interessanti ai fini della conoscenza di
patologie umane.
Lo sviluppo embrionale del pesce zebra può essere
seguito grazie alla trasparenza dell’uovo e somiglia
molto a quello di organismi superiori, permettendo di
studiare lo sviluppo e le possibili mutazioni. Con
l’uomo condivide poi il sangue, i reni, ed il sistema
ottico. Inoltre il suo genoma è metà di quello del
topo e dell’uomo, il che rappresenta un vantaggio
per individuare geni “chiave” dei vertebrati.
MAMMIFERI
RODITORI
Il topo è il modello di mammifero più vicino all’uomo. Le
sequenze geniche che codificano per diverse proteine
coinvolte in processi vitali presentano un elevato grado di
somiglianza fra uomo e topo. Per questi motivi il topo si è
rivelato un prezioso modello nella ricerca in ambiti quali la
biologia dello sviluppo, la genetica, l’immunologia. Il
sequenziamento del suo genoma fornisce inoltre un
sistema per lo studio e la comprensione di patologie umane
e delle relative strategie terapeutiche
http://www.ncbi.nlm.nih.gov/About/model/mammal.html
Il ratto rappresenta il modello principale nello studio del
legame geni-funzione. Il grande numero di ceppi inbred
(~400) e la vasta quantità di dati disponibili sul ratto
forniscono fondamentali strumenti per lo studio delle
malattie dell’uomo. Alcuni modelli di malattia umana sono
ottenibili solo nel ratto, che rappresenta quindi una risorsa
unica per sa conoscenza delle basi genetiche di tali
patologie. Il ratto è anche un modello di studio per la
fisiologia dell’apparato cardio-vascolare, della circolazione
polmonare, del metabolismo, del controllo neurologico, delle
differenze genere-correlate e età-correlate, degli studi
sull’ipertensione e sui sistemi di neurotrasmissione.
TOPO (mus musculus)
RATTO(rattus norvegicus)
Durata di vita
Pubertà
Ciclo estrale
gravidanza
pseudogestazione
Peso alla nascita
N° nati
Svezzamento
Peso svezzamento
24 – 36 mesi
6-8 settimane
≈ 5 giorni
18-21 giorni
10-12 giorni
≈1,5 g
8-10
21-23 giorni
≈10 g
≈ 3 anni
45 gg. femmina, 50 gg. maschio
Peso adulto
Temperatura
rettale
Ritmo cardiaco
20-25 → 40-50
36- 37 °C (ambiente
20-24 °C)
≈ 400-700 /min
Frequenza resp.
Pressione arteriosa
Fabbisogno
alimentare
Fabbisogno idrico
≈80-200/min
≈100/140 mm Hg
3-4 g/20 g p.c./die
300-600 g
37,5- 38,5 °C (ambiente 20-24
°C)
≈ 270-350 /min
≈66-114/min
≈110/120 mm Hg
3-7 ml
≈ 5 giorni
19-23 giorni
12 –14 giorni
≈4,5 g
8-12
21-23 giorni
≈50 g
10-20 g/die
20-45 ml
CAVIA (cavia porcellus)
Durata di vita
≈ 6-8 anni
Pubertà
70 gg. (femmina), 28-35 gg. (Maschio)
Ciclo estrale
14-19 giorni
gravidanza
59-72 giorni
Peso alla nascita
75-100 g
N° nati
8-12
Svezzamento
15-20 giorni
Peso allo svezzamento
180-240 g
Peso adulto
600-1000 g
Temperatura rettale
38,2-40,5 °C (ambiente 20-24 °C)
Ritmo cardiaco
≈ 226-400 /min
Frequenza respiratoria
≈69-104/min
Fabbisogno alimentare
≈ 30 g/die
Fabbisogno idrico
≈85 ml+ 30 g foraggio verde
CRICETO
(mesocricetus auratus - cricetulus griseus)
Durata di vita
≈ 570 giorni
Pubertà
6-8 sett. (femmina), 8-12 sett.(maschio)
Ciclo estrale
≈ 4 giorni
gravidanza
15-19 giorni (20-21) *
Peso alla nascita
≈2-4 g (1,5-2,5) *
N° nati
5-7
Svezzamento
18-20 giorni (21) *
Peso allo svezzamento
≈30-40 g
Peso adulto
100-140 g
Temperatura rettale
35,8-37 °C (ambiente 20-24 °C)
Ritmo cardiaco
≈ 380-412 /min
Frequenza respiratoria
≈33-127/min
Fabbisogno alimentare
7-15 g/die
Fabbisogno idrico
8-12 ml
(4-5) *
(16-18) *
(40-45) *
*in verde per il c. griseus
CONIGLIO (oryctolagus cuniculus)
Durata di vita
≈ 7-8 anni (max 15 anni)
Pubertà
Varia secondo la razza da 4 a 12 mesi
Ciclo estrale
poliestro
gravidanza
28-36 giorni
Peso alla nascita
30-70 g
N° nati
6-10
Svezzamento
6-8 settimane
Peso adulto
2,5-6 kg
Temperatura rettale
38,5-40 °C (ambiente 15-21 °C)
Ritmo cardiaco
≈ 200-250 /min
Frequenza respiratoria
≈38-60/min
Fabbisogno alimentare
25-49 g/kg/die
Fabbisogno idrico
62-140 ml/kg
STANDARDIZZAZIONE DEGLI
ESPERIMENTI CON ANIMALI
La variabilità di una popolazione può
essere di origine genetica o ambientale
• La variabilità ambientale in condizioni
artificiali può essere in gran parte
controllata mediante standardizzazione
delle tecniche di stabulazione,
alimentazione ecc.
• La variabilità genetica è controllata con
adatti metodi di allevamento e selezione
STANDARDIZZAZIONE GENETICA
DEGLI ANIMALI DA LABORATORIO
Uno dei fattori che maggiormente
contribuisce alla variabilità dei
risultati sperimentali è il
BACKGROUND GENETICO
degli animali da laboratorio
ANIMALI DA LABORATORIO
stato genetico
RANDOM BREEDING
(outbred)
INBREEDING
(inbred)
HYBRID BREEDING
(ibridi F1)
COISOGENICI e
CONGENICI
TRANSGENICI
KNOCKOUT
Accoppiamenti fra non
consanguinei
Accoppiamenti fratello-sorella
per almeno 20 generazioni
Accoppiamento fra due linee
consanguinee
Linee mutanti
Linea in cui un carattere
genetico è introdotto o tolto
dallo sperimentatore
Controllo della qualità genetica
La contaminazione genetica di un ceppo
inbred può avere cause svariate e
rimanere non identificata per un certo
tempo
È quindi necessario controllarne
regolarmente l’uniformità e l’autenticità
UNIFORMITÀ e AUTENTICITÀ
Sono testati mediante test di istocompatibilità
•“in vivo” praticando un innesto cutaneo:
l’attecchimento o il rigetto dipendono in gran parte
dalla compatibilità dell’aplotipo MHC tra il donatore e
il ricevente
•“in vitro” utilizzando test sierologici
•Con la ricerca di markers biochimici (isozimi)
specifici mediante elettroforesi
•Con la ricerca di markers del DNA
La tecnica del congelamento degli embrioni riduce
l’inevitabile “deriva genetica”
ANIMALI OUTBRED
Gli animali outbred sono indicati con un simbolo indicante l’allevatore o
rivenditore, seguito da due punti e dal simbolo dello stock costituito da 1-4
lettere. Es. Han: NMRI
• Derivano dall’incrocio RANDOM di individui
di uno “stock chiuso”
• Lo scopo è quello di evitare l’ inbreeding e
mantenere la variabilità genetica (∆F<1%)
• A questo scopo è necessario disporre di un
numero elevato di riproduttori (almeno 25
coppie di genitori)
• Il minimal breeding si ottiene mediante:
a) La scelta delle coppie
b) La scelta dei soggetti riproduttori
b) La scelta dei
B random
soggetti
5 coppie
riproduttori
riproduttori
F
a) La scelta
delle
coppie
A (fxs)
C random
80 coppie
riproduttori
generazioni
Evitare incroci fra
consanguinei
Scegliere come
riproduttori ad ogni
generazione un
ugual numero di
soggetti da ogni
famiglia
c) Ridurre la velocità di passaggio da una
generazione alla successiva, usando i riproduttori
più a lungo possibile e costituendo le coppie della
successiva generazione con i nati dell’ultima
nidiata.
ANIMALI INBRED
• Sono animali prodotti dall’accoppiamento di due
genitori che presentano un certo grado di
parentela fra loro, quindi
F
A (fxs)
Presentano un grado di
omozigosi superiore alla
media della popolazione
B random
5 coppie
riproduttori
C random
80 coppie
riproduttori
generazioni
• La riduzione di eterozigosi (aumento di omozigosi)
è misurata mediante il coefficiente di
inbreeding (F), compreso fra 0 e 100, che
aumenta ad ogni generazione inbred in rapporto al
grado di parentela tra i componenti la coppia
ANIMALI INBRED
• Per ogni generazione di accoppiamento fra cugini
primi l’incremento di omozigosi è dell’8 %, fra
fratellastri è circa del 10 %, fra fratelli e sorelle (f x s)
o genitori e figli è del 19 %
• Il coefficiente aumenta rapidamente alle prime
generazioni, mentre rallenta man mano che si avvicina
al valore massimo, tendendo asintoticamente a 100
Un ceppo è considerato inbred dopo almeno 20
generazioni di accoppiamenti fra fratelli e
sorelle o genitori e figli. Alla 21a generazione F=
98,6 %, cioè il 98,6% dei geni originariamente
eterozigoti sono stati fissati in omozigosi.
La consanguinetà e l’inbreeding permettono di costituire linee
pure in seno alla popolazione originaria, che si diversificano
sempre più man mano che il coefficiente di inbreeding aumenta*
Generazione
1600 Aa
0
1
% eterozigosi
100
400 AA
800 Aa
400 aa
2 400 AA 200 AA
400 Aa
200 aa 400 aa 25
3 600 AA 100 AA
200 Aa
100 aa 600 aa
100 Aa
50 aa
4
700 AA
50 AA
50
700 aa
12,5
6,25
*ipotetico caso di autofecondazione da 1600 eterozigoti con 1600 geni “A” e 1600 “a” .
Se consideriamo 10-20 caratteri diversi (polieterozigosi) avremo classi separate di
omozigoti per ogni carattere.
CONSEGUENZE dell’ INBREEDING sono:
SCARSO VIGORE
L’aumento di omozigosi
relativa a geni letali o
semiletali e la perdita di
geni utili alla salute degli
individui, rende i ceppi
INBRED poco prolifici,
meno resistenti alle
infezioni e alle variazioni
ambientali, causando la
“morte genetica” di
molte linee
VARIABILITÀ
fra le linee pure
La variabilità
genetica diminuisce
nella singola linea
pura, ma aumenta
tra le linee più o
meno secondo il
sistema di
allevamento
adottato:
• A linee parallele
• A linea singola
A linee parallele
Combinazione
dei due sistemi
A linea singola
0
0 0 0 00
0 0 0 00
0 0 0 00
1
0 0 0 00
0 0 0 00
0 0 0 00
2
0 0 0 00
0 0 0 00
0 0 0 00
3
0 0 0 00
0 0 0 00
0 0 0 00
4
0 0 0 00
0 0 0 00
0 0 0 00
5
0 0 0 00
0 0 0 00
0 0 0 00
Nel sistema a linee parallele le linee si
diversificano sempre più ad ogni generazione. Dopo
12 generazioni ognuna può essere considerata come
una sottolinea a sé.
Nel sistema a linea singola ciò è evitato in quanto
ogni individuo non dista più di una generazione dal
genitore comune.
Nella pratica si adotta una combinazione fra i due
sistemi di allevamento.
In ogni generazione, una parte di individui sono
destinati ad accoppiamenti random per non più di tre
generazioni (in queste condizioni il grado di
inbreeding si mantiene praticamente costante) la
prole è utilizzata per la sperimentazione e non per la
riproduzione, una parte è destinata al
mantenimento della linea pura.
COMMETTEE on STANDARDIZED
NOMENCLATURE for INBRED
STRAINS OF MICE
• Un ceppo inbred è identificato da un codice composto da 1-4
lettere maiuscole. Es. A; DBA, WAG.
• I nomi alfanumerici di alcuni vecchi ceppi (C3H; C57BL) sono
stati mantenuti perché già ampiamente accattati e
riconosciuti.
• Al fine di facilitare la comparazione dei risultati è essenziale,
nella descrizione degli esperimenti, la corretta nomenclatura.
• I ceppi inbred possono essere suddivisi in sottoceppi: dopo 819 generazioni di accoppiamenti (fxs) un ceppo stabilizzato
viene diviso in linee parallele che diventeranno sottoceppi se
si individuano differenze. Il simbolo del sottoceppo è apposto
a quello del ceppo, separato da una barra (es. C57BL/6J).
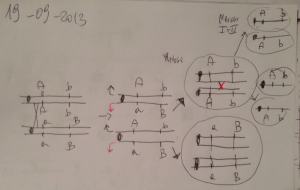
• Derivano dall’incrocio di due ceppi
aa
IBRIDI bb inbred
• Sono eterozigoti per tutti i geni per
F1 CC i quali i ceppi parentali differiscono
DD • Sono più vigorosi, resistenti e
ee
prolifici dei ceppi parentali
FF • Sono geneticamente uguali, ma
Meiosi
a
non risentono della depressione
b
dovuta alla consanguineità e
B
C
risentono meno delle influenze
c
D
d
ambientali
e
E
f F
• Possono talora presentare risposte
non uniformi (effetto Tryon), forse
sono
Aa
per la migliore capacità di
indicati con le
Bb
adattamento all’ambiente
sigle dei ceppi
Cc
• Generalmente accettano trapianti
materno e
da ambedue i ceppi parentali
paterno
Dd
separati da
• Non sono destinati alla
Ee
una barra.
riproduzione
Ff
AA
BB
cc
dd
EE
ff
A
CEPPI INBRED
specie ceppo
caratteristiche
topo
Elevata incidenza tumori mammari
Atrico, privo d cellule T
Modello di patologie autoimmuni
(artrite da collagene). Elevata
incidenza di tumori mammari
Sviluppa epilessia audiogena
Obeso
Manca di linfociti T e B. Può quindi
ricevere trapianti (es. tumori
umani) senza rigetto
Iperteso
Normoteso (usato come controllo)
C3H
nude
DBA/1
DBA/2
OB
SCID (severe combined
immunodefiency)
Ratto
SHR
Wistar Kyoto
ANIMALI MUTANTI
COISOGENICI
e CONGENICI
ANIMALI MUTANTI
COISOGENICI
• Gli animali coisogenici derivano dalla occasionale
comparsa, in un ceppo inbred, di una mutazione utile
ai fini sperimentali, che viene stabilizzata
Il ceppo coisogenico è geneticamente simile al
ceppo originario, tranne che per il gene mutato
• La nomenclatura contiene il nome completo del
ceppo di provenienza e del sottoceppo separati da
una barra e l’indicazione del gene mutante. Es.
BALB/cRij-nu indica un ceppo BALB/c portante l’allele
“nude” e mantenute a Rijswijk (Olanda)
ANIMALI MUTANTI
CONGENICI
• Gli animali congenici derivano dall’introduzione,
mediante opportuni incroci (cicli di
intercrossing / backcrossing per almeno 10
volte), di una mutazione recessiva presente in
un ceppo inbred (donatore)
Il ceppo congenico è geneticamente
simile al ceppo originario, tranne che per
il gene donato e per alcuni geni
concatenati al locus di interesse
La nomenclatura è simile a quella degli animali
coisogenici.
CEPPO
INBRED A
+
cross
CEPPO D
donatore
m
X
+
+
intercross
+
X
m
backcross
m
+
X
+
m
m
m
ANIMALI TRANSGENICI
Gli animali transgenici derivano dall’introduzione di un
gene esogeno nel DNA di un ceppo inbred stabilizzato
• Microiniezione del
DNA nel pronucleo
• È la più comune, per la semplicità e l’alta
percentuale di espressione. La posizione
all’interno del cromosoma ed il numero delle
copie della sequenza di DNA sono casuali, per
cui ogni “fondatore” sarà diverso dagli altri. Il
vantaggio sta nel fatto che il DNA esogeno si
trova in tutti i tessuti dell’individuo, compreso
quello germinale.
• Infezione con
• Semplice, ma a bassa espressione e limiti nella
retrovirus
lunghezza di DNA che può essere inserito. Il
tessuto germinale può non essere interessato
• Più complessa. Il tessuto germinale può non
• Trasferimento di
essere interessato
cellule embrionali Gli animali transgenici sono indicati dal nome del
pluripotenti nella ceppo, seguito dal simbolo del transgene. Es.
cavità blastocistica C57BL/6J-TgN (GG)L (N=inserzione non omologa)
Infezione con retrovirus
•Sfrutta la capacità dei virus di introdurre il proprio
genoma nella cellula ospite, provocandone la
trasfezione
•L’inoculazione nella cavità blastocistica delle
particelle virali provocherà “l’infezione” di alcune
cellule (trasfezione)
•Le cellule così modificate, come le altre rimaste
indenni, contribuiranno alla formazione di un
individuo “mosaico” o “chimerico”
•Se le cellule trasfettate non andranno a costituire
tessuto germinale il frammento di DNA non sarà
trasferito alla prole e si perderà alla prima
generazione
Trasferimento di cellule embrionali
pluripotenti nella cavità blastocistica
• Se si introducono cellule staminali embrionali
totipotenti nella cavità blastocistica, queste
contribuiranno alla formazione dei tessuti
dell’intero organismo
• I metodi utilizzati sono:
Elettroporazione
Infezione virale
Microiniezione
ANIMALI KNOCKOUT
• Gli animali knockout sono individui in cui uno specifico
gene viene sostituito con un allele inattivo
• La tecnica consiste nel “disabilitare” selettivamente un
gene target in cellule staminali embrionali
• Gli animali knockout consentono di studiare le specifiche
funzioni del gene sostituito
BARRIERATI
ANIMALI DA LABORATORIO
stato sanitario
CONVENZIONALI
Allevati in ambienti privi di
particolari misure protettive
SPECIFIC PATHOGEN
FREE (SPF)
Privi di germi patogeni
GERM FREE
Privi di patogeni e non
patogena
GNOTOBIOTICI
(mono/eteroxenici)
Ospitano una flora batterica
nota (flora intestinale
introdotta artificialmente) e
rigorosamente non patogena
QUALITÀ MICROBIOLOGICA
CONVENZIONALI
(CV)
BARRIERA
NESSUNA
riderivazione per isterectomia
GERM FREE (GF)
+
Flora batterica resistente
alla colonizzazione (CRF)
ASSOLUTA
controlli microbiologici
SPECIFIC PATHOGEN
FREE (SPF)
SISTEMA SPF
stretto (allevamento)
classico (sperimentazione)