Chimica Fisica – Biotecnologie sanitarie
Lezione n. 13
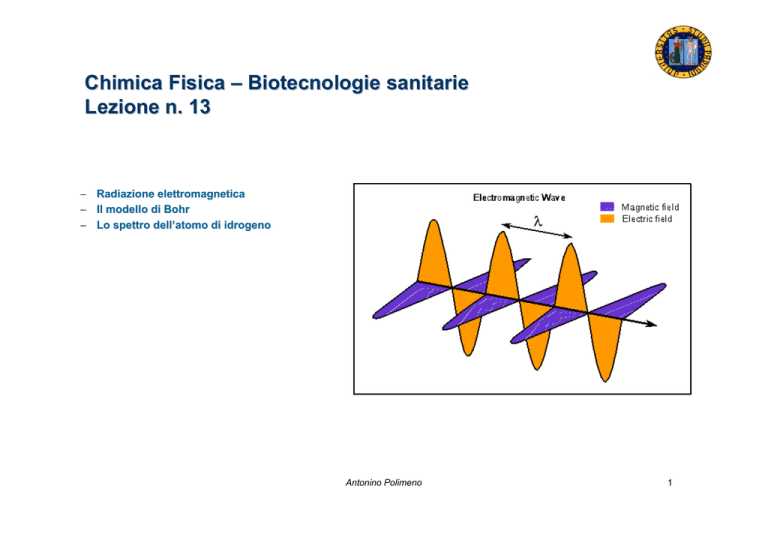
− Radiazione elettromagnetica
− Il modello di Bohr
− Lo spettro dell’
dell’atomo di idrogeno
Antonino Polimeno
1
Radiazione elettromagnetica (1)
-
Rappresentazione classica della radiazione elettromagnetica (Maxwell,
1864): oscillazione (onda) del campo elettrico (e magnetico)
ortogonalmente alla direzione di propagazione.
-
La radiazione elettromagnetica è formata da un campo elettrico e
magnetico oscillanti (E e B); la direzione di propagazione è diretto lungo
l’asse x; il campo elettrico è diretto lungo l’asse y.
Antonino Polimeno
2
Radiazione elettromagnetica (2)
-
La legge che descrive un campo elettrico (magnetico) nello
spazio e nel tempo è
G
G
⎡ 2π
⎤
Ey ( z , t ) = xE0 cos ⎢ ( z − ct ) ⎥
⎣λ
⎦
-
c è la velocità della radiazione nel vuoto = 2.988 ×108 m/s
Antonino Polimeno
3
Radiazione elettromagnetica (3)
Spettro elettromagnetico
Antonino Polimeno
4
Radiazione elettromagnetica (4)
Grafico di Ey/E0 contro z (in nm) per una lunghezza d’onda di 1 e 10 micrometri
Antonino Polimeno
5
Radiazione elettromagnetica (5)
Grafico di Ey/E0 contro t (in fs) per una lunghezza d’onda di 1 e 10 micrometri
Antonino Polimeno
6
Radiazione elettromagnetica (6)
-
La lunghezza d’onda è proporzionale al periodo di oscillazione della radiazione
T=
-
-
-
λ
c
⇒ λ = cT
La lunghezza d’onda si indica con λ
L’unità di misura SI della lunghezza d’onda è il metro, con i suoi sottomultipli:
- 1 µm = 10-6 m (micrometro)
- 1 nm = 10-9 m (nanometro)
- 1 pm = 10-12 m (picometro)
Un’unità di misura non SI della lunghezza d’onda molto usata è l’Angstrom, che ha l’ordine di
grandezza tipico delle distanze interatomiche
- 1 Ǻ = 10-8 cm = 10-10 m = 0.1 nm
La frequenza è inversamente proporzionale al periodo dell’oscillazione della radiazione
-
1 c
υ= =
T λ
La frequenza di indica con ν
L’unità di misura SI è l’hertz
- 1 Hz = 1 s-1
Una grandezza collegata è il numero d’onda (di solito espresso in cm-1)
υ=
1
λ
⇒ υ = cυ
Antonino Polimeno
7
Radiazione elettromagnetica (7)
-
Esempio: calcolo della frequenza e del numero d'onda di radiazione
con lunghezza d'onda pari a 5000 angstrom; a quale colore
corrisponde?
λ = 500 nm = 5 ×10 m = 5 × 10 cm
−7
−5
2.988 × 10
15
= 0.6 × 10 Hz
υ= =
−7
5 × 10
λ
1
-1
υ = = 20000 cm
c
8
λ
Antonino Polimeno
8
verde (quasi blu)
Antonino Polimeno
9
Antonino Polimeno
10
Antonino Polimeno
11
Radiazione ed energia
-
-
-
La radiazione elettromagnetica trasporta energia: secondo la fisica
non-quantistica il flusso di energia è proporzionale a E02, e può
essere modulato in modo continuo
Planck (radiazione del corpo nero, 1900) ed Einstein (effetto
fotoelettrico, 1905), propongono una visione del tutto nuova:
l'energia della radiazione elettromagnetica è quantizzata.
La radiazione è vista come un insieme di fotoni che si propagano
a velocità c ciascuno con energia (‘pacchetti’ discreti di energia)
h
E = hν =
2πυ = =ω
2π
-
dove h è la costante di Planck, con le dimensioni di un’energia per
tempo (azione)
−34
h = 6.626 × 10
Antonino Polimeno
Js
12
Atomo di idrogeno – Modello di Bohr (1)
-
Gli esperimenti di Rutheford (1911) dimostrarono che
- un’atomo è formato da un nucleo carico positivamente
(protoni+neutroni) e da elettroni carichi negativamente
- il nucleo di un atomo (protoni+ neutroni) è concentrato in una
regione molto più piccola del volume dell’atomo stesso, mentre
gli elettroni occupano tutto lo spazio rimanente
- Gli elettroni hanno una massa molto minore di quella dei nuclei
mH
≈ 1800
me
-
Possiamo quindi immaginare l’atomo, usando una descrizione
classica, come un nucleo pesante centrale e piccolo intorno al quale
orbitano gli elettroni leggeri.
Antonino Polimeno
13
Antonino Polimeno
14
Atomo di idrogeno – Modello di Bohr (2)
- L’ordine di grandezza delle dimensioni di un atomo è
circa un angstrom=10-10 m
- L’ordine di grandezza delle dimensioni di un nucleo è
circa un 10-15 m
- In altre parole: un atomo è centomila volte più grande di
un nucleo; se il nucleo fosse ingrandito fino a
raggiungere le dimensioni di una biglia, l’atomo avrebbe
le dimensioni di un campo di calcio.
Antonino Polimeno
15
Atomo di idrogeno – Modello di Bohr (3)
-
Il primo modello della struttura di un atomo è dovuto a Bohr (1913).
Consideriamo nel seguito specificamente il caso dell’atomo di
idrogeno. Sappiamo che
1. L’atomo di idrogeno è formato da un nucleo con carica +e e
massa mp ( un protone) e da un elettrone di carica –e e massa
me
2. L’atomo è stabile e il suo volume complessivo è molto maggiore
delle dimensioni del nucleo, suggerendo che l’elettrone ‘occupa’
la maggior parte del volume dell’atomo
3. Tra il nucleo e l’elettrone esiste un potenziale di interazione
elettrica, che dipende dalle loro cariche e dallo distanza reciproca
2
q
q
1 elettrone protone
1 e
U=
=−
r
4πε 0
4πε 0 r
Antonino Polimeno
16
Atomo di idrogeno – Modello di Bohr (4)
-
-
Il potenziale elettrostatico è
negativo, tende a meno infinito
per una distanza tendente a
zero; tende a zero per una
distanza tendente all’infinito
La carica di un elettrone è
misurabile come la carica di
una mole di elettroni, cioè di
un Faraday pari a 96485 C,
divisa per il numero di
Avogadro
e=
Antonino Polimeno
F
N
= 1.602 × 10−18 C
17
Atomo di idrogeno – Modello di Bohr (5)
-
-
Rutherford quindi postula un modello planetario, in cui l’elettrone orbita intorno al
nucleo.
Il modello planetario è basato su una stretta analogia tra il modello classico del moto
dell'elettrone con il moto planetario attorno al Sole, data la presenza in ambedue i
casi di un potenziale attrattivo la stessa dipendenza dalla distanza r (ovviamente la
costante d proporzionalità è diversa nei due casi).
Quindi dalla soluzione delle equazioni del moto di Newton si ottengono per gli stati
stabili le stesse soluzioni nella forma di traiettorie periodiche (orbite).
Nel caso di una orbita circolare di raggio r, l'analisi classica determina i seguenti
valori per l'energia totale E (somma dell'energia cinetica e dell'energia potenziale) e
per il periodo T dell'orbita
E=−
-
α
r
T = 2π m / α r 3/ 2
Quindi orbite a raggio decrescente corrispondono a diminuzioni sia dell’energia che
del periodo
Dal punto di vista classico il sistema risulta instabile in seguito alla perdita di energia
per emissione di radiazione elettromagnetica e conseguente "caduta" dell'elettrone
sul nucleo.
Antonino Polimeno
18
Antonino Polimeno
19
Atomo di idrogeno – Modello di Bohr (6)
-
Un dipolo elettrico è formato da due cariche uguali ed opposte +q e
–q ad una distanza r; il momento di dipolo è dato dal vettore
G
µ = qr
G
-
-
L'elettrone ruotante attorno al nucleo di idrogeno corrisponde ad un
momento di dipolo ruotante, e quindi ad una componente di
dipolo oscillante con frequenza 1/T lungo una direzione nel piano
dell'orbita.
Classicamente, un dipolo oscillante con frequenza ν agisce da
antenna di emissione di radiazione elettromagnetica con la stessa
frequenza. Data l'instabilità di tali orbite, la meccanica classica
non può descrivere la struttura dell'atomo.
Antonino Polimeno
20
Atomo di idrogeno – Modello di Bohr (7)
-
-
Osservazione sperimentale: spettro di emissione dell'idrogeno;
eccitazione degli atomi per mezzo di una scarica elettrica (via collisione tra
atomi e cariche accelerate) e successiva osservazione della radiazione
messa per diseccitazione
Previsione classica: emissione con frequenze decrescenti come un
continuo in seguito alla diseccitazione (perdita di energia radiante).
Dal punto di vista teorico si dovrebbe osservare uno spettro continuo (e
l’atomo non dovrebbe essere stabile); sperimentalmente si osserva
emissione per un insieme discreto di frequenze (o numeri d'onda) che
possono essere rappresentate come (Rydberg, 1890)
⎛ 1 1 ⎞
υ = RH ⎜ 2 − 2 ⎟
⎝ n1 n2 ⎠
-
Dove RH=109677 cm-1 è la costante di Rydberg e n1=1,2, … mentre
n2=n1+1, n1+2, …
Antonino Polimeno
21
Antonino Polimeno
22
Atomo di idrogeno – Modello di Bohr (8)
-
Il modello di Bohr postula l’esistenza di orbite elettronice stabili, a
cui corrispondono energie definite. L’atomo non ha, come previsto in
ambito classico, uno spettro continuo di valori energetici, ma può
esistere solo in determinati stati con energie corrispondenti.
1. L’elettrone si muove lungo orbite stabili circolari, con momento
angolare ed energie quantizzate
2. Gli elettroni non possono perdere o acquisire energia in modo
continuo e seguire traiettorie instabili; possono solo perdere o
guadagnare energia in modo discreto saltando da un’orbita stabile
ad un’altra, emettendo o acquistando un fotone la cui frequenza
associata si calcola secondo la formula di Bohr
∆E = E2 − E1 = hν
Antonino Polimeno
23
Atomo di idrogeno – Modello di Bohr (9)
-
-
Una volta stabilito che devono esistere orbite circolari stabili (con momento angolare
quantizzato), si possono applicare le regole della meccanica classica e ricavare I
valori delle energie orbitali
Le possibili energie delle orbite sono quantizzate dall’indice intero n=1,2, … (numero
quantico) secondo la relazione
1
En = − hcRH 2
n
-
La costante di Rydberg viene ad essere determinata in funzione di costanti
fondamentali
me e 4
RH = 2 3
8ε 0 h c
-
-
La diseccitazione corrisponde al salto di un elettrone dal livello n2 al livello n1
me e 4 ⎛ 1 1 ⎞
∆E = 2 3 ⎜ 2 − 2 ⎟
8ε 0 h c ⎝ n1 n2 ⎠
Il modello di Bohr giustifica la discretizzazione delle frequenze di emissione, per non
spiega perchè le energie delle orbite siano quantizzate
Antonino Polimeno
24
Antonino Polimeno
hν
25
Antonino Polimeno
26
Atomo di idrogeno – Modello di Bohr (10)
- Il modello di Bohr riesce anche a stimare il raggio delle
orbite circolari; in particolare il raggio dell’orbita più
piccola corrisponde al raggio dell’atomo nel suo stato ad
energia più bassa o stato fondamentale
- Il raggio dell’orbita ad energia minima dell’atomo di
idrogeno secondo Bohr si chiama raggio di Bohr, e ed è
una grandezza molto utile per definire la scala delle
lunghezze tipica dei processi a livello atomico:
4πε 0
−11
a0 =
= 0.5291× 10 m = 0.5281 Å
2
me e
Antonino Polimeno
27
Dai modelli primitivi alla meccanica quantistica
-
Perchè le energie sono quantizzate?
Esistono veramente delle “orbite” lungo le quali gli elettroni sono
costretti a muoversi?
Come si possono generalizzare le conclusioni di Bohr agli atomi
multielettronici?
Come si possono descrivere i legami chimici?
La risposta a questi ed a molti altri problemi deriva da una
rifondazione completa della descrizione fisica della materia a livello
molecolare ed atomico, secondo i principi della meccanica
quantistica (non relativistica), che trova la sua base nell’equazione
di Schröndinger
∂
i= Ψ = Hˆ Ψ
∂t
Antonino Polimeno
28












