Rapporto di Valutazione
Strisce reattive Accu-Chek® Inform II
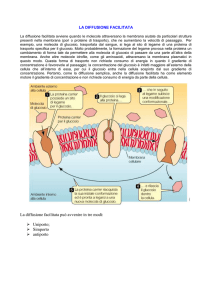
Le nuove strisce reattive Accu-Chek® Inform II forniscono risultati
precisi ed accurati nella misura del glucosio nel sangue
SOMMARIO
Le strisce reattive Accu-Check Inform II sono state testate in una grande varietà di contesti,
compresi studi in oltre 30 centri di sperimentazione esterni nonché approfonditi test interni. I
risultati dimostrano che il sistema Accu-Check Inform II fornisce una misurazione accurata e
affidabile della glicemia in diverse condizioni, compresa la presenza di maltosio.
Il presente documento descrive il sistema Accu-Check Inform II e ne sintetizza i risultati degli
studi condotti per valutarne l’accuratezza, la precisione e gli effetti dell’ematocrito e delle sostanze
interferenti.
1
Introduzione
Il sistema Accu-Check Inform II rappresenta una strumento preciso, affidabile e di facile impiego
per il controllo della glicemia. Il glucometro e le strisce reattive Accu-Check Inform II permettono
di eseguire un test affidabile in 5 secondi, con una rivelazione attendibile dell’adeguatezza del
campione, una notevole ampiezza del range di ematocrito e dei range di umidità e temperatura, e
un volume minimo di campione pari a 0,6 μl. Inoltre, il sistema fornisce risultati precisi anche se
utilizzato in sedi di prelievo inconsuete, come il palmo della mano e l’avambraccio.
Ad ogni determinazione, il sistema Accu-Check Inform II esegue numerosi controlli di qualità per
neutralizzare gli effetti di fattori quali la temperatura e l’ematocrito, che negli altri sistemi causano
talvolta errori o risultati imprecisi. Grazie alle sue caratteristiche chimiche avanzate, il sistema è
inoltre in grado di fornire risultati accurati in presenza di maltosio ed è quindi adatto all’impiego
in:
pazienti sottoposti a terapia con soluzioni contenenti maltosio, che è presente in alcune
preparazioni a base di immunoglobuline
pazienti sottoposti a dialisi peritoneale con l’impiego di soluzioni contenenti icodestrina,
come per esempio la soluzione per dialisi EXTRANEAL™.
Le strisce reattive Accu-Check Inform II sono utilizzabili con i glucometri Accu-Check Inform II e
Accu-Check Performa.
2
Specifiche del sistema Accu-Check Inform II
La tabella sotto riporta le specifiche del misuratore Accu-Chek Inform II e delle relative strisce
reattive.
Nota: Le strisce reattive Accu-Chek Inform II possono essere utilizzate anche con il misuratore
Accu-Chek Performa.
Tabella 1. Specifiche del sistema
Categoria
Specifiche Accu-Chek Inform II System
Principio di misura
Elettrochimico. Variante dell'enzima Mut. Quinoproteina Glucosio
Deidrogenasi (Mut. Q-GDH)
Intervallo di misura
10 - 600 mg/dL
Tempo di misura
5 secondi
Temperatura operativa
8°C to 44°C (46°F to 111°F)
Umidità operativa
10 - 90%
Volume campione
0.6 μL
Limiti ematocrito
10 - 65%
Altitudine
Fino a 3,094 metri s.l.m. (10,150 feet)
Tipo di campione
Capillare, venoso, arterioso, neonatale
Punto di prelievo
Polpastrello, palmo della mano,, braccio avambraccio, polpaccio, coscia
Riconoscimento e segnalazione automatica delle soluzioni di controllo
Funzioni di supporto e sicurezza data di scadenza rilevato tramite Code chip
Sistema in tempo reale per data e ora
Calibrazione
Code chip delle specifiche lotto contenuto in ogni flacone di strisce
3
Identificazione della confezione
La confezione delle strisce Accu-Chek Inform II è contrassegnata con un talloncino verde, che
indica le strisce reattive non sono soggette ad interferenze da maltosio clinicamente rilevanti
(Figura 1).
4
Tecnologia del sistema Accu-Check Inform II
Il sistema Accu-Check Inform II utilizza una tecnologia brevettata per raccogliere e analizzare
un’ampia serie di dati ai fini della determinazione della glicemia.
Alcuni dei vantaggi di questa tecnologia sono:
Stima accurata ed efficiente della temperatura. Il glucometro Accu-Check Inform II non
utilizza un termistore interno, ma rileva la temperatura nella zona di reazione della striscia.
Perciò, il glucometro è in grado di compensare in modo accurato ed efficiente gli effetti
della temperatura nel punto di applicazione del campione.
Compensazione degli effetti dell’ematocrito. Il glucometro Accu-Check Inform II è in grado
di compensare gli effetti dell’ematocrito entro un ampio intervallo
(10-65%).
Rilevazione dell’adeguatezza del campione. L’applicazione del campione viene rilevata da
una serie di elettrodi, mentre un’altra serie rileva l’adeguatezza del volume di campione. In
tal modo si previene il rischio di applicare una quantità insufficiente di campione alla
striscia reattiva, dando luogo a un risultato potenzialmente impreciso.
Riconoscimento automatico delle soluzioni di controllo Accu-Check Inform II. Il sistema è
in grado di distinguere automaticamente tra il sangue e le soluzioni per il controllo qualità.
Controlli qualità. Ad ogni determinazione, il glucometro Accu-Check Inform II esegue
numerosi controlli di qualità sul campione, sulla striscia e sul sistema.
Funzioni di sicurezza e supporto del glucometro
Rilevazione della data di scadenza del chip di codifica. Per una maggiore sicurezza, il
glucometro Accu-Check Inform II determina la data di scadenza del chip di codifica
utilizzando i dati impressi sul chip stesso. Questa caratteristica è finalizzata a impedire
l’utilizzo di strisce reattive scadute.
Orologio in tempo reale per la funzione ora e data. Nel glucometro è inserito un orologio
in tempo reale che indica l’ora e la data anche nei casi in cui la batteria principale non sia
più disponibile. Questa caratteristica fa sì che il glucometro sia sempre in grado di
determinare la data di scadenza del chip di codifica e di apporre l’ora e la data esatte sulla
stampa dei risultati.
5
Strisce reattive Accu-Check Inform II
Architettura e funzionalità delle strisce
Le strisce reattive Accu-Check Inform II contengono sei elettrodi d’oro (vedere Figura 2) che,
insieme alla tecnologia brevettata, consentono al sistema di eseguire numerosi controlli di qualità.
L’accuratezza dei risultati del test è garantita dai seguenti controlli:
Controlli sul campione
o Verifica dell’applicazione di una quantità di sangue corretta
o Rilevazione e identificazione del campione come sangue o soluzione di controllo
Controlli sul sistema
o Rilevazione dell’umidità ambientale
o Rilevazione delle variazioni di temperatura
Controlli sulla striscia
o Valutazione di un eventuale danneggiamento o uso improprio della striscia reattiva
e del reagente, comprese:
esposizione a un’umidità elevata
presenza di graffi sugli elettrodi della striscia
Principio di reazione della striscia
L’enzima sulla striscia reattiva Accu-Check Inform II, il Mut. Q-GDH ottenuto dall’Acinetobacter
calcoaceticus, ricombinante nell’Escherichia coli, converte il glucosio presente nel campione di
sangue in gluconolattone. Questa reazione genera una corrente elettrica continua innocua, che il
glucometro utilizza per interpretare i livelli di glucosio nel sangue. Attraverso un piccolo segnale di
corrente elettrica alternata, vengono inoltre valutate le condizioni ambientali e del campione.
6
Studi di accuratezza con il sistema Accu-Check Inform II
Accuratezza con sangue intero capillare
È stato condotto uno studio per valutare l’accuratezza del sistema Accu-Check Inform II con i
campioni di sangue capillare. I tecnici del centro che ha partecipato alla sperimentazione hanno
prelevato un campione di sangue capillare dal dito di 100 pazienti. Per ciascun paziente sono
state testate due strisce reattive da tre lotti diversi, per un totale di 200 determinazioni della
glicemia per ciascun lotto. Questi risultati sono stati comparati ai campioni di sangue intero di
riferimento, che sono stati analizzati su un analizzatore Roche/Hitachi 917 utilizzando il metodo
della glucosio esochinasi e sono stati matematicamente convertiti in valori di riferimento (plasma
IFCC). I valori di riferimento per il glucosio variavano da 21 a 547 mg/dl ed i limiti di ematocrito
testati erano del 29-50%.
I risultati dello studio sono stati valutati sulla base dei seguenti criteri di accettazione:
A concentrazioni di glucosio inferiori a 100 mg/dl, il 95% dei singoli risultati deve essere
compreso entro ±15 mg/dl dei valori di riferimento.
A concentrazioni di glucosio pari o superiori a 100 mg/dl, il 95% dei singoli risultati deve
essere compreso entro ±15% dei valori di riferimento.
Ciascuno dei lotti testati ha soddisfatto i criteri di accettazione. I dati relativi a un lotto-campione
di strisce reattive sono riportati come grafico di bias nella Figura 3 e sono sintetizzati nella Tabella
2. Come appare dalla Figura 3 e dalla Tabella 2, il 98,5% dei dati erano conformi ai requisiti di bias
richiesti e i criteri di accettazione risultavano chiaramente soddisfatti. I dati ottenuti dimostrano
pertanto che, con i campioni di sangue capillare, il sistema Accu-Check Inform II fornisce risultati
accurati.
7
Tabella 2. Accuratezza con Sangue Intero capillare
Risultati <100 mg/dL
Risultati ≥100 mg/dL
Entro ±5 mg/dL
45/58
(77.6%)
Entro ±5 mg/dL
92/142
(64.8%)
Entro ±10 mg/dL
56/58
(96.6%)
Entro ±10 mg/dL
128/142
(90.1%)
Entro ±15 mg/dL
58/58
100%
Entro ±15 mg/dL
139/142
(97.9%)
8
Accuratezza con autodeterminazioni su sangue intero capillare
Ai pazienti di tre centri è stato chiesto di leggere il foglio illustrativo del sistema Accu-Check
Inform II e successivamente di prelevare una goccia di sangue dal dito e depositarla su una
striscia reattiva proveniente da uno di tre lotti diversi. Ai pazienti non è stata fornita alcuna
istruzione da parte di un tecnico specializzato. Questi risultati sono stati comparati ai campioni di
sangue intero di riferimento, che sono stati analizzati su un analizzatore Roche/Hitachi 917
utilizzando il metodo della glucosio esochinasi e sono stati matematicamente convertiti in valori di
riferimento (plasma IFCC). Ai fini dell’analisi sono stati considerati i dati di 108 pazienti. I valori di
riferimento per il glucosio variavano da 45 a 547 mg/dl ed i limiti di ematocrito testati erano del
30-58%.
I risultati relativi a un lotto-campione di strisce reattive, valutati con l’analisi di regressione lineare,
sono illustrati nella Figura 4. Il grafico mostra una forte correlazione tra i risultati
dell’autodeterminazione glicemica del paziente e il metodo di riferimento (0,991) e un piccolo
errore standard (10,6), che indica una dispersione minima intorno alla linea di regressione. I dati
ottenuti dimostrano pertanto che anche un utente poco esperto può ottenere risultati accurati con
il sangue capillare.
9
Accuratezza con sangue intero venoso
I tecnici di un centro clinico hanno prelevato campioni di sangue ai pazienti mediante puntura
venosa. Il sangue venoso così prelevato è stato quindi trasferito su strisce reattive di tre lotti
diversi. Questi risultati sono stati comparati ai campioni di sangue intero di riferimento, che sono
stati analizzati su un analizzatore Roche/Hitachi 917 utilizzando il metodo della glucosio
esochinasi e sono stati matematicamente convertiti in valori di riferimento (plasma IFCC).
Ai fini dell’analisi sono stati considerati i dati di 210 pazienti. I valori di riferimento per il glucosio
variavano da 25 a 546 mg/dl ed i limiti di ematocrito testati erano del 32-63%.
I risultati relativi a un lotto-campione di strisce reattive, valutati con l’analisi di regressione lineare,
sono illustrati nella Figura 5. Il grafico mostra una buona correlazione con il metodo di riferimento
(0,992) e un piccolo errore standard (11,5), che indica una dispersione minima intorno alla linea di
regressione. I dati ottenuti dimostrano pertanto che, con i campioni di sangue venoso, il sistema
Accu-Check Inform II fornisce risultati accurati.
10
Accuratezza con sangue intero capillare neonatale
Sono stati condotti degli studi per valutare l’accuratezza del sistema Accu-Check Inform II con
campioni di sangue capillare neonatale. I tecnici del centro che ha partecipato alla
sperimentazione hanno prelevato un campione di sangue capillare dal tallone di neonati (di età
inferiore a 30 giorni) e lo hanno trasferito su strisce reattive di tre lotti diversi. Questi risultati sono
stati comparati ai campioni di sangue intero di riferimento, che sono stati analizzati su un
analizzatore Roche/Hitachi 917 utilizzando il metodo della glucosio esochinasi e sono stati
matematicamente convertiti in valori di riferimento (plasma IFCC). Ai fini dell’analisi sono stati
considerati i dati di 191 pazienti. I valori di riferimento per il glucosio variavano da 18 a 153 mg/dl
ed i limiti di ematocrito testati erano del 23-58%. I risultati relativi a un lotto-campione di strisce
reattive, valutati con l’analisi di regressione lineare, sono illustrati nella Figura 6. Il grafico mostra
una buona correlazione con il metodo di riferimento (0,976) e un piccolissimo errore standard
(5,0), che indica una dispersione minima intorno alla linea di regressione. I dati ottenuti
dimostrano pertanto che, con i campioni di sangue intero neonatale, il sistema Accu-Check
Inform II fornisce risultati accurati. Per dimostrare ulteriormente l’accuratezza del test con il
sangue capillare neonatale a concentrazioni di glucosio inferiori a 50 mg/dl, sono state eseguite
altre analisi su tre diversi lotti di strisce reattive utilizzando campioni di sangue prelevati dal
tallone di 45 neonati. La Tabella 3 mostra il bias cumulativo dei singoli campioni di sangue
capillare prelevato dal tallone dei neonati con una concentrazione di glucosio inferiore a 50 mg/dl.
Come appare dalla tabella, il sistema Accu-Check Inform II fornisce risultati accurati con i
campioni di sangue intero neonatale a concentrazioni di glucosio inferiori a 50 mg/dl.
Tabella 3. Bias per pool di Campione Capillare Neonatale inferiore a 50 mg/dL di Glucosio
Risultati <50 mg/dL
N
135
Bias medio
1,8
11
Accuratezza con sangue intero arterioso
I tecnici di un centro clinico hanno prelevato campioni di sangue arterioso ai pazienti mediante la
procedura operativa standard. Il sangue arterioso così prelevato è stato quindi trasferito su strisce
reattive di tre lotti diversi. Questi risultati sono stati comparati ai campioni di sangue intero di
riferimento, che sono stati analizzati su un analizzatore Roche/Hitachi 917 utilizzando il metodo
della glucosio esochinasi e sono stati matematicamente convertiti in valori di riferimento (plasma
IFCC). Ai fini dell’analisi sono stati considerati i dati di 214 pazienti. I valori di riferimento per il
glucosio variavano da 58 a 332 mg/dl ed i limiti di ematocrito testati erano del 19-54%.
I risultati relativi a un lotto-campione di strisce reattive, valutati con l’analisi di regressione lineare,
sono illustrati nella Figura 7. Il grafico mostra una buona correlazione con il metodo di riferimento
(0,990) e un errore standard di 6,4, che indica una dispersione minima intorno alla linea di
regressione. Come appare dalla tabella, il sistema Accu-Check Inform II fornisce risultati accurati
con i campioni di sangue arterioso.
12
Accuratezza ad altitudini elevate
Il test si è svolto presso un centro clinico che sorge a un’altezza di 3.094 metri sul livello del mare.
Un tecnico specializzato ha prelevato un campione di sangue capillare dal dito di ciascun paziente
e lo ha trasferito su tre strisce reattive, proveniente ciascuna da un lotto diverso. Questi risultati
sono stati comparati ai campioni di sangue intero di riferimento, che sono stati analizzati su un
analizzatore Roche/Hitachi 917 utilizzando il metodo della glucosio esochinasi e sono stati
matematicamente convertiti in valori di riferimento (plasma IFCC). Ai fini dell’analisi sono stati
considerati i dati di 94 pazienti. I valori di riferimento per il glucosio variavano da 63 a 468 mg/dl
ed i limiti di ematocrito testati erano del 34-62%.
I dati per tutti e tre i lotti di strisce reattive, riportati come grafico di bias nella Figura 8, sono stati
valutati sulla base dei seguenti criteri di accettazione:
A concentrazioni di glucosio inferiori a 100 mg/dl, il 95% dei singoli risultati deve essere compreso
entro ±15 mg/dl dei valori di riferimento.
A concentrazioni di glucosio pari o superiori a 100 mg/dl, il 95% dei singoli risultati deve essere
compreso entro ±15% dei valori di riferimento.
Come appare dalla Figura 8, il 97,5% dei dati rispettavano i requisiti di bias richiesti e i criteri di
accettazione erano chiaramente soddisfatti. I dati ottenuti dimostrano pertanto che il sistema
Accu-Check Inform II fornisce risultati accurati anche ad altitudini elevate.
13
Accuratezza con sito di prelievo alternativo
In alternativa al dito, si utilizzano comunemente altri punti di prelievo, come il palmo della mano
(tenar e ipotenar), la parte superiore del braccio, l’avambraccio, il polpaccio e la coscia. In totale,
390 pazienti in tre centri clinici sono stati sottoposti a test con emoprelievo da una sede
alternativa: tenar del palmo, ipotenar del palmo, parte superiore del braccio e avambraccio. Gli
studi sono stati condotti utilizzando un solo lotto di strisce reattive Accu-Check Inform II e il
glucometro Accu-Check Performa, la cui tecnologia è identica a quella del glucometro AccuCheck Inform II. Nell’analisi sono stati inclusi solo i dati dei pazienti che rispettavano i criteri di
inclusione del protocollo sperimentale e i criteri di inclusione allo steady-state (lo steady-state,
così come specificato nel foglio illustrativo del prodotto Accu-Chek Inform II, è definito come lo
stato del paziente che non assume cibo o insulina entro due ore dal test).
I pazienti sono stati sottoposti a test con emoprelievo da sedi alternative. Questi risultati sono stati
comparati ai campioni di sangue intero di riferimento (ottenuto con il pungidito), che sono stati
analizzati su un analizzatore Roche/Hitachi 917 utilizzando il metodo della glucosio esochinasi e
sono stati matematicamente convertiti in valori di riferimento (plasma IFCC).
Le Figure 9 e 10 mostrano i dati relativi a due sedi-campione, rispettivamente il tenar del palmo e
l’avambraccio. In totale, sono stati considerati 148 risultati per la comparazione nel tenar del
palmo e 127 risultati per la comparazione nell’avambraccio. I risultati, riportati come grafico di
bias, sono stati valutati sulla base dei seguenti criteri di accettazione:
A concentrazioni di glucosio inferiori a 75 mg/dl, il 95% dei singoli risultati deve essere
compreso entro ±15 mg/dl dei valori di riferimento.
A concentrazioni di glucosio pari o superiori a 75 mg/dl, il 95% dei singoli risultati deve
essere compreso entro ±20% dei valori di riferimento.
Come appare nelle Figure 9 e 10, il 98,6% dei dati relativi al tenar del palmo e il 96,9% dei dati
relativi all’avambraccio erano conformi ai requisiti di bias richiesti e i criteri di accettazione
risultavano chiaramente soddisfatti. I dati ottenuti dimostrano pertanto che il sistema Accu-Check
Inform II fornisce risultati accurati con i campioni di sangue prelevato da sedi alternative nei
soggetti che rispettano i criteri di inclusione.
14
15
Precisione del sistema Accu-Check Inform II
La precisione del sistema Accu-Check Inform II è stata valutata utilizzando sia soluzioni di
controllo acquose, sia campioni di sangue venoso. Per quanto riguarda le soluzioni di controllo
acquose, per ciascun livello e tipo di campione sono stati utilizzati 30 flaconi contenenti strisce
reattive di ciascuno dei tre lotti selezionati. Per quanto riguarda i campioni di sangue venoso, per
ciascun livello e tipo di campione sono stati utilizzati 50 flaconi contenenti strisce reattive di
ciascuno dei tre lotti selezionati. Sono state ottenute 10 repliche per ciascun flacone e si è quindi
provveduto a calcolare il CV o la DS complessivi (sulla base del livello di glucosio).
Negli studi di precisione sono stati utilizzati i seguenti livelli di controllo:
Basso: 30 - 60 mg/dl
Medio: 100 - 136 mg/dl
Alto: 261 - 353 mg/dl
Negli studi di precisione sono stati utilizzati i seguenti livelli di sangue venoso “spiked”:
1: 30 - 50 mg/dl
2: 50 - 110 mg/dl
3: 110 - 150 mg/dl
4: 150 - 250 mg/dl
5: 250 - 400 mg/dl
Le Tabelle 4 e 5 mostrano i risultati dei test sulla precisione, rispettivamente con i controlli e il
sangue. Un livello di performance accettabile è definito come:
A concentrazioni di glucosio pari o inferiori a 75 mg/dl, una deviazione standard (DS) pari
o inferiore a 5 mg/dl.
A concentrazioni di glucosio superiori a 75 mg/dl, un coefficiente di variazione (CV) pari o
inferiore al 5%.
I risultati mostrano che tutte le stime di precisione per i controlli e per il sangue venoso “spiked”
sono inferiori ad una DS di 5 mg/dl o ad una soglia di CV del 5%.
Tutti i valori di DS per le soluzioni di controllo e per il sangue venoso a concentrazioni di glucosio
pari o inferiori a 75 mg/dl sono pari o inferiori a 2,6 mg/dl, mentre tutti i valori di CV per le
soluzioni di controllo e il sangue venoso a concentrazioni di glucosio superiori a 75 mg/dl sono
pari o inferiori al 3,3%.
I dati ottenuti dimostrano pertanto che il sistema Accu-Check Inform II fornisce risultati accurati
sia con le soluzioni di controllo, sia con il sangue intero.
16
Tabella 4. Precisione del Sistema (tra le serie) – Soluzioni di Controllo
N
Media (mg/dL)
DS (mg/dL)
CV (%)
Basso
10
45
0,9
–
Medio
10
118
–
1.4
Alto
10
304
–
1,3
Tabella 5. Precisione del Sistema (entro la serie) – Sangue
N
Media (mg/dL)
DS (mg/dL)
CV (%)
1
10
40
1,6
–
2
10
64
2,6
–
3
10
124
4,1
3,3
4
10
193
6,4
3,3
5
10
312
9,9
3,2
3
17
Effetti dell’ematocrito
Cinque livelli di sangue venoso addizionato con glucosio, con livello target di 25, 55, 120, 350 e
500 mg/dl sono stati testati con livelli di ematocrito corretti al 10, 15, 20, 25, 30, 50, 55, 60, 65 e
70% per determinare gli effetti dell’ematocrito sulle prestazioni del sistema Accu-Chek Inform II.
Questi risultati sono stati confrontati con quelli di un campione con ematocrito nominale (43%).
Sono stati testati tre lotti di strisce reattive Accu-Check Inform II e tutti i lotti hanno soddisfatto i
seguenti criteri di accettazione:
Per concentrazioni di glucosio pari o inferiori a 75 mg/dl, un bias medio pari o inferiore a
10 mg/dl.
Per concentrazioni di glucosio superiori a 75 mg/dl, un bias medio pari o inferiore al 10%.
I risultati relativi a un lotto-campione sono illustrati nella Figura 11. I dati di tutti e tre i lotti
confermano che il sistema Accu-Check Inform II supporta l’intervallo di ematocrito del 10-65%
dichiarato dall’azienda produttrice
18
Sostanze interferenti
Il sistema Accu-Check Inform II è stato accuratamente valutato anche in riferimento alle potenziali
sostanze interferenti. Oltre 190 tra farmaci e metaboliti sono stati testati alle concentrazioni
descritte dal Clinical Lab Standard Institute (CLSI) nel documento EP7-A2 contenente le linee
guida approvate per i test sulle interferenze nelle analisi cliniche di laboratorio (quando
disponibile). Molti degli elementi endogeni ed esogeni sono stati valutati a concentrazioni da tre o
quattro volte superiori a quelle delle concentrazioni plasmatiche terapeutiche. Ogni farmaco e
ogni metabolita è stato valutato ai seguenti livelli target di glucosio per garantire la massima
accuratezza:
Basso: ~40 mg/dl
Medio: ~120 mg/dl
Alto: ~450 mg/dl
I dati dei test indicano che il sistema Accu-Check Inform II fornisce risultati accurati in presenza
delle sostanze testate, generalmente molto oltre il range terapeutico o fisiologico. Per un elenco
delle sostanze valutate, delle concentrazioni testate e dei range delle concentrazioni terapeutiche
o fisiologiche (limite superiore), si veda la Tabella 6. Tutte le concentrazioni sono espresse in
mg/dl, salvo quanto diversamente specificato.
Tabella 6. Sostanze Potenzialmente Interferenti – Concentrazioni Testate
Sostanza
Concentrazione Testata (mg/dL)
Limiti di concentrazione
Terapeutica / Fisiologica
(o limite superiore) (mg/dL)
Acarbosio
60
0.087
Acetaminofene
20
1–3
Acetazolamide
6
1.0 – 1.5
Acetone
60
< 1.0
Acetilprocainamide
15
0.4 – 1.0
Acido Acetilsalicilico
60
10.1 – 30.1
Aciclovir
5
0.5
Albumina
5000
3200 – 5400
Albuterolo
25
0.002 – 0.02
Allopurinolo
5
0.5 – 2.0
Acido Aminocaproico
0.08
0.01 – 0.04
Amiodarone HCl
5
0.05 – 0.3
Amitriptilina
1
0.0075 – 0.025
Amoxapina
0.1
0.01 – 0.05
Amoxicillina
600
0.3 – 2.5
Ampicillina
5.3
0.27 – 1.77
Acido Ascorbico
3
0.4 – 2.0
Astemizolo
1
0.01
19
Sostanza
Concentrazione Testata (mg/dL)
Limiti di concentrazione
Terapeutica / Fisiologica
(o limite superiore) (mg/dL)
Atropina
1
0.025
Beta-carotene
0.6
0.2
Bile
1.5
0.7
Bilirubina (coniugata)
15
0.2
Bilirubina (non coniugata)
40
< 1.1
Buspirone
1
0.5 μg/dL
Caffeina
10
0.5 – 2.0
Calcio (Cloruro)
20
11
Captopril
0.5
0.1
Carbamazepina
3
0.3 – 1.2
Cefadroxil
10.5
1.0 – 3.5
Cefalexina
32
0.4 – 3.9
Cefalotina
200
2.0 – 10.0
Diidrocloruro di cetirizina
1
0.08
Acido Chenodeossicolico
3
0.1
Clorotiazide
2
0.01
Clorpropamide
80
7.5 – 39.9
Colesterolo
500
300
Acido colico
2,4
0.06
Cimetidina
10
0.05 – 0.75
Acido citrico
30
1.7 – 3.0
Clindamicina HCl
4.5
0.2 – 1.5
Clonidina
2
0.02 – 0.2 μg/dL
Creatinina
30
1.5
Ciclofosfamide
37.5
12.5
Cisteina (L-)
5
0.4 – 1.4
Cistine (L-)
50
0.4 – 1.5
Desipramina
0.1
0.005 – 0.03
Desametasone
0.09
0.02
Diclofenac
5
0.25
Dicumarolo
20
1,7
20
Sostanza
Concentrazione Testata (mg/dL)
Limiti di concentrazione
Terapeutica / Fisiologica
(o limite superiore) (mg/dL)
Digossina
1
0.08 – 0.2 μg/dL
Diltiazem
20
0.5 – 2.0 μg/dL
Difenidramina HCl
1
0.02 – 0.06
Dipirone
11
0.75 – 2.27
Disopiramide
5
0.2 – 0.5
DOPA (L-)
2,8
0.02 – 0.28
Dopamina
1.5
0.03
Doxazosin mesilato
1
0.001
Doxiciclina iclato
3
0,2
Enalapril
8
0.012 – 0.015
Efedrina
20
0.001
Equilina
15
0.5
Eritromicina
60
0.2 – 2.0
Estradiolo
0.1
0.8 – 40.0 ng/dL
Estrone
1
1.0 – 20.0 ng/dL
Etanolo
350
100 – 200
Etosuccimide
25
4.0 – 10.0
Etil acetoacetato
20
2
Etilene glicolico
5
0
Famotidina
0,6
0,02
Felodipina
5
0.001
Fenofibrato
5
1.5
Fenoprofene
20
2.0 – 6.5
Flecainide
1
0.02 – 0.11
5-Fluorocitosina
30
2.1 – 10.1
Fluoxetina
12
0.0015 – 0.115
Flurbiprofene
5
1.5
Fruttosio
250
1–6
Furosemide
6
1.0 – 3.0
Galattosio
15
0 – 60
Galattosio-1-fosfato
5
0 – 0.3
21
Sostanza
Concentrazione Testata (mg/dL)
Limiti di concentrazione
Terapeutica / Fisiologica
(o limite superiore) (mg/dL)
Gamma Globulina
3000
0.7 – 1.6 g/dL
Gemfibrozil
15
2,5
Gentamicina
3.6
0.008
Acido Gentisico
50
0.2 – 0.6
Glimepiride
1
0.06
Glipizide
8
0,1
Glucosamina
450
2,32
Glutatione
12.3
0.7
Glicerolo
10
1,8
Emoglobin
500
2,5
Eparina (Li)
8000 U/dL
35 – 100 U/dL
Eparina (Na)
8000 U/dL
35 – 100 U/dL
Idroclorotiazide
0.61
0.05 – 0.2
Idrocortisone
1
0.005 – 0.023
Acido idrossibutirrico
100
0.21 – 2.81
Idrossiclorochina solfato
4
0.013
Acido Ibandronico
0.5
0.03
Ibuprofene
40
1.0 – 7.0
Indometacina
5
0.5 – 1.8
Insulina - Humulin N
20 U/dL
0.5 – 4 mU/dL
Insulina - Humulin R
20 U/dL
0.5 – 4 mU/dL
Isoniazide
5
0.1 – 2.0
Kanamicina
6
1.4 – 3.0
Acido lattico
100
20
Lattosio
10
< 0.5
Lecitina
500
370
Lidocaina
1.2
0.15 – 0.6
Lipidemia (Trigliceridi)
1800
30 – 32727
Lisinopril
1
0.03
Loratadina
1
0,01
Magnesio (solfato)
26
2,6
22
Sostanza
Concentrazione Testata (mg/dL)
Limiti di concentrazione
Terapeutica / Fisiologica
(o limite superiore) (mg/dL)
Maltosio (plasma)
360
0 – 360
Mannitolo
600
0.0128
Mannosio
10
1.15
Metaproterenolo
1.81
0.22 – 1.30 μg/dL
Metformina
50
0.4
Metil Dopa
2,5
0.1 – 0.75
Metil idrossiprogesterone
50
0.7 μg/dL
Metoclopramide
0.13
0.015
Mevinolina (Lovastatin)
0.4
0.0025 – 0.004
Metoprololo
0.7
0.0075 – 0.05
Mexiletina HCl
1
0.05 – 0.2
Misoprostol
0.8
0.05 – 0.11 μg/dL
Nadololo
2
0,04
Naproxene
100
3.0 – 12.0
Neostigmina Bromuro
0.2
0.9 μg/dL
Neostigmina metilsolfato
0.2
0.5
Nicotina
2
0.0024 – 0.005
Nifedipina
40
0.005 – 0.02
Nitrofurantoina
4
0.02 – 0.2
Nordoxepina
5
0.009 – 0.03
Normethylverapamil HCl
1
0.005 – 0.02
D-Norproproxyphene Maleate
1
0.04
Nortiptilina
0.3
0.005 – 0.03
Acido oleico
35
1.1
Omeprazolo
0.52
0.009
Acido ossalico
20
0,2
Acido palmitico
150
5.1
Penicillamina HCl
2,4
0.4 – 0.8
Penicillina
15
1.2
Fenelzina solfato
0.5
0.02
Fenilalanina (L-)
50
1.2 – 3.4 (neonati)
23
Sostanza
Concentrazione Testata (mg/dL)
Limiti di concentrazione
Terapeutica / Fisiologica
(o limite superiore) (mg/dL)
Fenitoina
10
0.5 – 2.0
Pindololo
0.5
0.01
Pioglitazone
5
0.17
Piroxicam
10
0.3 – 0.5
Potassio Cloruro
50
23
Primidone
5
0.2 – 1.9
Probenecid
60
9.98 – 19.95
Procainamide
10
0.4 – 1.2
Propanololo
1
0.005 – 0.1
Pseudoefedrina
1
0.04
Piridossina
3
dato non disponibile
Acido Piruvico
4
0.9
Quinino solfato
4.8
0.2 – 1.6
Ramipril
3.58
5.2 μg/dL
Ranitidina
20
0.01 – 0.2
Repaglinide
5
0.04
Rifampicina
8
0.4 – 3.21
Rosiglitazone
5
0.015
Acido salicilico
60
9.94 – 29.95
Sodio
175 mmol/L
136 – 145 mmol/L
Sodio Bicarbonato
336
0.024
Sorbitolo (D-)
70
0.044
Acido Stearico
15
2,8
Streptomicina
15
0.7 – 5
Saccarosio
500
0.06
Terfenadina
25
0.001
Tetraciclina
10
0.2 – 0.5
Theophylline
25
0.5 – 2.0
Tioridazina
4
0.01 – 0.26
L-Tiroxina Sodio
5
0.12
Tobramicina
3.6
0.001
24
Sostanza
Concentrazione Testata (mg/dL)
Limiti di concentrazione
Terapeutica / Fisiologica
(o limite superiore) (mg/dL)
Tolazamide
200
1.6
Tolbutamide
100
4.3 – 24.0
Trazodone
2
0.05 – 0.25
Triamterene
6
0.03 – 0.3
Trimetoprim
6
0.5 – 2.0
Tirosina (L-)
24
7 – 24 (neonati)
Urea
600
38
Acido urico
40
2.3 – 8.0
Acido valproico
50
10
Vancomicina
20
1.8 – 4.0
Verapamil
1
0.014 – 0.045
Vitamina B12
1
2.0 – 8.4 ng/dL
Vitamina E
20
0.5 – 2.0
Voluven
800
800
Warfarin
Xilitolo
Xilosio
Zenapax (Daclizumab)
10
200
100
10
0.1 – 1.0
0.12
30
1
I seguenti componenti, testati con Accu-Chek, Inform II sono stati classificati quali sostanze
interferenti.
Tabella 7. Sostanze Interferenti
Accu-Chek Inform II
Soglia di accuratezza (mg/dl)
Sostanza
Lipidemia (Trigliceridi)1
Galattosio
2
Acido ascorbico
1
2
> 1800
> 15
3
>3
Campioni lipemici (trigliceridi) superiori a 1800 mg/dL può produrre risultati aumentati.
Concentrazioni di galattosio nel sangue maggiori di 15 mg/dL causeranno una sovrastima dei
risultati del glucosio nel sangue. I valori di glucosio nei neonati con sospetta galattosemia
dovranno essere confermati con una metodologia di misura del glucosio alternativa..
3
Somministrazioni intravenose di acido ascorbico in grado di determinare concentrazioni di acido
ascorbico nel sangue superiori a causeranno una sovrastima dei risultati del glucosio nel sangue.
25
Conclusioni
I dati esposti nel presente documento dimostrano le potenzialità del glucometro e delle strisce
reattive Accu-Check Inform II. Grazie al tempo di esecuzione di appena 5 secondi, all’ampiezza dei
limiti di ematocrito e dei limiti di temperatura e umidità e al volume minimo del campione, questo
sistema rappresenta uno strumento di facile impiego per il controllo della glicemia. Ad ogni
determinazione, il sistema esegue numerosi controlli di qualità per assicurare risultati accurati e
affidabili.
Inoltre, le sue caratteristiche chimiche avanzate garantiscono risultati precisi in presenza di
maltosio e lo rendono quindi adatto all’impiego nei pazienti sottoposti a terapia con soluzioni che
contengono o producono maltosio
Traduzione integrale del documento Roche-“Evaluation Report Accu-Chek Inform II Test Strips_ mg”
26