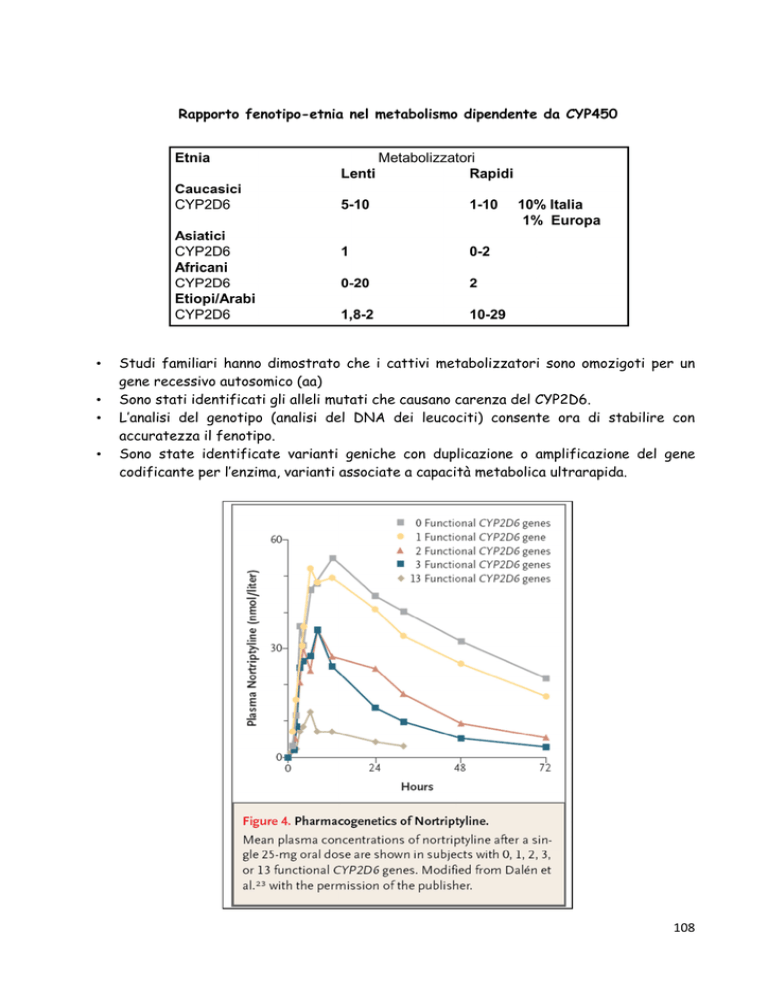
Rapporto fenotipo-etnia nel metabolismo dipendente da CYP450
•
•
•
•
Studi familiari hanno dimostrato che i cattivi metabolizzatori sono omozigoti per un
gene recessivo autosomico (aa)
Sono stati identificati gli alleli mutati che causano carenza del CYP2D6.
L’analisi del genotipo (analisi del DNA dei leucociti) consente ora di stabilire con
accuratezza il fenotipo.
Sono state identificate varianti geniche con duplicazione o amplificazione del gene
codificante per l’enzima, varianti associate a capacità metabolica ultrarapida.
108
Conseguenze del polimorfismo del cyp2d6
•
Il CYP2D6 metabolizza molti farmaci di notevole importanza clinica e con discreta
tossicità potenziale: antidepressivi triciclici, antipsicotici, molti antiaritmici, βbloccanti
lipofili, oppiacei. L’influenza del polimorfismo del CYP2D6 dipende
dall’importanza dell’ossidazione catalizzata da questo enzima sull’eliminazione del
farmaco.
•
I cattivi metabolizzatori corrono quindi il rischio di sviluppare effetti avversi con dosi
‘ordinarie’ di farmaco.
•
D’altra parte, in soggetti con capacità metabolizzante molto rapida, dosi ordinarie
possono determinare concentrazioni plasmatiche sub-terapeutiche e quindi un effetto
clinico inadeguato, come nel caso degli antidepressivi triciclici. Oppure possono
presentare intossicazione da morfina dopo somministrazione di profarmaco codeina
poiché viene velocemente convertita a morfina.
Conseguenze tossicologiche del polimorfismo del CYP2D6, non legate ai farmaci
•
Il CYP2D6 partecipa al metabolismo di:
•
insetticidi organofosforici
•
atrazina (erbicida)
•
MPTP (neurotossina che induce PD)
I cattivi metabolizzatori potrebbero essere più sensibili agli effetti tossici di queste
sostanze.
I cattivi metabolizzatori professionalmente esposti a pesticidi sembrano avere un più alto
rischio di sviluppare il morbo di Parkinson
109
ALTRI ENZIMI OSSIDATIVI: monoossigenasi contenenti flavina (FMO)
FMO catalizza la monoossigenazione di eterotaomi (N, S, P) ⇒ molte reazioni possono
essere catalizzate anche dal CYP450.
La FMO catalizza la reazione:
RH + NADPH + H++ O2 ⇄ ROH+ NADP+ + H2O
Anche la FMO è microsomiale, ma è meno diffusa rispetto al CYP450, presenta inoltre
poche isoforme e minor inducibilità; è quindi dotata di minor specificità di substrato
infatti agisce su substrati diversissimi.
Catalizza l'ossigenazione di atoni di N e S, ma non le reazioni di dealchilazione di
eteroatomi.
La FMO catalizza l’ossidazione di:
amine 3° ⇒ N-ossidi; amine 2° ⇒ idrossilamine (⇒ nitroni); amine primarie ⇒
idrossilamine (⇒ ossime)
•
numerosi composti solforati (tioli, tioeteri, tiochetoni e tiocarbammati
•
fosfine, rispettivamente a S- e P-ossidi:
110
FMO
•
Uno xenobiotico può essere metabolizzato in modo diverso in specie diverse in
dipendenza del contenuto dei CYP450 e degli enzimi FMO.
•
Es. gli alcaloidi pirrolizidinici (tossine prodotte da alcune piante da fiore come difesa
dagli insetti) sono epatotossici nel ratto (e nell’uomo) perché sono ossidati a metaboliti
tossici da un CYP450. Nella cavia, l’attività di questo enzima è bassa e gli alcaloidi sono
ossidati dalle FMO, con formazione di metaboliti non tossici.
Gli alcaloidi pirrolizidinici attivati possono legarsi a proteine (epatotossicità)
e al DNA (mutagenicità, cancerogenicità)
111
•
•
•
•
I metaboliti elettrofili formati dalle FMO non inibiscono le FMO ma possono inibire
irreversibilmente i CYP.
Nell’uomo sono presenti 5 FMO.
Non sono inducibili da sostanze esogene ma la loro attività è regolata dagli ormoni
sessuali.
La carenza di FMO3 provoca la sindrome dell’odore di pesce, dovuta alla mancata
ossidazione della trimetilamina endogena, che viene escreta nelle urine, sudore, alito.
Non si sa se questa carenza provochi conseguenze tossicologiche.
112
Prostaglandina H sintasi (PHS) o COX (co-ossidazione perossidasi dip.)
Esistono due isoenzimi distinti:
La COX-1 (PGH sintasi-1) è espressa costitutivamente in cervello, stomaco, endoteli,
dotti renali, piastrine), la sua presenza (fino a 2-4 volte in seguito a stimolazioni umorali.
La COX-2 (o PGH sintasi-2) è invece inducibile in stati di infiammazione (10-18 volte in
seguito alla stimolazione da parte di fattori di crescita, promotori tumorali, citochine,
sostanze batteriche). Eccezione è la COX-2 renale, un enzima costitutivo la cui
produzione di prostaglandine assicura il flusso nelle arterie afferenti.
Entrambi gli isoenzimi COX possiedono un'attività cicloossigenasica (ciclizzazione della
catena idrocarburica dell'acido arachidonico) + un'attività perossidasica.
113
•
•
•
Le perossidasi hanno una distribuzione ubiquitaria e sono presenti anche in tessuti in
cui i livelli di CYP450 sono bassi o nulli: rene, midollo osseo, polmone ecc.
COX e altre perossidasi hanno importanza nell’attivazione di xenobiotici in metaboliti
tossici e cancerogeni, specie in tessuti extraepatici aventi bassi livelli di citocromo
P450.
La biotrasformazione degli xenobiotici da parte di PHS è un processo controllato
dall’acido arachidonico, mentre quella condotta da altre perossidasi dipende dalla
disponibilità di idroperossido.
Reazioni catalizzate dalle perossidasi
L’ossidazione di xenobiotici da parte delle perossidasi avviene con trasferimento diretto
di ossigeno dal perossido allo xenobiotico (X →XO).
•
Es.
una
reazione
di
questo
tipo
è
l’epossidazione
PHS-dipendente
del
benzo[a]pirene7,8-diidrodiolo ⇒ nel relativo 9,10-epossido.
•
Es. PHS catalizza la 8,9-epossidazione dell’aflatossina B1, uno dei più potenti
epatocancerogeni conosciuti.
Nel ratto causa tumori al rene poiché a tale livello vi sono elevati livelli di PHS
(prostaglandina H sintasi).
114
115
Aflatossina metabolizzata da perossidasi
Il trasferimento diretto dell’ossigeno da un perossido (es. PGG2) al substrato xenobiotico
non è il solo meccanismo con cui avviene l’ossigenazione degli xenobiotici da parte delle
perossidasi:
• Le sostanze che fungono da donatori di elettroni (es. amine aromatiche, fenoli,
idrochinoni, idrocarburi policiclici e composti insaturi coniugati) possono essere ossidate a
radicali liberi durante la riduzione del perossido (PGG2) ad alcol (PGH2) e l’ossigeno del
perossido è ridotto ad H2O piuttosto che essere incorporato nella molecola dello
xenobiotico.
Es. dosi alte di paracetamolo nel fegato ⇒ metabolita tossico generato da P450, mentre
nel rene ⇒ metabolita tossico generato da PHS presente in quantità elevate rispetto a
P450.
116
Paracetamolo ad alte dosi
117
Mieloperossidasi
La ticlopidina è un antiaggregante piastrinico, antagonista del recettore purinergico
(P2Y12) per l'ADP, che inibisce l'aggregazione piastrinica.
La mieloperossidasi (perossidasi nei leucociti) trasforma il nucleo tiofenico in tiofeneS-cloruro che è un metabolita molto reattivo responsabile degli effetti collaterali
della ticlopidina a carico dei neutrofili (grave diminuzione dei neutrofili nel sangue =
agranulocitosi).
118
Alcol deidrogenasi (ADH)
Ossidazione di alcol alifatici e aromatici ad aldeidi:
ROH + NAD → RCHO + NADH + H+
•
•
•
•
•
•
Alcol primari: reazione veloce
•
secondari: lenti
•
terziari: praticamente nulla
ADH è un enzima citosolico; è un omo- o etero-dimero; 5 tipi di subunità (α, β, γ, π, χ) ⇒
molti isoenzimi, suddivisi in tre classi.
La classe I è quella più importante: ossidazione di CH3OH e CH3CH2OH.
CH3OH è ossidato molto più lentamente dell’etanolo; dato che la tossicità del metanolo è
dovuta alla sua ossidazione ad acido formico ⇒ etanolo usato come antidoto (inibizione
competitiva) nelle intossicazioni da metanolo.
ADH gastrica: eliminazione pre-sistemica, limita la biodisponibilità orale dell’etanolo.
I livelli gastrici di ADH sono diminuiti dal digiuno ⇒ maggiore effetto dell’ etanolo a
digiuno.
Gli isoenzimi di classe I che contengono almeno una subunità beta sono molto attivi nei
confronti dell’etanolo ⇒ ADH ‘atipica’, che porta alla conversione molto rapida ad
acetaldeide. Presente nell’85% di cinesi e giapponesi, in percentuali molto minori in altre
razze (0-20%).
Aldeide deidrogenasi (ALDH)
R-CHO + NAD(P)+ + H2O ⇄ R-COOH+ NAD(P)H + H+
•
•
Ossida le aldeidi ad acidi, utilizzando NAD come co-fattore
ALDH2 è polimorfa; in un alta percentuale (~50%) di giapponesi, cinesi e vietnamiti è
presente una variante ALDH2 a bassa attività, per una mutazione puntiforme.
Dato che in queste popolazioni vi è un’elevata prevalenza di ADH atipica, molti soggetti
hanno tossicità da acetaldeide (flushing syndrome) dopo assunzione di etanolo
•
L’ALDH è inibita da diverse sostanze; il disulfiram è utilizzato nella disassuefazione
degli alcolisti.
In generale le aldeidi sono più tossiche dei rispettivi alcol. Una delle più tossiche è
l’acroleina (CH2=CHCHO, epatotossica), che si forma per ossidazione dell’alcol allilico.
•
119
Monoaminoossidasi (MAO)
•
•
•
Catalizzano la deaminazione ossidativa delle ammine ad aldeidi in modo analogo a quella
catalizzata dal CYP450.
Importanti nel metabolismo di ammine endogene (noradrenalina, serotonina, dopamina)
ed esogene. Metabolizzano anche alcuni farmaci e xenobiotici
La formazione delle neurotossina MPP+ a partire da MPTP è catalizzata dalla MAO-B
120
Reazioni di fase I: riduzioni
Gruppi azo e nitro:
• Sono ridotti da: 1) microflora intestinale (bassa tensione di O2); 2) CYP450 (con bassa
tensione di O2).
• La riduzione dei nitrogruppi (-NO2) a -NO (nitroso) e -NH2 svolge un ruolo importante
nella tossicità di alcuni composti nitroaromatici (es. dinitrotoluene, epatocancerogeno nel
ratto).
•
Ar-N=N-Ar ⇒ Ar-NH-NH-Ar ⇒ Ar-NH2
•
R-SO2-R ⇒ R-SO-R ⇒ R-S-R
solfoni
•
•
solfossidi
dinitroto
solfuri
R-S-S-R ⇒ R-SH
disolfuri tioli o mercaptani
R-CHO o R-CO-R ⇒ ROH
aldeide o chetoni
alcoli
cancero
Es. Dinitrotoluene metabolizzato a compost cancerogeno
121
122
Epossido idrolasi
Catalizza l’addizione trans di H2O agli epossidi formati (dal citocromo P450) nelle reazioni di
ossidazione di alcheni e composti arilici ⇒ trans dioli.
• Dato che questi epossidi sono quasi tutti altamente reattivi e tossici (cancerogeni), le
epossido idrolasi sono enzimi detossificanti molto importanti.
• Sono ampiamente distribuiti nell’organismo; all’interno di alcuni tessuti, la loro
distribuzione è parallela a quelle del citocromo P450 ⇒ rapida detossificazione degli
epossidi.
• Alcuni epossidi non possono essere metabolizati dall’epossido idrolasi per ragioni steriche
(v. bay region) e sono quindi particolarmente tossici (es., benzopirene-9,10-epossido).
• L’epossido idrolasi è un enzima inducibile. La sua induzione è sempre associata a quella del
citocromo P450.
• Può essere inibito da alcuni epossidi e da alcuni farmaci ⇒ aumento della tossicità di altri
xenobiotici metabolizzati ad epossidi.
Es. acido valproico inibisce l’attività della epossido idrolasi e così aumentano i livelli
dell’epossido che si forma per metabolizzazione della carbamazepina ⇒ aumenta la
tossicità di carbamazepina.
Idrolisi
Carbossilesterasi (esterasi). Idrolisi di esteri (veloce), amidi (lenta), esteri tiolici, esteri
fosforici, anidridi acide.
RCOOR1 + H2O → RCOOH + R1OH
• Le esterasi sono enzimi poco specifici. Oltre agli xenobiotici, metabolizzano anche
composti endogeni.
• Sono ampiamente distribuite nell’organismo; i livelli più alti si trovano nel fegato,
plasma ed eritrociti, rene (tubulo prossimale), polmone.
• In alcuni casi l’idrolisi porta alla formazione di composti reattivi.
• Le carbossilesterasi (esterasi A con residuo di cisteina nel sito attivo) idrolizzano i
pesticidi organofosforici ⇒ detossificazione.
• Le carbossilesterasi (esterasi B con residuo di serina nel sito attivo) ⇒ il fosfato degli
organofosforici viene trasferito sull'enzina e va ad esterificare l'OH di un residuo
della serina in prossimità del sito attivo dell'enzima stesso. La carbossiesterasi, tipo B,
viene così inattivata irreversibilmente, ma in questo modo viene protetta
l'acetilcolinesterasi sinaptica del sistema colinergico.
123
•
Transesterificazione della cocaina in presenza di etanolo ⇒ l’estere etilico è più attivo
e più lipofilo ⇒ aumento della mortalità e tossicità epatica
Così, la cocaina ed alcuni suoi metaboliti vengono idrolizzati da una carbossiesterasi
epatica che, in presenza di etanolo proveniente da bevande alcoliche, produce
transesterificazione trasformando il gruppo carbossimetilico in carbossietilico:
COCAINA-COOCH3 → COCAINA-COOCH2CH3
Gli esteri etilici sono ancora attivi e più lipofili, incrementando l'attività e la tossicità
epatica dell'alcaloide al punto da risultare mortale ad alti dosaggi e in presenza di forti
dosi di etanolo.
124
125
Reazioni di fase II
•
•
•
Sono reazioni di coniugazione. Alcune aumentano l’idrofilia (glucuronidazione,
solfatazione, acetilazione, coniugazione con glutatione o con amminoacidi) e quindi
facilitano l’escrezione dei tossici nelle urine.
L’acetilazione e la metilazione possono diminuire l’idrofilia ma possono proteggere dalla
formazione di metaboliti reattivi.
Coniugazione di nucleofili:
glucuronidazione
solfatazione
acetilazione
metilazione
coniugazione con aminoacidi (glicina, taurina, acido glutammico)
•
Coniugazione di elettrofili:
coniugazione con glutatione (GSH) con formazione di acidi mercapturici
Le reazioni coniugative richiedono energia, che viene fornita come ‘attivazione’ del cofattore
coniugativo (coniugazione di nucleofili) o ‘attivazione’ dello xenobiotico (coniugazione di
elettrofili.
126
Coniugazione con acido glucuronico
Catalizzata dalla UDP-glucuroniltransferasi in presenza di co-substrato acido UDP-glucuronico
127