Chimica Biologica
A.A. 2010-2011
Catena di Trasporto
degli elettroni
Marco Nardini
Dipartimento di Scienze Biomolecolari e Biotecnologie
Università di Milano
Macromolecole Biologiche
- il catabolismo di tutti i combustibili metabolici
genera potere riducente (NADH e FADH2),
una forma di energia libera che viene convertita
in sintesi ATP nella fosforilazione ossidativa
- gli enzimi che catalizzano il trasporto elettronico
mitocondriale e la sintesi di ATP ad esso
accoppiata costituiscono:
la catena di trasporto degli elettroni:
ossidazione-riduzione sequenziale di centri redox
multipli localizzati in 4 complessi enzimatici
la fosforilazione ossidativa:
il trasporto di e- genera un gradiente protonico
transmembrana che promuove la sintesi dell’ATP
Respirazione
Macromolecole Biologiche
Respirazione
riduzione NADH ⇒ produzione di ~2.5 ATP a partire da ADP + Pi
riduzione FADH2 ⇒ produzione di ~1.5 ATP
Glicolisi
Glucosio + NAD+ + 2 ADP + 2 Pi → 2 Piruvato + 2 NADH + 2 ATP + 2H2O + 4 H+
• 2 coppie di e-, produzione di ~ 7 ATP
Fermentazione omolattica
Glucosio + 2 ADP + 2 Pi → 2 Lattato + 2 ATP + 2H2O + 2 H+
• produzione di 2 ATP
Piruvato deidrogenasi
Piruvato + CoA + NAD+ → Acetil-CoA + CO2 + NADH
• 2 coppie di e-, produzione di ~ 5 ATP
Ciclo acido citrico
3 NAD+ + FAD + GDP + Pi + Acetil-CoA → 3 NADH + FADH2 + GTP + CoA + 2 CO2
• 8 coppie di e-, produzione di ~ 20 ATP
Respirazione
Macromolecole Biologiche
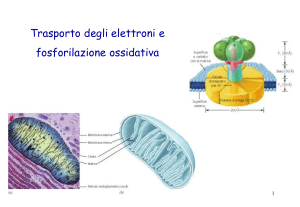
Il mitocondrio
- le proteine che mediano il
trasporto degli elettroni e la
fosforilazione ossidativa sono
legate alla membrana interna
- alcuni centri redox sono mobili
altri sono componenti di proteine
integrali di membrana
- la sequenza dei trasportatori di e- riflette grossolanamente i loro
potenziali di riduzione relativi
⇒ il processo di trasporto degli elettroni è complessivamente esoergonico
- membrana interna liberamente permeabile solo a O2, CO2 ed H2O
⇒ permeabilità controllata a ioni e metaboliti
⇒ possibilità di generare gradienti ionici attraverso questa barriera
Respirazione
Macromolecole Biologiche
- gli elettroni sono passati dal NADH
ad altri accettori di e- di potenziale di
riduzione via via maggiore (incluso il
FAD) fino ad O2
- l’ossidazione di una mole di NADH
da parte di O2 (cioè il trasferimento di
2 moli di e-) è associata (in condizioni
biochimiche standard) ad un rilascio di
218 kJ di energia libera:
F = 96485 C/mol
(faraday: carica di una mole di elettroni)
n = n° di moli di elettroni trasferiti per
mole di reagente convertito
1/2 O2 + NADH + H+
H2O + NAD+
ΔE0’ = 1.130 V
ΔG°’ = - nFΔE°’ = - 218 kJ/mol ⇒ processo fortemente esoergonico
Respirazione
Macromolecole Biologiche
ricordando che:
ADP + Pi → ATP
ΔG°’ = 30.5 kJ/mol
e poiché l’ossidazione di una molecola di NADH porta alla sintesi di ~2.5
molecole di ATP
efficienza termodinamica della fosforilazione ossidativa:
2.5 x 30.5 kJ/mol
218 kJ/mol
x 100 = 35%
in condizioni fisiologiche si ipotizza ~ 70%
(diverso pH, diverse conc. dei reagenti e prodotti rispetto alle in condizioni
biochimiche standard)
Respirazione
Macromolecole Biologiche
Ricapitolando …
- gli e- sono passati dal NADH ad altri accettori di e- di potenziale di
riduzione via via maggiore fino ad O2 (accettore terminale di e-)
⇒ tali molecole hanno E0’ compreso tra quello della coppia NAD+/NADH ed O2/H2O
- l’accoppiamento fra ossidazione di NADH (catena di trasporto degli
elettroni ) e sintesi di ATP (fosforilazione ossidativa) è catalizzato da
5 complessi mitocondriali (o complessi respiratori): I, II, III, IV, V
- la catena di trasporto riossida i coenzimi ed utilizza l’energia libera per
la sintesi dell’ATP (accoppiamento cascata trasporto e- / sintesi ATP)
- i trasportatori di elettroni (da NADH e FADH2 ad O2) sono associati alla
membrana mitocondriale interna (alcuni centri redox sono mobili altri sono
componenti di proteine integrali di membrana
- l’ossidazione del NADH a NAD+ da parte di O2 fornisce energia libera
sufficiente per la sintesi di 3 molecole di ATP (vedi dopo)
Macromolecole Biologiche
Catena di trasporto degli elettroni
Catena di trasporto degli elettroni
4 complessi proteici contenenti centri redox aventi per gli elettroni affinità
progressivamente crescenti
Complesso I
Complesso II (trasferisce e- da succinato a CoQ)
trasferimento e- mediante il CoQ (coenzima Q o ubichinone)
Complesso III
trasferimento e- mediante citocromo c (proteina periferica di membrana)
Complesso IV
⇒ gli e- viaggiano lungo questa catena da potenziali di riduzione più bassi
verso potenziali più alti
Macromolecole Biologiche
Catena di trasporto degli elettroni
Catena di trasporto degli elettroni
- CoQ è altamente idrofobico e solubile nella
membrana grazie alla sua coda isoprenica
- si muove liberamente per diffusione nella
membrana mitocondriale interna.
- non è stabilmente associato a proteine
- nei mammiferi Q10
(n=10 unità C5 isoprenoidi)
3 stati di ossidazione di CoQ:
- in grado di accettare e donare 1 o 2 epoiché la forma di semichinone (radicale
contenente un elettrone spaiato) è stabile
Macromolecole Biologiche
Catena di trasporto degli elettroni
Catena di trasporto degli elettroni
nero: vie trasferimento elettroni
rosso: vie di traslocazione protoni
Complesso II omesso perchè
ad esso non è associato alcun
trasferimento vettoriale di H+
- alcuni dei complessi respiratori accoppiano il trasporto elettronico al
trasporto di H+ da un lato all’altro della membrana mitocondriale interna
- i 4 complessi respiratori della catena di trasporto degli e- consistono di
parecchi componenti proteici associati a diversi gruppi prostetici attivi in
reazioni redox, con un potenziale di riduzione progressivamente crescente
- i complessi possono spostarsi lateralmente entro la membrana interna e
possono associarsi a formare “multicomplessi”
Macromolecole Biologiche
Catena di trasporto degli elettroni
Catena di trasporto degli elettroni
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso I: NADH-CoQ ossidoreduttasi
- nei mammiferi: 46 subunità (massa totale ~900 kD)
- forma ad L, con un braccio inserito nella membrana
mitocondriale interna e l’altro che si estende nella
matrice
- Coenzimi del complesso I:
a) 1 molecola di flavin mononucleotide (FMN)
b) 8-9 centri ferro-zolfo
matrice
mitocondriale
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso I: NADH-CoQ ossidoreduttasi
- FMN differisce dal FAD solo per l’assenza del gruppo AMP
- FMN ha 3 stati di ossidazione
⇒ in grado di accettare e donare 1 o 2 e- poiché
la forma di semichinone (radicale contenente
un elettrone spaiato) è stabile
- FMN legato saldamente alla proteina
⇒ FMN e CoQ sono quindi il punto di contatto
fra il donatore a 2 elettroni NADH ed i
citocromi accettori di un solo elettrone
matrice
mitocondriale
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso I: NADH-CoQ ossidoreduttasi
Centri ferro-zolfo (gruppi più comuni: [2Fe-2S], [4Fe-4S])
- gruppi prostetici in proteine con atomi
di ferro non eme
- atomi di Fe coordinati a 4 atomi di S (Cys)
disposti in modo quasi tetraedrico attorno
all’atomo di Fe
- ossidazione o riduzione con perdita o acquisto di 1 e- forma ossidata e ridotta differiscono per una sola carica formale
(indipendentemente dal numero di atomi di Fe ) poiché gli atomi di Fe del
centro formano un sistema coniugato e quindi possono assumere stati
di ossidazione tra +2 e +3
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso I: NADH-CoQ ossidoreduttasi
- transito elettroni da NADH a CoQ: meccanismo a tappe seguendo il
potenziale di riduzione dei vari centri redox del Complesso I
-0.340
[2Fe-2S]N1a
[2Fe-2S]N1b
[4Fe-4S]N3, 4, 5
-0.250
[4Fe-4S]N6a, 6b, 7
-0.250
[4Fe-4S]N2
-0.100
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso I: NADH-CoQ ossidoreduttasi
- il processo implica la riduzione transitoria dei vari centri redox del
Complesso I quando legano gli e- e la loro riossidazione quando gli
e- passano al gruppo successivo
- l’arrangiamento spaziale dei gruppi suggerisce il potenziale percorso degli
elettroni
- i centri redox non devono necessariamente essere in contatto al fine di
trasferire elettroni
- le proprietà quanto-meccaniche dell’elettrone gli permettono di passar
velocemente tra gruppi redox inseriti nella proteina che sono separarti da
meno di 14 Å.
- per distanze > 14 Å si ha una catena di centri redox
Macromolecole Biologiche
Catena di trasporto degli elettroni
Trasporto elettroni ⇒ Traslocazione protoni
- nella conformazione ossidata i protoni si legano alle catene laterali degli aa
dalla parte della membrana che si affaccia sulla matrice
- con la riduzione si ha un cambio conformazionale che espone i gruppi
protonati sul lato citosolico della membrana e riduce i loro valori di pK
causando la dissociazione dei protoni
- il processo di riossidazione riporta la proteina nel suo stato conformazionale
originale
Macromolecole Biologiche
Catena di trasporto degli elettroni
Trasporto elettroni ⇒ Traslocazione protoni
- accoppiamento fra trasporto di elettroni attraverso il centri redox del
Complesso I e la traslocazione di 4 protoni fuori dalla matrice nello
spazio intermembrana
- sistema di pompaggio promosso da variazioni conformazionali indotte
dal cambiamento dello stato redox della proteina (alterazione del pK
delle catene ionizzabili ⇒ protoni presi o rilasciati mentre gli elettroni
sono trasferiti
- meccanismo di accoppiamento non ben compreso poiché i gruppi redox
sono localizzati nel braccio idrofilico del Complesso I, mentre il trasporto
di protoni avviene nel braccio inserito in membrana
- H+ (nuclei atomici) non possono essere trasportati attraverso la
membrana come accade per gli ioni (Na+, K+) ⇒ traslocazione
mediante saltellamento (“hopping”) lungo una catena di gruppi legati da
legami a idrogeno in un canale transmembrana
Macromolecole Biologiche
Catena di trasporto degli elettroni
Citocromi
- proteine contenenti un gruppo eme che alterna stati di ossidazione Fe(II) e
Fe(III) durante il trasporto di elettroni
- il gruppo eme di un citocromo ridotto ha uno spettro di assorbimento
prominente nel visibile consistente di 3 picchi: bande α, β, γ (Soret)
- banda α (assente nelle forme ossidate) usata per differenziare i vari tipi
di citocromi (picco α diverso a seconda dell’intorno in cui si trova l’eme)
Catena di trasporto degli elettroni
Macromolecole Biologiche
Citocromi
- gruppo eme diversamente sostituiti a seconda del tipo di citocromo
citocromo b: protoporfirina IX (mioglobina ed emoglobina)
citocromo c: i gruppi vinilici formano legami tioetere con i gruppi
sulfidrilici di 2 Cys della proteina a scapito del doppio legame
citocromo a: lunga coda idrofobica di unità isopreniche e gruppo formile
al posto di un sostituente metilico
ligandi assiali: His/His
His/His
His/Met
Macromolecole Biologiche
Catena di trasporto degli elettroni
Catena di trasporto degli elettroni
Complesso I:
catalizza l’ossidazione di NADH da parte di CoQ
NADH + CoQoss → NAD+ + CoQrid
ΔE0’ = 0.360 V ΔG°’ = - nFΔE°’ = -69.5 kJ/mol
Complesso II:
FADH2 + CoQoss → FAD + CoQrid
ΔE0’ = 0.085 V ΔG°’ = - nFΔE°’ = -16.4 kJ/mol
la
reazione non III:
rilascia abbastanza energia libera
Complesso
per sintetizzare ATP (30.5 kJ/mol)
CoQridotto + (cit. c)oss → CoQoss + (cit. c)rid
⇒ serve
per iniettare e- da FADH2
0
ΔEnella
’ = 0.190
ΔG°’ = - nFΔE°’
catenaVdi trasporto
degli e-= -36.7 kJ/mol
Complesso IV:
(cit. c)rid + 1/2 O2 → (cit. c)oss + H2O
ΔE0’ = 0.580 V
ΔG°’ = - nFΔE°’ = -112.0 kJ/mol
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso II:
Succinato-CoQ ossidoreduttasi
- contiene l’enzima dell’acido citrico succinato deidrogenasi ed altre subunità
- reazione 6 delciclo dell’acido citrico
- unico enzima del ciclo dell’acido citrico ad
essere legato alla membrana (gli altri sono
componenti della matrice mitocondriale)
⇒ scarica gli e- con potenziale relativamente
alto direttamente nella catena di trasporto
degli elettroni saltando il Complesso I
(nel processo il FADH2 viene riossidato a FAD)
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso II:
Succinato-CoQ ossidoreduttasi
- transito elettroni da Succinato a CoQ:
meccanismo a tappe seguendo il potenziale di
riduzione dei vari centri redox del Complesso II
- catena FAD-[2Fe-2S]- [4Fe-4S]-[3Fe-4S]-Q (substrato-Q >40Å)
- 1 citocromo b560
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso II:
Succinato-CoQ ossidoreduttasi
- il CoQ diffonde nel doppio strato lipidico
tra i complessi respiratori
⇒ serve come punto di raccolta di elettroni
- il Complesso II non catalizza alcun
trasferimento vettoriale di H+
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso III: CoQ citocromo c
ossidoreduttasi (o citocromo bc1)
- passaggio di e- da CoQ ridotto a citocromo c
- Complesso III: struttura dimerica
- 1 solo citocromo c per dimero
(spazio intermembrana)
per ogni monomero si ha:
- 2 citocromi b (eme bL e eme bH)
(subunità di 8 eliche trabsnmembrana)
- citocromo c1 legato alla membrana da 1 elica
- proteina ISP incrociata con citocromo b e c1
di altra subunità
ISP = Iron-Sulfur Protein, con centro [2Fe-2S] di Rieske
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso III: Ciclo Q
- riduzione da parte di CoQH2 (trasportatore a 2 elettroni) di 2 molecole
di citocromo c (trasportatore a 1 elettrone)
⇒ il CoQH2 subisce una riossidazione che avviene in 2 cicli in cui il
semichinone CoQ•- è un intermedio stabile
⇒ 2 siti di legame per CoQ indipendenti nel Complesso III
sito Qo→ lega CoQH2 (localizzato fra il centro di Rieske [2Fe-2S] e l’eme bL)
⇒ vicino allo spazio intermembrana
sito Qi→ lega CoQ•- e CoQ (localizzato vicino all’eme bH)
⇒ vicino allo matrice mitocondriale
- la membrana mitocondriale contiene un insieme di CoQ, CoQ•- e CoQH2 in
modo che l’ubichinone che viene rilasciato dal sito Qo può non essere lo stesso
che si lega al sito Qi (capacità di CoQ di diffondere entro la membrana)
Macromolecole Biologiche
Catena di trasporto degli elettroni
1° Ciclo Q
a) CoQH2 (dal Complesso I) si lega al sito Qo e
trasferisce 1 dei suoi 2 elettroni a ISP
⇒ rilascio di 2 protoni nello spazio
intermembrana con la generazione di CoQ•b) ISP riduce il citocromo c1 mentre CoQ•trasferisce l’elettrone rimasto al citocromo
bL formando CoQ (totamente ossidato)
c) il citocromo bL riduce il citocromo bH
d) CoQ lascia il sito Qo e si lega al sito Qi dove
prende l’elettrone dal citocromo bH tornando alla
forma semichinonica CoQ•CoQH2+citocromo c1 (Fe3+)
→CoQ•-+citocromo c1 (Fe2+)+2H+
Macromolecole Biologiche
Catena di trasporto degli elettroni
2° Ciclo Q
CoQH2+CoQ•- +citocromo c1 (Fe3+)+2H+
→CoQH2+citocromo c1 (Fe2+)+2H+
a) si ripete il ciclo 1: CoQH2 si lega al sito Qo ed 1 elettrone riduce ISP e poi il citocromo c1,
mentre il secondo elettrone riduce il citocromo bL e poi bH
b) il secondo elettrone riduce il CoQ•- legato al sito Qì prodotto nel primo ciclo con produzione di
CoQH2 (i 2 protoni utilizzati provengono dalla matrice mitocondriale)
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso III: il Ciclo Q
ciclo 1:
CoQH2+citocromo c1 (Fe3+) → CoQ•-+citocromo c1 (Fe2+)+2H+
ciclo 2:
CoQH2+CoQ•-+citocromo c1 (Fe3+)+2H+→CoQH2+citocromo c1 (Fe2+)+2H+
reazione complessiva:
CoQH2+2 citocromo c1 (Fe3+)+2H+ → CoQ+2 citocromo c1 (Fe2+)+4H+
per ogni 2 CoQH2 che entrano nel ciclo Q:
- 1 CoQH2 viene rigenerato
- 1 CoQH2 viene ossidato a CoQ
- 2 elettroni sono trasferiti al citocromo c1
⇒ appaiono 2 citocromi c1 ridotti e 4 protoni sulla parte esterna della membrana
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso IV: citocromo c ossidasi
8H+matrice + O2 + 4 citocromo c (Fe2+) → 4 citocromo c (Fe3+) + 2H2O + 4H+intermembrana
- dimero
di ~410 kD (complesso IV di mammifero)
spazio intermembrana
- 4 centri redox:
Subunità I:
citocromo a
citocromo a3
CuB (1 atomo di rame)
Subunità II:
centro CuA (coppia di atomi di rame)
- protomero di 13 subunità di cui 10 transmembrana
- area concava e ricca di aa acidi verso lo spazio
intermembrana ⇒ interazione con residui Lys del
citocromo c (donatore di e-)
Macromolecole Biologiche
Catena di trasporto degli elettroni
Complesso IV: citocromo c ossidasi
1) 4 protoni chimici o scalari
presi dalla matrice mitocondriale durante la riduzione di O2 a 2 H2O
2) translocazione di 4 protoni pompati o vettoriali
dalla matrice allo spazio intermembrana
⇒ pompa vettoriale di protoni dalla matrice allo spazio intermembrana
Macromolecole Biologiche
Catena di trasporto degli elettroni
Catena di trasporto degli elettroni