Il Counselling
Padova, 21 marzo 2016
Dr.ssa Stefania ZOVATO
Istituto Oncologico Veneto (IOV) – IRCCS – Padova
SSD Unità per i Tumori Ereditari
Punti chiave del counselling
Significato
Scopo e limiti
A chi si rivolge
Criteri, modalità, fasi
Risultato e utilità del
test genetico
SIGNIFICATO DEL COUNSELLING
Processo attraverso il quale i soggetti a rischio per una
malattia che può essere ereditaria, vengono informati di:
conseguenze della malattia
modi con i quali essa può essere prevenuta o curata
rischio della sua comparsa
probabilità di trasmetterla.
Team multidisciplinare
PER LA CONSULENZA (in tutte le sue fasi):
Genetista Medico
Psicologo
Infermiere case-manager
Medico Specialista
PER IL POSTCONSULENZA:
Medico Specialista (Oncologo)
Psicologo
Chirurgo
Radiologo
SCOPO DELLA CONSULENZA ONCOGENETICA
Decisioni preventivo-terapeutiche
per l'abbattimento del rischio
(prevenzione primaria)
Percorso di sorveglianza adeguato
atto a identificare il tumore in
fase precoce (pevenzione
secondaria)
NB: Il counseling oncogenetico favorisce la scelta di programmi di prevenzione ad hoc, ma può anche aumentare il carico dello dello stress nei confronti del rischio percepito
A QUALI DONNE CI RIVOLGIAMO?
K mammella: tumore più frequente nella
popolazione femminile (8-10%)
“Solo” il 5-10% è di tipo ereditario
Il 15-20% può essere familiare (almeno
3 soggetti affetti in 2 generazioni)
Ad oggi i principali geni responsabili
sono :
-BRCA 1 (cromosoma 17)
-BRCA2 (cromosoma 13)
Buona parte dei tumori ereditari/familiari
sono legati ad altri geni (p53,pTEN,ATM,
CHEK2,CDH1, SDK11) o geni non ancora
identificati
I TUMORI EREDITARI DELLA MAMMELLA :
definizione
Tumore ereditario: una delle
alterazioni del DNA è presente
anche nelle cellule germinali (cellula
uovo o spermatozoo) ed è quindi
trasmissibile dai genitori ai figli
Tumore familiare: quando in una
famiglia vi siano almeno 3 persone
con tumore mammario in 2 diverse
generazioni, in assenza di quei criteri
che caratterizzano le forme
ereditarie, in particolare
l’identificazione della mutazione
PRIMO SCREENING: MMG?
CENTRI SPOKE?
Storia familiare di cancro al seno nei
parenti
età di insorgenza di cancro al seno
bilateralità della malattia
grado di parentela (primo o superiore)
più casi in famiglia (in particolare
sullo stesso ramo)
altri tumori correlati ad esordio
precoce (per esempio, ovaio)
numero di individui sani (grandi
famiglie con molti parenti non affetti
avranno una probabilità minore di
essere portatori di mutazione genica)
CRITERI PER LA CONSULENZA
LG internazionali: The French National Ad Hoc Committee/ National Health and Medical Reasearch Council (Australian Cancer Network) National
Comprehensive Cancer Network/ National Institute of Clinical Excellence (NICE) ScHARR, University of Sheffield
Per il lato paterno della famiglia considerare anche famigliari di secondo grado (nonna, zie)
CRITERI PER LA CONSULENZA
CONSULENZA GENETICA ONCOLOGICA
La consulenza genetica oncologica (CGO) è
una attività clinica e genetica che
affronta il problema della prevenzione
dei tumori, o delle loro conseguenze, in
relazione al rischio genetico di malattia
stimato in base alla storia familiare
e/o personale di cancro.
Al termine del percorso di CGO vengono fornite e
discusse:
1 la stima del rischio genetico (che include il
risultato del test genetico, ove eseguito)
2 la stima del rischio di cancro e le opzioni di
sorveglianza/riduzione del rischio relative alla
fascia di rischio considerata. [ 2013]
3 Il percorso di CGO può essere limitato ad un
solo colloquio oppure configurarsi come un
programma di presa in carico.
Fasi della consulenza oncogenetica
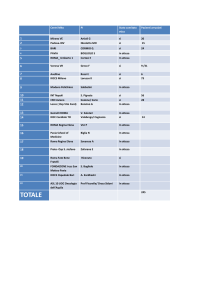
Breast Ca, 52
Ovarian
Ca, 45
Raccolta dell’albero genealogico (quanto più esteso e
completo possibile)
Breast Ca,
37
37
35
Cartella
clinica
Consulenza pre-test:
Analisi del referto istologico del probando e, se possibile, di
altri familiari affetti
Stima della probabilità a priori di mutazione BRCA (modelli
statistici):Risk assessment
Verificati i criteri: proposta test genetico (caso indice) e
Consenso Informato
Consulenza post-test:
Discussione del test genetico: implicazioni cliniche
RISULTATO DEL TEST
INFORMATIVO:
identificazione di mutazione
con noto significato
patogenetico nel gene BRCA1 o
BRCA2
INCERTO: identificazione di
una variante di incerto
significato (VUS)
NON INFORMATIVO: non
documentabile una precisa
alterazione per:
limiti delle tecniche
possibile coinvolgimento di
geni diversi
reale assenza di mutazione
Viene ereditata una copia mutata del gene(trasmissione AUTOSOMICA DOMINANTE) ma
Non si sviluppa tumore fino a quando non si verifica una mutazione a carico della seconda copia non mutata(“second hit)
Chi deve essere testato nella famiglia?
Carrier
obbligato
mut +
Mut TEST
completo
mut +
mut +
Rischio ~ di popolazione
1:74 OvCa
1:12 BrCa
Rischio
genetico
20-40%
ovarian
cancer
60-80%
breast
cancer
Test non informativo
(80%~ dei casi)
ALTO RISCHIO=
Rischio equivalente
UTILITA‘ DEL TEST GENETICO
Test diagnostico (soggetto affetto):
Se INFORMATIVO
-Diagnosi di ereditarietà
-Stima del suo rischio personale di sviluppare una seconda neoplasia
-permette una modificazione del trattamento (chir./terapeutico)
Test predittivo (per i familiari):
-Identificazione dei portatori (vero positivo) dai non portatori (vero
negativo)
-Inclusione dei portatori nei percorsi di prevenzione alti rischi
Permette di adottare i più idonei interventi di prevenzione primaria (RRS: Risk Reducing
Surgery) e/o sorveglianza (prevenzione secondaria/diagnosi precoce) nei soggetti
carrier di mutazione
PENETRANCE
Cancer risk associated with germline mutations in BRCA genes
TABLE 1. BRCA1/2 Cancer risk
Cancer site
BRCA1 Mutation
BRCA2 Mutation
Female breast
50%-80%
40%-70%
Ovarian
<40%
<20%
Prostate
<30%
<39%
Pancreatic
1.3%-3.2%
2.3%-7%
Second primary BC
35-43% to 10-20y
idem
Controlateral
30-40% to 10-20y
idem
K.M Shannon et al.The Cancer J.,vol.18;2002
Metcalfe K. et al. J.Clin.Oncol.22(12) ;2004
Test positivo: proposte
SOGGETTO SANO
Protocolli di sorveglianza
(utilizzo esami bioumorali e di
imaging adeguati)
Farmaco-chemoprevenzione
Proposte di chirurgia Riskreducing
SOGGETTO AFFETTO DA
NEOPLASIA
Proposte di chirurgia anche non
conservativa (malattia
localizzata)
Proposte di terapia mirata
(PARP-Inhibitors malattia
avanzata)
COMUNICAZIONE DELL’ESITO
DEL TEST POSITIVO
• Può essere causa di diversi disagi
psicologici:
interferenza con programmazione di vita futura
angoscia
verso la
possibile
malattia,)
aumento di
depressione,
ansia o stress
Senso di
colpa
rispetto ad
una possibile
trasmissione
CONCLUSIONI
VANTAGGI DELLA CGO:
Selezione di soggetti o famiglie ad alto rischio di
sviluppo di malattia
Proposte di protocolli di sorveglianza (sano) o followup mirati (affetto) in portatori di mutazione BRCA
1 o 2 o rischio di malattia elevato
strategie chirurgiche adeguate nei soggetti
malati/sani portatori di mutazione (abbattimento
del
rischio)
Impostazione terapie mirate (Parp-inhibitors) nei
soggetti mutati con malattia avanzata
Grazie a:
Silvia Tognazzo
Elisa Alducci
Marco Montagna
Roberta Pozzani
Marina Lorusso
Giuseppe Opocher