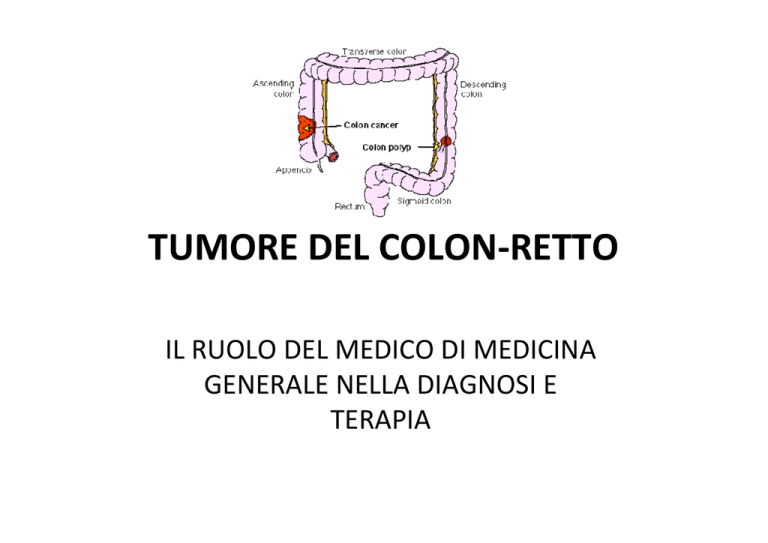
TUMORE DEL COLON-RETTO
IL RUOLO DEL MEDICO DI MEDICINA
GENERALE NELLA DIAGNOSI E
TERAPIA
COLORECTAL CANCER: ITALY, CHANGES IN 10 Yrs
-
NEW CASES / Yr
30.000
47.000
-
1995
2005
DEATHS / Yr
18.000
16.000
1995
2005
INCIDENCE and SURVIVAL
Gender
Age
15-44
45-54
55-64 65-74
75+
5 ys Survival
65%
62%
62%
49%
59%
EPIDEMIOLOGIA
In Europa il tumore dello colon retto è la 4° neoplasia più
frequente nella popolazione maschile (11.3) e la 3° in quella
femminile (11.5). Prevalente nel sesso maschile.
Più frequente tra i 50 e i 70 anni (il 70% >65 aa)
In Italia rappresenta la 2° causa di morte per neoplasia , in
entrambi i sessi, nonostante l’incidenza sia in riduzione, con un
gradiente geografico nord-sud
Nel 90-95% sono Adenocarcinoma.
La sede più frequentemente colpita dalla patologia è il colon prossimale
(38,8%), seguito dal colon distale (29,6%) e dal retto (28,5%), mentre i
restanti tumori (circa l’1%) hanno sede multipla.
Il rischio di avere una diagnosi di tumore del colon-retto nel corso della
vita (fra 0 e 84 anni) è di 1 caso ogni 11 uomini e 1 caso ogni 26 donne,
mentre il rischio di morire è di 1 su 17 uomini e 1 donna su 46.
•FATTORI DI RISCHIO
• Genetici (poliposici e non poliposici)
• non genetici:
- fumo (RR 1.38), alcol (RR 1.16), obesità (RR 1.24 per aumento di BMI> 5kg/m2)
- malattie infiammatorie croniche intestinali (RR 2.5 per pz con M.di Crohn)
- dieta: RR 0.34 per pattern nutrizionale frutta e verdura e RR2.20 per pattern
nutrizionale carne, patate e cereali raffinati
- aspirina
Si può stimare che ad un
MMG con 1.500 assistiti
si presenti, in media, un
caso all’anno di neoplasia
colo-rettale e 15 casi
sospetti per patologia
neoplastica del colonretto. Ai MMG devono
essere forniti:
informazione sul
funzionamento e sulle
modalità di accesso
delle strutture
diagnostiche (in
particolare Servizi di
Endoscopia) e
terapeutiche.
Fra esordio dei sintomi e terapia
chirurgica intercorrono in media 4 mesi
(range 1-24) per le localizzazioni del
colon sinistro e 7 mesi (range 2-28)
per quelle del colon destro.
Alcuni studi suggeriscono una
correlazione
tra
ritardo
e
peggioramento della prognosi.
Criteri per invio alla diagnostica
•
•
•
•
I sintomi tipici delle neoplasie colorettali sono presenti solo nel 40% dei casi. I pazienti
tendono a sottovalutare il sintomo con un ritardo tra comparsa ed accesso al MMG che può
arrivare a diversi anni. La falsa negatività degli accertamenti o il dilazionamento
dell’endoscopia possono ulteriormente aumentare il ritardo.
Un sanguinamento rettale di recente insorgenza in pazienti > 50 anni non deve essere
attribuito a patologia benigna senza aver escluso carcinomi o polipi adenomatosi del
colonretto.
Tutti i pazienti > 50 anni che si presentino al MMG con nuovi, significativi e/o persistenti
sintomi riferibili a patologia colorettale (dolore addominale, alterazioni dell’alvo,
mucorrea, rettorragia, dimagrimento, anemia sideropenica, ecc) devono ricevere
un’accurata anamnesi (inclusa quella familiare) ed essere sottoposti ad esame obiettivo
comprensivo di esplorazione rettale. Gli accertamenti diagnostici devono
preferenzialmente essere realizzati entro 4 settimane.
Pazienti di età < 50 anni che si presentino con sintomi riferibili a patologia colorettale, in
assenza di obiettività e di rischio familiare, possono essere sorvegliati per alcune
settimane; se i sintomi persistono devono essere avviati ad accertamenti.
Screening
•
L’evidenza disponibile indica che programmi di screening per il carcinoma del colon-retto,
che utilizzano il test per la ricerca del sangue occulto fecale (SOF) o l’endoscopia, possono
ridurre la mortalità. Le strategie devono considerare il rischio della popolazione da
esaminare, rate
il segmento
intestino
a maggior rischio,screenati
il costo-efficacia,
la “compliance”
e la e
Detection
(DR: di
tasso
di diagnosi/mille
con FOBT)
dei cancri
disponibilità
delle. tecnologie.
degli
adenomi
Secondo le Linee Guida Europee la DR per adenomi negli
• screening
Ognuna delle
strategie proposte
presenta
problemi cheal
devono
affrontatiPer
per poter
organizzati
varia fra
:13.3-22.3/mille
primoessere
passaggio.
i cancri
programmi
scala,
relativamente
al livello diai
adesione,
alla
la avviare
DR varia
da 1.8diascreening
9.5/millesuallarga
primo
passaggio
e 1.3/mille
successivi.
frequenza
con cui proporre
il test, all’età
in cui iniziare lo
screening. Per èla determinazione
Per
la valutazione
dell’efficacia
dell’indagine
endoscopica
utile misurare il
del SOF il test immunologico sembra superiore al test al guaiaco per detection rate e valore
valore predittivo positivo (VPP) per adenoma e per cancro. Tale valore
predittivo positivo (VPP).
corrisponde al tasso di diagnosi (DR) all’esame endoscopico eseguito. Le
• Le indicazioni sulla modalità di screening non sono univoche. Gli strumenti più aggressivi
Linee Guida Europee riportano un valore compreso tra 19.6% e 40.3% per il
(come la colonscopia) avrebbero una maggiore sensibilità diagnostica a scapito della
VPP
degli adenomi
tra 4.5 e 8.6%
peraggressiva)
il VPP del
cancro
primoaccettazione
passaggio
accettabilità
del test, laesigmoidoscopia
(meno
avrebbe
unaalmigliore
che
al circa
4% ilai30%-40%
passaggi
Il GISCoR
ma si
nonporta
identifica
dellesuccessivi.
lesioni; il sangue
occulto è piùpropone
accettabilecome
ma ha VPP
standard
valori e>=25%
al primo
avanzato
più grave,
bassa sensibilità
deve essere
ripetutoesame
ogni dueper
anni adenoma
(come minimo)
perchè looscreening
risulti efficace.
>=15%
agli esami successivi..
• Per lo screening l’uso dei marcatori fecali e della colonscopia virtuale sono ancora
sperimentali e non codificati.
Fattori di rischio
•
•
Storia di cancro o di adenoma, familiarità (compresa ereditarietà), malattie
infiammatorie intestinali, neoplasie dell’endometrio (se diagnosticate prima dei 60
anni), acromegalia, ureterosigmoidostomia, esposizione a radiazioni per neoplasie
della prostata (segnalazioni sporadiche riguardanti terapie non conformazionali).
La maggior parte dei carcinomi del colon retto è però di tipo sporadico con
incidenza in incremento con l’aumentare dell’età, con mediana di insorgenza di
circa 70 anni ed a bassa probabilità di comparsa prima dei 50 anni. L’età superiore
a 50 anni viene quindi considerata un fattore di rischio.
Storia familiare di neoplasia colorettale e
sorveglianza
•
In caso di familiarità per neoplasie colorettali, il rischio dipende dal numero di
familiari affetti dalla patologia, dall’età cui si sono ammalati e dal grado di
parentela. Sulla base di queste considerazioni si configurano tre possibili “gradi” di
sorveglianza.
1) Diagnosi di sindrome di Lynch o HNPCC: soddisfazione dei criteri di Amsterdam.
– Sorveglianza: colonscopia ogni 12-24 mesi e visita ginecologica annuale per le donne, a
partire dai 25 anni di età. Le altre neoplasie presenti che fanno parte dello spettro dei
tumori della sindrome, vanno controllate solo se presenti nella famiglia.
2) Parente di I grado con CCR o adenoma avanzato in età < 60 anni, oppure
almeno 2 parenti di I grado con diagnosi di CCR (indipendentemente dall’ età di
diagnosi). Sorveglianza: colonscopia all’ età di 40 anni oppure 10 anni prima dell’
età del parente più giovane affetto dal CCR, ripetuta ogni 5 anni
3) Parente di I grado (genitori, fratelli, figli) con CCR diagnosticato in età > 60 anni
oppure 2 parenti di II grado (nonni, zii) con diagnosi di CCR. Sorveglianza:
colonscopia a 40 anni e ripetuta ogni 5 anni.
POLIPOSI familiare
• In caso di Poliposi adenomatosa familiare, i soggetti portatori della
mutazione su APC devono essere seguiti con retto-sigmoidoscopie dalla
pubertà e con colonscopie, quando compaiono i polipi. La colectomia
profilattica deve essere programmata al termine dello sviluppo (intorno
ad i 20 anni di età) se le colonscopie precedenti non hanno già posto il
dubbio di trasformazione maligna di uno o più polipi.
• I parenti di I°grado dei pazienti affetti da poliposi attenuata vanno
sorvegliati con colonscopie a partire dai 18 anni di età, da ripetere ogni 12 anni.
• Sorveglianza post-polipectomia
• Carcinoma ereditario
Indagine genetica
•
•
•
E’ indicata solo nel sospetto di forme ereditarie. Esse sono: la Poliposi colica
familiare (FAP, FAP attenuate, poliposi associata al gene MUTYH/MAP, sindrome di
Gardner e di Turcot), la HNPCC (cancro colorettale ereditario non poliposico), le
poliposi amartomatose (Peutz-Jeghers, poliposi giovanili). Il test genetico
dovrebbe essere offerto quando la sindrome è evidente clinicamente (allo scopo
di identificare la mutazione e guidare lo screening nei familiari a rischio), ai
familiari di soggetti con diagnosi genetica nota (sempre allo scopo di guidare i
programmi di screening) e quando clinicamente la sindrome è sospetta ma non
certa (esempio in soggetti con più di dieci adenomi). Deve essere ricordato che la
mutazione è presente nello 80-90% dei soggetti con Poliposi colica familiare (FAP),
nel 50-70% di quelli con HNPCC, nel 30-70% di quelli con Peutz-Jeghers.
In pazienti con familiarità per HNPCC la sorveglianza deve essere effettuata con
colonscopia, deve iniziare all’età di 25 anni e deve essere ripetuta ogni 1-2 anni
fino all’età di 75. Questi soggetti sono a rischio anche per altre neoplasie e devono
quindi effettuare altri accertamenti preventivi (es. stomaco, utero, vie urinarie).
In pazienti con familiarità per FAP la sigmoidoscopia dovrebbe essere offerta ogni
1-2 anni ai soggetti che non hanno la mutazione a partire dall’età di 13-15 anni
fino all’età di 30 anni e poi ogni 5 anni.
Stadiazione della neoplasia
La stadiazione clinica è fondamentale per impostare
correttamente il trattamento e deve essere la più completa e
precisa possibile.
La pianificazione degli esami necessari alla stadiazione dovrà
essere volta a definire:
- il grado di infiltrazione (T)
- la presenza di linfonodi interessati (N)
- la presenza di metastasi (M)
COLON
-Ecografia addominale: esame di primo livello per il rapporto costobeneficio utile nella stadiazione pre-operatoria.
-Radiografia del torace: indispensabile ed integrata eventualmente dalla
TC torace
-TC addomino pelvica con mdc: ha valore diagnostico di primo livello per il
parametro T, buona accuratezza per il parametro M, utile per il parametro
N.
-RMN epatica: esame di II livello in caso di lesioni focali di dubbia
interpretazione.
-Ecografia epatica con mdc (CEUS): esame di II livello nella diagnosi
differenziale di lesioni focali epatiche.
-PET TC: esame di II livello, nell’interpretazione di lesioni dubbie e nella
valutazione delle recidive.
-Marker tumorali sierici (CEA): prognostici
RETTO
-Ecografia addominale: esame di primo livello per il rapporto costo-beneficio utile nella
stadiazione pre-operatoria.
-Radiografia del torace: indispensabile ed integrata eventualmente dalla TC torace
-TC addomino pelvica con mdc: ha valore diagnostico di primo livello per il parametro T,
buona accuratezza per il parametro M, utile per il parametro N.
- ECO trans-anale (o trans-vaginale): per la definizione del T e dell’N e relative scelte
terapeutiche
- RMN pelvica: per la definizione del T e dell’N e relative scelte terapeutiche
-RMN epatica: esame di II livello in caso di lesioni focali di dubbia interpretazione.
-Ecografia epatica con mdc (CEUS): esame di II livello nella diagnosi differenziale di
lesioni focali epatiche.
-PET TC: esame di II livello, nell’interpretazione di lesioni dubbie e nella valutazione
delle recidive.
- Rettoscopia con strumento rigido: utile nella definizione della distanza della neoplasia
dal margine anale.
-Marker tumorali sierici (CEA): prognostici
1987 Introduzione sistema TNM
American Join Committee on Cancer (AJCC)
International Union Against Cancer (IUCC)
I parametri TNM possono essere definiti clinicamente,
con metodiche di immagine, o con studio
istopatologico
• cT, cN, cM parametri definiti clinicamente
• uT, uN, uM parametri definiti con studio
ecografico (ultrasonografico)
• pT, pN, pM parametri definiti mediante
valutazione istopatologica
• ypT, ypN, ypM parametri definiti mediante
valutazione istopatologica su paziente
sottoposto a trattamento neo-adiuvante
COLON: sopravvivenza attesa
Stadio TNM
I
II (A,B,C)
III (A,B,C)
IV (A,B)
Stadio AJCC Stadio Dukes
T1,T2,N0,M0
A,B1
T3,T4,N0,M0
B2,B3
T1-4,N1-2,M0
C
T1-4,N1-2,M1
D
OS a 5 anni (%)
85-95
60-80
30-65
<5
Fattori prognostici negativi in pazienti con carcinoma del colon radicalmente operato
- estensione del tumore oltre la sierosa (pT4)
- coinvolgimento linfonodale loco-regionale (pN1-N2)
- meno di 12 linfonodi esaminati
- istologia scarsamente differenziata
- invasione linfatica/vascolare/perineurale
- presentazione clinica con perforazione/occlusione
- livelli di CEA pre-operatori >5.0 ng/ml
RETTO: sopravvivenza attesa
Linfonodi regionali del retto
Linfonodi mesorettali,
Linfonodi emorroidari superiori, medi ed
inferiori,
Lindonodi mesenterici inferiori,
Linfonodi iliaci interni,
Linfonodi latero-sacrali, presacrali e del
promontrorio sacrale (di Gerota)
Linfonodi inguinali………
• Ogni altra localizzazione linfonodale (es.
metastasi linfonodi inguinali) viene
considerata come metastasi a distanza (M)
• Definizione di retto medio-basso: sede anatomica al di sotto della
riflessione peritoneale <12 cm dal margine anale (retto extraperitoneale)
- Stadiazione definita con: esplorazione rettale, rettoscopia, RM
pelvica (ecografia endorettale se non disponibile RM), TC toraceaddome
- Pazienti in stadio cT1-T2 N0 (u) indicazione terapeutica:
chirurgia non preceduta da chemio-radioterapia
-
Pazienti in stadio cT3-T4 e/o N+ (u) indicazione terapeutica:
trattamento pre-operatorio con chemioterapia (5-fluorouracile in
infusione continua protratta o capecitabina) in combinazione con
radioterapia (5040 cGy in 28 frazioni da 180 cGy), seguita dopo 6-8
settimane dal termine del trattamento da chirurgia con TME, e
chemioterapia adiuvante in relazione allo stadio clinico iniziale e allo
stato patologico dopo chirurgia.
Trattamento sistemico
Retto (<12 cm dalla RA)
Chemio e Radioterapia concomitante neoadiuvante
Chemioterapia adiuvante
Chemioterapia in fase metastatica
Colon
Chemioterapia sistemica
– Adiuvante
– In fase metastatica
Followup
Le linee guida dell’AIOM che hanno come riferimento quelle ESMO ed ASCO
indicano nel follow-up:
- esame clinico ogni 4 mesi per i primi 3 anni, poi ogni 6 mesi per i due anni
successivi. Non vi sono evidenze che indichino l’utilità degli enzimi epatici.
- CEA ogni 4 mesi per i primi 3 anni, poi ogni 6 mesi per i 2 anni successivi.
- colonscopia dopo un anno dall’intervento, poi ogni 3 e quindi ogni 5 anni. Nei
pazienti senza uno studio del colon preoperatorio, la colonscopia va effettuata
entro 6-12 mesi dall’intervento.
- non c’è ancora evidenza che ecografia e TC dell’addome superiore aumentino la
sopravvivenza, ma in considerazione della possibilità di una diagnosi precoce di
metastasi epatiche operabili, devono essere effettuate ogni 6-12 mesi per i primi 3
anni.
- non c’è indicazione all’uso routinario di Rx e TC del torace, ma in considerazione
della possibilità di una diagnosi precoce, devono essere effettuate ogni 6-12 mesi
per i primi 3 anni.
- l’esecuzione di una 18F-FDG-PET è indicata in presenza di recidiva dubbia o di
rialzo del CEA senza evidenza di malattia all’imaging tradizionale
• Per il carcinoma del retto medio-basso vale
quanto già riportato per il carcinoma del colon
e retto alto. In considerazione del rischio di
ricaduta locale è indicata specificatamente in
corso di follow-up l’esecuzione di ecografia
endorettale, che va eseguita per i primi 3 anni
ogni 4-6 mesi
TERAPIA
APPROCCIO PERIOPERATORIO nel k retto Il trattamento chemioradioterapico concomitante con derivati del 5-FU. Dopo l’intervento e valutazine
della risposta, chemioeterapua adiuvante con schemi contenti oxaliplatino-5FU.
TRATTAMENTO DELLA MALATTIA AVANZATA OBIETTIVI:
- aumento della resecabilità epatica (20% vivo a 5 anni senza malattia)
- prolungamento della sopravvivenza (fino a 23-24 mesi)
- palliazione dei sintomi
- miglioramento della qualità di vita
La chemioterapia eseguita in pazienti asintomatici risulta più efficace in termini di
qualità di vita e sopravvivenza (livello di evidenza I)
I regimi di combinazione ( 5fluorouracile, oxaliplatino, irinotecan, farmaci biologici a
bersaglio molecolare come bevacizumab e aflibercept [anti-vegf], cetuximab e
panitumumab [anti-EGFR]).
RADIOTERAPIA sintomatica (emorragia /occlusione/ metastasi osee)
CHIRURGIA PALLIATIVA in caso di ostruzione o sanguinamento
Biomarcatori nei tumori gastrontestinali
Hypertension: incidence and RR (gr 3-4)
Anti-VEGF
All grade HTN 23.6%
RR 3.02 P<0.001
No. of
studies
Bevacizumab
(events/sample size)
Control
(events/sample size)
Incidence
(95% CI), %
Relative risk
(95% CI)
Overall
20
588/6754
75/5902
7.9 (6.1-10.2)
5.37 (4.23-6.82)
Colorectal cancer
7
278/3028
50/2969
8.6 (5.7-12.8)
5.24 (3.89-7.05)
NSCLC
4
108/1230
9/841
9.0 (6.1-13.2)
7.06 (3.66-13.62)
Renal cell cancer
3
55/779
2/693
7.1 (3.4-14.1)
8.99 (2.72-29.72)
Breast cancer
3
103/1091
4/794
8.5 (3.1-21.2)
14.80 (0.92-238.51)
Pancreatic cancer
2
32/563
5/550
5.5 (2.2-12.7)
5.52 (2.12-14.35)
Malignant
mesothelioma
1
21/268
5/258
22.6 (13.3-35.8)
2.49 (0.94-6.59)
Tumour type
Adapted from Ranpura V, et al. Am J Hypertens 2010;23(5):460-8.
Tossicità cutanea: farmaci anti-EGFR
EGFRBLOCKADE
• ↑ Apoptosis
• Keratinocyte
differentiation promotion
• Unblockade cutaneus
Chemokine production
Alteration of
keratinocyte terminal
differentiation and
synthesis process
• Stratum corneum thinning
• Inflammatory cells
Infiltration into the follicles
Proteic and/or lipidic
component
compromission?
Excessive
water loss
Alteration
of VEGF
expression
Alteration
synthesis nail’s leaf
at matrix level
Angiogenesis
inhibition
•↑ VEGF
under certain
conditions
Paronychia
Teleangiectasia
Pyogenic
granuloma
XEROSIS
Fullicular rash
Epidermis
Fissures
TERAPIA
CURE PALLIATIVE E ASSISTENZA DOMICILIARE il ruolo del medico di
medicina generale in Oncologia dovrebbe avere come obiettivo principale, dopo la
diagnosi, il trattamento di supporto e la gestione al domicilio durante la
chemioterapia e nella malattia avanzata in BSC.
BISOGNI DEL PAZIENTE CON TUMORE colorettale:
- tossicità da chemioterapia ( astenia, neutropenia, febbre, anemia, inappetenza,
mucosite, parestesie, …)
-
difficoltà fisiche ad accedere al DH Oncologico terapie di supporto e prelievi di
sangue a domicilio attivazione ADI
-
difficoltà ad alimentarsi contatti con i nutrizionisti
-
dolore non controllato
Sono in corso studi per l’attivazione dei Medici di Cure Palliative già al momento della
diagnosi
sarebbe necessario iniziare da subito una COLLABORAZIONE tra ONCOLOGI,
MEDICI DI BASE, PALLIATIVISTI per la migliore gestione dei bisogni del paziente
con tumore avanzato