Capitolo 86
Capitolo 86 ■ Difetti del metabolismo
lipidico
86.1 • DIFETTI DELLA -OSSIDAZIONE DEGLI ACIDI
GRASSI MITOCONDRIALI • Charles A. Stanley
e Michael J. Bennett
La -ossidazione mitocondriale degli acidi grassi è una via essenziale per la produzione di energia, particolarmente importante durante prolungati periodi di digiuno, in caso di riduzione
dell’apporto calorico dovuta a malattie gastrointestinali o di aumento del dispendio energetico in uno stato febbrile. In queste
condizioni l’organismo utilizza prevalentemente gli acidi grassi,
invece dei carboidrati, come principale “combustibile”. Gli acidi
grassi costituiscono anche un’importante fonte energetica per
i muscoli scheletrici e vengono utilizzati come substrato energetico principale dal cuore, per il motivo che sono completamente ossidati a diossido di carbonio e acqua. I prodotti finali
dell’ossidazione epatica degli acidi grassi sono i corpi chetonici
-idrossibutirrato e acetoacetato, i quali non possono essere ossidati dal fegato, ma costituiscono un’importante riserva energetica
nei tessuti periferici e in particolare nel cervello.
Difetti genetici a trasmissione recessiva sono stati identificati in
pressoché tutti i passaggi noti della via di ossidazione degli acidi
grassi (Tab. 86-1).
Le manifestazioni cliniche interessano i tessuti con un elevato
flusso di -ossidazione, come il fegato, il sistema scheletrico e
il muscolo cardiaco. La presentazione più comune consiste in
un episodio acuto di coma che mette a rischio la sopravvivenza
del paziente, con ipoglicemia indotta da un periodo di digiuno
dovuto a chetogenesi epatica deficitaria. Altre manifestazioni includono miocardiopatia cronica e debolezza muscolare o rabdomiolisi acuta indotta da esercizio fisico. I difetti dell’ossidazione
degli acidi grassi possono restare asintomatici durante periodi
di assenza di stress. La malattia acuta può essere erroneamente
diagnosticata come sindrome di Reye o, se fatale, come morte
improvvisa del lattante (SIDS). La diagnosi di difetto dell’ossidazione degli acidi grassi non è semplice da diagnosticare,
perché l’unico indicatore specifico può essere il riscontro di
concentrazioni insolitamente ridotte di chetoni nelle urine, in
un bambino con ipoglicemia. I deficit genetici dell’utilizzo dei
corpi chetonici rischiano di passare inosservati, perché la chetosi
è un reperto prevedibile in presenza di ipoglicemia a digiuno. In
alcune circostanze le manifestazioni cliniche sembrano derivare
maggiormente dagli effetti tossici dei metaboliti degli acidi grassi
piuttosto che dall’inadeguata produzione di energia. In alcuni di
questi disturbi (LCHAD, CPT-IA, SCAD e TFP; vedi oltre), la
presenza di un feto affetto (omozigote) aumenta il rischio che la
madre eterozigote sviluppi steatosi epatica acuta della gravidanza
o preeclampsia con sindrome HELLP (Hemolysis, Elevated Liver
enzymes, Low Platelets, emolisi, elevazione degli enzimi epatici,
riduzione delle piastrine). Malformazioni cerebrali e renali sono
state descritte nei casi di grave deficit della flavoproteina che
trasferisce elettroni (ETF, Electron Transfer Flavoprotein), di
ETF deidrogenasi (ETF-DH) o di carnitina palmitotrasferasi-2
(CPT-II); è possibile che tali deficit riflettano la tossicità in utero
dei metaboliti degli acidi grassi. Nei deficit di LCHAD sono
state identificate degenerazione retinica progressiva e malattia
epatica cronica progressiva. I programmi di screening neonatale
che utilizzano la spettrometria di tandem massa (MS/MS) individuano acilcarnitine caratteristiche, consentendo la diagnosi
presintomatica. Questi metodi di screening hanno dimostrato
che i disturbi dell’ossidazione degli acidi grassi, considerati nel
complesso, costituiscono uno dei più diffusi errori congeniti del
metabolismo.
Le Figure 86-1 e 86-2 illustrano le fasi dell’ossidazione di un
tipico acido grasso a catena lunga. Nel ciclo della carnitina gli
84-92ANA.indd 589
■
Difetti del metabolismo lipidico
■
589
acidi grassi sono trasportati attraverso la barriera della membrana mitocondriale interna come esteri dell’acilcarnitina. All’interno dei mitocondri, fasi successive del ciclo a quattro passaggi
della -ossidazione convertono l’acido grasso attivato (CoA) in
unità di acetil CoA. Ciascuno di questi passaggi richiede da due
a tre specifici isoenzimi a catena di lunghezze diverse, in grado
di adattarsi a specie di acil CoA di dimensioni differenti. La via
di trasferimento degli elettroni trasporta gli elettroni generati nel
corso del primo passaggio della -ossidazione (acil CoA deidrogenasi) alla catena di trasporto degli elettroni per la produzione
di adenosina trifosfato (ATP), mentre gli elettroni generati dal
terzo passaggio (3-idrossiacil CoA deidrogenasi) entrano nella
catena respiratoria a livello del complesso 1. La maggior parte
dell’acetil CoA generato dalla -ossidazione epatica confluisce
nella via della chetogenesi, per formare -idrossibutirrato e acetoacetato.
DIFETTI DEL CICLO DELLA -OSSIDAZIONE
DEFICIT DI ACIL COA DEIDROGENASI (MCAD) A CATENA MEDIA. Il
deficit di MCAD (Medium-Chain Acyl CoA) è il più comune difetto dell’ossidazione degli acidi grassi. L’effetto fondatore ha un
peso rilevante; la maggior parte dei pazienti discende da europei
nordoccidentali e risulta omozigote per una singola mutazione
missense: una transizione A-G in posizione 985 del cDNA, che
sostituisce una lisina con un acido glutammico a livello del residuo 329 (K329E).
Manifestazioni cliniche. I pazienti colpiti presentano, nei primi 3
mesi-3 anni di vita, episodi acuti scatenati da prolungati periodi
di digiuno (superiori a 12-16 ore). I segni e i sintomi includono vomito e letargia, che progrediscono rapidamente in coma,
convulsioni e insufficienza cardiorespiratoria. In tali circostanze
può verificarsi la morte improvvisa del bambino. Il fegato risulta talvolta leggermente ingrossato, con depositi di grasso. Nei
primi mesi di vita gli attacchi sono rari, probabilmente perché
l’intervallo tra una poppata e l’altra è ridotto, ma poi il rischio
aumenta nei bambini più grandi, in particolare durante la notte o
in periodi di digiuno dovuti a una malattia infantile intercorrente. La presentazione nei primi giorni di vita è stata segnalata in
neonati tenuti inavvertitamente a digiuno troppo a lungo tra una
poppata e quella successiva. La diagnosi di MCAD è stata occasionalmente documentata in adolescenti e adulti precedentemente
sani; ciò significa che anche soggetti che sono stati asintomatici
nel corso dell’infanzia sono a rischio di scompenso metabolico
se esposti a prolungati periodi di digiuno.
Reperti di laboratorio. Durante gli episodi acuti di solito è presente l’ipoglicemia. Le concentrazioni plasmatiche e urinarie di
chetoni risultano eccessivamente ridotte (ipoglicemia ipochetonica), causando, per la relativa ipochetonemia, un’acidemia assente o minima. I test della funzione epatica rivelano un’anomala
elevazione degli enzimi epatici (ALT, AST), un aumento dell’ammoniemia nel sangue e un tempo prolungato di protrombina
e di tromboplastina parziale. Nel corso dell’attacco acuto, la
biopsia epatica mostra steatosi micro o macrovescicolare, dovuta all’accumulo di trigliceridi. Durante i periodi di digiuno
o di malattia acuta, i profili urinari degli acidi grassi, ottenuti mediante gas-cromatografia/spettrometria di massa, rivelano
concentrazioni insolitamente ridotte di chetoni ed elevati livelli
di acidi dicarbossilici a catena media (acido adipico, suberico e
sebacico), che derivano dalla omega ossidazione microsomale e
perossisomale degli acidi grassi. Le concentrazioni plasmatiche e
tissutali di carnitina totale sono ridotte del 25-50% rispetto al
normale, mentre è aumentata la frazione di carnitina esterificata.
Questo deficit di carnitina secondario si evidenzia in quasi tutti
i difetti di ossidazione degli acidi grassi e riflette la competizione
tra l’aumento dei livelli di acilcarnitina e il trasporto della carnitina libera verso la membrana plasmatica. Eccezioni significative
a questa regola sono rappresentate dai deficit del trasportatore
della carnitina attraverso la membrana plasmatica CPT-IA e della
-idrossi--metilglutaril CoA (HMG CoA) sintasi.
23-09-2008 11:52:03
590
■
PARTE X
■
Malattie metaboliche
TABELLA 86-1. Difetti dell’ossidazione degli acidi grassi: caratteristiche cliniche e biochimiche
DIFETTO ENZIMATICO
GENE
FENOTIPO CLINICO
Trasportatore della carnitina
OCTN2
Trasportatore degli acidi grassi a catena lunga
FATP1-6
Carnitina palmitoil trasferasi-I
CPT-I
Carnitina traslocasi
Carnitina palmitoil trasferasi-II
CACT
CPT-II
Acil CoA deidrogenasi a catena corta
SCAD
Acil CoA deidrogenasi a catena media
MCAD
Acil CoA deidrogenasi a catena molto lunga
VLCAD
ETF deidrogenasi*
ETF-DH
Flavoproteina di trasporto degli elettroni*
␣-ETF
Flavoproteina di trasporto degli elettroni*
-ETF
L-3-idrossiacil CoA deidrogenasi a catena corta
SCHAD
L-3-idrossiacil CoA deidrogenasi a catena lunga
LCHAD
Proteina mitocondriale trifunzionale
MTP
3-Chetoacil-CoA tiolasi a catena lunga
LKAT
2,4-Dienoil-CoA reduttasi
DECR1
HMG CoA sintetasi
HMGCS2
HMG CoA liasi
HMGCL
Cardiomiopatia, miopatia scheletrica, malattia epatica, morte improvvisa, fibroelastosi ↓ Carnitina totale e libera, acilcarnitine normali, acilglicine e acidi
endocardiaca. Screening prenatale e neonatale possibile
organici
Rara insufficienza epatica acuta dell’infanzia che richiede il trapianto di fegato
Riduzione intracellulare di acidi grassi C14, C18, riduzione
dell’ossidazione degli acidi grassi
Insufficienza epatica, miopatia scheletrica, tubulopatia renale, morte improvvisa
Carnitina normale o libera ↑, acilcarnitine, acilglicine e acidi organici
del lattante. Screening prenatale e neonatale possibile. La preeclampsia materna
normali
e l’associazione con la sindrome HELLP sono state descritte in alcuni casi
Insufficienza epatica progressiva cronica, persistente ↑ NH2, cardiomiopatia ipertrofica Carnitina normale o libera ↓, anomalo profilo dell’acilcarnitina
Esordio precoce o ritardato. Insufficienza epatica, encefalopatia, cardiomiopatia,
Carnitina normale o libera ↓, anomalo profilo dell’acilcarnitina
rene cistico. Screening neonatale possibile
Presentazione da benigna a grave, malattia encefalopatica, miopatia progressiva.
Carnitina normale o libera ↓, elevazione dell’acido etilmalonico
Screening neonatale possibile. La preeclampsia materna e l’associazione
nelle urine, profilo dell’acilcarnitina insolitamente elevato
con la sindrome HELLP sono state descritte in alcuni casi
Ipoglicemia, encefalopatia epatica, morte improvvisa. Screening neonatale possibile. Carnitina normale o libera ↓, acilglicina plasmatica ↑, acidi grassi
La preeclampsia materna e l’associazione con la sindrome HELLP sono state
C6-C10 liberi, acil carnitina C8-C10 ↑
descritte in rari casi
Cardiomiopatia dilatatoria, aritmia, ipoglicemia, steatosi epatica. Esordio tardivo,
Carnitina normale o libera ↓, acil carnitina plasmatica C14:1 C14 ↑,
rabdomiolisi indotta da stress, miopatia episodica. Diagnosi prenatale e neonatale
acidi grassi plasmatici liberi C10
possibile
Ipoglicemia non chetotica a digiuno, anomalie congenite, forme lievi di malattia
Carnitina normale o libera ↓, aumento del rapporto tra acil carnitina
epatica, cardiomiopatia, miopatia scheletrica
e carnitina libera, acil carnitina ↑, acidi organici e acilglicine
nelle urine
Ipoglicemia non chetotica a digiuno, anomalie congenite, malattia epatica,
Carnitina normale o libera ↓, aumento del rapporto tra acil carnitina
cardiomiopatia, miopatia scheletrica
e carnitina libera, acil carnitina ↑, acidi organici e acilglicine
nelle urine
Ipoglicemia a digiuno, anomalie congenite, malattia epatica, cardiomiopatia,
Carnitina normale o libera ↓, aumento del rapporto tra acil carnitina
miopatia scheletrica
e carnitina libera, acil carnitina ↑, acidi organici e acilglicine
nelle urine
Ipoglicemia, iperinsulinemia, cardiomiopatia, miopatia. Screening neonatale possibile Carnitina normale o libera ↓, elevazione degli acidi grassi, acilcarnitine
anomale nel plasma, acidi organici anomali nelle urine
Screening neonatale possibile. Preeclampsia materna, sindrome HELLP
Carnitina normale o libera ↓, aumento del rapporto tra acil carnitina
e associazione con AFLP descritte di frequente
e carnitina libera, acidi grassi liberi ↑, carnitine C16-OH e C18-OH
Grave miopatia cardiaca e scheletrica, ipoglicemia, acidosi, morte improvvisa
Carnitina normale o libera ↓, aumento del rapporto tra acil carnitina
per iper NH3, aumento degli enzimi epatici, retinopatia. Preeclampsia materna,
e carnitina libera, acidi grassi liberi ↑, carnitina C16-OH e C18-OH ↑
sindrome HELLP e associazione con AFLP descritte di frequente
Grave presentazione neonatale, ipoglicemia, acidosi, creatina chinasi ↑,
Carnitina normale o libera ↓, aumento del rapporto tra acil
cardiomiopatia, neuropatia, morte precoce. Esordio tardivo con miopatia.
carnitina e carnitina libera, acidi grassi liberi ↑, 2-trans, 4-cis
Preeclampsia materna, frequente associazione con sindrome HELLP
decadienoilcarnitina ↑
Soltanto un paziente descritto, ipotonia neonatale, grave miopatia scheletrica,
Carnitina normale o libera ↓, rapporto tra acil carnitina e carnitina
insufficienza respiratoria. Ipoglicemia rara
libera ↑, acidi organici e acilglicine normali
Ipochetosi e ipoglicemia, raramente miopatia
Acidi grassi elevati nel plasma, studi enzimatici su fibroblasti
diagnostici
Ipochetosi e ipoglicemia, raramente miopatia
Carnitina normale o libera ↑, carnitina C5-OH e metilglutaril carnitina
↑, studi enzimatici su fibroblasti diagnostici
REPERTI DI LABORATORIO
* Nota anche con il nome di acidemia glutarica di tipo II.
HELLP, emolisi, enzimi epatici elevati, piastrine ridotte.
Da Shekhawat PS, Matern D, Strauss AW: Fetal fatty oxidation disorders, their effect on maternal health and neonatal outcome: Impact os expanded newborn screening on their diagnosis and managment. Pediatr Res 2005;57:78R-84R.
I marker diagnostici includono l’aumento plasmatico delle specie di acilcarnitina C8:0, C10:0 e C10:1 e l’aumento dei livelli urinari
di acilglicine come essanoil-, suberil- e 3-fenilpropionil glicina. I
programmi di screening neonatale che utilizzano la spettrometria
di tandem massa riescono a diagnosticare i bambini presintomatici segnalando la presenza di acilcarnitine anomale su sangue
absorbito su carta bibula.
In molti casi, la diagnosi può essere confermata individuando la comune mutazione A985G. Un’altra mutazione frequente,
T199C, è stata documentata in neonati con particolari acilcarnitine, anche se stranamente questo allele non è stato mai riscontrato
in pazienti MCAD sintomatici, per cui è ipotizzabile che si tratti
di una mutazione lieve.
Trattamento. La malattia acuta deve essere trattata tempestivamente mediante l’iniezione endovenosa di una soluzione contenente il 10% di destrosio, allo scopo di prevenire l’ipoglicemia e
interrompere il più rapidamente possibile la lipolisi (vedi Capitolo 92). La terapia a lungo termine consiste nell’evitare di restare a
digiuno per un periodo superiore a 10-12 ore, adattando quindi
le proprie abitudini anche per la notte. La possibilità di ridurre
l’apporto di grassi e di assumere un’integrazione di carnitina è
controversa.
84-92ANA.indd 590
La necessità di un intervento terapeutico attivo in individui
con mutazione T199C resta da stabilire.
Prognosi. La mortalità dei pazienti che non hanno ricevuto una
diagnosi raggiunge il 25% nel corso del primo attacco acuto.
Dall’anamnesi risulta spesso il precedente decesso di un fratello
in seguito a MCAD non riconosciuto. Durante un attacco di
grave ipoglicemia, alcuni soggetti possono sviluppare una lesione
cerebrale permanente.
La prognosi in chi sopravvive senza sviluppare lesioni cerebrali
è eccellente, perché il deficit di MCAD non provoca debolezza
muscolare né miocardiopatia. La tolleranza al digiuno migliora
con l’età, mentre i rischi di malattia decrescono.
Circa il 50% dei pazienti colpiti non ha mai sperimentato un
episodio acuto, per cui è importante sottoporre a test gli eventuali fratelli dei soggetti colpiti, per evidenziare altri membri della
famiglia possibilmente asintomatici.
DEFICIT DELLA COA DEIDROGENASI A CATENA MOLTO LUNGA
(VLCAD). Il deficit di VLCAD (Very Long Chain Acyl Dehydrogenase) veniva definito semplicemente di LCAD prima della scoperta della VLCAD legata alla membrana mitocondriale inter-
23-09-2008 11:52:03
■
Capitolo 86
Difetti del metabolismo lipidico
■
591
Acido grasso a catena lunga (C16 palmitato)
Carnitina
Acido grasso a catena media
Membrana plasmatica
OCTN2
Trasportatore
?
Acil CoA libero a catena lunga carnitina
Citosol
CPT I
CICLO DELLA
CARNITINA
Catena respiratoria
LC acilcarnitina
TRANS
-OSSIDAZIONE A CATENA
BREVE E MEDIA
e
LC acilcarnitina
Enoil CoA ETF-DH
ETF
Idratasi
3-OH-ACD
SCHAD
Ciclo della TCA
VLCAD
LCAD
ETF
Tiolasi
Acetil CoA
ETF-DH
C14-C10 Acil
2,3 (C16-10)
CoA
Enoil CoA
3-Chetoacil CoA
Membrana
mitocondriale
interna
HMG-CoA sintasi
Leucina
HMG CoA
HMG CoA liasi
Acetoacetato
Membrana
mitocondriale
esterna
CPT II
LC acil CoA grasso
MCAD
SCAD
C8-4 Acil CoA
3-Idrossacil CoA
Carnitina
TFP
-OSSIDAZIONE
A CATENA LUNGA
-idrossibutirrato
SINTESI
DEI CHETONI
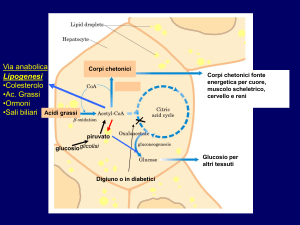
Figura 86-1. Ossidazione mitocondriale degli acidi grassi. La carnitina entra nella cellula grazie all’azione del trasportatore di carnitina/cationi organici (OCTN2).
Il palmitato, un tipico acido grasso a 16 atomi di carbonio, è trasportato attraverso la membrana plasmatica e può essere attivato per formare un acil coenzima
A (CoA) a catena lunga (LC). Entra poi nel ciclo della carnitina, dove viene transesterificato dalla carnitina plamitoiltrasferasi I (CPT-1), traslocato attraverso
la membrana mitocondriale interna dalla carnitina/acilcarnitina traslocasi (TRANS), e infine riconvertito in acil CoA grasso a catena lunga dalla carnitina
palmitotrasferasi II (CPT II), per essere sottoposto a -ossidazione. L’acil CoA deidrogenasi a catena molto lunga (VLCAD/LCAD) conduce alla produzione di
(C16-10) 2,3 enoil CoA. La proteina trifunzionale (TFP) contiene le attività di enoil CoA idratasi (idratasi), 3-OH-idrossiacil CoA deidrogenasi (3-0H-ACD) e
-chetotiolasi (tiolasi). Sono prodotte acetil CoA, FADH e NADH. Gli acidi grassi a catena media e breve (C8-4) possono entrare nella matrice mitocondriale
indipendentemente dal ciclo della carnitina. Sono richieste acil CoA deidrogenasi a catena media (MCAD), acil CoA deidrogenasi a catena corta (SCAD) e idrossi
acil CoA deidrogenasi a catena corta (SCHAD). L’acetil CoA può quindi entrare nel ciclo di Krebs (TCA). Gli elettroni sono trasportati da FADH alla catena respiratoria mediante la flavoproteina che trasferisce elettroni (ETF) e la flavoproteina che trasferisce elettroni deidrogenasi (ETF-DH). La NADH entra nella catena
di trasporto degli elettroni attraverso il complesso I. L’acetil CoA può essere convertita in idrossimetilglutaril (HMG) CoA mediante la -idrossi--metilglutaril
CoA sintasi (HMG CoA sintasi) e poi nel corpo chetonico acetoacetato mediante l’azione di -idrossi--metilglutaril CoA liasi (HMG CoA liasi).
na. Tutti i pazienti in precedenza diagnosticati come affetti da
carenza di LCAD hanno quindi un deficit dell’enzima VLCAD.
L’esistenza di pazienti con deficit isolato di LCAD non è mai
stata documentata e il ruolo della LCAD nell’ossidazione degli
acidi grassi resta da chiarire. I pazienti con carenza di VLCAD
risultano solitamente più gravi di quelli con deficit di MCAD,
tendono a divenire sintomatici più precocemente e manifestano
maggiori problemi cronici (debolezza muscolare o episodi di dolore muscolare e rabdomiolisi). Durante gli attacchi acuti associati al digiuno può essere presente la miocardiopatia. Talvolta il
ventricolo sinistro appare ipertrofico o dilatato e mostra scarsa
contrattilità all’ecocardiografia. Si sono verificati numerosi casi
di morte improvvisa durante un attacco acuto, ma i pazienti che
sopravvivono all’episodio vanno incontro a un miglioramento
(inclusa la normalizzazione della funzione cardiaca). Gli altri
risultati degli esami obiettivo e di laboratorio sono simili a quelli
riscontrati nel deficit di MCAD, inclusa la carenza secondaria di
carnitina. Il profilo urinario degli acidi grassi mostra aciduria
dicarbossilica nonchetotica e nelle urine può anche essere notato
84-92ANA.indd 591
un aumento dei livelli degli acidi dicarbossilici C6-12. La diagnosi
è talvolta suggerita da un anomalo profilo dell’acilcarnitina, con
presenza nel plasma o nel sangue adbsorbito su carta bibula di
acilcarnitina C14:1, 14:0, ma la diagnosi specifica richiede l’esame
dell’attività enzimatica della VLCAD su colture di fibroblasti
oppure l’analisi mutazionale diretta del gene per VLCAD. Il
trattamento si basa in primo luogo sull’evitare il digiuno per
periodi superiori a 10-12 ore, quindi in alcuni pazienti risulta
utile l’alimentazione intragastrica continua.
DEFICIT DELL’ACIL COA DEIDROGENASI A CATENA BREVE (SCAD).
È stato segnalato un numero ristretto di soggetti, con fenotipo
variabile, che presenta due chiare mutazioni nulle del gene per la
SCAD (Short-Chain Acyl Dehydrogenase). Nella maggior parte
dei pazienti con diagnosi di deficit della SCAD si riscontrano
polimorfismi del DNA del gene per la SCAD e una elevata
attività residua. I due polimorfismi più comuni sono G185S e
R147W, che sono ritenuti attualmente cambiamenti della suscettibilità che richiedono una seconda mutazione genetica, ancora
23-09-2008 11:52:03
592
■
PARTE X
■
Malattie metaboliche
Palmitato
C15 CO CoA
CPT-1
C15 CO carnitina
Membrana mitocondriale
interna
TRANS
Ciclo della
carnitina
C15 CO carnitina
CPT-2
Trasporto
di elettroni
C15 CO CoA
Catena ETF-DH ETF FAD
di trasporto
FADH2
degli elettroni
R CH2 CH
ACD
CH
CO CoA
Idratasi
R
CH2
CHOH CH
NAD
NADH
R
CH2
3
CHO
Acetil CoA
CO CoA
Ciclo di
-ossidazione
OH ACD
CH2
CO CoA
Tiolasi
C13
CO CoA
Acetil CoA
C11
CO CoA
Acetil CoA
C9
CO CoA
Acetil CoA
C7
CO CoA
Acetil CoA
C5
CO CoA
Acetil CoA
C3
CO CoA
Acetil CoA
Acetil CoA
HMG CoA sintasi
Leucina
bolica. I segni neurologici sono spesso presenti, ma gli individui
con la forma lieve della malattia possono essere asintomatici. La
diagnosi è suggerita dall’elevazione del livello di butirilcarnitina
su sangue adsorbito su carta bibula o plasma e dall’aumento
dell’escrezione nelle urine di acido etilmalonico e butirilglicina.
Tali anomalie metaboliche sono particolarmente pronunciate in
pazienti con mutazioni nulle, ma sono presenti anche in soggetti
omozigoti per il polimorfismo. La conferma della diagnosi richiede l’analisi della mutazione. Alcune delle caratteristiche cliniche
suggeriscono una sindrome tossica, dovuta forse all’accumulo
di metaboliti degli acidi grassi a catena corta. In un paziente è
stata segnalata una chetogenesi normale, ciò che implica l’assenza del coinvolgimento dell’ossidazione degli acidi grassi a
catena lunga.
Il trattamento consiste nell’evitare il digiuno e ridurre l’apporto
dietetico di grassi.
Idrossimetilglutaril CoA
Sintesi
dei chetoni
HMG CoA liasi
Acetoacetato
DEFICIT DI 3-IDROSSIACIL COA DEIDROGENASI (LCHAD) A CATENA
LUNGA/PROTEINA TRIFUNZIONALE MITOCONDRIALE (TFP). Il deficit
di LCHAD (Long-Chain 3-Hydroxyacyl Dehydrogenase) costituisce la seconda più comune forma di difetto dell’ossidazione degli
acidi grassi. L’enzima LCHAD è parte della proteina trifunzionale
mitocondriale (TFP, TriFunctional Protein), che contiene anche
enoil CoA idratasi a catena lunga e -chetotiolasi a catena lunga. Si tratta di una proteina etero-octamerica composta dalle
catene 4 e 4, che derivano da geni contigui distinti, con una
regione promoter comune. In alcuni pazienti è colpita soltanto
l’attività LCHAD della TFP (deficit di LCHAD), mentre altri
presentano carenze in tutte e tre le attività (deficit di TFP). Le
manifestazioni cliniche includono attacchi acuti di ipoglicemia
ipochetotica, simili a quelli riscontrati nel deficit di MCAD. I
pazienti mostrano spesso sintomi gravi, come miocardiopatia,
crampi e debolezza muscolare e anomalie della funzione epatica
(colestasi). L’effetto tossico dei metaboliti degli acidi grassi può
produrre retinopatia pigmentosa, insufficienza epatica progressiva, neuropatia periferica e rabdomiolisi. In madri eterozigoti con
un feto omozigote colpito da deficit di LCHAD/TFP sono state
segnalate complicanze ostetriche potenzialmente mortali: fegato
grasso acuto della gravidanza, emolisi, aumento degli enzimi
epatici e sindrome da riduzione delle piastrine (HELLP). La morte
improvvisa del lattante è un’evenienza frequente. La diagnosi è
suggerita dagli elevati livelli plasmatici o su sangue adsorbito su
carta bibula di 3-idrossi acilcarnitina a catena lunga C16-C18. Il
profilo urinario degli acidi organici può rivelare un incremento
dei livelli degli acidi 3-idrossidicarbossilici a catena lunga C6-C14.
Il deficit secondario di carnitina è comune. In circa il 60% dei
pazienti con deficit di LCHAD si riscontra una mutazione che
coinvolge la sottounità , E474Q, la quale, se presente nel feto, è
significativamente associata a complicanze ostetriche, sebbene sia
probabile che altre mutazioni in entrambe le sottounità abbiano
un ruolo nella malattia materna.
Il trattamento è simile a quello per deficit di MCAD o LCAD/
VLCAD e prevede essenzialmente di evitare il digiuno. Alcuni
ricercatori hanno suggerito l’utilità di integrare la dieta con olio
contenente trigliceridi a catena media e acido docosaesaenoico. Il
trapianto di fegato non migliora le anomalie metaboliche.
-idrossibutirrato
Figura 86-2. Via dell’ossidazione mitocondriale del palmitato, un tipico acido
grasso a catena lunga (16 atomi di carbonio). Gli enzimi dei diversi passaggi
includono carnitina palmitoiltrasferasi (CPT) 1 e 2, carnitina/acilcarnitina
traslocasi (TRANS), flavoproteina che trasferisce elettroni (ETF), ETF deidrogenasi (ETF-DH), acil CoA deidrogenasi (ACD), enoil CoA idratasi (idratasi), 3-idrossi-acil CoA deidrogenasi (3-OH-ACD), -chetotiolasi (tiolasi),
-idrossi-B-metilglutaril CoA (HGM CoA) sintasi e liasi.
sconosciuta, per esprimere un fenotipo clinico. Questi pazienti
non presentano ipoglicemia ipochetotica. La miopatia scheletrica
sembra predominante, ma non è stato ancora identificato un
fenotipo clinico coerente. Alcuni presentano grave acidosi meta-
84-92ANA.indd 592
DEFICIT DI 3-IDROSSIACIL-COA DEIDROGENASI A CATENA CORTA
(SCHAD). Sono stati descritti pochissimi pazienti con questo errore
congenito e soltanto in cinque casi è stato possibile documentare
la presenza di mutazioni della SCHAD (Short-Chain 3-Hydroxyacyl Dehydrogenase). In quattro pazienti provenienti da tre
famiglie con mutazioni recessive della SCHAD, la malattia si era
presentata con episodi di ipoglicemia ipochetotica dovuti a iperinsulinismo. A differenza dei pazienti con altre forme di difetti di
ossidazione degli acidi grassi, questi casi richiedono una specifica
terapia per l’iperinsulinemia, per evitare ipoglicemia ricorrente.
Nel quinto caso, un bambino eterozigote composto per due differenti mutazioni SCHAD, la malattia si era presentata all’età
di 10 anni con una insufficienza epatica fulminante. Altri casi
documentati includono: un bambino con attacchi di ipoglicemia
23-09-2008 11:52:03
Capitolo 86
a digiuno e mioglobinuria associata a deficit della SCHAD nei
muscoli ma non in colture di fibroblasti; tre bambini con malattia
epatica fatale e un lattante deceduto improvvisamente. Questo
fenotipo variabile può essere dovuto a eterogeneità genetica. Finora non sono stati individuati specifici marker metabolici del
deficit di SCHAD, perciò la diagnosi è particolarmente difficile
da stabilire.
DIFETTI DEL CICLO DELLA CARNITINA
DIFETTO DEL TRASPORTO DELLA CARNITINA ATTRAVERSO LA MEMBRANA PLASMATICA (DEFICIT DI CARNITINA PRIMITIVO). Il deficit
di carnitina primitivo è il solo difetto genetico in cui la carenza di
carnitina è la causa, piuttosto che la conseguenza, della compromissione dell’ossidazione degli acidi grassi. Nella maggior parte
dei casi la malattia si presenta a 1-4 anni di età, con miocardiopatia progressiva associata o meno a debolezza muscolare scheletrica. In una percentuale inferiore di pazienti, la presentazione è con
ipoglicemia ipochetotica a digiuno nel primo anno di vita, prima
che la miocardiopatia divenga sintomatica. Il difetto responsabile
coinvolge il trasportatore della carnitina attraverso la membrana
plasmatica che sfrutta il gradiente del sodio, presente nel cuore,
nei muscoli e nei reni. Questo trasportatore è responsabile del
riassorbimento renale della carnitina e del mantenimento della
sua concentrazione intracellulare, da 20 a 50 volte superiore alla
concentrazione plasmatica.
La diagnosi di difetto del trasporto della carnitina è facilitata
dalla presenza nel plasma e nei muscoli dei pazienti di livelli
estremamente ridotti di carnitina (1-2% del normale). I genitori
eterozigoti presentano livelli palsmatici di carnitina pari al 50%
del normale. La chetogenesi a digiuno può risultare normale,
perché il trasporto della carnitina nel fegato è regolare, ma può
essere alterata dall’interruzione dell’assunzione di carnitina nella dieta. Il profilo urinario degli acidi grassi può rivelare dicarbossilicaciduria ipochetotica in presenza di compromissione
dell’ossidazione degli acidi grassi epatici, ma è normale in tutti
gli altri casi. Il difetto del trasporto della carnitina può essere
dimostrato clinicamente dalla grave riduzione della soglia renale
della carnitina, oppure in vitro dalla misura dell’uptake della
carnitina su fibroblasti o linfoblasti in coltura. Le mutazioni del
trasportatore di carnitina/cationi organici (OCTN2) sono alla
base del disturbo. Il trattamento con dosi farmacologiche di
carnitina orale (100-200 mg/kg/die) è estremamente efficace nel
correggere la miocardiopatia e la debolezza muscolare, nonché
eventuali disturbi della chetogenesi a digiuno. Durante il trattamento, la concentrazione totale di carnitina nei muscoli resta
5% rispetto al normale.
DEFICIT DI CARNITINA PALMITOILTRASFERASI-IA (CPT-IA). Il deficit
epatico e renale dell’isozima CPT-IA è stato documentato in
dozzine di bambini. Le manifestazioni cliniche includono ipoglicemia ipochetotica a digiuno con occasionale anomalo aumento
della funzione epatica e, più raramente, acidosi tubulare renale. Cuore e muscolatura scheletrica non sono coinvolti, perché
l’isozima dei muscoli non è colpito. Il profilo urinario degli
acidi grassi a digiuno rivela dicarbossilicaciduria C6-C12 ipochetotica. L’analisi dell’acilcarnitina plasmatica segnala prevalentemente carnitina libera e una ridotta percentuale di carnitina
acilata. Questa osservazione ha consentito la formulazione della
diagnosi di CPT-IA, in seguito a screening neonatale mediante
spettrometria di tandem massa. Il deficit di CPT-IA è l’unico
difetto dell’ossidazione degli acidi grassi in cui il livello totale di
carnitina risulta aumentato fino al 150-200% oltre il normale.
Questo reperto può essere spiegato dall’assenza degli effetti inibitori delle acilcarnitine a catena lunga sul trasportatore della
carnitina nei tubuli renali. La presenza del deficit enzimatico
può essere dimostrata su colture di fibroblasti o linfoblasti. In
un caso documentato, il deficit di CPT-IA nel feto è stato collegato a steatosi epatica acuta della gravidanza nella madre. Il
trattamento è analogo a quello per il deficit di MCAD e prevede
84-92ANA.indd 593
■
Difetti del metabolismo lipidico
■
593
essenzialmente di evitare le situazioni che rendono necessaria la
chetogenesi durante il digiuno.
DEFICIT DI CARNITINA-ACILCARNITINA TRASLOCASI (CACT). Questo difetto della proteina di trasporto attraverso la membrana
mitocondriale interna delle acilcarnitine blocca l’entrata degli
acidi grassi a catena lunga nei mitocondri per l’ossidazione. Il
fenotipo clinico di questo disturbo determina una compromissione grave e generalizzata dell’ossidazione degli acidi grassi. Nella
maggior parte dei neonati la malattia si presenta con attacchi di
ipoglicemia indotti dal digiuno, iperammoniemia e collasso cardiorespiratorio. Tutti i neonati sintomatici mostrano miocardiopatia e debolezza muscolare. Sono stati identificati anche diversi
pazienti con deficit parziale di traslocasi, che sviluppano una
forma più lieve della malattia, senza coinvolgimento cardiaco.
Non è stata evidenziata la presenza di specifici acidi organici
nel plasma o nelle urine, ma si segnala un aumento dei livelli
plasmatici di acilcarnitine a catena lunga. La diagnosi può essere
stabilita su fibroblasti o linfoblasti in coltura. Il gene umano è
stato clonato e nei pazienti colpiti sono state individuate mutazioni. Il trattamento è simile a quello raccomandato per gli altri
difetti dell’ossidazione degli acidi grassi.
DEFICIT DI CARNITINA PALMITOILTRASFERASI-II (CPT-II). Sono state
descritte tre forme di deficit di CPT-II. La presentazione prenatale
di questo disturbo è associata a grave deficit enzimatico e la mortalità neonatale è elevata in presenza di reni displasici, malformazioni cerebrali e lievi anomalie faciali. Anche la forma a esordio
infantile si associa a un grave deficit dell’attività enzimatica e
presenta le stesse caratteristiche cliniche e di laboratorio del deficit di CACT. Una forma più lieve si può manifestare invece in età
adulta, con rabdomiolisi episodica. Il primo episodio solitamente
non si verifica prima della tarda infanzia o dell’adolescenza.
Gli attacchi possono essere scatenati dall’esercizio prolungato.
È presente dolore muscolare e la mioglobinuria può essere talmente grave da causare insufficienza renale. I livelli sierici di
creatinina chinasi risultano aumentati fino a 5000-100 000 U/L.
L’ipoglicemia a digiuno non è stata segnalata, ma il digiuno può
contribuire agli attacchi di mioglobinuria. La biopsia muscolare
mostra un aumento della deposizione di grassi neutri. La presentazione miopatica del deficit della CPT-II è associata alla comune
mutazione S113L. Una forma intermedia di CPT-II si può avere
nella prima infanzia con insufficienza epatica indotta dal digiuno,
miocardiopatia e miopatia scheletrica con ipoglicemia ipochetotica, ma questa forma non causa le gravi alterazioni dello sviluppo
della forma a esordio neonatale. Questo quadro clinico è simile
a quello riscontrato in caso di deficit della VLCAD e prevede un
trattamento identico. I pazienti sono solitamente eterozigoti per
una delle mutazioni gravi e per una di quelle lievi.
La diagnosi di tutte le forme di deficit di CTP-II può essere formulata dimostrando il deficit dell’attività enzimatica nei muscoli
o in altri tessuti oppure su colture di fibroblasti. È disponibile
l’analisi della mutazione.
DIFETTI DELLA VIA DI TRASPORTO
DEGLI ELETTRONI
DEFICIT DELLA FLAVOPROTEINA DI TRASFERIMENTO DEGLI ELETTRONI (ETF) E DELLA FLAVOPROTEINA DEIDROGENASI DI TRASFERIMENTO DEGLI ELETTRONI (EFT-DH) (ACIDURIA GLUTARICA DI TIPO
2, DEFICIT MULTIPLO DELLA ACIL COA DEIDROGENAZIONE). L’ETF
(Electron Transfer Flavoprotein) e l’ETF-DH funzionano trasferendo elettroni nella catena di trasporto mitocondriale degli
elettroni da reazioni di deidrogenazione catalizzate da VLCAD,
MCAD e SCAD, oltre che dalla glutaril CoA deidrogenasi e
almeno quattro enzimi coinvolti nell’ossidazione di amminoacidi
a catena ramificata. I deficit di ETF e ETF-DH determinano un
quadro patologico che combina le caratteristiche della compromissione dell’ossidazione degli acidi grassi e quelle dell’ossidazione di diversi altri amminoacidi. Il deficit completo di una delle
23-09-2008 11:52:03
594
■
PARTE X
■
Malattie metaboliche
due proteine è associato a grave malattia nel periodo neonatale,
caratterizzata da acidosi, ipoglicemia, coma, ipotonia, miocardiopatia e un insolito odore di piedi sudati dovuto all’inibizione
dell’isovaleril CoA deidrogenasi. Alcuni neonati colpiti presentano dismorfia facciale e reni policistici simili a quelli osservati nelle
forme gravi di deficit di CPT-II; ciò suggerisce che gli effetti tossici
dei metaboliti accumulati si verifichino già in utero.
La diagnosi può essere formulata sulla base del profilo degli
acidi organici urinari, che mostra anomalie corrispondenti al
blocco dell’ossidazione degli acidi grassi (etilmalonato e acidi dicarbossilici C6-C10), della lisina (glutarato) e degli amminoacidi a
catena ramificata (isovaleril-, isobutiril- e -metilbutiril-glicina).
La maggior parte dei bambini colpiti gravemente non sopravvive
al periodo neonatale.
Il deficit parziale di ETF e ETF-DH causa un disturbo che
mima le caratteristiche del deficit MCAD o di altri difetti più
lievi dell’ossidazione degli acidi grassi. Questi pazienti presentano attacchi di coma ipochetotico da digiuno. Il profilo urinario degli acidi organici rivela un’elevazione primaria degli acidi
dicarbossilici e dell’etilmalonato, derivati dagli intermedi degli
acidi grassi a catena breve. È presente un deficit secondario
della carnitina. Alcuni pazienti con le forme lievi di deficit di
ETF/ETF-DH traggono giovamento dal trattamento con dosi
elevate di riboflavina, cofattore della via per il trasferimento
degli elettroni.
DIFETTI DELLA VIA DELLA SINTESI CHETONICA
DEFICIT DI -IDROSSI--METILGLUTARIL COA (HMG COA) SINTASI.
La HMG CoA sintasi costituisce la tappa che limita la conversione di acetil CoA derivato dalla -ossidazione (nel fegato) degli
acidi grassi in chetoni. Diversi pazienti con questo difetto sono
stati identificati di recente. La malattia si presenta con ipoglicemia
ipochetotica a digiuno, in assenza di segni di compromissione
cardiaca o della muscolatura scheletrica. Il profilo urinario degli
acidi organici mostra solo una lieve aciduria ipochetotica dicarbossilica. A differenza di tutti gli altri difetti dell’ossidazione degli
acidi grassi, i livelli plasmatici e tissutali di carnitina sono normali. Una differente sintasi, presente nel citosol per la biosintesi del
colesterolo, non risulta colpita. Il difetto dell’HMG CoA sintasi è
espresso solo nel fegato e non può essere dimostrato su colture di
fibroblasti. Il gene è stato clonato ed è stato possibile descrivere
le mutazioni dei pazienti affetti. Evitare il digiuno costituisce di
solito un trattamento efficace.
DEFICIT DI -IDROSSI--METILGLUTARIL COA LIASI. Vedi Capitolo
85.6.
DIFETTI DELL’UTILIZZO DEI CHETONI
I chetoni -idrossibutirato e acetoacetato sono i prodotti terminali dell’ossidazione degli acidi grassi epatici e costituiscono
un’importante fonte di substrati metabolici per il cervello durante
i periodi di digiuno.
Due difetti dell’utilizzo dei chetoni nel cervello e in altri tessuti
periferici si presentano con episodi di coma “iperchetotico”, con
o senza ipoglicemia.
DEFICIT DI SUCCINIL-COA:3-CHETOACIDO COA TRASFERASI (SCOT).
Sono stati segnalati diversi pazienti con deficit di SCOT. La
presentazione caratteristica avviene nel lattante, con ricorrenti
episodi di grave chetoacidosi indotta dal digiuno. Tuttavia, le
anomalie dell’acilcarnitina plasmatica e degli acidi organici
nelle urine non consentono di distinguere questa patologia dalle
altre cause di chetoacidosi. Il trattamento degli episodi richiede
l’infusione di glucosio e di grandi quantità di metaboliti, fino
alla stabilizzazione metabolica. Tutti i pazienti manifestano
un’anomala iperchetonemia, anche tra episodi catabolici. La
SCOT è responsabile dell’attivazione dell’acetoacetato nei tes-
84-92ANA.indd 594
suti periferici, poiché utilizza il succinil CoA come donatore
per formare acetoacetil CoA. Il deficit di attività può essere
dimostrato nel cervello, nei muscoli e nei fibroblasti dei pazienti
colpiti. Il gene è stato clonato e sono state descritte diverse
mutazioni.
DEFICIT DELLA -CHETOTIOLASI. Vedi Capitolo 85.6.
Andresen BS, Dobrowolski SF, O’Reilly L, et al: Medium-chain acyl-CoA
dehydrogenase (MCAD) mutations identified by MS/MS-based prospective screening of newborns differ from those observed in patients with
clinical symptoms: Identification and characterization of a new, prevalent mutation that results in mild MCAD deficiency. Am J Hum Genet
2001;68:1408–1418.
Bonnefont JP, Djouadi F, Prip-Buus C, et al: Carnitine palmitoyltransferases
1 and 2: Biochemical, molecular and medical aspects. Mol Aspects Med
2004;25:495–520.
Clayton PT, Eaton S, Aynsley-Green A, et al: Hyperinsulinism in short-chain
L-3-hydroxyacyl-CoA dehydrogenase deficiency reveals the importance of
beta-oxidation in insulin secretion. J Clin Invest 2001;108:457–465.
Den Boer MEJ, Dionisi-Vici C, Chakrapani A, et al: Mitochondrial trifunctional protein deficiency: A severe fatty acid oxidation disorder with cardiac
and neurologic involvement. J Pediatr 2003;142:s684–s688.
Den Boer MEJ, Wanders RJA, Morris AAM, et al: Long-chain 3-hydroxyacylCoA dehydrogenase deficiency: Clinical presentation and follow-up of 50
patients. Pediatrics 2002;109:99–104.
Elpeleg ON, Hammerman C, Saada A, et al: Antenatal presentation of carnitine palmitoyltransferase II deficiency. Am J Med Genet 2001;102:183–187.
Fukao T, Mitchell GA, Song XQ, et al: Succinyl-CoA:3-ketoacid CoA transferase (SCOT): Cloning of the human SCOT gene, tertiary structural modeling
of the human SCOT monomer, and characterization of three pathogenic
mutations. Genomics 2000;68:144–151.
Gregersen N, Andresen BS, Corydon MJ, et al: Mutation analysis in mitochondrial fatty acid oxidation defects: Exemplified by acyl-CoA dehydrogenase
deficiencies, with special focus on genotype-phenotype relationship. Hum
Mutat 2001;18:169–189.
Klose DA, Kolker S, Heinrich B, et al: Incidence and short-term outcome of
children with symptomatic presentation of organic acid and fatty acid oxidation disorders in Germany. Pediatrics 2002;110:1204–1210.
Mathur A, Sims HF, Gopalakrishnan D, et al: Molecular heterogeneity in
very-long-chain acyl-CoA dehydrogenase deficiency causing pediatric cardiomyopathy and sudden death. Circulation 1999;99:1337–1343.
Shekhawat PS, Matern D, Strauss AW: Fetal fatty acid oxidation disorders,
their effect on maternal health and neonatal outcome: Impact of expanded newborn screening on their diagnosis and management. Pediatr Res
2005;57:78R–86R.
Stanley CA, Bennett MJ, Mayatepek E: Disorders of mitochondrial fatty
acid oxidation and related metabolic pathways. In: Fernandes J, Saudubray J-M, Van den Bergh G, Walter JH (eds). Inborn Metabolic Diseases:
Diagnosis and Treatment 4th edition: Heidelberg: Springer-Verlag, 2006
pp. 175–188.
Wilcken B, Haas M, Joy P, et al: Outcome of neonatal screening for mediumchain acyl-CoA dehydrogenase deficiency in Australia: a cohort study. Lancet 2007;369:37–42.
Yang Z, Yamada J, Zhao Y, et al: Prospective screening for pediatric mitochondrial protein defects in pregnancies complicated by liver disease. JAMA
2002;288:2163–2166.
86.2 • DIFETTI DEGLI ACIDI GRASSI A CATENA MOLTO
LUNGA • Hugo W. Moser
DIFETTI PEROSSISOMALI
Questi difetti geneticamente determinati sono causati o dall’impossibilità di formare oppure di mantenere il perossisoma o dal
deficit della funzione di un singolo enzima normalmente localizzato in questo organello. Tali disturbi gravemente invalidanti
sono molto più frequenti di quanto si ritenesse in passato e
presentano un’ampia gamma di fenotipi.
23-09-2008 11:52:03
Capitolo 86
EZIOLOGIA. I difetti perossisomali sono suddivisi in due categorie
principali (Tab. 86-2).
La categoria A include i difetti della biogenesi perossisomale
(PBD, Peroxisomal Biogenesis Disorders), il cui difetto di base
consiste nell’impossibilità di importare una o più proteine in questo organello. Nella categoria B, il difetto coinvolge una singola
proteina perossisomale. Il perossisoma è un organello subcellulare
circondato da una membrana singola, presente in tutte le cellule
fatta eccezione per gli eritroci maturi; sono stati identificati oltre
50 enzimi perossisomali diversi. Alcuni di questi sono coinvolti
nella produzione e decomposizione di perossido di idrogeno, altri
partecipano al metabolismo di lipidi e amminoacidi. La maggior
parte degli enzimi perossisomali è sintetizzata nella sua forma matura su poliribosomi liberi e poi entra nel citoplasma. Le proteine
destinate al perossisoma contengono specifiche sequenze segnale
(PTS, Peroxisome Targeting Sequences). Nella maggior parte dei
casi, le proteine della matrice perossisomale contengono PTS1,
una sequenza di 3 amminoacidi nel terminale carbossilico. PTS2
è invece una sequenza amminica terminale fondamentale per l’importazione di enzimi coinvolti nel metabolismo del plasmalogeno
e degli acidi grassi a catena ramificata. L’importazione di proteine
prevede una complessa serie di reazioni, che coinvolgono almeno
23 proteine differenti, definite perossine, codificate dai geni PEX.
Nella Tabella 86-3 sono riassunti i geni PEX deficitari negli stati
patologici.
■
■
Difetti del metabolismo lipidico
595
TABELLA 86-2. Classificazione dei difetti perossisomali
A: DIFETTI DELL’IMPORTAZIONE DI PEROSSISOMI
A1: Sindrome di Zellweger
A2: Adrenoleucodistrofia neonatale
A3: Malattia infantile di Refsum
A4: Condrodisplasia puntata rizomelica
B: DEFICIT DI UN SINGOLO ENZIMA PEROSSISOMALE
B1: Adrenoleucodistrofia legata all’X
B2: Deficit di acil CoA ossidasi
B3: Deficit dell’enzima bifunzionale
B4: Deficit di tiolasi perossisomale
B5: Malattia di Refsum classica
B6: Deficit di 2-metilacil CoA racemasi
B7: Deficit di DHAP aciltransferasi
B8: Deficit di alchil-DHAP sintasi
B9: Aciduria mevalonica
B10: Aciduria glutarica di tipo III
B11: Iperossaluria di tipo I
B12: Acatalasemia
puntata, opacamento corneale, cataratta congenita e retinopatia,
malattia cardiaca congenita e caratteristiche dismorfiche.
PATOGENESI. È probabile che tutti i cambiamenti patologici siano secondari al difetto perossisomale. Nei PBD, diversi enzimi
perossisomali smettono di funzionare (Tab. 86-4) e quelli assenti
o presenti in numero ridotto, anche se sono sintetizzati normalmente, vengono tuttavia degradati più velocemente, perché non
protetti al di fuori del perossisoma. Non è chiaro in che modo le
funzioni perossisomali deficitarie determinino la vasta gamma di
manifestazioni patologiche.
I PBD, suddivisi in 12 gruppi di complementazione, sono associati a difetti di importazione geneticamente determinati. I difetti molecolari sono stati definiti in 10 di questi gruppi (vedi
Tab. 86-3). Le caratteristiche e la gravità del quadro patologico
variano sulla base della natura del difetto di importazione e del
grado di compromissione di questa funzione. Tali difetti genetici
causano patologie alle quali è stato attribuito un nome prima
EPIDEMIOLOGIA. Fatta eccezione per le adrenoleucodistrofie legate
all’X (X-ALD), tutti i difetti perossisomali elencati in Tabella
86-2 si trasmettono con modalità autosomica recessiva. X-ALD
è il disturbo più comune, con un’incidenza stimata a 1/17 000.
L’incidenza combinata degli altri disturbi perossisomali è di circa
1/50 000.
ANATOMIA PATOLOGICA. L’assenza o la riduzione del numero di
perossisomi è patognomonica per il difetto della biogenesi. Nella
maggior parte dei disturbi si evidenzia la presenza dei cosiddetti “perossisomi fantasma”, sacche contenenti proteine integre di
membrana perossisomale prive del normale complemento di proteine di matrice. I cambiamenti patologici, osservati in diversi organi, includono marcati e caratteristici difetti della migrazione neuronale, cirrosi micronodulare epatica, cisti renali, condrodisplasia
TABELLA 86-3. Fattori della biogenesi perossisomale (PEX) e loro alterazioni nei disturbi della biogenesi perossisomale (PBD)
GRUPPO DI COMPLEMENTAZIONE
PEROSSINA
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
26
CARATTERISTICHE
AAA ATPasi 143-kd
C3HC4 proteina integrale di membrana perossisomale legata
allo zinco 35-52 kd
Proteina integrale di membrana perossisomale 51-52 kd
Enzima associato al perossisoma coniugato all’ubiquitina 21-24 kd
Recettore PTS 1
AAA ATPasi 12-127 kd
Recettore PTS 2
Proteina associata al perossisoma 71-81 kd
Proteina integrale di membrana perosossimale 42 kd
C3HC4 proteina integrale di membrana perossisomale legata allo zinco
Proteina di membrana perossisomale coinvolta nella proliferazione
perossisomale 27-32 kd
C3HC4 proteina integrale di membrana perossisomale legata allo zinco 48 kd
SH-3 contenente proteina integrale di membrana perossisomale 40-43 kd
Proteina integrale di membrana perossisomale 41 kd
Proteina citosolica 48 kd
Proteina di membrana perossisomale periferica 39 kd
Proteina intrinseca di membrana perossisomale? 27-30 kd
Proteina di membrana perossisomale a dita di zinco 35-39 kd
Proteina di membrana perossisomale prenilata
KKI
1
10
GIAPPONE AMS
E
2
F
5
2
4
11
C
7
NUMERO DEI PAZIENTI STUDIATI NEL KKI
KKI
99
2
FENOTIPO
ZS, NALD, IRD
ZS
CROMOSOMA
7q21-22
2
16
43
ZS, NALD
ZS, NALD
RCDP
12p13.3
6p21.1
6q22-24
B
5
ZS, NALD
8q21.1
H
6
2
ZS, NALD, IRD
ZS, NALD
9
D
1
ZS
8
J
A
G
7
ZS
ZS, NALD, IRD
ZS
3
4
3
1
Siti di aggancio per i fattori Pex1p e Pex6p
AMS, Amsterdam; KKI, Kennedy Krieger Institute.
Da Moser HW: Genotype-phenotype correlations in disorders of peroxisome biogenesis. Mol Genet Metalab 1999;68:316.
84-92ANA.indd 595
23-09-2008 11:52:04
596
■
PARTE X
■
Malattie metaboliche
TABELLA 86-4. Reperti di laboratorio anomali che accomunano i difetti
della biogenesi perossisomale
Perossisomi assenti o in numero ridotto
Catalisi nel citosol
Sintesi deficitaria e ridotti livelli tissutali di plasmalogeni
Ossidazione deficitaria e accumulo anomalo di acidi grassi a catena molto lunga
Ossidazione deficitaria e accumulo di acido fitanico dipendente dall’età
Difetti in alcuni passaggi della formazione degli acidi biliari e accumulo dei prodotti intermedi
Difetti dell’ossidazione e dell’accumulo di acido L-pipecolico
Aumento dell’escrezione urinaria di acido dicarbossilico
di riconoscerne il collegamento con il perossisoma: la sindrome
di Zellweger (ZS, Zellweger Syndrome), l’adrenoleucodistrofia
neonatale (NALD, Neonatal AdrenoLeukoDystrophy), la malattia di Refsum infantile (IRD, Infantile Refsum Disease) e la
condrodisplasia puntata rizomelica (RCDP, Rhizomelic ChondroDysplasia Punctata). Si ritiene attualmente che i primi tre
disturbi si collochino lungo un continuum clinico: la ZS è la più
grave, la NALD quella intermedia e la IRD la meno grave. Queste
malattie sono causate da 11 differenti difetti genetici, che colpiscono principalmente l’importazione di proteine che contengono
la sequenza segnale PTS1; non è possibile individuare il difetto
genetico sulla base delle caratteristiche cliniche. La gravità clinica
varia a seconda del grado di compromissione dell’importazione delle proteine. Le mutazioni che aboliscono completamente
l’importazione sono spesso associate al fenotipo ZS, mentre una
mutazione missense, che implica la conservazione parziale della
funzione, determina un fenotipo più lieve. Un difetto di PEX7
che provoca l’importazione delle proteine che utilizzano PTS2 è
associato a RCDP, mentre difetti di PEX7 che risparmiano parzialmente l’importazione sono collegati a fenotipi più lievi, alcuni
dei quali somigliano alla malattia di Refsum classica.
I disturbi genetici che coinvolgono singoli enzimi perossisomali
hanno solitamente manifestazioni cliniche più ristrette e si presentano successivamente al periodo neonatale, spesso nell’adolescenza o in età adulta. Le manifestazioni cliniche possono essere
collegate al difetto biochimico. L’insufficienza surrenale primaria
di X-ALD è causata dall’accumulo di acidi grassi a catena molto
lunga (VLCFA) nella corteccia surrenale e la neuropatia periferica
nella malattia di Refsum è determinata dall’accumulo di acido
fitanico nelle cellule di Schwann e nella mielina.
PDB con fenotipi atipici o più lievi. I neonati con sindrome di
Zellweger mostrano anomalie evidenti e riconoscibili. Assume
una particolare importanza diagnostica la presenza di una facies tipica (fronte alta, occhi a mandorla, arcate sopraorbitali
ipoplastiche ed epicanto; Fig. 86-3), grave debolezza e ipotonia,
convulsioni neonatali e anomalie oculari (cataratta, glaucoma,
opacamento corneale, macchie di Brushfield, retinopatia pigmentaria e displasia nervosa). A causa dell’ipotonia e dell’aspetto
“mongoloide”, può essere sospettata la sindrome di Down. I
bambini con la sindrome di Zellweger raramente vivono più di
qualche mese. Oltre il 90% mostra ritardo della crescita postnatale. La Tabella 86-5 elenca le principali anomalie cliniche.
Nei pazienti con ALD neonatale le caratteristiche dismorfiche
sono assenti o lievi. Le convulsioni neonatali sono frequenti. Si
nota un certo grado di sviluppo psicomotorio, ma il ritardo delle
funzioni resta grave o gravissimo e può esserci una regressione
dello sviluppo dopo i 3-5 anni, probabilmente in seguito a leucodistrofia progressiva. Attualmente diversi pazienti hanno raggiunto i 30-40 anni e, sebbene disabili, sono in uno stato stabile. Epatomegalia, compromissione della funzione epatica, degenerazione pigmentosa della retina e grave sordità sono invariabilmente
presenti. La funzione surrenocorticale è solitamente danneggiata,
ma la malattia di Addison vera e propria è un’evenienza rara. La
condrodisplasia puntata e le cisti renali sono assenti.
I pazienti con malattia di Refsum infantile possono sopravvivere fino alla seconda decade e oltre. Sono in grado di camminare,
benché con andatura atassica e base allargata. Le funzioni cognitive presentano un grave ritardo. Tutti i pazienti manifestano
84-92ANA.indd 596
Figura 86-3. Quattro pazienti con sindrome cerebroepatorenale di Zellweger.
Si notano la fronte alta, l’epicanto e l’ipoplasia delle arcate sopraorbitali. (Per
gentile concessione di Hans Zellweger.)
TABELLA 86-5. Principali anomalie cliniche nella sindrome di Zellweger
CARATTERISTICHE ANOMALE
Fronte alta
Platicefalia
Fontanella allargata, suture evidenti
Arcata sopraorbitale piatta
Radice nasale bassa/ampia
Epicanto
Palato ogivale
Deformità delle orecchie esterne
Micrognazia
Eccesso di cute sul collo
Macchie di Brushfield
Cataratta/cornea offuscata
Glaucoma
Anomala pigmentazione della retina
Pallore del disco ottico
Grave ipotonia
Risposta di Moro anomala
Iporeflessia o areflessia
Suzione inefficace
Nutrizione per sonda gastrica
Convulsioni epilettiche
Ritardo psicomotorio
Disturbi dell’udito
Nistagmo
DATI DERIVATI DA DESCRIZIONI
DATI OSSERVATI
NUMERO
PERCENTUALE NUMERO PERCENTUALE
60
53
58
97
16
14
13
81
57
50
55
96
33
29
33
100
23
20
23
100
36
32
33
92
37
32
35
95
40
35
39
97
18
16
18
100
13
11
13
100
6
5
5
83
35
31
30
86
12
11
7
58
15
13
6
40
23
20
17
74
95
83
94
99
26
23
26
100
57
50
56
98
77
68
74
96
26
23
26
100
61
54
56
92
45
39
45
100
21
18
9
40
37
32
30
81
Da Heymans HAS: Cerebro-hepato-renal (Zellweger) syndrome: Clinical and biochemical consequences of peroxisomal
dysfunctions. Thesis, University of Amsterdam, 1984.
23-09-2008 11:52:04
Capitolo 86
perdita neurosensoriale dell’udito e degenerazione pigmentosa
della retina; appaiono lievemente dismorfici e possono presentare epicanto, radice nasale piatta, orecchie a impianto basso.
L’ipotonia precoce e l’epatomegalia con compromissione della
funzionalità sono comuni. I livelli di colesterolo plasmatico e
delle lipoproteine a bassa ed elevata densità sono moderatamente
ridotti. La condrodisplasia puntata e le cisti renali corticali sono
assenti. Lo studio post mortem su pazienti con questa malattia
rivela cirrosi epatica micronodulare e surreni piccoli e ipoplastici.
Non emergono malformazioni cerebrali, fatta eccezione per una
grave ipoplasia dello strato granulare cerebellare e la localizzazione ectopica delle cellule di Purkinje nello strato molecolare. La
malattia si trasmette con modalità autosomica recessiva.
Alcuni pazienti con disturbi PBD hanno fenotipi più lievi e atipici. La presentazione avviene talvolta con neuropatia periferica
oppure con retinopatia, perdita visiva o cataratta nell’infanzia,
nell’adolescenza e nell’età adulta; a questi pazienti viene diagnosticata la malattia di Charcot-Marie-Tooth o sindrome di Usher.
Alcuni soggetti sono sopravvissuti fino alla quinta decade. I difetti di PEX7, che comunemente conducono al fenotipo RCDP,
possono determinarne uno più lieve, con manifestazioni cliniche
simili a quelle della malattia di Refsum classica (deficit di fitanoil
CoA idrossilasi).
Condrodisplasia puntata rizomelica (RCDP). Questo disturbo,
caratterizzato dalla presenza di focolai punteggiati di calcificazione all’interno della cartilagine ialina, è associato a nanismo,
cataratta (72%) e malformazioni multiple dovute a contratture.
I corpi vertebrali presentano una fessura coronale riempita di
cartilagine, risultato dell’arresto dello sviluppo embrionale. La
marcata brevità della parte prossimale degli arti causa la bassa statura (Fig. 86-4A). Le anomalie radiologiche consistono
nell’accorciamento delle ossa prossimali degli arti, nella disostosi
metafiseale e nei disturbi della calcificazione (Fig. 86-4B). Peso,
altezza e circonferenza cranica risultano inferiori al terzo percentile e il ritardo mentale è grave. I cambiamenti cutanei, come
quelli riscontrati nell’eritroderma ittiosiforme, sono presenti nel
25% dei pazienti.
Difetti isolati dell’ossidazione perossisomale degli acidi grassi. I
disturbi contrassegnati con le sigle da B1 a B3 (vedi Tab. 86-2)
coinvolgono uno dei tre enzimi implicati nell’ossidazione degli
acidi grassi. Le loro manifestazioni cliniche sono simili a quelle
■
Difetti del metabolismo lipidico
■
597
del continuum sindrome di Zellweger/ALD neonatale/malattia di
Refsum infantile; soltanto gli esami di laboratorio consentono di
distinguerle dai disturbi della biogenesi perossisomale. I difetti
dell’enzima bifunzionale sono comuni e si riscontrano nel 15%
dei pazienti con il fenotipo del continuum sindrome di Zellweger/
ALD neonatale/malattia di Refsum infantile. I pazienti con deficit
isolato di acil CoA ossidasi presentano un fenotipo più lieve,
analogo a quello dell’ALD neonatale.
Difetti isolati della sintesi del plasmalogeno. I plasmalogeni sono
lipidi nei quali il primo atomo di carbonio del glicerolo è legato a
un alcol invece che a un acido grasso. Sono sintetizzati attraverso
una complessa serie di reazioni, i cui primi due passaggi sono
catalizzati dagli enzimi perossisomali diidrossiacetone fosfato
alchil transferasi e sintasi. Il deficit di uno di questi due enzimi
(B4 e B5 nella Tab. 86-2) determina un fenotipo clinicamente
indistinguibile dal difetto dell’importazione perossisomale RCDP.
Quest’ultimo disturbo è causato da un difetto di PEX7, il recettore della sequenza segnale 2. È altrettanto grave del deficit di
plasmalogeno nei disturbi B4 e B5, ma presenta anche un difetto
dell’ossidazione dell’acido fitanico. Il fatto che i disturbi B4 e B5
siano associati al fenotipo completo di RCDP suggerisce che un
deficit dei plasmalogeni sia sufficiente a produrlo.
Malattia di Refsum classica. L’enzima deficitario (fitanoil CoA
ossidasi) è localizzato nel perossisoma. Le manifestazioni della
malattia includono perdita visiva conseguente a retinite pigmentosa, ittiosi, neuropatia periferica, atassia e occasionalmente aritmia cardiaca. A differenza della malattia di Refsum infantile, la
funzione cognitiva è normale e non sono presenti malformazioni
congenite. Spesso la malattia non si manifesta fino alla prima
età adulta, ma i disturbi visivi (come cecità notturna, ittiosi e
neuropatia periferica) possono aversi già dall’infanzia o dall’adolescenza. La diagnosi precoce è importante perché una dieta priva
di acido fitanico consente di correggere la neuropatia periferica e
previene la progressione delle manifestazioni visive e a carico del
sistema nervoso centrale. Il fenotipo della malattia classica può
essere causato anche da difetti di PEX7.
Deficit di 2-metilacil CoA racemasi. Questo disturbo è causato
da un difetto enzimatico che determina l’accumulo di acidi grassi
a catena ramificata (acido fitanico e acido pristanico) e di acidi
biliari. La presentazione è con neuropatia periferica di tipo adulto
e degenerazione pigmentosa della retina.
Figura 86-4. A, Neonato con condrodisplasia puntata rizomelica
(RCDP). Si vedono la marcata brevità della parte prossimale degli arti, la radice nasale piatta, l’iperlorismo e le lesioni
desquamanti cutanee. B, Si vedono l’evidente accorciamento
dell’omero e l’epifisi punteggiata a livello di spalle e gomito. (Per
gentile concessione di John P. Dorst.)
A
84-92ANA.indd 597
B
23-09-2008 11:52:04
598
■
PARTE X
■
Malattie metaboliche
REPERTI DI LABORATORIO. I test di laboratorio per i disturbi perossisomali possono essere suddivisi sulla base di tre livelli di
complessità.
Livello 1: il paziente ha un difetto perossisomale? È possibile rispondere a questa domanda mediante test non invasivi facilmente
reperibili (Tab. 86-6), tra cui la misura plasmatica di VLCFA è
quello più comunemente utilizzato. I livelli plasmatici di VLCFA
TABELLA 86-6. Difetti perossisomali che coinvolgono l’ossidazione
degli acidi grassi: approccio diagnostico
MALATTIA
Sindrome di Zellweger
ESAMI
Plasma
Adrenoleucodistrofia
neonatale
Malattia di Refsum
infantile
RBC
Fibroblasti
Condrodisplasia
rizomelica puntata
Plasma
RBC
Fibroblasti
Emizogote ALD legata
all’X
Plasma
Fibroblasti
Eterozigote ALD legata
all’X
Plasma
Fibroblasti
Difetto dell’enzima
bifunzionale
Plasma
Fibroblasti
Deficit di acil CoA ossidasi Plasma
Fibroblasti
Deficit di 2-metil acil CoA Plasma
racemasi
Fibroblasti
Malattia di Refsum
classica
VLCFA
Acido fitanico
REPERTI
Aumento
Aumento legato all’età
Acido pristanico
Aumento legato all’età
Acido pipecolico
Acido biliare
Livelli di plasmalogeno
Livelli dei VLCFA
Ossidazione dei VLCFA
Sintesi del plasmalogeno
Ossidazione fitanica,
pristanica
Localizzazione
della catalisi
Immunocitochimica
Complementazione
DNA
Acido fitanico
Aumento
Aumento, pattern anomalo
Aumento variabile
Aumento
Riduzione
Riduzione
Riduzione
Perossisomi assenti
Vedi Tabella 86-1
Vedi Tabella 86-1
Aumento
VLCFA
Livelli di plasmalogeno
Sintesi del plasmalogeno
Ossidazione dell’acido
fitanico
DNA
VLCFA
Difetto PEX7
Aumento
Livelli dei VLCFA
Ossidazione dei VLCFA
Immunoreattività ALDP
DNA
VLCFA
Aumento
Riduzione
Assente nel 70%
Mutazione ABCD1
Aumento variabile nell’85%
Livelli di VLCFA
Immunoreattività ALDP
DNA
VLCFA
Aumento variabile nel 90%
Riduzione variabile
Mutazione ABCD1
Aumento
Acido fitanico
Acido pristanico
Acidi biliari
Livelli di VLCFA
Ossidazione dell’acido
pristanico
Localizzazione
della catalisi
Enzimi
Aumento
Aumento
Aumento, pattern anomalo
Aumento
Riduzione
VLCFA
Livelli di VLCFA
Ossidazione di VLCFA
Enzima
Acido pristanico
Acido biliare
Ossidazione dell’acido
pristanico
Enzima
Normale
Riduzione
Riduzione
Riduzione
Perosossimale
Deficit di proteina
D-bifunzionale
Aumento
Aumento
Riduzione
Deficit di acil CoA ossidasi
Aumento
Aumento, pattern anomalo
Riduzione
Plasma
Acido fitanico
Deficit di 2-metil acil CoA
ossidasi
Aumento
Fibroblasti
Acido pristanico
Enzima
Riduzione
Deficit di fitanoil CoA
ALD, adrenoleucodistrofia; VLCFA, acidi grassi a catena molto lunga.
84-92ANA.indd 598
Citosolica
risultano elevati in molti pazienti con disturbi perossisomali, ma
non nella totalità dei casi. La principale eccezione è costituita
dall’RCDP, in cui i livelli di VLCFA sono normali mentre quelli di
acido fitanico plasmatico sono aumentati e quelli di plasmalogeno nei globuli rossi ridotti. In altri disturbi perossisomali le anomalie biochimiche sono ancora meno marcate. Di conseguenza si
consiglia di eseguire un set di test, che includa la misura dei livelli
plasmatici di VLCFA, degli acidi fitanico, pristanico e pipecolico
e dei livelli di plasmalogeno nei globuli rossi. Le tecniche di spettrometria di tandem massa consentono di quantificare la presenza
di acidi biliari in plasma e urine. Questo set di test, eseguito su
campioni di 2 mL di sangue venoso, permette di individuare la
maggior parte dei difetti perossisomali, la cui presenza viene resa
estremamente improbabile da risultati nella norma.
Livello 2: qual è la natura precisa del disturbo perossisomale? Nella Tabella 86-6 sono elencate le principali anomalie biochimiche
dei vari disturbi perossisomali. Se associato alla presentazione
clinica, il set di test menzionato è spesso sufficiente per identificare la natura precisa del difetto. L’elevazione plasmatica dei
livelli di VLCFA consente la diagnosi di X-ALD nei pazienti di
sesso maschile. La marcata riduzione dei livelli di plasmalogeno
negli eritrociti, associata all’aumento plasmatico dell’acido fitanico, permette di confermare la diagnosi in un paziente con le
caratteristiche cliniche della RCDP.
La malattia di Refsum classica può essere diagnosticata dimostrando l’aumento dell’acido fitanico associato a livelli normali o
ridotti di acido pristanico. Nei deficit dell’enzima D-bifunzionale
e di 2-metilacil CoA racemasi, i livelli di acido pristanico e fitanico risultano entrambi aumentati. L’identificazione precisa del
difetto perossisomale può richiedere studi più approfonditi su
colture di fibroblasti cutanei, che consentano la formulazione
della diagnosi differenziale tra PBD e difetti dell’enzima bifunzionale. Nei PBD i perossisomi del paziente sono assenti e la catalasi
è nella frazione solubile, mentre nel difetto dell’enzima bifunzionale i perossisomi sono presenti e la catalasi è nella frazione
particolata. I test sui fibroblasti sono richiesti per identificare la
natura del difetto molecolare nei PDB. La necessità di ricorrere
a questi esami di approfondimento viene stabilita sulla base delle
circostanze individuali.
La precisa definizione del difetto del probando consente una
diagnosi prenatale più accurata nelle gravidanze a rischio ed è
indispensabile per l’identificazione dei portatori sani. È inoltre
importante per la prognosi nei pazienti con difetti di PEX1,
che sono presenti nel 60% dei casi con PBD e circa il 50% dei
portatori di questi difetti presenta l’allele G843D associato a un
fenotipo significativamente più lieve rispetto a quello riscontrato
in altre mutazioni.
Livello 3: qual è il difetto molecolare? Come illustrato nella Tabella 86-3, nella maggior parte dei PBD il difetto molecolare è
stato identificato. La definizione del difetto nel probando, oggi
offerta in diversi laboratori, è essenziale per l’individuazione dei
portatori e per accelerare la diagnosi prenatale.
DIAGNOSI. Sono disponibili svariati test non invasivi che consentono una precisa e precoce diagnosi dei disturbi perossisomali
(vedi Tab. 86-6), distinguendoli dall’ampia gamma di altre condizioni patologiche responsabili di ipotonia, convulsioni, deficit
staturo-ponderale o caratteristiche dismorfiche.
I medici esperti riescono a riconoscere facilmente la sindrome di
Zellweger classica grazie alle sue manifestazioni cliniche. I pazienti con PBD spesso non mostrano lo spettro clinico completo
della malattia, perciò sono identificabili soltanto grazie agli esami
di laboratorio.
Le caratteristiche cliniche utili sul piano diagnostico includono:
grave ritardo psicomotorio, debolezza e ipotonia, caratteristiche
dismorfiche, convulsioni neonatali, retinopatia, glaucoma o cataratta, deficit uditivi, ingrossamento del fegato e compromissione
della funzione epatica, condrodisplasia puntata. La presenza di
almeno una di queste anomalie aumenta la probabilità della diagnosi. Sono state descritte anche forme atipiche più lievi, che si
presentano con neuropatia periferica.
23-09-2008 11:52:05
Capitolo 86
■
Difetti del metabolismo lipidico
■
599
Alcuni pazienti con difetti isolati dell’ossidazione perossisomale
degli acidi grassi (gruppo B) presentano caratteristiche in comune
con i disturbi del gruppo A; il riscontro di livelli insolitamente
elevati di VLCFA consente di formulare la diagnosi differenziale.
I pazienti con RCDP devono essere distinti da quelli con altre
cause di condrodisplasia puntata. Oltre alla sindrome di Zellweger e alla embriopatia da warfarin, queste patologie includono:
la forma autosomica dominante della condrodisplasia puntata
(sindrome di Conradi-Hunermann), caratterizzata da una migliore prognosi in termini di sopravvivenza, dall’assenza di marcata
brevità degli arti e da un livello intellettivo solitamente normale;
una forma dominante legata all’X; una forma recessiva legata
all’X, associata alla delezione della porzione terminale del braccio
corto del cromosoma X. La brevità degli arti, il ritardo psicomotorio e l’ittiosi suggeriscono la presenza della RCDP. L’esame di
laboratorio decisivo è il riscontro di livelli insolitamente ridotti di
plasmalogeno nei globuli rossi e la compromissione della capacità
di sintetizzarlo in colture di fibroblasti cutanei. Questi difetti
biochimici non sono presenti negli altri tipi di condrodisplasia
puntata. Quest’ultima può essere associata anche a un difetto
di 3-idrossisteroide-8, 7-isomerasi, un enzima coinvolto nella
biosintesi del colesterolo.
ADRENOLEUCODISTROFIA (LEGATA ALL’X)
COMPLICANZE. I pazienti con sindrome cerebroepatorenale di
Zellweger hanno disabilità multiple, che includono i disturbi del
tono muscolare e della deglutizione, le anomalie cardiache, la
malattia epatica e le convulsioni. L’unico trattamento possibile è
quello sintomatico, ma la prognosi è infausta: la maggior parte
dei pazienti decede nei primi mesi di vita. I pazienti con RCDP
possono sviluppare quadriparesi in seguito alla compressione
della base del cranio.
EPIDEMIOLOGIA. L’incidenza minima di X-ALD nei soggetti di sesso maschile è 1/21 000, mentre l’incidenza combinata di maschi
X-ALD e donne eterozigoti nella popolazione generale è stimata
a 1/17 000. Nessuna razza risulta maggiormente colpita rispetto
ad altre. I vari fenotipi si riscontrano spesso in membri dello steso
gruppo familiare.
PREVENZIONE. Vedi Capitoli 33 e 84.
TRATTAMENTO. La terapia più efficace nella malattia di Refsum
classica consiste nell’eliminazione dalla dieta dell’acido fitanico.
Nei pazienti con le varianti più lievi del difetto di importazione
dei perossisomi si è dimostrato utile un intervento multidisciplinare precoce, che include una terapia occupazionale e fisica,
l’uso di supporti acustici, il ricorso a metodi di comunicazione
alternativa e il sostegno ai genitori. Malgrado il ritardo mentale
resti grave o gravissimo nella maggior parte dei pazienti, alcuni
riescono a fare progressi nell’acquisizione delle capacità di base e
mantengono una condizione di stabilità nell’adolescenza.
Le terapie sperimentali per mitigare le anomalie biochimiche
secondarie prevedono la somministrazione orale di acido docosaesaenoico (50-100 mg/die), sia in forma di etil estere sia in quella
di trigliceride in cui uno degli acidi grassi è stato sostituito con
acido docosaesaenoico. Questa terapia consente la normalizzazione (in plasma ed eritrociti) dei livelli di questa sostanza, che
svolge importanti funzioni fisiologiche nella retina e nel cervello,
ma nei soggetti con difetti della biogenesi perossisomale risulta
gravemente ridotta, in seguito alla compromissione delle ultime
due tappe della sua sintesi. Sono stati documentati casi di miglioramento clinico con questa terapia. La somministrazione orale di
acido colico e acido chenodesossicolico (100-250 mg/die), allo
scopo di ridurre i livelli dei prodotti intermedi degli acidi biliari
(presumibilmente tossici), può risultare efficace.
COUNSELING GENETICO. Tutti i difetti perossisomali, fatta eccezione per l’iperossaluria di tipo 1, sono diagnosticabili nel primo
o secondo trimestre di gestazione. I test, simili a quelli descritti
per la diagnosi postnatale (vedi Tab. 86-6), prevedono l’esame di
campioni di villi coriali o di amniociti. Grazie al monitoraggio di
oltre 300 gravidanze, sono stati identificati oltre 60 feti colpiti,
senza incorrere in alcun errore diagnostico. A causa del 25% di
rischio di recidiva, le coppie con un figlio malato devono essere
informate sulla possibilità di ricorrere alla diagnosi prenatale.
Gli eterozigoti possono essere identificati nell’X-ALD e in tutti i
disturbi nei quali il difetto molecolare è stato identificato (vedi
Tab. 86-3).
84-92ANA.indd 599
L’X-ALD è una malattia geneticamente determinata associata
all’accumulo di VLCFA saturi e ad una progressiva disfunzione
della corteccia surrenale e della sostanza bianca del sistema nervoso centrale e periferico.
EZIOLOGIA. L’anomalia biochimica responsabile del disturbo è l’accumulo di VLCFA saturi non ramificati, con una catena lunga 24
atomi di carbonio o più. La caratteristica più evidente è l’eccesso
di acido esacosanoico (C26:0). Tale accumulo di acidi grassi è
determinata da una degradazione perossisomale geneticamente
deficitaria. Il difetto biochimico di base compromette la funzione
della lignoceroil CoA ligasi perossisomale, enzima che catalizza la
formazione di CoA derivato dai VLCFA. Il gene deficitario (ABCD1) codifica per la membrana perossisomale (ALDP). Sono state
identificate oltre 400 differenti mutazioni e la maggior parte delle
famiglie ne presenta una “privata” specifica di quel gruppo familiare (per l’elenco aggiornato, vedi il sito web http://www.x-ald.
nl). Il gene è stato mappato sul cromosoma Xq28. Il meccanismo
attraverso il quale il difetto ALDP conduce all’accumulo di VCLF
e alla patologia X-ALD è ignoto.
ANATOMIA PATOLOGICA. Caratteristiche inclusioni citoplasmatiche
lamellari sono evidenziate con il microscopio elettronico nelle cellule adrenocorticali, nelle cellule testicolari di Leydig e nei macrofagi del sistema nervoso. Tali inclusioni, probabilmente costituite
da colesterolo esterificato con VLCFA, sono particolarmente prominenti nelle cellule della zona fascicolata della corteccia surrenale,
la cui distensione è causata dai lipidi e dalla successiva atrofia.
Nel sistema nervoso si riscontrano due tipi di lesione. Nella
forma cerebrale infantile grave e in quella adulta progressiva, la
demielinizzazione è associata a una risposta infiammatoria, che si
manifesta con l’accumulo di linfociti perivascolari, in particolare
nella regione parieto-occipitale. Nella forma adulta a progressione lenta (adrenomieloneuropatia, AMN), il reperto principale
consiste nell’assonopatia distale, che colpisce i tratti lunghi del
midollo spinale. La risposta infiammatoria è lieve o assente.
PATOGENESI. La disfunzione surrenale è probabilmente una diretta conseguenza dell’accumulo di VLCFA. La distensione delle
cellule della zona fascicolata è provocata dall’anomalo accumulo
di lipidi. Il colesterolo esterificato con VLCFA è relativamente resistente al colesterolo estere idrolasi stimolata dall’ormone adrenocorticotropico (ACTH); ciò limita la capacità di convertire il
colesterolo in steroidi attivi. Inoltre, l’eccesso di C26:O aumenta
la viscosità della membrana plasmatica, interferendo con la funzione dei recettori e con le altre funzioni cellulari.
Non si riscontra alcuna correlazione tra il fenotipo neurologico
e la natura della mutazione o la gravità del difetto biochimico
(diagnosticato mediante misura dei livelli plasmatici di VLCFA),
né tra il grado di coinvolgimento surrenale e del sistema nervoso
centrale. La gravità della malattia e la sua progressione sono invece correlate all’intensità della risposta infiammatoria, la quale
può essere mediata da citochine e può implicare una risposta
autoimmune scatenata, con modalità sconosciuta, dall’eccesso
di VLCFA. L’antigene CD1 è coinvolto, come anche il danno
mitocondriale e lo stress ossidativo. Circa il 50% dei pazienti
non sperimenta alcuna risposta infiammatoria, per cui è stata
postulata l’esistenza di un gene modificato che funziona come
una sorta di “termostato” per regolarla.
MANIFESTAZIONI CLINICHE. Emergono cinque fenotipi distinti,
tre dei quali si presentano nell’infanzia, con vari sintomi e segni.
23-09-2008 11:52:05
600
■
PARTE X
■
Malattie metaboliche
In tutti i fenotipi lo sviluppo è solitamente normale nei primi
3-4 anni.
Nella forma cerebrale infantile di ALD, i sintomi sono notati
per la prima volta tra i 4 e gli 8 anni (21 mesi è la segnalazione di
esordio più precoce). Le manifestazioni iniziali più comuni sono
l’iperattività (spesso scambiata per un disturbo da deficit dell’attenzione) e il peggioramento del rendimento scolastico. La discriminazione uditiva è spesso compromessa, mentre la percezione
del tono è preservata; ciò spiega le difficoltà del bambino nell’uso
del telefono e il calo della performance nei test di intelligenza
che prevedono la presentazione di item verbali. Anche l’orientamento spaziale risulta spesso compromesso. Altri sintomi iniziali
sono costituiti da disturbi della visione, atassia, grafia illeggibile,
convulsioni e strabismo. I disturbi visivi dipendono spesso dal
coinvolgimento della corteccia cerebrale, che compromette in
grado variabile la capacità visiva. Le convulsioni si verificano
in quasi tutti i pazienti e possono costituire la manifestazione di
esordio della malattia. In altri soggetti l’esordio avviene con l’aumento della pressione intracranica o con lesioni unilaterali massive. La compromissione della risposta alla stimolazione ACTH
è presente nell’85% dei casi, nei quali si nota anche una lieve
iperpigmentazione. Tuttavia, nella maggior parte dei pazienti con
questo fenotipo, la disfunzione surrenalica è riconosciuta solo
successivamente alla formulazione della diagnosi, suggerita dai
sintomi cerebrali. La ALD cerebrale infantile tende a progredire
rapidamente, con aggravamento di spasticità e paralisi, perdita
visiva e uditiva e della capacità di parlare o deglutire. L’intervallo
medio tra il primo sintomo neurologico e uno stato apparentemente vegetativo è di 1,9 anni. I pazienti possono sopravvivere
in questo stato per altri 10 anni o più.
I soggetti con la forma adolescenziale di ALD sperimentano i
sintomi neurologici tra i 10 e i 21 anni. Le manifestazioni sono
simili a quelle delle ALD cerebrale infantile, ma la progressione è
più lenta. In circa il 10% dei casi la malattia ha un esordio acuto,
con stato epilettico, crisi surrenali, encefalopatia acuta o coma.
L’adrenomieloneuropatia si manifesta per la prima volta nella
tarda adolescenza o nella prima età adulta, con una paraparesi progressiva, causata dalla degenerazione dei tratti lunghi del
midollo spinale. In circa il 50% dei casi si riscontra anche una
compromissione della sostanza bianca cerebrale.
Il fenotipo “solo Addison” spesso non viene riconosciuto. Si
calcola che almeno il 25% dei pazienti maschi con malattia di
Addison presenti il difetto biochimico della ALD. In molti di
questi, il sistema nervoso è preservato, mentre altri manifestano
sottili segni neurologici. Parecchi acquisiscono adrenomieloneuropatia in età adulta.
Il termine “ALD asintomatica” si applica a pazienti con difetto
biochimico della ALD, ma privi di disturbi neurologici o endocrini. La quasi totalità dei soggetti portatori del difetto genetico
prima o poi diviene sintomatica. Sono stati segnalati solo rari casi
di pazienti asintomatici fino alla sesta o settima decade.
Circa il 50% delle donne eterozigoti sviluppa una sindrome
simile all’adrenomieloneuropatia, ma più lieve e ad esordio tardivo. L’insufficienza surrenale è rara.
REPERTI RADIOLOGICI E DI LABORATORIO. Il reperto di laboratorio
più specifico e importante è il riscontro di livelli insolitamente
elevati di VLCFA nel plasma, nei globuli rossi o su colture di
fibroblasti cutanei. Il test andrebbe eseguito in un laboratorio
specializzato. Risultati positivi sono ottenuti in tutti i pazienti
di sesso maschile con X-ALD e nell’85% delle donne portatrici.
L’analisi della mutazione è il metodo più efficace per l’identificazione dei portatori.
TC e RM. I pazienti con ALD cerebrale infantile o adolescenziale mostrano lesioni della sostanza bianca cerebrale che alla
RM rivelano una localizzazione e uno schema di attenuazione
caratteristici. Nell’80% dei casi le lesioni sono simmetriche e
coinvolgono la materia bianca periventricolare nei lobi occipitale e posteriore parietale. Circa il 50% dei soggetti mostra una
ghirlanda di materiale di contrasto accumulato anteriormente alle
lesioni ipodense posteriori (Fig. 86-5A). Quest’area corrisponde
alle zone di intensa infiltrazione linfocitica perivascolare, dove la
barriera ematoencefalica si interrompe. Nel 12% dei pazienti le
lesioni iniziali sono frontali. Possono riscontrarsi anche lesioni
unilaterali che producono un effetto massa analogo a quello dei
tumori cerebrali. La RM consente di delineare con maggiore chiarezza le anomalie della materia bianca, evidenziando eventuali
lesioni sfuggite alla TC (Fig. 86-5B).
Compromissione della funzione surrenale. Oltre l’85% dei pazienti con la forma infantile presenta elevati livelli plasmatici di ACTH
e un anomalo aumento dei livelli di cortisolo nel plasma in seguito
a iniezione endovenosa di 250 g di ACTH.
DIAGNOSI E DIAGNOSI DIFFERENZIALE. Le manifestazioni di esordio della ALD cerebrale infantile sono difficili da distinguere
dai più comuni disturbi da deficit dell’attenzione o dai disturbi
dell’apprendimento. La ALD è suggerita dalla progressione rapida, dai segni di demenza e dalle difficoltà di discriminazione
uditiva. Anche negli stadi precoci, TC e RM possono mostrare
anomalie marcate. Altre leucodistrofie (vedi i Capitoli 599 e
610.10) o sclerosi multipla (vedi Capitolo 600.1) possono produrre questi risultati radiografici. La diagnosi definitiva richiede
Figura 86-5. A, La TC con mezzo di contrasto
mostra le anomalie tipiche dell’adrenoleucodistrofia (ALD) localizzate a livello della corteccia
parieto-occipitale, evidenziando zone inattive
bilaterali ipodense (HO; indicate dalla frecce). Le immagini RM pesate in T2 mostrano
un segnale a elevata intensità proveniente dalla
materia bianca parieto-occipitale insolitamente
luminosa. La RM consente di identificare il coinvolgimento subcorticale, mentre la separazione
tra zone attive è apprezzata al meglio con la
TC, perché nella RM sia le zone attive sia quelle
inattive appaiono come aree a elevata intensità
di segnale. È ipotizzabile che tale importante
distinzione sarà facilitata dall’introduzione di un
mezzo di contrasto paramagnetico. Viene confrontato il coinvolgimento ipodenso mostrato
dalla TC (frecce e punte di freccia in A) con
le lesioni a elevata risoluzione della RM nella
figura B. (Per gentile concessione di Kumar AJ,
Rosenbaum WE, Naidu S, et al: Adrenoleukodystrophy: Corresponding MR imaging with CT.
Radiology 1987;165:497-504.)
A
84-92ANA.indd 600
B
23-09-2008 11:52:05
Capitolo 86
quindi la dimostrazione dell’eccesso di VLCFA, che si verifica
soltanto nell’X-ALD e negli altri difetti perossisomali, i quali
risultano distinguibili dalla X-ALD sulla base della presentazione
clinica durante il periodo neonatale.
Nelle forme cerebrali della ALD è possibile riscontrare un
aumento della pressione intracranica e lesioni con effetto massa unilaterali, talvolta erroneamente diagnosticate come gliomi,
anche successivamente a biopsia cerebrale (diversi pazienti sono
stati sottoposti a radioterapia prima di giungere alla diagnosi
corretta). La misura dei VLCFA nel plasma o su campioni ottenuti attraverso biopsia cerebrale è il test più affidabile per la
formulazione della diagnosi differenziale.
La forma adolescenziale o adulta di ALD può essere confusa
con disturbi psichiatrici, demenza o epilessia. La diagnosi è suggerita dal riscontro di lesioni della materia bianca mediante TC
o RM e la misurazione dei VLCFA fornisce la conferma.
L’ALD non può essere differenziata sul piano clinico dalle altre forme di malattia di Addison; è dunque raccomandabile che
tutti i pazienti maschi con malattia di Addison siano sottoposti a
verifica dei livelli di VLCFA. I pazienti ALD solitamente non possiedono anticorpi contro il tessuto surrenale nel loro plasma.
COMPLICANZE. L’insorgenza di insufficienza surrenale è una complicanza evitabile. I problemi neurologici più complessi sono
quelli collegati al riposo a letto, le contratture, il coma e i disturbi
della deglutizione. Inoltre, possono riscontrarsi disturbi comportamentali, lesioni associate ai disturbi dell’orientamento spaziale,
compromissione di visione e udito, convulsioni.
TRATTAMENTO. La terapia corticosteroidea è efficace in caso di
insufficienza surrenale o ipofunzione adrenocorticale (vedi Capitolo 576). Questo trattamento aumenta la forza e il benessere
del paziente e in alcuni casi può salvargli la vita, ma non altera
il corso della disabilità neurologica.
Trapianto di midollo osseo. Il trapianto di midollo osseo può
essere utile nei pazienti che mostrano precoci segni di demielinizzazione infiammatoria, la lesione tipica della forma a rapida progressione che colpisce ragazzi e adolescenti con fenotipo X-ALD.
Dal momento che si tratta di una procedura a elevato rischio, i
pazienti devono essere accuratamente selezionati. Il meccanismo
responsabile degli effetti benefici non è stato ancora chiarito con
precisione. Le cellule derivate dal midollo osseo esprimono ALDP,
la proteina deficitaria nell’X-ALD; il 50% delle cellule microgliali
cerebrali deriva dal midollo osseo. È dunque ipotizzabile che la
sostituzione delle cellule colpite con cellule contenenti il gene
normale modifichi il milieu cerebrale a sufficienza da correggere
il disturbo metabolico cerebrale.
Ma è possibile anche che l’effetto favorevole sia da attribuire
alla modifica della risposta infiammatoria cerebrale. Il follow-up
a 5 e 10 anni di ragazzi e adolescenti con coinvolgimento cerebrale precoce ha mostrato una stabilizzazione e, in alcuni casi,
un certo miglioramento. Al contrario, il trapianto di midollo non
si è rivelato efficace in pazienti che già presentavano gravi lesioni
cerebrali, nel quale caso è possibile che l’intervento acceleri la
progressione della malattia. Il QI non verbale sembra avere un
valore predittivo: il trapianto non è raccomandabile nei pazienti
con QI non verbale significativamente inferiore a 80. Sfortunatamente, in oltre il 50% dei casi diagnosticati in seguito ai sintomi
neurologici, la malattia è già troppo avanzata per procedere al
trapianto.
L’intervento può essere preso in considerazione nei soggetti
con sintomi neurologici lievi o assenti, che nella maggior parte
dei casi sono identificati attraverso lo screening dei parenti di
pazienti sintomatici. Anche lo screening mediante misura dei livelli plasmatici di VLCFA nei soggetti con la malattia di Addison
contribuisce all’identificazione dei candidati per il trapianto. A
causa dell’elevato rischio (la mortalità è compresa tra il 10 e il
20%) e poiché fino al 50% dei pazienti non trattati non sviluppa demielinizzazione infiammatoria cerebrale, il trapianto non
è raccomandato in assenza di un dimostrabile coinvolgimento
cerebrale. La RM può contribuire a questa decisione cruciale,
84-92ANA.indd 601
■
Difetti del metabolismo lipidico
■
601
rilevando anomalie prima della comparsa di sintomi neurologici
o neuropsicologici clinicamente evidenti. Il monitoraggio mediante RM di ragazzi e adolescenti asintomatici fra i 3 e i 15 anni
andrebbe effettuato a intervalli di 6 mesi-1 anno. Se la RM è
normale, il trapianto è controindicato, mentre in caso di riscontro
di anomalie il paziente andrebbe valutato a intervalli di tre mesi
per determinare la natura progressiva dell’anomalia stessa, anche
attraverso un accurato esame neurologico e neuropsicologico.
Il trapianto è preso in considerazione se la progressione neurologica viene confermata. La RM spettroscopica contribuisce a
determinare la natura progressiva. Non è chiaro se il trapianto
di midollo possa risultare efficace nei casi di pazienti adulti con
adrenomieloneuropatia, in assenza di coinvolgimento infiammatorio del midollo spinale.
Olio di Lorenzo. La somministrazione dell’olio di Lorenzo a
bambini asintomatici riduce il rischio di sviluppo del fenotipo cerebrale infantile. Questo olio (una miscela 4:1 di gliceril trioleato
e gliceril trierucato), associato a una dieta particolare, è raccomandato in bambini di età inferiore agli 8 anni privi di sintomi
neurologici e con RM cerebrale normale; durante la terapia il
paziente deve essere sottoposto a un attento monitoraggio mediante RM cerebrale e tramite la verifica della funzione surrenale.
In caso di sviluppo di anomalie RM progressive, viene valutata la
possibilità di ricorrere al trapianto di cellule staminali emopoietiche, quando le lesioni sono ancora nella fase iniziale. L’olio di
Lorenzo non altera la progressione della malattia in pazienti con
coinvolgimento cerebrale.
Altre terapie. L’interferone- e le terapie immunosoppressive
non sono risultate efficaci. La terapia con lovastatina e 4-fenilbutirrato è attualmente in fase di sperimentazione. La terapia genica
si è rivelata promettente su colture di cellule e nel modello mirino,
ma non è ancora disponibile per i trial umani.
Terapia di sostegno. I disturbi comportamentali e neurologici
progressivi associati alla forma infantile dell’ALD sono estremamente difficili da affrontare per le famiglie.
Per ciascun paziente è necessario elaborare un programma di
assistenza globale, che includa la famiglia, il medico, il personale
infermieristico per le visite a domicilio, le autorità scolastiche e i
consulenti. La partecipazione a gruppi di sostegno per genitori si
è rivelata spesso utile (negli Stati Uniti, United Leukodystrophy
Foundation, 2304 Highland Drive, Sycamore, IL 60178).
La comunicazione con le autorità scolastiche è fondamentale
perché, in seguito alla Public Law 94-142, i bambini con diagnosi
di ALD hanno diritto a un trattamento speciale. A seconda della
progressione della malattia, i programmi di intervento prevedono
la possibilità per il bambino di seguire lezioni a casa propria o
in ospedale.
La gestione della malattia varia a seconda dello stadio. Le
fasi precoci sono caratterizzate da sottili cambiamenti affettivi e
comportamentali, nonché da una marcata riduzione della durata
di attenzione. Il counseling con gli insegnanti è dunque fondamentale. Le alterazioni del ritmo sonno-veglia possono essere
tenute sotto controllo attraverso un prudente uso di sedativi,
come cloralio idrato (10-50 mg/kg), pentobarbital (5 mg/kg) o
difenidramina (2-3 mg/kg).
Quando la leucodistrofia progredisce, la principale preoccupazione consiste nella modulazione del tono muscolare e nel
supporto della funzione bulbare.
Il baclofen in dosi progressive (da 5 mg 2 volte/die a 25 mg al
dì) è il più efficace agente farmacologico per il trattamento degli
spasmi muscolari acuti e dolorosi. Possono essere somministrati
anche altri farmaci, purché il paziente sia sottoposto ad attento
monitoraggio per verificare gli eventuali effetti collaterali e le
interazioni tra farmaci.
La leucodistrofia progredisce fino alla perdita del controllo
bulbare della muscolatura. All’inizio è possibile affrontare il problema passando a una dieta con cibi in forma di purè o pappa, ma
il ricorso a una sonda nasogastrica o alla gastrostomia è spesso
inevitabile. Almeno un terzo dei pazienti presenta convulsioni
focali o generalizzate, che normalmente rispondono ai farmaci
anticonvulsivanti standard.
23-09-2008 11:52:05
602
■
PARTE X
■
Malattie metaboliche
COUNSELING GENETICO E PREVENZIONE. Il counseling genetico
e la prevenzione primaria e secondaria dell’X-ALD rivestono
un’importanza cruciale. Approfonditi programmi di screening
devono essere offerti a tutti i parenti di pazienti sintomatici; uno
di questi programmi ha consentito l’identificazione di oltre 250
soggetti maschi asintomatici e di 1200 donne eterozigoti per
X-ALD. I test plasmatici consentono di verificare l’aumento dei
livelli di VLCFA già dal giorno della nascita. L’identificazione
dei maschi asintomatici permette di avviare tempestivamente la
terapia steroidea (se necessaria) e di prevenire le crisi surrenali
(che possono avere un esito fatale). La RM cerebrale fa sì che
vengano identificati i candidati per il trapianto di midollo in
uno stadio in cui questa procedura ha la maggiore probabilità
di successo. La misura dei livelli di VLCFA è raccomandata in
tutti i pazienti di sesso maschile con malattia di Addison, essendo
stato dimostrato che l’X-ALD è la causa di insufficienza surrenale
in 25% di maschi con questa malattia. L’identificazione delle
donne eterozigoti per X-ALD è più difficile, dal momento che i
livelli plasmatici di VLCFA sono normali nel 15-20% dei casi, per
cui è più facile commettere errori nel corso del consulto genetico.
Se i livelli di VLCFA sono normali, sia nel plasma sia su colture
di fibroblasti cutanei, il rischio di falso negativo è ridotto ma non
eliminato. L’analisi del DNA permette l’accurata individuazione
dei portatori, purché la mutazione sia già stata trovata in un
membro del gruppo familiare; questa procedura è raccomandata
per l’identificazione di donne eterozigoti.
La diagnosi prenatale sui feti di sesso maschile affetti è realizzata mediante la misurazione dei livelli di VLCFA su colture
di amniociti o cellule di villi coriali, oppure mediante analisi
della mutazione. Ogni volta che un nuovo paziente con X-ALD
è identificato, è opportuno elaborare un pedigree dettagliato,
che contribuisca alla segnalazione delle donne portatrici e dei
maschi affetti. Durante il counseling è importante prestare la
massima attenzione agli aspetti sociali, emotivi ed etici collegati
alla malattia.
Difetti perossisomali
Baumgartner MR, Poll-The BT, Verhoeven NM, et al: Clinical approach
to inherited peroxisomal disorders: A series of 27 patients. Ann Neurol
1998;44:720–730.
Ferdinandusse S, Ylianttila MS, Gloerich J, et al: Mutational spectrum of
D-bifunctional protein deficiency and structure-based genotype-phenotype
analysis. Am J Hum Genet 2006;78:112–124.
Martinez M, Pineda M, Vidal R, et al: Docosahexaenoic acid—A new therapeutic approach to peroxisomal-disorder patients: Experience with two
cases. Neurology 1993;43:1389–1397.
Moser HW: Genotype-phenotype correlations in disorders of peroxisome biogenesis. Mol Genet Metab 1999;68:316–327.
Motley AM, Brites P, Gerez L, et al: Mutational spectrum in the PEX7 gene
and functional analysis of mutant alleles in 78 patients with rhizomelic
chondrodysplasia punctata type 1. Am J Hum Genet 2002;70:612–624.
Preuss N, Brosius U, Biermanns M, et al: PEX1 mutations in complementation
group 1 of Zellweger spectrum patients correlate with severity of disease.
Pediatr Res 2002;51:706–714.
Steinberg S, Chen L, Wei L, Moser A, et al: The PEX gene screen: Molecular
diagnosis of peroxisome biogenesis disorders in the Zellweger syndrome
spectrum. Mol Genet Metab 2004;83:252–263.
Walter C, Gootjes J, Mooijer PA: Disorders of peroxisome biogenesis due to
mutations in PEX1: Phenotypes and PEX1 protein levels. Am J Hum Genet
2001;69:35–48.
Wanders RJ, Jansen GA, Skjeldal OH: Refsum disease, peroxisomes and
phytanic acid oxidation: A review. J Neuropathol Exp Neurol 2001;60:
1021–1031.
Adrenoleucodistrofia (legata all’X)
Bezman L, Moser AB, Raymond GV, et al: Adrenoleukodystrophy: Incidence,
new mutation rate, and results of extended family screening. Ann Neurol
2001;49:512–517.
Boehm CD, Cutting GR, Lachtermacher MB, et al: Accurate DNA-based diagnostic and carrier testing for X-linked adrenoleukodystrophy. Mol Genet
Metab 1999;66:128–136.
84-92ANA.indd 602
Kemp S, Pujol A, Waterham HR, et al: X-linked adrenoleukodystrophy mutation database: Role in diagnosis and clinical correlations. Hum Mutat
2001;18:499–515.
Moser AB, Kreiter N, Bezman L, et al: Plasma very long chain fatty acids
in 3,000 peroxisome disease patients and 29,000 controls. Ann Neurol
1999;45:100–110.
Moser HW, Loes DJ, Melhem ER, et al: X-linked adrenoleukodystrophy:
Overview and prognosis as a function of age and brain magnetic resonance imaging abnormality: A study involving 372 patients. Neuropediatrics
2000;31:227–239.
Moser HW, Raymond GV, Dubey P: Adrenoleukodystrophy: New approaches
to a neurodegenerative disease. JAMA 2005;294:3131–3134.
Moser HW, Raymond GV, Lu SE, et al: Follow-up of 89 Lorenzo’s Oil
treated asymptomatic adrenoleukodystrophy patients. Arch Neurol
2005;62:1073–1080.
Peters C, Charnas LR, Tan Y, et al: Cerebral X-linked adrenoleukodystrophy:
The international hematopoietic cell transplantation experience from 1982
to 1999. Blood 2004;104:881–888.
Stephenson DJ, Bezman L, Raymond GV: Acute presentation of childhood
adrenoleukodystrophy. Neuropediatrics 2000;31:293–297.
Van Geel BM, Assies J, Haverkort EB, et al: Progression of abnormalities in
adrenomyeloneuropathy and neurologically asymptomatic X-linked adrenoleukodystrophy despite treatment with “Lorenzo’s oil.” J Neurol Neurosurg
Psychiatry 1999;67:290–299.
86.3 • DISTURBI DEL METABOLISMO E DEL TRASPORTO
DELLE LIPOPROTEINE • William A. Neal
EPIDEMIOLOGIA DEI LIPIDI EMATICI E MALATTIA
CARDIOVASCOLARE
La relazione tra il consumo di alimenti grassi e il colesterolo plasmatico è stata dimostrata quasi un secolo fa. Nel dopoguerra,
gli americani ben nutriti presentavano un tasso di malattie coronariche cardiache (CHD, Coronary Heart Disease) più elevato
rispetto agli europei costretti al razionamento. Il Seven Countries
Study ha approfondito le differenze geografiche, sociali ed etniche nella diffusione delle CHD, rilevando una inequivocabile
associazione tra il consumo medio di grassi saturi, il colesterolo
plasmatico e la mortalità in seguito a CHD. Nel 1960, il livello
medio del colesterolo ematico negli Stati Uniti raggiungeva i 220
mg/dL, mentre nel 1991 era sceso a 205 mg/dL.
Nel 1977 il Cooperative Lipoprotein Phenotyping Study ha
dimostrato la relazione inversa tra HDL (High Density Lipoprotein, lipoproteine ad alta densità) e CHD. I trial clinici di
modifiche della dieta e interventi farmacologici volti a ridurre i
livelli di colesterolo sono stati avviati negli anni ’70, fornendo
la base per lo screening e il trattamento standard raccomandato
dal National Cholesterol Education Program (NCEP). I progressi
nell’esatta conoscenza delle basi molecolari del metabolismo delle
lipoproteine hanno consentito una migliore comprensione delle
anomalie fenotipiche e l’elaborazione di strategie di intervento
sempre più mirate.
Tra tutte le malattie croniche, la CHD è quella maggiormente influenzata dai fattori genetici e ambientali. Questo disturbo
multifattoriale è fortemente associato all’aumentare dell’età e al
genere maschile, benché nelle donne sia probabilmente sottodiagnosticato. Nei fumatori il rischio raddoppia. La vita sedentaria
e l’eccessivo consumo di grassi saturi, con conseguente adiposità,
determinano una modifica dei livelli plasmatici di lipoproteine
aterogeniche. La storia familiare è un riflesso dell’influenza combinata di stile di vita e predisposizione genetica alla malattia cardiaca precoce. Il rischio associato a una storia familiare positiva è
1,7 volte superiore rispetto alle famiglie senza questa storia.
La patogenesi dell’aterosclerosi inizia durante l’infanzia. Nelle
vittime delle guerre di Corea e Vietnam, era stata notata un’avanzata formazione di placche e strie nelle arterie coronariche e
nell’aorta. Il Johns Hopkins Precursors Study ha dimostrato che
gli studenti di medicina di razza bianca e sesso maschile con
23-09-2008 11:52:05
Capitolo 86
livelli di colesterolo ematico nel quartile inferiore, mostravano
un’incidenza di CHD del 10% nelle tre decadi successive, mentre
negli studenti che si collocavano nel quartile superiore l’incidenza
era del 40%. Il Pathobiological Determinants of Atherosclerosis
in Youth (PDAY) Study ha dimostrato una relazione significativa
tra peso del grasso addominale ed estensione dell’aterosclerosi
riscontrata durante l’autopsia di soggetti fra i 15 e i 34 anni. Il
Bogalusa Heart Study, condotto su oltre 3000 bambini e adolescenti, ha fornito i dati longitudinali più completi sul rapporto tra
la presenza e la gravità dei fattori di rischio di CHD e la gravità
(parzialmente quantificabile) dell’aterosclerosi.
L’“ipotesi dell’origine fetale” è basata sull’osservazione che i
bambini nati sottopeso presentano una maggiore incidenza di
malattie cardiache da adulti. Studi epidemiologici confermano
inoltre l’idea che le condizioni prenatali e postnatali influenzino
la salute dell’adulto. I bambini con un peso elevato rispetto all’età
gestazionale e con una madre diabetica o obesa presentano un
rischio maggiore di sviluppare una “sindrome metabolica” (resistenza all’insulina, diabete di tipo II, obesità, CHD). L’allattamento al seno di neonati pretermine ha un effetto cardioprotettivo
a lungo termine, oltre i 13-16 anni. I bambini allattati al seno,
divenuti adolescenti, presentano concentrazioni ridotte di proteina C-reattiva e un rapporto tra LDL (Low-Density Lipoproteins,
lipoproteine a densità ridotta) e HDL del 14% inferiore rispetto
ai bambini allattati artificialmente.
Anche la povertà è associata a esiti negativi sulla salute. In
Irlanda del Nord, lo Young Hearts Project ha dimostrato che i
fattori di rischio comportamentale sono influenzati dallo status
socioeconomico e risultano già ben stabiliti nell’adolescenza, malgrado non emergano differenze biologiche evidenti.
LIPIDI EMATICI E ATEROGENESI
Numerosi studi epidemiologici hanno dimostrato l’associazione
tra l’ipercolesterolemia e la malattia aterosclerotica. I progressi
nelle tecniche di laboratorio per la misura di altre lipoproteine
selezionate hanno contribuito alla nostra comprensione del ruolo
dei lipidi ematici nell’insorgenza delle malattie cardiache. La possibilità di misurare sottoclassi di lipidi e marker infiammatori ha
ulteriormente chiarito il processo di aterogenesi e di rottura delle
placche responsabile delle sindromi coronariche acute. L’aterosclerosi colpisce prevalentemente le arterie coronariche, ma coinvolge
spesso anche l’aorta, le arterie degli arti inferiori e le carotidi.
Lo stadio iniziale dello sviluppo dell’aterosclerosi è contrassegnato dalla disfunzione endoteliale e dall’ispessimento dell’intima-media nei preadolescenti con fattori di rischio come l’obesità
o l’ipercolesterolemia familiare. Il complesso processo di penetrazione della parete dei vasi può essere dovuto a una varietà di
insulti, inclusa la presenza di particelle LDL ossidate altamente
tossiche. Linfociti e monociti penetrano il rivestimento endoteliale danneggiato, trasformandosi in macrofagi carichi di lipidi
LDL e in seguito in cellule schiumose. Tale accumulo è controbilanciato dalle particelle HDL capaci di rimuovere i depositi di
■
■
Difetti del metabolismo lipidico
603
lipidi dalle pareti dei vasi. La formazione di placche è accelerata
da una processo infiammatorio, dato dall’aumento della proteina C reattiva che coinvolge macrofagi e pareti delle arterie. La
deposizione di lipidi all’interno del rivestimento subendoteliale
conduce alla formazione di strie lipidiche macroscopiche, fino
a un certo grado ancora reversibili. Lo stadio successivo dello
sviluppo delle placche determina il danneggiamento delle cellule
muscolari lisce, stimolate dal rilascio di citochine tissutali e fattori di crescita. L’ateroma è composto da un nucleo di sostanza
lipidica, separato dal lume tramite il collagene e i muscoli lisci
(Fig. 86-6). La crescita della placca aterosclerotica può provocare
l’ischemia del tessuto irrorato dall’arteria. L’infiammazione cronica dell’ateroma, forse causata da agenti infettivi come Chlamydia
pneumoniae, provoca l’instabilità della placca e la conseguente
rottura. L’aderenza delle piastrine conduce alla formazione di
emboli nel sito della rottura, causando un infarto miocardico o
un evento cerebrovascolare.
METABOLISMO E TRASPORTO DELLE LIPOPROTEINE
PLASMATICHE
Le anomalie del metabolismo delle lipoproteine sono associate a diabete mellito e aterosclerosi prematura. Le lipoproteine
sono complessi solubili di lipidi e proteine, che influiscono sul
trasporto dei lipidi assorbiti attraverso la dieta o sulla sintesi
da parte di fegato e tessuti adiposi (per l’utilizzazione e l’immagazzinamento). I lipidi alimentari sono trasportati dall’intestino
tenue sotto forma di chilomicroni. I lipidi sintetizzati dal fegato come lipoproteine a densità molto bassa (VLDL, Very Low
Density Lipoproteins) sono catabolizzati a lipoproteine a densità
intermedia (IDL, Intermediate Density Lipoproteins) e a densità
ridotta (LDL). Le proteine ad alta densità (HDL) sono coinvolte
nel metabolismo di VLDL e chilomicroni, nonché nel trasporto
di colesterolo. Gli acidi grassi liberi non esterificati sono lipidi
metabolicamente attivi derivati dalla lipolisi di trigliceridi immagazzinati nel tessuto adiposo che si lega all’albumina per circolare
nel plasma (Fig. 86-7).
Le lipoproteine sono costituite da un nucleo centrale di trigliceridi e colesteril esteri (CE) circondato da fosfolipidi, colesterolo e
proteine (Fig. 86-8). La densità delle diverse classi di lipoproteine
è inversamente proporzionale al rapporto lipidi-proteine (Fig.
86-9). Le proteine costituenti sono chiamate apolipoproteine
(Tab. 86-7). Oltre al loro ruolo strutturale, sono responsabili di
una varietà di funzioni metaboliche, inclusa quella di cofattori o
inibitori di vie enzimatiche e mediatori del legame tra lipoproteine e recettori della superficie cellulare. ApoA è la principale apolipoproteina HDL; ApoB è presente nelle LDL, VLDL, IDL e nei
chimomicroni; ApoB-100 è derivata dal fegato, mentre apoB-48
proviene dall’intestino tenue. ApoC-I, C-II e C-III sono piccoli
peptidi importanti nel metabolismo dei trigliceridi. ApoE, presente nelle VLDL, HDL, nei chilomicroni e nei residui di chilomicroni, svolge un ruolo notevole nella clearance dei trigliceridi.
Arteria
Tonaca avventizia
Figura 86-6. Lo stadio precoce dello sviluppo
dell’aterosclerosi inizia con la penetrazione del
rivestimento della parete dei vasi da parte delle
cellule infiammatorie. La deposizione di lipidi
all’interno del rivestimento endoteliale dell’arteria conduce alla distruzione delle cellule muscolari lisce, per formare un nucleo lipidico ateromatoso, che preme sul lume. L’infiammazione cronica
causa l’instabilità della placca, con conseguente
rottura e completa occlusione del lume in seguito
a formazione di coagulo.
Monocita/
Macrofago
Cellule muscolari
lisce
Lume
Intima
Endotelio
Tonaca media
Endotelio
Cellule muscolari
lisce
84-92ANA.indd 603
Strato
subendoteliale
Nucleo lipidico
23-09-2008 11:52:05
604
■
PARTE X
■
Malattie metaboliche
Muscolo FFA
Adipe
Chilomicrone
Letto vascolare
LPL
Figura 86-7. Vie metaboliche esogena, endogena e inversa del
colesterolo. La via esogena trasporta i grassi alimentari dall’intestino tenue al fegato e alla periferia, in forma di chilomicroni.
La via endogena conduce alla secrezione di lipoproteine a densità
molto bassa (VLDL) dal fegato e al loro catabolismo in proteine a densità intermedia (IDL) e lipoproteine a bassa densità
(LDL). I trigliceridi sono idrolizzati dalle particelle di VLDL
grazie all’azione della lipoprotein-lipasi (LPL) nel letto vascolare,
con conseguente formazione di acidi grassi liberi (FFA, Free Fatty
Acid), per l’utilizzazione e l’immagazzinamento nei muscoli e nel
tessuto adiposo. Il metabolismo delle lipoproteine ad alta densità
(HDL) è responsabile del trasporto del colesterolo in eccesso dai
tessuti periferici al fegato, dove viene escreto nella bile. Le particelle di HDL-3 nascenti derivate dal fegato e dall’intestino tenue
sono esterificate nelle più mature particelle HDL-2 dal movimento (mediato da enzimi) di chilomicroni e VLDL nel nucleo delle
HDL, rimosso dalla circolazione mediante endocitosi.
VLDL
Residuo
di chilomicrone
Vasi linfatici
IDL
LDL
Via
esogena
Via
endogena
Fegato
Trasporto
inverso
del colesterolo
HDL 3
HDL 2
VLDL
Intestino tenue
Tessuti
periferici
Chilomicrone
TRASPORTO DEI LIPIDI ESOGENI (ALIMENTARI). Tutti i lipidi alimentari, fatta eccezione per i trigliceridi a catena media, sono
efficacemente trasportati nella circolazione mediante drenaggio
linfatico dalla muscosa intestinale. I trigliceridi e il CE si combinano con apoA e apoB-48 nella mucosa intestinale per formare
chilomicroni, trasportati nella circolazione periferica attraverso il
sistema linfatico. Le particelle di HDL donano ai chilomicroni gli
apoC-II richiesti per l’attivazione della lipoproteina lipasi (LPL)
all’interno dell’endotelio capillare dei tessuti adiposo, cardiaco
e muscoloscheletrico. Gli acidi grassi liberi sono ossidati, riesterificati per essere immagazzinati come trigliceridi o rilasciati
nella circolazione legati all’albumina per essere trasportati nel
fegato. Dopo l’idrolisi del nucleo dei TG, le particelle di apoC
ritornano nelle HDL. Il successivo contributo di apoE ai residui
di chilomicroni facilita il legame tra questa particella e i recettori
epatici per LDL (LDL-R). All’interno dell’epatocita, il residuo di
chilomicrone può essere incorporato nelle membrane, riescreto
come lipoproteina nella circolazione o secreto come acido biliare.
Normalmente tutti i lipidi introdotti con la dieta sono eliminati
entro 8 ore dal pasto, fatta eccezione per gli individui con un
disturbo del metabolismo dei chilomicroni. L’iperlipidemia postprandiale è un fattore di rischio per l’aterosclerosi. L’anomalo trasporto di chilomicroni e dei loro residui può determinare il loro
assorbimento nelle pareti dei vasi sanguigni in forma di cellule
schiumose, causate dall’ingestione di CE da parte dei macrofagi
(stadio iniziale dello sviluppo delle strie lipidiche).
TRASPORTO DI LIPIDI ENDOGENI DAL FEGATO. La via endogena
delle lipoproteine consiste nella formazione e secrezione delle
VLDL dal fegato e nel catabolismo in particelle IDL e LDL.
Gli acidi grassi usati nella formazione epatica delle VLDL so-
1,20
HDL
1,10
Fosfolipide
Colesterolo
non
esterificato
Densità g/mL
Colesterolo estere
LDL
1,06
IDL
1,02
VLDL
1,006
1,00
APOB-100
5
10
20
40
60
80
1000
Diametro, mm
Lipoproteina a bassa densità
Figura 86-8. Modello schematico di una lipoproteina a bassa densità (LDL),
costituita da un nucleo centrale di colesteril esteri circondato da fosfolipidi,
colesterolo e proteine.
84-92ANA.indd 604
Figura 86-9. La densità delle diverse classi di lipoproteine è inversamente
proporzionale al rapporto tra i lipidi e le proteine. Dato che i lipidi sono meno
densi, più ne sono contenuti nella particella, maggiori sono le dimensioni della
stessa, mentre la sua densità decresce. HDL, lipoproteine ad alta densità; LDL,
lipoproteine a bassa densità; IDL, lipoproteine a densità intermedia; VLDL,
lipoproteine a densità molto bassa.
23-09-2008 11:52:06
Capitolo 86
■
Difetti del metabolismo lipidico
■
605
TABELLA 86-7. Caratteristiche delle lipoproteine principali
LIPOPROTEINA*
Chilomicroni
Residuo di chilomicrone
VLDL
IDL
LDL
HDL
ORIGINE
Intestino
Chilomicroni
Fegato, intestino
VLDL
VLDL
Fegato, intestino, VLDL,
chilomicroni
DIMENSIONI (nm)
80-1200
40-150
30-80
25-35
18-25
5-20
DENSITÀ (g/mL)
0,95
1,0006
0,95-1,006
1,006-1,019
1,019-1,063
1,125-1,210
COMPOSIZIONE %
PROTEINE
LIPIDI
1-2
98-99
6-8
92-94
7-10
90-93
11
89
21
79
32-57
43-68
APOLIPOPROTEINE*
C-I, C-II, C-III, E, A-I, A-II, A-IV, B-48
B-48, E
B-100, C-I, C-II, C-III
B-100, E
B-100
A-I, A-II, A-IV, C-I, C-II, C-III, D, E
*Le lipoproteine sono costituite da un nucleo centrale di trigliceridi e colesteril estere circondato da fosfolipidi, colesterolo e proteine. Le proteine costituenti sono chiamate apolipoproteine.
HDL, lipoproteine ad alta densità; LDL, lipoproteine a bassa densità; IDL, lipoproteine a densità intermedia; VLDL, lipoproteine a densità molto bassa.
no derivati principalmente dall’assorbimento dalla circolazione.
Le VLDL (composte da trigliceridi, colesteril esteri, fosfolipidi
e apoB-100) sono trasportate dal fegato con la stessa rapidità
con cui vengono sintetizzate. Le particelle di VLDL secrete nella
circolazione si combinano con le apoliproteine C ed E. Le loro
dimensioni sono determinate dalla quantità di trigliceridi presenti, che si rimpiccioliscono progressivamente a mano a mano che
i TG sono idrolizzati dall’azione di LPL, producendo acidi grassi
liberi per l’utilizzazione o l’immagazzinamento nei muscoli o nel
tessuto adiposo. L’idrolisi dell’80% dei TG presenti nelle VLDL
produce IDL contenenti una identica quantità di colesterolo e
TG e i cui residui sono convertiti in LDL, da rilasciare nei tessuti
periferici o nel fegato. ApoE si lega a questi residui per consentire
il legame con le cellule e la successiva incorporazione nei lisosomi.
Gli individui con deficit di apoE2 o di trigliceridi lipasi epatica
accumulano IDL nel plasma.
Le particelle di LDL contengono il 70% del colesterolo plasmatico negli individui normali. I recettori LDL sono presenti
sulla superficie di quasi tutte le cellule. La maggior parte delle
LDL sono assorbite dal fegato e il resto è trasportato ai tessuti
periferici, come le ghiandole surrenali e la gonadi (per la sintesi
steroidea). La dislipidemia è enormemente influenzata dall’attività delle LDL-R. Anche l’efficienza della conversione delle VLDL
in LDL svolge un ruolo importante nell’omeostasi lipidica.
HDL E TRASPORTO INVERSO DEL COLESTEROLO. Dal momento che
la secrezione epatica di lipidi nella bile è l’unico meccanismo per
la rimozione del colesterolo dal corpo, il trasporto del colesterolo
in eccesso dalle cellule periferiche da parte delle HDL costituisce
una funzione vitale. Le HDL sono cariche di apoA-I contenente
lipoproteine non aterogeniche (a differenza delle lipoproteine B).
Le particelle di HDL a ridotto contenuto di colesterolo secrete
da fegato e intestino tenue sono esterificate nelle più mature particelle HDL-2, mediante l’azione dell’enzima lecitina-colesterolo
aciltransferasi (LCAT), che facilita il movimento dei chilomicroni
e delle VLDL nel nucleo della HDL. Le HDL-2 possono riportare
i colesteril esteri alle lipoproteine apoB, con la mediazione della
proteina di trasferimento del colesterolo esterificato; oppure le
particelle ricche di colesterolo sono rimosse dal plasma da parte
degli endociti, completando il trasporto inverso del colesterolo.
Ridotti livelli di HDL possono essere genetici (deficit di apoA-I)
o secondari all’incremento dei TG plasmatici.
IPERLIPOPROTEINEMIA
IPERCOLESTEROLEMIA (TAB. 86-8)
Ipercolesterolemia familiare (FH). La FH (Familiar Hypercholesterolemia) è una malattia monogenica autosomica codominante
causata da mutazioni che colpiscono il recettore LDL. È caratterizzata da un impressionante aumento del colesterolo LDL,
da malattia cardiovascolare precoce e da xantomi tendinei. Gli
studi molecolari hanno consentito di identificare cinque classi di
mutazioni che compromettono la capacità del colesterolo LDL
di legarsi al recettore LDL. Alcune delle 800 mutazioni descritte
alterano la sintesi del recettore LDL (recettore negativo), mentre
altre danneggiano la capacità di legame o determinano il rilascio
nell’interfaccia lipoproteina-recettore. Tali mutazioni negative
provocano fenotipi più gravi rispetto alle mutazioni responsabili
di deficit del recettore.
FH omozigote. Gli omozigoti FH ereditano due geni per il recettore LDL anomalo, con conseguente marcato aumento del
colesterolo plasmatico a livelli che raggiungono i 500-1200 mg/
dL. La concentrazione dei trigliceridi resta normale o lievemente
elevata, mentre i livelli di HDL possono risultare lievemente ridotti. Questa malattia colpisce 1/1 000 000 persone. Nei pazienti
con recettore negativo l’attività recettoriale è ridotta a 2% del
normale, mentre i soggetti con recettore deficitario, nei quali il
25% dell’attività è preservato, hanno una prognosi migliore.
La prognosi è comunque negativa a prescindere dal tipo di
aberrazione del recettore LDL. Fino dall’infanzia è presente grave
aterosclerosi, che coinvolge la radice aortica e le arterie coronariche. La malattia può esordire con xantomi, che causano un
ispessimento del tendine di Achille o dei tendini estensori delle
TABELLA 86-8. Iperlipoproteinemia
DISTURBO
Ipercolesterolemia familiare
Deficit familiare di ApoB-100
Ipercolesterolemia autosomica recessiva
Sitosterolemia
Ipercolesterolemia poligenica
Iperlipidemia combinata familiare (FCHL)
Disbetalipoproteinemia familiare
Chilomicronemia familiare (Frederickson di tipo I)
Ipertrigliceridemia familiare (Frederickson di tipo IV)
Ipertrigliceridemia familiare (Frederickson di tipo V)
Deficit della lipasi epatica familiare
LIPOPROTEINE ELEVATE
LDL
LDL
LDL
LDL
LDL
LDL, TG
LDL, TG
TG ↑↑
TG ↑
TG ↑↑
VLDL
REPERTI CLINICI
Xantoma tendineo, CHD
Xantoma tendineo, CHD
Xantoma tendineo, CHD
Xantoma tendineo, CHD
CHD
CHD
Xantoma tubero-eruttivo, malattia vascolare periferica
Xantoma eruttivo, epatosplenomegalia, pancreatite
±CHD
Xantoma ±CHD
CHD
GENETICA
AD
AD
AR
AR
AD
AD
AR
AD
AD
AR
INCIDENZA STIMATA
1/500
1/1000
1/1 000 000
1/1 000 000
1/30?
1/200
1/10 000
1/1 000 000
1/500
1/1 000 000
AD, autosomica dominante; AR, autosomica recessiva; CHD, malattia coronarica cardiaca; LDL, lipoproteine a bassa densità; TG, trigliceridi; VLDL, lipoproteine a densità molto bassa.
84-92ANA.indd 605
23-09-2008 11:52:06
606
■
PARTE X
■
Malattie metaboliche
mani, oppure con lesioni cutanee localizzate su mani, gomiti,
ginocchia o natiche (Figg. 86-10, 86-11 e 86-12). Può essere presente arco corneale. La storia familiare rivela spesso la prevalenza
di malattie cardiache premature nei parenti di entrambi i genitori.
La diagnosi può essere confermata dalla misura dell’attività del
recettore LDL su colture di fibroblasti cutanei. L’espressione fenotipica della malattia può essere valutata anche mediante misura
dell’attività recettoriale sulla superficie dei linfociti, utilizzando il
separatore cellulare o sorter.
I pazienti omozigoti non trattati raramente sopravvivono fino all’età adulta. La morte improvvisa in seguito all’insorgenza
di sintomi di insufficienza coronarica è un’evenienza comune.
L’aferesi LDL, per rimuovere selettivamente le particelle di LDL
dalla circolazione, è consigliata in molti bambini, nel tentativo
di rallentare la progressione dell’aterosclerosi. Anche il trapianto
di fegato si è dimostrato efficace nel ridurre i livelli di colesterolo
LDL, ma le complicanze legate all’immunosoppressione sono comuni. Gli inibitori della HGM CoA reduttasi sono spesso efficaci
su specifiche classi di recettori LDL deficitari. L’associazione di
ezetimibe, che blocca selettivamente l’assorbimento di colesterolo nell’intestino e che oggi ha ampiamente sostituito l’uso dei
chelanti degli acidi biliari, consente un ulteriore modesto declino
dei livelli di LDL.
FH eterozigote. È una delle mutazioni di gene singolo più comuni
associate a sindromi coronariche acute, aterosclerosi e coronaropatia (CHD) negli adulti. La sua prevalenza mondiale è di
1/500 individui, ma la frequenza in popolazioni specifiche come i
franco-canadesi, gli afrikaner e i libanesi cristiani può raggiungere
1/250, a causa dell’effetto fondatore di nuove mutazioni uniche.
Figura 86-12. Xantoma eruttivo sulla superficie esterna dell’avambraccio. (Da
Durrington P: Dyslipidemia, Lancet 2003; 362: 717-731.)
Figura 86-10. Xantoma del tendine di Achille (ipercolesterolemia eterozigote
familiare). (Da Durrington P: Dyslipidemia, Lancet 2003; 362: 717-731.)
Figura 86-11. Xantoma striato palmare. (Da Durrington P: Dyslipidemia,
Lancet 2003; 362: 717-731.)
84-92ANA.indd 606
Nelle società occidentali, le malattie cardiache sono responsabili di oltre il 50% dei decessi. La patogenesi della CHD è al
tempo stesso ambientale e genetica; l’espressione fenotipica della
malattia è determinata dalle complesse interazioni tra questi due
fattori. Per esempio, i cinesi con FH eterozigote che vivono in
Cina hanno un livello di colesterolo medio pari a 168 mg/dL,
mentre nei cinesi emigrati in Canada il livello sale a 288 mg/dL.
Questa impressionante disparità nei livelli di lipoproteine collegata alla localizzazione geografica è destinata a ridursi progressivamente, in seguito alla diffusione in Cina di abitudini dietetiche
e stili di vita occidentali.
Dal momento che la condizione di eterozigote FH è codominante con penetranza pressoché completa, il 50% dei parenti di primo
grado degli individui colpiti e il 25% dei parenti di secondo grado
svilupperanno la malattia. Si stima che l’FH colpisca 10 milioni di
persone nel mondo. I sintomi di CHD solitamente esordiscono tra
i 45-48 anni negli uomini e dieci anni dopo nelle donne.
L’Organizzazione Mondiale della Sanità (OMS) ha elaborato
una serie di strategie di intervento individualizzate per contrastare gli effetti dell’FH su morbilità e mortalità. Una percentuale
relativamente ridotta della popolazione presenta una quota sproporzionata di disturbi cardiovascolari. L’espressione clinica della
malattia è inequivocabile e il trattamento è efficace.
La storia familiare riveste un’importanza fondamentale nel
suggerire la diagnosi. Se dall’anamnesi risultano episodi di CHD
o un’ipercolesterolemia dei genitori, il bambino andrebbe sottoposto a esame del colesterolo plasmatico.
I livelli plasmatici di colesterolo LDL non consentono la diagnosi inequivocabile di FH eterozigote, ma i valori sono generalmente doppi rispetto a quelli normali per l’età, a causa dell’allele
disfunzionale o assente. Il programma MED-PED (Make Early
23-09-2008 11:52:06
Capitolo 86
Diagnosis-Prevent Early Death), elaborato in Utah, prevede una
serie di criteri diagnostici. Protocolli analoghi sono stati formulati
anche nel Regno Unito e in Olanda. La diagnosi in famiglie FH
ben definite si basa su soglie di selezione delle LDL. In famiglie mai diagnosticate in precedenza, per la formulazione della
diagnosi sono richieste soglie di selezione più elevate e criteri
più rigorosi, che dimostrino il modello ereditario autosomico.
Con il livello di colesterolo totale di 310 mg/dL, soltanto il 4%
delle persone della popolazione generale presenta FH, mentre
la percentuale sale al 95% nei soggetti parenti di primo grado
di individui malati. La probabilità matematica di FH, verificata
dalla genetica molecolare, si basa su una coorte di popolazione
statunitense e può non essere applicabile in altri Paesi.
Livelli molto elevati di colesterolo nei bambini suggeriscono
l’opportunità di effettuare uno screening dei parenti di primo e
secondo grado (screening “inverso” per il colesterolo). Un bambino o adolescente (di età inferiore ai 18 anni) con un livello di
colesterolo plasmatico di 270 mg/dL e/o LDL-C di 200 mg/dL
ha una probabilità dell’88% di essere affetto da FH. In presenza
di un parente di primo grado con FH dimostrata, la diagnosi è
virtualmente certa (Tab. 86-9). Per diagnosticare una probabile
FH in un bambino con genitore affetto, è sufficiente un’elevazione modesta del colesterolo totale (a 220 mg/dL; LDL-C 155
mg/dL).
Il trattamento dei bambini con FH dovrebbe cominciare con
una dieta a ridotto contenuto di grassi (vedi oltre), ma essa da
sola non è sufficiente a riportare i livelli di colesterolo a valori
accettabili (LDL-C 130 mg/dL). L’Expert Panel on Blood Cholesterol Levels in Children and Adolescents (National Cholesterol
Education Program) ha promulgato una serie di linee guida per
la somministrazione di farmaci in grado di ridurre il livello di
colesterolo nei bambini (di età superiore ai 10 anni). La terapia
farmacologica dovrebbe essere presa in considerazione in caso
di LDL-C 160 mg/dL e in presenza di una storia familiare di
malattia cardiaca precoce; in assenza di tale storia (per es. se il
bambino è stato adottato), valori 190 mg/dL consigliano l’opportunità della terapia.
Attualmente i chelanti degli acidi biliari sono usati di rado,
sebbene ne sia stata dimostrata la sicurezza, a causa della scarsa
compliance da parte dei pazienti e dei risultati insoddisfacenti.
L’ezetimibe blocca l’assorbimento di colesterolo nel tratto gastrointestinale e implica un rischio ridotto di effetti collaterali.
Dati preliminari suggeriscono che l’ezetimibe possa ridurre il co-
TABELLA 86-9. Percentuale di giovani al di sotto dei 18 anni nella quale
si prevede la presenza di FH sulla base dei livelli di colesterolo di genitori
e parenti prossimi con FH
COL. TOTALE
(mg/dL)
180
190
200
210
220
230
240
250
260
270
280
290
300
310
COL. LDL
(mg/dL)
122
130
138
147
155
164
172
181
190
200
210
220
230
210
PRIMO
GRADO
7,2
13,5
26,4
48,1
73,1
90,0
97,1
99,3
99,9
100,0
100,0
100,0
100,0
100,0
PERCENTUALE CON FH A QUEL LIVELLO
GRADO DI PARENTELA
TERZO
POPOLAZIONE
SECONDO
GRADO
GRADO
GENERALE
2,4
0,9
0,01
5,0
2,2
0,03
10,7
4,9
0,07
23,6
11,7
0,19
47,5
27,9
0,54
75,0
56,2
1,8
93,7
82,8
6,3
97,6
95,3
22,2
99,5
99,0
57,6
99,9
99,8
88,0
100,0
100,0
97,8
100,0
100,0
99,6
100,0
100,0
99,9
100,0
100,0
100,0
Col., colesterolo; FH, ipercolesterolemia familiare; LDL, lipoproteina a bassa densità.
Da Williams RR, Hunt SC, Schumacher MC et al, Diagnosing heterozygous familial hypercholesterolemia using new practical
criteria validated by molecular genetics. Am J Cardiol 1993;72: 171-176.
84-92ANA.indd 607
■
Difetti del metabolismo lipidico
■
607
lesterolo totale di 20-30 mg/dL, ma il farmaco non è stato ancora
valutato nei bambini con trial clinici controllati. Gli inibitori della
HMG CoA reduttasi sono diventati il farmaco di elezione per il
trattamento dell’FH, grazie all’estrema efficacia e ottimo profilo
di sicurezza. I dati clinici disponibili ne dimostrano l’efficacia
anche nei bambini e i rischi di elevazione degli enzimi epatici e di
miosite non sono superiori rispetto agli adulti (vedi oltre).
Deficit familiare di ApoB-100 (FDB). L’FDB (Familial Defective
apoB) è una malattia autosomica dominante indistinguibile dalla eterozigote FH. I livelli di colesterolo LDL sono aumentati,
mentre i trigliceridi risultano normali; gli adulti sviluppano spesso xantoma tendineo e CHD prematura. L’FDB è causato da
una mutazione nella regione legante il recettore dell’apoB-100,
il ligando del recettore LDL. La frequenza nelle popolazioni di
culture occidentali è di circa 1/700. La mutazione responsabile è
solitamente una sostituzione della glutammina per l’arginina in
posizione 3500 in apoB-100, che determina una riduzione della
capacità del recettore LDL di legare il colesterolo LDL, impedendone così la rimozione dalla circolazione. Test di laboratorio
specifici sono in grado di distinguere tra FDB e FH, ma visto che
il trattamento è identico, questa diagnosi differenziale è utile solo
a fini di ricerca.
Ipercolesterolemia autosomica recessiva. Questa rara malattia,
causata da un difetto del recettore LDL che media l’endocitosi
nel fegato, si presenta con una grave ipercolesterolemia, a livelli
intermedi tra quelli riscontrati nella FH omozigote e in quella eterozigote. Particolarmente frequente nei sardi, risponde moderatamente al trattamento con gli inibitori dell’HMG CoA reduttasi.
Sitosterolemia. Rara malattia autosomica recessiva caratterizzata da un eccessivo assorbimento di steroli, causata da mutazioni
nel sistema della proteina ATP-binding cassette transporter, responsabile della limitazione dell’assorbimento di steroli nell’intestino tenue e della promozione dell’escrezione biliare delle piccole
quantità assorbite. I livelli di colesterolo plasmatico possono
risultare gravemente aumentati, provocando xantomi tendinei e
aterosclerosi prematura. La diagnosi può essere confermata mediante la misurazione dei livelli plasmatici di sitosterolo. Il trattamento con gli inibitori dell’HGM CoA reduttasi non è efficace,
mentre sono utili gli inibitori dell’assorbimento di colesterolo
(come l’ezetimibe e i chelanti degli acidi biliari).
Ipercolesterolemia poligenica. L’elevazione primaria del colesterolo LDL in bambini e adulti è spesso poligenica; gli effetti di vari
geni sono potenziati dalle influenze ambientali (in primo luogo
dalla dieta). I livelli plasmatici di colesterolo sono moderatamente
aumentati, mentre quelli dei trigliceridi sono nella norma. L’ipercolesterolemia poligenica si riscontra in famiglie i cui membri
condividono lo stesso stile di vita, ma non segue un modello
ereditario prevedibile (a differenza dei difetti dei geni singoli). Il
trattamento dei bambini con ipercolesterolemia poligenica consiste nel promuovere uno stile di vita più sano, riducendo l’apporto
di grassi saturi ed effettuando attività fisica regolare (almeno
un’ora al giorno). L’instaurazione di una terapia farmacologica
per la riduzione del colesterolo è raramente necessaria.
IPERCOLESTEROLEMIA CON IPERTRIGLICERIDEMIA
Iperlipidemia familiare combinata (FCHL). La FCHL (Familial
Combined HyperLipidemia) è una malattia autosomica dominante caratterizzata da un moderato aumento di colesterolo LDL
e di trigliceridi nel plasma e da una riduzione del livello plasmatico
di colesterolo HDL. Con una frequenza di 1/200, è l’alterazione primitiva del metabolismo lipidico più comune. Non è stata
evidenziata alcuna aberrazione metabolica singola che colleghi
FCHL con l’aterogenesi, ma è dimostrato che il 20% degli individui che sviluppa CHD entro i 60 anni presenta FCHL. La storia
familiare di malattia cardiaca precoce è tipicamente positiva; la
diagnosi formale richiede che almeno due parenti di primo grado
presentino una delle tre varianti della dislipidemia: (1) colesterolo
LDL nel plasma 90º percentile; (2) colesterolo LDL e trigliceridi
90º percentile; (3) trigliceridi 90º percentile. Alcuni individui
possono passare da un fenotipo a un altro. Gli xantomi non
compaiono. La diagnosi è avvalorata dal riscontro di un aumento
23-09-2008 11:52:08
608
■
PARTE X
■
Malattie metaboliche
dei livelli plasmatici di apoB, con incremento delle particelle LDL
piccole e dense.
Bambini e adulti con FCHL presentano anche adiposità, ipertensione e iperinsulinemia; questi reperti suggeriscono la presenza
di una sindrome metabolica, la cui diagnosi formale è definita
dal NCEP’s Adult Treatment Panel III (ATP III), che identifica
sei componenti principali: obesità addominale, dislipidemia aterogenica, ipertensione, resistenza all’insulina con o senza compromissione della tolleranza al glucosio, infiammazione vascolare
e ipercoagulabilità. Si stima che il 30% degli adulti sovrappeso
soddisfi i criteri per la diagnosi di sindrome metabolica (inclusi i
due terzi con FCHL). Gli ispanici e gli asiatici del subcontinente
indiano meridionale sono particolarmente suscettibili.
I meccanismi responsabili dell’associazione tra adiposità viscerale, sindrome metabolica e diabete di tipo II non sono stati
ancora completamente precisati. Un principio unificante plausibile è la constatazione che l’obesità causa stress del reticolo
endoplasmatico, con conseguente soppressione della segnalazione
del recettore dell’insulina, calo della resistenza all’insulina e aumento della risposta infiammatoria. Come tutto ciò si colleghi
all’aterogenesi non è chiaro. Si ipotizza che l’ipercolesterolemia
e forse anche l’ipertrigliceridemia aumentino il rischio di malattia
cardiovascolare in pazienti con FCHL. Quando le caratteristiche
della sindrome metabolica sono incluse in modelli logistici, la
condivisione di parametri eziologici come l’aumento dell’adiposità viscerale diviene evidente. Quest’ultimo fatto avviene anche
con l’età e, malgrado la scarsità dei dati a riguardo, costituisce
certamente un fattore di rischio per malattia cardiaca e diabete
nei bambini. Misurazioni longitudinali della circonferenza addominale e la determinazione del grasso intra-addominale mediante
RM sono attualmente in fase di sperimentazione, ma nella pratica
pediatrica l’indice di massa corporea è tuttora il più utilizzato per
valutare l’adiposità.
La sindrome metabolica fornisce una drammatica dimostrazione dell’interazione tra fattori genetici e ambientali. La suscettibilità genetica è essenziale per l’insorgenza della malattia cardiaca
prematura in individui con FCHL. Ma uno stile di vita poco
salutare, una dieta scorretta e la mancanza di attività fisica contribuiscono all’obesità e alle altre caratteristiche della sindrome
metabolica. La modifica dello stile di vita costituisce un elemento
imprescindibile della terapia. Ciò include una dieta povera di
grassi saturi, grassi trans, colesterolo e zuccheri. È importante
inoltre aumentare il consumo di frutta e di verdure e praticare
un’ora di attività fisica moderata al giorno. La compliance da
parte di bambini e genitori costituisce spesso un problema; una
modifica graduale delle abitudini ha più probabilità di successo
rispetto a una dieta drastica e aggressiva. È fondamentale che i
genitori del bambino (o il caregiver) siano coinvolti nel processo
terapeutico. I livelli plasmatici di trigliceridi tendono a rispondere alle restrizioni dietetiche (in particolare all’eliminazione delle
bibite dolcificate). I livelli ematici di colesterolo possono scendere
del 10-15%, ma se il colesterolo LDL resta 160 mg/dL è opportuno prendere in considerazione la terapia farmacologica.
Disbetalipoproteinemia familiare (FDBL, iperlipoproteinemia di
tipo II). La FDBL (Familial DysBetaLipoproteinemia) è causata
da mutazioni del gene per l’apolipoproteina E (apoE), che se
viene esposta a influenze ambientali (come una dieta ricca di
grassi o troppo calorica, o un eccessivo consumo di alcol), può
condurre a un tipo misto di iperlipidemia. I pazienti mostrano
un aumento simile di colesterolo e trigliceridi nel plasma. A
differenza delle altre cause di ipertrigliceridemia associate a una
riduzione di HDL, il colesterolo HDL è normale. Questo raro
disturbo colpisce 1/10 000 persone. ApoE media la rimozione
dalla circolazione di chilomicroni e residui di VLDL legandosi ai
recettori di membrana degli epatociti. Il gene polimorfico apoE
si esprime in tre isoforme: apoE3, apoE2 e apoE4. E4 è l’allele “normale”, presente nella maggior parte della popolazione.
L’isoforma apoE2 presenta un’affinità inferiore per il recettore
LDL e ha una frequenza del 7%. L’1% circa della popolazione
è omozigote per apoE2/E2, la più comune mutazione associata
con FDBL, ma soltanto una minoranza esprime la malattia.
84-92ANA.indd 608
L’espressione richiede una patologia scatenante, come il diabete,
l’obesità, la malattia renale o l’ipotiroidismo. Gli individui omozigoti per apoE4/E4 sono a rischio per la malattia di Alzheimer
a esordio tardivo.
Nella maggior parte dei pazienti con FDBL, la malattia si
presenta in età adulta con caratteristici xantomi. Gli xantomi
tuberoeruttivi somigliano a grappoli d’uva e si sviluppano su
ginocchia, natiche e gomiti. Un’altra caratteristica tipica è la colorazione giallo-arancio delle pieghe delle mani (xantoma palmare).
L’aterosclerosi, che si presenta spesso come malattia vascolare
periferica, può insorgere nella quarta o quinta decade. Nei bambini la malattia tende a esordire con un’eruzione cutanea meno
riconoscibile, solitamente in seguito a una malattia scatenante.
La diagnosi di FDBL è stabilita mediante elettroforesi delle
lipoproteine, che dimostra un aumento della banda beta contente i residui delle stesse. La misura diretta della VLDL mediante ultracentrifugazione è eseguita in laboratori specialistici. Un
rapporto VLDL/trigliceridi totali 0,30 conferma la diagnosi.
L’ApoE genotipizzazione per l’omozigosità apoE2 può essere realizzata, confermando la diagnosi in presenza dei reperti obiettivi
caratteristici. Un risultato negativo non esclude necessariamente
la malattia, perché altre mutazioni di apoE possono causare
manifestazioni ancora più gravi.
Il trattamento farmacologico della FDBL è necessario, per ridurre la probabilità di aterosclerosi sintomatica negli adulti. Gli
inibitori dell’HMG CoA reduttasi, l’acido nicotinico e i fibrati
si sono rivelati ugualmente efficaci. La FDBL tende a rispondere
alla restrizione dietetica.
IPERTRIGLICERIDEMIA. Il disturbo familiare caratterizzato da lipoproteine ricche di trigliceridi include varianti rare e comuni
del sistema di classificazione di Frederickson: la chilomicronemia
(tipo I), l’ipertrigliceridemia familiare (tipo IV) e la più grave
forma combinata di ipertrigliceridemia e chilomicronemia (tipo
V). Anche il deficit di lipasi epatica (HL) determina una forma
simile di iperlipidemia combinata.
Chilomicronemia familiare (iperlipidemia di tipo I). Questo raro
difetto di un singolo gene, come l’ipercolesterolemia familiare,
è dovuto a una mutazione che colpisce la clearance delle lipoproteine contenenti apoB. Il deficit o l’assenza della lipoproteina
lipasi (LPL) o del suo cofattore apoC-II (che facilita la lipolisi),
causano un grave aumento plasmatico dei chilomicroni ricchi di
trigliceridi. I livelli di colesterolo HDL diminuiscono. A causa
del marcato ritardo della clearance di queste particelle, il plasma
assume un aspetto lattescente, anche dopo un digiuno prolungato
Figura 86-13. Plasma lattescente di un paziente con dolore addominale acuto.
(Da Durrington P: Dyslipidemia, Lancet 2003; 362: 717-731.)
23-09-2008 11:52:08
Capitolo 86
(Fig. 86-13). La chilomicronemia determinata dal deficit di LPL
è associata a una modesta elevazione dei trigliceridi, che non si
verifica in caso di deficit o assenza di apoC-II. Entrambi i disturbi
si trasmettono con modalità autosomica recessiva, con una frequenza di 1/1 000 000. Solitamente la malattia si presenta durante
l’infanzia con pancreatite acuta. Talvolta compaiono xantomi
eruttivi su braccia, ginocchia e natiche. L’epatosplenomegalia è
frequente. La diagnosi è stabilità mediante dosaggio dell’attività
lipolitica dei trigliceridi. Il trattamento della chilomicronemia
prevede restrizioni dietetiche rigorose e la somministrazione di
vitamine liposolubili. I trigliceridi a catena media assorbiti nel
sistema venoso portale possono aumentare l’assorbimento totale
di grassi e anche l’assunzione di olio di pesce può avere effetti
benefici.
Ipertrigliceridemia familiare (FHTG, iperlipidemia di tipo IV). La
FHTG (Familial HyperTriGlyceridemia) è un disturbo autosomico dominante dall’eziologia sconosciuta, che si verifica in 1/500
individui. È caratterizzato da un aumento 90º percentile dei
trigliceridi plasmatici (range: 250-1000 mg/dL), spesso associato a una lieve elevazione del colesterolo plasmatico e ad una
riduzione di HDL. Solitamente la FHTG non si manifesta fino
all’età adulta, benché sia espressa nel 20% dei bambini colpiti.
A differenza della FCHL, la FHTG non è ritenuta aterogenica.
È probabilmente causata da un deficit del catabolismo delle VLDL oppure, meno frequentemente, dall’iperproduzione di questa
classe di lipoproteine. La diagnosi dovrebbe includere la presenza
di almeno un parente di primo grado con ipertrigliceridemia. La
FHTG deve essere differenziata da FCHL e FDBL, perché queste
ultime richiedono un trattamento più aggressivo, per prevenire
la malattia vascolare coronarica o periferica. La diagnosi differenziale è solitamente possibile sul piano clinico, poiché nella
FHTG si riscontrano ridotti livelli di colesterolo LDL; la misura
dei livelli di apoB può essere utile nelle situazioni più ambigue.
Talvolta si osserva una forma più grave di ipertrigliceridemia,
caratterizzata da un aumento dei livelli di chilomicroni oltre che
delle particelle VLDL (tipo V nella classificazione di Frederickson). I livelli di trigliceridi sono spesso 1000 mg/dL. La malattia
si riscontra raramente nei bambini. A differenza della chilomicronemia (tipo I), il deficit di LPL o apoC-II non è presente. Questi
pazienti sviluppano spesso xantomi eruttivi in età adulta, mentre
negli individui con ipertrigliceridemia di tipo IV questo sintomo
non compare. La malattia può esordire con una pancreatite acuta. Come per le altre ipertrigliceridemie, un eccessivo consumo di
alcol o una terapia con estrogeni possono esacerbare la malattia.
Prima di stabilire la diagnosi di FHTG, è necessario escludere
le altre cause secondarie di ipertrigliceridemia transitoria, come
una dieta ricca di zuccheri semplici e carboidrati, un eccessivo
consumo di alcol o una terapia estrogenica. Adolescenti e adulti
andrebbero interrogati circa il consumo quotidiano di bibite zuccherate. L’eliminazione di tali bevande consente spesso di ottenere
un drastico calo dei livelli di trigliceridi e del peso corporeo nei
soggetti obesi. Quando l’indice di massa corporea si stabilizza,
anche i livelli di colesterolo HDL tendono a risalire.
Le malattie pediatriche associate all’iperlipidemia includono
l’ipotiroidismo, la sindrome nefrotica, l’atresia biliare, le glicogenosi, la malattia di Niemann-Pick, la malattia di Tay-Sachs, il
lupus eritematoso sistemico, l’epatite e l’anoressia nervosa (Tab.
86-10). I farmaci che causano un’esacerbazione dell’iperlipidemia includono l’isotretinoina, i diuretici tiazidici, i contraccettivi
orali, gli steroidi, i -bloccanti, gli immunosoppressori e gli inibitori della proteasi usati nel trattamento dell’HIV. Il trattamento
dell’ipertrigliceridemia nei bambini richiede raramente la somministrazione di farmaci, a meno che livelli 1000 mg/dL persistano malgrado l’instaurazione di una dieta a ridotto contenuto di
grassi, zuccheri e carboidrati e l’aumento dell’attività fisica. In
tali casi l’obiettivo è di prevenire episodi di pancreatite. L’utilizzo
di fibrati e niacina, comune negli adulti, non è consigliabile nei
bambini. Gli inibitori dell’HGM reduttasi sono ragionevolmente
efficaci nel ridurre i livelli dei trigliceridi e le esperienze finora
accumulate sembrano dimostrare l’assenza di effetti collaterali
significativi.
84-92ANA.indd 609
■
Difetti del metabolismo lipidico
■
609
TABELLA 86-10. Cause secondarie di iperlipidemia
IPERCOLESTEROLEMIA
Ipertiroidismo
Sindrome nefrotica
Colestasi
Anoressia nervosa
Farmaci: progesterone, tiazide, tegretol, ciclosporina
IPERTRIGLICERIDEMIA
Obesità
Diabete di tipo II
Alcol
Insufficienza renale
Sepsi
Stress
Sindrome di Cushing
Gravidanza
Epatite
AIDS, inibizione della proteasi
Farmaci: steroidi anabolici, -bloccanti, estrogeni, tiazide
RIDUZIONE DI HDL
Fumo
Obesità
Diabete di tipo II
Malnutrizione
Farmaci: -bloccanti, steroidi anabolici
HDL, lipoproteina ad alta densità.
Deficit di lipasi epatica. Il deficit di lipasi epatica è un disturbo autosomico recessivo estremamente raro, responsabile di un
aumento plasmatico di colesterolo e trigliceridi. La lipasi epatica
idrolizza i trigliceridi e i fosfolipidi in residui di VLDL e IDL,
prevenendo la loro conversione in LDL. I livelli di colesterolo
HDL tendono a crescere piuttosto che a diminuire, suggerendo
così la diagnosi. Il dosaggio dell’attività di HL nel plasma eparinato consente di confermare la diagnosi.
DISTURBI DEL METABOLISMO DELLE HDL
Ipoalfaliproteinemia primaria. La presenza isolata di ridotti livelli
di colesterolo HDL è un disturbo familiare che spesso sembra seguire un pattern di ereditarietà autosomica dominante, ma può insorgere indipendentemente dalla storia familiare. È il più comune
disturbo del metabolismo delle HDL. Per definizione, il colesterolo
HDL deve essere 10º percentile per genere ed età, con trigliceridi
e colesterolo LDL nella norma. Il collegamento tra questo disturbo
e l’accelerazione dell’aterosclerosi è controverso. Si nota tuttavia
una riduzione della sintesi di apoA-I e un aumento del catabolismo di HDL. La diagnosi differenziale è con le cause secondarie
di riduzione del colesterolo HDL: la sindrome metabolica e rare
malattie come il deficit di LCAT e la malattia di Tangeri.
Ipoalfaliproteinemia familiare. Questa insolita malattia comporta una riduzione del rischio di CHD tra i membri familiari. I livelli
plasmatici di colesterolo HDL superano gli 80 mg/dL.
Deficit di apoA-I familiare. Le mutazioni del gene apoA-I possono risultare in una completa assenza di HDL nel plasma. L’HDL
nascente è prodotto nel fegato e nell’intestino tenue. Il colesterolo
libero proveniente dalle cellule periferiche è esterificato da LCAT,
consentendo la formazione di particelle mature di HDL. ApoA-I è
richiesto per la normale funzione enzimatica di LCAT. L’accumulo
di colesterolo libero nella circolazione causa opacità corneale, xantomi palmari e aterosclerosi prematura. Tuttavia, alcuni pazienti
presentano mutazioni di apoA-I che consentono un più rapido catabolismo della proteina, non associato ad aterogenesi, malgrado i
livelli di colesterolo HDL siano compresi tra 15 e 30 mg/dL.
Malattia di Tangeri. Questa malattia autosomica dominante è
associata a livelli di colesterolo HDL 5 mg/dL ed è causata da
una mutazione di ACDA1, una proteina che facilita il legame
fra colesterolo cellulare e apoA-I. Ciò determina un accumulo
di colesterolo libero nel sistema reticoloendoteliale, che si manifesta con ipertrofia tonsillare, caratteristico colorito arancio
23-09-2008 11:52:09
610
■
PARTE X
■
Malattie metaboliche
ed epatosplenomegalia. L’accumulo di colesterolo nelle cellule
di Schwann può causare neuropatia periferica intermittente. La
diagnosi andrebbe sospettata in presenza di un bambino con
tonsille ipertrofiche tendenti all’arancione e bassi livelli di colesterolo HDL.
Deficit familiare di lecitina colesterolo aciltransferasi (LCAT). Le
mutazioni che colpiscono LCAT interferiscono con l’esterificazione del colesterolo, prevenendo la formazione di particelle di
HDL mature. Ciò determina un rapido catabolismo di apoA-I.
La libera circolazione di colesterolo nel plasma aumenta notevolmente, con conseguente opacità corneale e livelli di colesterolo
HDL 10 mg/dL.
Il deficit parziale di LCAT è noto con il nome di malattia con
“occhio di pesce”, mentre il deficit completo determina anemia
emolitica e insufficienza renale progressiva nella prima età adulta.
Questa rara malattia non sembra provocare aterosclerosi prematura. Gli esami di laboratorio per la conferma della diagnosi
prevedono la dimostrazione della riduzione dell’esterificazione
del colesterolo nel plasma.
Deficit della proteina di trasferimento del colesteril estere (CETP).
Le mutazioni che coinvolgono il gene per la CETP (Cholesteryl
Ester Transfer Protein) sono localizzate sul cromosoma 16y21.
La CETP facilita il trasferimento delle lipoproteine dalle HDL
mature alle VLDL e ai chilomicroni (e viceversa), regolando
in questo modo il trasporto di colesterolo verso il fegato, per
l’escrezione nella bile. Circa il 50% delle particelle mature di
HDL2 è rimosso direttamente dalla circolazione da parte dei
recettori HDL posti sulla membrana degli epatociti. Il restante
50% dei colesteril esteri che si trovano nel nucleo delle HDL
è scambiato con trigliceridi nel nucleo delle lipoproteine apoB
(VLDL, IDL, LDL), per essere trasportato nel fegato. Il deficit
omozigote di CEPT è stato osservato in sottogruppi della popolazione giapponese con livelli di colesterolo HDL estremamente
elevati (150 mg/dL).
MALATTIE ASSOCIATE ALLA RIDUZIONE DI COLESTEROLO. I deficit
delle lipoproteine contenenti apo-B e i disturbi del metabolismo
intracellulare del colesterolo implicano bassi livelli plasmatici di
colesterolo.
Abetalipoproteinemia. Questa rara malattia autosomica recessiva è causata da mutazioni del gene che codifica la proteina
microsomiale deputata al trasporto dei trigliceridi, necessaria per
trasferire i lipidi ai nascenti chilomicroni nell’intestino tenue e alle
VLDL nel fegato. Ciò determina l’assenza di chilomicroni, VLDL,
LDL e apoB, nonché livelli estremamente ridotti di colesterolo
plasmatico e trigliceridi. I sintomi di presentazione, nelle prima
infanzia, sono malassorbimento dei grassi, diarrea e deficit staturo-ponderale. La degenerazione spinocerebellare, secondaria al
deficit di vitamina E, si manifesta con perdita dei riflessi tendinei
profondi, che progredisce verso l’atassia e la spasticità degli arti
inferiori negli adulti. I pazienti con abetalipoproteinemia vanno
incontro anche a retinopatia pigmentosa progressiva, associata a
una riduzione della visione notturna e dei colori, fino alla cecità.
I sintomi neurologici e la retinopatia possono condurre all’erronea diagnosi di atassia di Friedreich. La diagnosi differenziale è
suggerita dalla presenza nell’abetalipoproteinemia di malassorbimento e acantocitosi su striscio di sangue periferico. La maggior
parte delle manifestazioni cliniche della malattia è il risultato del
malassorbimento di vitamine liposolubili, come E, A e K.
Il trattamento precoce con integratori vitaminici (in particolare
della E) può rallentare significativamente lo sviluppo delle sequele
neurologiche. La vitamina E in genere è trasportata dall’intestino
tenue al fegato dai chilomicroni, mentre il suo rilascio nella circolazione e nei tessuti periferici dipende dalla via endogena delle
VLDL. I genitori di bambini con abetalipoproteinemia presentano livelli ematici di lipidi e apoB nella norma.
Ipobetalipoproteinemia familiare. L’ipobetalipoproteinemia omozigote familiare è associata a sintomi molto simili a quelli dell’abetalipoproteinemia, ma è trasmessa con modalità autosomica codominante. La malattia è causata da mutazioni del gene che codifica
per la sintesi di apoB-100. Può essere differenziata dall’abetalipo-
84-92ANA.indd 610
proteinemia perché i genitori eterozigoti dei probandi presentano
livelli plasmatici di colesterolo LDL e apoB inferiori alla norma
del 50%. La condizione eterozigote non è associata a sintomi o
sequele di alcun tipo.
L’incapacità selettiva di secernere apoB-48 dall’intestino tenue
determina una malattia simile all’abetalipoproteinemia e all’ipoabetalipoproteinemia omozigote. Questo disturbo, talvolta definito malattia di Anderson, è caratterizzato da un insufficiente
assorbimento di chilomicroni, con conseguente steatorrea e deficit di vitamine liposolubili.
Sindrome di Smith-Lemli-Opitz (SLOS). I pazienti con SLOS
(Smith-Lemil-Opitz Sindrome) presentano spesso anomalie congenite multiple e ritardo evolutivo, causati dal ridotto livello plasmatico di colesterolo e dall’accumulo dei suoi precursori (Tabb.
86-11 e 86-12). L’analisi del pedigree familiare ha rivelato una
modalità di trasmissione autosomica recessiva. Le mutazioni del
gene DHCR7 (7 deidrocolesterol-7 reduttasi) determinano un
deficit dell’enzima microsomiale DHCR7, necessario per completare la tappa finale della sintesi del colesterolo.
Non è ancora stato chiarito in che modo i difetti della sintesi del colesterolo provochino le malformazioni congenite, ma
dal momento che il colesterolo è uno dei componenti principali
della mielina, lo sviluppo neurologico risulta gravemente compromesso. L’incidenza della SLOS è stimata a 1/20 000-60 000
nelle popolazioni di razza bianca, con una frequenza leggermente
superiore negli ispanici e un’incidenza ridotta nei soggetti a discendenza africana.
Può verificarsi l’aborto spontaneo di un feto SLOS. La mortalità nel periodo neonatale è elevata nei casi di SLOS di tipo II. Se
il livello di colesterolo plasmatico è 20 mg/dL, la sopravvivenza
è improbabile. Gli esami di laboratorio devono essere effettuati
mediante gas-cromatografia, perché le tecniche standard per il dosaggio delle lipoproteine includono la misura dei loro precursori,
con conseguente rischio di ottenere un risultato falso positivo. I
casi più lievi possono manifestarsi soltanto nella tarda infanzia.
Le varianti fenotipiche includono all’estremo più grave microcefalia, malformazioni cardiache e cerebrali e insufficienza multi
organo; nei casi più lievi si riscontrano caratteristiche dismorfiche
e ritardo dello sviluppo. Il trattamento include la supplementazione di colesterolo (tuorlo d’uovo) e di inibitori dell’HMG CoA
reduttasi, per prevenire la sintesi di precursori tossici prossimi al
blocco enzimatico.
TABELLA 86.11. Principali caratteristiche cliniche della sindrome
di Smith-Lemli-Opitz: anomalie frequenti (>50% dei pazienti)
ANOMALIE CRANIOFACIALI
Microcefalia
Blefaroptosi
Narici anteverse
Retromicrognazia
Orecchie a impianto basso, ruotate posteriormente
Palatoschisi
Ampi alveoli mascellari
Cataratta (50%)
ANOMALIE SCHELETRICHE
Sindattilia delle dita dei piedi II/III
Polidattilia postassiale (50%)
Deformità equinovaro (50%)
ANOMALIE GENITALI
Ipospadia
Criptorchidsmo
Ambiguità sessuale (50%)
ANOMALIE DELLO SVILUPPO
Ritardo dello sviluppo pre- e postnatale
Disturbi dell’allattamento
Ritardo mentale
Anomalie comportamentali
Da Haas D, Kelley RI, Hoffman GF: Inherited disorders of cholesterol biosynthesis. Neuropediatrics 2001; 32: 113-122.
23-09-2008 11:52:09
Capitolo 86
■
Difetti del metabolismo lipidico
■
611
tosi, viene ceduto ai lisosomi, per essere idrolizzato dalla lipasi
lisosomiale. Il difetto dell’idrolisi causato dalla completa assenza
dell’enzima causa l’accumulo di colesteril estere all’interno delle cellule. Nella prima infanzia compaiono epatosplenomegalia,
steatorrea e deficit staturo-ponderale, che causano la morte del
paziente entro il primo anno. Il disturbo dell’immagazzinamento
di esteri del colesterolo è una forma meno grave della malattia,
in cui è preservata un certa attività della lipasi.
Malattia di Niemann-Pick di tipo C. Questo disturbo del trasporto
intracellulare del colesterolo è caratterizzato dall’accumulo di
colesterolo e sfingomielina nel sistema nervoso centrale e nel sistema reticoloendoteliale. Questa malattia neurologica autosomica
recessiva causa un’elevata mortalità entro l’adolescenza.
TABELLA 86-12. Malformazioni degli organi interni tipiche dei pazienti
con grave sindrome di Smith-Lemli-Opitz
SITEMA NERVOSO CENTRALE
Ipoplasia del lobo frontale
Allargamento dei ventricoli
Agenesi del corpo calloso
Ipoplasia cerebellare
Oloprosencefalia
SISTEMA CARDIOVASCOLARE
Canale atrioventricolare
Difetto dell’atrio settale
Dotto arterioso pervio
Difetto membranoso del setto ventricolare
TRATTO URINARIO
Ipoplasia renale o aplasia
Cisti corticale renale
Idronefrosi
Duplicazione ureterale
TRATTO GASTROINTESTINALE
Malattia di Hirschsprung
Stenosi del piloro
Dismotilità refrattaria
Malattia epatica progressiva colestatica e non colestatica
SISTEMA POLMONARE
Ipoplasia polmonare
Lobazione anomala
SISTEMA ENDOCRINO
Insufficienza surrenale
Da Haas D, Kelley RI, Hoffmann GF: Inherited disorders of cholesterol biosynthesis. Neuropediatrics 2001; 32: 113-122.
DISTURBI DEL METABOLISMO INTRACELLULARE DEL COLESTEROLO
Xantomatosi cerebrotendinea. Questa malattia autosomica recessiva si presenta clinicamente nella tarda adolescenza, con xantomi tendinei, cataratta e neurodegenerazione progressiva. È
causata dall’accumulo tissutale di prodotti intermedi degli acidi
biliari, in forma di colestanolo, in seguito a mutazioni del gene
per lo sterolo 27-idrossilasi, un enzima necessario per la normale
sintesi mitocondriale degli acidi biliari nel fegato. Il trattamento
precoce con acido chenodesossicolico riduce i livelli di colesterolo
e previene lo sviluppo dei sintomi.
Malattia di Wolman e disturbo dell’immagazzinamento di esteri
del colesterolo. La malattia di Wolman, autosomica recessiva, è
causata dalla mancanza della lipasi acida lisosomiale. Dopo che
il colesterolo LDL è incorporato nella cellula mediante endoci-
ANDAMENTO DELLE LIPOPROTEINE IN BAMBINI E ADOLESCENTI. La
Tabella 86-13, formulata sulla base dei Lipid Research Clinics
Population Studies, illustra la distribuzione dei livelli di lipoproteine nella popolazione giovanile americana. Il colesterolo
plasmatico totale aumenta rapidamente da una media di 68 mg/
dL alla nascita, a un livello approssimativamente doppio entro la
fine del periodo neonatale. La concentrazione sale gradualmente
fino alla pubertà, quando il livello medio raggiunge i 160 mg/dL.
Durante la pubertà si verifica un calo transitorio, dovuto a un
lieve decremento del colesterolo HDL nei maschi e a un leggero
calo del colesterolo LDL nelle femmine. L’andamento negli anni
seguenti è facilmente prevedibile. Livelli elevati di colesterolo
circolante tendono a concentrarsi in gruppi familiari, in seguito
alle influenze genetiche e ambientali.
Il livello di colesterolo totale ritenuto accettabile in bambini e
adolescenti è 170 mg/dL; livelli compresi tra 170 e 199 mg/dL
sono considerati borderline; valori superiori a 200 mg/dL sono
elevati. Il livello di colesterolo LDL accettabile è 110 mg/dL; il
livello borderline è pari a 170-199 mg/dL; livelli superiori a 200
mg/dL sono elevati.
SCREENING DEL COLESTEROLO EMATICO. L’Expert Panel on Blood
Cholesterol Levels in Children and Adolescents elaborato dal
NCEP nel 1991 stabilisce le linee guida per la misura del colesterolo. Tale protocollo raccomanda un approccio selettivo, basato
sui seguenti criteri.
È opportuno sottoporre a screening bambini e adolescenti i cui genitori o nonni abbiano presentato documentate malattie coronariche prima dei 55 anni di età.
È opportuno sottoporre a screening bambini e adolescenti con un genitore che presenta un livello
di colesterolo ematico >240 mg/dL.
È opportuno sottoporre a screening bambini e adolescenti nei quali non è possibile ottenere la
storia familiare, in particolare se presentano altri fattori di rischio.
TABELLA 86-13. Colesterolo plasmatico e livelli dei trigliceridi nell’infanzia e nell’adolescenza: medie e percentili
TRIGLICERIDI TOTALI (mg/dL)
Cordone ombelicale
1-4 anni
Maschi
Femmine
5-9 anni
Maschi
Femmine
10-14 anni
Maschi
Femmine
15-19 anni
Maschi
Femmine
COLESTEROLO TOTALE
(mg/dL)
5° PRINCIPALE 75°
42
68
–
COLESTEROLO (mg/dL)
DELLE LIPOPROTEINE
A BASSA DENSITÀ (LDL)
5° PRINCIPALE
14
34
75°
–
90°
–
95°
84
90° 95° 5° PRINCIPALE
– 103 17
29
29
34
56
64
68
74
85
95
99
112
114
112
155
156
170
173
190
188
203
200
–
–
28
32
52
64
58
74
70
103
85
126
125
131
155
164
168
176
183
190
189
197
33
39
63
72
74
85
94
104
111
120
124
125
160
160
173
171
188
191
38
36
78
73
88
85
125
112
143
126
118
118
153
159
168
176
183
198
COLESTEROLO (mg/dL)
DELLE LIPOPROTEINE
AD ALTA DENSITÀ* (HDL)
75°
–
90°
–
95°
50
5°
13
–
–
–
–
–
–
–
–
–
–
63
68
93
100
103
115
117
125
129
140
202
205
64
68
97
97
109
110
122
126
191
207
62
59
94
96
109
111
123
129
PRINCIPALE
–
75°
–
90°
35
95°
60
–
–
–
–
–
–
–
–
38
36
42
38
49
47
56
53
74
73
132
136
37
37
40
40
46
45
55
52
74
70
130
137
30
35
34
38
39
43
46
52
63
74
* Sono evidenti i differenti percentili elencati per il colesterolo HDL.
I dati sul cordone ombelicale sono tratti da Strong W: Atherosclerosis: Its pediatric roots. In Kaplan N, Stamler J (eds): Prevention of Coronary Heart Disease. Philadelphia, WB Saunders, 1983. I dati per i bambini di 1-4 anni delle Tabelle 6, 7, 20 e 21 e tutti gli altri
dati delle Tabelle 24, 25, 32, 33, 36 e 37 sono tratti da Lipid Research Clinics Population Studies Data Book, Vol. 1, The Prevalence Study. NIH publication No. 80-1527. Washington, DC, National Institutes of Health, 1980.
84-92ANA.indd 611
23-09-2008 11:52:09
612
■
PARTE X
■
Malattie metaboliche
L’American Academy of Pediatrics e l’American Heart Association (AHA) hanno sottoscritto questi criteri. L’applicazione
di tale protocollo condurrà allo screening del 25% dei giovani
americani, nei quali la probabilità di una base familiare dell’ipercolesterolemia è elevata. Si prevede che il 59% dei bambini con
livelli ematici elevati di colesterolo non venga individuato a causa
della mancanza di uno screening universale. Questi dati sono tuttavia fonte di dubbi e controversie, dal momento che alcuni, per
esempio, ritengono che affidarsi alla storia familiare e al riscontro
nei genitori di livelli di colesterolo 240 mg/dL costituisca un
criterio troppo poco sensibile e difficile da applicare.
Malgrado le difficoltà di compliance, queste linee guida si
basano comunque su un ragionamento corretto. Se dalla storia clinica risulta aterosclerosi cardiaca prematura, il bambino
presenta un rischio più elevato di dislipidemia. Al contrario,
i bambini che non soddisfano i criteri per lo screening hanno
una probabilità ridotta di possedere una forte predisposizione
genetica alla malattia cardiaca. Molto probabilmente, il 59% dei
bambini con ipercolesterolemia non individuato dai medici che si
attengono alle linee guida citate presenta una moderata elevazione dei livelli di colesterolo, dovuta a influenze ambientali come
una dieta scorretta o uno stile di vita sedentario. Le strategie
di prevenzione primaria dirette al complesso della popolazione
includono attività fisica quotidiana e una dieta a ridotto contenuto di grassi saturi. I bambini e adolescenti che richiedono un
trattamento farmacologico per la riduzione del colesterolo sono
identificati nella quasi totalità dei casi da medici che seguono le
linee guida descritte.
La diagnosi precoce e il trattamento dei soggetti a rischio di
CHD a causa di una suscettibilità genetica sono fondamentali
per la salute pubblica. Si stima che attualmente soltanto il 20%
delle persone con ipercolesterolemia eterozigote familiare sia
stato diagnosticato e meno del 10% di questi pazienti è trattato
nella maniera corretta. Uno studio dettagliato condotto nel Regno Unito ha dimostrato l’utilità in termini di rapporto costobeneficio di uno “screening a cascata” dei familiari di probandi
FH. Lo screening dei giovani è particolarmente importante, perché il trattamento preventivo consente un allungamento della
vita media.
La ben documentata non conoscenza di molti genitori dei
livelli del proprio colesterolo rende problematica l’applicazione
dei criteri esposti. Appaiono invece del tutto infondate le preoccupazioni riguardo ai possibili danni psicologici per i bambini
sottoposti allo screening e al rischio di abuso di farmaci che
riducono il colesterolo. Negli Stati Uniti, la preoccupante epidemia di obesità infantile, che in alcuni gruppi a rischio raggiunge
punte del 50%, suggerisce l’opportunità di screening più ampi,
per identificare i soggetti con sindrome metabolica. Se lo screening è effettuato a causa dell’obesità, si consiglia la misura del
profilo lipidico a digiuno piuttosto che del colesterolo ematico
totale, in modo da evidenziare ipertrigliceridemia e/o ridotti livelli
di colesterolo HDL, fattori di rischio per la malattia cardiaca e
il diabete di tipo 2. Le linee guida NCEP non specificano l’età
alla quale i bambini a rischio andrebbero sottoposti al test, ma
5 anni è considerata un’età ragionevole, perché in questo stadio
dello sviluppo neurologico è possibile intervenire sulla dieta dei
soggetti con ipercolesterolemia.
VALUTAZIONE DEI RISCHI E TRATTAMENTO DELL’IPERLIPIDEMIA. Il
programma NCEP consiglia una valutazione dei rischi basata sui
livelli di colesterolo LDL (Fig. 86-14). L’intervallo tra i followup e le modifiche della dieta sono determinati dalla gravità della
dislipidemia. In caso di riscontro di ipercolesterolemia border-line
(LDL 110-129 mg/dL), è necessario avviare tempestivamente la
dieta AHA Step I:
le calorie consumate in forma di grassi non devono superare il 30% dell’apporto calorico giornaliero;
le calorie consumate in forma di grassi saturi non devono superare il 10% dell’apporto calorico
giornaliero;
l’apporto totale quotidiano di colesterolo deve essere limitato a 300 mg/dL.
84-92ANA.indd 612
I genitori vanno informati sugli altri fattori di rischio per
malattia cardiaca, come l’uso di tabacco. È opportuno inoltre
ripetere la valutazione del bambino l’anno successivo.
La persistenza di livelli di colesterolo LDL elevati (130 mg/
dL) segnala la necessità di una valutazione più ampia e di una
più radicale modifica dello stile di vita. L’esame obiettivo approfondito ed esami di laboratorio addizionali sono eseguiti per
escludere la presenza di cause secondarie dell’iperlipidemia (vedi
Tab. 86-10). Anche gli altri membri del gruppo familiare andrebbero sottoposti a screening del colesterolo ematico. Se il livello di
colesterolo LDL non scende a valori 130 mg/dL, è necessario
ricorrere alla dieta AHA Step II, che consente un consumo medio
di grassi non superiore al 30% dell’apporto calorico totale (come
nella Step I), ma limita l’assunzione di grassi saturi a 7-8%
dell’apporto calorico globale; l’intake di colesterolo consentito
scende a 200 mg/die. I test di laboratorio di follow-up, la misura di altezza e peso corporeo per il calcolo dell’indice di massa
corporea e la verifica della compliance alla dieta andrebbero
effettuati a intervalli di 3-6 mesi.
La revisione del 2004 della NCEP ATP III ha aumentato il livello minimo accettabile di colesterolo HDL da 35 mg/dL a 40 mg/
dL. In presenza di basso colesterolo HDL è opportuno informare
il paziente sui rischi di obesità, tabacco e vita sedentaria.
Nei bambini di età inferiore ai due anni non è opportuna alcuna restrizione dietetica di grassi e colesterolo, a causa del rischio
di insorgenza di deficit staturo-ponderale e di un rallentamento
dello sviluppo. Tuttavia, anche l’iperalimentazione del bambino
deve essere fortemente scoraggiata, perché un numero crescente
di bambini eccede i parametri pubblicati dall’U.S. Centers for
Disease Control and Prevention. Il mito che un bambino grasso
sia un bambino sano non è facile da sfatare.
Il National Health and Nutrition Examination Survey
(NHANES III) ha dimostrato l’importanza di una dieta sana
nei bambini fra i 3 e i 9 anni. Malgrado il calo del livello medio di consumo di grassi rispetto all’indagine NHANES II, non
emergeva alcuna compromissione dello stato nutrizionale, né
della crescita. Lo studio prospettico Dietary Intervention Study
in Children (DISC) ha confrontato bambini sottoposti alla dieta
AHA Step I con bambini che seguono una dieta “normale”, con
un contenuto calorico in forma di grassi del 33-34% (e un 13%
di grassi saturi). Non è stata riscontrata alcuna differenza tra i
due gruppi in termini di altezza, peso, micronutrienti o benessere
psicologico, ma i bambini a dieta AHA presentavano livelli di
colesterolo LDL inferiori.
Il Committee on Nutrition of the American Academy of Pediatrics suggerisce, nei bambini al di sopra dei due anni, una riduzione dell’apporto di grassi a vantaggio di cereali, frutta, verdura,
latticini non grassi, legumi, pesce, carne bianca e altri cibi ricchi
di proteine. Negli ultimi anni si è assistito alla diffusione di diete
povere di carboidrati e ricche di grassi, mirate a ottenere una
rapida riduzione del peso. L’intake illimitato di grassi deve essere
fortemente sconsigliato, come anche il consumo senza restrizioni
di zuccheri e carboidrati. I carboidrati dovrebbero fornire il 55%
delle calorie, ottenute dal consumo di carboidrati complessi come
pasta, alcune verdure, patate, legumi, cereali e pane integrale. Le
proteine dovrebbero invece apportare il 15-20% delle calorie e
dovrebbero contenere tutti gli acidi grassi essenziali. L’esclusione
di carne o pesce dalla dieta deve essere compensata dall’assunzione di proteine di derivazione vegetale, in modo da garantire il
giusto equilibrio dei nutrienti. I cibi ricchi di fibre, come frutta,
verdure e cereali sono raccomandati per il loro eccellente contenuto di nutrienti come componenti di una dieta a basso contenuto
di grassi saturi. I bambini dovrebbero assumere quotidianamente
almeno 5 tipi di frutta o verdura. Si raccomanda tuttavia di verificare il contenuto di sodio delle verdure in scatola o surgelate.
Questi consigli dietetici garantiscono l’apporto calorico ideale
per uno sviluppo sano, ma nella società attuale la compliance
da parte del bambino e dei genitori è costantemente minacciata.
I bambini apprendono le loro abitudini alimentari dai genitori.
L’adozione di un regime alimentare ha maggiori probabilità di
successo se si applica non soltanto al singolo bambino, ma all’in-
23-09-2008 11:52:09
Capitolo 86
■
Difetti del metabolismo lipidico
■
613
Valutazione dei rischi
Anamnesi familiare positiva o livelli ematici di colesterolo
elevati nel genitore o CVD prematura
Analisi delle lipoproteine a digiuno
Accettabile
Colesterolo LDL
110 mg/dL
Figura 86-14. Diagramma a flusso della classificazione, dell’educazione e del follow-up
dei bambini basato sui livelli di lipoproteine
a bassa densità (LDL) e di colesterolo. CVD,
malattia cardiovascolare; HDL, lipoproteina ad alta densità. (Da Williams CL, Hagman LL, Daniels SR et al: Cardiovascular
health in childhood. Circulation 2002; 106:
143-160.)
Borderline
Colesterolo LDL
110-129 mg/dL
Ripetizione
dell’analisi
delle lipoproteine
e confronto
con i valori
precedenti
Accettabile
Colesterolo LDL
110 mg/dL
Ripetizione dell’analisi
delle lipoproteine entro 5 anni
Counseling sui fattori di rischio
e le abitudini dietetiche
Borderline
Colesterolo LDL
110-129 mg/dL
Counseling sui fattori di rischio
Dieta Step-One
Follow-up a un anno
Elevato
Colesterolo LDL
130 mg/dL
Colesterolo HDL
35 mg/dL*
Persistenza
dell’elevazione
Colesterolo LDL
130 mg/dL
Valutazione clinica completa
(anamnesi, esame obiettivo,
test di laboratorio)
• Ricerca di cause secondarie
• Indagine dei disturbi familiari
Screening di tutti i membri
del gruppo familiare
Intervento clinico intensivo:
dieta Step-One o Step-Two†
Obiettivo della terapia:
riduzione del colesterolo LDL
a valori 130 mg/dL
(valore ideale: 110 mg/dL)
*In caso di riscontro di un basso livello di colesterolo HDL, il paziente deve essere informato sui fattori
di rischio (fumo, dieta ricca di grassi saturi, vita sedentaria, sovrappeso).
†Per pazienti con età inferiore a 10 anni: LDL-C 190 mg/dL (o 160 mg/dL in presenza di fattori
di rischio addizionali). Se questo obiettivo non viene raggiunto, è opportuno prendere in considerazione
il ricorso alla terapia farmacologica.
tero gruppo familiare. Assumere i pasti tutti insieme e ad orari
prestabiliti è preferibile. I nonni e gli altri caregiver andrebbero
istruiti a non tentare un bambino a dieta. Negli Stati Uniti, la
diffusione dell’obesità ha spinto i responsabili di alcuni distretti
scolastici a eliminare i distributori di bibite dolcificate, sostituendole con bevande alternative più salutari.
La tendenza alla vita sedentaria da parte dei giovani contribuisce
all’allarmante aumento dell’obesità nell’intera nazione, che a sua
volta incrementa la prevalenza di altri fattori di rischio, come la
dislipidemia e l’ipertensione. La National Association for Sport
and Physical Education (NASPE) raccomanda un’ora di attività
fisica quotidiana adeguata per l’età. I lunghi periodi di inattività
(più di due ore davanti al televisore o al computer) sono ritenuti
dannosi.
Terapia farmacologica (Tabb. 86-14 e 86-15). Secondo l’Expert Panel for Children and Adolescents (NCEP), il trattamento farmacologico dell’iperlipidemia deve essere preso in considerazione nei
bambini con età minima di 10 anni dopo il fallimento di una dieta
della durata di almeno sei mesi e precisamente quando:
•
•
il colesterolo LDL resta >190 mg/dL;
il colesterolo LDL resta >160 mg/dL ed emerge una storia familiare positiva di malattia cardiovascolare prematura (CVD, CardioVascular Disease) prima dei 55 anni; oppure permangono
uno o più fattori di rischio per CVD malgrado i tentativi di modificare lo stile di vita.
Queste linee guida (arbitrarie ma ragionevoli) sono basate sulla
probabilità statistica del bambino di presentare una forma ere-
84-92ANA.indd 613
ditaria di dislipidemia, come l’ipercolesterolemia familiare (FH).
L’età minima di 10 anni è stata stabilità perché è a quest’età che le
strie lipidiche risultano osservabili per la prima volta nelle coronarie e nell’aorta. In rari casi la terapia può essere avviata ancora
più precocemente, se i livelli di colesterolo sono particolarmente
elevati e la storia familiare conferma la prevalenza della malattia
coronarica precoce.
Le esperienze accumulate negli ultimi 15 anni nel trattamento
farmacologico di bambini e adolescenti con iperlipidemia hanno
consentito di ampliare le opzioni terapeutiche, migliorare la compliance e potenziare l’efficacia. In passato, i farmaci di elezione
erano i chelanti degli acidi biliari, come la colestiramina e il colestipolo, che tramite l’interruzione della circolazione enteropatica
degli acidi biliari promuovono la sintesi nel fegato di nuovi acidi
biliari a partire dal colesterolo. Ma gli effetti collaterali gastrointestinali e il cattivo sapore di questi farmaci compromettono la
compliance.
Gli inibitori della HGM CoA reduttasi, noti con il nome di
statine, sono molto efficaci nel ridurre il livello di colesterolo
LDL e l’infiammazione delle placche, diminuendo così il rischio
di un evento coronarico improvviso nei pazienti adulti, già da
qualche settimana dopo l’esordio della terapia. Questa classe di
farmaci funziona bloccando la biosintesi intraepatica del colesterolo, stimolando così la produzione di un maggior numero di
recettori LDL sulla superficie cellulare. Il programma NCEP ATP
consiglia una terapia aggressiva di riduzione del colesterolo LDL
23-09-2008 11:52:09
614
■
PARTE X
■
Malattie metaboliche
TABELLA 86-14. Farmaci utilizzati per il trattamento dell’iperlipidemia
FARMACO
Inibitori dell’HMG CoA reduttasi (statine)
Chelanti degli acidi biliari:
Colestiramina
Colestipol
MECCANISMO D’AZIONE
↑↓Sintesi del colesterolo e VLDL
↑Recettori LDL epatici
↑Bile ed escrezione
INDICAZIONE
LDL elevate
DOSE INIZIALE
5-80 mg qhs
LDL elevate
4-32 g/die
5-40 g/die
Acido nicotinico
↓Sintesi epatica delle VLDL
Derivati dell’acido fibrico:
Gemfibrozil
↑LPL
↓VLDL
Olio di pesce
Inibitori dell’assorbimento di colesterolo:
Ezetamibe
LDL elevate
TG elevati
TG elevati
100-2000 mg 3 volte/die
↓produzione delle VLDL
TG elevati
3-10 g/die
↓Assorbimento intestinale del colesterolo
LDL elevate
10 mg/die
600 mg 2 volte/die
LDL, lipoproteine a bassa densità; LPL, lipoproteina lipasi; TG, trigliceridi; VLDL, lipoproteine a densità molto bassa.
TABELLA 86-15. Effetti collaterali dei farmaci per la riduzione dei livelli
lipidici
FARMACO, MODALITÀ DI AZIONE
E LOCALIZZAZIONE DELL’EFFETTO
STATINE
Cute
Sistema nervoso
Fegato
Tratto gastrointestinale
Muscoli
Sistema immunitario
Capacità di legame delle proteine
EFFETTO
Eruzione cutanea
Calo della concentrazione, disturbi del sonno, mal di testa,
neuropatia periferica
Epatite, perdita di appetito, calo ponderale, aumento delle
amminotransferasi sieriche (duplicazione o triplicazione
rispetto al limite superiore normale)
Dolore addominale, nausea, diarrea
Dolore muscolare o debolezza, miosite (solitamente
con creatina chinasi sierica >1000 U/L), rabdomiolisi
con insufficienza epatica
Sindrome simile al lupus (lovastatina, simvastatina
o fluvastatina)
Riduzione della capacità di legame della varfarina
(lovastatina, simvastatina o fluvastatina)
RESINE CHE SI LEGANO AGLI ACIDI BILIARI
Tratto gastrointestinale
Pienezza addominale, nausea, flatulenza, costipazione,
emorroidi, ragadi anali, attivazione di diverticoliti,
diminuzione dell’assorbimento di vitamina D nei bambini
Fegato
Lieve aumento dell’amminotransferasi sierica (esacerbato
dal concomitante trattamento con una statina)
Sistema metabolico
Aumento dei trigliceridi nel siero pari al 10%
(superiore in pazienti con ipertrigliceridemia)
Elettroliti
Acidosi ipercloremica in bambini e pazienti con insufficienza
renale (colestiramina)
Interazione farmacologica
Capacità di legame di varfarina, digossina, diuretico tiazide,
tirossina, statine
ACIDO NICOTINICO
Cute
Arrossamento, pelle secca, prurito, ittiosi, acantosi nigricans
Occhi
Congiuntivite, edema maculare cistoide, distacco retinico
Tratto respiratorio
Congestione nasale
Cuore
Aritmia sopraventricolare
Tratto gastrointestinale
Pirosi, disturbi della motilità intestinale o diarrea
Fegato
Lieve aumento delle amminotransferasi sieriche; epatite
con nausea e affaticabilità
Muscoli
Miosite
Sistema metabolico
Iperglicemia (incidenza del 5% più elevata in pazienti
con diabete), aumento del 10% dell’acido urico sierico
FIBRATI
Cute
Eritema cutaneo
Tratto gastrointestinale
Mal di stomaco, dolore addominale (soprattutto
con gemfibrozil), bile satura di colesterolo, aumento
dell’1-2% dell’incidenza di calcoli biliari
Tratto genitourinario
Disfunzioni erettili (soprattutto con clofibrato)
Muscoli
Miosite con compromissione della funzione renale
Proteine plasmatiche
Interferenze con i legami della varfarina, che richiedono
una riduzione della dose del 30%
Fegato
Aumento delle amminotransferasi sieriche
Da Knopp RH: Drug treatment of lipid disorders. N Engl J Med 1999; 341: 498-512.
84-92ANA.indd 614
a valori 70 mg/dL in individui con documentata malattia coronarica. Questa informazione è particolarmente rilevante, perché
i bambini che soddisfano i criteri per il ricorso al trattamento
farmacologico hanno quasi certamente ereditato la malattia da
uno dei genitori. Accade spesso che, durante il trattamento di un
bambino, si finisca per affrontare la questione dello screening e
del trattamento di genitori o nonni. Le statine sono efficaci anche
nei bambini e consentono, se necessario, di dimezzare il livello
del colesterolo LDL, permettendo anche una moderata riduzione
dei trigliceridi e, talvolta, favorendo un aumento del colesterolo
HDL. È stato inoltre dimostrato l’effetto riducente l’ispessimento
dell’intima-media della carotide in bambini tra gli 8 e i 18 anni.
Prima di prescrivere questi farmaci, è opportuno considerarne
gli effetti collaterali, principalmente la disfunzione epatica e più
raramente la rabdomiolisi con insufficienza renale secondaria.
Non ci sono prove, tuttavia, che queste complicanze insorgano
con maggiore frequenza nei bambini rispetto agli adulti e anche
il dolore della muscolatura scheletrica sembra meno problematico nei bambini. Le statine sono controindicate nei pazienti con
malattia epatica attiva e durante la gravidanza e l’allattamento. È
opportuno un monitoraggio regolare degli enzimi epatici e della
creatinina fosfochinasi in caso di dolore muscolare o debolezza.
Un aumento degli enzimi epatici superiore al triplo suggerisce
che la terapia farmacologia debba essere sospesa. È importante
ribadire che i bambini con una modesta elevazione del colesterolo, come quella riscontrata nell’ipercolesterolemia poligenica,
non vanno mai sottoposti a terapia con statine, a causa dei loro
effetti collaterali.
Gli altri farmaci che riducono il livello di colesterolo, come
l’acido nicotinico e i fibrati, sono stati utilizzati con minore
frequenza nei bambini rispetto ai chelanti degli acidi biliari e
alle statine. L’acido nicotinico è stato talvolta selezionato per il
trattamento di bambini con marcata ipertrigliceridemia a rischio
di pancreatite acuta, benché la riduzione dell’apporto alimentare
di zuccheri complessi e carboidrati sia solitamente sufficiente a
ridurre i livelli di trigliceridi.
L’ezetimibe è utile nella popolazione pediatrica, in virtù della
sua efficacia e degli scarsi effetti collaterali. Questo farmaco riduce il livello plasmatico di colesterolo LDL, bloccando l’assorbimento di sterolo negli enterociti. Negli adulti è talvolta usato
in associazione alle statine, quando queste ultime non riescono
a ottenere la riduzione del colesterolo desiderata. Non sono ancora stati condotti trial clinici sufficientemente ampi per valutare
la monoterapia con ezetimibe nei bambini, ma i numerosi casi
documentati sembrano dimostrarne la straordinaria efficacia,
combinata alla relativa assenza di effetti collaterali. Dunque,
in presenza di una ipercolesterolemia moderata, l’ezetimibe può
essere tranquillamente consigliato invece di una statina (alla dose
di 10 mg/die). I genitori preoccupati dall’idea che il figlio possa
essere costretto ad assumere la statina per il resto della vita
23-09-2008 11:52:09
Capitolo 86
accolgono di buon grado la possibilità di utilizzare l’ezetimibe.
A prescindere dal farmaco scelto, l’obiettivo della terapia è la
riduzione del colesterolo LDL a valori 130 mg/dL (ma l’ideale
è rappresentato da valori 110 mg/dL). A differenza di quanto
raccomandato per gli adulti ad alto rischio, nei bambini non è
consigliabile ottenere una riduzione ancora maggiore.
Austin MA, Hutter CH, Zimmern RL, et al: Familial hypercholesterolemia
and coronary heart disease: A huge association review. Am J Epidemiol
2004;160:421–429.
De Jongh S, Ose L, Szamosi T, et al: Efficacy and safety of statin therapy in children with familial hypercholesterolemia. Circulation
2002;106:2231–2237.
Demerath E, Muratova V, Spangler E, et al: School-based obesity screening in
rural Appalachia. Prev Med 2003;37:553–560.
Durrington P: Dyslipidaemia. Lancet 2003;362:717–731.
Goldberg AC, Aditi S, Ji L, et al: Efficacy and safety of ezetimibe coadministered with simvastatin in patients with primary hypercholesterolemia:
A randomized, double-blind, placebo-controlled trial. Mayo Clin Proc
2004;79:620–629.
Grundy SM, Hansen B, Smith SC, et al: Clinical management of metabolic
syndrome: Report of the American Heart Association/National Heart, Lung,
Blood Institute/American Diabetes Association Conference on Scientific Issues Related to Management. Circulation 2004;109:551–556.
Hopkins PN, Heiss G, Ellison C, et al: Coronary artery disease risk in familial
combined hyperlipidemia and familial hypertriglyceridemia: A case-control
comparison from the National Heart, Lung, and Blood Institute Family
Heart Study. Circulation 2003;108:519–523.
Leren T: Cascade genetic screening for familial hypercholesterolemia. Clin
Genet 2004;66:483–487.
Merkens LS, Connor WE, Linck LM, et al: Effects of dietary cholesterol
on plasma lipoproteins in Smith-Lemli-Opitz syndrome. Pediatr Res
2004;56:726–732.
Raitakari OT: Arterial abnormalities in children with familial hypercholesteremia. Lancet 2004;363:342–343.
Singhal A, Cole TJ, Fewtrell M, et al: Breast milk feeding and lipoprotein
profile in adolescents born preterm: Follow-up of a prospective randomized
study. Lancet 2004;363:1571–1578.
Wiegman A, Hutten BA, de Groot E, et al: Efficacy and safety of statin therapy
in children with familial hypercholesterolemia. JAMA 2004;292:331–337.
86.4 • LIPIDOSI • Margaret M. McGovern
e Robert Desnick
Le malattie da accumulo lisosomiale sono causate da deficit
ereditari di un’idrolasi lisosomiale, che causano l’accumulo del
particolare substrato dell’enzima (Tab. 86-16). Fatta eccezione
per la malattia di Wolman e il disturbo dell’accumulo di esteri
del colesterolo, i substrati lipidici condividono una struttura comune, che include una ceramide (2-N-acilsfingosina) dalla quale
sono derivati i vari sfingolipidi mediante sostituzione di esosi,
fosforilcolina o uno o più acidi sialici residui del gruppo idrossile
terminale della ceramide. La via metabolica degli sfingolipidi nel
tessuto nervoso (Fig. 86.15) e negli organi viscerali (Fig. 86-16)
è nota; ciascuna tappa catabolica può presentare uno specifico
difetto metabolico geneticamente determinato. Dal momento che
gli sfingolipidi sono componenti essenziali di tutte le membrane
cellulari, l’incapacità di degradare tali sostanze e il loro conseguente accumulo provocano alterazioni morfologiche e fisiologiche, nonché manifestazioni cliniche caratteristiche dei disturbi
dell’immagazzinamento lipidico (vedi Tab. 86-16). Il progressivo
accumulo lisosomiale di glicosfingolipidi nel sistema nervoso centrale causa neurodegenerazione, mentre l’accumulo nelle cellule
viscerali può determinare organomegalia, anomalie scheletriche,
infiltrazione polmonare e altre manifestazioni. L’accumulo di un
substrato in uno specifico tessuto dipende dalla sua distribuzione
normale nel corpo.
Gli esami diagnostici per l’identificazione degli individui colpiti si basano sulla misura di specifiche attività enzimatiche su
leucociti isolati o colture di fibroblasti. Nella maggior parte dei
84-92ANA.indd 615
■
Difetti del metabolismo lipidico
■
615
disturbi sono disponibili metodi per l’individuazione dei portatori
sani e per la diagnosi prenatale. Una diagnosi accurata è essenziale per fornire al paziente un counseling genetico. La caratterizzazione dei geni che codificano per specifici enzimi necessari
per il metabolismo degli sfingolipidi ha consentito di ampliare le
opzioni terapeutiche, che includono la sostituzione degli enzimi
ricombinanti e la terapia genica. L’identificazione di specifiche
mutazioni patogenetiche facilita la diagnosi pre- e postnatale
e il riconoscimento dei portatori. Per alcuni disordini (come la
malattia di Gaucher), è stato possibile elaborare correlazioni
genotipo-fenotipo che facilitano la previsione della gravità della
malattia, consentendo un counseling genetico più preciso. Queste
malattie si trasmettono con modalità autosomica recessiva, fatta
eccezione per la malattia di Fabry legata all’X.
GANGLIOSIDOSI GM1. La gangliosidosi GM1 si presenta più frequentemente nella prima infanzia (malattia di tipo 1), ma è stato
descritto anche un esordio giovanile (tipo 2). Entrambe le patologie si trasmettono con modalità autosomica recessiva e sono il
risultato di un deficit dell’attività della -galattosidasi, un enzima
lisosomiale codificato da un gene localizzato sul cromosoma 3
(3p21.33). Il disturbo è caratterizzato da un accumulo patologico
di gangliosidi GM1 nei lisosomi delle cellule neurali e viscerali,
i cui effetti sono tuttavia più evidenti a livello cerebrale. Inoltre,
nei pazienti con gangliosidosi GM1 si riscontra anche un accumulo nel fegato del mucopolisaccaride cheratan solfato, escreto
attraverso le urine. Il gene della -galattosidasi è stato isolato e
sequenziato; ciò ha reso possibile l’identificazione delle mutazioni
patogenetiche responsabili di entrambi i tipi della malattia.
Le manifestazioni cliniche della forma infantile di gangliosidosi
GM1 (tipo 1) comprendono epatosplenomegalia, edema ed eruzioni cutanee (angiocheratoma). L’esordio si verifica solitamente
nei primi sei mesi di vita, con un ritardo evolutivo seguito da
un progressivo ritardo psicomotorio e dalla comparsa di convulsioni tonico-cloniche. I pazienti presentano una facies tipica,
con impianto basso delle orecchie, bozze frontali, radice nasale
depressa e filtro allungato. Fino al 50% dei pazienti ha una macchia rosso ciliegia sulla macula. Si osservano epatosplenomegalia
e anomalie scheletriche simili a quelle delle mucopolisaccaridosi
(anomalie vertebrali, allargamento della sella turcica, ispessimento del calvario). Entro il primo anno di vita, la maggior parte dei
pazienti perde la vista e l’udito in seguito a grave compromissione
neurologica, caratterizzata da rigidità decerebrata. La mortalità
nei primi 3-4 anni è elevata. La gangliosidosi GM1 a esordio giovanile (tipo 2) è un’entità clinica distinta, che si manifesta a età
variabili. I pazienti colpiti presentano sintomi neurologici quali
atassia, disartria, ritardo mentale e spasticità. Il deterioramento
è lento e i pazienti possono sopravvivere fino alla quarta decade.
Il coinvolgimento viscerale e le anomalie morfologiche e scheletriche tipiche del tipo 1 sono assenti. Per entrambe le forme non
è attualmente disponibile alcun trattamento.
La diagnosi di gangliosidosi GM1 andrebbe sospettata in presenza di un bambino con le caratteristiche cliniche tipiche. La dimostrazione del deficit di attività della -galattosidasi su leucociti
periferici o colture di fibroblasti cutanei consente di confermare
la diagnosi. Le malattie che condividono alcuni aspetti della
gangliosidosi GM1 includono la malattia di Hurler (mucopolissaccaridosi di tipo 1), la malattia a cellule con inclusi e la malattia
di Niemann-Pick (NPD, Niemann-Pick Disease) di tipo A. La
diagnosi differenziale è facilitata dal dosaggio delle specifiche
attività enzimatiche. I portatori sani del disturbo sono identificati mediante la misurazione dell’attività enzimatica su globuli
bianchi o colture di fibroblasti cutanei; la diagnosi prenatale è
realizzata tramite la determinazione dell’attività enzimatica su
colture di amniociti o villi coriali.
GANGLIOSIDOSI GM2. La gangliosidosi GM2 include la malattia di
Tay-Sachs e la malattia di Sandhoff. Entrambe derivano dal deficit di attività della -esosaminidasi e dall’accumulo lisosomiale
di gangliosidi GM2, in particolare nel sistema nervoso centrale.
Sulla base dell’età di comparsa delle manifestazioni e delle ca-
23-09-2008 11:52:10
616
■
PARTE X
■
Malattie metaboliche
↑ GAG URINARIE
↑ OLIGOSACCARIDI PATOLOGICI
–
–
–
–
–
–
–
–
–
(+)
(+)
–
–
–
–
+
+
–
–
–
–
–
–
–
Ceramidasi
-galattosidasi e sialidasi
-galattosidasi
-esosaminidasi A e B
–
–
(+)
(+)
–
–
–
++
++
–
–
(+)
++
+
(+)
+
++
+
(+)
–
–
+
++
++
++
–
_
(+)
–
+
–
_
+
(+)
+
–
+
–
–
–
–
(+)
+
++
++
+
–
+
+
–
++
–
+
+
–
–
–
+
–
–
–
–
–
–
–
–
–
+
+
+
Glucocerebrosidasi
Glucocerebrosidasi
Glucocerebrosidasi
Sfingomielinasi
Arilsolfatasi A
-galattocerebrosidasi
–
(+)
(+)
(+)
–
–
–
–
–
–
–
–
+
+
+
++
–
–
–
–
–
–
–
–
–
++
+
+
++
++
–
+
(+)
(+)
–
–
–
+
(+)
–
+
+
–
–
–
(+)
++
++
–
–
–
(+)
(+)
(+)
–
–
–
(+)
–
–
–
–
–
–
–
–
–
–
–
+
–
–
–
–
–
–
–
–
+
+
+
–
–
–
Trasporto intracellulare del colesterolo
Acido lipasi
Palmitoil-proteintioesterasi (CLN1)
Peptidasi insensibile alla pepstatina (CLN2). Varianti
Finlandia (CLN5), Turchia (CLN7) e Italia (CLN6)
CLN3, proteina di membrana
CLN4, probabilmente eterogeno
–
(+)
–
–
–
–
–
–
(+)
+
–
–
–
(+)
–
–
+
–
+
+
–
–
+
+
–
–
+
+
–
–
–
–
(+)
(+)
–
–
–
–
–
–
–
–
–
–
+
+
+
+
–
–
–
–
–
–
–
–
–
(+)
–
–
–
–
–
–
+
+
–
–
(+)
–
–
–
–
–
–
–
–
–
(+)
(+)
–
–
–
–
Aspartilglucosaminasi
–
–
–
–
–
(+)
(+)
+
++
++
+
–
–
++
(+)
(+)
+
(+)
–
–
+
(+)
+
–
–
–
–
+
+
++
++
+
+
–
++
–
+
–
–
+
++
(+)
–
+
(+)
+
+
+
–
–
–
–
+
–
+
–
–
–
–
–
–
++
++
(+)
–
++
–
–
(+)
–
(+)
(+)
(+)
(+)
–
–
+
+
+
+
–
–
+
+
–
–
–
–
–
–
–
+
+
+
+
+
+
+
Sconosciuto
-galattosidasi
-fucosidasi
-mannosidasi
-mannosidasi
-N-acetilgalattosaminidasi
Sialidasi
Sialidasi
MACCHIA ROSSO CILIEGIA
LINFOCITI VACUOLATI
–
–
–
ANGIOCHERATOMA
++
(+)
(+)
OFFUSCAMENTO CORNEALE
++
–
–
NEUROPATIA PERIFERICA
+
(+)
+
SPASTICITÀ
DETERIORAMENTO MENTALE
++
+
–
N-acetilglucosaminilfosfotransferasi
N-acetilglucosaminilfosfotransferasi
MIOCLONO
COINVOLGIMENTO CARDIACO,
INSUFFICIENZA CARDIACA
(+)
–
–
DIFETTO ENZIMATICO
EPATOSPLENOMEGALIA
LINEAMENTI GROSSOLANI,
DISOSTOSI MULTIPLA
NOMENCLATURA
MUCOLIPIDOSI
Mucolipidosi II, malattia a cellule con inclusi
Mucolipidosi III, pseudo-Hurler
Mucolipidosi IV
SFINGOLIPIDOSI
Malattia di Fabry
Malattia di Farber
Galattosialidosi
Gangliosidosi GM1
Gangliosidosi GM2 (malattia di Tay-Sachs, malattia
di Sandhoff )
Gaucher tipo I
Gaucher tipo II
Gaucher tipo III
Niemann-Pick tipo 1 (A e B)
Leucodistrofia metacromatica
Malattia di Krabbe
DISTURBI DELL’IMMAGAZZINAMENTO LIPIDICO
Niemann-Pick tipo II (C e D)
Malattia di Wolman
Lipofuscinosi ceroide infantile (Santavuori-Hantia)
Lipofuscinosi ceroide infantile tardiva (JanskyBielschowsky)
Lipofuscinosi ceroide giovanile (Spielmeyer-Vogt)
Lipofuscinosi ceroide, forma adulta (Kufs, Parry)
OLIGOSACCARIDOSI
Aspartilglucosaminuria
Fucosidosi
-mannosidosi
-mannosidosi
Malattia di Schindler
Sialidosi I
Sailidosi II
IDROPE FETALE
TABELLA 86-16. Diagnosi differenziale delle malattie da accumulo lisosomiale
++, marcata; +, spesso presente; (+), incostante o evidente solo nella fase tardiva; –, non presente
GAG, glicosaminoglicani
Modificata da Hoffmann GF, Nyhan WL, Zchoke J et al: Storage in Inherited Metabolic Diseases, Philadelphia, Lippincott, Williams & Wilkins, 2002, pp. 346-351.
ratteristiche cliniche, entrambi i disturbi sono classificati nelle
forme a esordio infantile, giovanile e adulto. La -esosaminidasi
è composta da due isozimi: -esosaminidasi A (composto da
una sottounità e una ) e -esosaminidasi B (composto da due
sottounità ). Il deficit della -esosaminidasi è il risultato di mutazioni della sottounità , che causano la malattia di Tay-Sachs.
Invece, mutazioni della sottounità determinano un deficit di
entrambe le -esosaminidasi (tanto la A quanto la B), provocando la malattia di Sandhoff. Entrambe le malattie si trasmettono
con modalità autosomica recessiva. La prima è particolarmente
diffusa nella popolazione ebrea askenazita, con una frequenza
dei portatori di 1/25.
Sono state finora identificate più di 50 mutazioni, per la maggior parte associate alle forme infantili. Tre mutazioni sono responsabili di circa il 98% degli alleli mutanti della malattia di
Tay-Sachs nei portatori ebrei askenaziti (incluso un allele associato con la forma a esordio adulto). Le mutazioni che causano
le forme subacuta o cronica producono proteine con una certa
attività enzimatica residua, il cui livello è correlato alla gravità
della malattia.
I pazienti con la forma infantile della malattia di Tay-Sachs
presentano manifestazioni cliniche di perdita di abilità motorie,
intensificazione del riflesso di allarme, pallore maculare e macchie retiniche rosso ciliegia (vedi Tab. 86-16). I bambini colpiti
84-92ANA.indd 616
solitamente si sviluppano normalmente fino ai 4-5 mesi, quando
la diminuzione del contatto oculare e l’esagerata risposta di trasalimento (iperacusia) cominciano a essere notati. Può svilupparsi
macrocefalia, non associata a idrocefalo. Nel secondo anno di
vita insorgono convulsioni che richiedono una terapia anticonvulsivante. La degenerazione nervosa progressiva conduce alla
morte entro i 4-5 anni. La forma a esordio giovanile si presenta
inizialmente con atassia e disartria, ma non sempre si nota la
macchia rosso ciliegia sulla macula.
Le manifestazioni cliniche della malattia di Sandhoff sono simili alle precedenti, ma prevedono anche epatosplenomegalia,
coinvolgimento cardiaco e lievi anomalie ossee. L’esordio della
forma giovanile è con atassia, disartria e deterioramento mentale, ma senza espansione viscerale e presenza della macchia rosso
ciliegia sulla macula. Per entrambe le malattie non è disponibile
alcun tipo di trattamento.
La diagnosi di malattia di Tay-Sachs infantile e malattia di
Sandhoff è solitamente sospettata in un bambino con disturbi
neurologici associati alla caratteristica macchia rossa. La diagnosi definitiva è determinata dalla misura del livello di -esosaminidasi A e B su leucociti. Il dosaggio enzimatico consente la
diagnosi differenziale tra le due malattie, perché nella malattia
di Tay-Sachs si riscontra soltanto il deficit di -esosaminidasi A,
mentre nella malattia di Sandhoff sia le -esosaminidasi A sia le
23-09-2008 11:52:10
Capitolo 86
Neuramidasi
gal
gal
glc
ceramide
NAcgal
gal
NANA
NANA
NANA
NAcgal
gal
NANA
■
Difetti del metabolismo lipidico
■
617
glc-ceramide
Ganglioside GM1 -galattosidasi
Gangliosidosi GM1
Polisialogangliosidi
NAcgal
gal
glc-ceramide
NANA
-esosaminidasi A
Gangliosidosi GM2
(Tay-Sachs, Sandhoff e altre)
gal
glc-ceramide
NANA
Ganglioside GM3 neuraminidasi
PC-ceramide
Sfingomielinasi
Malattia di Niemann-Pick
gal
glc-ceramide
Lattosilceramide -galattosidasi
Gangliosidosi GM1, malattia di Krabbe
glc-ceramide
Glucosilceramide -glucosidasi
Malattia di Gaucher
SO4
gal
Sulfatide
Sulfatasi
ceramide
Galattosilceramide
-galattosidasi
gal-ceramide
Leucodistrofia
metacromatica
Malattia di Krabbe
Ceramidasi
ceramide
sfingosina acido grasso
Malattia di Farber
Figura 86-15. Vie metaboliche degli sfingolipidi nei tessuti nervosi. Il nome dell’enzima che catalizza ciascuna reazione è fornito insieme al nome del substrato
su cui agisce. Gli errori congeniti sono indicati con la doppia barra che interrompe le frecce (le reazioni) e il nome del difetto (o dei difetti) associati è riportato
nel riquadro più vicino. Per la denominazione dei gangliosidi è stata adottata la nomenclatura di Svennerholm. Le configurazioni anomeriche sono fornite solo
per la formazione iniziale del composto. Gal, galattosio; glc, glucosio; NAcgal, N-acetilgalattosamina; NANA, acido N-acetilneuraminico; PC, fosforilcolina.
B sono carenti. La diagnosi prenatale nelle gravidanze a rischio
è realizzata mediante amniocentesi o prelievo di un campione di
villi coriali. La determinazione della -esosaminidasi A e B consente l’identificazione dei portatori nelle famiglie. Per prevenire
la malattia di Tay-Sachs si consiglia lo screening (precedente alla
gravidanza) di tutte le coppie in cui almeno uno dei due membri
è di origine ebrea askenazita, mediante determinazione dell’attività della -esosaminidasi A su leucociti periferici o plasma. Gli
studi molecolari per identificare lo specifico difetto molecolare
nei portatori consentono la diagnosi prenatale delle coppie a
rischio, mediante determinazione enzimatica e genotipica. L’incidenza della malattia di Tay-Sachs è stata drasticamente ridotta
dall’introduzione dei programmi di screening sulla popolazione
ebrea askenazita. Lo screening neonatale è possibile mediante la
misurazione di specifici marcatori dei glicosfingolipidi.
MALATTIA DI GAUCHER. La malattia di Gaucher è una lipidosi
multisistemica caratterizzata da problemi ematologici, organomegalia e coinvolgimento scheletrico (che si manifesta con dolore
osseo e fratture patologiche; vedi Tab. 86-16). Costituisce il più
comune disturbo dell’accumulo lisosomiale e il difetto genetico
prevalente nella popolazione ebrea askenazita. Sulla base della
presenza o assenza di manifestazioni neurologiche e della loro
progressione, è stato possibile distinguere tre sottotipi clinici: il ti-
84-92ANA.indd 617
po 1 (forma adulta o non neuropatica); il tipo 2 (forma infantile o
neuropatica acuta); il tipo 3 (forma giovanile o di Norrbottnian).
Tutti e tre i tipi si trasmettono con modalità autosomica recessiva.
Il tipo 1, responsabile del 99% dei casi, è particolarmente diffuso
tra gli ebrei askenaziti, con un’incidenza di circa 1/1000 e una
frequenza di 1/18.
La malattia di Gaucher è il risultato del deficit di attività
dell’idrolasi lisosomiale (acido -glucosidasi), codificata da un
gene localizzato sul cromosoma 1q21-q31. Questo difetto enzimatico provoca l’accumulo nelle cellule del sistema reticoloendoteliale di substrati glicolipidici non degradati, in particolare glucosilceramide, fino a che tale deposizione determina un’infiltrazione
nel midollo osseo, epatosplenomegalia progressiva e complicanze
scheletriche.
Quattro mutazioni (N370S, L444P, 84insG e IVS2) sono responsabili del 95% degli alleli mutanti nei pazienti ebrei askenaziti e consentono perciò lo screening in questa popolazione. Le
correlazioni genotipo-fenotipo che sono state notate forniscono
una spiegazione molecolare per l’eterogeneità clinica osservata
nella malattia di Gaucher di tipo 1, caratterizzata da gravità ed
età di esordio variabili.
Nei pazienti omozigoti per la mutazione N370S, l’esordio è
tardivo e il decorso più indolente rispetto ai pazienti con una copia
di N370S e un altro allele comune.
23-09-2008 11:52:10
618
■
PARTE X
■
Malattie metaboliche
fuc
fuc
gal
gal
NAcglc
gal
glc
gal
NAcglc
gal
glc
ceramide
NAcgal
Glicosfingolipidi gruppo sanguigno A
-galattominidasi
-galattosidasi
ceramide
fuc
gal
NAcglc
Malattia di Fabry
Glicosfingolipidi gruppo sanguigno B
gal
gal
glc
glc
ceramide
Glicosfingolipidi gruppo sanguigno O
-fucosidasi
Fucosidosi
gal
NAcgal
gal
NAcglc
gal
glc-ceramide
-galattosidasi
ceramide
GM1 gangliodisosi
Globoside
-esosaminidasi A e B
NAcglc
Gangliosidosi GM2 (Sandhoff)
gal
glc-ceramide
-esosaminidasi (probabilmente A e B)
Gangliosidosi GM2, alcuni tipi
Triesosilceramide
-galattosidasi
gal
gal
glc-ceramide
gal
Malattia di Fabry
glc-ceramide
Lattosilceramide -galattosidasi
Gangliosidosi GM1, malattia di Krabbe
Gangliosidosi GM3
neuraminidasi
NANA
gal
glc
glc-ceramide
Glucosilceramide -glucosidasi
ceramide
Malattia di Gaucher
Sfingomielinasi
PC-ceramide
Malattia di Niemann-Pick
Ceramidasi
ceramide
sfingosina acido grasso
Malattia di Farber
Figura 86-16. Vie metaboliche della degradazione degli sfingolipidi negli organi viscerali e nei globuli bianchi e rossi. Vedi la legenda della Figura 86-15. Fuc,
fucoso; NAcglc, N-acetilglucosamina.
Le manifestazioni cliniche del tipo 1 esordiscono a un’età variabile, compresa tra la prima infanzia e la tarda età adulta, ma
la maggior parte dei pazienti sintomatici è adolescente. I sintomi
di presentazione includono ematomi da trombocitopenia, fatica
cronica secondaria all’anemia, epatomegalia (con o senza aumento degli enzimi epatici), splenomegalia e dolore osseo. Alcuni
soggetti presentano coinvolgimento polmonare fino dall’esordio.
I pazienti sintomatici nella prima decade solitamente non sono
ebrei, presentano ritardo dello sviluppo e un decorso della malattia più grave. In altri soggetti con forma più lieve e decorso
benigno la malattia è scoperta casualmente durante esami medici
di routine. Nei casi sintomatici la splenomegalia è progressiva e
può diventare massiva. Il coinvolgimento scheletrico è frequente,
in particolare la deformità a fiasco di Erlenmeyer del femore
distale. Il coinvolgimento osseo, evidente in circa il 20% dei
casi, si presenta con dolore osseo o fratture patologiche. Lesioni
litiche possono svilupparsi nelle ossa lunghe come femore, coste
o pelvi; l’osteoporosi può svilupparsi in una fase molto precoce.
Si riscontrano anche crisi ossee, con grave dolore e tumefazione.
Emorragie secondarie alla trombocitopenia si manifestano con
84-92ANA.indd 618
epistassi o ematomi, spesso trascurate fino alla comparsa di sintomi più gravi. Lo sviluppo e l’intelligenza sono nella norma, se si
escludono i bambini con grave ritardo dello sviluppo secondario
agli effetti della malattia cronica.
La caratteristica patognomonica della malattia di Gaucher è
la presenza di cellule di Gaucher nel sistema reticoloendoteliale,
in particolare nel midollo osseo (Fig. 86-17). Queste cellule, che
misurano 20-100 m di diametro, hanno un tipico aspetto a
carta stropicciata, risultato delle inclusioni di substrato intracitoplasmatico. Il citoplasma delle cellule di Gaucher reagisce
positivamente alla colorazione PAS. La presenza di queste cellule
nel midollo osseo e nei campioni di tessuti è altamente suggestiva
della malattia di Gaucher, per quanto si possano trovare anche
nei pazienti con leucemia granulocitica e mieloma.
La malattia di Gaucher di tipo 2 è molto meno comune del tipo
1 e non possiede alcuna predilezione etnica. È caratterizzata da
un rapido decorso neurodegenerativo con esteso coinvolgimento
viscerale, che conduce al decesso nei primi due anni di vita. La
malattia esordisce con ipertonia, strabismo e organomegalia. Il
deficit staturo-ponderale e lo stridore causato dal laringospasmo
23-09-2008 11:52:10
Capitolo 86
Figura 86-17. Cellule della milza di un paziente con malattia di Gaucher,
infarcite di glucocerebrosidi.
sono tipici. Dopo un periodo di regressione psicomotoria, che si
protrae per diversi anni, la compromissione respiratoria causa la
morte del paziente.
La malattia di Gaucher di tipo 3 appare nell’infanzia con
manifestazioni cliniche intermedie tra quelle del tipo 1 e 2, causando il decesso entro i primi 10-15 anni. È particolarmente
diffusa nella popolazione svedese della contea di Norrbotten, con
un’incidenza di 1/50 000. Il coinvolgimento neurologico insorge
più tardivamente e con un decorso meno grave rispetto al tipo
2. La malattia di tipo 3 è ulteriormente suddivisa nei sottotipi
3a e 3b, sulla base dell’estensione del danno neurologico e della
presenza di miotonia progressiva e demenza (tipo 3a) o di paralisi
sopranucleare (tipo 3b).
La malattia di Gaucher deve essere presa in considerazione
nella diagnosi differenziale di pazienti con organomegalia inspiegabile, tendenza agli ematomi, dolore osseo (o una combinazione
di questi sintomi). L’esame del midollo osseo solitamente rivela la
presenza delle cellule di Gaucher. In caso di sospetto, la diagnosi deve essere confermata mediante determinazione dell’attività
dell’acido -glucosidasi su leucociti isolati o fibroblasti in coltura. L’identificazione del portatore è realizzata con il dosaggio
enzimatico e con la successiva conferma dei risultati mediante
un test molecolare.
Ai membri delle famiglie ebree deve essere offerta l’opportunità di sottoporsi allo screening, considerando che l’eterogeneità
può essere talmente elevata, anche nello stesso gruppo familiare,
da condurre alla diagnosi di individui asintomatici. La diagnosi prenatale è realizzabile mediante determinazione dell’attività
enzimatica su campioni villi coriali o colture di cellule prelevate
dal liquido amniotico.
Il trattamento dei pazienti con malattia di Gaucher di tipo 1
prevede la terapia di sostituzione enzimatica con acido ricombinante -glucosidasi (imiglucerasi).
La maggior parte dei sintomi extrascheletrici (organomegalia, indici ematologici) è reversibile mediante una dose iniziale
dell’enzima di 60 UI/kg, somministrato per infusione endovenosa
a cadenza quindicinale. Una dose di mantenimento mensile consente di migliorare la struttura ossea, ridurre il dolore e indurre una crescita compensatoria nei bambini colpiti. Una piccola
percentuale di pazienti è stata sottoposta a trapianto di midollo
osseo, ma questa procedura, benché curativa, possiede un elevato
indice di morbilità e mortalità, per cui richiede un’attenta selezione dei candidati.
Malgrado la terapia di sostituzione enzimatica non alteri la
progressione neurologica nei pazienti con malattia di Gaucher
di tipo 2 e 3, è stata utilizzata in alcuni casi selezionati come
palliativa, in particolare nel caso di un grave coinvolgimento
viscerale. Sono attualmente in sperimentazione trattamenti alternativi, come l’uso di agenti in grado di limitare la sintesi di glucosilceramide mediante inibizione chimica della glucosilceramide
sintasi o la terapia genetica per la malattia di tipo 1.
84-92ANA.indd 619
■
Difetti del metabolismo lipidico
■
619
MALATTIA DI NEIMANN-PICK (NPD). La descrizione iniziale di questa malattia si riferiva alla forma oggi nota con il nome di NPD
di tipo A, una malattia infantile fatale caratterizzata da deficit
staturo-ponderale, epatosplenomegalia e una rapida degenerazione neurologica progressiva, responsabile del decesso entro i primi
2-3 anni di vita. La NPD di tipo B è una forma non neuronopatica
osservata in bambini e adulti. Quella di tipo C è invece una forma
neuronopatica risultato di un deficit del trasporto di colesterolo.
Tutti e tre i sottotipi sono ereditati con modalità autosomica
recessiva e presentano una gamma estremamente variabile di
manifestazioni cliniche (vedi Tab. 86-16).
I tipi A e B sono provocati dal deficit di attività della sfingomielinasi acida, un enzima lisosomiale codificato da un gene
localizzato sul cromosoma 11 (11p15.1-p15.4). Questo difetto
enzimatico causa un accumulo patologico del fosfolipide sfingomielina e di altri lipidi nel sistema monocita-macrofago (sede
primaria della patologia). La progressiva deposizione di sfingomielina nel sistema nervoso centrale è responsabile del decorso
neurodegenerativo osservato nel tipo A; la deposizione nel tessuto
non neurale causa invece le manifestazioni sistemiche del tipo
B, inclusa la progressiva malattia polmonare osservata in alcuni
pazienti. Il gene per l’acido sfingomielinasi è stato sequenziato e
sono note svariate mutazioni responsabili di NPD A e B.
Le manifestazioni cliniche e il decorso dell’NPD A sono uniformi e caratterizzati da un aspetto normale alla nascita (ma
talvolta si segnala un ittero prolungato nel periodo neonatale).
Entro i 6 mesi di età si manifestano epatosplenomegalia, moderata linfoadenopatia e ritardo psicomotorio, seguiti da regressione
neuroevolutiva e dal decesso entro i 3 anni. Con la crescita, la
perdita della funzione motoria e il deterioramento delle capacità
intellettuali risultano sempre più debilitanti; negli stadi finali la
spasticità e la rigidità sono evidenti. I bambini colpiti perdono il
contatto con l’ambiente. A differenza del fenotipo A, la presentazione e il decorso del tipo B risultano più variabili. La maggior
parte dei casi è diagnosticata nell’infanzia, in seguito al riscontro
casuale, durante l’esame obiettivo, di un aumento del volume del
fegato o della milza (o di entrambi). Al momento della diagnosi,
i pazienti con NPD di tipo B presentano solitamente un lieve
coinvolgimento polmonare, che si evidenzia nella radiografia del
torace con una infiltrazione reticolare diffusa o finemente nodulare. Normalmente, i sintomi polmonari compaiono negli adulti.
Nella maggior parte dei pazienti l’epatosplenomegalia è particolarmente marcata nell’infanzia, ma la prominenza addominale si
attenua con la crescita. Nei casi più lievi le manifestazioni patologiche sono minime e la splenomegalia può passare inosservata
fino all’età adulta.
In alcuni pazienti con NPD di tipo B il calo della capacità di
diffusione polmonare causato dall’infiltrazione alveolare risulta
evidente nella tarda infanzia o in prima età adulta e continua
a progredire con l’età. I soggetti colpiti più gravemente vanno
incontro a grave compromissione polmonare entro i 15-20 anni.
Questi pazienti presentano valori PO2 ridotti e dispnea sotto
sforzo. Sono stati descritti casi di broncopolmonite fatale e cor
pulmonale. Il coinvolgimento epatico grave può causare cirrosi,
ipertensione portale e ascite. Una pancitopenia clinicamente significativa, dovuta a ipersplenismo secondario, può richiedere
una splenectomia parziale o completa; questa evenienza deve essere evitata per quanto possibile, perché provoca di frequente una
progressione della malattia polmonare con esiti potenzialmente
fatali. In generale, i pazienti di tipo B non presentano coinvolgimento neurologico e hanno un QI nella norma. In alcuni di essi
si riscontrano aloni o una macchia rosso ciliegia sulla macula e
lievi sintomi neurologici (neuropatia periferica).
Fatta eccezione per un possibile ittero prolungato nel periodo
neonatale, i pazienti con NPD C appaiono normali nei primi
1-2 anni, ma in seguito sperimentano un decorso neurodegenerativo lento e progressivo. La loro epatosplenomegalia è meno
grave rispetto ai pazienti con i tipi A e B e la sopravvivenza fino
all’età adulta è possibile. Il difetto biochimico responsabile della
malattia nei pazienti di tipo C è un’anomalia nel trasporto del
colesterolo, che causa l’accumulo di sfingomielina e colesterolo
23-09-2008 11:52:10
620
■
PARTE X
■
Malattie metaboliche
nei lisosomi e una riduzione secondaria parziale dell’attività della
sfingomielinasi acida (vedi Capitolo 86.3).
Nei pazienti con NPD di tipo B la splenomegalia è solitamente
la prima manifestazione notata nell’infanzia. Tuttavia nei casi
più lievi l’aumento di dimensioni può passare inosservato fino
all’adolescenza o all’età adulta. La presenza delle caratteristiche
cellule NPD negli aspirati midollari conferma la diagnosi di NPD
B. Anche i pazienti con NPD C possono presentare estese infiltrazioni di cellule NPD nel midollo osseo, perciò tutti i casi sospetti
devono essere valutati sul piano enzimatico, mediante la misura
dell’attività della sfingomielinasi acida su leucociti periferici, fibroblasti in coltura o linfoblasti (o una combinazione di questi
tre tipi di cellule). I pazienti con malattia di tipo A e B presentano
un marcato aumento dei livelli (1-10%), mentre nel tipo C si
osserva una riduzione di attività. L’identificazione enzimatica dei
portatori di NPD è problematica. Nelle famiglie in cui è stata
riscontrata la specifica lesione molecolare, tutti i membri devono
essere testati mediante analisi del DNA. La diagnosi prenatale dei
tipi A e B è realizzata senza difficoltà con la misura dell’attività
della sfingomielinasi acida su colture di amniociti o villi coriali;
l’analisi molecolare delle cellule fetali consente di confermare la
diagnosi. La diagnosi clinica di NPD C può essere dimostrata dalla positività alla colorazione con filipina su colture di fibroblasti
e/o identificazione di una specifica mutazione del gene NPC.
Non esiste alcun trattamento specifico per la NPD. Il trapianto
ortotopico di fegato in un bambino con il tipo A e il trapianto
di cellule amniotiche in diversi pazienti con il tipo B si sono rivelati fallimentari. Il trapianto di midollo in un piccolo numero
di pazienti con il tipo B ha consentito la riduzione del volume
di fegato e milza, del contenuto di sfingomielina nel fegato, del
numero di cellule di Niemann-Pick nel midollo e dell’infiltrazione
polmonare. Tuttavia, in un paziente biopsie epatiche prelevate
fino a 33 mesi dopo il trapianto hanno mostrato una riduzione
soltanto moderata della sfingomielina immagazzinata. A tutt’oggi
il trapianto polmonare non è mai stato eseguito nei pazienti con
malattia di tipo B e grave compromissione polmonare, ma sono
stati segnalati due casi sottoposti a lavaggio polmonare completo,
con risultati variabili.
Le prospettive future per il trattamento della malattia di tipo B
includono la sostituzione enzimatica e la terapia genica. Qualsiasi
tentativo di trattamento delle forme A e B è attualmente precluso
dal grave coinvolgimento neurologico.
MALATTIA DI FABRY. Questo errore congenito del metabolismo degli sfingolipidi è caratterizzato da angiocheratomi (telangectasie
cutanee), ipoidrosi, opacità corneali e lenticolari, acroparestesie
e malattia vascolare renale, cardiaca e/o cerebrale (vedi Tab. 8616). La malattia si trasmette con modalità autosomica recessiva
legata all’X e si manifesta nel sesso maschile, con una prevalenza
stimata di 1/40 000. Alcuni soggetti sono colpiti da una forma a
esordio tardivo, con attività residua della -galattosidasi A, che si
manifesta con malattia renale e/o cardiaca (inclusa la miocardiopatia ipertrofica e l’insufficienza renale). Le donne eterozigoti per
il fenotipo classico possono essere colpite altrettanto gravemente
degli uomini oppure risultare del tutto asintomatiche, in seguito
alla variabilità dovuta all’inattivazione random dell’X. La malattia è il risultato della deficitaria attività dell’-galattosidasi A, un
enzima lisosomiale codificato da un gene localizzato sul braccio
lungo del cromosoma X (Xq22). Tale difetto enzimatico causa
l’accumulo di glicosfingolipidi neutri, prevalentemente globotriaosilceramide, nel plasma e nei lisosomi delle cellule vascolari
endoteliali e della muscolatura liscia. La progressiva deposizione
vascolare di glicosfingolipidi provoca ischemia e infarto (manifestazioni più gravi della malattia). Le sequenze genomiche e del
cDNA che codificano per l’-galattosidasi A hanno consentito
di identificare più di 200 differenti mutazioni nel gene -galattosidasi A responsabili del deficit dell’accumulo lisosomiale, che
includono sostituzioni di amminoacidi, riarrangiamenti genetici
e difetti dello splicing dell’mRNA.
I maschi con il fenotipo classico presentano lesioni cutanee,
acroparestesie, ipoidrosi e alterazioni oculari, mentre in quelli
84-92ANA.indd 620
con la forma a esordio tardivo la patologia esordisce in età adulta, con malattia cardiaca e/o renale. Gli angiocheratomi classici
solitamente compaiono nell’infanzia e possono suggerire la diagnosi precoce; tendono ad aumentare in numero e dimensioni con
l’età. Le lesioni, alcune appena visibili, altre di diversi millimetri
di diametro, sono puntate, piatte o leggermente rilevate; di colore rosso scuro o blu-nero, non si decolorano con la pressione;
le più grandi possono manifestare una lieve ipercheratosi. Nella
maggior parte dei casi, tali lesioni tendono ad addensarsi tra
l’ombelico e il ginocchio, ma possono comparire anche in altre
sedi, inclusa la mucosa orale. Le localizzazioni più comuni includono anche cosce, natiche, ombelico, basso addome, scroto e
glande. Si nota una tendenza alla simmetria. Sono state descritte
varianti della malattia prive di lesioni cutanee. La sudorazione è
di solito ridotta o assente. Le opacità corneali e lenticolari, osservabili con la lampada a fessura, sono presenti nei soggetti colpiti
e nel 70% degli eterozigoti asintomatici. Anche la tortuosità dei
vasi di retina e congiuntiva è un sintomo comune, risultato del
coinvolgimento vascolare sistemico.
Il dolore è il sintomo più debilitante che colpisce bambini e
adolescenti. Le crisi di Fabry, che durano da qualche minuto
a diversi giorni, sono contrassegnate da un dolore tormentoso
e bruciante a mani, piedi e arti distali, solitamente associato
all’esercizio, alla fatica, alla febbre o ad una combinazione di
questi fattori. Tali dolorose acroparestesie tendono a divenire meno frequenti nella terza e quarta decade di vita, ma in alcuni casi
possono peggiorare, diventando ancora più gravi e frequenti. Gli
attacchi di dolore addominale o al fianco simulano l’appendicite
o una colica renale.
I principali sintomi patologici sono il risultato del progressivo coinvolgimento del sistema vascolare. Nella fase iniziale del
decorso della malattia, nei sedimenti urinari compaiono cilindri,
globuli rossi e inclusioni lipidiche con la caratteristica configurazione “a croce di Malta”. Tra la seconda e quarta decade si sviluppano proteinuria, isostenuria, graduale deterioramento della
funzione renale e iperazotemia. I reperti cardiovascolari possono
includere ipertensione, ipertrofia del ventricolo sinistro, dolore
toracico con i caratteri dell’angina, ischemia miocardica, infarto e
insufficienza cardiaca. L’insufficienza mitralica è la lesione valvolare più comune. Il riscontro di anomalie elettrocardiografiche ed
ecocardiografiche è comune. Le manifestazioni cerebrovascolari
sono il risultato del coinvolgimento multifocale dei piccoli vasi.
Gli altri sintomi includono bronchite cronica con dispnea, linfedema degli arti inferiori senza ipoproteinemia, diarrea episodica,
osteoporosi, ritardo della crescita e della pubertà. La mortalità
è spesso associata a uremia o malattia vascolare cardiaca o cerebrale. Prima dell’emodialisi e del trapianto renale, l’età media
della mortalità era 41 anni. Nelle varianti con esordio tardivo
e attività residua dell’-galattosidasi, si riscontrano la malattia
cardiaca e una lieve proteinuria, ma solitamente la funzione renale è integra. La manifestazioni cardiache includono ipertrofia
della parete del ventricolo sinistro e del setto interventricolare e
anomalie elettrocardiografiche tipiche della miocardiopatia. Alcuni pazienti vanno incontro a miocardiopatia ipertrofica, infarto
miocardico o entrambi.
Nei pazienti la diagnosi nei maschi con la forma classica è
formulata senza difficoltà grazie al riscontro anamnestico di
acroparestesie dolenti e ipoidrosi, alla presenza di caratteristiche
lesioni cutanee e all’osservazione di opacità corneali e lenticolari
tipiche. La malattia è spesso erroneamente diagnosticata come
febbre reumatica, eritromelalgia o nevrosi. La diagnosi differenziale delle lesioni cutanee deve escludere gli angiocheratomi
scrotali benigni (malattia di Fordyce) e l’angiocheratoma circoscritto. Angiocheratomi identici a quelli della malattia di Fabry
sono stati segnalati nella fucosidosi, nell’aspartilglicosaminuria,
nella gangliosidosi GM1 a esordio tardivo, nella galattosialidosi,
nel deficit di -acetilgalattosamidasi e nella sialidosi. Le varianti
a esordio tardivo sono state identificate in pazienti sottoposti a
emodialisi cronica. Al pari di quelle cardiache, tali varianti renali
sono prive delle manifestazioni iniziali classiche, come la comparsa di angiocheratomi, acroparestesie, ipoidrosi e opacità corneali.
23-09-2008 11:52:11
Capitolo 86
La diagnosi della forma classica e delle varianti è confermata sul
piano biochimico dalla dimostrazione della marcata riduzione di
attività dell’lfa-galattosidasi A nel plasma, su leucociti isolati o
colture di fibroblasti o linfoblasti.
Le donne eterozigoti possono presentare opacità corneali, lesioni cutanee isolate e un livello di attività intermedio dell’galattosidasi A nel plasma o nelle cellule. In rari casi queste
pazienti hanno manifestazioni cliniche altrettanto gravi di quelle
degli uomini. Nelle famiglie colpite dalla malattia di Fabry, le
donne asintomatiche vanno diagnosticate mediante analisi diretta
della specifica mutazione di quel gruppo familiare. La diagnosi
prenatale è realizzabile mediante la dimostrazione del deficit di
attività dell’-galattosidasi A o della presenza di una specifica
mutazione genetica su villi coriali ottenuti nel primo trimestre
della gravidanza o su colture di amniociti prelevati con amniocentesi nel secondo trimestre. Potenzialmente, lo screening neonatale
è in grado di rilevare la malattia di Fabry.
In passato il trattamento, aspecifico e di supporto, si limitava
all’uso di fenitoina e/o carbamazepina, per ridurre la frequenza
e l’intensità delle acroparestesie croniche e le periodiche crisi
di dolore insopportabile. Il trapianto renale e l’emodialisi consentono la sopravvivenza dei pazienti con insufficienza renale.
L’-galattosidasi ricombinante è un enzima sicuro ed efficace
utilizzato nella terapia di sostituzione, alla dose di 1 mg/kg, a
cadenza quindicinale.
FUCOSIDOSI. Questa rara malattia autosomica recessiva è causata da un deficit dell’attività dell’-fucosidasi e dal conseguente
accumulo di glicosfingolipidi, glicoproteine e oligosaccaridi contenenti fucoso nei lisosomi di fegato, cervello e di altri organi
(vedi Tab. 86-16). Il gene per l’-fucosidasi è localizzato sul
cromosoma 1 (1p24) e sono state identificate specifiche mutazioni
patogenetiche. Benché il disturbo sia panetnico, la maggior parte
dei pazienti è italiana o statunitense. Si nota un’estrema variabilità del fenotipo clinico. Nei soggetti colpiti più gravemente la
malattia esordisce nel primo anno di vita, con ritardo evolutivo e
caratteristiche somatiche analoghe a quelle della mucopolisaccaridosi (bozze frontali, epatosplenomegalia, lineamenti grossolani
e macroglossia). L’accumulo nel sistema nervoso centrale determina una neurodenegerazione progressiva e implacabile, con
esito fatale nell’infanzia. I pazienti colpiti dalle forme più lievi
presentano angiocheratomi, ma hanno una speranza di sopravvivenza più elevata. Non è disponibile alcuna terapia specifica. La
diagnosi è confermata dalla dimostrazione del deficit di attività
della -fucosidasi su leucociti periferici o colture di fibroblasti.
L’identificazione dei portatori e la diagnosi prenatale sono realizzabili mediante la determinazione dell’attività enzimatica.
MALATTIA DI SCHINDLER. Questa malattia autosomica recessiva è
il risultato di un deficit dell’attività dell’-N-acetilgalattosaminidasi e dal conseguente accumulo di sialilati, asialoglicopeptidi e
oligosaccaridi (vedi Tab. 86-16). Il gene per l’enzima è mappato
sul cromosoma 22 (22q13.1-13.2). La malattia è clinicamente
eterogenea e sono stati identificati due fenotipi principali. Il tipo
I consiste in una distrofia neuroassonale a esordio infantile. Dopo
i primi 9-15 mesi di sviluppo normale, i bambini colpiti vanno
incontro a un rapido decorso neurodegenerativo, che causa grave
ritardo psicomotorio, cecità corticale e convulsioni miocloniche
frequenti. La malattia di tipo II, a esordio variabile, è invece
caratterizzata da un lieve ritardo e dalla presenza di angiocheratomi. Per entrambe le forme non è disponibile alcuna terapia. La
diagnosi è confermata dalla dimostrazione del deficit enzimatico
su leucociti o colture di fibroblasti cutanei.
LEUCODISTROFIA METACROMATICA (MLD). L’MLD (Metachromatic LeukoDystrophy) è una malattia autosomica recessiva che colpisce la sostanza bianca ed è causata da un deficit di arilsolfatasi
A (ASA), necessario per l’idrolisi dei glicosfingolipidi solfatati.
Un’altra forma è invece determinata da un deficit di una proteina
attivatrice degli sfingolipidi (SAP1), richiesta per la formazione
del complesso substrato-enzima. Il deficit dell’attività enzimatica
84-92ANA.indd 621
■
Difetti del metabolismo lipidico
■
621
genera l’accumulo nella sostanza bianca di glicosfingolipidi solfatati, con conseguenti demielinizzazione e neurodegenerazione. Il
gene ASA si trova sul cromosoma 22 (22q13.31qter); le specifiche
mutazioni individuate sono classificate in due gruppi, correlati
alla gravità della malattia.
Le manifestazioni cliniche della forma infantile a esordio tardivo (la più comune) si presentano solitamente tra i 12 e i 18
mesi, con irritabilità, difficoltà di deambulazione e iperestensione del ginocchio che causa genu recurvatum. I riflessi tendinei profondi sono diminuiti o assenti. Il graduale logoramento
muscolare, la debolezza e l’ipotonia determinano uno stato di
grave debilitazione. Con il progredire della malattia, compaiono
nistagmo, convulsioni miocloniche, atrofia oculare e quadriparesi, con esito fatale nella prima decade di vita (vedi Tab. 86-16).
La forma giovanile del disturbo ha un corso più indolente e un
esordio tardivo (fino ai 20 anni), che avviene con disturbi della
deambulazione, deterioramento mentale, incontinenza urinaria e
difficoltà emotive. La forma adulta, che si presenta dopo la seconda decade, presenta manifestazioni cliniche analoghe alla forma
giovanile, ma le difficoltà emotive e la psicosi sono più marcate.
Sia nella forma giovanile sia in quella adulta si riscontrano anche
demenza, convulsioni, diminuzione dei riflessi e atrofia oculare.
La caratteristica patognomonica della MLD è la deposizione di
granuli metacromatici, che colorano fortemente con PAS e blu
alcian nella sostanza bianca cerebrale. Le inclusioni neuronali
sono evidenziabili nel mesencefalo, nel ponte, nel midollo, nella
retina e nel midollo spinale; la demielinizzazione colpisce il sistema nervoso periferico. Il trapianto di midollo osseo ha consentito
una normalizzazione dei livelli enzimatici nel sangue periferico,
ma non sembra rallentare il decorso neurologico. L’intervento di
elezione resta perciò la terapia di supporto.
La diagnosi è sospettata in pazienti con le caratteristiche cliniche della leucodistrofia. I reperti suggestivi di MLD sono una
riduzione della velocità di conduzione nervosa, un aumento delle
proteine nel liquido cerebrospinale, la presenza di depositi metacromatici in biopsie di nervo surale e di granuli metacromatici
nei sedimenti urinari. La conferma della diagnosi richiede la dimostrazione della ridotta attività di ASA su leucociti o fibroblasti
cutanei in coltura. Il deficit della proteina attivatrice degli sfingolipidi è diagnosticato mediante dosaggio della concentrazione di
SAP1 su colture di fibroblasti, utilizzando uno specifico anticorpo
della proteina. L’individuazione dei portatori e la diagnosi prenatale sono disponibili per tutte le forme.
DEFICIT MULTIPLO DI SOLFATASI. Questa malattia autosomica recessiva è il risultato del deficit dell’attività di tre enzimi: l’arilsolfatasi A, B e C. Solfatidi, mucopolisaccaridi, steroidi solfati e
gangliosidi si accumulano nella corteccia cerebrale e nei tessuti
viscerali, determinando un fenotipo clinico con caratteristiche
della leucodistrofia e della mucopolisaccaridosi. Può riscontrasi
anche una grave ittiosi. L’identificazione dei portatori e la diagnosi prenatale sono realizzabili mediante la misura delle attività enzimatiche. L’unico trattamento disponibile è quello di supporto.
MALATTIA DI KRABBE. Definita anche leucodistrofia a cellule globoidi, è una malattia autosomica recessiva infantile con esito
fatale, provocata dal deficit dell’attività enzimatica della galattocerebrosidasi e dall’accumulo nella sostanza bianca di galattosilceramide, normalmente riscontrata soltanto nella guaina mielinica. Il gene per la galattocerebrosidasi si trova sul cromosoma 14
(14q31) e sono state identificate specifiche mutazioni patogenetiche. La forma infantile, a rapida progressione, esordisce nella
prima infanzia con irritabilità, convulsioni e ipertonia (vedi Tab.
86-16). L’atrofia ottica è evidente già nel primo anno di vita e lo
sviluppo mentale risulta gravemente compromesso. Con il progredire della malattia, sia l’atrofia ottica sia il ritardo evolutivo
si aggravano e subentra opistotono. Si riscontra un esito fatale
entro il terzo anno di vita. È stata descritta anche una forma
infantile tardiva, che esordisce dopo i 2 anni e ha un decorso
clinico analogo a quello della forma precoce. Il trapianto di midollo è stato tentato in diversi casi a esordio tardivo, ma senza
23-09-2008 11:52:11
622
■
PARTE X
■
Malattie metaboliche
risultati significativi. Il trapianto di cellule da sangue del cordone
ombelicale nei primi 2 mesi di vita dei pazienti presintomatici ha
consentito l’attecchimento dell’innesto e la normalizzazione dei
livelli ematici di galattocerebrosidasi. Nei follow-up a tre anni,
l’acquisizione delle tappe evolutive, la mielinizzazione cerebrale
e le funzioni cognitive risultano nella norma rispetto all’età. Ciononostante, alcuni pazienti manifestano un ritardo del linguaggio
da lieve a moderato e un ritardo da lieve a grave della motricità
grossolana. La diagnosi di malattia di Krabbe si basa sulla dimostrazione dello specifico deficit enzimatico nei globuli bianchi
o su colture di fibroblasti cutanei. L’identificazione dei portatori
e la diagnosi prenatale sono disponibili.
MALATTIA DI FARBER. Questa malattia autosomica recessiva è il
risultato di un deficit dell’enzima lisosomiale ceramidasi e del
conseguente accumulo di ceramide in vari tessuti, in particolare
nelle articolazioni. I sintomi possono esordire già nel primo anno di vita, con articolazioni tumefatte e dolenti e formazione di
noduli (Fig. 86-18), talvolta diagnosticati come artrite reumatoide. Con la progressione della malattia, i noduli e le formazioni
granulomatose sulle corde vocali causano raucedine e difficoltà
respiratorie. Il deficit staturo-ponderale è comune. In alcuni pazienti si riscontra una moderata disfunzione del sistema nervoso
centrale (vedi Tab. 86-16). La mortalità in seguito a polmonite ricorrente nell’adolescenza è elevata. Attualmente non è disponibile
alcuna terapia specifica. La diagnosi deve essere sospettata nei
pazienti con noduli a livello delle articolazioni, in assenza degli
altri sintomi tipici dell’artrite reumatoide. In tali casi, l’attività
della ceramide può essere determinata su colture di fibroblasti
o globuli bianchi. L’individuazione dei portatori e la diagnosi
prenatale sono disponibili.
MALATTIA DI WOLMAN E DISTURBO DELL’ACCUMULO DI ESTERI DEL
COLESTEROLO. Questi disturbi autososmici recessivi dell’accumulo lisosomiale sono il risultato di un deficit della lipasi acida e
del conseguente accumulo di colesterolo esteri e trigliceridi nelle
cellule schiumose istiocitiche della maggior parte degli organi
viscerali. Il gene lisosomiale per la lipasi acida è localizzato sul
cromosoma 10 (10q24-q25). La malattia di Wolman possiede il
fenotipo clinico più grave e ha un esito fatale nell’infanzia. Le
caratteristiche cliniche, evidenti già nella prima settimana di vita,
includono deficit staturo-ponderale, vomito cronico, distensione
addominale, steatorrea ed epatosplenomegalia (vedi Tab. 86-16).
Di solito è presente anche l’iperlipidemia e possono insorgere una
disfunzione epatica e una fibrosi. La presenza di calcificazioni
delle ghiandole surrenali è un sintomo patognomonico della malattia. La mortalità entro i primi sei mesi è elevata.
Il disturbo dell’accumulo degli esteri del colesterolo costituisce
una forma meno grave della malattia, solitamente diagnosticata
soltanto in età adulta. L’epatomegalia può essere l’unica anomalia
evidente, ma gli individui colpiti presentano un rischio significativo si sviluppare aterosclerosi prematura. Non si osserva alcuna
calcificazione surrenale.
La diagnosi e l’identificazione dei portatori è basata sulla misura dell’attività della lipasi acida su leucociti o colture di fibroblasti
cutanei. La diagnosi prenatale è realizzata mediante misurazione
della riduzione dei livelli enzimatici su colture di villi coriali o
amniociti. Non è disponibile alcuna terapia per i due disturbi. In
pazienti con disturbo dell’accumulo degli esteri del colesterolo
è stata tentata la somministrazione di agenti soppressori della
sintesi del colesterolo, in combinazione con colestiramina e con
una modifica della dieta (vedi Capitolo 86.3).
Charrow J, Anderson HC, Kaplan P, et al: Enzyme replacement therapy and
monitoring for children with type 1 Gaucher disease: Consensus recommendations. J Pediatr 2004;144:112–120.
Clark JTR: Narrative review: Fabry disease. Ann Intern Med 2007;146:
425–433.
Desnick RJ, Brady R, Barranger J, et al: Fabry disease, an under-recognized multi-systemic disorder: Expert recommendations for diagnosis, management, and enzyme replacement therapy. Ann Intern Med 2003;138:
338–346.
Elstein D, Abrahamov A, Hadas-Halpern I, et al: Gaucher’s disease. Lancet
2001;358:324–337.
Escolar ML, Poe MD, Provenzale JM, et al: Transplantation of umbilical-cord blood in babies with infantile Krabbe’s disease. N Engl J Med
2005;20:2069–2080.
Johnson WG: The clinical spectrum of hexosaminidase deficiency diseases.
Neurology 1981;31:1453–1456.
Kaplan P, Anderson HC, Kacena KA, Yee JD: the clinical and demographic
characteristics of nonneuronpathic Gaucher disease in 887 children at diagnosis. Arch Pediatr Adolesc Med 2006;160:603–608.
Meikle PJ, Ranieri E, Simonsen H, et al: Newborn screening for lysosomal storage disorders: Clinical evaluation of a two-tier strategy. Pediatrics
2004;114:909–916.
Mistry PK, Abrahamov A: A practical approach to diagnosis and management
of Gaucher’s disease. Baillieres Clin Haematol 1997;10:817–838.
Schuchman EH, Desnick RJ: Types A and B Niemann Pick disease. In Scriver
CR, Beaudet AL, Sly WS, et al (eds): The Metabolic and Molecular Bases
of Inherited Disease, 8th ed. New York, McGraw-Hill, 2001.
Wilcox WR, Banikazemi M, Guffon N, et al: Long-term safety and efficacy of enzyme replacement therapy for Fabry disease. Am J Hum Genet
2004;75:65–74.
86.5 • MUCOLIPIDOSI • Margaret M. McGovern
e Robert Desnick
Figura 86-18. Avambraccio di una bambina di 18 mesi con malattia di Farber.
L’articolazione appare gonfia e dolente e si vede la formazione di noduli. Inizialmente era stata sospettata la presenza di artrite reumatoide.
84-92ANA.indd 622
La mucolipidosi II (ML-II o I-cell disease) e la mucolipidosi III
(ML-III o polidistrofia pseudo-Hurler) sono rare malattie a trasmissione autosomica recessiva, biochimicamente simili, che condividono alcune caratteristiche cliniche della sindrome di Hurler.
Sono il risultato di un’anomalia nel trasporto di enzimi lisosomali
appena sintetizzati, normalmente riconosciuti da specifici recettori localizzati sulla superficie della membrana lisosomiale, che
reagiscono alla presenza di residui di mannoso-6-fosfato. Questi
marker di riconoscimento sono sintetizzati nel corso di una reazione a due fasi che si realizza nell’apparato del Golgi, mediata
da due attività enzimatiche. Sia nella ML-II sia nella ML-III si
riscontra un deficit dell’enzima che catalizza il primo passaggio,
l’UDP-N-acetilglucosamina: N-acetilglucosamina-1-fosfotransferasi lisosomiale. Tale deficit causa la secrezione dell’enzima nella
matrice extracellulare. Dato che gli enzimi lisosomali richiedono l’ambiente acido dei lisosomi per funzionare, i pazienti con
23-09-2008 11:52:11
Capitolo 87
questo difetto accumulano differenti substrati. La diagnosi di
ML-II e ML-III è formulata in seguito al riscontro di un’elevazione dell’attività enzimatica lisosomiale nel siero o mediante
dimostrazione della riduzione dei livelli enzimatici su colture di
fibroblasti cutanei. È possibile anche la misura diretta dell’attività
della fosfotransferasi. La diagnosi prenatale e l’identificazione
dei portatori sono realizzabili in entrambi i disturbi, mediante
misurazione dell’attività enzimatica lisosomiale su colture di cellule. Lo screening neonatale con spettrometria di tandem massa
consente di diagnosticare la ML-II.
MUCOLIPIDOSI II (ML-II O I-CELL DISEASE). Questa malattia condivide molte delle manifestazioni cliniche della sindrome di Hurler,
ma non si riscontra mucopolisaccariduria e l’esordio è più precoce (vedi Tabella 86-16). Alcuni pazienti mostrano caratteristiche
cliniche evidenti fino dalla nascita, come lineamenti grossolani,
anomalie craniofaciali, limitazione dei movimenti articolari e ipotonia. Nel feto può essere presente idrope non immune. In altri
pazienti la malattia compare nel primo anno di vita con grave ritardo psicomotorio, lineamenti grossolani e manifestazioni
scheletriche che includono cifoscoliosi e gibbo lombare. Si può
riscontrare anche lussazione congenita dell’anca, ernia inguinale
e ipertrofia gengivale. A causa del grave e progressivo ritardo
psicomotorio, la mortalità nella prima infanzia è elevata. Non è
disponibile alcun trattamento.
MUCOLIPIDOSI III (ML-III O POLIDISTROFIA PSEUDO-HURLER). Questa malattia (meno grave della precedente) ha un esordio più tardivo e consente la sopravvivenza del paziente fino all’età adulta.
Le manifestazioni iniziali, intorno ai 4-5 anni, includono rigidità
articolare e bassa statura. Si nota in seguito la progressiva distruzione delle articolazioni dell’anca e una moderata disostosi
multipla. La radiografia mostra ali iliache tozze, appiattimento
dell’epifisi prossimale del femore, coxa valga della testa femorale, ipoplasia del terzo anteriore delle vertebre lombari. I reperti
oftalmici includono offuscamento corneale, retinopatia e astigmatismo; i sintomi visivi sono rari (vedi Tab. 86-16). Alcuni
pazienti presentano disturbi dell’apprendimento o ritardo mentale. Il trattamento è sintomatico e mirato ad alleviare i sintomi
ortopedici.
Capitolo 87 ■ Disturbi del metabolismo
dei carboidrati Priya S. Kishnani
e Yuan-Tsong Chen
La sintesi e la degradazione dei carboidrati forniscono l’energia
necessaria per la maggior parte dei processi metabolici. I carboidrati principali includono i monosaccaridi (glucosio, galattosio
e fruttosio) e un polisaccaride (glicogeno). Le vie metaboliche
dei carboidrati sono illustrate nella Figura 87-1. Il glucosio è
il principale substrato del metabolismo energetico e i suoi livelli ematici sono mantenuti costanti dalla continua assunzione
alimentare e dai processi di gluconeogenesi e glicogenolisi del
glicogeno. Il metabolismo del glucosio genera adenosina trifosfato (ATP, Adenosine TriPhosphate) mediante glicolisi (conversione del glucosio o del glicogeno in piruvato), fosforilazione
ossidativa mitocondriale (conversione del piruvato in diossido di
carbonio e acqua) o entrambi i processi. Il glucosio alimentare
deriva dall’ingestione di polisaccaridi (principalmente amido) e
disaccaridi (lattosio, maltosio e saccarosio). L’assunzione orale
di glucosio è irregolare e incostante, perciò per mantenere uno
stato euglicemico è necessario produrlo a partire dagli amminoacidi, principalmente dall’alanina (gluconeogenesi); tuttavia,
l’attivazione di questo processo richiede tempo. La scissione del
glicogeno epatico garantisce una rapida liberazione di glucosio,
84-92ANA.indd 623
■
Disturbi del metabolismo dei carboidrati
■
623
contribuendo a mantenere una concentrazione ematica costante.
Il glicogeno costituisce la principale fonte energetica immagazzinata nei muscoli, utilizzabile durante l’attività fisica. I monosaccaridi galattosio e fruttosio forniscono il “combustibile”
necessario per il metabolismo cellulare, ma svolgono un ruolo
meno determinante rispetto al glucosio. Il galattosio è derivato
dal lattosio (galattosio + glucosio) presente nel latte e nei suoi derivati; costituisce un’importante fonte energetica nell’infanzia, ma
deve essere prima metabolizzato a glucosio. Il galattosio (esogeno
o endogeno, cioè sintetizzato dal glucosio) è un’altra importante
componente di alcuni glicolipidi, glicoproteine e glicosaminoglicani. Le fonti alimentari del fruttosio sono il saccarosio (fruttosio
+ glucosio, sorbitolo) e il fruttosio stesso, presente in frutta,
verdura e miele.
I disturbi del metabolismo del glicogeno ne causano l’accumulo
nei tessuti, per cui si parla di malattie da accumulo del glicogeno
(Tab. 87-1). I disturbi della gluconeogenesi e della via glicolitica
(inclusi quelli del metabolismo di galattosio e fruttosio) non
determinano alcun accumulo di glicogeno (vedi Tab. 87-1), al
contrario del disturbo del metabolismo del piruvato nella via di
conversione in diossido di carbonio e acqua mediante fosforilazione ossidativa, che è spesso associato ad acidosi lattica.
87.1 • GLICOGENOSI • Priya S. Kishnani
e Yuan-Tsong Chen
Le glicogenosi, o malattie da accumulo del glicogeno (GSD, Glycogen Storage Disease), sono il risultato di deficit di vari enzimi
o proteine di trasporto nelle vie metaboliche del glicogeno (vedi
Fig. 87-1), del quale in queste patologie si riscontrano anomalie
qualitative e/o quantitative. Tali deficit enzimatici sono classificati
con una numerazione progressiva, che riflette l’ordine cronologico
di identificazione, ma possono essere nominati anche sulla base
degli organi coinvolti e delle manifestazioni cliniche in glicogenosi
epatiche e muscolari (vedi Tabella 87-1). In ogni caso, si utilizzano
comunemente le denominazioni fino al numero VII.
Esistono più di 12 forme di glicogenosi. Le più comuni, che
solitamente si presentano nella prima infanzia, sono il deficit
di glucosio-6-fosfatasi (tipo I), il deficit di acido lisosomiale glucosidasi (tipo II), il deficit di enzima deramificante (tipo III)
e il deficit della fosforilasi chinasi epatica (tipo IX). Il deficit di
miofosforilasi (tipo V, malattia di McArdle) è il più diffuso tra
gli adolescenti e gli adulti. La frequenza di tutte le forma di GSD
è di 1/20 000 nati vivi.
GLICOGENOSI EPATICHE
Le GDS che colpiscono prevalentemente il fegato includono i
seguenti deficit: di glucosio-6-fosfatasi (tipo I), di enzima deramificante di tipo III, di enzima deramificante di tipo IV, di
fosforilasi epatica (tipo VI), di fosforilasi chinasi epatica (tipo IX,
in precedenza denominato GSD VIa), di glicogeno sintetasi (tipo
0) e del trasportatore-2 del glucosio. Dato che il metabolismo
epatico dei carboidrati è responsabile dell’omeostasi del glucosio
plasmatico, questo gruppo di disturbi causa tipicamente ipoglicemia a digiuno ed epatomegalia. Alcuni deficit (tipo III, IV e IX)
possono essere associati a cirrosi. Anche altri organi sono talvolta
coinvolti (disfunzione renale nel tipo I e miopatia scheletrica e/o
cardiomiopatia nei tipi III e IV e in alcune rare forme di deficit
di fosforilasi chinasi).
GLICOGENOSI DI TIPO I (DEFICIT DI GLUCOSIO-6-FOSFATASI O TRASLOCASI, MALATTIA DI VON GIERKE). La GSD di tipo I è causata dall’assenza o dal deficit di attività della glucosio-6-fosfatasi
nel fegato, nei reni e nella mucosa intestinale. Nel sottotipo Ia,
l’enzima glucosio-6-fosfatasi risulta deficitario, mentre nel tipo
Ib manca la traslocasi che lo trasporta attraverso la membrana microsomale. Entrambi i difetti provocano una inadeguata
conversione epatica del glucosio-6-fosfato in glucosio attraverso
23-09-2008 11:52:11