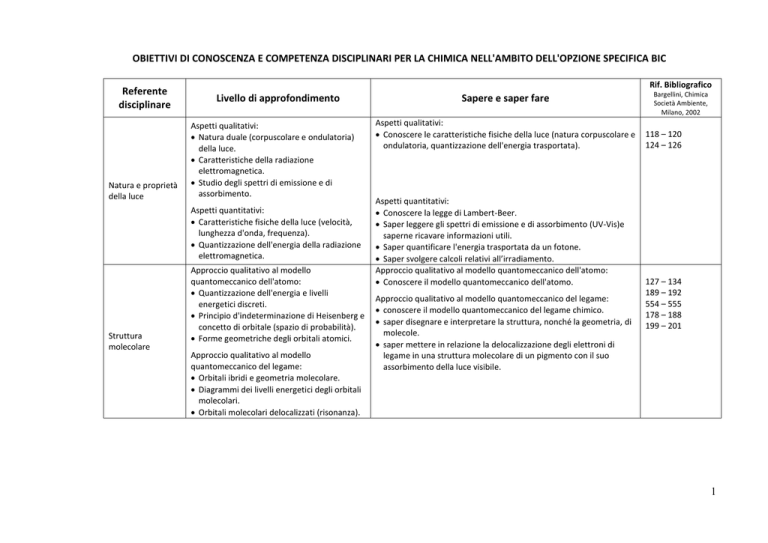
OBIETTIVI DI CONOSCENZA E COMPETENZA DISCIPLINARI PER LA CHIMICA NELL'AMBITO DELL'OPZIONE SPECIFICA BIC
Referente
disciplinare
Natura e proprietà
della luce
Rif. Bibliografico
Livello di approfondimento
Aspetti qualitativi:
Natura duale (corpuscolare e ondulatoria)
della luce.
Caratteristiche della radiazione
elettromagnetica.
Studio degli spettri di emissione e di
assorbimento.
Aspetti quantitativi:
Caratteristiche fisiche della luce (velocità,
lunghezza d'onda, frequenza).
Quantizzazione dell'energia della radiazione
elettromagnetica.
Struttura
molecolare
Approccio qualitativo al modello
quantomeccanico dell'atomo:
Quantizzazione dell'energia e livelli
energetici discreti.
Principio d'indeterminazione di Heisenberg e
concetto di orbitale (spazio di probabilità).
Forme geometriche degli orbitali atomici.
Approccio qualitativo al modello
quantomeccanico del legame:
Orbitali ibridi e geometria molecolare.
Diagrammi dei livelli energetici degli orbitali
molecolari.
Orbitali molecolari delocalizzati (risonanza).
Sapere e saper fare
Aspetti qualitativi:
Conoscere le caratteristiche fisiche della luce (natura corpuscolare e
ondulatoria, quantizzazione dell'energia trasportata).
Aspetti quantitativi:
Conoscere la legge di Lambert-Beer.
Saper leggere gli spettri di emissione e di assorbimento (UV-Vis)e
saperne ricavare informazioni utili.
Saper quantificare l'energia trasportata da un fotone.
Saper svolgere calcoli relativi all’irradiamento.
Approccio qualitativo al modello quantomeccanico dell'atomo:
Conoscere il modello quantomeccanico dell'atomo.
Approccio qualitativo al modello quantomeccanico del legame:
conoscere il modello quantomeccanico del legame chimico.
saper disegnare e interpretare la struttura, nonché la geometria, di
molecole.
saper mettere in relazione la delocalizzazione degli elettroni di
legame in una struttura molecolare di un pigmento con il suo
assorbimento della luce visibile.
Bargellini, Chimica
Società Ambiente,
Milano, 2002
118 – 120
124 – 126
127 – 134
189 – 192
554 – 555
178 – 188
199 – 201
1
Referente
disciplinare
Processi redox
Composti organici
Rif. Bibliografico
Livello di approfondimento
Stato di ossidazione e distribuzione elettronica
(elettronegatività e polarità del legame).
Semireazioni di ossidazione e di riduzione
(variazione dello stato di ossidazione).
Il concetto di potenziale di riduzione.
Principali gruppi funzionali e le loro caratteristiche
chimiche.
Classificazione di sostanze organiche di sintesi e
naturali.
Reazione
organiche
Concetto di nucleofilia e elettrofilia.
Esempi di meccanismi di reazione.
Studio di reazioni di sintesi dei polimeri naturali
(polisaccaridi, polipeptidi e acidi nucleici) e dei
composti organici naturali.
Stereochimica
Isomeria configurazionale e conformazionale.
Carbonio chirale.
Attività ottica.
Sapere e saper fare
Conoscere i concetti di stato di ossidazione, di
elettronegatività, di polarità del legame e di reazione redox.
Saper assegnare gli stati di ossidazione di tutti gli atomi
presenti in una molecola a partire dalla sua formula di
struttura.
Saper scrivere e manipolare delle semireazioni di riduzione e di
ossidazione.
Saper interpretare e discutere, anche da un punto di vista
quantitativo, processi elettrochimici.
Conoscere i gruppi monofunzionali principali e le
corrispondenti classi di sostanze organiche.
Conoscere le principali classi di sostanze naturali d'importanza
biologica: carboidrati, amminoacidi e proteine, acidi grassi,
trigliceridi e fosfolipidi, nucleotidi e acidi nucleici.
Saper mettere in relazione la distribuzione elettronica nella
molecola con le sue caratteristiche fisiche e chimiche
(reattività).
Conoscere alcune reazioni organiche (in particolare
condensazione e idrolisi).
Saper distinguere tra un attacco nucleofilo e un attacco
elettrofilo.
Saper leggere un meccanismo di reazione rappresentato
attraverso il formalismo chimico convenzionale.
Conoscere le principali forme di isomeria strutturale e
configurazionale.
Saper riconoscere un centro chirale.
Bargellini, Chimica
Società Ambiente,
Milano, 2002
211 – 213
436 – 438
446 – 454
459 – 463
576 – 582
588 – 589
597 – 598
608 – 614
628 – 630
639 – 641
646 – 648
651 – 653
658 – 661
666 – 669
674 – 688
564 - 570
556 – 564
2
Equilibrio
Termodinamica
Cinetica
Concetto di equilibrio chimico.
Definizione e significato della costante di
equilibrio.
Principio di Le Châtelier.
Equilibrio acido-base.
Saper assegnare la configurazione assoluta (R, S) a un centro
chirale.
Saper individuare molecole otticamente attive e coppie di
molecole enantiomere.
Saper formulare per un equilibrio chimico la LAM
corrispondente.
Saper valutare qualitativamente gli influssi delle variazioni
delle condizioni (concentrazione e temperatura) di un sistema
all'equilibrio secondo il principio di Le Châtelier.
Saper esprimere e manipolare un'equazione acido-base
partendo dal sistema reazionale.
Conoscere il significato di pH.
Saper eseguire calcoli riferiti a sistemi acido-base semplici
(anche sistemi tampone).
Saper valutare qualitativamente gli influssi delle variazioni di
pH su un sistema acido-base all'equilibrio secondo il principio
di Le Châtelier.
Saper interpretare grafici di titolazione.
Energia di legame.
Definizione e significato di H (eso e endotermicità
delle reazioni).
Definizione e significato di G.
Spontaneità e non spontaneità delle reazioni.
Conoscere la natura e le caratteristiche energetiche dei legami
forti (intramolecolari) e quella dei legami deboli
(intermolecolari).
Conoscere gli aspetti energetici correlati con la formazione e la
rottura dei legami chimici.
Conoscere il significato della grandezza termodinamica G e
saper eseguire semplici calcoli.
Saper valutare la relazione tra il valore di G la spontaneità
della reazione e lo stato di equilibrio.
Acquisire l’importanza degli accoppiamenti delle reazioni per i
trasferimenti di energia in ambito biologico.
Teoria delle collisioni.
Profili di reazione (energia di attivazione,
complessi attivati e stadi intermedi).
Catalisi.
Saper leggere un grafico riferito all'evoluzione di una reazione.
Conoscere i fattori che influenzano la velocità di una reazione e
il significato dell'energia di attivazione.
Conoscere la funzione svolta dai catalizzatori.
374 – 377
380 – 384
396 – 416
419 – 423
425 – 426
238 – 241
251 – 252
257 – 261
356 – 358
361 – 366
368 – 371
3