Cos'è la Fibrosi Cistica?
La fibrosi cistica (FC) è una grave malattia ereditaria, cronica, evolutiva; un bambino ogni 2700 nasce con questa
malattia. Nei pazienti affetti da FC le secrezioni delle ghiandole esocrine, (cioè i liquidi biologici come il muco, il sudore,
la saliva lo sperma, i succhi gastrici) sono molto più dense e viscose del normale. I problemi più gravi sono a carico dei
polmoni, dove il muco estremamente denso può causare problemi respiratori e infezioni. Anche i succhi pancreatici sono
più densi del normale, causando problemi digestivi. Infine, i pazienti affetti da FC sono scarsamente fertili, a causa
dell'eccessiva densità del loro liquido spermatico e delle secrezioni vaginali. La malattia si manifesta per lo più entro i
primi anni di vita, talora più tardivamente, e può esprimersi con maggiore o minore gravità in individui diversi. Pertanto
viene trattata con terapie che variano da soggetto a soggetto, costituite per lo più da fisioterapia, antibiotici, aerosolterapia, estratti pancreatici e vitamine. Il decorso e la prognosi della fibrosi cistica sono notevolmente migliorati negli
ultimi decenni, soprattutto per i pazienti diagnosticati precocemente. Nonostante ciò, allo stato attuale la guarigione non
è possibile e la durata media della vita è comunque ancora ridotta rispetto a quella della popolazione generale.
Come si trasmette la Fibrosi Cistica?
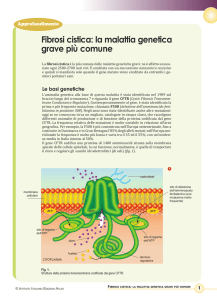
La FC è una malattia che si trasmette con modalità autosomica recessiva, determinata da alterazioni del DNA, chiamate
"mutazioni", che insorgono in entrambe le copie del gene CFTR (Cystic Fibrosis Transmembrane Regulator). I geni
vengono ereditati in coppie, derivando uno dal padre ed uno dalla madre. Negli individui malati entrambe le copie del
gene per la FC sono alterate. Gli individui che possiedono una sola copia del gene alterato e una normale sono invece
privi di ogni sintomo, ma sono portatori sani. I bambini malati di FC potranno nascere solo se entrambi i genitori sono
almeno portatori sani. Due genitori portatori sani avranno una probabilità del 25 % di avere figli affetti da FC. Dalla stessa
unione i figli avranno una probabilità su due (50%) di nascere portatori sani, come i genitori.
Come si esegue l'analisi genetica per la Fibrosi Cistica?
L'unico modo per identificare i portatori sani è quello di effettuare un test sul DNA alla ricerca di mutazioni nel gene
della FC. L'analisi però è complicata dal fatto che esistono numerosissime mutazioni (ad oggi oltre 900) che causano la
FC; molte di esse sono rare, molte altre ancora sconosciute. Generalmente, il test genetico viene eseguito tenendo conto
di 31-200 mutazioni (a secondo del tipo di analisi effettuata), scelte fra le più frequenti nell'area geografica in questione
e che nel complesso permette di identificare circa 90 per cento dei portatori. Il test genetico non è in grado di identificarle
tutte. In casi particolari, adeguatamente valutati dal genetista, può essere eseguito anche un test genetico che prevede
l'analisi di mutazione dell'intero gene, con conseguente ricerca di tutte le mutazioni sinora scoperte. Il gene responsabile
della malattia è stato identificato e localizzato sul cromosoma 7. Il gene codifica per una proteina chiamata CFTR (Cystic
fibrosis transmembrane regulator). La proteina CFTR ha un ruolo importante nel regolare la quantità di cloro che viene
secreto insieme ai liquidi biologici. Nei pazienti affetti da FC il gene della CFTR è alterato, in genere a causa di mutazioni
puntiformi. Queste alterazioni fanno sì che la proteina non venga più prodotta, o che venga prodotta ma in una forma non
funzionale. A causa del deficit della proteina, le secrezioni contengono una scarsa quantità di acqua di sali, che ne modifica
drasticamente le proprietà.
Che risultati può dare l'analisi genetica per la Fibrosi Cistica?
A seguito dell’analisi genetica per Fibrosi Cistica si possono ottenere due tipi di risultati:
• l’analisi può individuare nel DNA del paziente la presenza di una mutazione a livello di una copia del gene
CFTR, mentre l’altra copia è normale.
• Si dice che il soggetto risulta portatore in eterozigosi di quella mutazione, e questo risultato significa che il
paziente è un PORTATORE SANO.
• l’analisi può individuare nel DNA del paziente la presenza di mutazioni in entrambe le copie del gene
CFTR.
• Si dice che il soggetto risulta eterozigote composto (due mutazioni diverse) o omozigote (due mutazioni uguali)
di quella/e mutazione/i; questo risultato significa che il paziente è un AFFETTO da Fibrosi Cistica.
• l’analisi genetica non individua nel DNA del paziente la presenza di mutazioni del gene CFTR.
• Si dice che il soggetto risulta “NEGATIVO”. Questo risultato significa che il soggetto ha una probabilità
diminuita, rispetto a prima dell’analisi, di essere un portatore.
• Non è possibile che l’analisi escluda in assoluto la probabilità di essere un portatore, perché non è possibile
escludere la presenza di tutte le numerosissime mutazioni del gene della fibrosi cistica.
E’ importante ricordare che:
Pag. 1 di 7
•
•
•
la probabilità di essere un portatore di fibrosi cistica è maggiore per un soggetto che sia parente di un
malato o di un portatore.
In questo caso è necessario prima identificare la mutazione del malato o del portatore presente in famiglia
(mutazione “familiare”) e poi ricercarla nel parente. Se il parente risulta non avere nel suo DNA la mutazione
familiare, la sua probabilità di essere portatore diventa estremamente bassa.
la probabilità di essere portatore di fibrosi cistica è minore ma comunque presente anche nel soggetto che
non è parente di un malato o di un portatore. In questo caso, per chi si sottopone alla ricerca delle più frequenti
mutazioni del gene della fibrosi cistica e non risulta avere nel suo DNA nessuna di queste, la probabilità di essere
portatore diventa bassa (anche se non zero) (Tabella 1).
Tabella 1
% di mutazioni FC
identificabili
Probabilità residua di
essere portatore se il test
è negativo
0
Rischio di avere un figlio affetto da FC se
un paziente della coppia è
portatore/l'altro negativo al
test
entrambi i pazienti sono
negativi al test
1:25
non applicabile
1:2.500
70
1:82
1:331
1:27.400
75
1:99
1:396
1:39.200
80
1:124
1:494
1:61.000
85
1:165
1:661
1:109.200
90
1:246
1:984
1:242.100
95
1:491
1:1964
1:964.400
Frequenza ipotizzata del portatore: 1:25. Rif.: Da Lemma W. et al. N. Engl. J. Med. 1990. 322:295
Fibrosi Cistica ed infertilità
Una caratteristica ricorrente tra i maschi con Fibrosi Cistica è l'infertilità, che si associa alla patologia ostruttiva e spesso
all'agenesia bilaterale congenita dei vasi deferenti (CBAVD). Questo difetto costituisce circa il 15% delle cause di
sterilità maschile che nel 80% dei casi è riconducibile a mutazioni di del gene CFTR . Alcune di queste mutazioni come
R117H, N1303K e G551D sono molto comuni nei pazienti con CBAVD, in associazione alla Delta F508, che è presente
in eterozigoti nel 57% di pazienti maschi.
E' stata anche dimostrata una correlazione tra questa malformazione e una variante allelica polimorfa del gene CFTR,
conosciuta come polimorfismo 5T , che mostra una frequenza nei CBAVD circa 4- 6 volte superiore rispetto alla
popolazione generale. Il polimorfismo consiste in una regione di polipirimidine (polyT) di lunghezza variabile all'interno
dell'introne 8 del gene CFTR. La variabilità si manifesta sotto forma di tre alleli, chiamati 5T, 7T, 9T, a seconda del
numero di timine presenti. In particolare, l'allele 5T è associato ai cromosomi mutati dei maschi con CBAVD. Questo
polimorfismo intronico regola il meccanismo molecolare del processo di maturazione dell'RNA messaggero (mRNA) e
quindi la quantità di trascritto CFTR all'interno della cellula. La presenza di un allele 5T si accompagna ad una sintesi di
mRNA che manca dell 'esone 9 (ex9-) per il 90%, l 'assetto 7T presenta il 25% di mRNA ex9- mentre in quello 9T il 90%
dell 'mRNA è normale. Si ipotizza che una quantità ridotta di mRNA provochi questa forma incompleta o variante di FC,
che viene trasmessa da genitori eterozigoti.
Varianti del gene CFTR e incidenza
Il gene regolatore della conduttanza transmembrana della fibrosi cistica (CFTR) identificato nel 1989 si trova sul braccio
lungo del cromosoma 7 e contiene 27 esoni codificanti distribuiti su oltre 230 kb4. Un mRNA di 6,5 kb prodotto
dall'allele normale codifica il gene CFTR, una proteina integrale di 1490 aminoacidi situata sulla membrana che funziona
come canale di cloro regolato nelle cellule epiteliali di più organi4,5. Attualmente sono state descritte oltre 1900 varianti
del gene CFTR. Per la maggior parte si tratta di mutazioni puntiformi9. La variante del gene CFTR più comune è l'allele
F508del5, che rappresenta quasi il 70% di tutte le varianti del gene CFTR3. Tuttavia altre varianti comuni del gene
CFTR spesso determinano un fenotipo CF e altre patologie correlate a CFTR3-5.
Pag. 2 di 7
Panoramica del progetto CFTR2
Il progetto CFTR2 è un'iniziativa internazionale guidata da un team di ricercatori e medici e supportata dal National
Institute of Health e dalla fondazione statunitense Cystic Fibrosis Foundation.11,12 CFTR2 mira a fornire informazioni
complete e riviste da esperti sulle varianti funzionali e cliniche del gene CFTR. In uno sforzo per convalidare
clinicamente tutte le varianti CF con frequenze alleliche di 0,01% e di percentuali superiori, 25 archivi e cliniche CF
da tutto il mondo13 hanno unito le proprie risorse con lo scopo di confrontare le informazioni cliniche di più di 39.000
pazienti affetti da fibrosi cistica con circa 1.900 varianti del gene CF che sono stati registrati negli anni nel database
CFTR1 dell'ospedale Hospital for Sick Children di Toronto.11,13 Le caratteristiche cliniche, come concentrazione di
cloro nel sudore (% FEV1 prevista) e stato del pancreas sono stati analizzati assieme alle informazioni del genotipo
CFTR. L'approccio sistematico di analisi simultanea di queste varianti da una prospettiva clinica, funzionale e genetica
ha prodotto 134 varianti univoche causanti la fibrosi cistica a 129 posizioni genomiche univoche (poiché per cinque
posizioni, due cambiamenti del nucleotide appaiono sulla stessa posizione) attualmente contenute nel database CFTR2
(ad agosto 2013). L'uso di un pannello comprendente tutte queste varianti si prevede che equivalga al 95,4% degli alleli
(detection rate) che causano la fibrosi cistica e, mediante il rilevamento di entrambi gli alleli, aumenta a circa il 91%
l'identificazione di coppie a rischio rispetto al 72% usando il pannello di 23 varianti raccomandato dall'ACMG
(American College of Medical Genetics).
Mutazioni e varianti del gene CFTR investigate
Le varianti del gene CFTR investigate sono state specificatamente scelte perché rappresentano il gruppo completo di
varianti convalidate clinicamente classificate come causanti la fibrosi cistica nel database CFTR2 presso la Johns Hopkins
University, un prodotto dell'iniziativa di CFTR2 (Clinical and Functional Translation of CFTR). Le varianti includono
quelle raccomandate nel 2004 dall'American College of Medical Genetics (ACMG)1 e nel 2011 dall'American College
of Obstetricians and Gynecologists (ACOG)2.
Il saggio testa: 134 varianti che causano la fibrosi cistica; una variante del pannello raccomandata dall'ACMG (R117H,
classificata come mutazione di varie conseguenze cliniche, MVCC, da CFTR2); una variante modificante riportata
condizionatamente (PolyTG/PolyT); e tre varianti benigne riportate condizionatamente (I506V, I507V, F508C)14; per un
totale di 139 varianti riportate.
Le 134 varianti che causano la fibrosi cistica corrispondono a 129 varianti che causano la fibrosi cistica contenute nel
database CFTR2. Il database CFTR2 include cinque varianti che causano la fibrosi cistica per le quali lo stesso
cambiamento nel livello della proteina può verificarsi da due cambiamenti distinti del nucleotide [ad es., S466X(C>A)
e S466X(C>G)]. Queste cinque varianti sono elencate in base al codone di aminoacido nel database CFTR2 (ad es.,
S466X) mentre il saggio riporta ciascuna singola variante [ad es., S466X(C>A) e S466X(C>G)]. L'elenco delle 139
mutazioni e varianti sono fornite nella Tabella 2.
Tabella 2: Riepilogo delle 139 mutazioni e varianti investigate [Elencate in base alle coordinate genomiche;
Grassetto=ACMG-23; In rosso sono indicate le mutazioni Italiane ]
M1V
T338I
Q552X
3121-1G>A
CFTR dele2,3
1154insTC
R553X
3272-26A>G
Q39X
S341P
A559T
L1065P
E60X
R347H
R560T
R1066C
P67L
R347P
R560K
R1066H
R75X
R352Q
1811+1.6kb A>G
L1077P
G85E
1213delT
1812-1 G>A
W1089X
394delTT
1248+1G>A
E585X
Y1092X(C>A)
405+1 G>A
1259insA
1898+1G>A
Y1092X(C>G)
406-1G>A
W401X (c.1202G>A)
1898+3A>G
M1101K
E92X
W401X (c.1203G>A)
2143delT
E1104X
E92K
1341+1G>A
R709X
R1158X
Q98X
PolyTG/PolyT
K710X
R1162X
457TAT>G
1461ins4
2183delAA>G
3659delC
D110H
A455E
2184insA
S1196X
Pag. 3 di 7
R117C
1525-1G>A
2184delA
W1204X (c.3611G>A)
R117H
S466X (C>A)
2307insA
W1204X (c.3612G>A)
Y122X
S466X (C>G)
L732X
3791delC
574delA
L467P
2347delG
3849+10kbC>T
621+1G>T
1548delG†
R764X
G1244E
663delT
S489X
2585delT
3876delA
G178R
S492F
E822X
S1251N
711+1G>T
Q493X
2622+1G>A
3905insT
711+3A>G
I507del
E831X
W1282X
711+5 G>A
F508del
W846X
4005+1G>A
712-1 G>T
1677delTA
R851X
N1303K
H199Y
V520F
2711delT
4016insT
P205S
Q525X†
2789+5G>A
Q1313X
L206W
1717-8G>A
Q890X
4209TGTT>AA
Q220X
1717-1G>A
L927P
CFTRdele22,23
852del22
G542X
S945L
4382delA
1078delT
S549R (c.1645A>C)
3007delG
I506V
G330X
S549R (c.1647T>G)
G970R
I507V
R334W
S549N
3120G>A
F508C
I336K
G551D
3120+1G>A
† Classificato nel database CFTR212 come una variante che causa la fibrosi cistica, mentre Sosnay13 classifica la
variante come indeterminata. La classificazione in base al database è più attuale e riflette l'analisi funzionale
completa, che non era disponibile al tempo della pubblicazione di Sosnay.
Accuratezza del test
L'accuratezza del test è stata stimata valutando 500 campioni che rappresentano una vasta gamma di varianti del gene
CFTR da quattro fonti separate. La fonte principale dei dati di accuratezza è stato uno studio di accuratezza clinica
condotto usando un pannello di 366 campioni. La maggior parte (n = 355) dei campioni consisteva di campioni
clinici di gDNA archiviati, anonimizzati e isolati da sangue umano, i restanti 11 campioni sono stati ottenuti da
campioni di linee cellulari disponibili in commercio.
I dati di questo studio sono stati integrati con i dati di accuratezza ottenuti da 68 campioni di linee cellulari nello
studio di riproducibilità, 14 campioni clinici ottenuti dallo studio di valutazione analitica del metodo di estrazione
e 52 campioni di plasmidi sintetici. I plasmidi sintetici sono stati progettati per includere il contesto genomico di
varianti rare e contenuti ovunque da una a nove varianti entro lo stesso costrutto. Sono stati linearizzati, diluiti a
numero di copie equivalenti di DNA genomico e miscelati con campioni di DNA genomico umano di genotipo
wild type a numero di copie equivalenti per imitare un campione eterozigote.
I risultati di genotipizzazione per 137 siti di SNV/piccoli Indel, inclusa la regione PolyTG/PolyT, sono stati
confrontati con l'analisi bidirezionale delle sequenze di Sanger. Sono stati usati due saggi convalidati basati sulla
PCR come metodo di riferimento per due ampie delezioni nel pannello. Ciascun saggio di duplex PCR ha utilizzato
due gruppi di primer per discriminare tra genotipi wild type, eterozigote e omozigote. Uno dei gruppi di primer è
stato progettato per affiancare i punti di rottura delle delezioni, mentre l'altro gruppo ha amplificato una regione
interna alla delezione. I due prodotti sono stati rilevati mediante separazione in base alla dimensione su un gel di
agarosio.
I saggi PCR sono stati convalidati usando un pannello di 28 campioni in tutto (22 campioni per ciascuna delezione)
che consiste di campioni di DNA genomico di linee cellulari e derivati dal sangue e plasmidi sintetici, che hanno
incluso i genotipi WT, HET e HOM per ciascuna ampia delezione. È stato confermato che i saggi PCR presentano
una specificità e una riproducibilità del 100% per tutti i campioni testati, mediante la valutazione dei prodotti della
PCR su un gel di agarosio. L'accuratezza dei saggi PCR è stata confermata usando il sequenziamento Sanger ed è
stata del 100% per tutti i campioni.
L'accuratezza è stata determinata per ogni genotipo attraverso tre misurazione statistiche. La concordanza positiva è
stata calcolata per ciascun genotipo di variante dividendo il numero di campioni con identificazioni di varianti
Pag. 4 di 7
concordanti per il numero totale di campioni con detta variante come identificata dai metodi di riferimento. La
concordanza negativa è stata calcolata su tutte le posizioni wild type (WT) dividendo il numero di posizioni WT
concordanti per il numero di posizioni WT come definiti dai metodi di riferimento. La concordanza complessiva
(OA) è stata calcolata su tutte le posizioni riportate dividendo il numero di posizioni di WT e delle varianti
concordanti per il numero di posizioni riportate come determinate dai metodi di riferimento.
Il test presenta una concordanza positiva (PA) a livello di genotipo del 100%. La concordanza negativa (NA) per tutte
le posizioni WT era > 99,99% e la concordanza complessiva (OA) per tutte le posizioni riportate era > 99,99%. Tutti i
risultati del test sono basati su test iniziali.
Limiti della procedura
•
•
•
•
•
•
Per uso diagnostico in vitro. I risultati ottenuti dovrebbero essere usati e interpretati nel contesto di una
valutazione clinica completa.
Il test è progettato per identificare uno specifico sottogruppo di varianti note nel gene CFTR, ma non
include tutte le varianti identificate nel gene CFTR. Quindi, se una variante non viene identificata non
garantisce che altre varianti del gene CFTR non siano presenti nei campioni analizzati.
La frequenza delle varianti identificate mediante questo test varia fra le diverse popolazioni.
Come per qualsiasi test basato su ibridazione, i polimorfismi o le varianti latenti nelle regioni che legano gli
oligonucleotidi possono incidere sugli alleli sondati e, di conseguenza, sulle identificazioni effettuate.
Il saggio non può determinare se l'orientamento della variante PolyTG/PolyT si trova in cis/trans sulla variante
R117H. Per i pazienti con una variante R117H, dovrebbero essere eseguiti ulteriori test per determinare se una
variante PolyTG/PolyT, che può incidere sul fenotipo clinico [ad. es., 12-13 (TG) o 5T], è in orientamento
cis/trans sulla variante R117H.
PolyTG/PolyT sono regioni omopolimeriche note per essere difficili da interpretare con saggi basati sulle
sequenze dovuti a scivolamento della polimerasi. È stata osservata una percentuale di identificazioni errata
dello 0,9% (4/448) per i risultati PolyTG/PolyT dimostrando una discrepanza ±1 TG quando confrontato con il
sequenziamento bidirezionale Sanger.
Descrizione tecnica dell'analisi
Il test, eseguito utilizzando il kit CE-IVD MiSeqDx Cystic Fibrosis 139-Variant Illumina, comporta due procedure
principali. La prima consiste nel preparare i campioni per il sequenziamento, un'operazione detta preparazione della
libreria. La preparazione della libreria consiste di quattro fasi principali: ibridazione, estensione-ligazione,
amplificazione mediante PCR e normalizzazione della libreria. La seconda procedura consiste nel sequenziare il
campione preparato mediante la chimica SBS (sequenziamento mediante sintesi) su MiSeqDx.
Sequenziamento
La chimica SBS utilizza un metodo che fa uso di terminatori reversibili per rilevare le singole basi nucleotidiche
man mano che vengono incorporate in filamenti di DNA crescenti. Durante ciascun ciclo di sequenziamento, alla
catena dell'acido nucleico viene aggiunto un solo deossinucleotide trifosfato (dNTP) marcato in fluorescenza. Il
nucleotide marcato funge da terminatore per la polimerizzazione, così dopo ogni incorporazione di dNTP, il
colorante fluorescente viene sottoposto a imaging al fine di identificare la base e quindi sottoposto a scissione
enzimatica per consentire l'incorporazione del nucleotide successivo. Poiché tutti e quattro i dNTP legati al
terminatore reversibile (A, G, T, C) sono presenti come molecole singole e separate, la competizione naturale riduce
al minimo le distorsioni dovute all'incorporazione. Le identificazioni delle basi vengono effettuate direttamente dalle
misurazioni dell'intensità del segnale durante ogni ciclo di sequenziamento. Il risultato finale è un sequenziamento
base per base.
Analisi dei dati
MiSeq Reporter elabora le identificazioni delle basi generate durante l'analisi primaria e produce informazioni su
ciascun campione in base alle informazioni specificate nel foglio campioni, questa elaborazione si chiama analisi
secondaria. L'analisi secondaria include de-multiplex, generazione di file FASTQ, allineamento, identificazione
Pag. 5 di 7
delle varianti e generazioni di file VCF che contengono le informazioni relative alle varianti del gene CFTR
individuate in posizioni specifiche in un genoma di riferimento.
• Demultiplex: il de-multiplex costituisce la prima fase dell'analisi se nel foglio campioni sono elencati più
campioni e la corsa presenta letture indici. Il demultiplex separa i dati da un pool di campioni in base agli
indici sequenza univoci che sono stati aggiunti durante la fase di amplificazione mediante PCR.
• Generazione di file FASTQ: dopo il de-multiplex, MiSeq Reporter genera file intermedi in formato FASTQ, un
formato di testo utilizzato per rappresentare le sequenze. I file FASTQ contengono le letture di ciascun campione
e i punteggi qualitativi, con l'esclusione delle letture dei cluster che non hanno attraversato il filtro.
• Allineamento: mediante l'allineamento è possibile confrontare le sequenze rispetto a un riferimento al fine di
identificare una relazione fra le sequenze e assegnare un punteggio in base a regioni di similarità. Le letture
allineate sono scritte nei file in formato BAM. MiSeq Reporter utilizza un algoritmo di Smith-Waterman con
matrice a banda che esegue allineamenti locali di sequenze per determinare il grado di similarità fra due sequenze.
• Identificazioni delle varianti: durante questa fase vengono registrate le varianti di singolo nucleotide (SNV), le
inserzioni e delezioni (Indel) e altre varianti strutturali in un file di testo standardizzato chiamato
MiSeqDxCF139VariantAssay.txt..
Livello Diagnostico: II^ livello
Screening 139 Mutazioni
Detection Rate: 95.4%
Riferimenti Bibliografici
1
Watson MS, Cutting GR, Desnick RJ, Driscoll DA, Klinger K, et al. (2004) Cystic fibrosis population
carrier screening: 2004 revision of American College of Medical Genetics mutation panel. Genetics in
Medicine 6(5): 387–391.
2 Committee on Genetics. (April 2011) The American College of Obstetricians and Gynecologists
Committee Opinion. Update on Carrier Screening for Cystic Fibrosis 486: 1–4.
3 Bobadilla JL, Macek Jr. M, Fine JP, Farrell PM. (2002) Cystic Fibrosis: A Worldwide Analysis of
CFTR Mutations—Correlation With Incidence Data and Application to Screening. Human Mutation
19:575 606.
4 Moskowitz SM, Chmiel JF, Sternan DL, Cheng E, Gibson RL, et al. (2008) Clinical practice and
genetic counseling for cystic fibrosis and CFTR-related disorders. Genetics in Medicine
10(12):851–868.
5 Moskowitz SM, Chmiel JF, Sternen DL, Cheng E, Cutting GR. CFTR-related disorders. Pagon RA, Bird
TC, Dolan CR, Stephens K, editors. GeneReviews. Seattle (WA): University of Washington; 2008.
Disponibile alla pagina Web www.ncbi.nlm.nih.gov/books/NBK1250. [Online] Aggiornato il 19
febbraio, 2008.
6 Katkin JP. (2012) Cystic fibrosis: Clinical manifestations and diagnosis. Disponibile alla
pagina Web www.uptodate.com. [Online] 7 dicembre 2012.
7 Farrell PM, Rosenstein BJ, White TB, Accurso FJ, Castellani C, et al. 2008 Guidelines for diagnosis of
cystic fibrosis in newborns through older adults: Cystic Fibrosis Foundation consensus report. J Pediatr
153(2):S4– S14.
8 Cystic Fibrosis Foundation Patient Registry: Annual Data Report 2010.
9 Cystic
Fibrosis
Mutation
Database (CFTR1).
Disponibile alla
pagina
Web
www.genet.sickkids.on.ca/app. [Online] agosto 2013.
10 Rohlfs EM, Zhou Z, Heim R, Nagan N, Rosenblum L, et al. (2011) Cystic Fibrosis Carrier Testing
in an Ethnically Diverse US Population. Clinical Chemistry; 57(6): 841–848.
11 Clinical and Functional Translation of CFTR (CFTR2). Disponibile alla pagina Web www.cftr2.org.
[Online] agosto 2013.
Pag. 6 di 7
12 The Clinical and Functional Translation of CFTR (CFTR2) Project. Disponibile alla pagina Web
www.nacfconference.org/art/plenaryarchives/2011.Cutting.pdf. [Online] Presentato da Garry Cutting a nome
del progetto CFTR2 al 25th Annual North American Cystic Fibrosis Conference (NACFC) sponsorizzato da
Cystic Fibrosis Foundation. 4 novembre 2011. Anaheim, CA, U.S.A..
13 Sosnay PR, Siklosi KR, Van Goor F, Kaniecki K, Yu H, et al. (2013) Defining the disease liability of variants
in the cystic fibrosis transmembrane conductance regulator gene. Nat Genet. 25 agosto [Epub prima della
stampa].
14 Grody WW, Cutting GR, Klinger KW, Richards CS, Watson MS, Desnick RJ. (March/April 2001) Laboratory
standards and guidelines for population-based cystic fibrosis carrier screening. Genetics in Medicine 3(2): 149–
154.
15 Castellani C, Cuppens H, Macek H Jr, Cassiman JJ, Kerem E, et al. (2008) Consensus on the use and
interpretation of cystic fibrosis mutation analysis in clinical practice. J Cystic Fibrosis 7:179–196.
16 Pratt VM, Caggana M, Bridges C, Buller AM, DiAntonio L, et al. (May 2009) Development of Genomic
Reference Materials for Cystic Fibrosis Genetic Testing. Journal of Molecular Diagnostics 11(3): 186–193.
17 Amos J, Feldman GL, Grody WW, Monaghan K, Palomaki GE, et al. (2008 Edition, Revised 03/2011)
American College of Medical Genetics Standards and Guidelines for Clinical Genetic Laboratories.
18 Rehm HL, Bale SJ, Bayrak-Toydemir P, Berg JS, Brown KK, Deignan JL, et al. (2013) ACMG clinical
laboratory standards for next-generation sequencing. Genetics in Medicine. Genetics in Medicine 15(9): 733–
747.
Pag. 7 di 7





![Referto Fibrosi Cistica [PDF - 304.16 kbytes]](http://s1.studylibit.com/store/data/006502619_1-762882ca07df9880014b7ac47729a206-300x300.png)