FISIOLOGIA
Sbobinature A.A. 2008/2009
Prima Parte
1
Lezione del 17/11/2008
Introduzione.
La fisiologia è la disciplina che si occupa di studiare il funzionamento di organi ed apparati.
Occorre gettare un ponte tra le conoscenze di tipo morfologico e di tipo fisico, perché non dobbiamo
dimenticarci che tutto ciò che accade nell’organismo umano dipende da fenomeni chimico-fisici. Se
noi dovessimo parlare di muscolo, ci configuriamo una struttura che come già sapete ha la capacità
di produrre lavoro meccanico. L’attività dei muscoli sposta delle masse. E’ chiaro che questo prevede
l’esistenza di forze, e quando noi applichiamo una forza ad una massa abbiamo un lavoro, (forza x
spostamento). Sul piano ecologico ed evoluzionistico questo è fondamentale, perché consente, alle
specie dotate di questa organizzazione anatomo – funzionale di muoversi nello spazio. Questo
significa che sono in grado, a differenza di altre specie (vegetali) di andarsi a scegliere la nicchia
ecologica su cui operare, oppure di spostarsi da luoghi dove non è più conveniente per competizioni
eccessive di altre specie. Quindi potersi muovere diventa un vantaggio evoluzionistico notevole.
Inoltre, l’evoluzione ha provveduto a costruire un sistema di attuazione del movimento, o di
trasferimento della forza:mi riferisco al sistema scheletrico, delle strutture rigide, connesse tra di
loro in sistemi di giunzione articolare, dei punti di snodo con gradi di libertà differenti a seconda del
tipo di articolazione. In altre parole, la integrazione di attività tra sistema muscolare e apparato
scheletrico ci consente di muoverci, sia ai fini di compiere quello che noi chiamiamo lavoro esterno,
spostare la massa del corpo nello spazio, sia al fine di compiere movimenti che non sono attinenti a
quanto detto ma che consentono di fare altre attività, pur mantenendo il corpo in equilibrio
stazionario. Il motore muscolare, possiamo chiamarlo cosi, perché di fatto si tratta di una macchina a
combustione interna, che per poter produrre forza, si serve di trasformazioni energetiche, da
chimico a meccanico. Tuttavia, per avere la possibilità di compiere attività motorie cosi perfette cosi
come noi siamo abituati ad osservare, è necessario un sistema di controllo, in grado di inviare
informazioni coerenti al motore muscolare, in funzione di ciò che si decide di fare, ma anche di ciò
che si recepisce dall’esterno. Quindi esiste un altro organo o apparato, che si chiama sistema
nervoso che, in termini evoluzionistici, possiamo dire abbia la funzione di generare i pattern di
movimento. Informa l’apparato muscolare attraverso modulazioni di frequenza e comunicazioni
elettriche tramite i nervi, ma è anche in grado di recepire, tramite sensori che sono in contatto con
l’esterno, capaci di recepire variazioni di energia provenienti dall’esterno e tradurre le informazioni
sempre in modulazione di frequenza che dai recettori viene captato. Si ha cosi una comparazione tra
ciò che sta avvenendo e ciò che si vuol fare, in modo da ottimizzare lo schema motorio. Si tratta di
generare, attraverso l’attivazione differenziata di diversi gruppi muscolari, delle situazioni che
possano sia consentire il movimento, sia impedire il movimento, perché se voi ci pensate bene il
fatto che io stia in piedi non è normale, perché ci sono delle cerniere come le ginocchia, l’anca, che si
dovrebbero flettere e dovrebbero farmi cadere, poiché la massa del mio corpo agisce su queste
strutture che dovrebbero piegarsi. Non avviene perché produco una forza nei gruppi muscolari detti
“antigravitari” che attivati consentono al ginocchio di non piegarsi, ma come al ginocchio anche
all’anca e al collo ad esempio. Tutto questo nasce da caratteristiche “biofisiche”delle cellule
eccitabili, cioè quelle cellule del nostro organismo capaci di modulare la differenza di potenziale
elettrico che esiste a cavallo della loro membrana plasmatica. Tutte le cellule dell’organismo sono
caratterizzate dalla separazione di cariche elettriche, all’interno e all’esterno, a cavallo della
membrana, con un accumulo di cariche positive all’esterno e di tipo negativo all’interno.
Elettricamente parlando stiamo parlando di una capacità, con il dielettrico che è la membrana. Tra le
cellule dell’organismo, tra i tipi di tessuto, due tipi vengono definiti eccitabili: si tratta delle cellule
nervose e delle cellule muscolari, che sotto questo punto di vista si comportano esattamente allo
stesso modo.
2
Biofisica e Biochimica della membrana cellulare.
Partiamo da alcune esperienze classiche che possono interessarci. E’ possibile, in laboratorio, fare
delle esperienze in vitro; con particolari tecniche di tipo istologico, è possibile isolare dall’organismo
delle cellule. Questa che vedete qui schematizzata vorrebbe essere una cellula muscolare scheletrica
o striata. Io riesco ad isolare questa cellula e la inserisco in un liquido nutritivo, cioè un bagno, una
soluzione acquosa, che contiene dei soluti che sono simili ai liquidi extracellulari. Praticamente c’è
una certa quantità di sodio, un pH neutro, più o meno, e anche del glucosio. Come potete osservare
da questo schema, io utilizzo un voltmetro , e ai due capi del voltmetro pongo in uno una piastrina
che immetto semplicemente nella soluzione, e nell’altro collego una pippetta. Questo consentiva di
impalare la cellula, permetteva di penetrare nella membrana della cellula, senza ucciderla. In questo
modo si può mettere in relazione l’ambiente interno della cellula con l’ambiente esterno, e in questo
modo posso misurare, , se esiste, col voltmetro, la differenza di potenziale elettrico, tra l’interno e
l’esterno della membrana. Condizione 1: inizialmente i due elettrodi sono entrambi nella soluzione
neutra, e infatti il voltmetro è a zero, nell’istante t1. Se poi io impalo la cellula, succede quello che
vedete qui. Se si tratta di una cellula muscolare scheletrica umana o comunque di un mammifero
primate, leggo una differenza di potenziale che ha valore assoluto di circa 90 mV, ma che ha segno
negativo, ed è appunto -90 mV, che significa che all’interno c’è una densità di cariche negative e
all’esterno di cariche positive.
Quindi ho una struttura interno/esterno schematizzata più o meno come nella figura sopra. E’ anche
evidente che c’è qualcosa che consente di mantenere questa situazione di non equilibrio elettrico,
che se fosse possibile si neutralizzerebbe. Alla base dell’esistenza c’è questa separazione di cariche a
cavallo della membrana. Uso un banalissimo parallelismo elettrico: quello che ho appena
rappresentato lo posso paragonare ad una pila. Evidentemente se io connetto questa pila con un
voltmetro misurerò una ddp ad esempio di 12 V. Se io chiudo il circuito di questa pila essa si
scaricherà. Quindi dopo aver cortocircuitato la batteria passo da una condizione di equilibrio ad
un’altra. Quello che può succedere in una cellula come quella che vi ho mostrato è più o meno la
stessa cosa: io misuro la ddp e leggo -90 mV. Se qualcuno o qualcosa dall’esterno, anche
semplicemente un’azione meccanica, genera un corto circuito nella membrana, si vede che molto
velocemente la cellula si scarica, e noi diciamo si depolarizza. Da una condizione di polarizzazione
3
che chiamiamo potenziale di membrana di riposo, che è uguale a -90 mV, si passa ad una condizione
di depolarizzazione, poiché cariche elettriche di segno diverso si muovono attraverso la membrana.
Più esattamente si ha ingresso di cariche positive sottoforma di ioni sodio Na+. E’ evidente che se
entrano delle cariche positive esse neutralizzeranno le negative e quindi la quantità di cariche di
segno opposto diminuisce. Questo processo di depolarizzazione è rapido sul piano dei tempi
biologici, lunghissimo sul piano di altri tempi, perché può durare qualche millisecondo. Quindi mi
ritrovo, all’istante t2 una condizione analoga a quella della pila dopo il cortocircuito.
Però poi succede una cosa
diversa, a questo punto: se io
voglio ripetere l’esperienza su
questo apparato elettrico devo
ricaricare la pila, quindi devo
staccare il sistema e farle
riprendere potenziale, con un
caricabatterie ad esempio,
quindi fornendo energia
dall’esterno. Avviene anche
nella cellula, però avviene
automaticamente: dopo i primi
secondi di depolarizzazione, si
ottiene una ripolarizzazione. La
cosa interessante è che il
fenomeno si ripete nel tempo, e
se le condizioni di partenza sono
costanti, anche gli intervalli di
ampiezza della ripetizione sono costanti. Quindi noi abbiamo generato una variazione di potenziale
elettrico che in valore assoluto è di 100 mV, visto che in depolarizzazione la ddp non era andata a 0
mV ma a +10 mV. La depolarizzazione e la successiva ripolarizzazione si chiama potenziale d’azione.
Quindi noi partiamo da una condizione di riposo, di stabilità, ad una condizione di perturbazione di
questa stabilità che si caratterizza con una rapida depolarizzazione e una rapida ripolarizzazione,
chiamata potenziale d’azione. Quello che viene fuori però è che a seconda delle informazioni che il
sistema nervoso invia al terminale cellula muscolare, quest’evento si può ripetere con frequenza
crescente. In altre parole, il sistema è in grado di operare una modulazione di frequenza su questo
evento potenziale d’azione. Questa modulazione di frequenza rappresenta il codice di informazione
del sistema nervoso per la attività muscolare. La struttura nervo – muscolo finale opera una
trasduzione da modulazione di frequenza a modulazione di ampiezza. Allora se il muscolo deve
generare forza, possiamo osservare un’ampiezza, un’ampiezza ancora maggiore e cosi via sino alla
massima ampiezza possibile. Per ottenere questo tipo di output meccanico, il sistema si serve di una
modulazione di frequenza, ovvero di una depolarizzazione nella membrana cellulare che aumenta di
frequenza. Si badi bene che lo stesso processo vale per la trasmissione di informazioni alle
terminazioni nervose: si ha una frequenza di scarica della membrana del nervo, che si traduce in una
quantità crescente di emissione di una sostanza chimica, un neuromediatore , che nel caso specifico
di questa giunzione sinaptica è l’acetilcolina. Viene generata nella terminazione nervosa del
muscolo, quando questa membrana si depolarizza, viene diffusa in maniera proporzionale alla
frequenza di scarica del nervo, in termini quadrici, con pacchetti di quantità costante. Questo si
traduce in una frequenza di scarica della membrana del muscolo e dà luogo alla forza. Questa è
quindi la catena di eventi che, dal sistema di controllo nervoso, porta alla produzione di forza. Quindi
4
è molto importante che si abbia la condizione di partenza di separazione della carica a cavallo della
membrana, che non è però una cosa così ovvia.
Questa dovrebbe essere una rappresentazione schematica della membrana cellulare.
Come si può vedere è composta fondamentalmente
da una struttura lipidica: fosfolipidi doppio strato, la
parte idrofoba verso l’interno e la parte idrofila verso
l’esterno. Sarebbe una barriera insormontabile per le
sostanze in circolo nell’organismo, potrebbe essere
attraversata solo da sostanze liposolubili, come ad
esempio certi ormoni steroidei, ma proteine e ioni
normalmente non passerebbero. Esistono delle
soluzioni di continuità nella membrana, i cosiddetti
canali ionici, di tipo proteico, che si aprono e si chiudono solo in determinate condizioni voltaggio –
dipendenti. La possibilità di aprirsi è legata alla ddp transmembranale. Quello che risulta è che noi,
osservando questa struttura, leggiamo, come abbiamo visto, una ddp transmembranale che, se
trattiamo un muscolo scheletrico è -90 mV. Questo significa che esiste una potenzialità di generare
lavoro, che scomparirà quando la ddp andrà a zero. Per ora però le cariche sono impossibilitate a
muoversi, quindi abbiamo l’esistenza di una We, energia elettrica. In realtà, se guardiamo bene,
notiamo che, sul piano della concentrazione chimica, nel recipiente interno ed esterno alla cellula vi
sono delle importanti differenze: per il sodio la concentrazione è notevolmente più elevata
all’esterno, abbiamo infatti 145 mmol/l contro12 mmol/l; per il potassio è il contrario, per il cloro è
come per il sodio. Poi esistono, all’interno della cellula, una quantità di cosiddetti “anioni non
diffusibili”, che sono residui del metabolismo cellulare, grosse compagini molecolari, che
normalmente sono caricate negativamente, e che contribuiscono elettricamente a quello che
vediamo.
Ho usato il termine non diffusibile perché le precedenti specie ioniche possono diffondere ovvero
attraversare la membrana, mentre queste no, ma ci interessa relativamente. Quello che io osservo è
che esiste un altro gradiente energetico nel sistema, che è un gradiente di tipo chimico, di
concentrazione; sapete benissimo che quando in un sistema esiste una differenza di concentrazione
di sostanze, questa tende ad annullarsi: se si tratta di una soluzione, le parti dove c’è maggior
concentrazione si spostano dove c’è minor concentrazione, e questo può avvenire più o meno
rapidamente a seconda della resistenza al passaggio che può essere presente tra comparto A e
comparto B.
5
Come potete vedere abbiamo una resistenza
al passaggio nell’immagine B. Quindi,
tornando al discorso generale, abbiamo la
presenza di un altro tipo di energia, Wc , che è
l’energia chimica di concentrazione, che, se gli
è permesso, consente di compiere lavoro,
portare particelle da una parte all’altra del
sistema, perché c’è gradiente. Certamente, se
fosse permesso, il sodio si sposterebbe
dall’esterno all’interno. Quindi questo sistema
è caratterizzato dall’esistenza di due gradienti
energetici, uno di tipo chimico e uno di tipo
elettrico. Ora, se esistono questi gradienti
vuol dire che c’è qualcosa che impedisce di
compiere questo lavoro. L’ipotesi che io faccio
è che questo sistema sia equilibrio, ed è in
equilibrio perché il flusso netto di ioni che
attraversano la membrana è pari a zero, a
causa di questa uguaglianza:
[Wc]=[We]
Ammettiamo che ci siano soltanto delle particelle neutre, ma che ci sia una separazione, una
differenza di concentrazione. Facciamo un esempio: io ho un recipiente con acqua, abbiamo
condizione A e condizione B. A un certo tempo t0 immetto una manciata di cloruro di sodio (le
palline rosse), e al tempo ti vedrò che queste si sono diffuse in modo omogeneo in tutta la soluzione.
Il sistema ha spostato da un punto all’altro ioni. Ovviamente se io metto una barriera, una
membrana che riduce la diffusibilità dal primo al secondo comparto, il tempo tx sarà più lungo, fino a
diventare infinito quando non c’è proprio permeabilità. Io voglio sapere la quantità di lavoro
necessaria a spostare una quantità nota di solvente dal comparto 1 al comparto 2 di questo sistema.
Siccome dobbiamo riportare tutto a condizioni di tipo fisico, ci serviamo delle leggi dei gas perfetti,
considerando la soluzione interna alla cellula una soluzione diluita, che può essere assimilata, per
quanto noi sappiamo dalla fisica, ad un gas perfetto. Allora io posso considerare la condizione
chiamata A, cioè una concentrazione elevata del soluto nel comparto 1 rispetto al comparto 2, che
determina un gradiente energetico, come un sistema, come quello qui rappresentato, un cilindro
con un gas compresso, ovvero la concentrazione delle particelle di gas nel volume è più elevata
rispetto a quella esterna. Quindi il risultato sarà che all’interno del cilindro io avrò una pressione,
chiamata PC , che è maggiore di quella atmosferica, PATM. Abbiamo un fermo che tiene lo stantuffo in
posizione, e abbiamo una situazione di energia potenziale. Cosa succede se togliamo il fermo allo
stantuffo?Accade che questo si muove, il gas all’interno si espande, si riduce la concentrazione delle
particelle di gas perché sta aumentando il volume del cilindro stesso, fino a che la concentrazione
diventa uguale a quella atmosferica. Abbiamo ottenuto lavoro meccanico, spostando il pistone nello
spazio, esattamente della distanza ∆l. Questo lavoro lo definisco come F×∆l. Questa forza interessa
una superficie, quindi io posso scrivere P×V=P×S×∆l. Si ha quindi P×∆V, che è il lavoro che ho
compiuto. L’equazione di stato dei gas mi dice che P×V=RT, semplifico ancora, sostituisco
nell’espressione del lavoro e viene fuori che il lavoro è
=
×∆ =
×
∆
. Sto così misurando
la quantità di lavoro che è stata necessaria per eliminare questo gradiente energetico sotto forma di
6
∆
pressione. Integrando si ha che
spostare il pistone sarà
= ln ( ) − ln ( ). Quindi in definitiva il lavoro necessario a
× ln ( ). Se io traslo questa relazione alla soluzione di partenza so
=
come definire il lavoro necessario a portare la soluzione dalla condizione A alla condizione B, che
sarà, per simiglianza,
=
× ln
=
. Quindi io so sia la concentrazione esterna che quella
interna, e quindi sono in grado di risolvere il problema, cioè sono sia in grado di stabilire il lavoro
necessario a eliminare il gradiente, sia in grado di stabilire che energia esterna è necessaria affinché
non avvenga la neutralizzazione di concentrazione. Tutto sommato questa è la situazione che ho
nella cellula, dove ho un gradiente di concentrazione che non dovrebbe esserci, in quanto parliamo
di ioni diffusibili che dovrebbero poter attraversare la membrana, mentre c’è qualcosa che lo
impedisce, generando un lavoro che è uguale e contrario a questo di concentrazione. L’altra forza a
cui mi posso riferire è l’energia elettrica, quindi se vogliamo abbiamo già risolto una parte di
quest’equazione.
Adesso dobbiamo risalire a We.Ci riportiamo quindi l’equazione generale che abbiamo
ottenuto: −
=
× ln
[ ]
[
, dove [ ] è la concentrazione interna dello ione generico D, mentre
]
[ ] è la concentrazione esterna. Consideriamo che si tratta di un sistema polarizzato, ci sono degli
addensamenti di cariche di segno diverso che generano un campo elettrico in qui, se si immette una
carica q=+1C, essa viene spostata in direzione delle cariche negative. Facendo ciò si compie un
lavoro di tipo elettrico sulla particella che si sposta dal punto A al punto B. Questo lavoro è pari al
prodotto della carica elettrica per la ddp ai capi del campo elettrico, avremo cioè: = ×
( − ) = × ∆ . Se poi usiamo una Mole, abbiamo = × × × ∆ , dove Z è la valenza.
Ma M×q=F=96.500C=Faraday, cioè la carica di una mole, quindi avremo, infine: = × × ∆ .
Abbiamo cosi ottenuto l’espressione della quantità di lavoro necessaria a spostare una certa
quantità di cariche da un punto all’altro del campo o, facciamo attenzione, necessaria a mantenere
la situazione di differenza di potenziale. Allora io posso, a questo punto, prendere quest’elemento e
trasferirlo nell’equazione:
+
= 0, quindi
Nernst, da cui giungiamo alla relazione ∆ = −
× ln
[
× ln ([
[
[
]
]
]
]
+
∆ = 0, che è l’equazione di
) Volt, che è la ddp ai capi della
membrana, nonché potenziale di equilibrio del sistema misurato prima, cioè -90 V, che è l’energia
elettrica che non permette agli ioni di attraversare la membrana e che si oppone al gradiente di
concentrazione. Sulla base di quanto detto, mi dovrei aspettare che, ritornando a quell’esperienza di
misura in vitro sulla differenza di potenziale elettrico a cavallo della membrana, troviamo quel valore
di ∆V. Allora vado a calcolare, con l’equazione appena trovata, i valori di ∆ , visto che sono tutti
valori noti e che le concentrazioni interne ed esterne le posso calcolare. Sorge un problema: quale di
7
questi ioni diffusibili tra K, Na e Cl è il responsabile di quest’evento ∆ ?Sarà solo uno, saranno due o
tutti e tre ad esserne la causa?E’ molto importante saperlo, quindi faccio delle prove, di tipo
puramente matematico, considerando l’equazione di ∆ trovata in precedenza, e sostituendo i
valori rispettivamente dei tre ioni in esame. Se
= −61 × log
= −61 × log
= 61 × log
=−
[
× ln ([
= −90
]
), allora avremo
= +1
[ ] = 155
[ ] =4
= −96.8
= +66
]
[
[
[
[
/
/
= +1
] = 12
] = 145
= −1
] =4
] = 120
/
/
/
/
Stando a ciò che abbiamo osservato, potremmo affermare che è il cloro il responsabile del
potenziale di equilibrio, però io non mi fido e faccio una controprova. Se ciò che osservo fosse vero,
cambiando le concentrazioni interna ed esterna al cloro, dovrebbe cambiare anche il valore della
ddp. Allora aggiungiamo del cloro, e riandiamo a misurare, sia la ddp che la concentrazione: notiamo
che la ddp è rimasta a -90 mV e che anche il rapporto delle concentrazioni non è variato, mentre
sarebbe dovuto variare. Ciò significa che gli ioni si sono mossi attraverso la membrana, per fare in
modo che il potenziale non cambiasse; quindi adatta le sue concentrazioni interna ed esterna in
funzione di una ddp di membrana che è gestita da qualcos’altro. Allora escludendo il cloro per
quanto detto, escludendo il sodio perché genera un valore troppo distante da quello cercato, non ci
resta che esaminare il potassio. Faccio quindi variare la concentrazione di potassio e vedo che il
potenziale d’equilibrio cambia, ma cambia anche il potenziale di equilibrio del cloro, però non
diventa uguale a quello che io mi aspettavo. Diciamo che esiste una relazione diretta tra il potenziale
d’equilibrio dello ione K+ e il potenziale che misuro, che però rimane un po’ più basso. Se io aumento
(in valore assoluto) il potenziale del potassio, aumenta anche quello della membrana.
Facciamo quindi un grafico con la
concentrazione esterna del potassio e il
potenziale di membrana, scoprendo che
per valori elevati della concentrazione
esterna del potassio, il valore teorico e il
valore misurato del potenziale di
membrana coincidono. E coincidono solo
per valori superiori a 10: man mano che
io abbasso la concentrazione del
potassio, e che quindi aumento il
potenziale d’equilibrio del potassio
stesso, i valori teorici e quelli misurati si
discostano sempre più, poiché il
potenziale calcolato è maggiore di quello che vado a misurare. Come mai avviene questo? Ho
dimostrato che è il potassio che pilota il sistema, vedo con quest’altro esperimento che c’è una
coincidenza perfetta tra valore teorico calcolato e valore misurato, entro certi limiti di variazione
della concentrazione esterna di K+ e a un certo punto si perde questa coincidenza. Succede che, lo
ione Na+, che in prima approssimazione si pensa che non abbia permeabilità attraverso la membrana
8
e quindi non passi, invece passa, per valori di concentrazione del potassio bassi. In questo modo la
membrana è attraversata dall’esterno all’interno da cariche positive. Questo passaggio è voltaggio –
dipendente: man mano che io aumento la elettronegatività interna, aumento la conduttanza del
sodio dall’esterno verso l’interno e questo è un evento depolarizzante. Infatti se da un lato l’ingresso
del potassio tenderebbe a iperpolarizzare l’interno, dall’altro l’ingresso del sodio riduce questa
iperpolarizzazione, e da qui deriva appunto la differenza tra ddp teorica e ddp misurata. La corrente
di ioni sodio può essere dunque espressa tramite la legge di Ohm: INa=GNa(Em-ENa), dove INa è la
corrente di ioni sodio, GNa è la conduttanza del sodio, ed Em ed ENa sono rispettivamente il
potenziale di membrana e il potenziale di equilibrio del sodio. Più ioni sodio riescono ad entrare, più
il potenziale di membrana si abbassa, più la cellula si depolarizza. Però questa depolarizzazione non
va avanti a lungo, ma si ferma ad un valore abbastanza vicino al nostro -90 mV. Questo perché esiste
in membrana un sistema biochimico vicario che lavora contro gradiente di concentrazione, che fa in
modo di espellere gli ioni sodio entrati. Inoltre questo sistema, essendo una pompa elettroneutra, fa
entrare il potassio. In questo modo si riesce a mantenere in modo dinamico quest’equilibrio;
diversamente la cellula si estinguerebbe, poiché il potenziale di membrana scomparirebbe. Questi
fenomeni appena descritti sono autogestiti, non hanno cioè bisogno di energia esterna, poiché
assecondano il gradiente. Se io invece voglio andare contro gradiente, cioè voglio buttar fuori il
sodio, il sistema non ha quest’energia, che infatti viene fornita tramite adenosintrifosfato (pompa
ATP dipendente), che è il combustibile di queste pompe ioniche, e che proviene dalla possibilità che
l’organismo ha di nutrirsi. Sempre l’ATP è il responsabile della contrazione muscolare, grazie
all’interazione con actina e miosina. Vedremo comunque meglio l’ATP la prossima lezione, quando ci
occuperemo della contrazione muscolare. Abbiamo quindi osservato più o meno qual è la genesi di
quest’evento, il potenziale di membrana -90 mV. Tutto questo è molto bello ma non servirebbe a
niente, in quanto è una situazione di potenzialità:quello che ci interessa è disturbare questa
situazione di equilibrio squilibrandola, depolarizzando la cellula, in modo da generare quegli eventi
rapidi che sono depolarizzazione e ripolarizzazione che hanno la caratteristica di trasmettersi lungo
le membrane biologiche, creano una corrente, che non è esattamente una corrente ohmica, ma è
pur sempre un trasferimento di energia sotto forma elettrica nello spazio; lo spazio sono i
conduttori, cioè fibre nervose e membrane muscolari. Quindi è necessario creare questa situazione
quando io voglio inviare informazioni, ma devo partire da quel -90, che abbiamo visto come si
genera. Ammettiamo di avere la nostra membrana, come sempre carica positivamente all’esterno e
negativamente all’interno. Posso fare due esperienze in vitro, sempre con delle pippette. Nel caso 1
prendo una pila e collego il morsetto negativo con l’interno della membrana, poi tramite
l’interruttore lascio che la corrente fluisca: abbiamo un’iniezione di una carica negativa all’interno
della membrana. Se vado a misurare col voltmetro quello che sta succedendo noto che sto
iperpolarizzando e quindi il potenziale, da -90, va verso picchi più bassi. Questa situazione non dura
molto in realtà, perché stiamo iperpolarizzando, e ricordiamo che in seguito a iperpolarizzazione si
ha anche ingresso di sodio, per cui il sistema tende a riequilibrarsi al solito potenziale di membrana
di -90 mV. Ovviamente se io scambio le polarità della pila e attivo l’interruttore sto iniettando una
carica positiva, e questo è il caso 2: in questo caso succede l’opposto, poiché ho depolarizzato, e si
avrà un andamento esattamente simmetrico rispetto a quello osservato nel caso 1 (vedi figura
seguente).
9
Ripeto le esperienze 1 e 2 eseguendo le esperienze 3 e 4, dove, rispettivamente, inietto due cariche
negative e due cariche positive, e notiamo come i grafici crescano. Se continuo a iniettare cariche
negative e positive avrò, per la parte negativa, un certo valore, e invece che il valore positivo, di
depolarizzazione, è più ampio di quello che mi aspetto, cioè, nonostante continui ad iniettare la
stessa quantità di cariche negative e positive, la ddp del caso 4 risulta amplificata rispetto alla sua
simmetrica negativa del caso 3. Evidentemente si sta innescando un nuovo processo. Succede che la
depolarizzazione innesca quello che è chiamato Ciclo di Hodgking.
Il Ciclo di Hodgking.
Il sistema inizia ad autoalimentarsi, in modo
voltaggio – dipendente, depolarizzazione –
dipendente, ed iniziano ad aprirsi quei canali
proteici nella membrana, che sono adatti al
sodio: in questo caso GNa (conduttanza del
sodio) aumenta. In pratica passiamo da una
condizione elettrica ad una condizione ionica.
Questo aumento della conduttanza aumenta
la corrente di ioni sodio, quindi io sto
depolarizzando la membrana, e a sua volta la
depolarizzazione aumenta la conduttanza al
sodio. Il risultato di tutto ciò è una rapida
depolarizzazione, nel giro di qualche
millisecondo, a seconda del tipo di cellula. Il
sistema quindi si sgancia dall’evento che lo ha
10
generato (l’emissione di cariche positive) e va da sé, per questo aumento di conduttanza. Esiste un
valore di potenziale di membrana, che si chiama soglia, oltre il quale l’evento va da sé; quindi ci
vuole qualcosa che faccia entrare cariche positive, inizialmente, in quantità sufficiente da poter
superare il valore soglia oltre il quale il fenomeno si autoalimenta e va da sé seguendo le sue
leggi,generando il potenziale d’azione,cioè una rapida depolarizzazione da -90 mV a circa + 10 mV.
Ma in realtà dovrebbe portarsi a +66 mV, che è il potenziale d’equilibrio del sodio non ci arriva
perché la membrana, ad un valore di potenziale di circa 0 mV, inizia a ridurre la conduttanza al sodio
e a +10 mV tale conduttanza è azzerata: i canali ionici sono di nuovo chiusi, e quindi gli ioni Na + non
entrano più. Ma se non entrano più, io mi dovrei aspettare un sistema instabile, ma in realtà non
avviene perché, se da un lato la depolarizzazione ha azzerato la conduttanza al sodio, essa ha anche
aumentato la conduttanza al potassio. Il potassio è uno ione positivo, ed è concentrato più
all’interno che all’esterno, e quindi tende ad uscire, per gradiente di concentrazione. Elettricamente
alla cellula poco importa di cosa entra o cosa esce, l’importante è che si ripolarizzi.Quindi la parte di
depolarizzazione del potenziale è sodio-dipendente, mentre la parte di ripolarizzazione è potassio
dipendente. Se io sottopongo la cellula ad un ciclo di varie depolarizzazioni-ripolarizzazioni, essa avrà
una perdita di potassio e un arricchimento di sodio, poiché la pompa Na-K non ha tempo di
intervenire ad annullare questi scompensi. E’ come dire che noi possiamo contrarre un muscolo
quante volte vogliamo, ma dopo dobbiamo fermarci a riposarlo, per ragioni che vedremo, di fatica.
Quando il sistema si ferma quelle pompe rimettono dentro il potassio e ributtano fuori il sodio,
ristabilendo cosi le concentrazioni ioniche, sia all’interno che all’esterno. Com’è che si ferma la
conduttanza al sodio?Immaginando la cellula come un contenitore, la teoria che è stata formulata è
quella dei cancelli:
le frecce nere rappresentano il potenziale del
sodio, mentre le frecce bianche
rappresentano le varie fasi della
depolarizzazione, con m che è il cancello del
sodio ed h che è il cancello del potassio; i due
cancelli hanno evidentemente due velocità di
apertura/chiusura che sono sfasate,
differenti, altrimenti non si avrebbe alcuno
squilibrio ionico ed entrerebbe e uscirebbe la
stessa quantità di ioni positivi. Nelle cellule
muscolari e nervose avviene un fenomeno
detto iperpolarizzazione postuma: anziché
riportarsi a -90 mV (o -70 mV se si tratta di
una cellula nervosa), si porta a valori più elevati, e tende a portarsi al valore del potenziale
d’equilibrio del potassio, questo perché la chiusura del passaggio al sodio impedisce l’ingresso
voltaggio-dipendente di sodio che avverrebbe normalmente. Quando poi i canali del sodio si
liberano e quindi si ha la ripolarizzazione tutti i processi precedenti (pompa Na-K ed ingresso del
sodio voltaggio dipendente) ripristinano la situazione di partenza.
11
Rappresentazione schematica di un ciclo depolarizzazione-ripolarizzazione.
Lezione del 04/12/2008
Riepilogo della lezione precedente.
Nell’ultima lezione avevamo iniziato il discorso della fisiologia e biofisica della membrana delle
cellule eccitabili. Siamo arrivati a cogliere gli elementi che influenzano il potenziale elettrico
transmembranale delle cellule nervose e muscolari. Abbiamo anche colto che questa differenza
transmembranale ha ragion d’essere in quanto rappresenta una condizione di energia potenziale
che, quando opportuno, si traduce in energia elettrica, sottoforma di rapidi spike di variazione di
differenza di potenziale, lungo la membrana della cellula. Abbiamo detto anche che la frequenza con
cui si hanno queste depolarizzazioni e ripolarizzazioni rappresenta il codice di trasmissione tra una
cellula e l’altra. Quindi le informazioni che si trasmettono tra cellule eccitabili sono governate da una
logica di modulazione di frequenza. Abbiamo anche visto che, questa differenza di potenziale
elettrico transmembranale dipende, o quantomeno è legata ad una particolare distribuzione, ai due
lati della membrana, di ioni. Ma ho detto particolare distribuzione nel senso di relativa
concentrazione tra l’una e l’altra parte della membrana. Se consideriamo lo ione Na+ , questo è
particolarmente concentrato all’esterno della membrana: nello specifico, in una cellula muscolare
scheletrica umana, abbiamo mediamente 145 mmol/l che, si badi bene, è la stessa concentrazione
immessa nel sangue: c’è equilibrio tra tutti i liquidi corporei extracellulari; all’interno della cellula la
concentrazione è di 12 mmol/l. Questo implica una nuova condizione di potenzialità di tipo chimico
di concentrazione, che tende ad annullarsi qualora sia consentito il flusso di ioni: ovviamente se
questo è possibile, dalla zona a maggior concentrazione ci sarà una migrazione verso la zona a minor
concentrazione, ma tutto questo non avviene, e si mantiene questa potenzialità. Il discorso vale, in
modo reciproco, per lo ione K+. La potassemia, e quindi la concentrazione nel liquido extracellulare,
12
è pari a 4 mmol/l, mentre all’interno della cellula si riscontrano 155 mmol/l: la situazione è
praticamente contraria rispetto a quella del sodio. Entrambi gli ioni sono però positivi, e allora c’è
una differenza di potenziale chimico, in termini di concentrazione tra interno ed esterno che tende a
generare un flusso in modo da riequilibrare le concentrazioni, ma abbiamo detto che ciò non
avviene. Per quanto riguarda il cloro, Cl-, abbiamo una concentrazione assimilabile a quella del sodio,
nel senso che è concentrata molto maggiormente all’esterno della membrana che all’interno.
Questa particolare condizione dà luogo all’esistenza di energia potenziale di tipo chimico. Se
null’altro intervenisse, tutto ciò si annullerebbe. Com’è possibile mantenere questa differenza di
concentrazione? Semplicemente mettendo un muro tra i due comparti: in questo modo non ci
sarebbe possibilità di diffusione, ma le cose non vanno così, perché esiste una diffusività di questi
ioni attraverso la membrana, diversa e specifica per ognuno di questi ioni. Quindi a questo punto, se
non accadesse nient’altro, la situazione si equilibrerebbe; evidentemente c’è un altro tipo di energia
che lo impedisce: in questo modo si ha una situazione di equilibrio. Se ci sono diverse componenti
energetiche che agiscono su un sistema, e questo sistema mantiene una certa condizione, significa
che c’è equilibrio; in questo caso le componenti energetiche in gioco sono l’energia elettrica, che noi
riteniamo esista data l’osservazione della ddp di membrana di -90 mV, che dà quindi luogo ad un
gradiente chimico, ed il gradiente elettrico. Allora la coesistenza di questi due gradienti fa si che
questi squilibri (elettrico e chimico), continuino ad esistere. Naturalmente parliamo di un equilibrio
dinamico, in quanto il flusso netto di ogni specie ionica è pari a zero. Tutto questo serve a generare
quella condizione potenziale che se necessario si trasforma in spike, che si trasmettono e danno
l’informazione (che si può tradurre in contrazione muscolare, o in altre attività coordinate dal
sistema nervoso). Abbiamo quindi una interazione tra fenomeni di tipo chimico e fenomeni di tipo
fisico che danno luogo al fenomeno di separazione di cariche elettriche a cavallo della membrana.
E’ evidente, osservando l’equazione di Nernst, che nel sistema c’è una relazione tra la variabile di
tipo elettrico e di tipo chimico, ossia l’equazione lega queste due variabili, a meno di una costante.
E’ altresì evidente che il variare del rapporto tra le concentrazioni ioniche va ad influire su tale
relazione: ad esempio, esistono delle patologie che portano alla mancata escrezione per via renale
del potassio in eccesso, che inevitabilmente, non potendo essere espulso, torna nel liquido
extracellulare; si va così incontro ad una situazione di iperpotassemia.
∆ =−
× ln (
[ ]
)
[ ]
Osservando la relazione ricavata dall’equazione di Nernst, inevitabilmente si giunge alla conclusione
che alla mancata espulsione del potassio in eccesso corrisponde un aumento del denominatore
dell’argomento del logaritmo, dunque si riduce il rapporto, e quindi possiamo avere una situazione
in cui il potenziale di membrana non è -90mV, ma ad esempio -80 mV; tutto ciò crea problemi
fisiologici al funzionamento dei muscoli, ma soprattutto del cuore: si può andare incontro a
tachicardia parossistica o altri problemi, anche legati al pompaggio di sangue. Tutto questo discorso
mostra quanto sia importante mantenere la situazione di equilibrio. Avevamo visto inoltre,
ragionando ione per ione al fine di trovare il responsabile di quel -90mV che si misura a livello
transmembranale, che potevamo escludere il sodio, dato che stando alle sue concentrazioni, il
potenziale del campo dovrebbe essere +66mV; facendo una prima prova col cloro, si trovava un
valore di ddp esattamente uguale a quello misurato: era lecito dunque pensare che in quel processo
fosse coinvolto esclusivamente il cloro; in realtà, aumentando in vitro la concentrazione esterna del
cloro, abbiamo successivamente visto che il valore di ddp misurato non cambia, poiché anche la
concentrazione esterna di tale ione si rimetteva nella situazione di partenza: da tutto ciò, è lecito
pensare che anche il potenziale d’equilibrio del cloro è pilotato da qualcos’altro. Infine, andando a
misurare il valore legato al potassio, troviamo un riscontro lievemente più elevato di quello
13
misurato: ci si chiede quindi come mai, se è il potassio il responsabile del potenziale di membrana, il
valore non sia uguale a -90mV; andiamo quindi a manovrare la concentrazione esterna dello ione,
troviamo che il potenziale d’equilibrio si muove, in maniera direttamente proporzionale con la
variazione del rapporto di concentrazione.
Si notava che andando a misurare il
valore del potenziale di membrana per
una concentrazione esterna di potassio
pari a 20 mmol/l, la ddp riscontrata era
effettivamente corrispondente a quella
calcolata con l’equazione di Nernst, ma
che diminuendo la concentrazione
esterna, il valore misurato e quello
stimato coincidono sino ad un certo
punto. E’ evidente che per valori di
concentrazione esterna del potassio
inferiori ai 10 mmol/l, in cui il potenziale
di membrana e quello dello ione è di circa -60/65 mV, interviene un altro ione a rallentare la
depolarizzazione, e il sospetto cade sullo ione sodio. Ci si aspetta dunque che il potenziale del
sistema vada a +66 mV, ma ciò non accade. Man mano che la concentrazione esterna del potassio
diminuisce, aumenta la conduttanza al sodio, e quindi la relativa corrente, che rallenta la
depolarizzazione e causa quella differenza tra valori misurati e valori calcolati che si vede nel grafico.
La depolarizzazione si ferma quindi intorno a -90 mV, poiché esistono dei fenomeni metabolici di
membrana che, sotto spesa energetica esterna a questo sistema biofisico di membrana, prendono
gli ioni sodio e li portano fuori, contro gradiente. Nel frattempo il potassio era uscito per equilibrare
l’ingresso del sodio. Questa pompa ATPasica è detta pompa sodio-potassio, e si basa sulla possibilità
di trasformare substrati energetici derivati dall’alimentazione da parte dell’organismo. Tale pompa
fa parte del metabolismo basilare dell’organismo, ossia quell’insieme di processi minimi necessari
per sopravvivere, ossia atti a mantenere la termoregolazione e all’attuazione di altri processi che
vedremo. Tutto questo ci costa mediamente, tra le 1500 e le 2000 kcal al giorno, solo per mantenere
un corpo fermo e permettergli di respirare.
Un altro aspetto che abbiamo osservato è che iniettando attraverso la membrana delle cariche
elettriche , si ha una modulazione del potenziale di membrana: a seconda del segno di tali cariche
elettriche si ha un aumento o una diminuzione della ddp transmembranale, ossia si va incontro a
iperpolarizzazione (iniettando cariche negative) o depolarizzazione (iniettando cariche positive). In
entrambi i casi, se si interrompe l’immissione di cariche, dopo un certo tempo il sistema ristabilisce il
potenziale standard. Aumentando man mano il numero delle cariche immesse (negative o positive) i
rispettivi fenomeni crescono sino a che, per un certo valore di depolarizzazione, il fenomeno non è
più lineare rispetto a quello di iperpolarizzazione, ma si amplifica (vedere grafici e spiegazioni alle
pagine 9-10). Quello che succede è un aumento della conduttanza al sodio voltaggio – dipendente.
La depolarizzazione quindi aumenta con l’ingresso di ioni sodio, e non si ferma se non al cosiddetto
valore soglia per lo scatenamento del potenziale d’azione e non si ha più bisogno di iniezione di
cariche positive per aumentare la depolarizzazione, poiché abbiamo innescato il ciclo di Hodgking,
dove la conduttanza al sodio aumenta spontaneamente, fino a che, teoricamente, la cellula
raggiunge un nuovo punto di stabilità che sarebbe il potenziale d’equilibrio del sodio, cioè +66 mV.
Questo valore non viene però raggiunto: la depolarizzazione si ferma a +10 mV a causa
14
dell’innescamento di un altro fenomeno voltaggio – dipendente. Man mano che la cellula si
depolarizza, i canali al sodio, che prima si erano aperti, tendono a chiudersi. Tutto questo viene
spiegato con la teoria dei cancelli (pagine 10-11). Dopo la depolarizzazione si ha una ripolarizzazione,
e qui il sodio non è responsabile, perché non entra ne esce. Non consideriamo il discorso delle
pompe, perché sono troppo lente per intervenire e ripristinare tutto, ma intervengono dopo che il
fenomeno di eccitazione è finito. La ripolarizzazione è dunque dovuta ad un altro fatto:
consideriamo lo ione potassio. La corrente potassio è uguale a:
IK=GK(Em-EK)
Dove GK,Em ed EK sono, rispettivamente, la conduttanza al potassio, il potenziale di membrana e il
potenziale d’equilibrio del potassio. In condizioni di riposo, l’espressione (Em-EK) vale(-90-(-96)), ossia
+6 mV, che è una spinta debole. Quando invece ritrovo il potenziale di membrana a +30 mV,
quell’espressione assume il valore di +126 mV, che è una spinta molto maggiore della precedente. Si
consideri inoltre che in quelle condizioni si ha un aumento della conduttanza al potassio. Sotto
l’effetto di questa spinta, cariche positive abbandonano l’interno della cellula, con la conseguente
ripolarizzazione, alla quale segue la cosiddetta condizione di ripolarizzazione postuma. Questo ciclo
continua a ripetersi, come mostrato nel seguente grafico:
Si vede chiaramente come il potenziale d’azione si propaghi come una corrente, ma senza
decremento di ampiezza; si ricordi inoltre che il PdA è un transiente, che ha durata minima di 1ms
(nel sistema nervoso), fino a 15-20 ms a livello muscolare. La cellula può rieccitarsi, quindi produrre
un nuovo potenziale d’azione, non prima che sia passato un tempo pari al tempo della
depolarizzazione più 1/3, ½ del tempo di ripolarizzazione. Questo periodo è detto periodo refrattario
assoluto, oltre il quale è possibile rieccitare la cellula, ma è necessaria stavolta molta più energia di
stimolo di quanta ce ne voglia quando la cellula si trova a riposo; inoltre il potenziale che viene
generato è più lento e più basso. Man mano che i nuovi stimoli si allontanano dal periodo refrattario
diventano più ampi e rapidi. Come avviene la trasmissione di informazione senza decremento di
ampiezza? Se noi andiamo a vedere cosa succede in una struttura eccitabile, con una morfologia
allungata, come ad esempio il nervo, e in un punto del nervo si ha una depolarizzazione, si scatena il
potenziale d’azione, e notiamo che il segnale si propaga senza alcuna variazione di ampiezza.
15
Consideriamo quest’immagine come un tratto di assone,
o se si preferisce anche di membrana muscolare. Abbiamo
la parte esterna (le sezioni B) con un addensamento di
cariche positive, e la parte interna A con un
addensamento di cariche negative: questa è una struttura
polarizzata. Nella sezione A è avvenuta una
depolarizzazione, c’è stato cioè uno stimolo che ha ridotto
le cariche negative interne, ha ridotto la ddp che ha raggiunto la soglia, è aumentata la conduttanza
al sodio, si è innescato il ciclo di Hodgking, è entrato sodio, si è avuta l’inversione del potenziale e la
generazione del potenziale d’azione. Nelle sezioni adiacenti tutto questo non è avvenuto, quindi
sono polarizzate normalmente; tuttavia, la presenza di ioni positivi in questa sezione A provoca i
cosiddetti rigetti di corrente, esterni e anche interni, ma noi vedremo quelli interni. Queste cariche
positive che sono entrate, gli ioni sodio, si spostano verso cariche negative adiacenti da una parte e
dall’altra, e vanno a neutralizzare parte delle cariche negative (Figura 1): non è altro che una
depolarizzazione. Quindi le aree B, depolarizzate, raggiungono la soglia e producono a loro volta
potenziale d’azione, identico a quello precedente; il periodo refrattario assoluto impedisce una
depolarizzazione immediata della zona A, che si era appena depolarizzata e che ora si sta
ripolarizzando: in questo modo è evidente che parliamo di un fenomeno bilaterale centrifugo, che si
innesca nella zona A e si propaga via via (Figura 2).
Figura 1: Gli ioni sodio neutralizzano parzialmente le aree B e innescano la depolarizzazione
Figura 2: Il potenziale d'azione si propaga.
Questo spiega perché non vi è decremento di ampiezza, poiché ogni volta si genera un nuovo
potenziale d’azione. Un altro aspetto importante del fenomeno è la velocità di conduzione del
potenziale d’azione: infatti questo aspetto è un indice dell’efficacia nella trasmissione
dell’informazione. In linea di massima dipende dalla legge di Ohm, poiché le variabili in gioco sono
sezione e lunghezza del conduttore, ma bisogna anche considerare l’istologia della struttura che
16
andiamo a considerare. Ci riferiremo a cellule nervose, quindi agli assoni, che costituiscono la
stragrande maggioranza dei nostri tessuti di conduzione. Dall’istologia è noto che esistono due tipi di
assone, ossia dotati o meno di guaina mielinica. La guaina mielinica è una struttura di tipo lipidico,
fortemente isolante per quanto riguarda la trasmissione transmembranale di qualunque
informazione; risulta però che lungo l‘assone mielinico esistano delle soluzioni di continuità, dette
Nodi di Ranvier, dove invece è possibile la migrazione di ioni. Negli altri tipi di cellule nervose, che
sono più sottili, non esiste la guaina mielinica, ed infatti sono dette cellule mieliniche, e in queste la
trasmissione è possibile sezione per sezione. Abbiamo che la velocità di trasmissione nelle cellule
nervose mieliniche è maggiore rispetto a quella delle cellule amieliniche, poiché in queste ultime la
trasmissione dell’informazione deve avvenire per tutta la lunghezza del conduttore, mentre nelle
cellule mieliniche, la trasmissione del sodio avviene solo a livello dei nodi di Ranvier, che si sposta in
modo rapidissimo da un nodo all’altro senza dover depolarizzare tutta la cellula nella sua lunghezza,
come mostra la seguente schematizzazione
Figura 3: Propagazione del potenziale d'azione nelle cellule amieliniche.
Figura 4: Propagazione del potenziale d'azione nelle cellule mieliniche.
Matematicamente, abbiamo che VM>VA, poiché VM è legato in maniera lineare al diametro della
cellula dalla seguente relazione lineare:
VM=ø [µ]×6 [m/s]
Si hanno quindi 6 metri al secondo per ogni micron di diametro di sezione, per cui se consideriamo il
caso di un nervo grosso come quello che manda le informazioni dai recettori muscolari del tricipite
della sura, che ha una fibra afferente a livello del midollo spinale di 20µ, si ha una velocità di 120
m/s. Al contrario le cellule mieliniche hanno invece una relazione del tipo;
VA=ÿ [m/s]
La velocità di trasmissione nelle cellule mieliniche è quindi pari alla radice quadrata del diametro
della sezione, e non hanno dunque la funzione di rapida trasmissione, come vedremo. Come
facciamo a misurare la velocità di trasmissione? Prendiamo come esempio una gamba: attraverso
uno strumento chiamato stimolatore, che produce correnti elettriche adatte e non dannose,
iniettiamo le famose cariche elettriche che abbiamo visto prima in vitro, e posizioniamo un
voltmetro in un altro punto della gamba. Si misura la distanza tra il punto d’applicazione dello
17
stimolatore e il voltmetro, si fa partire lo stimolo, che dopo un certo periodo arriva e viene rilevato
sul voltmetro. Allora sapendo spazio e tempo, conosciamo la velocità. Questa procedura è detta
elettroneurografia.
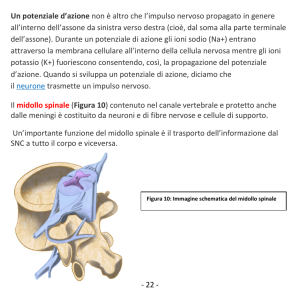
Fisiologia del sistema nervoso.
Abbiamo acquisito le basi del funzionamento dei sistemi di trasmissione del nostro organismo, ora
vedremo più nello specifico le strutture e le varie funzioni. Dall’anatomia è ben nota la distinzione
tra sistema nervoso centrale e periferico: il primo è costituito dal cervello e dal midollo spinale, il
secondo da tutte le altre terminazioni nervose. Si può anche parlare di sistema nervoso afferente e
sistema nervoso efferente: abbiamo informazioni che escono e si diramano tramite effettori, e
informazioni che da sensori o recettori, dalla periferia, entrano nel midollo spinale. Tutto questo
sistema si basa sia sulla modulazione di frequenza che abbiamo appena introdotto, sia sulla
possibilità di poter modulare ulteriormente questa frequenza tramite filtri di tipo chimico. Si parla
delle sinapsi neurone - neurone. Dall’anatomia si è appreso che il neurone ha una dimensione finita
che, per quanto lunga, termina con un bottone, il bottone o membrana presinaptica. Ogni neurone è
connesso con altri neuroni, ma c’è una soluzione di continuità tra un neurone e l’altro, una fessura, il
cosiddetto spazio sinaptico. I neuroni non sono quindi anatomicamente attaccati, ma si ha una
continuità di funzionamento. Se si ha lo scatenamento del potenziale d’azione in un neurone, come
fa a propagarsi agli altri neuroni ad esso connessi? Accade che nel neurone si ha la sintetizzazione di
un certo tipo di sostanza, genericamente detto mediatore chimico. Nel nostro caso specifico, ad
esempio, ci stiamo riferendo al mediatore chimico acetilcolina, che viene sintetizzato in un certo tipo
di neuroni in zona presinaptica: ci sono sistemi enzimatici, mitocondri, che sintetizzano questa
molecola, che una volta prodotta viene conservata in vescicole. Quando il potenziale d’azione giunge
alla membrana presinaptica, si nota un avvicinamento di queste vescicole alla membrana, seguita da
una fusione delle vescicole stesse con la membrana, dall’apertura della membrana e dall’estrusione,
nello spazio intersinaptico, dell’acetilcolina. Tutto questo può avvenire solo con la presenza dello
ione calcio Ca++, il quale, in condizione di depolarizzazione entra nella membrana presinaptica ed è il
responsabile dell’apertura della membrana. La quantità di mediatore chimico che viene estrusa è di
tipo quantico, ossia non vengono liberate una o due molecole, ma una o due vescicole, e dipende
dall’ampiezza e dalla frequenza del potenziale d’azione. Abbiamo quindi una trasduzione di energia,
dal tipo elettrico al tipo chimico, a livello presinaptico. Questa acetilcolina va a disperdersi un po’
dappertutto, ma una certa quantità va a finire sulla membrana postsinaptica, cioè sull’altro neurone:
su questa membrana ci sono delle formazioni chimiche, detti recettori di membrana per
l’acetilcolina, che sono delle molecole con un’altissima affinità con l’acetilcolina. Se una molecola di
acetilcolina si avvicina ad un recettore, viene catturata, e si forma un complesso chimico recettoremediatore, che ha la funzione di aprire i famosi cancelli al sodio e quindi di innescare il ciclo di
Hodgking nella membrana postsinaptica. In questo modo si ripete questa serie di operazioni che
portano alla propagazione del potenziale d’azione. Applicando tutto questo alla generazione di
movimento muscolare, c’è bisogno di un meccanismo che permetta di scaricare subito la struttura
dall’acetilcolina, e che quindi permetta la ripolarizzazione per consentire una nuova
depolarizzazione, in modo che si sommino gli effetti di contrazione uno dietro l’altro. Ci sono delle
sostanze, nello spazio intersinaptico, dette colinesterasi, che sono enzimi che attaccano l’acetilcolina
non permettendone il riconoscimento da parte dei recettori, ed in questo modo avviene la
ripolarizzazione e si ripete il ciclo, sino ad avere una serie di contrazioni muscolari. Esistono sostanze
dette inibitori delle colinesterasi: in questo modo l’acetilcolina non viene mai inibita e si ha la paralisi
spastica (mentre in caso di inibizione totale dell’acetilcolina, come col curaro, si ha paralisi flaccida),
18
ossia il muscolo rimane contratto. Gran parte degli insetticidi, ad esempio, sono inibitori delle
colinesterasi, ed ecco perché sono molto pericolosi.
La giunzione neuro-muscolare.
Possiamo ora vedere un tipo di sinapsi che ci interessa in particolare, che è la sinapsi neuro –
muscolare, la giunzione nervo – muscolo.
Nella prima immagine vediamo, in maniera molto schematizzata, tutto ciò che va a collegarsi alla
terminazione nervosa amielinica che si interfaccia con la membrana muscolare; nell’immagine a
destra si vedono chiaramente le vescicole contenenti l’acetilcolina, la fessura sinaptica, i recettori
postsinaptici e tutto il resto della struttura. All’interno della terminazione presinaptica colinergica si
attua la sintesi dell’acetilcolina. Il potenziale d’azione presinaptico induce la migrazione delle
vescicole contenenti acetilcolina verso la membrana presinaptica. La depolarizzazione della
membrana presinaptica, in presenza di Ca++, induce l’estrusione del mediatore. L’acetilcolina dà
luogo ad una depolarizzazione chiamato potenziale di placca. Il legame mediatore-recettore
postsinaptico è antagonizzato dalle colinesterasi, per consentire la ripetitività dell’evento potenziale
d’azione.
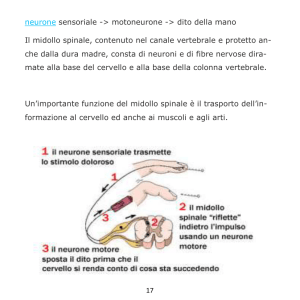
I motoneuroni.
Ci stiamo avvicinando, pian piano, a parlare di quel meccanismo chiamato riflesso spinale. I riflessi
rappresentano dei fenomeni o dei meccanismi per cui si ha lo scatenamento di un potenziale
d’azione, che percorrendo il nervo afferente giunge ai muscoli, per poi tornare per vie efferenti
direttamente al midollo spinale, senza passare per l’encefalo: si ha quindi un fenomeno totalmente
spinale. La caratteristica dei riflessi è l’avere un comportamento stereotipato. Sono molto importanti
i riflessi spinali legati al movimento e alla locomozione: il vantaggio di questo sistema è che ci
consente di effettuare diverse azioni senza il bisogno di doverle pensare. Ad esempio, io sto in piedi,
e non è un evento così immediato come si potrebbe pensare, poiché va contro la legge di gravità,
che imporrebbe il piegamento delle ginocchia e la caduta. Non cado perché ci sono delle strutture, i
muscoli antigravitari (quadricipite femorale, glutei), che vengono attivati, producono forza, che
stende l’articolazione del ginocchio. Per quanto il midollo spinale sia organizzato come detto, molti
movimenti sono influenzati dalla cosiddetta encefalizzazione, ossia, per quanto la loro realizzazione
sia del tutto autonoma dall’encefalo, sono coordinati da un “progetto” che noi abbiamo in mente,
come il mantenimento della postura, che ha origine riflessa, come abbiamo appena visto.
19
Il riflesso da stiramento viene evocato
dall'allungamento del muscolo e provoca una
risposta contrattile che tende e a ridurre la
lunghezza del muscolo stesso. La risposta
presenta due componenti, una fasica di
breve durata evocata dal rapido
cambiamento di lunghezza ed una tonica
indotta anche da lente variazioni del
muscolo. L'attività riflessa non riguarda solo
il muscolo stirato che si contrae ma anche il
muscolo antagonista che si rilascia
(fenomeno detto innervazione reciproca). Questa risposta avviene con una latenza molto bassa che
è spiegabile solo attraverso la presenza di una sinapsi diretta tra fibra afferente e neurone motore
(riflesso monosinaptico) ed è proporzionale all'intensità dello stiramento ed alla velocità con cui
viene provocata. I riflessi spinali, che costituiscono il primo livello dell'organizzazione motoria, si
basano sulla risposta diretta a stimoli recettoriali. I recettori specializzati del muscolo sono i fusi
neuromuscolari e gli organi muscolo tendinei del Golgi.
Figura 5 : ll riflesso monosinaptico
Il riflesso monosinaptico.
Riferendoci alla figura 5, parliamo ora di questo riflesso, che sul piano anatomico è il più semplice,
consta di pochi elementi: midollo spinale, muscolo scheletrico, fuso neuromuscolare, fibra afferente
Ia e motoneurone α. Le fibre Ia hanno diametro di circa 16-20 µ. Proviamo a fare un ragionamento:
consideriamo il quadricipite, che ha lunghezza di circa mezzo metro: quanto tempo impiega il riflesso
per attivarsi?Facciamo qualche calcolo: se avessimo un metro di una struttura che viene attraversata
da un informazione a 120 m/s, questa informazione percorrerebbe la struttura in 10 ms;
aggiungiamo i tempi sinaptici, ossia il tempo che il mediatore impiega a trasferirsi dalla membrana
presinaptica alla postsinaptica (parliamo di 1, massimo 2 ms); c’è poi il tempo di trasferimento dalla
giunzione neuromuscolare alla membrana, anch’esso della durata di pochi millisecondi, e
soprattutto c’è il tempo di eccitazione e contrazione del muscolo, che può richiedere anche 50, 100
ms. Quindi in totale parliamo di circa 100, 150 ms: sono dei tempi che noi, con la volontà, non
riusciremmo ad attuare.
Abbiamo qui uno schema, sul posizionamento dei
recettori: abbiamo le fibrille muscolari, dette anche
fibre extrafusali, e abbiamo il recettore (intrafusal
fiber), messo in parallelo con le fibre: notiamo come
sia più affusolato sulle estremità e come la sua
struttura sia di diametro maggiore nella parte
centrale. La caratteristica istologica del recettore è
che esso è costituito strutturalmente in maniera
analoga alle fibre muscolari: è anch’esso formato da sarcomeri, al suo interno ha delle sottilissime
fibre muscolari, ed è quindi capace di contrarsi. Un esempio tipico del funzionamento dei riflessi è
l’evocazione del riflesso patellare: si cerca la nicchia sotto la rotula, dove c’è un tendine, e si dà un
colpetto secco e veloce. Tramite questo colpetto, non si fa altro che modificare la lunghezza del
tendine del quadricipite, il quadricipite si allunga, stira i fusi neuromuscolari, si innesca la risposta
riflessa, si ha la contrazione del muscolo estensore, e si ha l’estensione dell’articolazione del
20
ginocchio. Chiaramente il colpetto dura poco, la contrazione finisce e la gravità riporta l’articolazione
nella posizione precedente. Tutto questo serve al neurologo per sapere se il sistema sta funzionando
bene, ma anche a stabilire se si hanno dei danni muscolari. In sequenza si ha:
Abbiamo la struttura formata da tendine, rotula e quadricipite, midollo spinale,motoneurone α, fibra
Ia, che nasce dai fusi neuromuscolari, entra e chiude il riflesso monosinaptico.
21
Ammettiamo che l0 sia la lunghezza di riposo del muscolo quadricipite e dei suoi fusi neuromuscolari.
Se vado ad osservare l’attività di scarica dei nervi afferenti Ia ed efferenti α motoneuroni, vedo che
c’è un certo tono: il nervo Ia trasferisce continuamente potenziale d’azione. Significa che il fuso
neuro muscolare è continuamente disteso rispetto alla sua posizione di riposo meccanico. Per via
riflessa, se c’è attività nella fibra Ia, ce n’è anche nel motoneurone α, nella condizione di
preeccitazione. Opero la deformazione del tendine col martelletto: ho prodotto un allungamento del
sistema e del suo fuso neuro muscolare. Si osserva una aumento della frequenza di scarica del
potenziale d’azione a livello di fibra afferente e, con un certo delay, o ritardo, si trasmette al
motoneurone α: il risultato è che il sistema si accorcia; successivamente, finito lo stimolo di
stiramento, il muscolo si inflaccidisce perché non arrivano più impulsi al motoneurone α e la gamba
torna in posizione di riposo. La prossima volta vedremo che questo sistema di meccanismi ci
consente di stare in piedi.
Figura 6: Schema del fuso neuromuscolare
Il fuso neuromuscolare è composto, al suo interno, da 5, 6 fibrille, ed è circondato da guaina
connettivale. Queste fibre muscolari sono di due tipi: quelle disegnate in rosso dette a borsa di
nuclei, dove i nuclei sono concentrati al centro, e quelle blu dette a catene di nuclei, dove i nuclei
sono appunto disposti uno dietro l’altro, e sono un po’ più corte; questi due tipi di fibre hanno
funzioni diverse. Sia le fibre a borsa di nucleo che quelle a catena di nucleo sono innervate in
maniera complessa:
Figura 7
C’è un innervazione afferente al midollo spinale, rappresentata dalle due terminazioni anulo-spirali
in figura, che nasce da queste fibre e va verso il midollo spinale, ma ci sono anche delle innervazioni
motorie: come tutte le fibre muscolari, anche i fusi sono innervati da motoneuroni efferenti dal
midollo spinale (β e γ), e quindi se questi motoneuroni vengono attivati, i loro sarcomeri tendono a
contrarsi, e questo è importantissimo perché ci consente di effettuare movimenti precisi: sono alla
22
base del fatto che noi decidiamo di prendere un determinato oggetto, come una penna, pilotando
semplicemente il movimento della punta delle dita, senza pensare a dover muovere tutte le altre
articolazioni.
Lezione del 05/12/2008
Riepilogo della lezione precedente.
Facendo riferimento alla figura 7, riprendiamo il discorso relativo ai fusi neuromuscolari, strutture
che contengono strutture muscolari connesse a terminazioni nervose: le fibre del gruppo Ia, che
escono, cioè afferenti al midollo spinale, che nascono dalle terminazioni anulo-spirali , strutture
situate a livello equatoriale del fuso neuromuscolare; le Ia possono avere diametro sino a 20 µ. Ci
sono poi le fibre del gruppo II , posizionate in modo più polare,più sottili delle precedenti (circà metà
del diametro) e quindi più lente. Abbiamo detto che questi sono i due tipi di fibre afferenti, che
portano informazioni al midollo spinale che nascono dall’eventuale deformazione meccanica delle
fibre intrafusali, che possono essere o stirate da forze esterne, o contratte perché il muscolo si sta
contraendo. L’informazione nasce in caso di stiramento, ed infatti questi recettori sono detti
recettori da stiramento.
Dinamica dello stiramento del fuso neuromuscolare.
Figura 8: Modello di fuso neuromuscolare
Tutto questo, sul piano meccanico, ha un senso ben preciso: se prendiamo un muscolo scheletrico,
ad esempio un bicipite, col relativo fuso neuromuscolare, ogni variazione di lunghezza che il muscolo
subisce, si riscontra anche sul fuso neuromuscolare, data la loro connessione in parallelo meccanico.
Questo significa che se si applica una forza F a questo sistema, sottoponendolo a deformazione di
lunghezza, dalla terminazione anulo-spirale arriva un’informazione sottoforma di frequenza di
potenziali d’azione al midollo spinale, attraverso le corna dorsali o posteriori, informazione che è
legata linearmente o proporzionalmente alla variazione di lunghezza subita dal muscolo. Abbiamo
quindi un sensore di lunghezza del muscolo. Questa informazione, una volta che entra nel midollo
spinale, attiva un riflesso che torna indietro tramite il motoneurone α, situato nelle corna ventrali
del midollo spinale: parliamo di sostanza grigia. Il motoneurone α esce dal midollo spinale, e l’assone
va ad innestarsi col fuso neuromuscolare corrispondente . In questo modo abbiamo un circuito
chiuso, il cosiddetto arco riflesso monosinaptico. Il significato funzionale di questo riflesso è che se io
stiro il muscolo, si allunga la terminazione anulo-spirale, in questo modo aumenta la frequenza della
scarica di potenziali d’azione della fibra afferente Ia, entra nel midollo spinale, passa nel
motoneurone α, ne aumenta la depolarizzazione e genera una scarica di potenziali d’azione che
arriva alla placca o giunzione neuromuscolare; si ha poi emissione di acetilcolina, col conseguente
legame mediatore-recettore, aumento della conduttanza al sodio, depolarizzazione della membrana
muscolare, estrusione di calcio dal reticolo sarco-plasmatico verso il sarcomero, attivazione della
contrazione, quindi accorciamento del muscolo. Questo meccanismo è alla base del controllo della
postura, che altro non è se non la posizione relativa delle articolazioni istante per istante. Se
qualcuno o qualcosa che non sia la nostra volontà tenta di distogliere l’articolazione da quella
23
postura programmata, questo riflesso lo impedisce. Naturalmente questa sembrerebbe una cosa
inutile, perché altrimenti noi non potremmo muoverci ne compiere nessuna azione; evidentemente
il sistema nervoso è molto articolato e plastico, per cui ci sono dei meccanismi che modulano le
informazioni di periferia sulla base di ulteriori comandi centrali, per cui può essere inibita
parzialmente o totalmente questa situazione appena descritta, attraverso interferenze nello spazio
sinaptico. Si tenga conto che su ogni motoneurone ci sono tra le 1000 e le 3000 terminazioni
sinaptiche di altri neuroni il risultato è un’integrazione spazio temporale di tutte queste
informazioni, convergenti sul motoneurone. Abbiamo già detto che possiamo adottare un modello
meccanico analogo al fuso neuromuscolare, sul piano delle caratteristiche materiali e di
deformazione all’applicazione di forze. Sappiamo benissimo che i corpi solidi possiedono o meno
caratteristiche di deformazione elastica, o di viscoelasticità. Possiamo ragionevolmente pensare,
perché ce lo dimostra l’evidenza sperimentale, che la parte equatoriale o centrale della fibra
intrafusale abbia caratteristiche assimilabili ad un corpo elastico: questo significa che se applico una
forza di trazione al corpo centrale, il sistema si deforma, si allunga, istantaneamente, in maniera
proporzionale alla forza applicata ed alla sua rigidità, ma se la forza viene tolta il sistema recupera
istantaneamente la posizione originale. Le zone polari, le estremità, dove non c’è la terminazione
anulo-spirale ma ci sono i sarcomeri, si comportano come corpi con caratteristiche di viscosità, per
cui noi le assimiliamo ad un sistema come un cilindro, contenente un fluido, a cui è applicato uno
stantuffo.
Sappiamo che una struttura viscosa, sottoposta a forza, si deforma in direzione della forza, ma tale
deformazione non è istantanea, e al cessare della forza non recupera la posizione originale. Allora
noi mettiamo insieme queste due caratteristiche strutturali, e abbiamo un corpo elastico al centro e
due strutture viscose ai lati. Ammettiamo di stirare il muscolo, e quindi il fuso neuromuscolare:
succede che quando applico un gradino di forza (in nero in figura 9) al sistema, esso si allunga.
Figura 9
Vediamo bene dal grafico che la parte centrale (in rosso) si deforma istantaneamente con
l’applicazione della forza. Per ciò che interessa a noi, accade che la terminazione anulo-spirale viene
meccanicamente deformata, temporalmente in maniera coerente con la forza applicata; questa
deformazione implica un aumento della conduttanza al sodio nella terminazione nervosa, si innesca
un ciclo di Hodgking e quindi partono potenziali d’azione, che attivano il riflesso. Se io però applico
24
una forza e la mantengo nel tempo, succede che l’energia elastica accumulata viene recuperata a
spese delle strutture viscose, che vengono stirate. C’è quindi una fase successiva in cui si ha
l’annullamento della deformazione della parte centrale, compensata da un progressivo
allungamento delle parti polari, perché la deformazione totale deve essere mantenuta.
Ma allora l’informazione che arriva non è costante: si ha un picco di deformazione, e quindi di
depolarizzazione, e poi una riduzione; questo picco è tanto alto quanto è veloce l’applicazione della
forza, e questo è molto importante per il tipo di informazione che dà questo recettore. Si considera a
questo punto un esperimento di tanti anni fa, condotto su preparati animali.
E’ possibile isolare, con delle tecniche di microchirurgia, dei fusi muscolari animali, esattamente
presi dal dito lungo della zampa posteriore della rana, si estrae il muscolo estensore, lo si spella e si
ottiene il fuso neuromuscolare con le sue terminazioni nervose. Questo si fa all’interno di una micro
vaschetta contenente un liquido nutritizio; si fissa un capo del fuso ad una parete della vaschetta, e
l’altro capo viene fissato ad un asse, in questo caso si tratta di un pezzetto di lenza di nylon, a sua
volta legato ad un motorino con un asse che può oscillare; questo motore è controllato
elettronicamente in modo da poter monitorare l’andamento della velocità angolare nel tempo.
Abbiamo inoltre collegato un troncone della terminazione Ia ad un filino di platino, collegato ad un
oscilloscopio, mentre con un altro oscilloscopio controllo il troncone di terminazione di tipo II.
Figura 10
25
Si farà ora riferimento alla figura 10. Si genera un impulso meccanico, che ha generato la variazione
di 1 mm della lunghezza del sistema, e lo ha fatto il 40 ms. Si sostiene questo allungamento per un
certo periodo e poi lo si fa cessare. Andiamo a valutare l’andamento della scarica del potenziale
d’azione nelle due terminazioni collegate agli oscilloscopi: si nota chiaramente che all’inizio
dell’allungamento, la frequenza di scarica nella terminazione Ia è aumentata moltissimo rispetto alla
condizione di riposo. Una volta raggiunto il nuovo valore di lunghezza e la mantengo tale, questa
frequenza di scarica si riduce: è sempre superiore alla frequenza a riposo, ma è scemata rispetto alla
precedente, che era conseguente all’aumento dinamico della lunghezza del fuso. Abbiamo quindi
due informazioni, una relativa alla fase dinamica, ossia che riguarda la fase di allungamento, e una
relativa alla fase statica, in cui la lunghezza del fuso non varia, ma resta costante. Se vado a guardare
le fibre del gruppo II c’è, rispetto alla condizione precedente, un aumento della frequenza che però
non è distinguibile tra fase dinamica e fase statica. Rimettiamo a riposo la fibra e ripetiamo
l’esperimento, stavolta raddoppiando l’allungamento (figura 10, colonna 2), mantenendo la stessa
velocità di allungamento: arriveremo a 2 mm in 80 ms. Andando a valutare l’andamento della
frequenza di scarica, la fibra Ia aumenta la sua frequenza di scarica durante l’allungamento, e anche
la frequenza di scarica in fase statica ha subito un raddoppiamento, proporzionalmente al
raddoppiamento dell’allungamento che abbiamo imposto al fuso; lo stesso si può dire per la fibra del
gruppo II, che aumenta la frequenza ma che, come nel caso precedente, non permette una
distinzione tra fase dinamica e fase statica. Possiamo quindi dire che, facendo un diagramma della
relazione tra la variazione di lunghezza e la variazione di frequenza, troviamo una retta. Rimettiamo
a riposo il fuso e, come mostrato nella colonna 3, ripetiamo l’allungamento di 1 mm, stavolta
dimezzando il tempo di allungamento, ossia raddoppiando la velocità di stiramento: notiamo, nel
diagramma delle frequenze, che la variazione della frequenza di scarica nella fibra Ia è aumentata
notevolmente rispetto alla condizione di riposo, mentre nelle fibre del gruppo II si ha lo stesso
comportamento che si è osservato nel primo caso. Quest’ultima osservazione ci dà un’informazione
di tipo meccanico: la parte anulo-spirale ci dice la velocità con cui il muscolo è stato stirato, mentre
dalla parte statica stabiliamo a che allungamento ci siamo fermati. A cosa serve quest’informazione?
Torniamo al riflesso: ricordiamo che il riflesso ci deve impedire di cadere, ad esempio; se un peso
grava sulle mie spalle, maggiore è il peso, maggiore sarà la velocità del riflesso e maggiore sarà
l’allungamento. La risposta dinamica del sistema è proporzionale, e quindi avremo un aumento della
frequenza di scarica di rientro del riflesso tanto alto quanto sarà maggiore la velocità di stiramento,
avendo in questo modo una risposta abbastanza rapida per il recupero della posizione. Andiamo ora
a valutare in modo più completo il sistema, considerando, oltre alle fibre Ia e II, le fibre efferenti, gli
assoni dei motoneuroni.
Figura 11
26
Arriva dell’informazione nei motoneuroni, si stimola la produzione di acetilcolina e si ha la
generazione di forze di contrazione, che dovrebbe consentire l’avvicinamento dei capi tendinei, ma
ciò non accade, perché chiaramente non può generare forza sufficiente. Allora è arrivata
un’informazione dai motoneuroni γ, si è avuta una contrazione dei sarcomeri, e questa forza si è
scaricata tramite lo stiramento della parte equatoriale: stiamo ugualmente deformando la
terminazione anulo-spirale. Ecco cosi spiegato il controllo riflesso dei nostri movimenti, in cui noi
focalizziamo l’attenzione solo sul movimento finale, sull’obiettivo. Per provare tutto ciò, ci si riferisce
all’esperimento precedente e alla figura 11. Abbiamo la stessa situazione precedente, con un
motorino, le fibre Ia e II, e stavolta abbiamo anche le fibre efferenti γ, che sono di due tipi: γS e γD,
gamma statico e gamma dinamico. Ripetiamo l’esperimento di prima, produco un allungamento del
fuso neuromuscolare a velocità costante, mantengo lo stiramento per un certo periodo e poi faccio
recuperare alla struttura la sua lunghezza originale. Accadrà ciò che abbiamo già visto: nella fibra Ia
ci sarà un aumento della frequenza di scarica in fase dinamica, un aumento in fase statica ma più
basso della fase dinamica, mentre nella fibra del gruppo II ci sarà un aumento generale, ma senza
distinzione tra fase dinamica e fase statica. Nella seconda riga della figura 11 è evidenziata la novità
dell’esperimento: simulo, sul motoneurone γS, l’attività del midollo spinale, stimolandolo, e
generando un potenziale d’azione che si trasmette. Tutto questo si realizza con i soliti stimolatori
elettrici, in grado di simulare l’attività nervosa, producendo degli spike, con frequenze ed ampiezze
regolabili. Noto che la frequenza di scarica della fibra II in fase statica raggiunge la frequenza della
fibra Ia in fase dinamica: abbiamo quindi di fronte un amplificatore di frequenza.
Intuitivamente quindi, se si va a stimolare la γD accade che si ha un aumento della frequenza di
scarica della fibra Ia.
Tutto questo va a raffinare ulteriormente la sensibilità dei nostri movimenti e riflessi.
27
Il riflesso miotatico.
In questo schema vediamo
l’articolazione del gomito: B=
muscolo bicipite, flessore del
gomito, T= muscolo tricipite,
estensore del gomito. Questi
muscoli sono detti muscoli
antagonisti: a seconda della
risultante delle forze di questi due
muscoli, il gomito assume posizioni
differenti. Nello schema abbiamo
inoltre una sezione del midollo
spinale, da cui si dipartono assoni
di motoneuroni α, schematicamente definiti come MB ed MT. Ognuno di questi motoneuroni, oltre a
differenziarsi anatomicamente dall’altro, ha anche dei rientri riflessi differenti, a seconda di ciò che
la fibra intramuscolare trasmette. Abbiamo inoltre schematizzato la fibra afferente IaB, che dal
bicipite esce e va a chiudere il circuito direttamente su MB, consentendo la depolarizzazione, la
produzione di acetilcolina e la contrazione del bicipite; c’è inoltre una divergenza da cui si diparte
un’altra fibra afferente parallela, che va a fare sinapsi con un piccolo interruttore spinale:
quest’interruttore, se stimolato, è inibitorio, cioè produce un mediatore chimico chiamato acido
gamma-aminobutirrico (GA-BA) che è iperpolarizzante, cioè riduce la sensibilità della membrana
postsinaptica, e quindi tende a “spegnere”. Naturalmente tutto questo esiste in modo speculare per
il tricipite, anche se nello schema non è riportato. Abbiamo quindi un aumento della frequenza di
scarica nel bicipite e una relativa generazione di forza nel muscolo, e parallelamente un’inibizione
del motoneurone del tricipite in modo che, ad esempio, mentre io sollevo l’avambraccio, il tricipite
non me lo impedisca. Questo meccanismo, chiamato innervazione reciproca, è in grado non solo di
gestire due muscoli, ma come si è visto, un intero sistema.
L’organo tendineo del Golgi.
L’organo tendineo del Golgi (OTG) è un altro recettore da stiramento, ma dà delle risposte diverse a
causa della sua posizione anatomica. Anziché essere messo in parallelo ad un muscolo, è in serie:
Figura 12
Esso è situato tra la fine della struttura muscolare e l’inizio della struttura tendinea, ma
fondamentalmente è situato più sul tendine che sul muscolo. Quindi, perché esso si deformi, si deve
28
deformare la struttura su cui è poggiato, cioè il tendine. Normalmente, sul piano della rigidità
meccanica, il tendine è ben più rigido del muscolo: ebbene, se applichiamo un carico, ci rendiamo
conto che questo è un recettore della forza generata dal muscolo a cui esso è collegato.
Ricapitolando, il fuso neuromuscolare è un recettore di lunghezza, mentre l’OTG di forza. E’ un
recettore estremamente sensibile, e la frequenza di scarica che manda al midollo spinale è
linearmente collegata alla quantità di forza generata dal muscolo. Come si può vedere dalla figura,
dall’OTG si diparte un’altra fibra afferente detta Ib, più sottile della Ia ma la cui velocità di
trasferimento delle informazioni si attesta sempre intorno ai 100 m/s. Entra nel midollo spinale dalle
corna dorsali, arriva al motoneurone α del muscolo omologo non per connessione diretta, ma
tramite un altro motoneuroncino inibitore (disegnato in blu). In altre parole: il muscolo genera forza,
l’OTG viene deformato, manda una frequenza di scarica proporzionale all’allungamento subito e
quindi alla forza del muscolo, entra nel midollo spinale, arriva all’interneurone, che viene eccitato e
produce GA-BA, che iperpolarizza la membrana del motoneurone omologo, e quindi riduce la forza:
abbiamo quindi un feedback negativo, opposto a quello dei fusi neuromuscolari, e ha la funzione di
preservare da rotture muscolari generate da un eccesso di forza prodotta dal muscolo stesso.
Questo è un riflesso protettivo, perché è possibile che in certi soggetti la forza prodotta da un
muscolo sia superiore alla soglia di resistenza meccanica del muscolo stesso, con conseguenti
distaccamenti tendinei.
Dall’immagine sopra è evidente come sul motoneurone α ci sia una sommazione spazio temporale di
informazioni, per cui si ha un “contrasto” di informazioni, in modo tale da impedire al muscolo di
potersi danneggiare.
29
Questo meccanismo di protezione può non funzionare correttamente a seconda della velocità con
cui la forza agisce sul sistema o ad esempio in caso di tendinosi o altre patologie che non rendono
ottimale il funzionamento del sistema, oltre ad alterarne le caratteristiche strutturali di resistenza
meccanica. Infine parliamo del riflesso a serramanico, riferendoci ad un organismo decerebrato,
poiché i controlli centralizzati attenuano di molto gli effetti di tale riflesso. Applico una forza
all’articolazione del gomito, inizia lo stiramento del bicipite, partono i riflessi dei fusi neuromuscolari
che tendono ad impedire tale stiramento, e quindi aumenta la forza del bicipite. Questo aumento di
forza però, si traduce in un aumento di deformazione dell’OTG, che in via riflessa tende ad inibire il
muscolo stesso, man mano che la forza aumenta. C’è una specie di battaglia tra le scariche dei
potenziali d’azione (Ia e Ib) del fuso neuro-muscolare e dell’OTG, come mostra la figura seguente:
Alla fine a prevalere è proprio l’OTG, che fa rilasciare il muscolo inibendone il motoneurone α, e così
l’articolazione si apre.
Lezione dell’11/12/2008
Riepilogo della lezione precedente.
L’organizzazione anatomica che fa capo al riflesso monosinaptico ci consente, sul piano clinico, e
quindi sul piano della possibilità di indagare su possibili alterazioni del sistema stesso, di fare delle
verifiche. Consideriamo lo schema in figura 12 (pagina 29) come esempio di riferimento: abbiamo
l’assone del motoneurone α che va ad innervare le fibre muscolari di un certo muscolo: esso,
attivandosi, provoca verosimilmente contrazione muscolare. Gli stessi muscoli, come abbiamo visto,
possiedono dei recettori, i fusi neuromuscolari, messi meccanicamente in parallelo e quindi sensibili
agli allungamenti del muscolo stesso: quando questo allungamento ha luogo, dalla terminazione
anulo – spirale parte un’informazione in termini di frequenza di scarica di potenziali d’azione che
entra nel midollo spinale, alla stessa altezza a cui si trovano i motoneuroni α del muscolo omologo, e
determina un rinforzo della attività di scarica del motoneurone α verso il muscolo. Questo, in breve,
è il riflesso monosinaptico. Naturalmente sul motoneurone α interagiscono altre informazioni
(abbiamo detto che sul corpo cellulare del motoneurone α ci sono migliaia di sinapsi): per esempio
delle informazioni che provengono dal cosiddetto tratto piramidale, ossia quella via nervosa che
senza interruzione anatomica, parte dalle cellule piramidali della corteccia motoria e arriva sino al
motoneurone α. Si tratta di un sistema anatomico per il controllo del movimento volontario: noi
decidiamo di muovere un certo gruppo di muscoli, questo avviene grazie all’attivazione di una
determinata area della corteccia motoria (o area 4) che poi vedremo meglio, e da qui l’informazione
va direttamente al motoneurone di quel gruppo muscolare. Possiamo quindi vedere che sul
motoneurone α possono intervenire due tipi di informazione: una diretta, volontaria, proveniente
dal tratto piramidale, che fa contrarre il muscolo, e un’altra, riflessa, che deriva dalla deformazione
meccanica del sistema muscolo-fuso neuromuscolare per via di eventuali stiramenti. Quando questo
30
avviene, a prescindere dal fatto che ci sia o meno attività volontaria (che non è continua, è
ovviamente periodica), si determina un ripristino, tramite meccanismo riflesso, di una posizione
predeterminata da altre afferenze che agiscono sempre sul motoneurone α, e che vedremo in
seguito, chiamate afferenze extrapiramidali.
Importanza clinica dei riflessi da stiramento
In questa immagine vediamo, schematicamente,
l’attivazione volontaria e riflessa del movimento:
nell’attivazione volontaria, parte
un’informazione dal tratto piramidale, arriva al
motoneurone α, e si ha la contrazione del
muscolo; nell’attivazione riflessa si applica un
carico al sistema muscolo-fuso neuromuscolare,
si ha un allungamento che determina scarica di
potenziali d’azione sulla fibra Ia, aumento
dell’attività del motoneurone α, e quindi si ha
una contrazione riflessa dello stesso muscolo.
Otteniamo quindi un risultato analogo seguendo
Figura 14 Movimento volontario e riflesso
due strategie differenti. Possiamo avere tre
situazioni differenti tali da rendere il sistema
ipofunzionale o addirittura di
interromperne il funzionamento.
Ammettiamo che ci sia una lesione del
tratto Ia, ad esempio un’interruzione,
un’infiammazione, un’intossicazione,
insomma, parliamo di una situazione di
ipofunzionalità. Per diagnosticare una
lesione di questo tipo, si sottopone il
paziente ad un test banale, chiedendogli
ad esempio di contrarre il bicipite. Se si ha
la contrazione volontaria, e poi
successivamente si evoca il riflesso con un
martelletto, senza successo, è evidente
che c’è una lesione del sistema che non è
nel tratto piramidale, non è nel
Figura 13 : Lesione della fibra Ia
motoneurone α (altrimenti non si avrebbe
nemmeno movimento volontario), ma è nel sistema riflesso. Ammettiamo invece che la lesione sia
nel tratto spinale: tutte le informazioni, in uscita e in entrata dall’encefalo, oltre la lesione sono
interrotte, e quindi viene interrotta anche l’informazione che dal tratto piramidale si propaga verso i
motoneuroni a valle della lesione. Ci si rende conto di un danno di questo genere dal fatto che il
comando volontario del movimento non funziona. Per capire se il danno è limitato alla sezione
spinale si evoca il riflesso, e ovviamente, se allo stimolo corrisponde l’attuazione riflessa del
movimento, possiamo dire che il danno sta a monte del motoneurone, che è ancora in grado di
trasmettere il movimento per via riflessa, e non ha quindi subito danni.
31
Figura 15: Lesione spinale
Possiamo avere infine la lesione dello stesso motoneurone α, ossia della via efferente dal midollo
spinale ai muscoli stessi: tutto questo chiaramente causa l’impossibilità dell’attivazione del
movimento sia volontario che riflesso. L’insieme dei test che si effettuano per determinare il tipo di
lesione da cui è colpito un soggetto con dei problemi di movimento è un esempio di diagnosi
differenziale.
Figura 16 : Lesione del MN-alfa
I riflessi polisinaptici
Parliamo ora di un’altra categoria di riflessi spinali, definiti come riflessi polisinaptici, che sono la
maggior parte dei meccanismi riflessi. Ricordiamo la definizione di sistema riflesso:
si ha uno schema di questo tipo, con
recettore, via afferente, centro
sinaptico, via efferente ed effettore. Nel
caso che abbiamo studiato, il recettore
del fuso neuromuscolare entra nel
midollo spinale attraverso la fibra Ia per
inviare l’informazione, c’è una sola
32
sinapsi col motoneurone α del muscolo omologo e, se il riflesso viene attivato, il muscolo omologo,
ossia l’effettore, si contrae. Quantitativamente, il numero dei riflessi che si avvale di questo
meccanismo estremamente, troppo semplice, è trascurabile rispetto alla totalità dei riflessi spinali,
che si avvalgono di più di una sinapsi, e quindi hanno una sorta di divergenza verso più possibili
effettori:
ci sono delle reti di neuroni
all’interno del midollo
spinale che possono essere
interessate da
un’informazione afferente
da un recettore, e che poi
possono divergere
spazialmente in direzioni
differenti, e quindi dare
l’attivazione di diversi
effettori.
Questo è il meccanismo della stragrande maggioranza dei riflessi, in particolare ci riferiamo ai riflessi
legati al movimento. La risposta tipica di un
riflesso polisinaptico è detto riflesso di fuga del
cane, definizione storica che risale all’Ottocento,
che prende il suo nome dall’esperimento che
venne effettuato su cani anestetizzati, messi in
una certa posizione sul piano e stimolati in
maniera nocicettiva: si notò che tale stimolo
innescava l’attivazione di movimento riflesso.
Consideriamo lo schema in figura 17: abbiamo un
circuito composto da 4 motoneuroni, A,B,C,D, e
su questi motoneuroni arrivano due vie nervose,
che portano informazioni, in modo da avere la
Figura 18 : Riflesso a fuga di cane
possibilità di innescare delle depolarizzazioni. La
prima via, in rosso, ha tre sinapsi sul motoneurone
A, due sul B, una sul C e nessuna sul D. La seconda
via, rappresentata in azzurro, si comporta in modo
simmetrico. Il risultato è che su ogni motoneurone ci
sono tre sinapsi, a prescindere dalla provenienza.
Diciamo che per raggiungere la soglia di eccitabilità,
cioè necessaria a scatenare il potenziale d’azione,
serve la contemporaneità di tre sinapsi su ogni
corpo cellulare. Se viene attivata solo la via 1, che ha Figura 17
tre sinapsi sul motoneurone A, accade che esso passa da un potenziale di riposo di -70 mV al
potenziale soglia di -55 mV, in modo che si scateni il potenziale d’azione e si inneschi il ciclo di
Hodgking. Nel motoneurone B invece, solo due delle tre sinapsi necessarie sono effettivamente
attive: il risultato sarà una depolarizzazione cosiddetta sub-soglia, e come tale rimane un evento
33
locale che nasce e muore, ma non produce potenziale d’azione. Un evento analogo si ripete sul
motoneurone C, dove la sinapsi della via 1 è una sola, mentre sul motoneurone D non accade nulla.
Ovviamente se ripeto l’esperimento
stimolando la sola terminazione 2 si ha un
risultato simmetrico dal motoneurone D,
scalando sino al motoneurone A. Se invece
si vanno a stimolare sia la via 1 che la via 2
contemporaneamente, su ognuno dei 4
motoneuroni si hanno 3 sinapsi attive,
situazione che porta ad un’uscita come
quella mostrata nella seconda
rappresentazione in figura 19. Questo
meccanismo si chiama facilitazione,
mentre l’organizzazione/condizione
elettrofisiologica appena descritta fa capo
al sistema detto frangia subliminare della famiglia di motoneuroni (dove per famiglie si intendono
gruppi di neuroni che nel loro insieme innervano un gruppo muscolare), localizzati vicino al midollo
spinale. Quindi diciamo che c’è la possibilità di ottenere una sorta di amplificazione, dosando il
numero di fibre che afferiscono ai gruppi io posso modificare la risposta del sistema, che in definitiva
è il movimento: ad esempio, se “spegniamo”
una fibra è possibile bloccare il sistema.
Figura 19
Tutto questo significa che il fenomeno che
abbiamo osservato è il risultato di una
sommazione di eventi di membrana in termini di
contemporaneità o successione: quando si parla
di contemporaneità ci riferiamo ad una
sommazione spaziale: in membrana abbiamo
infatti una sommazione di eventi di
depolarizzazione; quando invece si parla di
sommazione temporale significa che si ha una
frequenza di ripetizioni sullo stesso punto , per
cui si sommano gli effetti. Ammettiamo di avere
un motoneurone con afferenze dalla via 1 e dalla
via 2, e di andare a misurare l’attività di
depolarizzazione nell’assone: stimolo la
terminazione s1, vado a vedere e nel grafico
trovo che si ha una depolarizzazione, ma non
viene raggiunta la soglia per il potenziale
d’azione. Abbiamo quindi un fenomeno subsoglia, che non dà luogo a trasmissione di
informazioni. Non appena la stimolazione viene
interrotta, dopo un certo arco di tempo il
potenziale torna in una condizione di riposo.
Figura 20 : Sommazione spaziale e temporale
Tale potenziale è detto potenziale postsinaptico
eccitatorio (PPSE), ed ha una durata stereotipata di circa 15 ms a prescindere dall’ampiezza dello
stimolo. Analogo risultato si ottiene dalla stimolazione della sola terminazione s2 . Ma se i tempi di
34
stimolazione di s2 rispetto ad s1 iniziano ad avvicinarsi, si ha un effetto tale da creare una
depolarizzazione che è la risultante delle singole depolarizzazioni causate dalle singole terminazioni,
sino a quando non si ha una depolarizzazione tale da poter raggiungere la soglia per il potenziale
d’azione. Questa è la sommazione spaziale: con questo sistema è possibile modulare l’accensione o
lo spegnimento del motoneurone e quindi è possibile modificare gli effetti che la sua attivazione ha
sugli effettori muscolari, giocherellando con i tempi di stimolazione delle terminazioni presinaptiche.
Possiamo avere un fenomeno analogo anche con una sola sinapsi che, come abbiamo visto, dà luogo
ad un potenziale postsinaptico eccitatorio (PPSE), che abbiamo visto essere un fenomeno subsoglia.
Se però si stimola la sinapsi stringendo la frequenza, gli effetti di queste stimolazioni vanno a
sovrapporsi, in una sommazione chiamata sommazione temporale, che permette di raggiungere la
soglia per il potenziale d’azione. Dobbiamo quindi immaginare quanto sia complesso questo
meccanismo, poiché sul corpo cellulare del motoneurone vanno ad agire dalle 2000 alle 3000
terminazioni nervose. Abbiamo già accennato il fatto che gli effetti postsinaptici dell’eccitazione di
una terminazione presinaptica dipendono dal tipo di neuromediatore che la terminazione
presinaptica stessa sintetizza, in quanto esistono neuromediatori eccitanti e inibitori. I neuro
mediatori eccitatori fondamentalmente agiscono aumentando la conduttanza al sodio, e quindi,
sulla base dell’equazione di Ohm si ha:
INa=GNa (Em-ENa)
Aumentando quindi la conduttanza al sodio, è chiaro che aumenterà la corrente sodio, e più si
innescherà più facilmente il ciclo di Hodgking. I neuro mediatori inibitori invece agiscono
aumentando la conduttanza al potassio:
IK=GK (Em-EK)
Siccome il potenziale di membrana non è uguale al potenziale d’equilibrio del potassio, ma è ridotto
a causa dell’ingresso di sodio, se io aumento la conduttanza al potassio, a parità di differenza di
potenziale passa più potassio dall’interno all’esterno, e quindi aumenta l’elettronegatività del
sistema; questo significa che si passa da -90 mV a -95 mV, e naturalmente non si potrà mai andare
oltre -96 mV perché è il valore del potenziale d’equilibrio del potassio.
Analizziamo lo schema in figura 21.
Abbiamo il potenziale postsinaptico
eccitatorio mentre in basso, sull’asse delle
ascisse, col simbolo
è indicato lo
stimolo eccitatorio, che fa raggiungere la
soglia ed innesca il potenziale d’azione. Se
prima di questo evento eccitatorio si fa
partire uno stimolo inibitorio
Figura 21
(rappresentato come
) è chiaro che
non si riesce a raggiungere la soglia,
nonostante l’ampiezza dello stimolo
eccitatorio sia rimasta la stessa. Quindi il
fenomeno scema e non si innesca il
potenziale d’azione. In questo modo è
chiaro come il sistema sia in grado di
modulare le informazioni dosando stimoli
eccitatori ed inibitori, regolando cosi il
35
tipo di uscita. Normalmente, nel sistema nervoso, il neuromediatore adibito alla funzione inibitoria è
l’acido gamma-amminobutirrico (GA-BA), mentre il neuromediatore eccitatore per eccellenza, come
già detto, è l’acetilcolina. Dal grafico si vede bene che man mano che si stringe l’intervallo tra
stimolo inibitorio ed eccitatorio il potenziale postsinaptico scema. Quindi, ricapitolando, la frangia
subliminare è costituita da quei neuroni che, nell’ambito di una popolazione di motoneuroni spinali,
risulta essere in condizione di facilitazione, ovvero la membrana di questi neuroni si trova in uno
stato di depolarizzazione sub-soglia. Quando sulla membrana dei neuroni facilitati si attua una
sommazione di tipo spaziale o temporale , tale da portare sopra-soglia la loro depolarizzazione,
allora anche queste cellule si eccitano.
Altro meccanismo simile alla facilitazione è l’occlusione. Per descrivere questo fenomeno facciamo
riferimento ad un esempio pratico: si consideri il gruppo muscolare del tricipite della sura, composto
da tre muscoli sinergici, il ventre mediale (o gemello mediale), il ventre laterale (o gemello laterale) e
il ventre anteriore (o muscolo soleo). I due gemelli nel loro insieme sono detti gastrocnemio, e ci
riferiremo ad essi proprio coi nomi di gastrocnemio mediale e laterale. Tutti e tre i muscoli
convergono sul tendine achilleo, e tutti e tre hanno la funzione di sollevamento del calcagno,
meccanismo importantissimo dal punto di vista evoluzionistico. Potremmo dire quindi di avere tre
muscoli che fanno la stessa cosa: ci troviamo così di fronte ad una situazione di ridondanza.
Consideriamo il circuito in figura 22, che
rappresenta appunto i tre muscoli del tricipite della
sura, coi relativi motoneuroni α su cui arrivano i
nervi spinali (che fanno capo al nervo sciatico) che
trasmettono le informazioni. Osserviamo
attentamente lo schema di innervazione: il
gastrocnemio laterale è innervato due volte, il
soleo tre volte e il gastrocnemio mediale ancora
due volte. In realtà per arrivare a ciascun gruppo di
questi motoneuroni basta una sola sinapsi attiva.
Procedo con la stimolazione nervosa del
gastrocnemio laterale, e vedo che vado ad agire su
due dei tre muscoli che convergono nel tendine
achilleo, ottenendo un certo effetto; stimolo
successivamente il nervo del soleo e in realtà
stimolo tutti e tre i muscoli; infine, stimolando il
gastrocnemio mediale attivo sia il soleo che il
gastrocnemio stesso. Allora se andiamo a fare due
conti, scopriamo di avere informazioni per
l’attivazione
di ben sette gruppi muscolari, mentre
Figura 22
in realtà ne abbiamo solo tre. Ecco quindi che torna il concetto di ridondanza, e questa ridondanza di
informazioni è chiamata occlusione. Questo eccesso di informazioni non è da considerarsi un errore,
ma un meccanismo di garanzia, perché quando noi dobbiamo sollevare il calcagno contro gravità, c’è
bisogno di forza muscolare, e se si dovesse avere ad esempio una lesione del nervo del gastrocnemio
laterale, i muscoli devono poter essere comunque eccitati; analogamente, se ci fosse una lesione del
nervo del soleo, i muscoli verrebbero ugualmente eccitati, e così via. Ecco quindi spiegato il perché
l’occlusione sia un meccanismo di garanzia; tecnicamente non è altro che un eccesso di informazioni
in entrata rispetto a quelle in uscita.
36
La scarica postuma e i circuiti riverberanti.
Andiamo ora su circuiti un po’ più complessi: parliamo del
meccanismo della cosiddetta scarica postuma (figura 23). Da
un recettore, entra nel midollo spinale un’informazione (IN),
che diverge su tre vie: quella nella via 1 va direttamente al
motoneurone in uscita, quella nella via 2 ci arriva con un certo
ritardo, perché ci sono di mezzo due interruttori, mentre
l’informazione che passa per la via 3 sarà l’ultima a giungere al
motoneurone. Questo è un sistema di amplificazione, non
soltanto di informazione, ma anche di durata. Allora un evento
Figura 23
IN che dura qualche millisecondo, darà in uscita tre eventi della
durata complessiva di 1.5 ms: abbiamo quindi amplificato la risposta, nonostante lo stimolo sia già
cessato. La scarica postuma sostanzialmente consiste in questo, ed è molto importante nel caso in
cui ad esempio lo stimolo iniziale sia nocicettivo: se ad esempio siamo distratti ed andiamo ad urtare
una mano contro un oggetto appuntito, immediatamente parte il riflesso polisinaptico che, a
differenza del monosinaptico, raggiunge la coscienza. Allora questo stimolo nocicettivo si diramerà
in tre vie: attraverso la prima noi ci accorgiamo immediatamente del pericolo e ritraiamo la mano,
mentre l’informazione veicolata dalle altre due vie servirà a non far ricadere la mano sull’oggetto
appuntito, proprio perché lo stimolo viene amplificato in durata e si ha il tempo di pensare a quale
azione compiere, cioè a bloccare il braccio in una posizione di sicurezza.
Un altro tipo di circuito complesso è il cosiddetto
circuito riverberante (figura 24): abbiamo uno
stimolo di input che viene “riciclato” e che durerebbe
in eterno, se non ci fossero progressive perdite di
energia. Questo tipo di organizzazione in genere è a
capo ad esempio dei ritmi circadiani, come il ritmo
sonno-veglia, che è organizzato sulla base di questo
tipo di attivazione. Sui neuroni che fanno capo al
sistema riflesso riverberante si può interferire
dall’esterno con modalità di modulazione, con
afferenze che provengono ad esempio dall’encefalo,
Figura 24
in termini di facilitazione (tramite sinapsi eccitatoria
ed aumentando la frangia subliminare), ma anche in termini di inibizione.
Per concludere il discorso sui riflessi, torniamo al quadrupede rappresentato in figura 18 (pagina 33),
e lo supponiamo spinalizzato, ossia il quadrupede è sopravissuto ma il midollo spinale ha subito dei
danni e non è più in collegamento con l’encefalo. Se nella terminazione dell’arto inferiore sinistro si
applica uno stimolo nocicettivo, il quadrupede ha una tendenza ad allontanare il corpo dal punto di
stimolazione, ma il movimento non è pensato: significa che il midollo ha una sua organizzazione
anatomo funzionale che consente questo tipo di risposta, necessaria alla salvezza dell’organismo.
Noi con la nostra cultura, attraverso l’encefalizzazione del midollo spinale, possiamo rimodulare
questo principio, annullandolo, modificandolo o in ogni caso decidendo in maniera assolutamente
personale cosa fare. Quindi all’applicazione dello stimolo segue una flessione dell’arto stimolato
(questo riflesso è infatti detto flessorio), e se lo stimolo prosegue, il riflesso interesserà anche gli arti
37
superiori, con un comportamento reciproco, dove ad una flessione dell’arto inferiore segue
un’estensione dell’arto superiore
omolaterale, come a voler cercare
un nuovo punto d’appoggio.
Consideriamo lo schema di
organizzazione neuronale in figura
25: in basso vediamo il recettore
stimolato, che è un recettore
diverso dai recettori che abbiamo
fin ora studiato (recettori
muscolari), ma fa parte degli
esterocettori, cioè in contatto
meccanico con l’ambiente esterno
(recettori sottocutanei).
Solitamente questi recettori sono
delle terminazioni nervose
istologicamente specializzate, dove
alla terminazione mielinica si
aggiungono delle membrane
particolari che caratterizzano questi
recettori nella possibilità di poter
recepire informazioni su un certo
tipo di energia piuttosto che
Figura 25
un’altra. Lo stimolo agisce dunque sul recettore che è collegato ad una fibra nervosa che entra,
come al solito, nelle corna dorsali del midollo spinale: è una fibra più sottile di quelle connesse ai
muscoli o all’organo tendineo del Golgi (circa la metà, 10 µ di diametro e 60 m/s di velocità di
conduzione). L’informazione entra dunque nel midollo spinale, e troviamo subito una divergenza,
prima di arrivare ai motoneuroni interessati, che certamente dà luogo ad una scarica postuma.
Quindi , se vengono attivati degli effettori muscolari, essi mantengono la loro nuova posizione per un
tempo prolungato rispetto alla cessazione dello stimolo. Si possono poi avere dei fenomeni di
amplificazione, ma ad un certo punto, l’informazione si dirige verso gli output: si ha una divergenza
notevole che non interessa solo un gruppo muscolare come nel caso del fuso neuromuscolare, ma
tale divergenza interessa ad esempio i motoneuroni dei muscoli flessori ed estensori del muscolo
omologo, sempre della stessa parte, o anche i motoneuroni dei muscoli contro laterali; osserviamo
che però quando l’informazione raggiunge il motoneurone del muscolo omologo, sul flessore si ha
un rinforzo con n neuroni eccitatori, cioè tramite sinapsi colinergiche che aumentano la conduttanza
al sodio, innescano il ciclo di Hodgking che fa aumentare il potenziale d’azione nei motoneuroni α
dei flessori, provocando la tendenza ad allontanare l’arto. Questo effetto viene potenziato
dall’inibizione contemporanea dei muscoli estensori. L’informazione può divergere ulteriormente
verso i motoneuroni del muscolo antagonista (dell’arto opposto) dove l’innervazione è reciproca:
vengono eccitati gli estensori e inibiti i flessori. Questo è detto riflesso estensorio crociato. Se poi
l’informazione prosegue il suo cammino nel midollo spinale e arriva ai motoneuroni degli arti del
tratto superiore, sul muscolo omolaterale si avrà un potenziamento degli estensori e sul contro
laterale un potenziamento dei flessori, con il conseguente spostamento della massa. Su questo
sistema, rigidamente organizzato dal punto di vista anatomico, possono interferire, in termini di
modulazione eccitatoria o inibitoria, delle informazioni provenienti dai centri superiori tronco
38
encefalici e corticali, agendo in termini di facilitazione o inibizione su tutte le stazioni sinaitiche e
quindi producendo una possibilità di risposte molto ampia.
Principio del segno locale e della posizione finale.
Queste risposte sono interessanti perché danno ragione dell’organizzazione anatomica
estremamente rigorosa e precisa. Una di queste risposte è detta “Principio del segno locale”.
Figura 26
Faremo riferimento alla figura 26, scorrendo le sequenze da sinistra verso destra. Abbiamo una
posizione di partenza, dove si va a stimolare il braccio come mostrato nella prima immagine: allora
l’arto tenderà ad avvicinarsi al resto del corpo. Se poi si stimola lo stesso punto da un’altra posizione
si nota che l’arto compie lo stesso gesto riflesso: è evidente che la stimolazione di quella zona eccita
delle vie nervose che sono sempre le stesse dà luogo all’informazione sui motoneuroni responsabili
di quel movimento, a prescindere dal punto di partenza dello stimolo. Il “Principio della posizione
finale” è un tipo di risposta molto simile.
Analisi clinica dei riflessi spinali.
Sul piano clinico questo tipo di conoscenze può dar luogo alla possibilità di fare delle diagnosi non
invasive interessanti su possibili danni o lesioni del midollo spinale.
Tutto questo è possibile servendoci
delle conoscenze dei riflessi
monosinaptici, e quindi quelli tendinei,
dove battendo sul tendine si ha
l’estensione dell’articolazione, e dei
riflessi polisinaptici, strisciando
semplicemente delle zone del corpo, e
quindi eccitando gruppi di recettori
cutanei. Ad esempio, possiamo avere
informazioni sulle lesioni che
interessano il tratto cervicale del
midollo spinale, eccitando il riflesso
tendineo monosinaptico del gomito: se
evocando il riflesso, esso non si
manifesta o si manifesta in maniera
Figura 27
incompleta, è possibile che ci siano
39
delle lesioni del tratto 6-7 cervicale. Andando sul tratto toracico, facendo una stimolazione a livello
epigastrico (si individua la fine delle coste, e si effettua uno strisciamento con un martelletto
arrotondato), si deve assistere ad una contrazione della parte alta della muscolatura addominale; se
ciò non avviene ci possono essere delle lesioni del tratto 6-7-8 toracico; facendo la stessa
stimolazione a livello mesogastrico ed ipogastrico è possibile che ci siano delle lesioni,
rispettivamente, del tratto 9-10 e 12 toracico. E’ possibile avere informazioni riguardanti possibili
lesioni del tratto lombare evocando il riflesso patellare, che, se non si manifesta correttamente, è
indice di possibili lesioni del tratto 2-3-4 lombare. Infine, se l’evocazione del riflesso plantare
(strisciare la pianta del piede) non dà esito positivo, significa che si possono avere lesioni del tratto
1-2 sacrale, mentre se ad avere esito negativo è l’evocazione del riflesso achilleo, le zone che
possono essere lesionate sono il tratto 5 lombare e l’1-2 sacrale
Lesione spinale nell’uomo.
Quando si parla di lesioni spinali, un conto è parlare delle rane su cui si effettuano gli esperimenti,
che possono vivere senza testa per un certo periodo di tempo, e un conto è parlare dell’essere
umano, dove la lesione spinale comporta una condizione di completa disattivazione del midollo
spinale stesso, a causa del controllo che l’encefalo ha del midollo spinale, processo denominato
encefalizzazione. Infatti, più si va avanti nella scala evoluzionistica, più midollo spinale ed encefalo
diventano un tuttuno, tanto è vero che quando si verifica una sezione spinale nell’uomo, si assiste
alla nascita della grave condizione clinica esposta di seguito.
Settimane
0
1
2-3
5
Situazione
-Shock spinale
-Perdita di coscienza
-Flaccidità della muscolatura liscia e striata
-Areflessia Totale
-Recupero tono muscolatura liscia (sfinteri e
vasi)
-Recupero parziale dei riflessi flessori nocicettivi
-Comparsa di un debole riflesso rotuleo
Come possiamo osservare, durante la prima settimana successiva all’evento si ha il vero e proprio
shock spinale, con perdita di coscienza, flaccidità muscolare, con conseguente assenza di riflessi, sia
della muscolatura liscia che della striata: abbiamo quindi tutti gli sfinteri rilasciati, i vasi sanguigni
fortemente dilatati, con conseguente caduta della pressione arteriosa. Si ha inoltre areflessia totale.
Se il soggetto sopravvive, nella seconda settimana possiamo osservare un recupero del tono della
muscolatura liscia, con interessamento dunque di sfinteri e vasi: il paziente non è più incontinente
dal punto di vista di urine e feci, o almeno questa condizione si riduce, ma soprattutto, questo
recupero del tono della muscolatura liscia significa che il sistema vascolare non è più così vasodilatato da far ristagnare il sangue, e quindi, con la ripresa seppur minima della contrazione dei vasi,
si ha un miglioramento del pompaggio del sangue al cuore. Dalla seconda alla terza settimana si può
assistere ad un recupero della sensibilità dei riflessi flessori nocicettivi, che abbiamo visto in
precedenza. Infine, alla quinta settimana, è possibile avere la comparsa di un debole riflesso rotuleo.
In questo quadro di recupero, difficilmente si va oltre questi miglioramenti senza ricorrere a terapie
riabilitative piuttosto importanti, ma certamente non si recupera la situazione precedente la lesione.
Quello che rimane in genere, quando il paziente sopravvive e supera questa fase critica, è
un’ipotonia muscolare generale, accompagnata da iporeflessia, incapacità posturale e insensibilità.
Ammettiamo che la lesione sia lombare, per cui il soggetto è paraplegico, ossia impossibilitato al
40
controllo degli arti inferiori: il risultato sarà un’incapacità posturale, in particolare nel mantenere la
posizione eretta, chiaramente impossibile. Da quegli arti inoltre non giunge alcuna informazione
sensoriale (se la lesione è totale). Accenniamo ad un problema, poiché vi si sta lavorando in questo
periodo facendo della sperimentazione su paraplegici che fanno attività sportiva, di carattere
cardiovascolare, poiché manca, in questi soggetti, la possibilità di far tornare il sangue al cuore
attraverso il meccanismo della pompa muscolare dei muscoli inguinali, che muovendosi tendono a
schiacciare le nostre vene, facendo aumentare la pressione interna. La mancanza di questo
meccanismo riduce cronicamente il volume di riempimento del cuore, e di conseguenza la possibilità
di generare pressione da parte del cuore stesso viene ridotta. Questi pazienti vanno quindi incontro
ad insufficienza miocardica della portata cardiaca, che può portare anche all’impossibilità di
movimento. Abbiamo quindi visto, per grandi linee, il funzionamento e l’importanza dei riflessi del
midollo spinale, e la loro funzione. Passiamo quindi all’osservazione di uno schema a blocchi
dell’intero sistema di controllo del movimento.
Abbiamo una divisione per blocchi logici, sia per
funzioni che per gerarchia, dove l’importanza
gerarchica decresce dall’alto verso il basso.
Possiamo riconoscere, nell’attuazione dei
movimenti, dei momenti: il momento della
strategia, della programmazione e
dell’esecuzione o attuazione. La strategia è
quella condizione per cui si decide il movimento
da attuare: tale decisione ha luogo
nell’encefalo, più precisamente nella corteccia,
che è la parte più sofisticata e che ci caratterizza
rispetto alle altre specie, nonché la meno
importante per la sopravvivenza; non a caso i
centri di controllo della respirazione e del
battito cardiaco stanno al di sotto della
corteccia, mentre le lesioni in genere arrivano a
livello corticale, per cui si possono avere
emiplegie o comunque problemi motori, ma
non mortali. La corteccia cerebrale può essere
Figura 28
distinta in due categorie, sul piano funzionale: una categoria è costituita da zone di corteccia
cosiddette a proiezione specifica: significa che c’è una relazione anatomica (e quindi funzionale)
individuabile, tra quelle aree corticali e determinate parti del corpo, ossia con una proiezione di vie
nervose tra le due parti (ad esempio la corteccia motoria), e quindi si ha proiezione di informazioni.
Ma come si fa a sapere che c’è proiezione reciproca? La risposta a questa domanda ci viene fornita
attraverso due possibilità sperimentali: è possibile monitorare l’attività cerebrale durante dei
movimenti specifici che vengono fatti compiere al paziente, oppure è possibile stimolare
elettricamente le aree corticali sopra citate provocando il movimento di una certa articolazione, e
quindi si stabilisce la corrispondenza. Ma esiste anche la corteccia visiva, ad esempio: stimolando
zone specifiche della retina si osserva attività elettrica in particolari zone della corteccia occipitale:
tali aree saranno appunto la corteccia visiva. Abbiamo inoltre la corteccia uditiva, che è nella zona
temporale, che quando vengono percepiti dei suoni attiva delle cellule specifiche. Stimolando altre
zone del corpo, ad esempio esercitando una pressione sul polpastrello del dito indice, non si attiva
solo la corrispondente area di corteccia motoria, ma anche un’area della cosiddetta corteccia
41
sensitiva, che ci permette appunto di sentire questa pressione. Tutto il resto della corteccia non ha
un utilizzo specifico, serve a fare massa.
Abbiamo una sezione sul piano sagittale
dell’encefalo, dove è evidenziata la corteccia
motoria; decidiamo di muovere l’indice.
Supponiamo che in quell’area ci siano le cellule
piramidali che escono e vanno nel midollo
spinale per controllare il movimento di
quell’area: allora vedremo eccitarsi quest’area,
ma prima che ciò avvenga, si vedranno vaste
aree della corteccia ai lati dell’area interessata,
percorse da potenziale, e tutto questo avverrà
esattamente 800 ms prima dell’attivazione delle
cellule piramidali. Questo fenomeno è detto
promovimento, e sta a significare che la corteccia
motoria è pilotata da eventi precedenti che
Figura 29
fanno nascere l’informazione a livello della
corteccia associativa, che è quindi la sede della strategia del movimento. Le stesse informazioni
generate dalla corteccia associativa vanno verso due strutture subcorticali, ossia il cervelletto e i
gangli della base. Queste due strutture, che sono una sorta di interfaccia tra la strategia e
l’attuazione, e che ricevono quest’informazione, la trasmettono alla corteccia motoria tramite
un’altra struttura subcorticale, il talamo. La corteccia motoria verrà attivata localmente, a seconda
del tipo di movimento che si è pensato, e darà informazione esecutiva attraverso la via corticospinale diretta, o via piramidale. Questa, come abbiamo già detto prima, va a fare sinapsi
direttamente coi motoneuroni α e γ, ma ciò che ci interessa è proprio il collegamento coi
motoneuroni α e quindi coi muscoli che ci interessano: anatomicamente, questa connessione nasce
da cellule grosse del quarto strato della corteccia motoria, si dirama attraverso vie mieliniche di
diametro piuttosto spesso e quindi veloci che decussano a livello del ponte, cambiano quindi
direzione e diventano contro laterali (anche se una piccola parte di queste fibre rimane
omolaterale), per cui la corteccia motoria sinistra controlla la parte destra del corpo e viceversa.
Questo tipo di controllo è molto veloce, ed è quello che viene utilizzato quando decidiamo di
compiere un’azione, ad esempio afferrare un oggetto, controllando volontariamente il movimento
delle dita nello spazio, attraverso l’azione coordinata degli occhi. Come abbiamo già detto però, per
compiere questo movimento si deve cambiare la posizione di molte articolazioni, a cui non pensiamo
volontariamente, essendo l’ attenzione focalizzata sulla punta delle dita: a coordinare tutto il
movimento ci pensa l’informazione stessa, che si dirama dalla corteccia verso altre strutture. A
livello tronco-encefalico, quindi subcorticale, ci sono delle zone che acquisiscono l’informazione e la
mandano al midollo spinale, per controllare, in maniera involontaria gruppi muscolari che sono
sinergici per ottenere una buona qualità del movimento che abbiamo deciso di attuare: questo
sistema, che è un po’ più complesso e che rivedremo, si chiama sistema extrapiramidale.
Abbiamo quindi visto questo sistema di strategia, programmazione ed esecuzione; all’interno di
questo stesso sistema ci sono dei loop: attraverso il sistema recettoriale, il sistema riflesso, arrivano
informazioni, come ben sappiamo, ai motoneuroni α, nel noto meccanismo dei riflessi, ma queste
informazioni possono proseguire attraverso neuroni interspinali, possono risalire al tronco
dell’encefalo, al talamo e si pensa che possano raggiungere anche la corteccia associativa. Quindi ci
42
sono le uscite motorie ma anche gli ingressi sensoriali che continuamente contribuiscono ad
ottimizzare il movimento.
Se vogliamo capire quali sono le strutture encefaliche che hanno una qualche azione sul movimento,
e come queste relazioni si collocano nel sistema di controllo del movimento, la via più semplice è
“tagliare”, ossia escludere dal sistema varie sezioni encefaliche e vedere quali capacità rimangono.
Procedendo dal basso verso l’alto
della figura 30, abbiamo varie
possibilità di sezionamento: si
ottengono in questo modo vari
preparati, come quello spinale, o
il bulbare, mentre se si lascia il
ponte il preparato è detto
decerebrato. Quando parliamo di
preparato si intende un modello
animale, ma parliamo anche di un
vasto campionario di lesioni che
sono facilmente reperibili in un
qualunque reparto di
rianimazione o di traumatologia
Figura 30
della strada. Più schematicamente(figura 31), quando si attua una sezione spinale si esclude
praticamente tutto l’encefalo: non arrivano informazioni di rientro ne alte ne basse.
Se invece viene praticata una lesione
bulbare, rimane il midollo allungato,
al quale arriva informazione dal
sistema vestibolare, che è il sistema
deputato al mantenimento
dell’equilibrio (verrà trattato in
seguito). Se la lesione viene praticata
più in alto, mantenendo una parte
maggiore integra, sotto il
mesencefalo ad esempio, si ha un
individuo cosiddetto decerebrato:
allora abbiamo sia informazioni dalla
sostanza reticolare attivatrice, che è
una zona molto importante
dell’encefalo, rimangono ovviamente
le informazioni labirintiche, ma
Figura 31
arrivano anche le informazioni provenienti dal cervelletto, che possono andare verso il midollo
spinale e quindi verso i muscoli. Con una lesione mesencefalica praticamente non cambia niente,
mentre con una lesione corticale salta il controllo volontario di tutte le strutture, perché vengono a
mancare, ad esempio, le zone di corteccia motoria.
Quando parliamo di lesione parliamo anche di ictus, emorragie localizzate, che sono ormai delle
patologie estremamente comuni, che distruggono parti dell’encefalo. Vediamo ora nello specifico
una tabella di raffronto tra il tipo di lesione e il quadro motorio del paziente.
43
Tipo di sezione
SPINALE
BULBARE
PONTINA
MESENCEFALICA
CORTICALE
Quadro motorio
-Flaccidità muscolare
-Se stimolato capace di movimenti deambulatori
-Leggero tono muscolare
-Non si raddrizza
-Se messo in piedi e se stimolato, cammina
-Ipertono muscolare antigravitario
-Riflesso di raddrizzamento
-Tono muscolare quasi normale
-Se stimolato, capace di movimenti coordinati
-Movimenti spontanei
-Assenza di memoria dei movimenti
In caso di lesione spinale, si ha flaccidità muscolare e sotto stimolazione si ha la capacità di eseguire
movimenti deambulatori; naturalmente parliamo di un gatto, poiché nell’uomo il discorso è più
complesso ed è meno facile ottenere questi risultati. Se all’animale viene praticata una lesione
bulbare, troviamo un leggero tono muscolare, se viene capovolto non riesce a rimettersi in piedi, ma
se lo si mette in piedi, sostenendolo e stimolando una zampa, abbozza dei movimenti, tende
insomma a camminare. Questo significa che il midollo spinale si è liberato dall’interferenza
dell’encefalo, cioè è meno encefalizzato, e questo mostra che esistono dei controlli crociati che
consentono di dare informazioni a partire da un arto verso gli altri arti, seguendo degli schemi
anatomici che sono quelli necessari a determinare la locomozione. In caso di lesione pontina
troviamo una situazione di ipertono muscolare antigravitario, ossia una rigidità della muscolatura
antigravitaria: articolazione del ginocchio distesa, rigidità dei glutei, estensione del collo; l’individuo
è insomma una specie di statua.
Questo stato è determinato dal fatto che viene liberata la capacità della sostanza reticolare
attivatrice di interferire sul midollo spinale. Alla fine degli anni ’50 una ricerca condotta
dall’italiano Maurizio Maurizi mostrò che da questa fitta rete di neuroni (mostrata in figura
31 e ripresa in figura 32) partono delle informazioni che seguono delle vie tronco-spinali ben
definite chiamate vie reticolo-spinali, che seguono il midollo spinale, una parte a livello
Figura 32 dorsale e una parte a livello mediale: queste vie sono responsabili del controllo della
sensibilità dei muscoli antigravitari. In questo caso avviene una stimolazione eccessiva dei
motoneuroni γ (che ricordiamo, innervano le fibre intrafusali di questi muscoli), e viene cosi
amplificato fortemente il riflesso da stiramento dei muscoli antigravitari. Sappiamo cosi che la
funzione di queste vie è garantire la postura antigravitaria; ovviamente, se, come nel caso di questa
lesione non ci sono altre informazioni afferenti, la sostanza reticolare ha il predominio nel controllo
del movimento, con il conseguente ipertono muscolare. Il fatto che su un individuo integro ciò non si
verifichi è perché su questo gruppo di neuroni tronco-encefalici, agiscono delle vie superiori e quindi
vengono attivati solo quando necessario. Un altro aspetto della lesione pontina è il riflesso di
raddrizzamento, che è legato all’informazione che proviene dal sistema vestibolare: è noto
dall’anatomia che dietro l’orecchio esiste un sistema detto labirinto uditivo (che però non ha niente
a che fare con l’udito), formato da recettori sensibili alla posizione, alla velocità e all’accelerazione
della testa nello spazio: tutte queste informazioni, una volta raccolte, vengono trasmesse ai muscoli
antigravitari, che tendono a posizionare il corpo in una posizione eretta di equilibrio. Ebbene se il
sistema vestibolare non è sottoposto ad alcun controllo, l’individuo tenderà sempre a raddrizzarsi,
non riuscirà a coricarsi. L’apparato vestibolare fa parte del sistema extrapiramidale.
44
Parliamo ora della lesione mesencefalica: troviamo una situazione di tono muscolare quasi normale;
inoltre l’individuo, se stimolato, è in grado di compiere movimenti coordinati, ma non è capace di
compiere un movimento basato su un progetto motorio. Infine, in caso di lesione corticale, abbiamo
dei movimenti spontanei, come ad esempio una deambulazione normale, però, se ad esempio
durante il cammino l’individuo incontra un muro, torna indietro e va a sbatterci nuovamente,
proprio a causa della mancanza di memoria dei movimenti. Non riesce cioè a cogliere questa
informazione e ad utilizzarla in termini di strategia motoria. E’ quindi evidente la funzione di
carattere comportamentale della corteccia.
Riassumendo, attraverso degli esperimenti in cui venivano escluse alcune parti del sistema nervoso
si è potuto capire la funzione di queste parti, ma soprattutto, oltre a determinarne la singola utilità,
si è capito che è necessario un loro funzionamento contemporaneo ed integrato.
Il sistema vestibolare.
Il sistema vestibolare è situato in profondità nell’osso temporale, dietro l’orecchio interno. Le
informazioni che arrivano ai recettori del labirinto si riuniscono in un fascio nervoso che fa capo
all’ottavo nervo cranico, passano per il ganglo dello Scarpa, entrano nel tronco dell’encefalo e nei
nuclei vestibolari.
Figura 33 : Il sistema vestibolare
Da qui l’informazione diverge, per un
verso in direzione della sostanza
reticolare attivatrice, per un altro verso
va in direzione dei muscoli estrinseci
dell’occhio (esiste quindi una stretta
relazione tra i movimenti oculari e
l’attività vestibolare), e infine va pure
verso il midollo spinale, attraverso le vie
vestibolo-spinali. Esistono due tipi di
recettori vestibolari: i canali
semicircolari e il sistema utricolosacculo. I canali semicircolari sono dei
tubicini, delle sorta di spiraline, e ne
abbiamo tre per ogni orecchio,
posizionati nei piani ideali dello spazio
anatomico: piano orizzontale, frontale e
sagittale (figura 34).
Per poter avere informazioni da questo
sistema bisogna fare in modo che i canali
ruotino intorno al loro asse di rotazione.
Ogni volta che compiamo un movimento del
capo, qualunque esso sia, eccitiamo tutti o
parte di questi recettori in modo
differenziato a seconda della direzione del
movimento ciò che succede in un orecchio è
reciproco nell’altro. Vediamo ora nello
specifico com’è strutturato questo sistema. Figura 34
45
Ci stiamo allontanando dal tronco:
utricolo e sacculo sono più vicine al
tronco e poi la via prosegue con il
canale semicircolare. Nel canale si
individua una zona, chiamata ampolla,
dove si trova il recettore vero e
proprio del canale semicircolare:
nell’ampolla troviamo un “pavimento”
di cellule nervose, che hanno dei villi,
o ciglia, riuniti insieme da una
sostanza gelatinosa, un po’ come
immaginare un pennello da barba con
la schiuma. Sono quindi vincolati l’uno
all’altro dal punto di vista del
Figura 35
movimento. Quando qualcosa sposta
questa barbetta, le cellule del pavimento si deformano, come al solito aumenta la conduttanza al
sodio e partono i potenziali d’azione, che
entrano nel nervo vestibolare.
La stimolazione avviene tramite una
sostanza liquida contenuta nel canale
semicircolare, l’endolinfa, nella cui
produzione è coinvolto il fegato:
problematiche epatiche possono dar
luogo a fastidi vestibolari. L’endolinfa ha
una certa viscosità, quindi i movimenti
non sono immediati: succede che se si fa
ruotare il canale semicircolare intorno ad
un asse trasversale(figura 36), il canale si
sposta, mentre l’endolinfa rimane ferma,
per inerzia, e trascina l’ampolla che,
deformandosi, fa muovere i villi e cosi si
generano le scariche di potenziali
d’azione. L’aumento della frequenza di
scarica è proporzionale alla velocità
angolare della rotazione. Se si compie la
rotazione opposta, il fenomeno non ha
luogo: la stimolazione dei villi è quindi
unidirezionale, per ogni canale
Figura 36
semicircolare, quindi durante questa
seconda rotazione sarà il secondo orecchio a sentire la deformazione. E’ quindi chiaro che per avere
un’informazione sensoriale completa sono contemporaneamente necessarie le informazioni
provenienti da entrambe le orecchie, informazioni che ci danno dei dati sulla rotazione che stiamo
compiendo: infatti, la frequenza di scarica è un indice della velocità angolare della rotazione.
46
Questa scarica di potenziali naturalmente si mantiene fino a quando c’è variazione di velocità.
Quando la velocità diventa costante l’informazione cessa. Vediamo gli altri recettori.
A sinistra della figura 37 è situata
l’ampolla, mentre nella parte
centrale troviamo l’utricolo: anche
qui ci sono delle cellule nervose e
delle terminazioni nervose che
vanno verso i nuclei vestibolari e il
tronco dell’encefalo. Sotto
l’utricolo troviamo il sacculo,
all’interno del quale troviamo dei
villi, che in questo caso però sono
protetti da una “tettoia”, dove troviamo delle micro formazioni minerali, calcaree, chiamate otoliti.
Figura 37
Il sistema funziona in modo analogo al caso precedente, ma ha sensibilità solo per le accelerazioni
lineari, cioè quando ci muoviamo rettilineamente. In figura è mostrato come, muovendosi in
direzione M, la forza d’inerzia agisce sulla massa degli otoliti, che determinano la deformazione dei
villi, tanto più intensa quanto maggiore è l’accelerazione. Anche in questo sistema, il fenomeno
cessa quando la velocità diventa costante. In più, questi recettori danno un’informazione della
posizione della testa (e quindi del corpo), nello spazio.
Come mostrato in figura 38, se
inizialmente ci troviamo in posizione
eretta, e stiamo misurando l’attività di
scarica, notiamo un’attività di base e
costante; appena iniziamo a ruotare, ci
sottoponiamo ad una variazione
dell’accelerazione di gravità, in quanto
è cambiata la nostra inclinazione: col
variare dell’inclinazione si nota un
aumento della attività di scarica, che si
traduce in un aumento
dell’informazione che tende a farci
rimettere in posizione eretta. Questo
meccanismo fa parte del riflesso da
Figura 38
raddrizzamento di cui abbiamo parlato. L’intensità di scarica massima si ha quando ci troviamo con
la testa rivolta verso il basso: non a caso è una sensazione gradevole, che viene anche dal sistema
utricolo-sacculo e dagli otoliti. Si stanno iniziando a studiare gli effetti che la diminuzione o la
mancanza di gravità hanno su questo sistema.
Abbiamo già accennato al fatto che c’è una relazione con la muscolatura oculomotrice: questo è
fondamentale per avere una buona visione dello spazio che ci circonda quando ruotiamo. Il tempo
necessario per impressionare la retina da parte di un ambiente illuminato è di qualche centinaio di
millisecondi. Se la velocità di rotazione è molto alta infatti non riusciamo a distinguere niente, poiché
la retina non viene impressionata abbastanza rapidamente. Il sistema è organizzato in modo tale che
nonostante si ruoti la testa, l’occhio mantiene fissa l’immagine sull’oggetto fino a che non lo
47
acquisisce, poi passa al fotogramma successivo. Possiamo quindi dire che questo tipo di acquisizione
è digitale.
Figura 39
Nella prima delle tre immagini in
sequenza in figura 39 vediamo il capo
fermo e gli occhi fissi su un punto; non
appena inizia la rotazione del capo (senso
antiorario), gli occhi restano fissi sul punto,
ruotando in senso contrario rispetto alla
testa, fino a quando non viene
impressionato quel punto. Una volta fatto
questo si riportano in linea con l’asse
perpendicolare al naso, e inquadrano il
nuovo punto. In altre parole, noi riusciamo
a recepire un numero di punti non
continuo, che viene poi elaborato nella
corteccia visiva e ci ritorna come immagine
totale. Questo evento è detto nistagmo,
che viene evocato proprio per accertare di
non avere danni al sistema vestibolare, in
un test piuttosto fastidioso dove si fa
ruotare una persona in una sedia
particolare, e se si hanno
malfunzionamenti si possono manifestare
capogiri e nausea. Fenomeni quali mal
d’auto, mal di nave e simili sono dati tutti
da scompensi di questo meccanismo.
Vediamo infine una
panoramica di tutti i
recettori che adesso
conosciamo: ci mettiamo
in movimento, diciamo che
stiamo correndo. Se la
velocità è costante non
succede nulla; durante la
nostra corsa, nel nostro
percorso intravvediamo
una curva: a questo punto
ruotiamo la testa per
osservare. Questo
movimento è
un’eccitazione dei canali
Figura 40
semicircolari che, a
seconda del movimento che abbiamo fatto danno luogo ad informazioni differenziali ai muscoli
posturali, che ci fanno cambiare posizione: in particolare, nell’affrontare una curva, tendiamo ad
inclinarci lateralmente, in modo da dislocare il baricentro per non andare fuori traiettoria e
48
mantenere una velocità elevata. Questa è una funzione automatica dei canali semicircolari, grazie
anche all’informazione visiva. Questa integrazione di informazioni produce una correzione anticipata
della postura, come mostrato in figura. Le macule del sistema utricolo-sacculo vengono attivate da
brusche variazioni nell’orientamento spaziale, ma sono importanti anche nel decubito, e servono ad
una rapida correzione della postura. I fusi neuromuscolari, che si trovano nei recettori articolari dei
muscoli del collo, quando vengono deformati perché sono intervenute delle informazioni
provenienti dai canali semicircolari o dal sistema vestibolare, si attivano e contribuiscono al
raddrizzamento dell’individuo. Gli esterocettori, ossia quei recettori che abbiamo citato parlando del
riflesso flessorio, sono sensibili alle pressioni, e quindi in questo esempio, tramite la pianta del piede,
contribuiscono alla correzione dell’asse del corpo, oppure nel torace, rilevano la pressione dell’aria
mentre corriamo, e quindi fanno in modo di aumentare la nostra inclinazione in avanti, tutto questo
senza che noi ce ne possiamo accorgere, poiché parliamo di meccanismi riflessi.
Lezione del 12/12/2008
Riepilogo della lezione precedente.
Abbiamo concluso l’ultima lezione parlando dell’apparato vestibolare, uno di quei sistemi che
concorrono all’ottimizzazione dei movimenti o del mantenimento della postura. La logica generale
che è stata scelta nell’evoluzione è stata di avere una ripartizione nell’ambito del controllo dei
movimenti, nelle due grandi categorie di movimenti volontari e movimenti riflessi. Quest’ultima
parte è probabilmente più complessa; abbiamo visto che l’apparato vestibolare è molto importante
in questo, in quanto consente di stabilizzare la posizione del corpo in funzione della gravità,
contribuisce insomma al mantenimento della posizione eretta, oltre alle funzioni che ricopre nel
mantenimento dell’equilibrio dinamico quando si percorrono traiettorie che cambiano,
contribuendo a distribuire bene le masse e non andare fuori strada, soprattutto se si è in velocità.
Effetti omolaterali di lesioni cerebellari.
Un’altra importante struttura del sistema di controllo del movimento è il cervelletto. Il cervelletto
prende il suo nome proprio dal fatto che sembra una “miniatura” del cervello; se lo si guarda
esternamente, esso presenta una corteccia con delle rigature che formano dei solchi un po’ più
profondi rispetto a quelli del cervello. In effetti potremmo anche dire di avere due cervelli; il
cervelletto ha però una vocazione particolare: si interessa infatti solamente alla funzione motoria, è
quindi un organo specializzato al controllo del movimento. E’ possibile fare questa affermazione
prima di tutto tramite l’osservazione di soggetti che presentano lesioni in quest’area: ad esempio, la
emidecerebellazione, può insorgere per motivi traumatici o motivi chirurgici (a volte i tumori
cerebellari, pur essendo spesso benigni, richiedono una lobotomia, quindi la asportazione di metà
cervelletto). Questo significa che la metà del corpo omolaterale con la parte di cervelletto fuori uso è
senza controllo: si osserva, in questa metà del corpo, un’esecuzione lenta e scorretta del
movimento, che non è più automatico e preciso come siamo abituati a conoscerlo. Un’altra
caratteristica che si osserva è la decomposizione del movimento, che è ancora più caratteristica: i
movimenti che vengono compiuti da questa parte devono essere completamente pensati, manca
l’automatismo nel compierli. Un altro effetto delle lesioni emicerebellari è la perdita di equilibrio
statico e dinamico, ossia difficoltà a mantenere la posizione eretta sia da fermi che durante la
deambulazione. Infine, un segno interessante in quanto è differenziale rispetto ad un’altra patologia
(morbo di Parkinson) è il tremore intenzionale, ossia il tremore che si presenta durante l’esecuzione
dei movimenti (al contrario dei parkinsoniani che invece presentano tremore da fermi). Questi
elementi che si rilevano sulla base dell’osservazione clinica ci dicono che il cervelletto presiede
49
questa funzione primaria. Dal punto di vista dell’organizzazione anatomica, il cervelletto presenta
una struttura corticale e delle strutture sottocorticali che fondamentalmente sono dei nuclei di
cellule nervose, i cosiddetti nuclei cerebellari. Ci occupiamo, poiché è interessante dal punto di vista
circuitale, della corteccia cerebellare.
La corteccia cerebellare.
La corteccia cerebellare è una struttura
molto semplice: è un’organizzazione
stereotipata che si ripete per migliaia di
unità costituita da 4-5 cellule nervose. La
corteccia comunica coi nuclei cerebellari, i
quali poi comunicano con tutte le altre
strutture del sistema nervoso. La
comunicazione tra corteccia cerebellare e
nuclei avviene attraverso quella che è
l’unica uscita del sistema cerebellare
verso i nuclei, ossia la cellula del Purkinje.
Nella figura 41 osserviamo il corpo
cellulare della cellula del Purkinje, il cui
assone va a fare sinapsi col nucleo
cerebellare, e si tratta di una sinapsi di
tipo inibitorio: quando la cellula del
Purkinje viene eccitata dall’attività della
Figura 41
corteccia cerebellare, essa inibisce il
nucleo cerebellare col quale fa sinapsi, in qualche modo modula le uscite del cervelletto. Questo
fenomeno nasce dalle fibre parallele: se osservassimo la corteccia cerebellare dall’alto, vedremmo
una sorta di struttura a binari come quella mostrata in figura 42.
Periodicamente, da queste fibre parallele, viene fuori
una divergenza sinaptica che si attacca alla cellula del
Purkinje, in una sinapsi che, come accennato prima, è
eccitatoria. In realtà la fibra parallela non è altro che
l’assone (assone a T) di una cellula chiamata cellula
granulare, come mostrato in figura 41. La cellula
granulare è la porta d’ingresso di un certo tipo di
informazioni che afferiscono dalle altre parti del
sistema nervoso centrale alla corteccia cerebellare.
Riassumendo brevemente, abbiamo l’ingresso più
importante (c’è anche un’altra modalità di ingresso) che è la cellula granulare, e un’uscita che è la
cellula del Purkinje.
Figura 42
La cellula granulare, se viene
eccitata, produce un’informazione
che diverge nei due rami della T
lungo la fibra parallela, ed
ovviamente interessa tutte le uscite Figura 43 : Cellula granulare e diramazione a T
che ci sono lungo la fibra:
l’informazione diventerà una funzione della lunghezza della fibra stessa. Le uscite della fibra
50
parallela, per un verso interessano le cellule del Purkinje, per l’altro interessano altri due tipi di
cellule: le cellule a canestro e le cellule del Golgi. Le cellule del Golgi hanno una funzione di inibizione
in retroazione della stessa cellula granulare: accade che se un segnale arriva alla cellula granulare,
esso si diparte nella fibra parallela ed immediatamente, vista la conformazione del circuito, il
segnale stesso inibisce la cellula (vedi schema in figura 41). Il segnale continua quindi il suo percorso,
ma non si ripete, proprio grazie a questo rapidissimo meccanismo di reset, che immediatamente
dopo il passaggio dell’informazione nella cellula granulare, la rende disponibile per un’informazione
successiva (e diversa). Questo sistema di controllo è quello che ci consente di effettuare azioni
rapide nel tempo: il cervelletto infatti controlla in particolare i movimenti balistici che si ripetono
rapidamente, perché può reperire velocemente informazioni in successione, proprio in virtù di
questo meccanismo di reset appena esposto.
L’altra cellula, la cellula a
canestro, se viene eccitata
inibisce la cellula del Purkinje
della fibra parallela adiacente,
come mostrato in figura 44.
Vediamo che le due fibre
parallele hanno in opposizione
reciproca un’uscita per le
cellule del Purkinje e un’uscita
Figura 44
per le cellule a canestro: si
nota come le cellule a canestro, eccitate dalla loro fibra parallela, vadano ad inibire tramite sinapsi
inibitoria la cellula del Purkinje ad esse opposte. Questo meccanismo è noto come inibizione
laterale. Accade che se nell’istante t0 parte l’attività della prima fibra parallela e all’istante t1 l’attività
della seconda (con t0<t1) , nella prima fibra si attivano sia la cellula del Purkinje che la cellula a
canestro, che va ad inibire la cellula del Purkinje della fibra che sta di fronte. Questa pulizia del
segnale dà ragione della assoluta focalizzazione dell’attività del cervelletto sulla funzione motoria.
Sul piano neuronale abbiamo quindi identificato due funzioni: la veloce ripetitività e la focalizzazione
dell’informazione.
Figura 45
Le informazioni passano e arrivano alla corteccia
cerebellare seguendo due possibili vie: la prima è quella
delle fibre muscoidi, che danno luogo alla cascata di
azioni legate all’attivazione della cellula granulare. Il
potenziale d’azione di queste fibre, come mostrato, è
molto rapido. La seconda via è quella che si segue
attraverso il circuito delle fibre rampicanti le quali,
contrariamente a ciò che fanno le fibre muscoidi,
agiscono su una singola cellula del Purkinje e, come
mostrato, danno luogo ad un potenziale piuttosto
prolungato, attraverso un’informazione che proviene da
altre zone dell’encefalo. Questa serie di semplici
meccanismi si ripete continuamente nella corteccia
cerebellare. Andiamo ad analizzare ora una visione di
questo circuito un po’ più ampia.
51
Vediamo appunto, nella figura 46, uno
schema circuitale più ampio: abbiamo la
corteccia cerebellare,e la corteccia motoria
(area IV della corteccia cerebrale). C’è una
relazione ovvia tra queste due parti perché,
come abbiamo detto la volta scorsa, dalla
corteccia motoria parte l’informazione
volontaria per controllare i muscoli, ma la
corteccia non è in grado di sapere se il
movimento viene effettuato in maniera
corretta: invia dunque le informazioni sia
alla periferia che alla corteccia cerebellare.
Contemporaneamente, dalla periferia
(recettori, OTG, etc.), attraverso le fibre
Figura 46
spino cerebellari, vengono inviate delle
informazioni su ciò che sta succedendo esternamente alla corteccia cerebellare. In questa sede
avviene un confronto tra i dati forniti dalla corteccia motoria e dalla periferia e, se c’è, viene estratto
un segnale di errore (nel caso il confronto non dia esito positivo), e questo segnale viene inviato alla
corteccia motoria, che in questo modo aggiusta l’informazione in uscita verso la periferia. In termini
circuitali, in figura 46 si vede la corteccia motoria, che si connette con le periferie tramite le cellule
piramidali. Esse scendono, decussano a livello del ponte, andando sino al midollo spinale senza
interruzioni ma diramandosi: abbiamo un’uscita a livello dei nuclei del ponte (tronco dell’encefalo),
in cui troviamo dei neuroni che danno luogo alle fibre muscoidi, che vanno ad agire sulle cellule
granulari e quindi sulla corteccia cerebellare. Un’altra uscita si ha a livello del nucleo reticolare
laterale, da cui ancora si dipartono fibre muscoidi. Infine abbiamo un’uscita verso l’oliva inferiore,
che è un altro nucleo tronco encefalico da cui si dipartono fibre rampicanti che vanno ad agire sulle
cellule del Purkinje. Il circuito si attiva e da luogo ad informazioni che poi convergono sulle cellule del
Purkinje, le quali a loro volta proiettano sui nuclei cerebellari (che non sono uguali, interessano
diverse parti del sistema nervoso centrale in termini di trasferimento di questa informazione
elaborata dalla corteccia cerebellare). A noi interessa proprio questo loop: cellule del Purkinje,
nucleo cerebellare e rientro, attraverso i nuclei del talamo ventrolaterale. L’informazione va dunque
in periferia e torna indietro corretta, e l’operatività di questo circuito, in termini biologici, è
rapidissima. Ci si chiede su che base il cervelletto effettui delle correzioni delle informazioni inviate
dalla corteccia motoria: l’essere umano, oltre ad avere un progetto genetico che gli consente di
migliorare la forma e il funzionamento degli organi dall’atto della nascita, ha anche una potenzialità
di ottimizzazione di questi organi, per cui, per un certo periodo della vita chiamato età evolutiva,
dall’inizio dell’esistenza si accumulano esperienze motorie che in buona parte si traducono in sorta
di “schede” nella memoria del cervelletto. Quindi in realtà il cervelletto non fa altro che ricevere
l’informazione dalla corteccia motoria e dalla periferia, fa un confronto con queste “schede” e
controlla se l’input è corretto o meno, rimandando, nel caso sia necessario, l’informazione corretta
alla corteccia motoria.
Nell’immagine che segue (figura 47) vediamo gli accessi dalla periferia al cervelletto: dai fusi
neuromuscolari e dagli organi tendinei del Golgi si dipartono le fibre Ia e II. Osserviamo inoltre la
connessione tra cervelletto e corteccia motoria; a noi interessano anche delle strutture subcorticali
di tipo extrapiramidale legate alla postura, che interferiscono coi nuclei vestibolari, adibiti al
raddrizzamento e che danno il tono alla muscolatura antigravitaria. Questi due sistemi agiscono sul
motoneurone α in modo differente: l’informazione vestibolare, sia che venga mediata dal
52
cervelletto, sia che provenga direttamentte dal sistema vestibolare, agisce direttamente sul
motoneurone α; l’informazione che invece scende dalla sostanza reticolare attivatrice attraverso le
via reticolo-spinale (mediale e laterale), agisce sui motoneuroni γ dei fusi neuromuscolari,
modulandone l’eccitabilità e quindi andando ad agire sulla sensibilità dei fusi stessi .
Abbiamo quindi questa situazione: la corteccia motoria manda informazioni al cervelletto, il
cervelletto che riceve informazioni dalla periferia, e tramite i suoi schemi rimanda indietro
l’informazione corretta sia alla corteccia motoria, che al sistema vestibolare e a quello reticolare, in
modo da farci mantenere la postura più corretta per il movimento che stiamo compiendo. Il sistema
cerebellare controlla dunque sia il sistema piramidale che l’extrapiramidale.
Figura 47
I gangli della base.
Tornando un attimo alla figura 28, vediamo che l’altra struttura fondamentale nel controllo del
movimento sono i gangli della base. Essi ricevono l’informazione dalla struttura di decisione che è la
corteccia associativa e la convogliano,
attraverso il talamo, verso la corteccia
motoria.
Per quanto riguarda il discorso anatomico,
essi sono delle strutture subcorticali, dei
nuclei, che comprendono il corpo striato, il
globo pallido e la sostanza nera. All’interno
del corpo striato si riconoscono il nucleo
caudato e il putamen, che formano un
circuito un po’ intricato. Quello che
interessa è che dalla corteccia cerebrale ci
sono delle uscite che vanno verso il corpo
striato, e in questo modo avviene il
passaggio di informazioni, che da qui
vanno al globo pallido, l’uscita del globo
Figura 48
pallido va ai nuclei talamici, e da qui
l’informazione va sia al midollo spinale, sia alla corteccia (ritorna indietro chiudendo il circuito).
53
Quindi i gangli svolgono più o meno un’attività simile a quella del cervelletto: ricevono
un’informazione dalla corteccia motoria e, sulla basi di informazioni che possono giungere anche
dalla periferia, controllano lo svolgimento dei movimenti lenti e precisi: i gangli della base svolgono
una funzione complementare a quella del cervelletto.
Osservando l’andamento temporale
dell’intervento che queste due
strutture operano sul movimento,
possiamo dire che il tempo di
intervento del cervelletto è rapido,
e quindi assimilabile alla funzione
gradino, mentre per quanto
riguarda i gangli della base, poiché
ci troviamo di fronte al
coordinamento di movimenti lenti e
precisi, tale andamento sarà come
Figura 49
quello di una funzione rampa, come
mostrato in figura. Entrambi gli andamenti sono necessari, in quanto l’essere umano si serve
distintamente sia di movimenti rapidi (pensiamo alla battuta di un tennista) che precisi (pensiamo ad
un chirurgo). Come al solito, per stabilire che questa struttura ha queste funzioni, è stata condotta
un’analisi differenziale su pazienti affetti da lesioni o malfunzionamenti dei gangli della base.
Esistono delle patologie tipiche dei gangli della base, che si dividono in tre categorie:
1) Discinesie: sono generalmente dei deficit o delle difficoltà motorie, e ce ne sono diverse:
a) Tremore a riposo: contrario al tremore tipico delle disfunzioni cerebellari, che si
presenta durante il movimento, il tremore a riposo è, tra gli altri, uno dei sintomi del
morbo di Parkinson;
b) Atetosi: questa patologia causa dei movimenti involontari e lenti di torsione delle
estremità distali (braccia e gambe);
c) Corea di Huntington: si hanno delle scosse involontarie della muscolatura del volto;
d) Ballismo: può essere totale o parziale (emiballismo), ed è una patologia
caratterizzata da movimenti violenti, ampi e involontari della muscolatura
prossimale degli arti.
2) Ipertono muscolare: si tratta di una contrattura eccessiva dei muscoli, e anche questo è,
insieme al tremore a riposo, uno dei sintomi del morbo di Parkinson;
3) Bradicinesia: lentezza nel compiere i movimenti, anch’esso sintomo di Parkinson.
Quindi, come abbiamo potuto appena vedere, le strutture dei gangli della base sono molto
importanti, e possono danneggiarsi o a causa di traumi, anche se sono abbastanza protette essendo
nella zona corticale, o per alterazioni, problemi genetici o anche intossicazioni. Per esempio, sono
abbastanza note le basi della degenerazione parkinsoniana: si tratta di un’alterazione dei neuroni
dopaminergici, che hanno come mediatore chimico la dopamina. Tutti i neuroni hanno un mediatore
chimico che ne consente la funzione sinaptica: abbiamo visto gli eccitatori, con l’acetilcolina, ma ci
sono altri tipi di mediatori chimici chiamati catecolamine, come l’adrenalina e la noradrenalina, e in
questa categoria è compresa anche la dopamina, che si trova in certi neuroni situati nei gangli della
base; più precisamente, nella sostanza nera, di cui si è accennato brevemente, ci sono i corpi
cellulari di questi neuroni dopaminergici che proiettano i loro assoni nel corpo striato, le cellule del
corpo striato poi proiettano sul globo pallido, queste a loro volta sul talamo e poi indietro verso la
corteccia.
54
Essendo un circuito un po’ complesso è
importante osservare i segni indicati nelle
sinapsi: ad esempio, l’assone che si
proietta dal corpo strato alla sostanza
nera (disegnato in blu scuro) attiva una
sinapsi inibitrice con il neurone
dopaminergico (azzurro), reazione che va
ad inibire a sua volta il neurone disegnato
in rosso nel corpo striato, che invece è
colinergico e libera acetilcolina. In altre
parole, se si attiva il dopaminergico, viene
inibito l’inibitore. E’ stato appurato che la
lesione che provoca il Parkinson è proprio
nel neurone dopaminergico (azzurro), che
quindi non può inibire il neurone in rosso,
ed essendo quest’ultimo colinergico, si
avrà un effetto finale di forte inibizione
colinergica che è la causa di tutte le
Figura 50
lentezze tipiche dei parkinsoniani. Il parkinsonismo ormai viene curato molto bene, poiché sul piano
farmacologico e chimico sono stati fatti dei progressi notevoli. E’ possibile oggi sintetizzare delle
sostanze che hanno un effetto simile alla dopamina (generalmente sono dei precursori della
dopamina che si iniettano, ad esempio il Levodopa). L’effetto collaterale di questo genere di farmaco
è che non va ad agire solo nelle cellule della sostanza nera, ma anche in tutti gli altri recettori sparsi
per il corpo, ed essendo la dopamina un mediatore eccitante, è possibile osservare un’eccitazione
complessiva del paziente.
Abbiamo cosi concluso una
carrellata abbastanza rapida del
sistema di controllo del movimento.
Sappiamo che c’è anche un sistema
afferente, lo abbiamo visto quando
abbiamo parlato dei propriocettori
muscolari, che è il sistema che dalla
periferia, attraverso il midollo
spinale, porta le informazioni
all’encefalo. Quindi la funzione
cerebrale si può dire che sia una
funzione di comparazione tra i dati
in ingresso e le informazioni in
uscita. Diciamo che il sistema
nervoso motorio ha un reciproco in
termini di direzione di informazioni, Figura 51
che chiamiamo sistema sensoriale (o sensitivo). Stiamo quindi introducendo il concetto di
sensazione, che non è altro che l’acquisizione cosciente di qualcosa, che proviene o dall’esterno o
dalla mediazione di strutture dell’organismo.
Ci sono azioni del sistema nervoso che non danno luogo a sensazione cosciente: abbiamo visto ad
esempio i riflessi spinali, che devono agire comunque autonomamente. Infatti quando è coinvolta la
55
sensazione cosciente, sull’azione nervosa che si sta attuando vi è la mediazione di carattere
culturale, e questa mediazione non è detto che sia sempre e comunque adatta. Ci sono dei
meccanismi che devono andare avanti a prescindere dalla nostra volontarietà, come ad esempio il
battito cardiaco o il mantenersi in piedi.
La maggior parte però delle informazioni che arrivano al sistema nervoso, legate a variazioni
dell’ambiente esterno o anche interno all’organismo, raggiungono la coscienza e vengono quindi
acquisite: è possibile in questo modo elaborare delle risposte strategiche e non più stereotipate. Se
ci riferiamo all’ambiente esterno, possiamo individuare un sistema generale di recezione sensoriale:
questo prevede delle strutture specializzate in grado di trasferire in termini di frequenza di potenziali
d’azione variazioni di energia (in figura 51 abbiamo infatti ∆E). La fibra afferente primaria, dalla
periferia porta l’informazione al midollo spinale; successivamente abbiamo una serie di neuroni
intramidollari che chiameremo centro di integrazione dell’informazione. Proseguendo verso l’alto
troviamo le fibre ascendenti (fibre spino-cerebellari, spino-talamiche, spino-corticali).
Fondamentalmente la maggior parte delle informazioni che dall’esterno entrano nel midollo spinale
hanno una prima stazione, a livello subcorticale, nelle strutture che compongono il talamo, che sono
una serie di nuclei di cellule nervose, dislocate sotto la corteccia, che recepiscono informazioni da
varie zone e, invece di elaborarle, le smistano. Le informazioni che arrivano al talamo tramite le vie
ascendenti del midollo spinale, quindi, vengono proiettate attraverso proiezioni talamo corticali,
sulla corteccia sensitiva primaria, che è affacciata alla corteccia motoria (tra le due cortecce vi è un
solco). La corteccia sensitiva primaria è prganizzata allo stesso modo della corteccia motoria, in
modo tonotopico, cioè ci sono strutture della corteccia sensitiva i cui neuroni sono attivati da
particolari zone del corpo. E’ possibile quindi disegnare la figura di un corpo dal punto di vista della
sensibilità: la sensibilità della testa sarà da una parte, quella delle braccia da un’altra e così via. Tale
rappresentazione è chiamata homunculus sensorialis (riproduce il rapporto topografico fra
l'ampiezza delle aree corticali dedicate e gli organi o le funzioni – figura 52), che è il contrario
dell’homunculus motorio, che è quello che riguarda il movimento (link).
Figura 52 : Homunculus sensorialis
Si parla di homunculus perché in realtà è deforme;
infatti se andiamo a guardare le aree di pertinenza
delle varie parti del corpo, non corrispondono alle
dimensioni delle stesse parti del corpo: vediamo
ad esempio che il tronco è piccolissimo, la lingua è
enorme e anche il pollice è enorme. Questo
perché l’estensione relativa di zone di corteccia
sensoriale è legata alla densità di recettori della
parte del corpo che trasmette l’informazione.
Maggiore è il numero di recettore, maggiore è la
dimensione dell’area corticale, perché devono
arrivare le informazioni. Questo è un altro indice
di come sia graduata la sensibilità del nostro
corpo: la sensibilità del tronco è molto inferiore
rispetto a quella che si rileva sulla mano o nella
zona buccale, le labbra e la lingua sono infatti
zone molto sensibili.
I recettori sensoriali.
Giusto per conoscenza, vediamo alcune definizioni importanti di questo sistema. Noi abbiamo diversi
tipi di recettori sensoriali, ossia di strutture nervose adatte all’acquisizione di informazione derivante
dalla variazione di energia (che può essere recepita dal nostro organismo in varie forme, meccanica,
termica e chimica ad esempio).
56
I recettori più diffusi sono le cosiddette terminazioni sensoriali libere: il loro corpo cellulare si trova
adiacente al corno dorsale del midollo spinale. Parliamo di cellule a T, dove dal corpo cellulare
l’assone si prolunga in due diramazioni: una parte recepisce l’informazione dalla periferia, e l’altra
entra nel midollo spinale e distribuisce l’informazione con varie sinapsi ad altri neuroni. Questo
meccanismo riguarda un po’ tutte le cellule sensoriali, ma in particolare riguarda lo sfiocca mento di
fibre sottilissime amieliniche, che abbiamo dappertutto: nei muscoli, sotto la cute. Sono terminazioni
nervose che consentono di acquisire informazioni in modo abbastanza aspecifico, al contrario di
altre informazioni che siamo in grado di discriminare in maniera molto precisa, ma che non
provengono da questo tipo di neuroni. Parliamo di aspecificità perché, basta che un qualsiasi evento
depolarizzi la membrana di queste terminazioni nervose per generare la scarica di potenziali
d’azione: ad esempio, quest’effetto può essere dato da una compressione, o un’infiammazione
locale, che sono due fenomeni ben diversi. Non a caso queste fibre sono in maggioranza deputate
alla percezione del dolore, il quale di per sé non
è una forma di energia, ma una sensazione.
Esistono però altre terminazioni nervose che
invece sono specializzate: sono in grado di
percepire solo variazioni di determinati tipi di
energia. In linea di massima si tratta sempre
della solita terminazione nervosa amielinica,
che però è circondata da altro, delle capsule di
forma e sostanza particolare. Parliamo ad
esempio di recettori come quelli mostrati in
figura 53, che sono incapsulati, magari
terminano con delle sostanze chimiche per cui
gli effetti che abbiamo visto prima qui non
agiscono. Sono però costruiti per monitorare
una forza che agisce su di essi, e quindi una
pressione. La sensazione del tatto fisicamente è
pressione: agiamo ad esempio con una forza su Figura 53
un polpastrello. La pressione è una sensazione molto discriminabile, in quanto noi siamo in grado di
percepire due punti molto vicini o di dosare quantità. Questa precisione dell’informazione è
garantita dal tipo di costruzione del recettore, oltre che dalla sua collocazione. Parliamo di sensibilità
somatica, ossia presente in tutto il corpo. Esistono però informazioni che nascono da zone
localizzate in modo preciso, dai cosiddetti organi di senso. Se ad esempio ci riferiamo all’organo
dell’udito, vicino al vestibolo c’è l’organo del Corti, che è proprio l’organo dell’udito, oppure nel caso
della vista, abbiamo la retina, mentre per olfatto e gusto abbiamo rispettivamente l’epitelio nasale e
le papille gustative: sono appunto zone localizzate e organi molto precisi. Questa era una
panoramica degli “agenti” che ci consentono di acquisire le informazioni. Abbiamo dei recettori di
questo genere anche dentro il nostro corpo, che ci consentono di far arrivare in maniera meno
cosciente sensazioni quali il mal di pancia. A titolo esemplificativo, citiamo i meccanorecettori
dell’aorta, che leggono in maniera molto precisa la pressione arteriosa, che viene trasmessa ai
sistemi di controllo cardiovascolare che in questo modo la possono tenere sotto controllo istante per
istante. Un altro esempio sono dei recettori che sono sensibili alla pressione parziale di ossigeno
disciolto fisicamente nel sangue, e regolano la ventilazione polmonare sulla base della quantità di
ossigeno presente nel sangue.
Il sistema recettore, in ogni
caso, ha delle caratteristiche
comuni come la soglia (figura
54), che è la quantità di
energia necessaria a far
partire l’informazione.
Figura 54
57
Prima, al fine di semplificare l’introduzione del discorso dei recettori, abbiamo fatto un’affermazione
non esatta: non esistono infatti recettori per un solo tipo di energia, ma esistono recettori più adatti
a recepire un tipo di energia piuttosto che un’altra, perché per quel tipo di energia hanno una soglia
di eccitabilità molto bassa. Per esempio, se consideriamo un recettore come quello in figura 54,
chiamato corpuscolo del Paceni, esso ha una terminazione nervosa a cipolla, e tra uno strato e l’altro
della terminazione c’è un liquido abbastanza viscoso. Ebbene, se a questo corpuscolo si applica un
incremento di temperatura, si nota qualche scarica di potenziale, nonostante lo si stia scaldando
parecchio. Se invece si applica uno stimolo meccanico, e quindi una pressione, molto minore rispetto
allo stimolo termico precedente, si vede che nonostante ciò si ha una notevole scarica di potenziali
d’azione. Allora diremo senza dubbio che questo è un recettore che può recepire anche l’energia
termica, ma che è molto più adatto all’acquisizione della pressione. Quindi la soglia ci dice qual è lo
stimolo (inteso come forma di energia) più adatto a far funzionare un determinato recettore. E’
evidente che il corpuscolo del Paceni è un meccanorecettore adatto alla rilevazione della pressione,
e infatti li abbiamo sotto i polpastrelli.
Sovrapposizione dell’informazione e l’adattamento.
Per parlare di questo argomento,
partiamo da un quesito: come facciamo
ad accorgerci che una formica ci sta
camminando sul dorso della mano senza
guardare? Partiamo dalla considerazione
che la formica è una massa, quindi
abbiamo bisogno di sensori in grado di
recepire una forza, più precisamente
una pressione. Ma noi non sentiamo
solo la presenza della formica, bensì
Figura 55
anche la posizione, la velocità, e questo
e legato alla disposizione dei recettori sotto la cute. In figura 55 vediamo due sistemi recettoriali
diversi, uno rosso e uno blu, e stiamo analizzando un tratto di cute che in questo esempio è di 7 mm.
Notiamo che i recettori rossi sono più abbondanti nella parte superiore del lembo di cute, i blu sono
più concentrati a sud, mentre al centro abbiamo una zona di interferenza. Bisogna dire una cosa:
l’entità dell’informazione dipende dalla densità dei recettori che ho in superficie. Allora se inizio a far
camminare la formica dal punto 0, a maggior concentrazione rossa, e la faccio procedere sino al
settimo millimetro, vedrò nel grafico l’informazione che viene rilevata da questi due recettori che
sarà la stessa informazione continua e precisa recepita dal midollo spinale e dalla corteccia in
maniera tonotopica.
Quando ci infiliamo un cappotto, sentiamo
immediatamente il suo peso gravare sulle
nostre spalle. Immaginare di tenere questa
sensazione di peso durante tutto il tempo di
indossamento dei nostri indumenti è
chiaramente terribile. Invece sentiamo lo
stimolo iniziale, e poi la sensazione di peso
scompare. In termini di scarica di potenziali,
parliamo di recettori a rapido adattamento
(grafico verde in figura 56), ossia, tornando
Figura 56
58
all’esempio del cappotto, ci dicono quando lo mettiamo, quando lo togliamo, per quanto tempo lo
indossiamo e ci comunicano il peso. Per il resto, rimangono spenti. Altri recettori non hanno questa
caratteristica, ma si mantengono in funzione per tutta la durata dello stimolo (grafico blu).
Per dare una prima conclusione a questo discorso, parliamo della corrispondenza che vi è tra stimoli,
quindi energia applicata, e sensazioni, che sono rispettivamente parametri oggettivi e soggettivi.
STIMOLI
FORZA MECCANICA
LUCE
TEMPERATURA
SOSTANZE IN SOLUZIONE
ELEVATA INTENSITA’ DEGLI STIMOLI
SENSAZIONI
TATTO, PRESSIONE, SENSO DI POSIZIONE, UDITO
VISIONE
CALDO, FREDDO
GUSTO, OLFATTO
DOLORE
Come mostrato in tabella, per stimoli di forza meccanica, quindi applicazione di forza, le sensazioni
risultanti possono essere tatto, pressione, senso di posizione (di un’articolazione ad esempio), udito.
Le variazioni dello spettro luminoso ci permettono la visione, mentre la differenza di temperatura, di
energia termica, ci permette di provare le due sensazioni differenziate di caldo e freddo. Le sostanze
in soluzione (acquosa generalmente) danno luogo al gusto e all’olfatto. Generalmente, quando
questi stimoli hanno elevata intensità proviamo dolore. Consideriamo quindi la sensibilità somatica
divisa in sensibilità meccanocettiva (tattile, vibratoria e cinestesica, che ci consente di sapere dov’è
situata un’articolazione nello spazio senza il bisogno di guardarla), sensibilità termica (al caldo o al
freddo), e infine sensibilità dolorifica (di origine culturale, che ci fa distinguere dolore puntorio,
dolore urente e dolore profondo).
Lezione del 15/12/2008.
Riepilogo dell’ultima lezione.
L’ultima volta ci siamo fermati all’analisi della relazione che esiste tra i tipi di variazione di energia
che possono venire in relazione con l’organismo e ciò che percepiamo culturalmente sul piano della
sensazione. Abbiamo detto che nel caso della sensibilità meccanocettiva, possiamo avere tre tipi di
sensazioni derivanti dallo stesso input, ossia tattile, vibratoria e cinestesica. La sensibilità tattile è
quella che ci consente di individuare le caratteristiche di un corpo col quale le nostre strutture
recettoriali esterne vengono a contatto: è la sensibilità più sviluppata dal punto di vista della
capacità discriminatoria. La sensibilità vibratoria ci consente di recepire l’applicazione di forze con
una bassa frequenza: infatti riusciamo ad acquisire l’oscillazione causata da questa applicazione di
forze fatta con una certa frequenza; è chiaro che all’aumentare della frequenza la sensazione
risultante tenderà ad essere continua. Per questo tipo di sensibilità sono molto importanti i fusi
neuromuscolari e le fibre del gruppo II, che nascono dalla struttura fusale ed entrano nel midollo
spinale. La sensibilità cinestesica è legata invece all’esistenza di recettori di tipo meccanico dentro e
attorno alle articolazioni, come mostrato in figura 57:
abbiamo lo schema generico di un’articolazione, in cui
troviamo dei meccanocettori connessi al midollo spinale,
che mandano informazioni attraverso delle vie che,
possono mischiarsi ad altre informazioni sino alla
corteccia sensoriale. Esiste un codice per il
riconoscimento del recettore che invia l’informazione, in
Figura 57
59
modo tale che a livello corticale possa essere ricostruito lo spazio. Questo ci consente di acquisire
l’informazione dell’articolazione nello spazio senza bisogno di guardarla. Se l’energia di attivazione è
termica, il tipo di recettore adatto all’acquisizione di questa informazione sarà diverso, sia dal punto
di vista della costituzione che da quello della posizione, oltre alla differenza delle vie che portano le
informazioni in corteccia. Abbiamo due tipi di recettori, con diversa specializzazione: alcuni più
sensibili alle basse temperature (recettori del freddo), altri più sensibili alle alte temperature
(recettori del caldo). Abbiamo anche degli esterocettori (in genere sono quelli per il freddo) e degli
enterocettori, nell’encefalo e in altre parti del corpo, che invece sono più adatti a rilevare l’aumento
di temperatura. Stiamo parlando della sola sensibilità somatica, trascurando le sensazioni che
provengono dagli organi di senso: somatica significa infatti che parliamo di una sensibilità i cui
recettori sono distribuiti su tutto il corpo. Un altro tipo di sensibilità è quella dolorifica: tutti
conosciamo la sensazione del dolore (a parte alcune persone che hanno un’alterazione genetica che
non consente loro di provare dolore, il che le pone a rischio continuo, in quanto il dolore è
un’informazione di pericolo). Tradizionalmente si distinguono diverse tipologie di sensibilità
dolorifica: il dolore puntorio, ben definito dal nome stesso, è quella sensazione circoscritta di un
dolore che viene da un punto del corpo, a causa di una puntura ad esempio, ma generalmente a
causa di agenti esterocettivi. Questo tipo di dolore è fortemente discriminabile: possiamo infatti
distinguere diversi dolori puntori anche in aree molto piccole del nostro corpo. Il dolore urente e il
dolore profondo sono invece sensazioni più interne: il dolore urente è esteso in un’area ampia e non
è localizzabile in un solo punto, e un esempio ne è il mal di pancia; il dolore profondo è difficile da
definire, in effetti può parlarne solo chi l’ha provato, ad esempio malati di tumore. Il dolore
oncogeno è infatti un esempio di dolore profondo.
Questi tipi di informazioni somatiche sono in grado di integrarsi per fornire una risultante: un
esempio tipico è il cubetto di ghiaccio tenuto tra le dita. Noi, pur non guardandolo, riusciamo ad
affermare che stiamo tenendo in mano in cubetto di ghiaccio: ci sono tre modalità di informazione
sensoriale. Sicuramente interviene il tatto, e ci dà il peso; interviene altresì la sensibilità cinestesica
che, fornendoci la posizione delle articolazioni delle dita che circoscrivono l’oggetto, ci comunica la
forma stessa dell’oggetto. Infine, la sensibilità termica ci fornisce un’informazione di bassa
temperatura. Queste tre informazioni, sulla base dell’esperienza e della cultura personale, vengono
integrate in modo automatico e ci fanno capire qual è l’oggetto che stiamo tenendo in mano.
Modalità di trasmissione della sensibilità tattile.
L’acquisizione di informazione precisa come quella tattile è possibile grazie ad un sistema
recettoriale molto raffinato. Pensiamo ad un polpastrello su cui poggiamo la punta di una penna:
riusciamo a sentire con precisione il punto di applicazione della forza. Tutto questo è possibile
perché a livello di midollo spinale abbiamo un’organizzazione basata sul concetto di inibizione
laterale reciproca. Ammettiamo di avere una situazione come quella in figura 58: tre recettori
sottocutanei per l’acquisizione della sensazione tattile, ognuno dei quali ha un certo numero di vie
sensoriali che convergono su una via nervosa che entra nel midollo spinale e tende ad andare in
corteccia. Allora tutto ciò che interessa l’area stimolata viene acquisito dalla via nervosa e così via.
Lo stesso discorso vale per tutti e tre i recettori, che del tutto o in parte sono interessati nella
deformazione provocata dallo stimolo. A livello dell’ingresso del midollo spinale, da ognuna delle vie
nervose dei recettori, si ha una divergenza, per creare sinapsi su interneuroni inibitori, che saranno
attivati in maniera proporzionale all’informazione che percorre la via nervosa. Questo processo ha
luogo per tutti e tre i recettori, che attiveranno l’inibizione dei neuroni laterali, con la prevalenza per
la via nervosa del recettore che acquisisce più informazioni: notiamo infatti che in figura,
60
schematicamente, sulla via nervosa del recettore centrale, abbiamo rappresentato una frequenza
maggiore di potenziale d’azione.
Figura 58
Questo potenziale attiva l’azione inibitoria sugli interneuroni laterali, in questo modo l’informazione
prosegue nel circuito con un andamento quasi lineare sino alla corteccia, e il risultato è il grafico
mostrato in basso nella figura: avremo una sensazione più forte a livello del recettore centrale,
mentre dai recettori laterali arriverà un’informazione davvero minima. Analizziamo il percorso in
modo più specifico. Con questo tipo di circuito riusciamo a focalizzare il punto di maggior
stimolazione; diversamente si avrebbe la sensazione di uno sfocamento sensoriale. A livello
corticale, come è possibile notare dal grafico, abbiamo una percezione non solo della posizione dello
stimolo, ma anche della sua frequenza: abbiamo detto che i nuclei talamici sono dei centri di
smistamento delle informazioni dalla periferia verso la corteccia o viceversa, ma all’interno dei
nuclei talamici ci sono altri neuroni. Si ha, quindi, anche a livello talamico, una divergenza di
informazioni su più neuroni talamici e, come si vede in figura, la distribuzione dell’informazione
anche qui non è uniforme, ma seguirà la stessa distribuzione che abbiamo osservato nel passaggio
dai recettori al midollo spinale. Finalmente l’informazione giunge alla corteccia: a seconda della
quantità di stimoli che attraverso le vie nervose entra a livello corticale, una o più aree della
corteccia vengono eccitate, che in maniera tono topica rappresentano tutte le zone del nostro
corpo. Quindi, in breve, a seconda della quantità di recettori attivati dallo stimolo, e a seconda
61
dell’intensità dello stimolo stesso, si ha un aumento o una diminuzione del numero di neuroni
interessati allo stimolo a livello di corteccia sensoriale, che schematicamente è rappresentata dal
grafico dell’andamento della frequenza dei potenziali d’azione. C’è quindi un filtro iniziale che
ripulisce l’informazione, successivamente troviamo una possibilità di amplificazione
dell’informazione pulita sia a livello talamico che a livello corticale. Questo tipo di trasferimento di
informazione è tipico della sensibilità tattile: le altre sensibilità somatiche che abbiamo citato non
hanno un’organizzazione così discriminante, ma sono più grossolane dal punto di vista
dell’acquisizione dell’informazione. Questa stessa sensibilità tattile però, non ha lo stesso grado di
discriminazione in tutti i punti del corpo. Torniamo quindi a parlare della soglia.
Prendiamo in
considerazione il
grafico in figura, e
nello specifico la
soglia spaziale,
rappresentata in
rosso. Come si può
vedere stiamo
prendendo in
considerazione
diverse parti del
corpo. Si prende un
compasso e, partendo Figura 59
da un’apertura nulla e
allargandolo via via, lo si poggia su queste diverse zone del corpo, si no a quando la zona in
questione non rileva la presenza di due stimoli. Dopo di che si legge la distanza in mm tra i due bracci
del compasso, e quella sarà proprio la soglia spaziale di quella zona del corpo: in questo modo si
ricava il grafico, dal quale si nota che la zona maggiormente sensibile a rilevare due punti distinti è il
palmo della mano (in accordo con la teoria alla base dell’homunculus sensorialis), seguito dai
polpastrelli, poi dalle labbra e infine dal tronco. Un altro tipo di misura è la soglia assoluta, che
stabilisce la massa minima percepibile da una certa zona del corpo: si effettua quindi un test
ponendo dei pesetti piccolissimi su queste zone del corpo, e si individua qual è il peso minimo che
esse rilevano. L’andamento del grafico della soglia assoluta, come possiamo osservare, segue lo
stesso andamento di quello della soglia spaziale, che sono quindi entrambe legate alla densità di
recettori.
Tutte queste informazioni però non hanno solo una valenza
sensoriale e culturale, ma anche clinica: il neurologo,
chiaramente, quando effettua questi test su un paziente, si
aspetta una certa risposta, quindi questi sono a tutti gli effetti
dei test diagnostici.
Collegandoci a quanto appena esposto, e facendo riferimento
alla figura 60, possiamo ad esempio vedere come ci sia un
fondamento scientifico nell’agopuntura, che è un sistema
antalgico fisico (e non chimico). E’ possibile, infilando degli
aghetti in varie parti del corpo, combattere il dolore: tutto
questo ha delle basi neurofunzionali. Ammettiamo di avere di
Figura 60
62
fronte un tratto sottocutaneo, dove ci sono delle dei recettori che danno luogo a diverse fibre
nervose, che afferiscono al midollo spinale e inviano le informazioni sino all’encefalo. Quando
parliamo di tipi diversi di fibre nervose, parliamo di differenze di spessore: passiamo da fibre più
grosse, legate ai recettori del tatto, alle fibre più sottili, legate alla sensibilità dolorifica. Vediamo il
percorso dell’informazione dolorifica: essa può essere causata da un’alterazione del sistema, sia essa
cutanea o di altro tipo, che eccita in modo molto aspecifico i recettori dolorifici. L’informazione
arriva dunque al midollo spinale attraverso neuroni del secondo ordine, e arrivano alla corteccia
cerebrale. Nel midollo spinale esiste una struttura chiamata sostanza gelatinosa del Rolando, i cui
neuroni emettono degli assoni che agiscono in termini di inibizione sulle afferenze dei neuroni del
secondo ordine che vanno alla corteccia. I neuroni del secondo ordine possono essere interessati sia
da fibre grosse afferenti dalla periferia, che portano informazioni di tipo tattile, sia da fibre sottili che
portano informazione dolorifica. Quando l’informazione che arriva è di tipo dolorifico, essa precorre
la fibra di colore rosso, che diramandosi, attraverso la sinapsi inibitoria va a bloccare la sostanza
gelatinosa, che in questo modo è impossibilitata ad inibire l’informazione dolorifica, che arriva
dunque sino alla corteccia. Invece se l’informazione che arriva è di tipo tattile, essa va a stimolare la
sostanza gelatinosa che quindi andrà ad inibire le strutture presinaptiche delle fibre dolorifiche.
Quindi, quando si va ad infilare l’ago, ad esempio in uno spazio intermedio tra la fibra grossa e quella
sottile, si generano entrambi i tipi di informazione: bisogna quindi ricordare che la velocità di
conduzione delle fibre nervose è funzione del quadrato del diametro. L’informazione fornita dalla
fibra grossa arriva quindi per prima alla sostanza gelatinosa del Rolando, che si attiva ed inibisce le
strutture presinaptiche delle fibre dolorifiche, bloccando il dolore. Dalla stessa corteccia possono
partire informazioni in grado di attivare la sostanza gelatinosa del Rolando.
Vediamo ora le vie
nervose che
trasportano le
informazioni dalla
periferia alla
corteccia. A sinistra
vediamo un circuito
delle vie nervose
che trasportano le
informazioni
altamente
discriminate:
notiamo il tratto
cosiddetto
neospinotalamico,
Figura 61
che è una delle novità dell’evoluzione, ed è quindi più giovane e specializzato. L’informazione entra
attraverso le corna dorsali del midollo spinale, lo percorre ed arriva ai due nuclei gracile e cuneato,
che sono delle strutture di ricezione dell’informazione da queste vie. Da questi due nuclei partono
due vie che insieme formano il lemnisco mediale che, senza interruzione, prosegue fino al talamo
ventrobasale, e da qui l’informazione va in una zona ben precisa della corteccia sensoriale. Si tenga
presente che le due informazioni che percorrono le corna dorsali e il tratto neospinotalamico
restano separate in tutto il loro percorso, entrano nei due nuclei sopracitati e finiscono, tramite il
63
talamo, in due zone ben distinte della corteccia. Questa è la base anatomica che consente di
recepire diversi punti in cui il corpo viene stimolato.
Altre informazioni, ad esempio di tipo termico e dolorifico, quindi non discriminate, percorrono il
circuito rappresentato a destra della figura 61: attraversano il tratto paleospinotalamico, che, al
contrario del neospinotalamico, ha diversi incroci. Notiamo diverse sinapsi a livello di midollo,
omolateralmente può andare a finire sul talamo ed entrare in corteccia; può anche andare verso la
sostanza reticolare attivatrice ed altre zone, formando un circuito parecchio intricato, perché
l’informazione dolorifica deve interessare tantissime aree. Possiamo quindi dire che il secondo tipo
di sensibilità è molto più importante dal punto di vista della salvaguardia dell’individuo. Le
informazioni più discriminate (tattile, vibratoria e cinestesica), per percorrere le nostre vie nervose,
si servono del cosiddetto sistema dei cordoni posteriori, che è appunto il risultato dell’evoluzione,
mentre le informazioni meno discriminate (dolorifica, termica), si servono del cosiddetto sistema
spinotalamico, che è invece un sistema più antico. Infatti, attraverso tale sistema, noi siamo in grado
di sentire la sensazione di prurito, che altro non è se non una sensazione ancestrale.
L’ipotalamo.
Abbiamo così terminato una panoramica di ciò che accade nel midollo spinale. Vediamo invece cosa
accade nell’encefalo. Abbiamo tutti quanti sentito parlare dell’ipotalamo, struttura che sta sotto il
talamo, ed è un insieme di cellule nervose che danno luogo a nuclei che sono fondamentali per il
mantenimento dell’individuo, grazie alla generazione di schemi comportamentali. L’ipotalamo non
ha però capacità di scelta, ed ha quindi bisogno di un’altra struttura che dia gli input per l’attivazione
dei vari nuclei. Non a caso l’ipotalamo è al centro di tutta una serie di informazioni che entrano ed
escono: ad esempio è in relazione col sistema nervoso volontario di cui abbiamo già parlato, col
sistema nervoso autonomo; è anche in connessione diretta col sistema endocrino, in quanto è
sensibile ad ormoni o gestisce la produzione di ormoni. Le uscite dell’ipotalamo vanno verso tutta
una serie di sistemi neuroendocrini atti alla creazione della condizione di omeostasi dell’organismo.
L’omeostasi è il mantenimento costante di una certa funzione: ad esempio, la concentrazione di
glucosio del sangue, o glicemia, deve rimanere costante, poiché un suo aumento può determinare
gravi forme di disidratazione, caduta della pressione e coma iperglicemico (questa patologia è detta
diabete mellito), mentre riduzioni della glicemia portano a coma ipoglicemico, in quanto il glucosio è
l’unico combustibile del sistema nervoso, e quindi riducendo la glicemia togliamo energia al sistema
nervoso centrale che si spegne. Il glucosio è altresì un ottimo combustibile per le strutture muscolari,
e non a caso l’organismo ha messo a punto un sistema di conservazione del glucosio, non appena
raggiunge la sua concentrazione ottimale nel sangue (100 mg/100 ml): immediatamente viene
attivata l’increzione dell’insulina che toglie il glucosio dal sangue e lo manda in cellule di deposito,
verso le strutture muscolari, dove esso si ricostituisce in un polimero chiamato glicogeno muscolare,
ma anche verso le cellule epatiche, dove questo glicogeno è molto abbondante. Il glucosio viene
mandato anche verso le cellule adipose dove viene trasformato in trigliceride e quindi in grasso di
deposito. A questa omeostasi bada l’ipotalamo, in quanto in esso sono contenuti il nucleo
ventromediale e il nucleo laterale che sono sensibili alla glicemia. La sensazione di fame, così come
quella di sazietà, è regolata proprio da questi due sistemi, che leggono la glicemia. Un’altra
condizione che riguarda l’omeostasi è ad esempio l’omeostasi termica, in quanto il nostro organismo
è un sistema che funziona alla temperatura costante di 37° C: variazioni di questa temperatura
interna possono essere molto dannose, in quanto le funzioni enzimatiche del nostro organismo
hanno bisogno di quella specifica temperatura per funzionare al meglio. L’ipotalamo possiede quindi
dei termocettori che regolano la quantità di calore prodotto e consentono di risparmiare il calore
stesso, attraverso due meccanismi: per aumentare la quantità di calore agisce su un’altra ghiandola,
64
la tiroide, regolando l’increzione di tiroxina, ormone che svolge la funzione di immagazzinamento
delle sostanze tramite fosforilazione, e la funzione di ossidazione delle sostanze, ossia le “brucia” per
produrre calore. Si ha inoltre una vasocostrizione periferica, per allontanare il sangue dalla cute e
aumentare la barriera di protezione termica e limitare la perdita di calore. L’ipofisi mette in moto
anche altri meccanismi culturali quali lo spostarsi all’ombra in caso di temperature eccessive, o il
mettere un cappotto in caso di freddo, e così via. L’osmolarità dei liquidi interni all’organismo è un
altro meccanismo legato al mantenimento dell’entropia: 300 mosm/l (milliosmoli per litro) è
l’osmolarità del sangue e di tutti gli altri liquidi extra cellulari. Le alterazioni dell’osmolarità indicano
variazioni del volume di liquidi: in primis la volemia, ossia la quantità di sangue in circolo
(mediamente di 5 l). Un aumento dell’osmolarità trattiene acqua, che fa aumentare la volemia, che
ha implicazioni emodinamiche quali l’aumento di pressione, ed infatti uno degli strumenti più usati
per ridurre la pressione negli ipertesi sono i diuretici, in modo da far espellere acqua e ridurre la
volemia. Questo è lo stesso motivo per cui agli ipertesi è sconsigliato assumere in grandi dosi cloruro
di sodio, in quanto fa aumentare l’osmolarità, la ritenzione di liquidi e di conseguenza volemia e
pressione. Tutte queste regolazioni, a livello ipotalamico, vengono effettuate dagli osmocettori, che
leggono questa informazione e regolano di conseguenza la diuresi e la sensazione della sete.
Anatomicamente, l’ipotalamo ha relazioni col talamo, e quindi con le strutture di smistamento delle
informazioni tra periferia e corteccia, ha relazioni col sistema limbico, di cui non abbiamo ancora
parlato ma che è un sistema subcorticale abbastanza complesso legato alla affettività del soggetto
(da non confondere con l’accezione romantica del termine; per affettività si intende la capacità di
rispondere immediatamente con azioni e comportamenti per la salvaguardia dell’individuo, ad
esempio la risposta ad uno schiaffo). Il sistema limbico manda le informazioni all’ipotalamo che
regola in questo modo i comportamenti che teniamo, che sono oltretutto mediati culturalmente
dalla corteccia che sovrasta il sistema limbico stesso. I nuclei ipotalamici hanno delle uscite
anatomiche verso la neuroipofisi, e quindi regolano la produzione di un certo tipo di ormoni (ad
esempio l’ormone antidiuretico, che viene prodotto proprio in questa ghiandola e trasferito nel
sangue quando necessario, oppure l’ossitocina, ormone importantissimo nelle donne durante il
parto, in quanto necessario alla dilatazione dell’endometrio uterino e alla contrazione della
muscolatura liscia dell’utero). Un’altra struttura controllata dall’ipotalamo è l’adenoipofisi, che altro
non è se non un’altra parte dell’ipofisi, attraverso un circuito ematico molto fine che scende
dall’ipotalamo e produce tutti i releasing factors (ormone della crescita, della corteccia surrenale
etc.). Riceve inoltre informazioni nervose dal tronco dell’encefalo e dal midollo spinale, informazioni
che possono essere di tipo olfattivo, gustativo, somestesico o anche di tipo tattile; l’ipotalamo riceve
quindi tutte queste informazioni e gestisce le risposte dell’organismo, che possono essere di tipo
involontario, attraverso il sistema riflesso,
oppure di tipo più complesso e
comportamentale.
Vediamo meglio il funzionamento dei
termocettori talamici. Esistono due modalità di
acquisizione dell’informazione: una nasce in
periferia ed è legata ad un certo tipo di
recettore sensibile alle basse temperature.
Questa informazione entra, come tutte le altre
informazioni sensoriali, al midollo spinale, ed
Figura 62
arriva al centro di controllo ipotalamico della
temperatura, dove però arrivano informazioni anche da endorecettori ipotalamici che leggono la
65
temperatura del sangue. Abbiamo quindi un’informazione della temperatura esterna, una della
temperatura interna, e nel centro di controllo della temperatura si effettua una differenza tra queste
informazioni. Il differenziale viene trasformato in informazione di regolazione per la produzione o la
dispersione del calore. Vediamo ora un diagramma a blocchi sul funzionamento di questo sistema.
Figura 63
In alto, da sinistra verso destra, vediamo che c’è la temperatura del corpo, la risposta ipotalamica al
caldo, e quest’informazione va al centro termoregolatore ipotalamico che definisce e attiva
meccanismi per l’aumento della dispersione di calore e la riduzione di produzione di calore
attraverso il metabolismo. In caso di temperature basse, si ha la risposta ipotalamica al freddo, una
diminuzione della dispersione del calore (attraverso la vasocostrizione) e un aumento della
produzione del calore metabolico, attraverso l’aumento dell’increzione degli ormoni tiroidei
attraverso il metabolismo. Non è un caso che i soggetti affetti da patologia ipertiroidea siano più
magri del normale e soffrano il caldo. Sempre in figura 63, vediamo, rappresentato in blu, uno
schema di paragone “meccanico” con le strutture del nostro organismo.
Vediamo ora, il controllo generale che l’ipofisi
ha sul sistema endocrino, che è un sistema
molto importante. Dall’ipotalamo,
anatomicamente nasce l’ipofisi, la quale,
come abbiamo già accennato, si divide in
adenoipofisi anteriore e neuroipofisi
posteriore. Dall’adenoipofisi nascono degli
ormoni che ad esempio controllano la tiroide
(TSH), oppure controllano lo sviluppo
dell’organismo in età evolutiva (ormone della
Figura 64
crescita), ma soprattutto, in seguito ad un
pasto iperproteico, l’ipofisi rilascia nel sangue una sostanza per preservare quelle proteine in
eccesso e non utilizzarle come combustibile. Stimola inoltre la disponibilità di grassi e zuccheri
mentre si è a digiuno: svolge quindi una funzione di mantenimento delle masse muscolari. Nelle
donne, durante il periodo dell’allattamento, rilascia la prolattina, che è un ormone che stimola la
produzione di latte dagli acini ghiandolari della mammella. La prolattina è presente anche negli
uomini, ma non si sa ancora a cosa serva; tuttavia, c’è una relazione interessante tra la prolatinemia
e il turnover del neuromediatore dopamina, in neuroni dopaminergici che non sono situati nei gangli
della base, ma nella cosiddetta zona mesolimbica (che è coinvolta nel discorso dell’affettività), dove
66
è fondamentale per il controllo dei comportamenti che nascono da gratificazione consapevole, che è
il meccanismo che ci fa ripetere un’azione che ci dà piacere. Da una parte esso è un meccanismo per
la salvaguardia della specie, in quanto alla base del comportamento sessuale, della ricerca del cibo,
l’aggressività, ma è anche alla base delle dipendenze da sostanze stupefacenti. E’stato dimostrato
che anche l’esercizio fisico, se fatto con costanza, poiché tiene l’organismo in forma, crea
dipendenza. Oltre a tutto questo, nell’adenoipofisi vengono prodotti anche ormoni per il controllo
delle gonadi, e infine, importantissimo, l’ormone adrenocorticotropo (ACTH) che, increto nel sangue,
implica la produzione da parte della corteccia del surrene di cortisolo (glucocorticoide in grado di
aumentare la glicemia e responsabile dello stress: quando si ha bisogno di energia supplementare, il
cortisolo scinde il glucosio a livello epatico immettendolo nel sangue, e blocca la produzione di
glicogeno da parte dell’insulina, tenendo alta la glicemia).
Esiste un meccanismo a feedback (generalmente
negativo) della concentrazione sanguigna di questi
ormoni appena citati in rapporto alla loro produzione:
l’ormone viene prodotto, il sistema nervoso centrale,
attraverso l’ipotalamo, coordina la sintesi e l’increzione
di uno di questi ormoni; si attiva l’adenoipofisi che
rilascia l’ormone nel sangue, che successivamente
raggiunge le cellule bersaglio, e il surplus di ormone
costituisce il feedback negativo per l’ipotalamo, il che
rende questo controllo completamente automatico.
Figura 65
Passiamo ora all’analisi dei processi di controllo
dell’osmolarità a livello ipotalamico. Nel nostro
organismo abbiamo un input e un output idrico:
l’input è chiaramente l’ingestione di acqua, mentre
l’output è sostanzialmente costituito dall’urina, ma
abbiamo anche la sudorazione, la perspiratio
insensibilis di acqua e la respirazione (ogni volta che
espiriamo emettiamo vapor acqueo). L’incremento
del volume idrico non dipende solo dall’ingestione
di acqua: ricordiamo che ogni volta che bruciamo 1
mole di glucosio produciamo 6 moli d’acqua.
L’acqua ha quindi anche un’origine metabolica, ed
essa è molto importante non solo per il
mantenimento del volume del sangue, ma anche la
concentrazione di acqua stessa a livello
Figura 66
intracellulare. Nell’ipotalamo abbiamo delle cellule
dedicate chiamate osmorecettori, che leggono l’osmolarità e si attivano non appena essa si muove
dal valore di 300 mosm/l, regolando la produzione dell’ormone antidiuretico, o vasopressina (ADH),
che avviene a livello dell’ipotalamo stesso. Questo avviene per trasporto assonico attraverso la
neuroipofisi posteriore, che lo immette nel sangue. Una volta nel sangue, l’ADH arriva a livello
renale, più precisamente a livello dei tubuli collettori, che normalmente sono impermeabili
all’acqua, e l’antidiuretico non fa altro che rendere il tubo permeabile all’acqua, che può quindi
67
passare attraverso la parete del tubulo collettore. Sostanzialmente accade che per riaumentare
l’osmolarità del sangue si regola il sistema in modo da espellere urine ridotte in volume ed
altamente concentrate (1200 osm), mentre per far diminuire l’osmolarità stessa il sistema agirà in
modo da produrre un volume di urine più consistente, e quindi meno concentrato (300 osm). In
poche parole, il rene ogni giorno filtra 180 l d’acqua dal sangue, di cui l’80% viene riassorbito a livello
dei tubuli collettori e rimesso in circolo. Se non ci fosse l’ormone antidiuretico quindi, espelleremmo
36 litri d’acqua al giorno: questa patologia è detta diabete insipido, perché produce lo stesso effetto
volemico del diabete mellito; ricordiamo però che il diabete mellito è dovuto ad iperosmolarità del
liquido, per presenza di glucosio nel filtrato, che ha una rilevante funzionalità osmotica, e quindi
trattiene acqua causando poliuria diabetica che poi porta ad ipovolemia, caduta di pressione e coma;
in questo caso si ha una poliuria, ma che non ha le stesse origini di quella da diabete mellito, bensì è
causata da una lesione della neuroipofisi. Oggi questa patologia si tratta farmacologicamente:
diversamente, i pazienti affetti da diabete insipido sarebbero destinati alla morte.
Riassumendo, abbiamo una riduzione di
acqua nei tessuti che provoca
l’attivazione degli osmorecettori; si attiva
la neuroipofisi che produce ADH che
attraverso i vasi raggiunge i reni, e qui si
ha il riassorbimento aumentato di acqua
attraverso la permeabilizzazione dei
tubuli collettori: ciò provoca una perdita
d’acqua a livello renale e l’innescamento Figura 67
della sensazione di sete. Naturalmente vale anche il procedimento contrario: se c’è un eccesso di
acqua nei tessuti, viene ridotta l’attività degli osmorecettori, e di conseguenza diminuisce la
produzione di ADH a livello di neuroipofisi, si ha riduzione di permeabilità dei tubuli, accumulo di
acqua nei reni, e grande quantità di urine. Misurando la densità delle urine siamo quindi in grado di
dire se un soggetto è o meno a rischio di disidratazione: se la densità è alta sarà a rischio, viceversa,
le urine risulteranno poco concentrate, il soggetto sarà iperidratato.
Figura 68
Concludiamo parlando di un’altra
funzione importante dell’ipotalamo
riferendoci ad un esperimento
condotto su un gatto anestetizzato.
L’esperimento consiste nella
stimolazione dei nuclei ipotalamici
per conoscerne la funzione. Abbiamo
degli elettrodi inseriti nel nucleo
ventromediale, e in un altro piccolo
nucleo più in alto (rappresentato in
verde). Il nucleo ventromediale
possiede delle cellule chiamate
glucostati, che sono le uniche cellule
nervose che hanno bisogno
dell’insulina per assorbire glucosio.
68
Un incremento della glicemia corrisponde ad un incremento del glucosio in queste cellule, che fanno
cessare nell’animale l’appetito, lo pongono in uno stato di quiescenza e lo fanno addormentare.
Possiamo notare, in figura 68, una serie di informazioni comportamentali dell’animale, a cui
corrispondono una serie di informazioni oggettive come la pressione del sangue, l’attività peristaltica
dell’intestino, e il flusso sanguigno che arriva nell’intestino e nei muscoli. A causa della stimolazione
del nucleo ventromediale, l’animale presenta il comportamento descritto nella colonna sinistra:
stato di allerta e cammina annusando alla ricerca di cibo. Inizia a mangiare, si smette di stimolare il
nucleo ed immediatamente smette di mangiare. Notiamo che la pressione del sangue, rispetto allo
stimolo descritto nella colonna destra, è più bassa che dopo, mentre la peristalsi dell’intestino è più
alta, come se avesse ingerito e iniziasse a digerire, stesso motivo per cui è aumentato il flusso
ematico intestinale, necessario ad assorbire le sostanze digerite. A causa di questo elevato flusso
ematico intestinale, il flusso a livello muscolare diminuisce. Successivamente si va a stimolare l’altro
centro, legato all’aggressività, e si osserva la serie di comportamenti descritti nella colonna destra:
inarcamento della schiena, estrazione delle unghie, piloerezione, ed infine l’animale sbava ed urina.
Questo comportamento non avrebbe motivo d’essere, l’animale in precedenza dormicchiava ed era
tranquillo: sappiamo per certo quindi, che quella reazione è provocata dalla stimolazione della
seconda area. A livello fisiologico si ha un aumento della pressione del sangue, azzeramento della
peristalsi dell’intestino, poiché la digestione, in questa situazione di emergenza, ruberebbe energia.
Diminuisce per lo stesso motivo il flusso ematico intestinale, che viene convogliato nei muscoli. Dopo
la fine dello stimolo, l’animale riprende la precedente condizione di quiescenza.
Riepilogando, l’ipotalamo è una struttura che interagisce con diversi centri nervosi: col tronco
encefalico, col quale scambia informazioni sia a livello volontario che a livello autonomo; interagisce
col sistema limbico, che è una struttura complessa sottocorticale legata, come abbiamo detto,
all’affettività; tale sistema fa in modo, in cooperazione con l’ipotalamo, di creare determinate
reazioni comportamentali coerenti con la salvaguardia del soggetto, al di là di mediazioni culturali. Il
sistema limbico è connesso con il lobo frontale della corteccia, che è la sede di integrazione delle
informazioni dove si crea una risposta “personalizzata” agli stimoli esterni. Abbiamo infine la
corteccia associativa che media col sistema limbico. La conclusione di questo discorso è che noi, in
quanto individui, siamo caratterizzati da quadri espressivi, non soltanto da espressioni facciali ma
anche da comportamenti veri e propri, che vengono gestiti dal sistema limbico: esso infatti media tra
l’azione dell’ipotalamo e il controllo culturale della neocorteccia. Il quadro espressivo altro non è se
non la risposta alla variazione della situazione ambientale mediata dal filtro composto da sistema
limbico, ipotalamo e neocorteccia.
Lezione del 19/12/2008.
Il muscolo scheletrico.
In conclusione di questa prima parte del corso, inizieremo a parlare della macchina muscolare.
Riprenderemo quindi le nozioni anatomiche e cercheremo di capire il funzionamento chimico di
questa struttura che attua una trasduzione di energia, passando dall’energia chimica contenuta nei
tre legami (altamente energetici) fosforici dell’adenosintrifosfato, i quali, in condizioni idonee, si
scindono, e questa energia viene trasformata o in altri legami chimici (nel cosiddetto anabolismo), o
in forza meccanica applicata dalla macchina muscolo. La caratteristica dinamica della struttura
muscolare scheletrica è quella di accorciarsi. I muscoli non si allungano, vengono allungati da forze
applicate su di essi, ma se eccitati, tendono a ridurre la loro lunghezza. Possono riuscirci solo nel
caso in cui la forza o il carico applicati siano inferiori alla massima forza che possono produrre: se le
due forze si equivalgono si ha la cosiddetta contrazione senza movimento (o contrazione isometrica,
69
tipica dei muscoli posturali, che stanno in contrazione ma bilanciano la forza peso distribuita fra di
loro); se invece avviene la contrazione, essa viene detta contrazione isotonica (o concentrica), e in
questo caso si compie lavoro meccanico. Esiste infine anche la contrazione eccentrica, che si
manifesta quando il muscolo genera una forza necessaria a contrarsi ma i carichi applicati sono
superiori a questa forza, per cui esso viene comunque allungato. Alla base di queste caratteristiche
c’è una complessa struttura molecolare di tipo proteico, chiamata sistema delle proteine contrattili :
è infatti noto che sostanzialmente alla base del movimento muscolare vi sono le due proteine actina
e miosina, che al loro interno hanno una struttura ulteriormente complessa. Queste due proteine,
scivolando l’una sull’altra, producono forza, che per essere prodotta ha bisogno di altri fattori: c’è
sicuramente bisogno di energia potenziale, fornita dall’adenosintrifosfato, che ha bisogno di un
trigger che dia l’inizio, che è lo ione Ca++, presente nel sarcomero ad un basso livello di
concentrazione. In determinate condizioni lo ione Ca++, contenuto nel reticolo sarcoplasmatico,
vicino al sarcomero, viene liberato, e la sua concentrazione aumenta tantissimo, rendendolo
disponibile alla sua funzione di trigger, ossia di aggancio delle due proteine, con conseguente
scorrimento. Il primo passo di questo fenomeno è sempre lo stesso, ossia la depolarizzazione della
membrana della cellula muscolare, la quale avviene, normalmente, quando uno specifico
neuromediatore (acetilcolina) viene estruso dalla terminazione nervosa che fa sinapsi con la cellula
muscolare (giunzione neuromuscolare). La terminazione nervosa non è altro che un assone di un
motoneurone α che sta a livello del midollo spinale che, quando viene attivato produce una scarica
di potenziali d’azione che si traduce in una quantità di acetilcolina che viene estrusa nello spazio
intersinaptico, tra membrana presinaptica neuronale e membrana postsinaptica muscolare;
quest’ultima ha delle strutture specifiche, dei recettori di membrana adatti a legarsi con
l’acetilcolina. Il legame tra acetilcolina e recettori determina un aumento di conduttanza al sodio,
che fa scattare una depolarizzazione della membrana, e questo evento libera lo ione Ca++ dal reticolo
sarcoplasmatico e, per gradiente di concentrazione, va ad invadere il sarcomero. Inizia così la
contrazione, evento che in termini biologici ha un tempo d’esecuzione molto rapido. La possibilità di
produrre forza per tempi prolungati è legata alla rapida successione di contrazioni e stiramenti della
struttura muscolare o meglio, alle rapide depolarizzazioni e ripolarizzazioni che avvengono a livello di
membrana.
Possiamo osservare, nell’immagine a lato,
una sezione di muscolo ingrandita al
microscopio, dove è possibile distinguere
una struttura muscolare frammista a
cellule adipose.
Figura 69
70
Vediamo ora, tramite uno schema
esploso(figura 70), come una grossa struttura
come una massa muscolare, non sia altro che
un ripetersi, in termini di lunghezza e
spessore, dell’unità morfofunzionale del
muscolo, cioè il sarcomero. Consideriamo il
muscolo in figura (bicipite), lo deafferentiamo
ad un capo e lo allunghiamo; iniziamo
successivamente a sezionarlo e troviamo dei
fascicoli allungati, dei cilindroidi, che sono le
fibre muscolari che, a seconda del tipo di
muscolo possono essere anche piuttosto
lunghe. Andando ad osservare l'interno della
fibra muscolare, troviamo una membrana di
connettivo e si individua un'altra struttura
ancora più piccola, la miofibrilla, al cui interno Figura 70
troviamo una struttura lineare composta da
elementi posti in serie fra di loro, anatomicamente delimitati da delle bande che istologicamente
sono dei discoidi che uniscono un elemento all’altro. L’elemento delimitato dalle due bande è
proprio il sarcomero.
Schematicamente, il sarcomero è
rappresentato dalla struttura
rappresentata a lato.
Macroscopicamente si compone di
due tipologie di filamenti: quelli
sottili, di actina, che vanno dalla
banda Z e protrudono verso
Figura 71
l’interno; notiamo che i filamenti di
actina di ogni sarcomero sono opposti e non si toccano. All’interno di due coppie di filamenti di
actina si trova un altro filamento, apparentemente staccato dai dischi Z intercalari: si tratta della
miosina, o filamento grosso. Quando il sistema viene attivato si generano delle forze che tendono a
far avvicinare le bande Z, con uno scorrimento dell’actina sulle teste di miosina che tende ad
accorciare il sarcomero.
71
In questa immagine abbiamo
una fibra muscolare, con le
sue miofibrille, a cui arriva
una terminazione nervosa da
un motoneurone α, che si
sfilaccia e innerva un certo
numero di fibrille, e quindi un
certo numero di strutture
sarcomeri che. Quando si ha
una stimolazione o artificiale
o da parte del motoneurone
α avviene, a livello di
membrana, a causa
dell’acetilcolina, la
depolarizzazione mostrata in
grafico. Se andiamo a vedere
il grafico in basso notiamo
che il propagarsi del
potenziale d’azione provoca
un picco di incremento di
concentrazione dello ione
Ca++ all’interno del
sarcomero; successivamente
a questo evento si osserva il
fenomeno di produzione di
Figura 72
forza tra le due bande Z:
questo evento meccanico è detto stato attivo. L’ampiezza di questo impulso di forza è costante, ed
è sempre la massima possibile che il sarcomero può generare. Il valore assoluto dello stato attivo
dipende dalla lunghezza del sarcomero: si ha infatti una lunghezza ideale per la quale si ha la
massima ampiezza dello stato attivo, per cui un sarcomero di lunghezza maggiore o minore rispetto
a quella ideale ha uno stato attivo di ampiezza inferiore a quella massima; vedremo in seguito il
perché. Il meccanismo è quindi innescato da un’eccitazione (potenziale d’azione), che provoca
l’accoppiamento tra actina e miosina (estrusione di ione Ca++) che genera la contrazione (stato
attivo): tra queste fasi essenziali della contrazione muscolare c’è evidentemente un ritardo in termini
di tempo.
La miosina.
Vediamo ora schematicamente la
morfologia della miosina: si tratta di
un fascicolo di strutture filiformi,
come bastoncelli (circa 100 per
fascicolo), caratterizzati da una forma
simile a quella di una mazza da golf, la
cui estremità (testa della miosina) è
composta da meromiosina pesanteMMP, mentre il corpo centrale
allungato è composto da meromiosina
Figura 73 : Miosina
72
leggera-MML. La lunghezza media dei filamenti di miosina nell’uomo è di circa 1200 Å; se noi
disponiamo questi filamenti in un fascio, chiaramente le teste andranno a disporsi in diversi punti:
andando a considerare le teste di miosina giacenti sullo stesso piano, si è notato che la loro distanza
è costante ed è pari a 400 Å.
Le teste della miosina hanno una forte affinità
con l’ATP, per cui, quando ne trovano in
circolo, lo catturano, e in una zona vicinale alla
testa della miosina, nel bastoncello, si trova un
sito enzimatico ATPasico che è il responsabile
della scissione dell’ATP e della generazione di
energia.
Figura 74 : Testa di miosina
L’actina.
Andiamo ora a vedere il
cosiddetto filamento sottile,
l’actina, che in realtà più che un
filamento, è un sistema proteico
multi molecolare. Il filamento è
infatti un concatenamento di
molecole sferoidali che sono
proprio molecole di actina. Tali
molecole hanno un diametro di
circa 55 Å e sono polarizzate, e
in questo modo si attaccano
formando una specie di
“collana”. Il filamento di actina
è formato da una doppia elica
composta da due di queste
collane, conformazione che
prevede dei nodi e delle
espansioni: in presenza dei nodi
si trova un’altra struttura
molecolare, chiamata
troponina, e la distanza tra due
nodi è esattamente di 400 Å,
come le due teste di miosina
Figura 75 : Actina
nello stesso piano. Si ha un’altra struttura molecolare filamentosa chiamata tropo miosina, che è
situata nel solco formato dalle due collane.
73
Cross-link acto-miosinico.
Proviamo a vedere in sezione il
sistema: a riposo, la troponina I ha
affinità con l’actina e vi si attacca,
la troponina T ha affinità con la
tropomiosina e le impedisce di
finire in mezzo al solco, mentre la
troponina C ha affinità con lo ione
Ca++. In condizioni di non
contrazione, il sistema troponinatropomiosina forma, con l’asse
delle due molecole di actina, un
angolo di 50°. Le teste di miosina,
che contengono ATP,
poggerebbero sull’actina, se non ci
fosse il sistema troponinatropomiosina ad impedirlo.
Dobbiamo tener conto del fatto
che sia la testa della miosina che
l’actina sono polarizzate
negativamente. Abbiamo quindi
una repulsione elettrica tra questi Figura 76
due sistemi. Quando si passa allo stato 2 di attivazione, ossia una depolarizzazione che ha liberato
calcio dal reticolo sarcoplasmatico verso il sarcomero, fa diffondere rapidamente Ca++ che si attacca
alla sub unità C della troponina. In questo modo la sub unità I si sgancia dall’actina, e l’energia
accumulata dalla tropo miosina la spinge all’interno del solco, portandosi dietro tutto il sistema e
liberando il sito di attacco tra teste di miosina ed actina. Si tenga presente che l’ATP contenuto nelle
teste di miosina è ancora integro, che a questo punto innesca il meccanismo di contrazione
muscolare.
La contrazione muscolare.
Figura 77
74
Facendo riferimento all’immagine 77, vediamo un modello elettrochimico della contrazione
muscolare. Nella prima immagine della sequenza vediamo il banda Z e l’interno del sarcomero:
abbiamo il filamento di actina con la troponina, il filamento di miosina e notiamo che c’è ATP in
circolo. Sia l’actina che la miosina sono caricate negativamente, ma il sito ATPasico della miosina fa si
che essa venga caricata sulla testa, aumentandone l’elettronegatività. Successivamente uno stimolo
depolarizza la membrana delle cellule muscolari e viene liberato lo ione Ca++ nel sarcomero, che
arriva in prossimità della sub unità C della troponina, viene catturato e si crea una sorta di legame
tra l’uno e l’altro. A questo punto il calcio va a svolgere l’ulteriore funzione di polarizzazione positiva
della testa di miosina, che si piega e si avvicina al filamento di actina. La testa, piegandosi, determina
una variazione di lunghezza ∆l della banda Z, e quindi si genera lavoro. Nel momento in cui avviene
questo, l’ATP viene scisso dal sito ATPasico, però la testa della miosina rimane attaccata all’actina: in
questo modo si passa da un complesso ad alto livello energetico ad un complesso a basso livello
energetico (sequenze 5 e 6). Inoltre l’ADP, che non ha affinità con la testa della miosina, si sgancia;
nel frattempo la ripolarizzazione della membrana della cellula muscolare non consente più uscita di
calcio dal reticolo sarcoplasmatico. Questo è importante, in quanto il movimento muscolare si basa
sulle contrazioni: è quindi necessario riportare continuamente il calcio nel reticolo sarcoplasmatico,
che non può tornare indietro autonomamente, essendo contro gradiente. La concentrazione di
calcio nel reticolo infatti è sempre più alta di quella nel sarcomero.
Nella struttura del reticolo
sarcoplasmatico si spende energia
per sfruttare meccanismi esterni di
origine metabolica: ci sono delle
pompe che prendono il calcio dal
sarcomero e lo riportano, contro
gradiente, nel reticolo
sarcoplasmatico, spendendo in
questo modo ATP. Tuttavia questo
meccanismo è lento, e non dà
ragione della rapidità di contrazioni
e rilasciamenti. Vediamo ora il
reticolo plasmatico più nello
specifico. Istologicamente notiamo
la fibra muscolare, avvolta da
guaina connettivale, sotto la quale
Figura 78 : Reticolo sarcoplasmatico
possiamo osservare le miofibrille e i
sarcomeri che le compongono. Attorno alle fibrille c’è una struttura di piccoli canali e, in
corrispondenza della banda Z, a livello di demarcazione tra un sarcomero e l’altro, i canali si fondono
e formano le cosiddette cisterne, dove si ha l’effettivo addensamento del calcio. Ovviamente la
concentrazione di calcio nel reticolo sarcoplasmatico dipende dalla calcemia, ossia dalla
concentrazione di calcio nel sangue, a sua volta dipendente dalla tireotropina tiroidea (TSH), dal
paratormone delle paratiroidi, dal calcio che assumiamo con la dieta e dal calcio presente nelle ossa,
che non serve solo a strutturare le ossa, ma funge da vera e propria riserva minerale per
l’organismo. Nell’immagine notiamo due zone, denominate A e I: la banda A è costituita da filamenti
spessi (che durante la contrazione mantengono la stessa lunghezza), mentre la banda I è la zona del
sarcomero occupata dai filamenti sottili. Abbiamo detto che nella zona di congiunzione tra A ed I
75
(cioè la banda Z), il reticolo sarcoplasmatico presenta la cisterna, dalla quale si dipartono tubuli
disposti longitudinalmente che confluiscono in una cisterna fenestrata centrale. Alla confluenza di
due cisterne terminali è presente, tra le due cisterne una formazione tubulare detta tubulo T, si
tratta di una invaginazione del sarcolemma il cui lume comunica con l'ambiente extracellulare ma
non con il lume del reticolo sarcoplasmatico. Le membrane dei due sistemi sono affrontate ma
separate da un interstizio. L'insieme di queste formazioni (tubulo a T+cisterne) prende il nome di
triade del reticolo ed è connessa alla modulazione del rilascio di ioni calcio necessari per consentire
la contrazione.
Schematicamente, in figura, vediamo
la membrana della miofibrilla, il
tubulo a T, interfacciato alle due
cisterne. Notiamo che a riposo la
concentrazione del calcio nel reticolo
sarcoplasmatico è di 10-8 mM. Il
potenziale
d’azione
provoca
un’inversione di polarizzazione della
membrana,
evidenziata
nella
sequenza 2 di quest’immagine, e
permette la fuoriuscita di Ca++ dalle
cisterne verso il sarcomero, facendo
diminuire la concentrazione di calcio
a livello sarcoplasmatico di ben tre
zeri: si passa infatti ad una
concentrazione di 10-5 mM. La
quantità di calcio estrusa è sufficiente
a scatenare il meccanismo descritto
ad inizio pagina 75. Una volta che la
membrana si è ripolarizzata, si pone il
problema del recupero di calcio, che
non può tornare spontaneamente nel
reticolo
sarcoplasmatico,
come
abbiamo già accennato. Allora
intervengono quei meccanismi di
recupero attivo con costo energetico
che però sono troppo lenti. Esistono,
Figura 79
a seconda del tipo di cellula
muscolare, nei dintorni della membrana, delle piccole proteine, le parvalbumine (P), che hanno una
forte affinità per lo ione calcio e funzionano come tamponi o spugne, consentendo il distacco di tali
ioni dalla troponina e quindi il recupero pressoché istantaneo della condizione di riposo. In altre
cellule, quelle più sottili ed ossidative, ad espletare questa funzione sono gli stessi mitocondri. Viene
cosi recuperata la concentrazione iniziale di calcio nel reticolo, come mostrato nella sequenza 3.
Questo meccanismo è temporaneo, serve solo durante le contrazioni successive, che chiaramente
non possono essere infinite. Normalmente questa funzione viene svolta proprio dalla pompa
ATPasica descritta in precedenza. Questi argomenti verranno approfonditi nella seconda parte del
corso dove affronteremo il modello meccanico del muscolo.
76