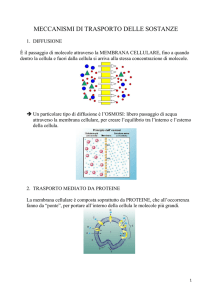
CELLULA ED ORGANULI
Le cellule hanno dimensioni dell’ordine dei μm
Variabilità nella morfologia cellulare
Sec XVII: prime osservazioni al microscopio
Osservazioni di T Hooke e prima definizione
di “cellula”
Sec XIX: viene proposta la teoria cellulare
(elaborata da Schleiden, Schwann e Virchow)
“ esiste un principio generale di costruzione di
tutti gli esseri viventi e questo principio
costruttivo è la formazione di cellule”.
Nel corso del XX sec. la cellula è
definitivamente riconosciuta come unità
fondamentale morfologica e funzionale di tutti
gli organismi viventi.
Una cellula piccola ha un rapporto superficie/volume maggiore di una
cellula grande della stessa forma.
Il rapporto s/v deve mantenersi alto per garantire efficienza cellulare
Superficie
scambio/interazione
ambiente est
I microscopi ci permettono di studiare le cellule
•Il microscopio ottico (LM, dall’inglese Light Microscope) permette di vedere forma e
struttura di una cellula.
Oculare
Lenti dell’oculare
Lenti dell’obiettivo
Campione
I microscopi sono caratterizzati
da
•potere di risoluzione
•potere di ingrandimento
Lenti del condensatore
Fonte di luce
Le osservazioni al microscopio
hanno permesso di formulare la
teoria cellulare
I microscopi ottici ingrandiscono le cellule (sia vive che conservate) fino a 1000
volte le loro dimensioni reali.
LM 1000×
•Risoluzione 0,2 µm
•ingrandimento 1000X
Tipi diversi di microscopi ottici usano tecniche diverse per aumentare il
contrasto ed evidenziare in modo selettivo le varie componenti cellulari.
•Il microscopio elettronico ha un potere di risoluzione molto più elevato (è in
grado d’ingrandire un’immagine anche 100 000 volte) e rivela i dettagli cellulari
sia interni (TEM) che superficiali (SEM)
SEM 2000 ×
TEM 2800 ×
•Risoluzione 0.2 nm
•Ingrandimento 100000X
Figura 4.1C – Immagine prodotta con il microscopio
elettronico a scansione (SEM, Scanning Electron Microscope).
Figura 4.1D – Immagine prodotta con il microscopio
elettronico a trasmissione (TEM, Transmission Electron
Microscope).
Componenti cellulari si possono separare e studiare con tecniche
come la centrifugazione differenziale
Esistono due tipi di cellule: procariotiche ed eucariotiche
Cellula procariotica
Nucleoide
Colorizzata TEM 15 000 ×
Procariotica (batteri)
•Più piccola
•Più semplice
•DNA concentrato nel nucleoide
non separato dal resto mediante
membrana cell
•Priva di organelli
Eucariotica
•Più grande
•Struttura più complessa
•DNA concentrato nel nucleo
(separato dal resto mediante
membrana)
•Molti organelli
Nucleo
Cellula eucariotica
Organuli
Elementi strutturali di una cellula procariotica
Flagelli
batterici
Ribosomi
Capsula
Parete cellulare
Membrana
cellulare
nucleoide
Pili
Tutti i procarioti hanno alcune caratteristiche
strutturali che consentono loro di occupare una vasta
gamma di ambienti.
Colonizzata TEM 70 000 ×
la parete cellulare, spesso avvolta da una capsula
gelatinosa, ha funzione protettiva
Capsula
I pili sono appendici corte e sottili che permettono
l’adesione ad un substrato
Colonizzata TEM 16 000 ×
Pili
Flagello
Colonizzata TEM 14 000×
I flagelli sono organelli locomotori: grazie al
loro moto ondulatorio permettono ai batteri di
muoversi in un ambiente fluido
Membrana plasmatica
Parete cellulare
Movimento rotatorio del flagello
Da “L’Essenziale di Biologia. Campbell et al., Pearson Ed.”
Alcuni caratteri strutturali dei procarioti (evidenziabili al TEM)
Il DNA è su cromosoma singolo e circolare, ancorato a membrana
Plasmidi: 1 o più molecole DNA circolare di dimens. più piccole
Alcune proteine sono associate al DNA con azione simile agli istoni
Mesosomi: invaginazioni di membrana che forniscono ATP (energia);
Depositi lipidici, polisacc., P inorg. (granuli)
Mesosomi per
respirazione e/o fotosintesi
Nei procarioti si distinguono 2
principali linee evolutive:
•Archea
•Eubatteri
Differiscono per caratteri strutturali,
biochimici e fisiologici
•Gli Archea comprendono batteri
estremofili (alofili, termofili, metanogeni)
molto importanti dal punto di vista
ambientale ecologico
esempi di Archea
batteri alofili e batteri metanogeni
Gli Eubacteria si suddividono in 9 gruppi,
•
•
•
•
•
5 dei quali sono considerati sottogruppi di un unico clado di batteri
Gram-negativi chiamati Proteobatteri.
Gram-positivi
Clamidie
Spirochete
Cianobatteri
21
I batteri hanno forme molto variabili
ma sono tipicamente unicellulari e di piccole dimensioni
Alcuni eubatteri hanno capacità di formare endospore:
sopravvivono ad ambienti ostili in uno stato di “dormienza”
Endospora
•Rivestimento spesso ed
impermeabile
TEM 34 000 ×
•Perdita acqua
•metabolismo ridotto
•Sopravvive anche per anni
23
In condizioni favorevoli i batteri si riproducono rapidamente per scissione
binaria → crescita esponenziale
Riproduzione asessuata in q. manca scambio di materiale genetico
Malgrado la riproduzione batterica sia asessuata esistono fenomeni di
sessualità legati a scambio di materiale genetico
Batteri con pilum sessuale
La struttura della parete è un carattere morfologico importante per la
classificazione dei batteri in Gram-positivi e Gram-negativi
La parete cell. degli eubatteri è formata da un particolare polisaccaride: il
peptidoglicano.
Batteri Gram-pos.:blu scuro con violetto di genziana
Biologia e “nicchie ecologiche” dei procarioti
biochimicamente molto versatili!
Tutti i viventi possono essere suddivisi in base a fonte di energia e fonte di carbonio in foto/chemio
(fonte energia) auto/etero trofi (fonte C)
Modalità
nutrizionale
Fonte Energia
Fonte di Carbonio
Fotoautrofo
(fotosintetico)
Luce solare
CO2
Chemioautotrofo*
Sostanze
inorganiche
CO2
Fotoeterotrofo*
Luce solare
Composto organico
Chemioeterotrofo
Composti organici
Composti organici
•Esclusiva dei procarioti
Procarioti hanno metabolismi molto diversi e dunque appartengono a tutte queste
categorie: es cianobatteri (fotoautrofi); batteri che usano NH 3 e H2S (chemioautotrofi);
batteri fermentanti (chemioeterotrofi) come animali e protisti.
I batteri sono responsabili di varie patologie umane
Yersinia pestis (peste)
Listeria monocitogenes (listeriosi)
Staphylococccus aureus (tossine)
Vibrio cholera (colera)
SEM 2800×
I batteri patogeni compromettono la salute perché la loro proliferazione
comporta lesioni, e perché producono tossine che interferiscono con
processi cellulari fondamentali (ad es la tossina del tetano interferisce con
la conduzione dello stimolo nervoso; la tossina colerica altera le cascate
di trasduzione del segnale; la tossina difterica blocca la sintesi proteica,
etc.)
Es di malattie umane di origine batterica
Tetano,colera, difterite, peste, tubercolosi,ulcera gastrica, etc
31
La proliferazione di Helicobacter
pylori provoca lesioni ulcerose su
mucosa gastrica
Ruolo ecologico dei batteri
Azotofissatori e decompositori: importanza nei cicli biogeochimici
•Alcuni batteri convertono sost inorganiche in composti organici
•alcuni demoliscono materiali organici per renderli utilizzabili, sotto forma di
sostanze inorganiche, da altri organismi.
utilità nel risanamento ambientale
Procarioti decompositori possono essere usati nella depurazione delle acque reflue,
nei disastri petroliferi o nella decontaminazione delle miniere di metallo in disuso
Braccio rotante
che spruzza
il liquame
Letto roccioso
coperto di batteri
e funghi aerobi
Liquami
Da “L’Essenziale di Biologia. Campbell et al., Pearson Ed.”
Deflusso
33
•Batteri “azotofissatori”:
convertono l’azoto gassoso (N2)
dell’atmosfera in composti azotati.
Cellula eucariotica
Le cellule eucariotiche sono suddivise in compartimenti con funzioni diverse
–Le cellule eucariotiche sono contraddistinte dalla presenza di un vero e proprio nucleo.
–Nelle cellule eucariotiche esiste un esteso e complesso sistema di membrane interne che
suddivide il citoplasma in zone diverse con funzioni differenti facilitando metabolismo
cellulare.
Cellula eucariotica
animale
Una cellula vegetale ha alcune strutture che sono assenti nella cellula animale,
come i cloroplasti, i vacuoli e una parete cellulare rigida (formata da cellulosa e/o
lignina).
Nucleo
Reticolo
endoplasmatico
ruvido
Ribosomi
Apparato
di Golgi
Assenti
nelle cellule
animali
Vacuolo
centrale
Cloroplasto
Reticolo
endoplasmatico
liscio
Microtubulo
Filamento
intermedio
Microfilamento
Parete
cellulare
Mitocondrio
Perossisoma
Membrana plasmatica
Cellula eucariotica
vegetale
Citoscheletro
Strutture presenti nelle cellule
eucarioti
(protozoi e
metazoi)
procarioti
(batteri)
Cromatina o DNA
si
si
membrana plasmatica
si
si
Involucro nucleare
si
no
ribosomi
si
si
mitocondri o cloroplasti
si
no
apparato Golgi
si
no
parete cellulare
Sì-no
si
reticolo endoplasmatico
si
no
lisosomi e perossisomi
si
no
Citoscheletro
si
no
STRUTTURA
Membrana plasmatica e membrane biologiche
La membrana plasmatica è una struttura flessibile e dinamica:
Deformazioni a seguito di movimento cellulare, divisione, fusione
STRUTTURA DI MEMBRANA
Modello a mosaico fluido (Singer e Nicolson, 1972)
Membrana come “fluido bidimensionale”: proteine inserite in
doppio strato lipidico
Il modello a mosaico fluido è frutto di varie osservazioni sperimentali
•I fosfolipidi tendono naturalmente ad organizzarsi in doppi strati
•Studi mediante criofrattura
•Immagini TEM di membrana evidenziano struttura “trilaminare”
1)Componente lipidica proprietà strutturali fluidità
2)Componente proteica proprietà funzionali
Rapporto (lipidi/proteine) 50% ma variabile in base a tipo di membrana
I lipidi sono distribuiti
asimmetricamente
Nelle membrana plasmatica
delle cell di Schwann il
rapporto proteine/lipidi molto
basso guaina mielinica con
funzione isolante
Fosfogliceridi
la componente + abbondante
Sfingolipidi
Glicosfingolipidi
prevalgono nella membrana delle cellule nervose e cerebrali animali
Il colesterolo modula la fluidità di membrana
•Evita impaccamento rigido (a basse T) effetto antifreeze
•Aumenta stabilità (alte T) molti legami deboli con altri lipidi
•Nei vegetali basso contenuto di
colesterolo, sostituiti dai fitosteroli
•Opanoidi: molecole simili nei batteri
Effetto della T sulla struttura
di membrana (gel↔fluido)
3 diversi tipi di movimento dei lipidi di membrana
“Zolle” di membrana con minore fluidità:
rafts (transitori) e caveole (invaginazioni) funzione?
Proteine di membrana
1) Integrali (hanno domini transmembrana)
2) Periferiche (associate ad altre proteine o a lipidi mediante legami ionici)
3) Ancorate (legate covalentemente a lipidi o glicolipidi)
Le proteine transmembrana sono estratte/solubilizzate usando detergenti
Le proteine integrali sono anfipatiche
e interagiscono col core lipidico grazie a porzioni idrofobiche
Il dominio transmembrana della glicoforina A è un alfa elica idrofobica
Anche le proteine di membrana si muovono!
Dimostrazione della mobilità laterale di proteine e lipidi di membrana
Esp. di fusione cellulare
La diffusione laterale si evidenzia
anche con esperimenti di recupero
di fluorescenza dopo
fotosbiancamento (FRAP).
•Marcatura delle proteine con sostanza
fluorescente
•Laser perdita fluorescenza
localizzata
•Diffusione della zona “sbiancata”
Grado di motilità
variabile per le
proteine di membrana
Carboidrati di membrana
Associati a proteine o a lipidi sul versante esterno
L’orientamento dei gruppi
glucidici dipende dai
meccanismi con cui si
ri/generano le membrane
•Componente glucidica sintetizzata e
rimodelllata nel lume di reticolo e del Golgi
•In seguito a fusione di vescicole con
membrana esposizione vs lato esterno
Il glicocalice caratterizza superficie delle cellule animali
è l’insieme di gruppi glucidici (da glicolipidi e glicoproteine)
Funzione
- protettiva-meccanica
- interazione-riconoscimento-adesione intercellulare
Antigeni di superficie (carboidrati) sulla membrana degli eritrociti
gruppi sanguigni
Funzioni della membrana
Processi di trasporto:
• Trasporto passivo
• Diffusione facilitata
• Trasporto attivo
Le proteine sono responsabili delle diverse
funzioni di membrana :
•Proteine di trasporto: facilitano movimento attraverso le
membrane, di nutrienti come zuccheri e Aa. Proteine canale:
forniscono passaggi idrofili. Tra esse ATPasi di trasporto che
sfruttano l’E dell’ATP per pompare ioni da una parte all’altra della
membrana. Proteine che trasportano e- (es.: citocromi e Fe-prot.)
•Enzimi come proteine ancorate a membrana
•Recettori : partecipano ai mecc di segnalazione intercell.
•Proteine di giunzione intercellulare
Permettono la comunicazione e l’adesione tra cellule nei tessuti.
•Proteine importanti
intercellulare
per
riconoscimento
ed
adesione
•Proteine di ancoraggio al citoscheletro e alla matrice
extracellulareche stabilizzano e modellano la membrana
cellulare:es: anchirina, spettrina etc. Proteine che formano
connessione tra membrana e la matrice extracellulare (es:
fibronectine, laminine)
Esistono cellule “polarizzate” in cui le diverse porzioni di
membrana svolgono funzioni diverse
Il nucleo è il centro di controllo della cellula
– Il nucleo è organulo sferoidale (Ø 5 μm) più grande ed è separato dal
citoplasma tramite l’involucro nucleare.
– l’involucro nucleare è formato da 2 membrane formate da doppi strati
fosfolipidici e proteine, presenta pori ed è in continuità col RE.
Cromatina
–Il nucleo è il centro di controllo
genetico della cellula eucariotica
perché contiene il DNA che dirige
tutte le attività cellulari.
Nucleo
Nucleolo
Membrana nucleare
a doppio strato
Poro
Figura 4.7
Reticolo
endoplasmatico
ruvido
Ribosomi
organizzazione strutturale del nucleo e dell’involucro nucleare
Il DNA è presente nel
nucleo come lunghe
molecole lineari i
cromosomi, associato a
proteine
Il N di cromosomi è tipico
di una specie (es 46
nell’uomo)
I cromosomi sono evidenti
solo in periodi particolari
(es. mitosi), altrimenti
massa indistinta:
cromatina
L’involucro nucleare delimita il “nucleoplasma”
Involucro nucleare: 2 membrane fosfolipidiche
fuse a livello dei pori nucleari e in continuità con il RE
Le proteine “lamìne” formano il nucleoscheletro nella matrice
nucleare (nel nucleoplasma) e la lamina nucleare (reticolo fibroso
appena sotto l’involucro membranoso) : strutture proteiche di
sostegno al nucleo
laminopatie umane DIFETTI GENETICI A CARICO DELLE LAMINE
nuclei deformi
Versante esterno dell’involucro nucleare è rivestito da actina.
Connessione tra cito- e nucleoscheletro
La matrice nucleare è una fitta rete di sostegno a cui si associano
cromosomi ed enzimi
Complesso del poro
nucleare (NPC)
•Punto di fusione tra le due
membrane
•Simmetria ottagonale
•Trasportatore o tappo centrale
•Unica via comunicazione tra
nucleo e citoplasma
traffico macromolecolare controllato dentro e fuori dal nucleo.
RNA, ribosomi e proteine
Passaggio controllato (facilitato o ostacolato) a livello del poro nucleare
DINAMICITA’ STRUTTURALE DELL’INVOLUCRO NUCLEARE
Durante la divisione nucleare (mitosi) l’involucro nucleare si dissolve
per poi riformarsi mitosi “aperta”
Nucleolo : zona densa
•Sito di trascrizione e maturazione degli rRNA assemblaggio di subunità ribosomali
•Contiene porzione fibrillare (RNA) e granulare (proteine ribosomali+RNA)
I nucleoli possono essere più di uno, a seconda dello stato celluare
Il nucleolo si trova associato alle regioni di DNA con i
geni per l’rRNA o “nucleolar organization region” (NOR)
Reticolo endoplasmatico: sistema di canali, sacchi e vescicole
membranose
•delimita un lume interno
•Strutturalmente e funzionalmente diviso in liscio e rugoso
La composizione
biochimica dei 2 tipi di RE è
stata determinata grazie a
tecniche di centrifugazione
differenziale.
-Rottura della cellula
-centrifugazioni successive
e prolungate permettono di
separare comparti cellulari
in base a densità
Il RER è associato ai ribosomi
Sede di :
•sintesi di proteine destinate a
secrezione e vari organuli (golgi
lisosomi, membrana pasmatica..)
•Ripiegamento proteico
•Associazioni tra polipeptidi
•Modificazioni postraduzionali
N-glicosilazione
idrossilazione
Formazione ponti S-S
Aggiunta di glicolipidi
La glicosilazione sulle proteine avviene a livello di specifici aa,
Nel RER avviene la N-glicosilazione, la O-glicosilazione avviene in altri
settori cellulari
Il reticolo endoplasmatico liscio (REL o SER)
Ha aspetto tubulare
svolge molteplici funzioni
Grazie a varietà dgli enzimi inglobati nella sua
membrana:
•sintetizza i lipidi (acidi grassi, fosfolipidi,
steroidi) e quindi le membrane e gli ormoni
steroidei;
•Detossifica: demolisce/modifica chimicamente
tossine, farmaci e molecole estranee (es.
antibiotici, pesticidi) nelle cellule del fegato
(ossidasi citocromo P450);
•immagazzina e rilascia ioni calcio nelle cellule
muscolari: importante per controllo della
contrazione
•Metabolismo carboidrati (cell fegato)
Ruolo del REL nel
catabolismo del
glicogeno epatico
E’ presente l’enzima glucosio-6-fosfatasi. Che
produce Glucosio dalla forma fosforilata (Glu
6P) permettendogli di uscire dalle cellula
epatica nel sangue
Il
fegato,
sotto
controllo
ormonale,
contribuisce a mantenere costante il livello
ematico del glucosio.
La glucosio-6-fosfatasi è presente in fegato, reni e cellule intestinali.
Assente in cell. muscolari e cervello che utilizzano il glucosio per attingere E.
Lo sviluppo di RER e SER riflette il tipo di attività cellulare
REL sviluppato in cellule di ghiandole che
producono ormoni steroidei (es testicoli) o
impegnate in detossificazione (fegato) e/o
in soggetti che assumono farmaci
cronicamente
RER sviluppato in cellule di ghiandole che
secernono enzimi o producono ormoni
proteici
I ribosomi sono complessi formati da RNA e proteine
•Presenti in eucarioti e procarioti
•Ogni ribosoma consiste di 2 subunità , unite solo al momento della traduzione
(sintesi proteica)
•La dimensione del ribosoma e delle sue subunità è espressa in unità “Svedberg”
(che indica il coefficiente di sedimentazione in ultracentrifugazione in gradiente di
densità)
Strutture 3D complesse
- adesi a membrane
RIBOSOMI
(RE e m. est involucro nucleare)
- liberi
NB: Presenti ed attivi
anche in mitocondri e
cloroplasti
proteine di membrana,
lume vescicole,
secrezione
Proteine citoplasmatiche
Apparato di Golgi
•Sistema di dischi membranosi appiattiti (cisterne) e vescicole associate
•Sede di modificazione e smistamento delle proteine
•Ha polarità funzionale (Golgi cis-ingresso proteine; mediale; trans-uscita proteine)
Nel Golgi operano enzimi glicosil-trasferasi e glicosidasi che
modificano e rimodellano porzione zuccherina di glicoproteine
Avviene
la O-glicosilazione (Ser e Treo)
Solfatazione su zuccheri
e la sintesi di glicolipidi e sfingomielina
La composizione biochimica enzimatica è diversa nei vari settori del Golgi
(vescicole spola) anterogrado
RE cis Golgi Golgi mediale trans Golgi membrana/secrezione/organuli
(vescicole spola) senso retrogrado
LISOSOMI
Vescicole delimitate da singola membrana (Ø 50nm- 1μm)
ripiene di enzimi idrolitici digestione endocellulare di molecole di varia
natura (proteine, lipidi, zuccheri, acid nucleici)
Le idrolasi lisosomiali agiscono a pH acido
generato e mantenuto da pompe protoniche di membrana
Lisosoma primario : pieno di enzimi
inattivi (pH non acido)
Fusione (lisosoma primario+ vacuolo
alimentare-digestivo) lisosoma
secondario: pH acido ed enzimi attivati
-Parte del materiale digerito rilasciato
nel citosol riciclo
- Materiale non digerito corpi residui
1)espulsi dalla cellula
2) accumulati nel citoplasma
Varie funzioni dei lisosomi
•Eterofagia (nutrimento organismi unicellulari)
•Autofagia (digestione di strutture cellulari usurate
riciclo materiali
•Reazione immunitaria (macrofagi)
•Morfogenesi (sviluppo embrionale e metmorfosi)
•Digestione extracellulare (es. Spermatozoo, funghi,..)
Via autofagica
1. Un vacuolo autofagico a
doppia membrana avvolge
struttura da digerire
2. Si fonde con lisososma
primario
3. Digestione
4. Espulsione di scarti e/o
accumulo di residui
Gli enzimi destinati ai lisosomi sono prodotti nel RER ed indirizzati
con una “marcatura” chimica specifica (mannosio 6-P)
Lisosomi e patologie
Silicosi e asbestosi:
Particelle /fibre ingerite da macrofagi morte cellulare fibrosi del
tessuto polmonare
Patologie autoimmuni, es artride reumatoide: articolazioni danneggiate
da enzimi lisosomiali rilasciati negli spazi extracellulari.
Malfunzionamento dei lisosomi malattie da accumulo
(base genetica: difetti negli enzimi o nel targeting degli enzimi vs
lisosomi)
Es
Tay-Sachs (accumulo di lipidi nelle cellule cerebrali)
Pompe (accumulo di glicogeno negli epatociti)
Gaucher (accumulo di glucocerebrosidi)
PEROSSISOMI
Piccoli organelli racchiusi da membrana contenenti enzimi ossidativi
La presenza di corredi enzimatici specifici permette di evidenziare i
perossisomi distinguendoli da altre vescicole
tecniche citochimiche: (reazione con substrato specifico forma
prodotto colorato o elettrondenso)
Gli enzimi perossisomiali (ossidasi)
ossidano vari substrati (composti
azotati, xenobiotici, ecc.) trasferendo
H all’O2 per dare H2O2.
H2O2 è tossico
Enzimi catalasi (abbondanti nel
lisosoma)
H2O2 H2O +O2
In fegato e rene i perossisomi hanno
azione detossificante
Sono inoltre sede
•di beta-ossidazione degli acidi grassi
•della sintesi di alcuni lipidi
Biogenesi dei perossisomi
Le proteine interne e di membrana del
perossisoma originano da ribosomi
liberi e contengono specifiche seq aa
di targeting.
Parte dei lipidi di membrana
sintetizzate nel perossisoma stesso
NB: Biogenesi simile a mitocondri e
plastidi: divisione binaria di
perossisomi preesistenti
(a differenza di lisosomi che originano per
gemmazione del RE)
HP2: Oppure origine da vescicole del
RE??
MITOCONDRI
Organelli delimitati da 2 membrane; m est liscia, m interna si ripiega (creste)
e delimita la matrice
Funzione: respirazione cellulare (produzione di ATP) enzimi coinvolti
inglobati nella m int e nella matrice.
Differenze tra membrana int ed est.
•Composizione proteica (70% proteine in m int)
•Permeabilità (elevata in m est e con porine., impermeabile la m. int)
I mitocondri possiedono un proprio genoma (20-1000 kb)
•Circolare (come nei batteri)
•Con geni per: rRNA, tRNA e proteine mt
(NB i geni mt seguono schema di eredità particolare in quanto derivano dalla cellula
uovo linea materna)
Il mt dispone anche di un proprio
apparato di traduzione (ribosomi e tRNA)
Ma non è completamente autonomo in q
riceve maggior parte degli enzimi e proteine
dalla cellula (geni nucleari)
Es enzimi per duplicare e trascrivere proprio DNA
•Proteine destinate a mt sono sintetizzate su
ribosomi liberi e contengono seq segnale
specifiche.
•Anche lipidi di membrana sono importati dal
citosol
Biogenesi dei mitocondri
Si formano per divisione da mt pre-esistenti organelli semiautonomi
Abbondano nei tessuti con alta richiesta energetica (es muscolo)
A volte assumono forme particolari
I mitocondri costituiscono una rete inerconnessa?
Pochi grandi mitocondri “ramificati” ed estesi in tutta la
cellula (piuttosto che numerosi, distinti e piccoli).
CLOROPLASTI E PLASTIDI
•Tipici di cellula eucariotica vegetale
•Famiglia plastidi : proplastidi cromoplasti, cloroplasti, leucoplasti (=
amiloplasti, elaioplasti)
• sede di conversione energia luminosa in chimica
•Più complessi rispetto ai mitocondri (2 membrane + tilacoide con analogia
funzionale alla m int mt)
•Biogenesi per divisione
•corredo genetico proprio organelli semiautonomi
1. Spazio intemembrana
2. Stroma
3. Lume del tilacoide
Teoria dell’endosimbiosi
Mitocondri e plastidi derivano da batteri
fagocitati da cellule (protoeucariotiche) +
grandi, con cui si è instaurata simbiosi
vantaggio reciproco
(protezione-alimento vs capacità fotosintetica/
respiratoria)
La teoria dell’endosimbiosi spiega la nascita della
cellula eucariotica
Osservazioni a favore della teoria dell’endosimbiosi
•Doppia membrana (int batterica (creste
come mesosomi)- est cellulare)
•Dimensioni
•Ribosomi simili ai batteri
•DNA circolare e con meccanismo di
duplicazione analogo ai batteri
•Omologia a livello di sequenza rRNA
Citoscheletro: complessa rete di filamenti e tubuli proteici che si estende nel
citosol, dal nucleo alla faccia interna della membrana citoplasmatica
Funzioni:
•sostegno strutturale
•Mantenimento forma cellulare
•Movimento cell. ed organuli
•Adesione e segnalazione cell.
•Divisione cellulare
•Associazione con enzimi citosolici?
3 Elementi strutturali principali, diversi per struttura, dimensione, distribuzione
diametro
monomeri-struttura
funzione
Microtubuli
25-15 nm Tubulina α e β
Tubo cavo di 13
protofilamenti
Motilità cell. (ciglia e flagelli), forma
cell., movimento intracell. di
cromosomi e organelli, vescicole
Microfilamenti
7 nm
Actina G→actina F
2 catene di actina F
intrecciate
Contraz. muscolo, ciclosi,
movimento ameboide, divisione
cell, forma
Filamenti
intermedi
8-12 nm
Varie proteine
8 protofilamenti dimerici
associati
Sostegno, forma cell., lamina
nucleare,
Lo studio del citoscheletro si avvale delle moderne tecniche di microscopia e
dell’uso di farmaci specifici
(Es: colchicina e taxolo→microtubuli; citocalasina D e falloidina→microfilamenti)
Proprietà meccaniche diverse nei vari componenti
•Flessibilità actina (microfilamenti)
•Rigidità- resistenza a compressione microtubuli
•Flessibilità- estensibilità filamenti intermedi
- assonemali: strutt. stabili associate al movimento→ciglia,flagelli
microtubuli
- citoplasmatici:strutt.dinamiche→forma, movimento di vescicole e
cromosomi, polarità assone
I microtubuli sono cilindri cavi con pareti formate da 13 polimeri lineari
(:protofilamenti) di eterodimeri di tubulina (α + β); orientamento
specifico→polarità intrinseca
polarità nel microtubulo
•L’estremità positiva + dinamica (si
allunga e accorcia)
•Estremità negativa “bloccata” e ancorata
a proteine del centro organizzatore dei
microtubuli (contenente anelli di tubulina
γ)
•Attività dei microtubuli modulata dalle
proteine MAP
I microtubuli sono strutture molto dimaniche
L’assemblaggio dei microtubuli procede attraverso una fase di
nucleazione iniziale (lenta)→oligomeri e foglietti; seguita da fase di
allungamento alle estremità (+veloce) per aggiunta progressiva di altri
eterodimeri.
Quando l’eterodimero si associa al mt si idrolizza il GTP
MICROFILAMENTI
Coinvolti nei cambi di forma cell; adesioni
cell-cell e matrice; moto ameboide; ciclosi;
solco di clivaggio in citocinesi; “corteccia
cellulare”; contraz. muscolare.
Il costituente fondamentale
microfilamenti è l’actina
dei
Più molecole di actina G (globulare)
polimerizzano per dare actina F
(filamentosa)
L’orientamento dei monomeri è
specifico→polarità del
microfilamento
Molte e varie proteine possono
associarsi ai filamenti di actina
modulandone la funzione
L’actina globulare lega ATP in
una sorta di tasca proteica
Esistono diverse forma di
actina (famiglia genica) es:
muscolo specifiche e non
muscolari; ARP
Nel muscolo l’interazione con la
proteina motrice miosina produce
la contrazione muscolare
a)
b)
I fasci di actina che costituiscono l’asse portante dei microvilli
dell’eptitelio intestinale (a) e dei filopodi di macrofago (b) sono ancorati
ad una trama filamentosa sub-membrana
I fasci di actina formano le stress fiber
tensione nei punti di contato cellula-cellula e cellula-matrice
Filamenti intermedi
I filamenti intermedi (diametro 8-12 nm) sono le strutture più stabili del
citoscheletro
•funzione di sostegno meccanico (es desmosomi, lamina nucleare, collegamento
tra organuli)
•Tessuto-specifici (importanza diagnostica→tumori e test prenatali)
•Proteine costituenti i FI sono divise in classi
Cheratine (epitelio); vimentine (connettivi); desmine (muscolo); neurofilamenti (cell. nervose);
lamìne nucleari (trama interna involucro nucleo)
Le proteine dei FI costituiscono un’unica grande famiglia genica
•Sono tutte proteine fibrose con dominio centrale (conservato per seq AA e
struttura) a bastoncello coinvolto nell’assemblaggio dei protofilamenti
•Domini N e C terminali molto variabili secondo funzione specifica
Modello per assemblaggio di filamenti intermedi
Dimero proteico (super-elica) → affiancamento sfalsato laterale tra
dimeri→ protofilamento → 8 protofilamenti formano un FI
Interconnessione tra gli elementi citoscheletrici
Il citoscheletro è formato da una rete di filamenti intermedi, microtubuli e
microfilamenti tra loro interconnessi
I FI (verde) sono collegati agli altri elementi grazie alla proteina plectina
(rosso)
Così citoscheletro sopporta compressione, tensione, conferisce rigidità ma assicura
anche dinamismo.