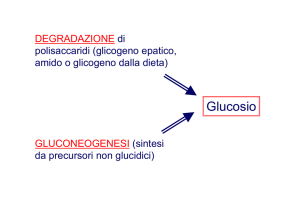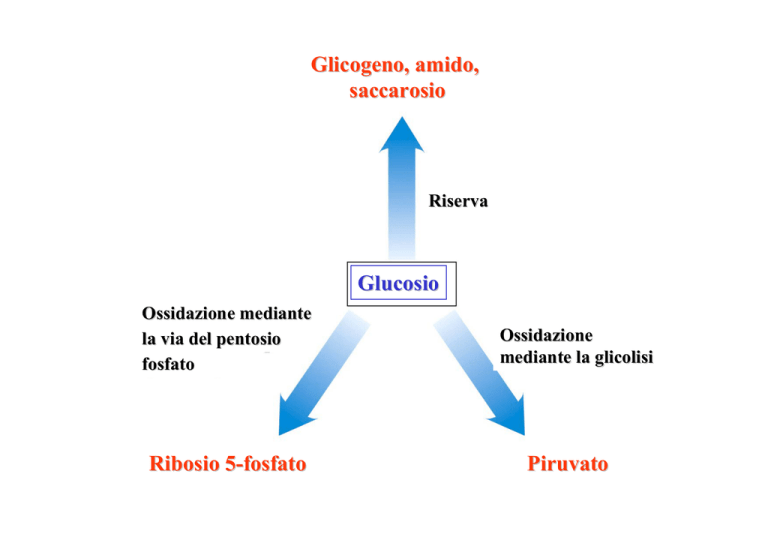
Glicogeno, amido,
saccarosio
Riserva
Glucosio
Ossidazione mediante
la via del pentosio
fosfato
Ribosio 5-fosfato
Ossidazione
mediante la glicolisi
Piruvato
Fase preparatoria
Fase di recupero energetico
Tutti gli intermedi glicolitici sono fosforilati.
1) Gli intermedi fosforilati non possono uscire dalla cellula.
2) I composti fosforilati ad alta energia che si formano nel corso della glicolisi
(1,3-bisfosfoglicerato e fosfoenolpiruvato) donano i loro gruppi fosforici
all’ADP e formano ATP.
2) Il gruppo fosforico favorisce il legame del substrato all’enzima.
1) Fosforilazione del glucosio
Enzima: esochinasi
I substrati di quasi tutti gli enzimi NTP-dipendenti sono i complessi
formati da magnesio (o manganese) e nucleoside trifosfato
Lo ione magnesio neutralizza alcune cariche negative del NTP, riducendo le
interazioni ioniche non specifiche tra l’enzima e il gruppo polifosforico del
nucleotide
Lo ione magnesio mantiene il nucleotide in una conformazione ben definita
che può essere riconosciuta dall’enzima.
Lo ione magnesio fornisce ulteriori punti di interazione tra il complesso ATPMg2+ e l’enzima.
Enzima
Adattamento indotto dell’esochinasi
In rosso il glucosio
Adattamento indotto nell’esochinasi
Le modificazioni conformazionali indotte
dal legame del substrato creano un
ambiente molto più apolare intorno al
glucosio il che favorisce la donazione del
gruppo fosforico terminale dell’ATP.
L’adattamento indotto assicura che si
formi una conformazione cataliticamente
attiva dell’enzima solo quando sono legati
sia il donatore che l’accettore del fofosfato,
impedendo trasferimenti dispendiosi del
gruppo fosforico all’acqua
2) Conversione del glucosio-6-fosfato in fruttosio 6-fosfato
Enzima: fosfoesosio isomerasi o fosfoglucosio isomerasi
Il glucosio-6-fosfato, un aldoso, viene trasformato in fruttosio-6-fosfato, un chetoso.
3) Fosforilazione del fruttosio-6-fosfato a fruttosio-1,6-bisfosfato
Enzima: fosfofruttochinasi 1
Formazione della gliceraldeide 3-fosfato per scissione (4) e
isomerizzazione (5)
Enzima: aldolasi
Rottura del fruttosio 1,6-bisfosfato
Scissione del fruttosio 1,6-bisfosfato in
glicaraldeide 3-fosfato e diidrossiacetone fosfato.
I prodotti delle restanti tappe della glicolisi sono
costituiti da unità a tre atomi di carbonio anziché
da unità a sei atomi di carbonio.
L’enzima aldolasi è così chiamato in base alla
natura della reazione inversa, una condensazione
aldolica.
DHAP= diidrossiacetone fosfato
GAP= gliceraldeide 3-fosfato
5) Interconversione dei trioso fosfato
Enzima: trioso fosfato isomerasi
Struttura della trioso fosfato isomerasi
8 filamenti β circondati da 8 α eliche: il barile αβ
Meccanismo catalitico della trioso fosfato isomerasi
Il glutammato 165 trasferisce un protone tra gli atomi 1 e 2 con l’ausilio
dell’istidina 95.
L’istidina 95 facilita la catalisi donando un protone per stabilizzare la carica
negativa che si sviluppa sul gruppo carbonilico sull’atomo C-2.
La forma rara dell’istidina carica negativamente è stabilizzata da interazioni con
altre parti dell’enzima
Struttura della trioso fosfato isomerasi
L’ansa impedisce all’intermedio instabile enediolo di abbandonare l’enzima
chiudendo il sito attivo sino a quando l’isomerizzazione non è completata
Gli atomi C1, C2 e C3 diventano indistinguibili rispettivamente
dagli atomi C6, C5 e C4.
6) Ossidazione della gliceraldeide 3-fosfato a 1,3-bisfosfoglicerato
Enzima: Gliceraldeide 3-fosfato deidrogenasi
La fosforilazione è accoppiata all’ossidazione della gliceraldeide 3-fosfato
La reazione catalizzata dalla gliceraldeide 3-fosfato deidrogenasi è la somma di
due reazioni:
1) Ossidazione dell’aldeide a un acido
carbossilico ad opera del NAD+
(termodinamicamente favorevole)
2) Unione dell’ acido carbossilico e
dell’ortofosfato a formare un
acilfosfato (termodinamicamente
sfavorevole)
Se queste reazioni si svolgessero in
successione la seconda avrebbe
un’energia di attivazione troppo
alta per avvenire a velocità
significativa.
I due processi devono essere
accoppiati.
Struttura della gliceraldeide 3-fosfato deidrogenasi
Il sito attivo include un residuo di cisteina e un residuo di istidina adiacenti a
un NAD+ legato
Meccanismo catalitico della gliceraledeide 3-fosfato deidrogenasi
La reazione procede attraverso un intermedio tioestere, che permette che
l’ossidazione della gliceraldeide sia accoppiata alla fosforilazione del 3fosfoglicerato
L’intermedio tioestere ha un’energia libera più alta di quella
dell’acido carbossilico libero
Reazione non accoppiata
Reazione accoppiata
Reazione catalizzata dalla gliceraldeide 3-fosfato deidrogenasi
Lo iodoacetato è un potente inibitore della gliceraldeide 3fosfato deidrogenasi
7) Formazione dell’ATP dall’ 1,3-bisfosfoglicerato
Enzima: Fosfoglicerato chinasi
Idrolisi dell’ 1,3-bisfosfoglicerato
Il prodotto dell’idrolisi è il 3-fosfoglicerato il cui
gruppo carbossilico, dopo la formazione, può andare
incontro a dissociazione.
La ionizzazione e le strutture di risonanza rendono
possibile la stabilizzazione dei prodotti della reazione
idrolitica.
Un ulteriore contributo alla variazione di energia
libera è dovuto alla stabilizzazione per risonanza del
Pi.
…….formazione del piruvato e generazione della seconda
molecola di ATP (tappe 8, 9 e 10).
8) Conversione del 3-fosfoglicerato in 2-fosfoglicerato
Enzima: Fosfoglicerato mutasi
Meccanismo catalitico della fosfoglicerato mutasi
L’enzima viene inizialmente
fosforilato mediante
trasferimento di un gruppo
fosforico dal 2,3 BPG. Il 2,3
BPG si comporta da cofattore:
è necessario in piccole quantità
per iniziare il ciclo e poi viene
continuamente rigenerato dal
ciclo stesso.
Solo negli eritrociti il 2,3 BPG è
presente in alte concentrazioni
(5 mM) e regola l’affinità
dell’emoglobina per l’ossigeno
Sono necessarie quantità catalitiche di 2,3-bisfosfoglicerato per
mantenere un residuo di istidina del sito attivo in forma fosforilata
9) Deidratazione del 2-fosfoglicerato a fosfoenolpiruvato
Enzima: Enolasi
Si forma un enolo.
Un enolfosfato ha un elevato potenziale di trasferimento del gruppo fosforico;
Un estere fosforico di un normale alcol ha un potenziale di trasferimento del
gruppo fosforico basso.
Idrolisi del fosfoenolpiruvato
Piruvato
(forma enolica)
Piruvato
(forma chetonica)
Il prodotto dell’idrolisi può esistere in due forme tautomeriche,
mentre il reagente ha una sola forma, la forma enolica.
Il prodotto è più stabile del reagente.
10) Trasferimento del gruppo fosforico dal fosfoenolpiruvato
all’ADP (formazione della seconda molecola di ATP).
Tautomerizzazione del piruvato
Consumo e produzione di ATP nella glicolisi
Molecole di ATP
Reazione
Glucosio Æ Glucosio 6-fosfato
-1
Fruttosio 6-fosfato Æ Fruttosio 1,6-bisfosfato
-1
2 x 1,3-bisfosfoglicerato Æ 2 x 3-fosfoglicerato
+2
2 x Fosfoenolpiruvato Æ 2 x piruvato
+2
Resa complessiva
+2
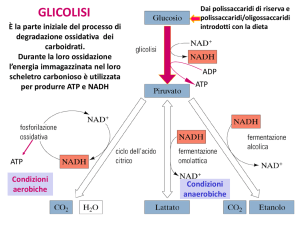
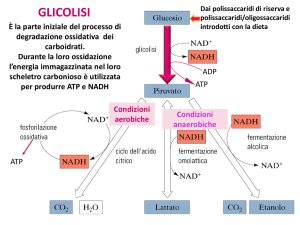
Glicolisi
Glucosio + 2 ATP + 2 NAD+ + 4 ADP + 2 Pi Æ 2 Piruvato + 2 ADP + 2 NADH + 2 H+ +
4 ATP + 2 H2O
semplificando i termini comuni
Glucosio + 2 NAD+ + 2 ADP + 2 Pi Æ 2 Piruvato + 2 NADH + 2 H+ + 2 ATP + 2 H2O
ΔGo’ = - 85 kj/mole
Gli intermedi glicolitici sono incanalati fra i siti attivi degli enzimi
Gli enzimi della glicolisi vengono considerati normalmente componenti solubili nel
citosol delle cellule, ma vi sono numerosi risultati sperimentali che tendono a suggerire
che questi enzimi all’interno della cellula esistano come complessi multienzimatici.
Quando una cellula viene aperta, per purificare gli enzimi citosolici, la diluizione della
soluzione del citosol contenente complessi proteici non covalenti favorisce la
dissociazione dei complessi nei suoi costituenti.
Incanalamento di un substrato tra due enzimi della via glicolitica
Differenti destini del piruvato.
Si forma etanolo a
partire dal piruvato
nei lieviti e in
parecchi
altri
microorganismi
Si forma lattato a
partire dal piruvato
in un’ampia gamma
di microorganismi, ed
anche nelle cellule
degli
organismi
superiori quando la
quantità di ossigeno è
limitante come nel
tessuto
muscolare
durante
l’attività
fisica intensa
Una quantità di energia
molto maggiore può essere
estratta
aerobicamente
mediante il ciclo dell’acido
citrico e la catena di
trasporto degli elettroni
La formazione e il consumo di NADH, localizzati entro la via glicolitica.
La fermentazione indica la degradazione anaerobica del
glucosio (e di altri nutrienti organici) per ottenere energia sotto
forma di ATP.
La fermentazione lattica
Nella fermentazione lattica (o lattacida) il
NAD+ viene rigenerato dal NADH
mediante la riduzione del piruvato a
lattato.
La fermentazione alcolica
I lieviti ed alcuni microorganismi
fermentano il glucosio ad etanolo e CO2.
La tiamina pirofosfato (TPP) e il suo ruolo nella decarbossilazione del piruvato
Protone acido, la sua
perdita
genera
un
carbanione
La tiamina pirofosfato è la forma coenzimatica della vitamina B1 (tiamina).
La TPP ha una funzione rilevante nelle reazioni in cui si ha la rottura di un
legame adiacente a un gruppo carbonilico.
La tiamina pirofosfato (TPP) e il suo ruolo nella decarbossilazione del piruvato
La tiamina pirofosfato (TPP) e il suo ruolo nella decarebossilazione del piruvato
1) Il carbanione della TPP agisce
come un nucleofilo, attaccando il
carbonio carbonilico del piruvato
2) In seguito alla decarbossilazione
si forma un carboanione. L’anello
tiazolico della TPP si comporta
come una trappola per elettroni,
stabilizzando il carbanione per
risonanza
Dopo la protonazione (3), il
prodotto
della
reazione,
l’acetaldeide, viene rilasciato (4) e
un protone si dissocia per
rigenerare il carbanione della TPP
(5)
Alcune reazioni in cui la tiamina pirofosfato è un cofattore essenziale
Il sito attivo dell’acol deidrogenasi
Il sito attivo contiene uno ione
zinco legato a due residui di
cisteina e a un residuo di istidina.
Lo ione zinco lega il substrato
acetaldeidico attraverso il suo
atomo di ossigeno, polarizzandolo
in modo che possa accettare più
facilmente un idruro dal NADH
Una fermentazione su scala industriale
Mantenimento dell’equilibrio redox
Vie di alimentazione della glicolisi
Rimozione del residuo di glucosio terminale dall’estremità non riducente di
una catena di glicogeno ad opera della glicogeno fosforilasi.
La glicogeno fosforilasi catalizza la reazione in cui il legame glicosidico
(α1Æ4), viene attaccato dal fosfato inorganico producendo il rilascio di
glucosio 1-fosfato.
Parte dell’energia del legame glicosidico viene conservata mediante la formazione
dell’estere fosforico nel glucosio 1-fosfato.
Demolizione del glicogeno vicino a un punto di ramificazione (α1Æ6)
Dopo la rimozione sequenziale dei residui
terminali di glucosio da parte della glicogeno
fosforilasi, i residui di glucosio vicini a una
ramificazione sono staccati mediante un
processo a due tappe che richiede l’azione di
un “enzima deramificate” bifunzionale.
Il glucosio 1-fosfato viene poi convertito in glucosio 6-fosfato dall’enzima
fosfoglucomutasi.
Glucosio 1-fosfato ' Glucosio 6-fosfato
Nel fegato è presente l’enzima Glucosio 6-fosfatasi che catalizza la reazione
Glucosio 6-fosfato + H2O ' Glucosio + Pi
La maggior parte del fruttosio viene metabolizzato dal fegato usando la via del
fruttosio 1, fosfato.
Fruttosio + ATP Æ Fruttosio 1-fosfato + ADP
enzima: fruttochinasi
- Il fruttosio 1-fosfato viene quindi convertito in gliceraldeide e diidrossiacetone fosfato
dalla fruttosio 1-fosfato aldolasi.
- Il diidrossiacetone fosfato viene poi convertito in gliceraldeide 3-fosfato dall’enzima
glicolitico trioso fosfato isomerasi.
- La gliceraldeide viene poi trasformata dalla trioso chinasi:
Gliceraldeide + ATP Æ Gliceraldeide 3-fosfato + ADP.
Il fruttosio può anche essere fosforilato a fruttosio 6-fosfato dall’esochinasi.
Nel muscolo, nel tessuto adiposo e nel rene questa è la via principale di utilizzo
del fruttosio.
Mannosio
Mannosio + ATP Æ Mannosio 6-fosfato + ADP
enzima: esochinasi
Il Mannosio 6-fosfato viene poi isomerizzato ad opera della fosfomannosio
isomerasi in fruttosio 6-fosfato.
Via di conversione del D-Galattosio 1-fosfato in D-Glucosio 1-fosfato
I disaccaridi della dieta vengono idrolizzati a monosaccaridi
Maltosio + H2O Æ 2 D-Glucosio
enzima: maltasi
Lattosio + H2O Æ D-Galattosio + D-Glucosio
enzima: lattasi
Saccarosio + H2O Æ D-Fruttosio + D-Glucosio
enzima: saccarasi
Trealosio + H2O Æ 2 D-Glucosio
enzima: trealasi
L’intolleranza al lattosio
La lattasi nell’endotelio intestinale:
Sebbene tutti i bambini possiedano una lattasi intestinale, molti di loro smettono
di produrre questo enzima da adulti diventando intolleranti al lattosio.
La lattasi può essere identificata trattando una fettina di tessuto intestinale con un
anticorpo che si lega in modo specifico a questo enzima.
a) Adulto che ha conservato alti livelli di lattasi
b) Adulto con un’intolleranza al lattosioi
Vie di alimentazione della glicolisi
Cancro e glicolisi
Le condizioni ipossiche esistenti all’interno di una massa tumorale
determinano l’attivazione del fattore di trascrizione inducibile dall’ipossia
(HIF-1), che induce l’adattamento metabolico (aumento degli enzimi glicolitici)
e attiva i fattori angiogenici che stimolano la crescita di nuovi vasi sanguigni.
Regolazione del catabolismo dei carboidrati
In ogni via metabolica vi è almeno una reazione che è lontana
dall’equilibrio a causa della bassa attività dell’enzima cha la
catalizza.
La velocità di questa reazione non è limitata dalla disponibilità
del substrato, ma soltanto dall’attività dell’enzima.
La reazione viene detta limitata dall’enzima e la velocità di
questa tappa determina quella della via nel suo complesso.
In genere queste tappe che limitano la velocità sono reazioni
molto esoergoniche e quindi irreversibili nelle condizioni
intracellulari.
Gli enzimi che catalizzano queste tappe esoergoniche che
limitano la velocità sono di solito il bersaglio delle regolazioni
metaboliche.
Glicolisi e gluconeogenesi sono regolate in modo coordinato
PFK-1 = fosfofruttochinasi -1; FBPase-1 = fruttosio 1,6-bisfosfatasi.
Tre reazioni della glicolisi sono così esoergoniche da essere praticamente irreversibili;
sono quelle catalizzate dalla esochinasi, dalla PFK-1 e dalla piruvato chinasi.
L’esochinasi del muscolo viene inibita allostericamente dal suo prodotto, il glucosio 6fosfato
I mammiferi hanno diverse forme di esochinasi, tutte capaci di catalizzare la
conversione del glucosio in glucosio 6-fosfato. Proteine diverse in grado di catalizzare la
stessa reazione sono dette isoenzimi.
La forma predominante di esochinasi nel fegato è l’esochinasi D, detta anche
glucochinasi
La glucochinasi continua a fosforilare il glucosio anche se i livelli di glucosio 6-fosfato
sono elevati.
La glucochinasi ha una elevata KM per il glucosio e diventa efficiente quando il glucosio
è abbondante.
La funzione della glucochinasi epatica è quella di fornire glucosio 6-fosfato per la sintesi
del glicogeno.
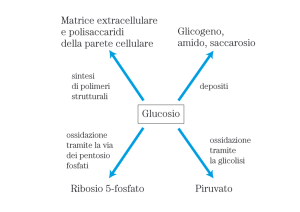
Il glucosio 6-fosfato non è solo un intermedio della glicolisi (¼glicogeno, via dei
pentosio-fosfato).
La prima reazione irreversibile utilizzata dalla sola via glicolitica è la fosforilazione del
fruttosio 6-fosfato a fruttosio 1,6-bisfosfato.
La fosfofruttochinasi-1 è il principale sito di controllo della glicolisi
La fosfofruttochinasi - 1 è il principale elemento di regolazione della via
glicolitica nei mammiferi.
L’enzima del fegato viene inibito da elevate concentrazioni di ATP.
Struttura della fosfofruttochinasi 1
Elevate concentrazioni di ATP fanno
diminuire l’affinità dell’enzima per
il substrato fruttosio 6-fosfato.
L’azione inibitrice dell’ATP viene
abolita dall’AMP.
Perché l’AMP e non l’ADP?
Quando l’ATP viene utilizzato
rapidamente, l’adenilato chinasi può
formare ATP a partire da ADP:
ADP + ADP ' ATP + AMP
L’AMP è il segnale per lo stato a
bassa energia.
-Elevate concentrazioni di ATP fanno diminuire l’affinità dell’enzima per il substrato
fruttosio 6-fosfato.
-L’azione inibitrice dell’ATP viene abolita dall’AMP.
-La fosfofruttochinasi -1 è inibita dal citrato, il primo intermedio del ciclo dell’acido
citrico.
Elevati livelli di citrato indicano che le necessità energetiche e la richiesta di metaboliti
per le vie biosintetiche sono soddisfatte.
Il principale regolatore allosterico della fosfofruttochinasi-1 (PFK-1) è il
fruttosio 2,6 bisfosfato.
Il fruttosio 2,6 bisfosfato è un potente attivatore della PFK-1.
Il fruttosio 2,6 bisfosfato si forma dal fruttosio 6-fosfato ad opera della
fosfofruttochinasi 2 (PFK-2)
Il fruttosio 2,6 bisfosfato viene idrolizzato a fruttosio 6-fosfato da una specifica
fosfatasi la fruttosio 2,6 bisfosfatasi (Fbasi-2)
La fosfofruttochinasi 2 e la fruttosio 2,6 bisfosfatasi sono presenti in una unica
catena polipeptidica (detta enzima tandem) e sono reciprocamente regolate
dalla fosforilazione di un residuo di serina.
Proteina fosforilata ↑ attività fosfatasica
Proteina defosforilata ↑ attività chinasica
Regolazione della sintesi e della degradazione del fruttosio 2,6-bisfosfato
Una diminuzione della concentrazione del glucosio ematico, segnalato dal glucagone,
determina la fosforilazione dell’enzima bifunzionale (aumento attività fosfatasica) e
quindi fa diminuire la concentrazione di fruttosio 2,6-bisfosfato, rallentando la glicolisi.
Un aumento della concentrazione di fruttosio 6-fosfato, che segue ad un aumento del
glucosio ematico, accellera la formazione di fruttosio 2,6-bisfosfato facilitando la
defosforilazione dell’enzima (aumento dell’attività chinasica).
La piruvato chinasi viene inibita da concentrazioni elevate di ATP
L’ATP inibisce la piruvato chinasi allostericamente, diminuendo l’affinità
dell’enzima per il suo substrato, il fosfoenolpiruvato.
La piruvato chinasi viene anche inibita dall’Acetil-CoA e dagli acidi grassi a
catena lunga, importanti combustibili per il ciclo dell’acido citrico.
Regolazione della glicogeno fosforilasi
La glicogeno fosforilasi è regolata
da più effettori allosterici che
segnalano lo stato energetico della
cellula nonché dalla fosforilazione
reversibile che risponde a segnali
ormonali quali l’insulina, il
glucagone e l’adrenalina.
Strutture della fosforilasi a e della fosforilasi b
La glicogeno fosforilasi a è fosforilata sulla serina 14 di ciascuna subunità.
Questa modificazione favorisce la struttura dello stato R più attivo.
Attivazione della fosforilasi chinasi
Nel muscolo il fine ultimo della glicolisi è la produzione di ATP
Il fegato ha il ruolo di mantenere costante il livello di glucosio nel sangue
producendo ed esportando questo metabolita ai tessuti che lo richiedono, e
importandolo e conservandolo quando viene introdotto in eccesso con la dieta.
Muscolo
La fosforilasi b muscolare è attiva in presenza di elevate concentrazioni di
AMP, che si lega a un sito di legame per i nucleotidi presente su entrambe le
subunità e stabilizza la conformazione della fosforilasi b nello stato R.
La glicogeno fosforilasi del fegato è un sensore per il glucosio.
Il legame del glucosio sposta
l’equilibrio
allosterico
della
glicogeno fosforilasi a epatica dallo
stato R (attivo) allo stato T (meno
attivo).
Se è presente glucosio libero
derivante da qualche altra fonte
come la dieta, non è necessario
mobilitare il glicogeno.
Il metabolismo secondario del glucosio
Vie cataboliche che, partendo dal glucosio, portano alla formazione di prodotti
specializzati necessari alla cellula.
La via del pentoso fosfato
- produce NAPDH e Ribosio 5-fosfato.
Glucosio 6-fosfato + 2 NADP+ + H2O Æ Ribosio 5-fosfato + CO2 + 2 NADPH + 2 H+
Il NAPDH è necessario per le reazioni di biosintesi
Il Ribosio 5-fosfato è un precursore nella sintesi dei nucleotidi
(presente in: ATP, CoA, NAD+, FAD, DNA, RNA)
I trasportatori di elettroni derivati dalla nicotinamide
Il NADH viene ossidato dalla catena respiratoria per generare ATP
Il NADPH serve come donatore di elettroni nelle biosintesi riduttive
Le reazioni ossidative della via del pentoso fosfato (a)
Le reazioni ossidative della via del pentoso fosfato (b)
La via del pentoso fosfato è molto attiva nel tessuto adiposo in cui è attiva la
biosintesi degli acidi grassi che richiede potere riducente nella forma di
NADPH.
L’attività della via del pentoso fosfato è molto bassa nel muscolo scheletrico.
La via del pentoso fosfato
Reazione
Enzima
Parte ossidativa
Glucosio 6-fosfato + NADP+ Æ
Æ 6-fosfoglucono-δ-lattone + NADPH + H+
Glucosio 6-fosfato
deidrogenasi
6-fosfoglucono-δ-lattone + H2O Æ
Æ 6-fosfogluconato + H+
Lattonasi
6-fosfogluconato + NADP+ Æ
Æ ribuloso 5-fosfato + CO2 + NADPH
6-fosfogluconato
deidrogenasi
La via del pentoso fosfato
Nei tessuti che richiedono più NADPH per le biosintesi riduttive che ribosio 5fosfato da incorporare nei nucleotidi, il ribosio 5-fosfato viene convertito in
gliceraldeide 3-fosfato e fruttosio 6-fosfato (reazioni non ossidative della via del
pentoso fosfato).
3 ribosio 5-fosfato ' 2 fruttosio 6-fosfato + gliceraldeide 3-fosfato
Il ribosio 5-fosfato formato in eccesso dalla via del pentoso fosfato può essere
completamente convertito in intermedi glicolitici.
Il fruttosio 6-fosfato e la gliceraldeide 3-fosfato sono anche intermedi della via
gluconeogenetica.
La via del pentoso fosfato
Reazione
Enzima
Parte non ossidativa
riboso 5-fosfato ' ribuloso 5-fosfato
Fosfopentoso isomerasi
ribuloso 5-fosfato ' xiluloso 5-fosfato
Fosfopentoso epimerasi
xiluloso 5-fosfato + riboso 5-fosfato '
' sedoeptulosio 7-fosfato + gliceraldeise 3-fosfato
Transchetolasi
sedoeptulosio 7-fosfato + gliceraldeise 3-fosfato '
' fruttoso 6-fosfato + eritroso 4-fosfato
Transaldolasi
Xiluloso 5-fosfato + eritroso 4-.fosfato '
' fruttoso 6-fosfato + glicaraldeide 3-fosfato
Transchetolasi
Parte non ossidativa della via del pentoso fosfato
transchetolasi
C5 + C5
'
C 3 + C7
transaldolasi
C 7 + C3
'
C 4 + C6
transchetolasi
C 5 + C4
'
C 3 + C6
Parte non ossidativa della via del pentoso fosfato
transchetolasi
C5 + C5
'
C 3 + C7
transaldolasi
C 7 + C3
'
C4 + C6
transchetolasi
C 5 + C4
'
C3 + C6
Il risultato complessivo di queste reazioni è la formazione di due esosi e di un
triosio a partire da tre pentosi :
3 C5
'
2 C 6 + C3
C5 + C5
'
C 3 + C7
transchetolasi
Il donatore dell’unità bicarboniosa è lo xilulosio 5-fosfato,
un epimero del ribulosio 5-fosfato. Un chetosio è un
substrato della transchetolasi soltanto se il gruppo
ossidrilico su C-3 ha la configurazione dello xilulosio
anziché del ribulosio.
Il ribulosio 5-fosfato viene convertito nell’epimero
appropriato per la reazione della transchetolasi dalla
fosfopentosio epimerasi.
C3
C5 + C5
'
C 3 + C7
transchetolasi
C 7 + C3
'
transaldolasi
Intermedio
glicolitico
C4 + C6
C 5 + C4
'
C3 + C6
transchetolasi
Intermedi
glicolitici
La via del pentoso fosfato
Via del pentosio fosfato
La somma delle reazioni della via del pentosio fosfato è:
2 Xilulosio 5-fosfato + ribosio 5-fosfato '
2 fruttosio 6-fosfato + gliceraldeide 3-fosfato
Lo xilulosio 5-fosfato può essere formato a partire da ribosio 5-fosfato ad opera
dell’azione sequenziale della fosfopentosio isomerasi e della fosfopentosio
epimerasi pertanto:
3 Ribosio 5-fosfato ' 2 fruttosio 6-fosfato + gliceraldeide 3-fosfato
L’eccesso di ribosio 5-fosfato formato dalla via del pentosio fosfato può essere
completamente convertito in intermedi glicolitici.
Inoltre, grazie alla via del pentosio fosfato:
- Ogni molecola di ribosio ingerita nella dieta può essere convertita in
intermedi glicolitici.
- Gli scheletri carboniosi degli zuccheri possono essere riarrangiati per
soddisfare esigenze fisiologiche
Regolazione della via del pentoso fosfato
Il glucosio 6-fosfato viene metabolizzato sia dalla via glicolitica sia dalla via del
pentosio fosfato.
La regolazione della via del pentoso fosfato avviene al livello della prima
reazione, la deidrogenazione del glucosio 6-fosfato, che è una reazione
irreversibile.
Il fattore di regolazione più importante è il livello di NADP+, l’accettore di
elettroni in questa reazione catalizzata dalla glucosio 6-fosfato deidrogenasi.
La parte non ossidativa della via del pentoso fosfato è controllata
principalmente dalla disponibilità dei substrati.
Metabolismo del glucosio 6-fosfato in 4 differenti condizioni metaboliche:
Quattro modi della via del pentoso fosfato
Modo 1: E’ necessario molto più ribosio 5-fosfato che NADPH
Es.: cellule in rapida divisione necessitano di ribosio 5-fosfato per la sintesi di DNA
Modo 2: Il fabbisogno di NADPH e quello di ribosio 5-fosfato
sono bilanciati
Modo 3: E’ necessario più NADPH che ribosio 5-fosfato
Es.: il tessuto epatico richiede una elevata concentrazione di NADPH per la sintesi
di acidi grassi.
La via gluconeogenetica
risintetizza glucosio
6-fosfato
Modo 4: Sono necessari sia NADPH che ATP
Il glucosio può essere trasformato in acido glucuronico
L’acido glucuronico è importante nella detossificazione e nell’escrezione di
composti organici estranei
L’UDP-glucuronato è il donatore di
unità glucuronosidiche utilizzato da
una famiglia di enzimi detossificanti
che agiscono su composti non polari
come molte tossine ambientali e
carcinogeni
La coniugazione di questi composti
con il glucuronato (glucuronazione)
produce derivati più polari rimossi
più facilmente dal sangue da parte
dei reni.
Un modo alternativo per generare energia è una variazione della respirazione
in cui l’accettore finale di elettroni è diverso dall’ossigeno
(respirazione anaerobica)
Un secondo sistema di generazione di energia prevede il ricorso a sostanze chimiche
inorganiche invece che organiche. Gli organismi in grado di utilizzare sostanze chimiche
inorganiche come donatori di elettroni sono un tipo di chemiotrofi detti chemiolitotrofi.
Esempi di donatori di elettroni inorganici sono : l’idrogeno solforato (H2S), l’idrogeno
gassoso (H2), il ferro ferroso (Fe2+) e l’ammoniaca (NH3)
I chemiolitotrofi hanno dei sistemi di trasporto degli elettroni simili a quelli dei
chemioorganotrofi e determinano una forza protomotrice che porta alla sintesi di ATP.
L’ossidazione dell’idrogeno.
Diversi chemiolitotrofi sono in grado di utilizzare come donatore di elettroni l’idrogeno,
H2, un prodotto moilto comune del metabolismo microbico.
Bioenergetica negli
idrogenobatteri aerobi
La riduzione del solfato.
Oltre all’idrogeno (H2) l’idrogenasi
può anche sfruttare H2 che si genera
dal catabolismo dei composti
organici come il lattato e il piruvato.
Un gran numero di microorganismi, così come le piante verdi, sono fototrofi, usano cioè
la luce come fonte di energia nel processo di fotosintesi.