IL LEGAME A IDROGENO
Il legame a idrogeno, come le forze di dispersione (presenti in tutti gli atomi o molecole) e le forze
dipolo-dipolo (presenti solo nelle molecole polari), sono forze intermolecolari che agiscono tra le
molecole, a differenza dei legami chimici che si manifestano all’interno di una stessa molecola e
sono in genere più forti del legame a idrogeno. Quest’ultimo è un caso particolare di interazione
fra dipoli ed è la forza intermolecolare più forte, infatti le sostanze costituite da molecole che
formano legami a idrogeno hanno punti di fusione e di ebollizione più alti rispetto a quello che ci si
aspetterebbe considerando il loro peso molecolare. Il legame a idrogeno lo troviamo quando le
molecole polari che contengono atomi di idrogeno si legano direttamente a fluoro (F), ossigeno (O)
o azoto (N), elementi molto elettronegativi che attraggono a sé gli elettroni di valenza, acquisendo
una parziale carica negativa (delta -) e lasciando l'idrogeno con una parziale carica positiva
(delta+). Il legame a idrogeno è dovuto alla grande differenza di elettronegatività tra l’idrogeno e
questi elementi, e alla dimensioni ridotte degli atomi di questi ultimi dando origine a una forte
attrazione tra l’idrogeno di ciascuna delle molecole e gli atomi di fluoro, ossigeno o azoto. Questo
legame viene, in genere, rappresentato come una linea tratteggiata tra l’idrogeno e l’altro atomo
elettronegativo.
Ad esempio, nel metanolo sono presenti legami a idrogeno in cui l’idrogeno direttamente legato
all’ossigeno è attratto fortemente dall’atomo di ossigeno della molecola adiacente e ciò provoca un
elevato punto di ebollizione del metanolo (64,7) e di conseguenza il fatto che esso sia liquido a
temperatura ambiente.
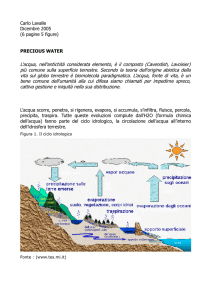
Un altro esempio di legame idrogeno lo troviamo nelle molecole di acqua che interagiscono l’una
con l’altra attraverso l’attrazione di una coda positiva (l’idrogeno) con una testa negativa
(l’ossigeno). Più precisamente, un atomo di idrogeno, legato all'ossigeno in una molecola di acqua,
forma legame idrogeno con l’atomo di ossigeno di un’altra molecola, facendo da ponte fra i due
atomi di ossigeno. Nell’acqua questo legame è presente sia allo stato liquido sia allo stato solido
ed è responsabile del suo punto di ebollizione a 100 °C nonostante questa abbia un peso
molecolare basso (18,02). In particolare, senza il contributo dei legami idrogeno, l'acqua bollirebbe
a -100 °C. Le molecole di acqua, inoltre, possono interagire con moltissime sostanze attraverso
legami idrogeno. Per esempio, esse interagiscono sia con i soluti polari, determinandone la
solubilità, sia con macromolecole biologiche, come proteine ed acidi nucleici determinandone la
conformazione in soluzione
Esempio di legami a idrogeno tra molecole di acqua.
Il legame a idrogeno spiega anche il motivo per cui la densità del ghiaccio è inferiore a quella
dell'acqua. Infatti quando l'acqua congela le molecole sono costrette a distanziarsi per formare la
struttura esagonale ordinata tipica del ghiaccio meno densa della struttura disordinata tipica
dell'acqua allo stato liquido.
Nel DNA, i legami idrogeno fra le basi azotate di due filamenti sono responsabili della struttura a
doppia elica. Anche se l’energia necessaria per rompere il singolo legame idrogeno è piccola, in
condizioni fisiologiche la struttura a doppia elica è stabilizzata proprio dal numero elevatissimo di
legami idrogeno presenti.
L'esistenza di tale legame, inoltre, si riflette su alcune proprietà fisiche delle sostanze interessate.
Il fluoruro di idrogeno è formato da molecole HF. A causa della forte differenza di elettronegatività
tra H e F, si forma un legame idrogeno tra l’atomo di idrogeno di una molecola e l'atomo di fluoro di
una molecola vicina. A causa della presenza di numerosi legami idrogeno tra le molecole, HF ha
un punto di ebollizione più alto di quello di altre molecole (HCl, HBr, HI) contenenti elementi dello
stesso gruppo del Sistema periodico, ma più pesanti e meno elettronegativi. A temperatura vicina
a quella ambiente, HF è un liquido, mentre HCl, HBr, e HI sono gassosi.