LA POTENZIOMETRIA
I metodi potenziometrici di analisi si basano sulla misura del potenziale di celle
elettrochimiche in condizioni di assenza di corrente. Per molti anni la tecnica
potenziometrica è stata utilizzata per localizzare il punto finale di una titolazione.
La strumentazione richiesta per i metodi potenziometrici è relativamente semplice
ed economica; infatti necessita di un elettrodo di riferimento, un elettrodo
indicatore ed un sistema che misuri il potenziale.
Qualsiasi analisi chimica basata sull’ utilizzo della potenziometria prevede la misura
della differenza di potenziale fra i due elettrodi di una cella elettrochimica.
Una cella elettrochimica è un dispositivo che può convertire l’energia derivante da
una reazione chimica in energia elettrica o che può far avvenire una reazione non
spontanea convertendo energia elettrica in energia chimica.
Nel primo caso si parla di cella galvanica ed un esempio tipico è quello della
batteria, mentre nel secondo caso si parla di cella di elettrolisi ed un tipico esempio
è quello dell’elettrolisi dell’acqua processo attraverso il quale si ottengono
idrogeno e ossigeno gassosi.
In entrambi i casi si verificano reazioni di ossidoriduzione in cui avviene un
trasferimento di elettroni: la specie che si ossida perde elettroni mentre quella che
si riduce li acquista e ciò comporta un passaggio di elettroni.
In una cella galvanica è presente un ponte salino (costituito da un elettrolita) che
viene interposto tra le due semicelle al fine di garantire il contatto ionico tra le due
soluzioni e l’elettroneutralità delle stesse garantendo il passaggio di ioni da una
semicella all’altra. Il ponte salino può essere sostituito da un setto poroso che abbia
analoghe caratteristiche di transitabilità ionica. In assenza di ponte salino la reazione
si arresta e conseguentemente il flusso di elettroni.
La Pila di Daniell è una cella galvanica costituita da due semicelle in una delle quali
è presente un elettrodo di zinco immerso nei suoi ioni (soluzione contenente ZnSO4)
mentre nell’altra è presente un elettrodo di rame immerso nei suoi ioni (soluzione
di CuSO4).
Nella prima semicella lo zinco si ossida: Zn(s) → Zn2+(aq) + 2 e– quindi l’elettrodo
di zinco man mano che la reazione decorre si assottiglia. Lo zinco funziona da polo
negativo: per convenzione infatti si assegna il segno – all’elettrodo che cede
elettroni. I due elettroni ceduti dallo zinco attraverso il conduttore metallico
giungono all’elettrodo di rame che in tal modo viene ad essere carico
negativamente (anodo). Gli ioni rame contenuti nella soluzione di solfato di rame
(II) si depositano sull’elettrodo di rame a seguito della semireazione di riduzione
Cu2+(aq) + 2 e–→ Cu(s) quindi l’elettrodo di rame si inspessisce. Il rame funziona
da polo positivo (catodo)
La reazione redox complessiva è Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Nel ponte salino sono contenuti ioni positivi e negativi così per garantire
l’elettroneutralità i cationi presenti nel ponte salino migrano nella semicella
contenente l’elettrodo di rame per rimpiazzare gli ioni Cu2+ che si riducono mentre
gli anioni presenti nel ponte salino migrano nella semicella contenente l’elettrodo
di zinco per controbilanciare la carica positiva degli ioni zinco che si formano
durante il processo.
Elettrodo di riferimento
Nelle analisi potenziometriche è necessario utilizzare un elettrodo in cui il potenziale
rimanga costante e noto per tutta la durata dell’analisi, ciò in relazione al fatto che
il potenziale non può essere definito come valoro assoluto ma relativo.
Elettrodo ad idrogeno, che è un ottimo elettrodo ma
troppo scomodo per un uso generale, infatti si richiede
l’uso di H2, ed intorno all’elettrodo è necessario
mantenere la pressione di 1 bar; inoltre l’elettrodo deve
essere rivestito di Pt, definito platino nero perché molto
poroso, ma grazie alla sua porosità oltre ad assorbire H+
e H2 assorbe anche altri ioni determinando
l’ “avvelenamento” dell’elettrodo.
Più utilizzati: elettrodo a calomelano ed elettrodo Ag/AgCl
Elettrodo a calomelano è formato da mercurio a contatto con
una soluzione satura di Hg2Cl2 (calomelano)
Le due semicelle sono così rappresentate:
Hg⎹ Hg2Cl2(sat), KCl(x M) ⎹⎹
Dove x rappresenta la concentrazione M del KCl nella soluzione.
Il potenziale elettrodico per questa semicella è determinato dalla reazione
Hg2Cl2 (s) + 2 e-
⥄ 2 Hg(l) + 2 Cl-
e dipende dalla concentrazione x del cloruro.
Pertanto nel descrivere l’elettrodo, si deve specificare la concentrazione di KCl.
L’elettrodo a calomelano saturo (SCE) è il più utilizzato.
Elettrodo argento/cloruro di argento
E’ il sistema di elettrodi più venduto ed è costituito
da un elettrodo di argento immerso in una
soluzione di KCl saturata di AgCl:
Ag⎹ AgCl(sat), KCl(x M) ⎹⎹
Il potenziale elettrodico: AgCl (s) + e-
⥄ Ag(s) + Cl-
Elettrodi indicatori: sono gli elettrodi che rispondono in modo rapido e
riproducibile alla variazione della attività (concentrazione) degli ioni dell’analita. Per
quanto nessun elettrodo indicatore sia assolutamente specifico nella risposta ne
esistono in commercio alcuni molto selettivi. Esistono due tipi di elettrodi indicatori:
metallici e a membrana;
Metallici: prima, seconda, terza specie ed indicatori redox inerti.
Prima specie sono quelli costituiti da un metallo puro in equilibrio diretto con il
suo catione in soluzione; in questo caso è implicata una singola reazione; ad
esempio per un elettrodo indicatore di rame si potrà scrivere:
Cu+2 +2e- ⥄ Cu(s), quindi il potenziale dell’elettrodo
𝐸𝑖𝑛𝑑= − 0.059 𝑙𝑜𝑔
2
1
𝐶𝑢2+
Questo tipo di elettrodi non trovano largo impiego poiché sono poco selettivi ed
in taluni casi possono essere utilizzati solo a valori di pH particolari.
Elettrodi di seconda specie: sono quelli in cui il metallo può essere utilizzato come
indicatore per il suo catione ma risente anche della variazione della concentrazione
degli anioni che formano con il metallo precipitati poco solubili o complessi molto
stabili. Ad esempio un elettrodo ad argento può servire come elettrodo di seconda
specie per gli anioni alogenuri.
Elettrodo di terza specie: è un elettrodo di metallo costruito per rispondere ad un
catione differente: ad esempio un elettrodo a mercurio può essere utilizzato per la
determinazione dello ione Calcio.
Elettrodi indicatori per metalli redox: sono elettrodi costituiti di metalli quali Pt,
oro, palladio ed altri metalli inerti utilizzati nelle reazioni redox.
Elettrodi a membrana: gli elettrodi a membrana vengono anche definiti elettrodi
iono-selettivi (o elettrodi a p-ione) a causa della elevata selettività di molti di essi.
Il meccanismo generale mediante il quale in questi dispositivi si sviluppa un
potenziale iono-selettivo dipende dalla natura della membrana ed è completamente
differente dalla sorgente di potenziale degli elettrodi indicatori metallici nei quali,
il potenziale ha origine dalla tendenza di una reazione di ossido-riduzione ad
avvenire sulla superficie dell’elettrodo. Negli elettrodi a membrana, invece il
potenziale osservato è una specie di potenziale di giunzione che si sviluppa
attraverso la membrana che separa la soluzione di analita da una soluzione di
riferimento.
Proprietà delle membrane iono-selettive: tutte le membrane possiedono delle
proprietà comuni che sono:
-
Solubilità minima: indispensabile proprietà di un mezzo iono selettivo è che
sia insolubile nelle soluzioni dell’analita; pertanto molte membrane sono formate
da grandi aggregati molecolari come vetri silicei o resine polimeriche;
-
Conducibilità elettrica: una membrane deve mostrare una certa conducibilità
elettrica per quanto piccola; tale conducibilità è dovuta alla migrazione di ioni a
carica singola all’interno della membrana;
-
Reattività selettiva con l’analita: una membrana o alcune specie contenute
all’interno della matrice della membrana devono essere in grado di legare
selettivamente lo ione analita; i tipi di legame sono scambio ionico, cristallizzazione
e complessazione i primi due sono i più comuni.
Elettrodi a membrana di vetro – misura del pH.
L’elettrodo a vetro per la misura del pH rappresenta l’elettrodo iono-selettivo di più
vasto impiego. Esso consiste in una sottile membrana di vetro speciale, che è
l’elemento dell’elettrodo effettivamente sensibile al pH, saldata all’estremità di un
tubo resistente in plastica o vetro. Nel tubo è contenuta una soluzione con attività
nota e costante di ione H+ saturata con AgCl. Un filo di argento rivestito di AgCl
immerso nella soluzione forma un elettrodo di riferimento ad Ag/ AgCl, che viene
utilizzato per collegare l’elettrodo ad uno dei terminali del potenziometro.
Il cosiddetto modello “combinato” dell’elettrodo
a vetro porta, per comodità, una seconda camicia
contenente
l’elettrodo
e
la
soluzione
di
riferimento esterni, che comunicano con la
soluzione esterna tramite un setto poroso. Si
tratta a tutti gli effetti di una coppia di elettrodi,
e il cavo che va allo strumento porta sul centrale
il segnale dell’elettrodo a vetro e sulla guaina metallica esterna il segnale
dell’elettrodo di riferimento.
Il vetro: Una membrana di vetro di spessore molto esiguo (0,003- 0,1mm) separa
due soluzioni elettrolitiche. Su di essa si può rilevare (tramite due elettrodi di
riferimento) una differenza di potenziale che dipende in maniera riproducibile e
definita dalle attività dell’idrogeno o di altri ioni presenti negli elettroliti.
Cambiando la composizione del vetro: – Potenziale dipendente in maniera
logaritmica dall’attività di uno ione specifico, trascurando l’attività di altri ioni.
Principio di funzionamento: – I vetri silicati sono composti da una rete di atomi di
silicio posti al centro di tetraedri formati da quattro atomi di ossigeno. La bontà di
un elettrodo a vetro è determinata essenzialmente dalle proprietà della membrana
di vetro.
Un buon vetro per membrana deve soddisfare le seguenti esigenze:
• resistenza elettrica non troppo alta;
• operatività su un range di pH il più ampio possibile;
• stabilità chimica;
• lavorabilità alla soffieria.
Il meccanismo microscopico di funzionamento di questi vetri speciali è legato alle
proprietà di trasporto della membrana e in particolare ad un equilibrio di scambio
degli ioni sodio nel materiale siliceo con i protoni delle soluzioni interna ed esterna;
Tutti gli elettrodi a vetro per pH danno potenziali stabili e riproducibili solo dopo
averli lasciati immersi in acqua per qualche tempo. Durante tale “tempo
d’idratazione” ioni Na + diffondono dal vetro nella soluzione, venendo soppiantati
da ioni H+ provenienti dalla soluzione. Lo strato di gel risultante si estende da 10
a 1000 Å all’interno del vetro ed è di fondamentale importanza per il
comportamento elettrochimico del vetro. Gli elettrodi a vetro vanno dunque
conservati immersi in acqua o in una soluzione debolmente acida.
Soluzione
interna
Ei
Ed
Ed
Ee
Strato di gel
idratato
Vetro interno
“secco”
Strato di gel
idratato
Soluzione
esterna
Tutti i vetri vanno infatti soggetti
- ad un “errore acido” che si manifesta
nel campo delle attività di H+ più alte
(in pratica, a pH < 0.5) e in questo caso
dà luogo a letture più alte dei valori
veri.
- ad un “errore alcalino ” da collegarsi
alla loro sensibilità ai cationi dei metalli
alcalini (litio, sodio, potassio, bario...) che, sia pur limitatissima, si fa sentire dove gli
ioni H+ sono diluitissimi (pH 13 −14), e che ha per effetto una lettura di pH più
bassa del valor vero. Questo errore viene molto ridotto, ma non completamente
eliminato, sostituendo nel vetro l’ossido di sodio con ossido di litio.
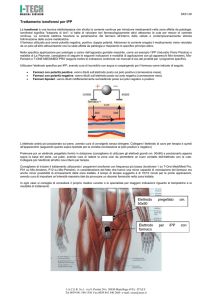
Forma dell’elettrodo
La forma a sfera è quella che offre la massima superficie di
contatto con la soluzione, e quindi la minima resistenza. E’
dunque quella più raccomandabile per le misure in
soluzione. E’ però fragile e richiede cautele nel suo utilizzo.
Per questi motivi è usata soprattutto in laboratorio.
La forma a cono è vista come applicabile in praticamente
ogni campo perché è robusta, facile da pulire e di media
resistenza. Non raggiunge tuttavia le prestazioni della forma
a sfera.
La forma a cilindro è simile a quella a cono, ma un poco
più robusta; ha anch’essa media resistenza.
La forma a cupola è adatta per processi in cui occorre misurare il pH online, con
procedure automatiche di pulitura dell’elettrodo, perché è particolarmente
resistente agli urti; ha però piccola area di contatto col campione e quindi alta
resistenza.
La forma piatta è ideale per i monitoraggi in continuo e con soluzioni contenenti
sostanze molto aggressive, perché la sua geometria contrasta la formazione di
depositi che possano sporcare l’elettrodo, minimizzando la manutenzione richiesta.
E’ anche la scelta più ovvia per misure dirette sulla superficie di pelle, cuoio, carta,
etc. Però come la forma a cupola ha elevata resistenza
La forma a lancia è raccomandata per la misura del pH in materiali semisolidi.
Tipiche applicazioni sono carne, salumi, formaggi e terreni.
Gli elettrodi a vetro vengono costruiti in varie forme e dimensioni, a seconda
dell’uso (la casistica delle loro applicazioni è sterminata). Alcuni sono così piccoli da
consentire ad esempio la misura del pH nei tubi NMR o nelle cuvette per
spettroscopia, ovvero del sangue direttamente in vena.