Analisi dell'adattamento in soluzioni acide
di batteri gram positivi e negativi
Lavoro di maturità in biologia
Anno 2010 / 2011
Prof. Davide Speziga
Stefania Battaglioni
Liceo cantonale Bellinzona
Sommario
1
Introduzione ................................................................................................................................. 1
2
Alla ricerca dei due organismi viventi ......................................................................................... 2
2.1
La sistematica nel tempo ....................................................................................................... 2
2.2
Cellule eucariote e procariote ................................................................................................ 5
2.3
I batteri gram positivi e gram negativi.................................................................................. 8
2.3.1
Gram negativi ................................................................................................................ 9
2.3.2
Gram positivi ................................................................................................................10
2.4
L'adattamento.......................................................................................................................11
2.5
pH e omeostasi ......................................................................................................................12
2.6
Spinte ....................................................................................................................................17
2.7
Crescita dei batteri ...............................................................................................................17
3
Domanda ......................................................................................................................................19
4
Ipotesi di ricerca .......................................................................................................................20
4.1
Crescita delle colonie a un valore di pH 7 ............................................................................21
4.2
Crescita delle colonie da un valore di pH 7 a 3 ....................................................................21
4.2.1
Batteri gram positivi .....................................................................................................21
4.2.2
Batteri gram negativi ....................................................................................................22
4.3
5
7
Crescita delle colonie da un valore di pH 7 a 9 ....................................................................23
Indagine pratica .......................................................................................................................24
5.1
Selezione dei due tipi di batteri ............................................................................................24
5.2
Misura della crescita delle due colonie a pH 7 .....................................................................26
5.3
Misura della crescita delle due colonie a diversi valori di pH .............................................28
6.1
Elaborazione dei risultati .....................................................................................................30
Discussione ...................................................................................................................................34
7.1
Crescita delle colonie da un valore di pH 7 a 3 ....................................................................34
7.1.1
Batteri gram positivi .....................................................................................................34
7.1.2
Batteri gram negativi ....................................................................................................35
7.2
Un’ulteriori ipotesi ...............................................................................................................36
7.2.1
Crescita delle colonie da un valore di pH 7 a 9 ............................................................36
8
Conclusioni ..................................................................................................................................42
9
Bibliografia ..................................................................................................................................44
10
Allegati .........................................................................................................................................47
Stefania Battaglioni
LaM Biologia
2010/2011
1 Introduzione
Nel seguente lavoro intendo indagare la capacità di adattamento in soluzioni acide di due tipi di
batteri diversi, uno appartenente al gruppo dei gram positivi e l'altro ai gram negativi.
Nella teoria del sapere scientifico che ho consultato non ho trovato una vera e propria definizione
di "capacità di sopravvivere in soluzioni acide", bensì una serie di concetti, principi, situazioni
che ruotano attorno ad essa. È dunque necessario fornire al lettore, in una prima parte teorica,
una spiegazione dei concetti chiave che mi hanno permesso di costruire un modello che potesse
interpretare il fenomeno. Illustrerò in che modo la classificazione degli esseri viventi mi ha
permesso di scegliere i due organismi implicati nella mia ricerca, spiegando le caratteristiche che
differenziano gli organismi eucarioti dai procarioti, focalizzando poi l'attenzione sui batteri, in
particolare sulle caratteristiche che distinguono quelli che reagiscono positivamente da quelli che
reagiscono negativamente al saggio di Gram. Spiegherò in seguito il concetto di adattamento e di
sopravvivenza degli esseri viventi come pure l'idea di omeostasi e alcune nozioni sull'acidità per
sapere in che modo quest'ultima è in grado di influenzare la vita e la riproduzione degli esseri
viventi unicellulari.
In che modo due tipi di batteri gram positivi e gram negativi, che vivono normalmente a un
valore neutro di acidità, si adattano a delle soluzioni con acidità diverse?
Per il fatto che la teoria non riesce a darmi delle indicazioni precise sulla capacità di adattamento
in funzione dell'acidità dei due tipi di batteri in esame è stato necessario realizzare un
esperimento che mi ha permesso di misurare la riproduzione cellulare dei due organismi in
ambienti che presentano diverse acidità in modo da poter indirettamente individuare quale dei
due esseri viventi riesce ad adattarsi meglio.
1
Stefania Battaglioni
LaM Biologia
2010/2011
2 Alla ricerca dei due organismi viventi
2.1
La sistematica nel tempo
Come detto precedentemente, nel mio lavoro desidero confrontare la capacità di adattamento in
differenti ambienti acidi di due esseri viventi simili. Per rispondere alla mia domanda devo prima
identificare due organismi viventi simili ma non uguali e poi confrontarli. Ma quali sono i criteri
che definiscono un essere vivente simile ad un altro? Essi potrebbero essere: il colore, l'odore o
la forma, ad esempio. La scelta dei criteri è significativa solo se alla base c'è uno scopo. Nella
storia, uomini che hanno arditamente tentato di classificare gli esseri viventi ci sono stati, tutti
con degli obiettivi ben precisi. Prendiamo ad esempio Aristotele. Egli nato nel 384 a.C., fu il
primo a porsi il quesito come classificare gli organismi viventi. Perciò con scopi puramente
conoscitivi (dobbiamo tener conto che Aristotele era un filosofo e in quanto tale “amante della
sapienza” inoltre fu influenzato dal padre medico, cioè biologo come diremmo oggi) egli
classificò in modo molto accurato ciò che vedeva; 581 esseri viventi in gran parte dell'Asia
minore e di Lesbo (un'isola greca), secondo i criteri da lui ritenuti importanti: il tipo di habitat,
cioè dove vivono, se sono enaima (ovvero con sangue) o anaima (senza sangue), caratteristiche
anatomiche (numero zampe, ecc.), viviparità (il feto si sviluppa all'interno del corpo della madre)
o oviparità (nell'uovo fecondato deposto dalla femmina), ecc. (Masi, 16.01.2011).
Negli anni che seguirono, con le scoperte geografiche, scientifiche e l'Illuminismo, lo scopo della
classificazione cambiò: non era più l'amore per la sapienza a spingere gli scienziati a cercare un
sempre più perfetto schema di classificazione, ma il desiderio di validare o no la teoria
dell'evoluzione. Lo scopo divenne "evoluzionistico" per il fatto che in quei tempi la Chiesa dava
una spiegazione a tutto ciò che non era conosciuto con l'interpretazione delle sacre scritture, le
quali siccome riferite dal Creatore restavano inviolabili. Quando però la scienza è maturata e, per
mezzo del metodo scientifico, ha trovato delle risposte diverse da quelle religiose, è scaturita la
necessità di far luce su questi argomenti considerati sacri. Uno di questi è appunto l'origine della
vita, interpretata da due pensieri diversi: il creazionismo e l'evoluzionismo. La datazione dei
fossili è un esempio interessante, di come la religione è stata smentita dalle prove empiriche
della scienza, perché mostrano che già prima dell'età della Terra (6'000 anni come nell'età
medievale si credeva secondo le indicazioni bibliche) erano presenti degli esseri viventi.
Georges-Louis Leclerc (1707 – 1788), conte di Buffon, pubblicò il libro Natural history (1749),
nel quale stimò la formazione della Terra a circa 75.000 anni fa (Hoquet, 16.01.2011).
Oggigiorno la Terra è datata a circa 4.5 miliardi di anni fa.
In seguito si avanzarono diverse ipotesi riguardo l'origine degli esseri viventi e la loro
evoluzione, il conte di Buffon fu ispiratore di Charles Darwin (1809 – 1882), il quale nel 1858
scrisse L'origine delle specie, testo importantissimo che sconvolse le tesi bibliche, per cui Dio
creò ogni specie vivente, e la visione antropocentrica che si aveva all'epoca (Locarnini, 2010).
Egli infatti spiegò che nel tempo le specie si sono evolute e selezionate, come dimostra con il
famoso esempio delle giraffe: una volta esistevano sia le giraffe con il collo lungo che quelle con
il collo più corto e che poi, a causa della mancanza di nutrimento, quelle dal collo corto non
avevano più arbusti da dove potersi nutrire mentre quelle dal collo lungo potevano prendere le
foglie dagli alberi più alti. Questo fu un vantaggio non indifferente che permise di spiegare così
la sola presenza delle giraffe dal collo lungo ai giorni nostri (Linguaggio Globale, 16.01.2011).
2
Stefania Battaglioni
LaM Biologia
2010/2011
Prima di Darwin ci furono comunque innumerevoli tentativi per cercare di spiegare la storia
evolutiva, uno di questi, il primo ad essere coerente e completo, fu il lamarckismo, dal nome del
suo ideatore: Jean Baptiste Lamarck (1744 – 1829) amico del conte di Buffon. La sua tesi spiega
che gli esseri viventi nel tempo sono in continua evoluzione e che quando ci sono le condizioni
favorevoli essi possono passare da esseri semplici, costituiti da sostanze inanimate, a forme
sempre più perfette (Davi, 2003).
La classificazione oggigiorno è lo strumento che utilizziamo per cercare di capire da dove
proveniamo, quindi è in continuo mutamento siccome man mano che troviamo dei criteri
migliori per classificare si forma direttamente un modello evoluzionistico diverso e il più
possibile fedele alla realtà. Nell'illustrazione 1 sono raffigurati diversi tentativi di classificazione,
al fine di rendere più chiaro che cosa vuol dire mutamento di modelli di classificazione e farne
degli esempi. Uno di questi è quello di Woese, che nel 1977 propose la divisione degli esseri
viventi in sei regni: animali, funghi, piante, protisti, archeabatteri ed eubatteri, poi nel 1990
propose un altro modello in base a criteri differenti: stilò un albero filogenetico, cioè uno schema
che raggruppa i “parenti” evolutivi, dove sono rappresentati tre domini: Batteri, Archea ed
Eucarioti (vedi illustrazione 2). La seconda proposta è più completa perché classifica partendo da
basi precedenti, aggiungendo perciò un ulteriore criterio, tiene anche conto della “vicinanza”
evolutiva tra gli esseri viventi.
Illustrazione 1. Diverse proposte di classificazione degli esseri viventi dal 1894 al 2004 (Allzoon, 2009).
3
Stefania Battaglioni
LaM Biologia
2010/2011
Illustrazione 2. L'albero filogenetico realizzato da Woese (adattata da Wikipedia 1, 26.11.2010).
L'ultima idea è quella di Thomas Cavalier-Smith, docente di biologia evolutiva nel dipartimento
di zoologia ad Oxford. A differenza di Woese, Cavalier-Smith adottò ancora altri criteri e, in
base al risultato della classificazione, rimise gli Archea nel regno dei batteri e suddivise il regno
dei Protista in Cromista e Protozoa (vedi illustrazione 3) (Cavali, 16.01.2011). Egli propose un
albero filogenetico, nel quale divise gli esseri viventi in due domini e in sei regni, come mostrato
nell’illustrazione 3:
Illustrazione 3. Albero filogenetico di Cavalier-Smith. Cavalier-Smith separò gli esseri tra procarioti ed
eucarioti: i procarioti sono quelli al disotto della linea rossa e comprendono gli Archeabacteria e gli
Eubacteria, mentre gli eucarioti sono tutti gli altri egli suddivise gli esseri viventi in sei regni: batteri, ben
riconoscibile perché è identificabile con il dominio dei procarioti, animali (Animalia), funghi (Fungi), vegetali
(Plantae), Chromista e Rhizaria (Protozoa). “Branch order uncertain” significa “ordine di ramificazione
incerta”, nel senso che non si hanno ancora delle prove empiriche per stabilire con sicurezza che quella
ramificazione è la rappresentazione più vicina alla realtà. Infine unikonts e bikonts letteralmente vogliono
dire “un nodo” e “due nodi” ma si intende che nel primo caso c'è un'unica ramificazione e quindi gli esseri
viventi di quel “nodo” hanno geni comuni, cosa che non avviene invece per i bikonts (Oxford, 2009).
4
Stefania Battaglioni
LaM Biologia
2010/2011
Lo schema di classificazione proposto da Weose non si può definire peggiore ma semplicemente
meno vicino alla realtà rispetto a quello di Cavalier-Smith, perché quest'ultimo ha usato dei
criteri diversi che gli hanno permesso di stilare un modello più realistico e, fino a prova
contraria, a meglio raggiungere il suo scopo, cioè verificare se gli esseri viventi che attualmente
popolano il nostro pianeta derivano da un parente comune ancestrale.
Sulla base della proposta di classificazione di Cavalier-Smith ci sono due tipi di cellule differenti
che rappresentano i due domini e che dividono gli esseri viventi: le cellule procariote ed
eucariote.
È necessario chiarire questa distinzione (che verrà spiegata più dettagliatamente nel prossimo
capitolo) poiché per svolgere il mio lavoro di ricerca ho bisogno di due tipi di esseri viventi
relativamente semplici, che si riproducono rapidamente (minuti-ore) e che siano simili fra loro. Il
modello di classificazione proposto da C.-Smith si presta molto bene per scegliere i due
organismi viventi in quanto li separa con i seguenti criteri: dimensioni, forma, struttura, in
particolare quella della parete cellulare (si sono riportati quelli più significativi per la mia scelta,
in realtà sono molti di più).
Per il mio lavoro prenderò in esame i batteri, i quali fanno parte degli esseri procarioti e si
differenziano dagli eucarioti in quanto sono organismi relativamente semplici, che si
riproducono velocemente e tra loro molto simili.
2.2
Cellule eucariote e procariote
Le cellule che per prime si ipotizzano essere comparse sulla Terra, sono le cellule procariote (dal
greco pro, prima, e karyon, nucleo) (vedi illustrazione 4) (Padoa-Schioppa, 28.11.2010). Esse
sono molto semplici, rispetto a quelle eucariote evolute in seguito, e sono formate nel seguente
modo: all'esterno hanno una parete cellulare che serve a proteggerle e a darle forma (molto
spesso racchiusa da una capsula), più interna è la membrana plasmatica utile allo scambio di
sostanze dall'interno all'esterno della cellula e viceversa. All'interno c'è: il citoplasma, una
sostanza semifluida dove avvengono diverse reazioni chimiche, i ribosomi che tramite i segnali
inviati dal DNA assemblano gli aminoacidi per formare polipeptidi (lunghe catene di, appunto,
aminoacidi) e infine un lungo filamento di DNA detto nucleoide, dove sono raccolte le
informazioni genetiche, che non è racchiuso da nessuna membrana ma vaga nel citoplasma
(Campbell, Reece, Taylor, Simon, 2006).
5
Stefania Battaglioni
LaM Biologia
2010/2011
Illustrazione 4. Modello di cellula procariota (Wikipedia 2, 28.11.2010).
Le cellule eucariote (dal greco eu, vero, e karyon, nucleo), derivano dalle procariote, ma esse
sono più grandi, infatti una cellula procariota ha una dimensione che varia da 0.3 a 10
micrometri, circa un decimo di una eucariota, e anche nettamente più complesse (vedi
illustrazione 5). Esse differiscono a dipendenza se sono animali o vegetali. Le prime al loro
interno hanno degli organelli, ognuno dei quali ha un proprio ruolo per il funzionamento
dell'intera cellula, un po' come nel nostro corpo ci sono i polmoni per respirare, il cuore per
pompare sangue, ecc (Campbell, Reece, Taylor, Simon, 2006). Per capire meglio e a fondo la
composizione della cellula, a scopo puramente conoscitivo, elencherò alcuni degli organelli più
importanti e spiegherò brevemente la loro funzione.
Mitocondrio: dove principalmente viene prodotta la molecola ATP partendo da ADP+P.
Nucleo: contiene le informazioni per la sintesi di proteine, quando se ne vuole produrre una si fa
la copia della parte di DNA interessata e la si invia nel citoplasma, questa copia si chiama RNA.
Ribosoma: dove vengono assemblati gli aminoacidi in base al RNA ricevuto.
Reticolo endoplasmatico (RE):
- rugoso: ricoperto di ribosomi e direttamente collegato alla membrana nucleare, i
ribosomi formano polipeptidi, i quali entrano nel RE rugoso che li dà la tridimensionalità
formando così la proteina, essa uscirà dall'organello mediante vescicole e si dirigerà vero
l'apparato di Golgi.
-liscio: sintesi di lipidi ed eliminazione di farmaci e tossine.
Apparato di Golgi: riceve le vescicole dal RE, trasforma ciò che contengono e mediante altre
vescicole le distribuisce o all'interno o all'esterno della cellula.
(Moresi, 2009).
6
Stefania Battaglioni
LaM Biologia
2010/2011
Illustrazione 5. Modello di cellula eucariota animale (UNISA, 16.09.2010).
Come detto ci sono anche le cellule eucariote vegetali che presentano qualche differenza rispetto
a quelle animali, come la forma rettangolare dovuta anche alla presenza della parete cellulare e
certi organelli (vacuolo centrale e cloroplasti) che mancano in quella animale (vedi illustrazione
6) (Campbell, Reece, Taylor, Simon, 2006).
Illustrazione 6. Modello di cellula eucariota vegetale (MANTAX, 28.11.2010).
Le cellule eucariote formano anche organismi complessi (come l'uomo), dunque esse possono
anche specializzarsi e collaborare per far funzionare l'organismo, cosa che non sempre possono
fare le cellule procariote presentandosi in natura principalmente come organismi unicellulari. Ad
esempio nel nostro corpo abbiamo gli epatociti (le cellule del fegato) che hanno particolarmente
7
Stefania Battaglioni
LaM Biologia
2010/2011
sviluppato il reticolo endoplasmatico liscio visto che si occupano dell'eliminazione di sostante,
oppure abbiamo i globuli rossi che in età adulta sono privi di nucleo o ancora le cellule cerebrali
che inviano impulsi elettrici, ecc.
Come detto precedentemente, ho scelto di studiare i batteri, che fanno parte delle cellule
procariote, in quanto sono esseri viventi relativamente semplici e unicellulari, si riproducono
velocemente (20 minuti rispetto a 15 anni per l'uomo) e non richiedono particolari fonti nutritive.
I batteri sono classificabili secondo diversi criteri. Si potrebbero distinguere ad esempio per la
loro forma (bacilli, cocchi, vibrioni, spirilli, spirochete) oppure secondo l'optimum di
temperatura nella quale possono crescere (criofili, mesofili, termofili), basandosi sulla loro
relazione rispetto a un organismo (batteri commensali o patogeni), oppure ancora usando come
criterio la complessità della parete cellulare dei microrganismi (gram positivi e negativi),
(Polliotto, 13.01.2011).
Fra tutti questi tipi diversi di classificazione dei batteri ho scelto di confrontare una specie di
batteri che reagisce in modo positivo al saggio di Gram e l'altra in modo negativo. Selezionando
questi due tipi di batteri nelle stesse condizioni ambientali si assume che sono organismi
unicellulari che differiscono l'uno dall'altro per la loro parete cellulare che ha strutture diverse. Il
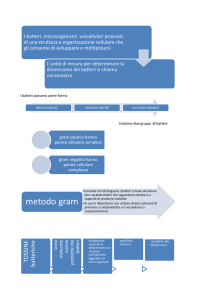
metodo gram (che approfondirò in seguito) mi permette di fare questa distinzione.
2.3
I batteri gram positivi e gram negativi
Nel 1884 il medico danese Hans C. Gram (1853 – 1938) scoprì un metodo in grado di
suddividere i batteri in due categorie: gram positivi e gram negativi (Pacifici 1, 08.12.2010).
Questo metodo si chiama colorazione di Gram (vedi all'Allegato 3 il protocollo di laboratorio).
Esso consiste nel colorare i batteri con due diversi coloranti (Cristal violetto e Safranina), alla
fine del procedimento si avranno i batteri gram positivi blu-violetti mentre i gram negativi rosarossi. La differenza di colore dipende dal fatto che i batteri gram positivi hanno una diversa
parete cellulare rispetto ai gram negativi.
La parete cellulare è differente dalla membrana cellulare, infatti, come si può vedere
nell'illustrazione 11, la prima è lo strato più esterno del battere, mentre la seconda definisce
l'interno della cellula (Segreto, 15.08.2010).
La parete cellulare per una cellula è essenziale perché al suo interno quest'ultima ha una
pressione relativamente alta, dovuta ai soluti disciolti in concentrazione maggiore nel citoplasma,
rispetto all'ambiente esterno (Pacifici 2, 14.08.2010). Per la presenza delle acquaporine1, nel caso
in cui la cellula fosse immersa in un liquido ipotonico (poco concentrato), l'acqua tenderebbe per
osmosi2 ad entrare facendola scoppiare. Nel caso in cui la cellula fosse invece immersa in un
liquido ipertonico (molto concentrato), l'acqua tenderebbe per plasmolisi ad uscire facendola
raggrinzire (vedi illustrazione 7).
1
Le acquaporine sono delle proteine della parete cellulare e hanno il ruolo di mediare il passaggio dell'acqua da
dentro a fuori la cellula e viceversa. Sono molto selettive e fanno passare solo le molecole d'acqua impedendo il
passaggio a ioni, sali, ecc.
2
L'osmosi è la diffusione del solvente (acqua) nel soluto attraverso una membrana selettiva, quindi quando il soluto
non può diffondere nella soluzione, perché la membrana non glielo permette, il solvente attraversa la membrana
e diffonde nel soluto. Questo finché non si raggiunge l'equilibrio.
8
Stefania Battaglioni
LaM Biologia
2010/2011
Illustrazione 7. Comportamento delle cellule animali e vegetali poste in soluzioni con diversa concentrazione
(Campbell, Reece, Taylor, Simon, 2006)
Precedentemente ho detto che i gram positivi si differenziano dai gram negativi per la loro parete
cellulare, ecco di seguito le caratteristiche specifiche.
2.3.1
Gram negativi
La parete cellulare dei gram negativi è più complessa e stratificata rispetto a quella dei gram
positivi (vedi illustrazione 11). La membrana esterna formata da proteine, fosfolipidi e
lipopolisaccaridi racchiude la cellula. Poi delle speciali proteine (le lipoproteine) uniscono questa
membrana al peptidoglicano che, nel caso dei gram negativi, costituisce solo il 10 % della parete
cellulare (Pacifici 2, 14.08.2010). La zona dove si trova il peptidoglicano (vedi illustrazione 8)
(quindi tra la membrana esterna e quella citoplasmatica) si chiama periplasmatica e contiene
inoltre le proteine periplasmatiche coinvolte anche nel trasporto di ioni, aminoacidi e zuccheri
(Segreto, 15.08.2010). Per quanto riguarda l'assorbimento di sostanze idrofile nella membrana
esterna sono presenti in grande quantità le porine, proteine cilindriche cave transmembranose
(cioè che attraversano la membrana), di circa 0.5-1 nm di diametro (vedi illustrazione 9 e 10).
Quindi gli ioni, tra i quali anche lo ione H+, quando oltrepassano la membrana esterna sono
obbligati a passare attraverso le porine visto che la membrana non è loro permeabile. Per quanto
riguarda invece le sostanze lipofile, esse possono con più facilità attraversare le membrane
lipidiche in quanto hanno più affinità (Segreto, 15.08.2010).
9
Stefania Battaglioni
LaM Biologia
2010/2011
Illustrazione 9. Una delle tre porine vista da due diverse
angolazioni (Biochemical Journal, 11.12.2010).
Illustrazione 8. Modello strutturale del
peptidoglicano (UNICAM, 24.08.2010).
Illustrazione 10. Porine viste dall'alto. Il luogo di passaggio
delle sostanze ha un diametro di ca. 0.5-1 nm (Biochemical
Journal, 11.12.2010).
2.3.2
Gram positivi
La parete cellulare dei gram positivi è prevalentemente composta da più stati di peptidoglicano
con, in meno presenza rispetto ai gram negativi, acidi teicoici che servono se legati con dei lipidi
(diventando dei lipoteicoici) ad attaccare il peptidoglicano alla membrana cellulare (vedi
illustrazione 11) (Labianca, 2010).
La parete cellulare dei gram positivi è altamente polare e ciò permette di non far entrare le
sostanze idrofobe ma solo quelle idrofile, indipendentemente dalla loro grandezza. Inoltre questa
polarità serve a legare una ingente quantità di cationi alla parete che permette così ai batteri gram
positivi, in contrapposizione a quelli negativi, di sopravvivere più a lungo in soluzioni con
concentrazioni saline elevate (Labianca, 2010). Con il termine "sopravvivere" si intende rimaner
vivo nel tempo, mantenendo quindi la stabilità delle funzioni vitali (Juri Lotman).
Ciò evidenzia che nei gram positivi, legando dei cationi alla parete cellulare, la possibilità da
parte di un catione di entrare nella cellula viene limitata dalla schermatura di cationi associati
alla parete (Labianca, 2010), (due cariche positive tendono ad allontanarsi tra di loro).
A questo punto si suppone che la parete cellulare dei gram positivi, essendo altamente polare
rispetto a quella dei gram negativi, potrebbe ostacolare l'entrata non solo dei sali ma anche degli
ioni H+, siccome sono anch'essi cationi. In questo modo i batteri gram positivi potrebbero
10
Stefania Battaglioni
LaM Biologia
2010/2011
riuscire a sopravvivere più a lungo in concentrazioni relativamente alte di H+ rispetto ai gram
negativi.
Illustrazione 11. Modello della struttura delle pareti cellulari dei gram - e gram + (UNICAM, 24.08.2010).
2.4
L'adattamento
Siccome desidero indagare la capacità di adattamento in soluzioni acide di due tipi di esseri
viventi, un tipo di battere gram positivo e l'altro gram negativo, trovo necessario specificare cosa
intendo dire con “sopravvivere” (già accennato nel capitolo 2.3.2) ed “adattarsi” alle condizioni
ambientali. Affinché un organismo viva nel tempo (sopravviva), esso deve mantenere costanti
nel proprio corpo determinate condizioni (temperatura, concentrazione di soluti, pressione,
quantità e qualità di biomolecole, ecc.). L'uomo, per stabilire e monitorare nel tempo lo stato del
vivente, utilizza dei fattori, o meglio delle grandezze: la temperatura, la concentrazione, la
pressione e il pH sono solo alcune d'esse. Per ogni grandezza attribuita allo stato del vivente si
son scoperti in alcuni casi i valori di limite massimo, minimo e di optimum che permettono di
diagnosticare lo stato dell'organismo. Ad esempio si è scoperto che alcuni organismi (classificati
come acidofili) vivono in ambienti con acidità particolarmente elevata (pH valore 2 o inferiore).
Nel nostro corpo, il sangue umano deve avere un valore di pH pari a 7.4, anche solo con una
variazione di 0.4 dal valore standard l'individuo rischia il coma acidosico o la tetania alcalosica
(accertato da più fonti). In altre parole, si dice che un organismo per vivere e restare in vita deve
11
Stefania Battaglioni
LaM Biologia
2010/2011
mantenere l'omeostasi3. Si può parlare di adattamento nel caso in cui tutte le funzioni vitali
dell'essere vivente e la capacità di duplicarsi sono mantenute nel tempo malgrado i cambiamenti
del sistema che lo circonda. Quando nella domanda del mio lavoro mi chiedo quale tipo, tra i
batteri gram positivi e gram negativi, riesce ad adattarsi meglio a soluzioni acide, mi chiedo
dunque quale dei due tipi di batteri riesce a sopravvivere (a mantenere l'omeostasi) e a duplicarsi.
La riproduzione degli organismi viventi è ciò che permette il mantenimento di una specie nel
tempo. Se un essere vivente mantiene l'omeostasi non ha sempre la capacità di riprodursi. Ad
esempio nel caso specifico dei batteri, se il valore del pH nel citoplasma è ideale per un tipo di
battere, questo si riprodurrà in modo ottimale (vedi illustrazione 16, linea nera), se invece il
valore del pH della soluzione non corrisponde all'optimum, ecco che la riproduzione ne viene
influenzata negativamente, ovvero i batteri potrebbero ad esempio crescere in quantità minore
rispetto alla crescita ottimale (vedi illustrazione 16, linea viola) o moltiplicarsi più lentamente e
forse raggiungere un numero totale di cellule maggiore dell'optimum (vedi illustrazione 16, linea
verde). Misurando dunque la crescita dei batteri in funzione del tempo in differenti soluzioni
acide, si può indirettamente studiare la capacità di sopravvivere e di sapersi adattare.
Per quanto riguarda il mio esperimento ho scelto quindi di selezionare i due tipi di batteri
mantenendo stabili i valori di concentrazione di nutrimento (zucchero e ossigeno), temperatura e
pressione e di modificare il valore della grandezza pH. Tra tutte le grandezze misurabili sopra
citate, ho scelto il pH perché è un valore facilmente misurabile e testabile. Ma cos'è il pH?
Perché è un a grandezza significativa per la crescita batterica?
2.5
pH e omeostasi
Prima di rispondere alle domande poste dal capitolo precedente è necessario fare una premessa:
io desidero scoprire chi tra batteri gram positivi e negativi si adatta meglio ad ambienti con
diversa acidità, ed è quindi importante precisare che la maggior parte dei batteri si moltiplica da
un valore minimo di pH di 4.4 a un massimo di pH di valore 9. Tuttavia ci sono batteri che
riescono a riprodursi anche a pH molto più bassi (ovvero con valori inferiori a 4) come ad
esempio i batteri dell’acido lattico (Foodlexicon, 16.01.2011).
Il pH (dal latino pondus hydrogenii, potenziale dell'idrogeno) è un indice per determinare
l'acidità di una soluzione acquosa.
Nell'acqua sono presenti degli ioni che non hanno niente a che vedere con i sali minerali disciolti
(Mg2+, Ca2+, ecc.). Infatti anche l'acqua distillata presenta, sebbene debolissima, una
conducibilità elettrica, questo a dimostrazione che anche nell'acqua pura, cioè dove normalmente
dovrebbero esserci esclusivamente molecole H2 O, ci sono degli ioni (Nicola Pé, 2009). Ma
quali? E da dove vengono? Sono gli ioni H+(aq) e OH-(aq) provenienti dal seguente equilibrio di
autoionizzazione:
H2O(l)
3
H+(aq) + OH-(aq)
Capacità di un essere vivente di mantenere costante l'ambiente interno malgrado i cambiamenti dell'ambiente
esterno (MEDNAT, 24.12.2010).
12
Stefania Battaglioni
LaM Biologia
2010/2011
Ciò vuol dire che sempre e in tutte le soluzioni acquose l'H2O è presente anche in forma
parzialmente dissociata in H+(aq) e OH-(aq). Se in una soluzione la concentrazione di H+ supera
quella di OH-, significa che la soluzione è acida come ad esempio la soluzione di acido cloridrico
(HCl):
HCl(aq)
H+(aq) + Cl-(aq)
Viceversa, se in una soluzione è presente in maggior quantità OH -, significa che è una base. Un
esempio è la soluzione di idrossido di sodio (NaOH):
NaOH(aq)
OH-(aq) + Na+(aq)
Affinché una soluzione si possa definire, acida, basica o neutra c'è un valore “sparti acque” della
concentrazione del catione idrogeno ([H+]) o viceversa nell'anione idrossido ([OH-]):
[H+] > 10-7 mol/L > [OH-]
soluzione acida
[H+] < 10-7 mol/L < [OH-]
soluzione basica
[H+] = 10-7 mol/L = [OH-]
soluzione neutra
I valori del pH si misurano nel seguente modo:
pH = - log [H+]
dove le concentrazioni di H+ variano da un massimo 100 = 1 mol/L a un minimo di 10 -14 mol/L,
quindi i valori del pH sono compresi da 14 a 0, dove il valore 7 sta per soluzione neutra, mentre
il 14 rappresenta il massimo grado di basicità e lo 0 il massimo grado di acidità (vedi immagine
12) (Nicola Pé, 2009).
13
Stefania Battaglioni
LaM Biologia
2010/2011
Illustrazione 12. Scala dei valori del pH con alcuni esempi di sostanze (Campbell, Reece, Taylor, Simon,
2006).
L’elevata presenza o meno di H+ è un fattore limitante per la crescita batterica, perché?
Esattamente come interagisce lo ione idrogeno con l'organismo vivente in questione? In che
modo potrebbe modificare l'omeostasi?
Tra le svariate componenti della cellula descriverò quelle che ho trovato più significative
(NADH, DNA, proteine-enzimi) per discutere in che modo gli ioni H+ potrebbero compromettere
l'omeostasi.
In condizioni ottimali nel citoplasma del battere è già presente una data concentrazione di H+. Gli
ioni idrogeno possono provenire da varie fonti: dalla molecola NADH ad esempio, che è
responsabile del trasporto degli elettroni in vari processi della respirazione cellulare secondo la
seguente reazione (Moresi, 2009):
NAD+ + 2H
NADH + H+
Un'altra fonte di protoni che permette d'acidificare il citoplasma è il DNA, perché formato da
acidi nucleici. Oppure ancora le proteine, quest'ultime sono costituite da aminoacidi, i quali sono
14
Stefania Battaglioni
LaM Biologia
2010/2011
caratterizzati da più gruppi funzionali: quello amminico, carbossilico, ecc., che in determinate
condizioni hanno la possibilità di rilasciare o prendere H + (vedi illustrazione 13). Sono
soprattutto i resti ad essere liberi in soluzione e quindi a dipendenza della loro composizione
possono influenzare il pH (ZYXEL, 2007).
Per formare una proteina, ci sono diversi livelli strutturali (vedi illustrazione 14):
Primo livello: è una lunga sequenza di aminoacidi, infatti essi si legano tra loro fino a formare
una catena polipeptidica;
Secondo livello: consiste nella forma tridimensionale che questi aminoacidi assumono. Infatti
ogni aminoacido è caratterizzato dalla presenza di un resto, detto R, che a dipendenza della sua
grandezza o della sua tendenza idrofoba o idrofila può alterare la forma del polipeptide, dato che
può legarsi con altri aminoacidi della stessa catena tramite dei legami intermolecolari dando così
la caratteristica forma ad alfa elica (come mostrata nell'illustrazione 14) e a foglietto ripiegato;
Terzo livello: è invece la forma tridimensionale dell'intera proteina. Questa è di vitale
importanza, perché per quanto riguarda la maggior parte delle proteine, quando reagiscono
devono esattamente avere la forma che combacia con il substrato (sostanza che viene modificata
dopo la reazione), come una serratura per una chiave. Le due forme che la proteina può assumere
è globulare (come illustrata nella figura 14) tipica degli enzimi oppure fibrosa, come possono
essere le proteine muscolari;
Quarto livello: è l'associazione di due o più catene polipeptidi (Moresi, 2009).
Illustrazione 13. Struttura dei venti amminoacidi presenti negli esseri viventi (THEA, 2004).
15
Stefania Battaglioni
LaM Biologia
2010/2011
Illustrazione 14. Modello di strutturazione di una proteina su quattro livelli (UNIFI, 2005).
Gli enzimi, sono delle proteine e hanno il ruolo di regolare la velocità (ovvero catalizzare) di
specifiche reazioni chimiche, che, senza l'ausilio dei suddetti, ci vorrebbero tempi troppo lunghi
per avvenire. Gli enzimi reagiscono di solito solo con un dato substrato, ciò implica che in
reazioni più complesse (come per la trascrizione e traduzione proteica) dove avvengono diversi
passaggi, devono attivarsi diverse tipologie di enzimi (vedi illustrazione 15) (De Pascalis,
09.12.2010).
Nel caso in cui nel citoplasma di un battere dovesse improvvisamente cambiare la
concentrazione di ione idrogeno, gli enzimi avrebbero un grave problema. Infatti l'H + modifica la
ionizzazione dei resti degli aminoacidi modificando così la tridimensionalità della proteina e
facendole perdere o inibire perciò alcune funzioni. Lo ione idrogeno si può definire un inibitore
non competitivo, perché modifica la forma dell'enzima. Al contrario un inibitore competitivo
sostituisce il substrato impedendogli così di continuare a catalizzare la reazione (Speziga, 2010).
Se le funzioni essenziali per la sopravvivenza del battere sono inibite, quest'ultimo potrebbe
morire oppure sopravvivere, mantenendo l'omeostasi ma non riproducendosi (Arienti, 2003).
Illustrazione 15. Modello di reazione enzimatica: il substrato e
l'enzima si incontrano, durante la reazione enzimatica il
substrato viene modificato. Dopo la reazione l'enzima è rimasto
integro e immutato mentre il substrato è stato trasformato (De
Pascalis, 09.12.2010).
16
Stefania Battaglioni
LaM Biologia
2010/2011
Nel capitolo precedente ho spiegato ciò che distingue un gram positivo da uno negativo ed ho
brevemente accennato grazie a quali strutture della parete cellulare gli ioni idrogeno possono
entrare o uscire dalla cellula. Tuttavia vorrei ulteriormente approfondire quest'aspetto, ovvero:
quali spinte entrano in gioco durante il passaggio degli H+ da dentro a fuori la cellula e
viceversa?
2.6
Spinte
Innanzitutto è importante fare una premessa: nel citoplasma sono disciolti diversi ioni (come ad
esempio lo ione fosfato: PO43- aq) che gli conferiscono una carica negativa, mentre fuori dalla
parete cellulare sono maggiormente presenti ioni positivi (come K+ o Na+). In questo modo si
crea una differenza di potenziale elettrico di circa 70 mV tra dentro e fuori il battere (Speziga,
2010). Quest'aspetto è molto importante per quanto riguarda la diffusione di H +, perché essendo
una molecola caricata, quando diffonde è spinta da due forze: dal gradiente chimico, cioè la
differenza di concentrazione, e dal gradiente elettrico, ovvero la differenza di carica (UNIPV,
12.12.2010).
Per chiarire quest'aspetto faccio (di seguito) un esempio. Se introduciamo in una soluzione a pH
3 un battere il cui citoplasma ha un valore di pH 6, al punto di equilibrio non si avrà pH 4,5
dentro e fuori la cellula, ma si avrà un pH del citoplasma più basso rispetto a quello esterno.
Oltre al gradiente di concentrazione, che “attira dentro” gli ioni H +, entra infatti in gioco anche il
gradiente elettrico, che dipende dal fatto che gli ioni idrogeno, essendo caricati positivamente,
sono attratti dagli ioni negativi disciolti nel citoplasma.
Si può ipotizzare che più la differenza di potenziale è alta, più intensa è la spinta che permetterà
di spostare gli H+ da una parte all'altra della parete cellulare.
2.7
Crescita dei batteri
Con il termine crescita si intende l'aggiunta di materia a un corpo già esistente. Nel caso dei
batteri il termine è attribuito a un aumento del numero di unità cellulari in quanto la quantità di
materia aggiunta al singolo organismo unicellulare viene quasi sempre sortita nelle due cellule
figlie dopo la divisione cellulare. Le cellule batteriche possono crescere in medium solidi e
liquidi. Solitamente la crescita di una colonia batterica in medium liquidi viene monitorata
misurando la densità ottica della soluzione che contiene le cellule nel tempo (vedi illustrazione
16).
Con questo metodo si possono distinguere le seguenti fasi:
fase di latenza: in questa fase il numero di batteri rimane all'incirca costante. Questo
perché l'essere vivente cerca di adattarsi al tipo di terreno in cui è stato inoculato e ciò
può durare anche diverse ore;
17
Stefania Battaglioni
LaM Biologia
2010/2011
fase esponenziale: il microrganismo si divide in maniera esponenziale con velocità di
crescita costante, raddoppiando la loro popolazione a intervalli regolari;
fase stazionaria: non vi è un aumento netto della popolazione batterica perché vi è
equilibrio tra divisione e morte cellulare. Ciò succede per un nutriente che scarseggia, per
l'accumulo di sostanze tossiche, per il valore di pH divenuto troppo basso o alto, ecc.;
Fase di morte: la popolazione batterica diminuisce.
La crescita di una colonia batterica può variare a dipendenza delle condizioni della soluzione
nella quale è immersa. Nell'illustrazione 16 sono mostrati tre tipi di possibili crescite batteriche:
la linea nera potrebbe rappresentare la crescita standard in una soluzione idonea alla colonia
batterica; la linea viola potrebbe rappresentare la crescita in un ambiente che permette ai batteri
di seguire una fase di latenza standard seguita da una fase esponenziale più corta, dove il numero
di cellule totali è minore di quello presente nella crescita ideale (linea nera); la linea verde
potrebbe rappresentare la crescita in un ambiente che permette ai batteri di sopravvivere per un
periodo di latenza più lungo della latenza standard (linea nera), seguito eventualmente da una
crescita esponenziale più lunga in modo da raggiungere un numero di cellule totali in soluzione
maggiore di quelle ritrovate nella soluzione standard. In questo caso teorico, la colonia batterica
si è riprodotta in tutte e tre le soluzioni in modi diversi, ce ne potrebbero essere altri, per esempio
la colonia potrebbe solamente sopravvivere e quindi si monitorerebbe solo una fase di latenza
continua, senza identificare la fare esponenziale.
Per il fatto che ci sono più possibilità di crescita è arduo a livello teorico avanzare delle ipotesi
precise circa l'andamento di due colonie di batteri gram positivi/negativi in differenti soluzioni
acide. È a questo punto necessario misurare empiricamente la crescita dei due tipi di batteri che
desidero analizzare in soluzioni con valori di pH differenti.
Illustrazione 16. Tre possibili modelli (linee nera, viola e verde) di crescita di una
colonia batterica nel tempo. La prima fase di crescita si chiama fase di latenza, in
seguito c'è una crescita esponenziale, poi una fase stazionaria e infine la morte della
colonia (Giammanco Giovanni, 2004).
18
Stefania Battaglioni
LaM Biologia
2010/2011
3 Domanda
Ponendo a confronto due colonie batteriche aventi come optimum un pH di valore 7, una gram
positiva e l'altra gram negativa, quale delle due, se immerse in un ambiente con valore di pH
diverso rispetto al loro ideale, è in grado di adattarsi meglio alla nuova situazione?
19
Stefania Battaglioni
LaM Biologia
2010/2011
4 Ipotesi di ricerca
Per formulare le ipotesi di ricerca ho identificato dall'indagine teorica i seguenti aspetti:
- lo spostamento dello ione idrogeno tra l'interno e l'esterno delle cellule batteriche è soggetto a
due spinte: quella "chimica" derivata dalla differenza di concentrazione di ioni idrogeno tra
l'interno e l'esterno della cellula e quella "elettrica", derivata dalla differenza di cariche
distribuite all'interno e all'esterno delle cellule.
- la membrana dei batteri gram positivi, essendo più polare di quella dei batteri gram negativi,
lega dapprima dei cationi al suo esterno e poi scherma la cellula da una possibile entrata di ioni
idrogeno. Questo comporta una miglior predisposizione dei batteri gram positivi a sopravvivere
più a lungo in concentrazioni relativamente alte di H+ rispetto ai gram negativi.
- se cambiando ambiente (acidità della soluzione che lo contiene) l'essere vivente non si
riproduce più può significare che è morto oppure che riesce a mantenere l'omeostasi grazie a una
serie di meccanismi cellulari che coinvolgono soprattutto l'attività enzimatica implicata con la
replicazione del DNA. Se invece l'essere vivente, cambiando ambiente, riesce a moltiplicarsi
significa che non solo mantiene l'omeostasi ma riesce ad adattarsi, a mantenere il successo
riproduttivo della sua specie.
- è necessaria una parte pratica che permetta di misurare la crescita (fasi di latenza e
esponenziale) delle colonie batteriche prese in esame a differenti valori di pH in modo da
stabilire quale dei due tipi di microorganismi si adatta meglio alla variazione di acidità della
soluzione che li ospita.
L'indagine pratica deve permettere di trovare i risultati proposti nei capitoli seguenti (4.1, 4.2 e
4.3).
20
Stefania Battaglioni
4.1
LaM Biologia
2010/2011
Crescita delle colonie a un valore di pH 7
Siccome i due tipi di batteri gram positivi e negativi sono stati presi e selezionati dallo stesso
ambiente, si presume che in condizioni di pH 7 abbiano lo stesso andamento di crescita.
Ci si aspetta una fase di latenza ed esponenziale che nominerò "standard" (vedi illustrazione 17).
Illustrazione 17. Grafico dell'ipotetico andamento della crescita dei batteri gram positivi immersi in un
ambiente a pH pari a 7 nominato "standard" (cioè riferito alla crescita delle colonie in un ambiente a
pH neutro, lo stesso usato per selezionarle).
4.2
Crescita delle colonie da un valore di pH 7 a 3
4.2.1
Batteri gram positivi
Introducendo la colonia di batteri gram positivi (cresciuti inizialmente in un ambiente a pH 7) in
una soluzione avente un valore di pH 3, si ipotizza che sia la spinta "chimica" che quella
"elettrica", che potrebbero permettere ai protoni di muoversi verso l'interno della cellula batterica
a causa della differenza di concentrazione di ioni idrogeno, aumentino d'intensità.
Si pensa che la repulsione elettrostatica della parete dei gram positivi riesca a contrastare lo
spostamento degli ioni idrogeno verso l'interno della cellula, essendo attratti dalla parete
cellulare altamente polare dei batteri e spinti dal gradiente elettrochimico.
Ci si aspetta quindi una fase di latenza standard, seguita da una breve fase di crescita
esponenziale come mostrato nell'illustrazione 18.
La fase di latenza è standard, poiché mi aspetto che i batteri riescano a mantenere l'omeostasi
come nella soluzione a pH 7 per poi iniziare la crescita esponenziale che ipotizzo essere corta,
poiché gli H+, malgrado sono respinti dalla parete cellulare, riescono ad entrare e così facendo
21
Stefania Battaglioni
LaM Biologia
2010/2011
potrebbero modificare l'ambiente interno (enzimi di vario tipo tra i quali quelli coinvolti nella
sintesi del DNA) dei batteri, i quali non riescono più a riprodursi.
Illustrazione 18. Grafico dell'ipotetico andamento della crescita dei batteri gram positivi immersi
in un ambiente a valore di pH pari a 3 (linea rossa) e crescita di riferimento standard (linea nera),
cioè riferito alla crescita della stessa colonia a in un ambiente a pH neutro.
4.2.2
Batteri gram negativi
Inserendo la colonia di batteri gram positivi (cresciuti inizialmente in un ambiente a pH 7) in una
soluzione avente un valore di pH 3, si ipotizza come nel caso dei gram positivi, che la spinta
elettrochimica, che potrebbe permettere ai protoni di muoversi verso l'interno della cellula
batterica a causa della differenza di concentrazione di ioni idrogeno, aumenti d'intensità.
Si pensa in questo caso che gli ioni idrogeno riescano sin dall'inizio ad entrare con più facilità
rispetto ai gram positivi nelle cellule batteriche visto che la parete dei gram negativi non riesce a
contrastare lo spostamento degli ioni idrogeno verso l'interno della cellula.
Ci si aspetta quindi una fase di latenza di lunga durata seguita da una lenta crescita esponenziale
(caso 1 nell'illustrazione 19), oppure una sola fase di latenza, senza crescita esponenziale, (caso 2
nell'illustrazione 19).
Nel primo caso la fase di latenza è prolungata, siccome gli ioni idrogeno, entrando
immediatamente nelle cellule, potrebbero far cambiare gli equilibri interni che permettono di
mantenere l'omeostasi. La crescita esponenziale richiede più tempo rispetto a quella misurabile a
pH 7; nel caso in cui i batteri riescono a mantenere l'omeostasi (caso 1), oppure non avviene del
tutto se gli ioni idrogeno impediscono la riproduzione (caso 2).
22
Stefania Battaglioni
LaM Biologia
2010/2011
Illustrazione 19. Grafico dell'ipotetico andamento della crescita dei batteri gram negativi immersi in un
ambiente a valore di pH pari a 3 (linee blu) e crescita standard (linea nera), cioè riferito alla crescita
della stessa colonia a in un ambiente a pH neutro. L'andamento 1 ha una lenta crescita esponenziale
(quasi lineare), mentre l'andamento 2 non cresce, permane una fase di latenza.
4.3
Crescita delle colonie da un valore di pH 7 a 9
Per rispettare le tempistiche di consegna mi sono limitata ad avanzare delle ipotesi per il
cambiamento di pH descritto nel capitolo 4.2. Se avessi avuto più tempo avrei avanzato delle
ipotesi anche per questa parte prevista all’inizio della progettazione pratica. Condurrò comunque
l’esperimento a pH 9 e riporterò nella sezione dei risultati le misure in modo da poterle usare
eventualmente nella discussione.
23
Stefania Battaglioni
LaM Biologia
2010/2011
5 Indagine pratica
La metodologia che ho scelto per rispondere alla mia domanda di ricerca è la seguente:
selezionare e poi coltivare due colonie batteriche caratterizzate dal fatto che una è gram positiva
e l'altra gram negativa e che sono state raccolte dallo stesso ambiente. In seguito immergerle in
soluzioni con diversi valori di pH e monitorarne la crescita, che è indice dell'adattamento o meno
dei batteri agli ioni H+, come spiegato nel capitolo 2.4.
In accordo con le ipotesi formulate nel capitolo 4, per interpretare i dati dell'esperimento che
misurerà la crescita dei due tipi di batteri in funzione del tempo, stabilisco che con più una
colonia riesce a crescere come il suo riferimento standard, con più questa si è adattata. Nel caso
in cui non si misura nessuna crescita allora la colonia batterica sopravvive mantenendo
l'omeostasi oppure muore.
5.1
Selezione dei due tipi di batteri
Per quanto riguarda il mio esperimento ho scelto quindi di selezionare i due tipi di batteri
mantenendo stabili i valori di concentrazione di nutrimento (zucchero e ossigeno), temperatura e
pressione e di modificare il valore della grandezza pH. Tra tutte le grandezze misurabili sopra
citate, ho scelto il pH perché è un valore facilmente misurabile e testabile.
Tutti i giorni in quasi tutti i momenti della nostra giornata si è circondati da batteri. Non si
vedono tranne quando si moltiplicano e formano delle colonie, a quel punto diventano visibili ad
occhio nudo. I batteri si moltiplicano quando trovano le condizioni ideali, e spesso il fattore
limitante per la crescita è il cibo. Quello che ho fatto io, è prelevare dei batteri dall'aria di un'aula
di biologia del liceo (lasciando per dieci minuti delle capsule di Petri aperte in modo che uno o
più batteri cadendoci dentro cominciassero a riprodursi) e coltivarli nelle suddette capsule con
all'interno dell'Agar-agar, un miscuglio nutritivo apposito per batteri (per la preparazione vedi
allegato 1).
Coltivare questi batteri nell'Agar-agar è stata una prima selezione in funzione del nutrimento, del
pH, infatti è possibile che qualche battere non è riuscito a riprodursi a causa della composizione
del nutrimento non adatto alle sue esigenze. In seguito ho chiuso le capsule e le ho messe in
incubatrice a 30 °C per circa 18 ore. Questa rappresenta un'ulteriore selezione, tant'è vero che ci
sono batteri che si moltiplicano esclusivamente in temperature comprese tra 0 °C e 25 °C e altri
invece che si riproducono tra i 47 °C e i 70 °C (Polliotto, 13.01.2011).
Diciotto ore dopo, all'interno delle capsule era cresciuto qualcosa (vedi illustrazione 20).
24
Stefania Battaglioni
LaM Biologia
2010/2011
Illustrazione 20. Capsule di Petri contenenti colonie
batteriche e altri tipi di esseri viventi prelevati per 10
minuti dall'aria di un'aula di biologia del liceo e incubate
a 30 °C per circa 18 ore.
Dal momento in cui avevo sufficienti colonie su cui lavorare, ho cominciato la terza fase di
selezione. Essa consiste nel prelevare con un'ansa di metallo un'infima quantità di una colonia e
trasferirla su un'altra capsula Petri con Agar-agar vergine, in modo tale che in quella capsula
cresca esclusivamente quella determinata colonia (vedi allegato 2). Questo procedimento l'ho
compiuto più volte e per più colonie batteriche (in totale otto colonie batteriche, triplicate), (vedi
illustrazione 21), così da aumentare le possibilità di trovare inseguito due colonie, una gram
positiva e una negativa.
Illustrazione 21. Capsule Petri contenenti singole colonie
batteriche prelevate da altre capsule, incubate a 30 °C
per circa 14 ore. Da notare che la fotografia è stata
scattata un mese dopo la stesura dei batteri e, sebbene le
capsule siano state tenute in frigorifero, sono cresciute
delle muffe riconoscibili per il loro colore nero in
contrasto con i batteri.
25
Stefania Battaglioni
LaM Biologia
2010/2011
A questo punto possedevo numerose capsule Petri contenenti in ognuna una colonia batterica
diversa. L'ultima fase (la quarta selezione) era la colorazione gram. Prima però per sicurezza ho
quadruplicato le colonie, così, nel caso in cui una capsula si fosse contaminata, avevo ancora
altre due capsule di riserva (vedi illustrazione 23).
Il procedimento specifico per la colorazione di gram è descritto nell'allegato 3 e nell'illustrazione
22 è raffigurato il risultato ottenuto.
Illustrazione 22. Risultati della colorazione gram.
5.2
Illustrazione 23. Capsule Petri contenenti
colonie batteriche prelevate da altre capsule e
incubate a 30 °C per circa 14 ore.
Misura della crescita delle due colonie a pH 7
A questo punto, dopo aver selezionato i due tipi di batteri in funzione del nutrimento, del pH,
della temperatura e della reazione della loro parete cellulare al saggio di Gram, avevo la
necessità di misurare la crescita delle colonie in funzione del tempo nello stesso nutrimento (ora
non più gelatinoso ma liquido). Una colonia per arrivare alla fase stazionaria può metterci 6 ore
come può mettercene 48. Era dunque essenziale fare prima una prova in modo da sapere a che
ora poter far partire il mio esperimento.
26
Stefania Battaglioni
LaM Biologia
2010/2011
In base ai risultati ottenuti organizzai l'inizio dell'esperimento tra le 7:30 e le 8:00 di mattina.
Mancava tuttavia la scelta del metodo per il conteggio dei batteri. A disposizione ne avevo
diversi tra cui:
- conteggio indifferenziato: si diluisce quanto necessario la cultura batterica, poi se ne mette una
qualche goccia su un apposito vetrino fornito di piccolissime celle con le quali è possibile
contare al microscopio le cellule. Quindi calcolare il numero di cellule globali.
- conteggio con lo spettrofotometro: l'assorbanza, o densità ottica, è direttamente proporzionale
al numero di cellule per millimetro. Quindi basta prendere del nutrimento sterile come tara e
misurare l'assorbanza (a 600-660 nm come lunghezza d'onda). Dai risultati infine si può stilare
un grafico che mostra in modo significativo le quatto fasi della crescita batterica: latenza,
esponenziale, stazionaria e morte (vedi illustrazione 16).
Ho scelto il secondo metodo perché più pratico e veloce, sia per quanto riguarda l'esperimento
che per l'elaborazione dei dati in quanto ero interessata a monitorare la fase di latenza e quella
esponenziale.
0,300
0,300
0,250
0,250
0,200
0,200
0,150
pH 7 D
Assorbanza
Assorbanza
Di seguito le curve di crescita delle due colonie di batteri a pH 7, usate come riferimento
(illustrazioni 24 e 25).
0,150
pH 7 H
0,100
0,100
0,050
0,050
0,000
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 24. Assorbanza in funzione del
tempo della colonia batterica gram positiva a
pH di valore 7.
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 25. Assorbanza in funzione del
tempo della colonia batterica gram negativa a
pH di valore 7.
Facendo riferimento ad ambo le curve (illustrazioni 24 e 25) si può attribuire al lasso di tempo
che da 0 va a 5 ore e 45 minuti la fase di latenza, mentre la crescita avvenuta tra le 5 ore e 45
minuti e le 11 ore si può considerare esponenziale in accordo con l'ipotesi stilata
nell'illustrazione 17. Tuttavia i dati non danno una chiara visione di quel che sarebbe potuto
accadere se avessi continuato le misurazioni, la crescita avrebbe potuto stabilizzarsi come anche
continuare.
27
Stefania Battaglioni
5.3
LaM Biologia
2010/2011
Misura della crescita delle due colonie a diversi valori di pH
La maggior parte dei batteri, come detto precedentemente, crescono in soluzioni con valori di pH
che variano dai 4.4 ai 9, ovvero con concentrazioni di ione idrogeno che spaziano dai 10 -4.4
mol/L ai 10-9 mol/L. Le due colonie che esaminerò sono state selezionate con un valore di pH 7.
Per il mio esperimento utilizzo delle soluzioni per le culture batteriche aventi i seguenti valori di
pH: 3, 7 e 9. Ho scelto il valore 7 perché è il valore pH con il quale ho selezionato i due tipi di
batteri e tarato l'esperimento di crescita; mentre ho scelto i valori 3 e 9 perché sono dei valori di
pH tollerati dalla maggior parte dei batteri (gram positivi e negativi) e nello stesso tempo
relativamente diversi in modo da poter distinguere la crescita dei batteri gram positivi dai gram
negativi, ma non troppo da impedirne completamente la riproduzione (Foodlexicon, 16.01.2011).
Organizzai l'esperimento nel seguente modo:
- preparai il materiale di laboratorio e le sei beute contenenti l'Agar-agar liquido, due a valore di
pH pari a 3, due a valore di pH 7 e due a valore di pH 9;
- alle 7:45 introdussi la stessa quantità di batteri nelle sei beute (separando gram positivi dai
negativi in modo da avere per ogni valore di pH una beuta contenente la colonia gram positivo e
l'altra gram negativo). In seguito misi ogni beuta su un fornellino allo scopo di mantenere
costante la temperatura dell'Agar-agar a 30 °C (vedi illustrazione 26);
- a partire dalle 13:30 (orario derivato dalle misure condotte in precedenza, capitolo 5.2) misurai
regolarmente (circa ogni 45 minuti o 1 ora) la crescita batteria con lo spettrofotometro;
- dalle 18:45 interruppi le misurazioni, in quanto constatai dai dati raccolti fino a quel momento,
che la fase stazionaria era già stata raggiunta da tutte le colonie prese in esame (vedi illustrazione
27).
28
Stefania Battaglioni
LaM Biologia
2010/2011
Illustrazione 26. Esperimento alle ore 7:45. A sinistra ci sono due beute contenenti Agar-agar a pH di valore
3, al centro a pH di valore 7 e a destra a pH di valore 9.
Illustrazione 27. Esperimento alle ore 19:00 circa. Da notare l'aumento di torbidità dell'Agar-agar nelle
beute. La torbidità è segno di crescita batterica.
29
Stefania Battaglioni
6
LaM Biologia
2010/2011
Risultati
I valori registrati dall'analisi allo spettrofotometro dell'Agar-agar liquido contenente i batteri,
sono mostrati qui di seguito nella tabella 1 (i batteri gram positivi sono stati nominati con la
lettera “D”, mentre quelli negativi con la lettera “H”):
Tabella 1: Dati della misurazione del 12.10.2010 iniziata alle ore 07:45. I batteri gram positivi sono stati
nominati con la lettera “D”, mentre quelli negativi con la lettera “H”. Nelle colonne “%T” e “A” sono
riportati i valori rispettivamente della trasmittanza e dell'assorbanza.
6.1
Elaborazione dei risultati
Assorbanza in funzione del tempo della colonia D a un valore di pH 3
0,300
0,250
Assorbanza
0,200
0,150
pH 3 D
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
30
Stefania Battaglioni
LaM Biologia
2010/2011
Assorbanza in funzione del tempo della colonia H a un valore di pH 3
0,300
0,250
Assorbanza
0,200
0,150
pH 3 H
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Assorbanza in funzione del tempo della colonia D a un valore di pH 7
0,300
0,250
Assorbanza
0,200
0,150
pH 7 D
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
31
Stefania Battaglioni
LaM Biologia
2010/2011
Assorbanza in funzione del tempo della colonia H a un valore di pH 7
0,300
0,250
Assorbanza
0,200
0,150
pH 7 H
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Assorbanza in funzione del tempo della colonia D a un valore di pH 9
0,300
0,250
Assorbanza
0,200
0,150
pH 9 D
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
32
Stefania Battaglioni
LaM Biologia
2010/2011
Assorbanza in funzione del tempo della colonia H a valore di pH 9
0,300
0,250
Assorbanza
0,200
0,150
pH 9 H
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Assorbanza in funzione del tempo delle colonie D e H a valori di pH 3, 7 e 9
0,300
0,250
Assorbanza
0,200
pH 3 H
pH 3 D
pH 7 H
pH 7 D
pH 9 H
pH 9 D
0,150
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
33
Stefania Battaglioni
LaM Biologia
2010/2011
7 Discussione
Prima di cominciare a discutere i risultati ottenuti, trovo necessario fare una premessa. Il
fenomeno vita è molto complesso, per questo motivo nell'analisi dei dati ho dovuto fare delle
semplificazioni. In realtà ci sono svariati motivi per cui una data colonia di batteri riesce ad
adattarsi e un'altra no. Ma restando nei limiti delle mie conoscenze e delle mie possibilità ho
tentato comunque di analizzare i singoli casi in base al complesso di elementi teorici che ho
proposto precedentemente. Ogni volta che si parla di soluzione o ambiente a un certo valore di
pH di assume che i valori delle altre grandezze (temperatura, concentrazione di nutrienti,
pressione, ecc.) rimangono costanti.
7.1
Crescita delle colonie da un valore di pH 7 a 3
7.1.1
Batteri gram positivi
Per quanto riguarda l’andamento della curva dei risultati per la colonia di gram positivi introdotti
nella soluzione a pH valore 3 (come mostrato nell’illustrazione 29): da 0 a 5 ore e 45 minuti i
batteri si sono moltiplicati relativamente poco (valore dell’assorbanza da 0 a 0.03) da quel
momento in poi il numero di cellule è rimasto invariato.
Ho ipotizzato che i batteri avrebbero avuto una fase di latenza standard, seguita da una corta
crescita esponenziale (vedi illustrazione 28). I risultati invece mostrano che dopo una
inconsistente crescita il numero di cellule è rimasto costante (vedi illustrazione 29). La mia
ipotesi non è stata validata in quanto mi aspettavo che la parete cellulare avrebbe contrastato
l’entrata degli ioni idrogeno nelle cellule, permettendogli di mantenere l’omeostasi e seguire una
fare di latenza standard seguita da una breve fase di crescita esponenziale. Probabilmente gli ioni
idrogeno sono entrati sin dall’inizio dell’esperienza nelle cellule e hanno impedito (inattivando
gli enzimi coinvolti) la riproduzione. Un certo numero di cellule potrebbe essere sopravvissuto,
in quanto si misura, seppur con valori vicini allo zero (0.03), un’assorbanza per le 11 ore di
misurazione. Purtroppo non misurando la viabilità delle cellule non posso stabilire se i
corpuscoli cellulari erano vivi oppure morti in quanto la misura spettroscopica indica solamente
la presenza di cellule. Non monitorando nessuna fase esponenziale i batteri non si sono riprodotti
e quindi non si sono adattati al nuovo ambiente con un pH di valore 3.
0,300
0,250
Assorbanza
0,200
0,150
pH 3 D
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 28. Ipotesi di crescita batterica in
funzione del tempo della colonia D a un valore di
pH 3.
Illustrazione 29. Assorbanza in funzione del
tempo della colonia D a un valore di pH 3.
34
Stefania Battaglioni
7.1.2
LaM Biologia
2010/2011
Batteri gram negativi
La crescita della colonia dei batteri gram negativi, raffigurata nell’illustrazione 31, è simile a
quella della colonia dei gram positivi (vedi illustrazione 29). Da 0 a 5 ore e 45 minuti i batteri si
sono moltiplicati relativamente poco (valore dell’assorbanza da 0 a 0.03) da quel momento in poi
il numero di cellule è rimasto invariato.
Per questo tipo di batteri avevo avanzato due ipotesi: secondo la prima i batteri si sarebbero
comportati in modo da monitorare una lunga fase di latenza seguita da una lenta crescita
esponenziale (caso 1), mentre nella seconda ipotesi stabilivo che i batteri non si sarebbero
riprodotti (caso 2) (vedi illustrazione 30) e quindi mi aspettavo un’unica fase di latenza. I
risultati convalidano la mia seconda ipotesi (vedi illustrazione 31). Non monitorando nessuna
fase esponenziale i batteri non si sono riprodotti e quindi non si sono adattati al nuovo ambiente
con un pH di valore 3. Tra le due ipotesi formulate, quella più accreditata è espressa dal caso 2.
Probabilmente gli ioni idrogeno sono entrati sin dall’inizio dell’esperienza nelle cellule e hanno
impedito (inattivando gli enzimi coinvolti) la riproduzione. Il valore di assorbanza misurato per
tutto il tempo di coltura indica comunque che forse le cellule batteriche sono sopravvissute.
Anche in questo caso però, come per i gram positivi, non si è misurata la viabilità delle cellule e
non ho potuto stabilire se le cellule sono effettivamente sopravvissute o sono morte.
0,300
0,250
Assorbanza
0,200
0,150
pH 3 H
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 30. Ipotesi di crescita batterica in
funzione del tempo della colonia H a un valore di
pH 3.
Illustrazione 31. Assorbanza in funzione del
tempo della colonia H a un valore di pH 3.
Per il fatto che tutte e due le colonie batteriche non sono cresciute in modo esponenziale durante
la coltivazione in una soluzione con un valore di pH 3 significa che nessuna delle due è riuscita
ad adattarsi. Non si può stabilire con sicurezza se i batteri sono sopravvissuti in quanto non si è
misurata la viabilità. Alternativamente si sarebbe potuto aumentare il tempo di coltura per poter
scoprire se avrebbero impiegato più tempo a moltiplicarsi-adattarsi, oppure si sarebbe potuto
rialzare il valore del pH da 3 a 7 dopo 11 ore di coltivazione per vedere se le cellule sono
sopravvissute. I risultati finora discussi mostrano che la crescita dei due tipi di batteri è inibita se
immersi in una soluzione di valore di pH 3. Le differenti caratteristiche delle due pareti cellulari
non sembrerebbero incidere sul loro possibile adattamento.
35
Stefania Battaglioni
LaM Biologia
2010/2011
Un’ulteriori ipotesi
7.2
Il fatto che gli ioni H+ sono probabilmente entrati nei batteri immersi in soluzioni a valore di pH
3, potrebbe significare che, al momento del trasferimento nel nuovo ambiente, nel citoplasma
delle cellule erano presenti gli ioni idrogeno in minor concentrazione rispetto all'ambiente
esterno. Oltre a questa differenza di concentrazione di ioni idrogeno una seconda spinta, formata
dalla differente distribuzione delle cariche (netta negativa all’interno del battere), avrebbe potuto
influire sull’entrata degli ioni idrogeno nei batteri. Se i batteri fossero stati coltivati in una
soluzione più basica (ad esempio a un valore di pH 9) rispetto alla coltivazione in una soluzione
a pH 7, come sarebbero cresciuti?
La differenza di gradiente elettrochimico tra l’interno e l’esterno della cellula dei batteri sarebbe
stata minore se non addirittura inversa. Di conseguenza, usando gli stessi criteri usati finora per
interpretare l’adattamento dei batteri in soluzioni con differenti concentrazioni di ioni idrogeno,
in che modo le differenti pareti cellulari dei due tipi di batteri potrebbero favorire l’adattamento
in una soluzione avente un pH di valore 9?
Nelle varie prove che ho condotto, ho raccolto anche i dati della coltivazione delle due colonie in
una soluzione a pH 9 (vedi tabella 1 e illustrazioni 32 e 33):
7.2.1
Crescita delle colonie da un valore di pH 7 a 9
Gram positivi e negativi
0,300
0,300
0,250
0,250
0,200
0,200
0,150
pH 9 D
Assorbanza
Assorbanza
L’andamento delle curve dei dati acquisiti dall’esperimento di crescita delle colture batteriche (H
e D) a un valore di pH 9, presentate nelle illustrazioni 32 e 33 mostra che da 0 a 5 ore e 45
minuti avviene una crescita esponenziale "esplosiva", seguita da una fase stazionaria.
0,150
pH 9 H
0,100
0,100
0,050
0,050
0,000
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 32. Assorbanza in funzione del
tempo della colonia D a un valore di pH 9.
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 33. Assorbanza in funzione del
tempo della colonia H a un valore di pH 9.
La crescita iniziale sembrerebbe "esplosiva", ma bisogna tener conto del fatto che sono passate 5
ore e 45 minuti dalla prima alla seconda misurazione (mi sono basata sulla misurazione iniziale
di riferimento). In quel lasso di tempo i batteri hanno probabilmente attraversato anche la fase di
latenza e non sono cresciuti secondo il modello standard.
I batteri si sono moltiplicati in questo modo perché hanno trovato delle condizioni
particolarmente favorevoli o perché si sono adattati? Secondo i criteri formulati devo stabilire
36
Stefania Battaglioni
LaM Biologia
2010/2011
che ambo le colonie batteriche si sono adattate molto bene al nuovo ambiente che presentava un
pH di valore 9. Magari però l’acidità ideale per le colonie prese in esame non è di valore 7 come
si è stabilito durante la selezione dei batteri, ma potrebbe essere 9.
I batteri in questione potrebbero essere basofili, ovvero preferiscono vivere in ambienti basici (ad
esempio a un valore di pH 9), e non neutrofili, i quali preferiscono un ambiente neutro (a un pH
di valore 7). Dunque la crescita standard che ho illustrato nei grafici mostrati nelle illustrazioni
17, 18 e 19, non si riferisce più al pH di valore 7, bensì a quello di valore 9, questo perché quella
curva rappresenta la crescita ideale di quella determinata colonia e una tale crescita si ha quando
la colonia è immersa in una soluzione con l'optimum di pH, che in questo caso sarebbe di valore
9.
Di conseguenza, le ipotesi espresse inizialmente per il valore di pH 3 potrebbero valere per il
valore 7. Introducendo le colonie da un ambiente ideale con un valore di pH 9 a un ambiente
avente valore di pH 7 si ha di fatto un allungamento della fase di latenza seguita da una fase di
crescita esponenziale non più esplosiva (non misurato direttamente ma dedotto dai risultati
ottenuti). Sia i gram positivi che i gram negativi riescono in questo caso a sopravvivere,
mantenendo l’omeostasi, e a riprodursi (dopo 11 ore le colone batteriche raggiungono una
densità ottica equivalente a quella misurata a pH 9) indicando che riescono ad adattarsi in modo
simile al nuovo ambiente con una maggior concentrazione di ioni idrogeno (vedi illustrazione
34). Per il fatto che entrambe le colonie sono riuscite ad adattarsi in modo analogo alla
variazione di pH (da 9 a 7) e non potendo monitorare cosa è capitato all’interno degli esseri
unicellulari, non si riesce a stabilire se la differente composizione della parete cellulare delle
cellule incide in qualche modo sull’adattamento.
B
0,300
0,250
0,250
0,200
0,200
0,150
pH 7 D
Assorbanza
Assorbanza
A
0,300
0,150
pH 9 D
0,100
0,100
0,050
0,050
0,000
0,000
0
5¾
7½
8¾
9¾
11
0
5¾
Tempo [h]
7½
C
9¾
11
D
0,300
0,300
0,250
0,250
0,200
0,200
0,150
pH 7 H
Assorbanza
Assorbanza
8¾
Tempo [h]
0,150
pH 9 H
0,100
0,100
0,050
0,050
0,000
0,000
0
5¾
7½
Tempo [h]
8¾
9¾
11
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 34. Assorbanza in funzione del tempo della colonia D a un valore di pH 7 (A) e 9 (B) e
l’assorbanza in funzione del tempo della colonia H a un valore di pH 7 (C) e 9 (D).
37
Stefania Battaglioni
LaM Biologia
2010/2011
La mia ipotesi per i gram positivi immersi in una soluzione a pH 3, era che si sarebbero
moltiplicati secondo la crescita rossa dell'illustrazione 35. Se si attribuisce quest'ipotesi alla
situazione di crescita a pH 7 (vedi illustrazione 36), si nota che anche in questo caso l'ipotesi e i
risultati non convergono, nel senso che rispetto alla crescita standard i batteri gram positivi,
coltivati in un ambiente avente un valore di pH 7, hanno avuto una fase di latenza più lunga e
riescono a raggiungere il massimo valore di crescita (dopo la fase esponenziale).
0,300
0,250
Assorbanza
0,200
0,150
pH 7 D
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 35. Grafico dell'ipotetico andamento della
crescita dei batteri gram positvi immersi in un
ambiente a valore di pH pari a 3
Illustrazione 36. Assorbanza in funzione del
tempo della colonia D a un valore di pH 7.
38
Stefania Battaglioni
LaM Biologia
2010/2011
Al contrario. la prima ipotesi espressa per i batteri gram negativi a pH 3 (illustrazione 38, caso 1)
corrisponde alla crescita monitorata dei gram negativi coltivati in pH 7 (illustrazione 37), mentre
la seconda ipotesi (caso 2) corrisponde ai batteri coltivati a pH 3 (illustrazione 39), poiché a pH 7
la concentrazione di ioni idrogeno è considerevolmente minore rispetto quella presente a pH 3.
Per questo motivo nel primo caso i batteri sono riusciti a crescere, quindi si sono adattati, mentre
nel secondo no; ma non sono in grado di stabilire come mai si sono comportati così e se la parete
cellulare ha determinato l'adattamento.
0,300
0,250
Assorbanza
0,200
0,150
pH 7 H
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 37. Assorbanza in funzione del
tempo della colonia H a un valore di pH 7.
0,300
0,250
0,200
Assorbanza
Illustrazione 38. Grafico dell'ipotetico andamento della
crescita dei batteri gram negativi immersi in un
ambiente a valore di pH pari a 3 (linee blu) e crescita
standard (linea nera), cioè riferito alla crescita della
stessa colonia a in un ambiente a pH neutro.
L'andamento 1 ha una lenta crescita esponenziale
(quasi lineare), mentre l'andamento 2 non cresce,
permane una fase di latenza.
0,150
pH 3 H
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 39. Assorbanza in funzione del
tempo della colonia H a un valore di pH 3.
39
Stefania Battaglioni
LaM Biologia
2010/2011
Un'altra ipotesi iniziale, validata da una prima serie di misure, era che i gram positivi e i negativi
in una soluzione a pH 7 sarebbero cresciuti secondo l'andamento standard illustrato
nell'illustrazione 41. Il risultato però ottenuto per i batteri gram positivi coltivati in una soluzione
a pH 9 (vedi illustrazione 40) e gram negativi (vedi illustrazione 42) va contro l'ipotesi iniziale
perché indica che l'optimum di pH per i due tipi di batteri presi in esame non è 7, bensì 9.
0,300
0,250
Assorbanza
0,200
0,150
pH 9 D
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 40. Assorbanza in funzione del
tempo della colonia D a un valore di pH 9.
0,300
0,250
Illustrazione 41. Grafico dell'ipotetico andamento
della crescita dei batteri gram negativi e positivi
immersi in un ambiente a valore di pH pari a 7.
Assorbanza
0,200
0,150
pH 9 H
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 42. Assorbanza in funzione del
tempo della colonia H a un valore di pH 9.
Dopo aver analizzato singolarmente le crescite batteriche ho provato a introdurre in un solo
grafico (vedi illustrazione 43) le tre crescite a valori di pH (3, 7 e 9) dei due tipi di batteri presi in
esame. La tendenza dei due tipi di batteri sembra quella di riprodursi nel migliore dei modi (fase
di latenza relativamente corta ed "esplosiva" fase esponenziale) in un ambiente avente un valore
di pH 9. Quando immersi a pH 7 si misura una fase di latenza più lunga rispetto a quella
misurata a pH 9, seguita da una fase esponenziale che porta le cellule D a raggiungere lo stesso
valore di assorbanza ottenuto a pH 9 mentre le cellule H a raggiungere un valore di assorbanza
leggermente più alto rispetto quello monitorato a pH 9. Quest'ultima discrepanza fra valori
massimi di assorbanza può essere dovuta a un errore di misurazione oppure a una capacità di
crescita maggiore da parte delle cellule H rispetto a quelle di tipo D (purtroppo le misure non
sono state condotte oltre le 11 ore per motivi organizzativi). A pH 3 le due colonie batteriche
crescono in modo analogo come discusso precedentemente (7.1), non si identifica nessuna
crescita esponenziale.
40
Stefania Battaglioni
LaM Biologia
2010/2011
0,300
0,250
Assorbanza
0,200
pH 3 H
pH 3 D
pH 7 H
pH 7 D
pH 9 H
pH 9 D
0,150
0,100
0,050
0,000
0
5¾
7½
8¾
9¾
11
Tempo [h]
Illustrazione 43. Assorbanza in funzione del tempo delle colonie H e D ai valori di pH 9, 7 e 3.
I due tipi di batteri H e D immersi in ambienti aventi un pH di valore 7, visto che crescono come
mostrato nell'illustrazione 43, riescono ad adattarsi mentre gli stessi immersi in una soluzione a
pH 3 non riescono ad adattarsi ma sopravvivono in quanto non si riconosce nessuna crescita
esponenziale.
I risultati registrati mostrano che malgrado i due tipi di batteri presentano delle pareti cellulari
con struttura diversa, si comportano analogamente per quanto riguarda la loro crescita in
funzione del tempo a differenti concentrazioni di pH.
41
Stefania Battaglioni
LaM Biologia
2010/2011
8 Conclusioni
La mia ricerca ha provato a rispondere alla seguente domanda: "In che modo due tipi di batteri
gram positivi e gram negativi, che vivono normalmente a un valore neutro di acidità, si adattano
a delle soluzioni con acidità diverse?".
A livello teorico si sono identificate svariate componenti della cellula che potrebbero incidere
sulla capacità di adattamento (NADH, DNA, proteine-enzimi) ma purtroppo non ho potuto
diagnosticare sperimentalmente queste costituenti. La strategia impiegata è stata quella di
misurare empiricamente la crescita dei due tipi di batteri con pareti cellulari diverse (gram + / -)
in ambienti aventi differenti valori di pH in modo da poter indirettamente individuare quale dei
due esseri viventi riesce ad adattarsi meglio.
Lo strumento d'indagine dichiara che con più una colonia riesce a crescere come il suo
riferimento standard, con più questa si è adattata mentre nel caso in cui non si misura nessuna
crescita allora la colonia batterica sopravvive mantenendo l'omeostasi oppure muore.
Inizialmente, stabilendo il valore di pH pari a 7 per l'optimum di crescita per i due tipi di batteri,
non monitorando nessuna fase di crescita esponenziale per ambo i batteri gram positivi e
negativi, si è concluso che non si sono riprodotti e quindi non si sono adattati al nuovo ambiente
avente un pH di valore 3. Per il fatto che tutte e due le colonie batteriche non sono cresciute in
modo esponenziale durante la coltivazione in una soluzione con un valore di pH 3 significa che
nessuna delle due è riuscita ad adattarsi. Non si può stabilire con sicurezza se i batteri sono
sopravvissuti in quanto non si è misurata la viabilità. Alternativamente si sarebbe potuto
aumentare il tempo di coltura per poter scoprire se avrebbero impiegato più tempo a
moltiplicarsi-adattarsi, oppure si sarebbe potuto rialzare il valore del pH da 3 a 7 dopo 11 ore di
coltivazione per vedere se le cellule sono sopravvissute. I risultati rivelano che la crescita dei due
tipi di batteri è inibita se immersi in una soluzione di valore di pH 3. Le differenti caratteristiche
delle due pareti cellulari non sembrerebbero incidere sul loro possibile adattamento.
Secondo i criteri formulati posso stabilire che ambo le colonie batteriche si sono adattate molto
bene al nuovo ambiente che presentava un pH di valore 9. Si è quindi pensato che magari
l’acidità ideale per le colonie prese in esame non era di valore 7 come si era stabilito durante la
selezione dei batteri, ma potrebbe essere stata di valore di pH 9.
Secondariamente si è dunque ipotizzato che i batteri avessero avuto un valore di pH 9 come
optimum di crescita. Per il fatto che entrambe le colonie sono riuscite ad adattarsi in modo
analogo alla variazione di pH (dal valore 9 a 7 e dal valore 7 a 3) e non potendo monitorare cosa
è capitato all’interno degli esseri unicellulari, non si riesce anche in questo caso a stabilire se la
differente composizione della parete cellulare delle cellule incide in qualche modo
sull’adattamento.
L'indagine pratica ha mostrato quindi che malgrado i due tipi di batteri presentano delle pareti
cellulari con struttura diversa, si comportano analogamente per quanto riguarda la loro crescita in
funzione del tempo a differenti concentrazioni di pH (vedi illustrazione 43). Le colonie di batteri
gram positivi e negativi selezionati per questa ricerca crescono rapidamente e in elevata quantità,
dimostrando di sapersi adattare quando sono immerse in una soluzione avente un valore di pH 9;
crescono più lentamente ma raggiungono comunque la stessa quantità a pH 7 e non riescono a
riprodursi nello stesso modo (si misura una fase di latenza costante) ma sopravvivono a pH 3.
42
Stefania Battaglioni
LaM Biologia
2010/2011
Le ipotesi formulate inizialmente nel capitolo 4 non sono state validate completamente.
Probabilmente identificando sin dall'inizio l'andamento delle colonie a pH 9 avrei potuto
riformularle e progettare un'attività pratica più idonea. Se già prima di iniziare il LaM ero
cosciente della complessità del tema che ho scelto, ora mi accorgo che è ancora più complesso.
Il fenomeno vita come detto è estremamente articolato, ci sono innumerevoli motivi per cui un
determinato battere riesce a sopravvivere ed eventualmente adattarsi in un ambiente poco
ospitale, e ci sono innumerevoli differenze tra due colonie e addirittura tra due singoli individui.
Pensavo che semplificando la realtà al modello proposto dal mio LaM per indagare
sull'adattamento dei batteri mi avrebbe potuto dare dei risultati più significativi. Ho afferrato
però in che modo si possono falsificare le teorie, come disse Karl Popper (1902-1994), filosofo
del XX secolo, per rendere vera una teoria, è necessario che sia rispettata in tutti i casi, ma basta
anche solo un esempio in cui questa non è convalidata, e la teoria cade. Inoltre afferma che una
teoria per essere scientifica deve anche essere falsificabile, perché così porta inevitabilmente al
suo miglioramento (Gabriele Tori, 2010). Pure Albert Einstein sostenne che se avesse avuto
un'altra vita, l'avrebbe passata a falsificare la teoria della relatività, al fine di sentirsi poi
obbligato a farne una migliore ( Maccagno, 2010).
43
Stefania Battaglioni
LaM Biologia
2010/2011
9 Bibliografia
Libri
AAVV, Corso di aggiornamento di microbiologia, Bellinzona, Istituto cantonale di microbiologia, 2010
Hans G. SCHLEGEL, Microbiologia, Bologna, Zanichelli, 1996, 482 p., (1^ ed. 1976)
CAMPBELL, REECE, TAYLOR, SIMON, Immagini della biologia, Bologna, Zanichelli, 2006 (1^ed.it.
2000), 695 p., (1^ed. 1997)
Appunti
LOCARNINI Tiziano, Appunti orali, Bellinzona, Liceo cantonale, 2010
MACCAGNO Ennio, Appunti orali, Bellinzona, Liceo cantonale, 2010
MORESI Ruben, Appunti personali di biologia di 2a liceo, a cura di Stefania Battaglioni, Bellinzona, Liceo
cantonale, 2009
PE Nicola, Appunti personali di chimica di 2a liceo, a cura di Stefania Battaglioni, Bellinzona, Liceo
cantonale, 2009
SPEZIGA Davide, Appunti orali, Bellinzona, Liceo cantonale, 2010
Web
ABRUSCI Michele:
http://host.uniroma3.it/dipartimenti/biologia/new_sito_bio/Abrusci/2009_2010/Sulla%20storia%20della%2
0biologia.ppt (03.10.2010)
ARIENTI Giuseppe, Le basi molecolari della nutrizione, Perugia, Piccin, 2003, 803 p.
http://books.google.ch/books?id=0361QfHKmIC&pg=PA171&dq=catalisi+enzimi+pH&hl=it&ei=naMDTfu3MNDvsgaR2_XoCQ&sa=X&oi=book_re
sult&ct=result&resnum=1&ved=0CCYQ6AEwAA#v=onepage&q=catalisi%20enzimi%20pH&f=false
(11.12.10)
CAVALI: http://www.cavali.co.uk/cavali/default.asp?menuitemID=131 (16.01.11)
DAVI Elisa: http://www.liceofoscarini.it/studenti/c2003/evoluzione/Ipertesto/lamarckismo.html
(03.10.2010)
DE PASCALIS Pierluigi: http://www.nonsolofitness.it/fitness/biologia/enzimi.html (09.12.2010)
DOC STUDENTI: http://doc.studenti.it/appunti/biologia/confronto-pareti-cellulari-gram-gram.html
(14.08.10)
FOODLEXICON: http://it.foodlexicon.org/p0000800.php (16.01.11)
Hoquet Thierry: http://www.scricciolo.com/Nuovo_Neornithes/Buffon.htm (16.01.11)
LABIANCA: http://medicinapertutti.altervista.org/argomento/parete-batterica-o-sacculo (24.08.10)
LINGUAGGIO GLOBALE: http://www.linguaggioglobale.com/animali/txt/16.htm (16.01.11)
44
Stefania Battaglioni
LaM Biologia
MASI Alberto: http://www.scricciolo.com/Nuovo_Neornithes/cronologia_1.htm (16.01.11)
MEDNAT: http://www.mednat.org/cure_natur/omeostasi.htm (24.12.2010)
PACIFICI Bruno: http://www.pacifici-
2010/2011
net.it/biologia/microbiologia/La%20colorazione%20di%20Gram.htm (08.12.2010)
PACIFICI Bruno 2: http://www.pacifici-net.it/biologia/microbiologia/La%20parete%20cellulare.htm
(14.08.10)
PADOA-SCHIOPPA Emilio:
http://www.formazione.unimib.it/DATA/personale/PADOA/hotfolder/2/lez4%20cellula.pdf (28.11.2010)
POLLIOTTO M.: http://polliotto.altervista.org/dispense/I%20batteri.pdf (13.01.2011)
SCIORTINO Luca: http://www.swif.uniba.it/lei/2r/2Rscienze/2RScienze_1_3_Manzi-Sciortino.pdf
(03.10.2010)
SEGRETO Michele: http://michelesegreto.altervista.org/membranabatterica.pdf (15.08.10)
UNI ROMA: http://schubert.bio.uniroma1.it/corsiol/docecorsi/le%20proteine%20di%20membrana.pdf
(15.08.10)
UNICAM: http://www.unicam.it/discimo/morfologia/Didattica/Microlab/on%20line/2bcellula.pps
(24.08.10)
UNIPV: www-1.unipv.it/tslmra22/1%20Potenziale%20di%20Membrana.ppt (12.12.2010)
WIKIPEDIA Carl Woese: http://it.wikipedia.org/wiki/Carl_Woese (03.10.2010)
ZYXEL, 2007:
zyxel-nsa210.lilu2.ch/MyWeb/public/Chimica_Web/BICIII/RisposteStruttProteine.doc (16.01.11)
Illustrazioni
ALLZOON, 2009: http://www.allzoon.com/2009/01/regni-e-domini/ (26.11.10)
BIOCHEMICAL JOURNAL: http://www.biochemj.org/bj/431/0013/bj4310013.htm (08.12.10), modificata
il 11.12.10
CAMPBELL, REECE, TAYLOR, SIMON, Immagini della biologia, Bologna, Zanichelli, 2006 (1^ed.it.
2000), 695 p., (1^ed. 1997)
DE PASCALIS Pierluigi: http://www.nonsolofitness.it/fitness/biologia/enzimi.html (12.12.10)
GIAMMANCO Giovanni, 2004:
http://gmg.xoom.it/Microonline/CrescitaMetabolismoBatteri/CrescitaMetabolismoBatteri.htm (21.10.10),
modificata il 21.10.10
MANTAX: http://www.mantax.net/bionline2002/euc_veg.htm (28.11.10)
OXFORD, 2009: http://www.zoo.ox.ac.uk/group/cavalier_smith/index.htm (26.11.10)
PARPAGLIONI Giuliano: http://www.molecularlab.it/insidemicro/?p=11 (16.01.11) modificata il 16.01.11
THEA, 2004: http://www.albanesi.it/Alimentazione/amino.htm (15.01.11)
45
Stefania Battaglioni
LaM Biologia
2010/2011
UNICAM: http://www.unicam.it/discimo/morfologia/Didattica/Microlab/on%20line/2bcellula.pps
(24.08.10)
UNIFI, 2005: http://www.scibio.unifi.it/triennali/biochem/proteine/proteins6.html (11.12.10)
UNISA: http://www.dia.unisa.it/~ads/BIOINFORMATICA/BiologiaMolecolare/pag/procariotieucarioti.html (16.09.10)
WIKIPEDIA 1: http://it.wikipedia.org/wiki/Carl_Woese (03.10.10), modificata il 26.11.10
WIKIPEDIA 2: http://it.wikipedia.org/wiki/Prokaryota (28.11.10)
WIKIPEDIA 3: http://it.wikipedia.org/wiki/Pressione_osmotica (28.11.10)
46
Stefania Battaglioni
LaM Biologia
2010/2011
Dichiarazione
Il/la sottoscritto/a ……………………………..dichiara di aver compilato e redatto di persona il
lavoro di maturità. Dichiara pure di non aver commesso plagio e di aver indicato chiaramente e
coscienziosamente le parti prese dalle diverse fonti.
Luogo, data e firma
………………, …………………. …………………………..……..
47
Stefania Battaglioni
10
LaM Biologia
2010/2011
Allegati
Sterilizzazione e preparazione nutrimento Agar – agar
Materiale
Autoclave
Becher
Acqua mineralizzata e non
Fogli d’alluminio
Bottiglie apposite
Guanti
Nutrimento
Agar – agar
Alcol etilico 70%
Becco bunsen
Capsule Petri
Etichette e penna
Frigorifero
Procedimento
Iscriversi per l’utilizzo dell’autoclave
controllare che ci sia acqua demineralizzata nell’apposito contenitore dell’autoclave
introdurre un becher contenente acqua nell’autoclave e immergervi la sonda termica
a) preparare una bottiglia e riempirla per metà con acqua mineralizzata e Agar – agar
nelle giuste concentrazioni e creare con dell’alluminio un tappo non troppo aderente,
oppure se il contenitore possiede già un proprio tappo lasciarlo leggermente aperto (per
via della pressione)
b) introdurre nell’autoclave il materiale che si vuole sterilizzare avvolto da alluminio, se
non composti da vetro resistente agli sbalzi termici
dopo che l’autoclave ha finito di lavorare lasciare raffreddare il materiale finché è
“prendibile” (circa 50 °C) e chiudere il tappo (eventualmente si può accelerare la
procedura con l’ausilio di acqua fredda, sempre che il recipiente resista agli sbalzi
termici. Attenzione: non mettere a contatto ciò che deve’ essere sterile con l’acqua!)
nel caso della preparazione di capsule di Petri con nutrimento, prendere la pila di capsule
imballate e sterili, e togliere delicatamente l’involucro lasciandolo integro
intanto preparare il laboratorio spruzzando alcol etilico 70% sulla superficie del tavolo e
tutt’attorno, mettersi i guanti, lavarli con l’alcol e accendere un becco bunsen lasciando la
fiamma gialla
stando sempre al massimo a 30 centimetri di raggio dalla fiamma aprire delicatamente il
tappo dall’alluminio della bottiglia contenente il nutrimento e far passare alla fiamma sia
48
Stefania Battaglioni
LaM Biologia
2010/2011
il tappo che il bordo della bottiglia (quest’ultima procedura dev’essere attuata
ogniqualvolta si debba lasciare il tavolo da laboratorio o si esce dai 30 cm di raggio)
cominciare a riempire le capsule con il nutrimento Agar – agar (che inizialmente è a una
temperatura di circa 50°C) dal basso, alzando la pila tutte le volte affinché ci sia il
minimo contatto con l’estero e quindi il minimo contagio
la quantità corretta di Agar – agar nelle capsule, usata nelle ricerche scientifiche, è di 0.5
- 1.0 cm di altezza, qui si mettere giusto la quantità necessaria per coprire tutta l’area
della capsula
riempirle tutte e lasciarle raffreddare per circa mezzora finché l’Agar – agar si solidifica
(a circa 40°C)
aspettato il tempo dovuto e dopo aver controllato che il nutrimento si sia veramente
solidificato, riprendere l’involucro delle capsule e rimetterglielo
chiudere il sacchetto con un’etichetta con scritto Cosa c’è dentro, Nome, Data (ev.
Concentrazione)
Riporre i preparati in frigorifero capovolti (cosicché se ci dovessero essere all’interno dei
batteri essi non potranno usufruire del nutrimento e riprodursi).
49
Stefania Battaglioni
LaM Biologia
2010/2011
Protocollo per trasferire le colonie
Materiale
Becco bunsen
Capsule Petri sterili
Capsule Petri con già le colonie
Ansa di metallo
Guanti, occhiali, alcol
Parafilm
Procedimento
Sterilizzare il piano di lavoro e i guanti con l’alcol.
Cercare una piccola e isolata colonia di batteri da poi prelevare, trovatola marcarla sul
retro della capsula e nominarla (ad esempio “A”). Restando a 30 cm di raggio dal bunsen
aprire la capsula Petri dove si ha marcato la colonia.
Mettere l'ansa di metallo nel fuoco finché diventa incandescente per sterilizzarla e poi
posarla leggermente sull’Agar-agar ancora sterile per far si che si raffreddi.
Delicatamente con l'ansa prelevare un po’ della colonia precedentemente marcata e
spalmarla a strisce su un bordo della capsula Petri, quindi girare l'ansa di 180° e
ripassando su metà della zona già toccata e distendere nuovamente a un po’ più di 90°
dalla precedente affinché si diluisca la quantità di batteri.
Rimettere nel fuoco l'ansa di metallo e raffreddarla. Quindi distendere nuovamente,
questa volta però partendo dalla seconda stesura. Girare ancora di 180° l'ansa e spalmare
la quarta stesura. (vedi figura seguente)
Chiudere tutte le capsule di Petri, le nuove metterle in incubatrice mentre le altre in
frigorifero.
50
Stefania Battaglioni
LaM Biologia
2010/2011
Colorazione Gram
Materiale
Cristal violetto
Lugol
Safranina O
Soluzione decolorante (95% alcol etilico
e 5% acetone)
Microscopio
Bacchettina di ferro
Guanti
Occhiali
Bunsen
Capsule Petri con batteri da testare
Vetrini
Acqua di rubinetto e sterile
Pipetta Pasteur
Procedimento semplificato
Fase
Durata d'azione
Soluzione
1
30 sec.
Cristal violetto
2
30 sec.
Acqua di rubinetto
3
60 sec.
Lugol
4
20 sec.
Acqua di rubinetto
5
5-10 sec.
Decolorante
6
30 sec.
Acqua di rubinetto
7
60 sec.
Safranina O
8
60 sec.
Acqua da rubinetto
9
5 min.
Asciugare a 50 °C
51
Stefania Battaglioni
LaM Biologia
2010/2011
Procedimento dettagliato
1. Preparare le soluzioni dei coloranti con una punta di spatola di sostanza e 100 ml di
acqua distillata.
2. Preparare il tavolo da lavoro sterilizzandolo, indossare i guanti, gli occhiali e accendere il
bunsen.
3. Prendere le capsule di Petri contenenti i batteri che si vogliono testare e un vetrino.
4. Sul vetrino mettere una goccia d’acqua sterile e con l’ausilio dell'ansa di metallo,
precedentemente sterilizzata con il fuoco, prendere una quantità infima di batteri da una
capsula di Petri e scioglierli nella goccia.
5. Tenere il vetrino vicino al fuoco affinché l’acqua evapori e i batteri si fissano al vetrino.
6. Mettere una o più gocce, basta che tutti i batteri siano immersi, di soluzione cristal
violetto sui batteri, aspettare 30 secondi e sciacquare delicatamente sotto il rubinetto
facendo attenzione che il getto non tocchi direttamente i batteri.
7. Mettere una o più gocce di Lugol, il quale serve a fissare il colore, sul vetrino (se il
liquido non si estende bene su tutta la superficie aiutarsi con la punta di una pipetta
Pasteur) aspettare 60 secondi e risciacquarlo per 20 secondi.
8. Restando sopra il lavandino lavar via il colorante (sempre che se ne vada) con la
soluzione decolorante per 5-10 secondi, stando sempre attenti a non mettere i batteri sotto
il getto diretto, quindi risciacquare con acqua per altri 30 secondi.
9. Infine colorare ancora la superficie con la soluzione di safranina O, aspettare 60 secondi e
risciacquare bene con acqua per altri 60 secondi.
10. Aspettare che il tutto asciughi e con il microscopio verificare se i batteri sono di colore
rosa - rosso o blu – violetto.
11. Ripetere l'operazione almeno tre volte per assicurarsi del risultato ottenuto.
Risultati
Gram + blu - violetto
Gram - rosa - rosso
52
Stefania Battaglioni
LaM Biologia
2010/2011
Misurazione dell'assorbanza e della trasmittanza di colonie in Agar liquido
Materiale
Agar – agar liquido sterile
2 beute
2 fornelli con magnetizzatore
2 magneti
diverse pipette Pasteur sterili
becco bunsen
spettrofotometro
2 cuvette
materiale di base (guanti, alcol,
occhiali)
2 colonie batteriche
ancia di metallo
2 recipienti “spazzatura biologica”
recipiente “oggetti da sterilizzare”
alluminio
Fare molta attenzione a lavorare con i batteri perché sono in grande quantità e potenzialmente
patogeni, quindi sterilizzare ogni oggetto toccato!
Procedimento:
Preparare l'Agar – agar liquido sterile
Versare 150 mL di Agar – agar in una beuta e con l'ancia in metallo prelevare da una
colonia una determinata quantità di batteri, quindi agitare l'ancia all'interno dell'Agar.
Fare la stessa cosa con l'atra beuta e un altra colonia batterica cercando di prendere la
stessa quantità di batteri.
Mettere le beute con all'interno i magneti (devono mescolare ma non creare schiuma se
no vengono spaccate le cellule) sui fornelli ad una temperatura di circa 30 °C e ricoprirle
con dell'alluminio.
5 minuti prima di cominciare la misurazione accendere lo spettrofotometro,
impostare la lunghezza l'onda su 600 nm e tararlo prendendo dell'Agar sterile come punto
di riferimento
Arrivato il momento della misurazione accendere il bunsen, prendere la beuta contenente
i batteri interessati e, sempre stando vicino alla fiamma, prendere con una pipetta Pasteur
la quantità necessaria di agar per riempire la cuvette
Richiudere la beuta con l'alluminio e coprire la cuvette con del parafilm, così da evitare
che i batteri si disperdano nell'ambiente visto che potrebbero essere patogeni. Mettere la
pipetta Pasteur nel contenitore “oggetti da sterilizzare” e chiuderlo (in seguito questo
contenitore verrà messo nell'autoclave)
Andare allo spettrofotometro e misurare la trasmittanza e l'assorbanza. Fare la stessa cosa
anche per l'altra colonia batterica e marcare i dati (attenzione a cosa si tocca!)
53
Stefania Battaglioni
LaM Biologia
2010/2011
Finita la misurazione, stando vicino alla fiamma, versare l'Agar contaminato delle cuvette
nel recipiente “spazzatura biologica” che contiene circa 100 mL di alcol al 70%
Lavarsi i guanti con l'alcol, pulire ciò che si ha toccato e lavare prima con l'alcol e poi
con acqua e sapone le cuvette. L'alcol usato per pulire le cuvette va nel recipiente
“spazzatura biologica” mentre acqua e sapone nel lavandino.
Ripetere l'esperimento quante volte è necessario
Al momento di mettere via tutto prendere un grande recipiente da usare come “spazzatura
biologica” e versarci dentro alcol al 70% molto sale e sapone. Questo cocktail non lascia
scampo ai batteri! Versare al suo interno tutto ciò che contiene i batteri (Agar
contaminato delle cuvette, delle beute e del piccolo recipiente “spazzatura biologica”), in
seguito lavare tutto come appena spiegato, cioè con alcol e sapone, mentre il grande
recipiente va messo in frigorifero.
54

![5\) batteri [modalità compatibilità]](http://s1.studylibit.com/store/data/000928299_1-28a224c15810efb654d8d9e4b207aa31-300x300.png)