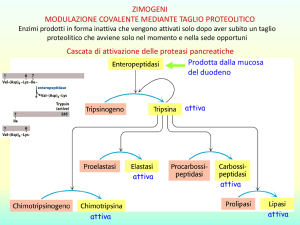
ENZIMI
Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle
reazioni cellulari e lavorano in condizioni blande di temperatura e pH (sono in
grado di aumentare la velocità delle reazioni biologiche anche di 1020 volte).
Durante la reazione l’enzima può essere temporaneamente modificato ma
alla fine del processo ritorna nel suo stato originario, un enzima viene riciclato
in modo da poter prendere parte alla stessa reazione numerose volte.
Gli enzimi catalizzano le reazioni con una Specificità molto
elevata: quando un enzima funziona correttamente non si
formano mai prodotti secondari di reazione (che potrebbero
essere potenzialmente tossici per la cellula)
Affinché un enzima funzioni correttamente è essenziale:
1) Che conservi la sua conformazione nativa: struttura proteica
tridimensionale biologicamente attiva
2) La presenza di gruppi funzionali specifici che partecipano alla
catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o
quelli di cofattori)
Ioni inorganici (Mg2+, Zn2+), o molecole
organiche o metallorganiche (coenzimi)
3) Condizioni appropriate di temperatura e pH, che influenzano la
stabilità della struttura proteica degli enzimi e quindi la loro attività
catalitica. Ogni enzima possiede un intervallo ideale di valori di
temperatura e pH all’interno del quale è attivo.
Classificazione: In base al tipo di reazione che catalizzano
OSSIDORIDUTTASI (deidrogenasi, ossigenasi, perossidasi, ossidasi, riduttasi)
Reazioni di ossido-riduzione (trasferimento di elettroni, ioni H:¯ o H•)
TRANSFERASI (chinasi, transamminasi o amminotransferasi…)
Reazioni di trasferimento di un gruppo, richiedono spesso la presenza di un coenzima
(es.: le Chinasi >> trasferiscono un gruppo fosfato dall’ATP su un substrato; le Transamminasi
>> trasferiscono un gruppo amminico)
IDROLASI
Reazioni di idrolisi dei legami C=O, C-N, C-C, P-O-P….(l’H2O agisce da accettore del gruppo
eliminato)
LIASI (sintasi, decarbossilasi…)
Reazioni di lisi di un substrato che danno luogo alla formazione di un doppio legame.
Reazione di eliminazione non idrolitica e non ossidativa.
ISOMERASI
Reazioni di cambiamenti strutturali all’interno di una stessa molecola (isomerizzazioni)
LIGASI (sintetasi)
Reazioni di condensazione di 2 substrati che richiedono l’energia chimica di un nucleotide
trifosfato (ATP).
L’enzima partecipa alla reazione che catalizza senza modificare lo stato di equilibrio della
reazione. L’enzima accelera i tempi con cui reagenti e prodotti raggiungono l’equilibrio.
L’enzima non modifica la variazione di energia libera tra reagenti e prodotti che si verifica
durante la reazione
Per es.:
A
GA = Energia libera reagenti
GB = Energia libera prodotti
B
ΔG0 = variazione di energia libera della
reazione (rende conto della spontaneità
della reazione)
ΔG0 < 0 = reazione esoergonica
(spontanea)
ΔG0 > 0 = reazione endoergonica (non
spontanea)
Affinché avvenga la
trasformazione dei reagenti in
prodotti è necessario superare
un dislivello energetico:
ENERGIA DI ATTIVAZIONE (ΔG0‡)
(correlata alla velocità della
reazione)
A
B
ΔG10‡ = Eatt della reazione diretta
ΔG-10‡ = Eatt della reazione inversa
ENERGIA DI ATTIVAZIONE (ΔG0‡)
A
B
Quantità minima di energia che le
molecole di reagente devono avere
per superare gli ostacoli che si
oppongono alla trasformazione in
prodotti:
1) URTI MOLECOLARI
2) ORIENTAMENTO
3) FORZE REPULSIVE fra le molecole
È l’energia necessaria a raggiungere e superare lo stato di transizione della reazione.
STATO DI TRANSIZIONE: è il momento più difficile della reazione, le molecole di
reagente che urtano sono disposte correttamente per trasformarsi, subiscono
distorsioni e sono tese perché contemporaneamente si devono rompere alcuni
legami e formarsene degli altri. Solo le molecole con energia sufficiente possono
superarlo e andare avanti nella reazione.
È fornita dall’En. Cinetica delle molecole di reagente in movimento, che è convertita
in energia libera G: le molecole di reagente che hanno un’En. Cin. ≥ all’Eatt passano
dallo stato iniziale allo STATO DI TRANSIZIONE
LA VELOCITÀ DELLA REAZIONE DIPENDE DALL’ENERGIA DI ATTIVAZIONE
La velocità di reazione è elevata se Eatt è bassa: vuol dire che un maggior numero di
molecole hanno l’en. Cinetica media ≥ all’Eatt .
La velocità di reazione è bassa se Eatt è alta: vuol dire che poche molecole hanno l’en. Cinetica
media ≥ all’Eatt .
L’ENZIMA AGISCE ABBASSANDO L’ENERGIA DI ATTIVAZIONE
Modifica il meccanismo della reazione e crea un ambiente in cui i reagenti non
incontrano ostacoli alla reazione
Substrato
(reagente)
S+E
ES
E+P
Prodotto
Complesso Enzima/substrato
S‡
(in assenza di
enzima)
ES‡
ΔG0‡ ES
EP‡
E+S
Stato intermedio della
reazione che si trova ad
un minimo energetico
ΔG0‡ EP
ES
E+P
L’enzima lega il reagente (o i reagenti) >> SUBSTRATO/I.
Abbassa l’Eatt nella formazione di un complesso enzima/substrato (ES)
Promuove direttamente l’evento catalitico rilasciando il prodotto e ritornando inalterato nel
suo stato originario
S+E
ES
E+P
L’interazione reversibile fra enzima e substrato (o più substrati) è il passo
fondamentale anche nelle reazioni enzimatiche più complesse.
La formazione del complesso ES comporta il legame fra il SITO ATTIVO dell’enzima
e il substrato/i.
Tasca della proteina in cui sporgono le catene laterali di alcuni residui
amminoacidici che costituiscono il sito di legame per il substrato (responsabile
della specificità) e di altri residui amminoacidici, o cofattori che costituiscono il sito
catalitico (responsabile dell’evento catalitico)
La formazione di legami fra il sito attivo dell’enzima e il substrato è un processo
esoergonico: libera l’energia necessaria ad abbassare la barriera di Enatt.
Quando si forma il complesso ES il
substrato è bloccato nella corretta
posizione (La specificità di legame
fa si che il complesso ES si formi
molto facilmente).
Il substrato nel complesso ES subisce distorsioni in
modo che gli atomi che devono reagire sono
avvicinati. Le interazioni fra sito attivo di un enzima e
substrato diventano ottimali solo quando è raggiunto
lo stato di transizione del passaggio ES → E + P
stato di transizione
S = substrato
da scindere
EP
ES‡
ΔG0‡ ES
EP‡
E+S
ΔG0‡ EP
ES
E+P
Se il sito attivo fosse perfettamente complementare al
substrato la reazione non procederebbe
Nelson • Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright © 2014
6 | 10
La specificità del legame enzima/substrato può essere spiegata col modello
chiave-serratura di Fisher
Il sito attivo possiede
dei punti di ancoraggio
specifici per i gruppi
funzionali del
substrato
Il potere catalitico di un enzima può essere spiegato col modello
dell’adattamento indotto di Koshland
L’enzima ha un sito che può alloggiare in modo specifico un substrato
ma questo sito diventa
complementare al substrato
solo nello stato di
transizione e solo attraverso
un cambiamento
conformazionale
dell’enzima stesso
Nel distorcere il substrato l’enzima stesso cambia conformazione
adattando perfettamente la forma del sito catalitico allo stato di
transizione del substrato e presentando ad esso i suoi gruppi
catalitici.
esochinasi
(è una trasferasi: trasferisce sul C-6 del glucosio un gruppo
fosfato donato dall’ATP e produce glucosio-6-fosfato)
velocità di reazione
Effetto della temperatura sulla velocità
di una reazione enzimatica
La velocità di reazione aumenta
all’aumentare della temperatura sino a
raggiungere un valore massimo
(Mantenendo costanti pH, [E] e [S])
Optimum di temperatura: è
diverso per i diversi enzimi
A T° superiori a quella ottimale
viene alterato lo stato
energetico del sistema e
l’enzima va incontro a
modificazioni strutturali del
sito attivo (rottura dei legami
deboli, denaturazione)
Effetto del pH sulla velocità di una reazione enzimatica
Da ricollegare al diverso stato di protonazione delle catene laterali di
residui amminoacidici che costituiscono il sito catalitico e il sito di
legame per il substrato.
Cys-25
Cys-25
His-159
Cys-25
His-159
5
6
7
8
9
Massima attività: intervallo di pH
compreso fra i pKa di due residui
amminoacidici del sito attivo (fra pH 4.2 e
8.2). In questo intervallo le catene laterali
di entrambi i residui aminoacidici sono
ionizzati.
S¯
pH
H
4
l ―
C
― l
3
2
CH
l
2
O=C
l
C ―H
―
N
H
l
CH 2
H
l
+
C―N CH
N
H
His-159
=C
O
velocità di reazione
Massima attività
PAPAINA = enzima proteolitico, scinde
i legami peptidici delle proteine.
In quest’enzima la cisteina è più acida
e l’istidina più basica di quanto non lo
siano in altre condizioni
FORMANO UNA COPPIA IONICA NEL
SITO ATTIVO
C―N
H
H
His-159 (pKR 8.2)
Cys-25 (pKR 4.2)
1) Perché studiare la cinetica di una reazione enzimatica?
Per determinare dei parametri specifici e caratterizzanti per un dato enzima che ci dicono:
- Quanto un enzima è affine ad un dato substrato
- Quanto l’enzima è efficiente
- Come posso controllare la velocità della reazione
- Come posso regolare l’attività catalitica dell’enzima (inibendolo o attivandolo)
2) Cosa devo misurare per studiare la cinetica enzimatica?
LA VELOCITA’ DI REAZIONE AL TEMPO ZERO
IN FUNZIONE DELLA CONCENTRAZIONE DI SUBSTRATO
(misurata come variazione della concentrazione di prodotto ottenuto nel tempo, o di
substrato consumato nel tempo)
3) Come interpreto i dati ottenuti?
Applico delle equazioni matematiche.
Il modello matematico BASE per elaborare i dati di una cinetica enzimatica
(per enzimi non allosterici)
è quello proposto da L. Michaelis e M. Menten (1913)/Haldane e Briggs (1925)
CINETICA ENZIMATICA
Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione
ad una determinata [S], misurata come variazioni della concentrazione del prodotto o del
reagente in un dato intervallo di tempo.
S→P
v = Δ[P]
Δt
=
[P] = aumenta nel tempo
[S]= diminuisce nel tempo
_ Δ[S]
Δt
[P]
[S]
Col procedere della reazione le curve
cinetiche si appiattiscono: la velocità
non subisce variazioni. S è consumato
perché trasformato in P e la reazione
tenderà a raggiungere l’equilibrio.
tempo
Se voglio avere una stima esatta di quale sia la velocità di reazione quando utilizzo una data
concentrazione di substrato, devo misurare la velocità della reazione al momento iniziale (entro
i primi 50-60 sec), quando la quantità di prodotto formato è molto bassa e la concentrazione
del substrato ha un valore preciso (quello iniziale stabilito dallo sperimentatore).
COME DETERMINO LA VELOCITA’ INIZIALE?
Studio di una reazione enzimatica semplice (1 solo substrato e 1 solo stadio
intermedio):
1) miscelo l’enzima con il suo substrato, lavoro a temperatura e pH costanti,
2) mantengo inalterata la [E] e modifico la [S]: per ogni esperimento misuro come
varia la velocità di reazione nel tempo. S → P v = Δ[P] = _ Δ[S]
Δt
Δt
Per es.: faccio 4 esperimenti con 4 diverse
concentrazioni di substrato. La velocità di
reazione varia al variare della
concentrazione del substrato
e dipende da una costante di velocità k che
è specifica per ogni reazione.
v = Δ[P]
Δt
=
_ Δ[S]
Δt
v = k [S]
k = -1/Δt
(costante di velocità)
3) Determino il valore della velocità di reazione nello stadio iniziale (v0) alle diverse [S].
VELOCITA’ INIZIALE (v0) è calcolata come pendenza della tangente alla curva cinetica.
Per ognuna delle curve cinetiche ottenute a diverse [S] viene calcolata la v 0
(4)
v0 (3)
v0 (2)
v0 (1)
v0 = k [S]
È direttamente proporzionale alla concentrazione iniziale di
reagente [S] usata per la reazione.
Per gli enzimi che seguono la cinetica di Micaelis-Menten la
dipendenza della v0 dalla [S] è descritta da una curva iperbolica
ENZIMI CHE SEGUONO LA CINETICA DI MICHAELIS-MENTEN
Alte [S] = la v0 non varia molto al variare
di [S], l’enzima è quasi completamente
saturato, viene raggiunta
asintoticamente una velocità di
reazione massima
Basse [S] = la velocità di reazione v0
dipende strettamente dalla [S],
aumenta all’aumentare della [S]
Velocità iniziale v0 (μM/min)
Inserendo i valori di v0 ottenuti per le diverse [S] utilizzate in un grafico
ottengo una curva iperbolica
Concentrazione substrato [S] (mM)
Posso spiegare questo comportamento con un’equazione che
correla la v0 alla [S], alla Vmax e ad una costante di affinità (Km)
ENZIMI CHE SEGUONO LA CINETICA DI MICHAELIS-MENTEN
Mostrano una dipendenza della velocità iniziale (v0) dalla
concentrazione di substrato di tipo IPERBOLICO.
Catalizzano una reazione enzimatica che nel caso più semplice prevede:
1 prima tappa veloce (ΔG‡ minore e k maggiore)
k1
S+E
k-1
ES
1 seconda tappa lenta (ΔG‡ maggiore e k minore) che determina la
velocità globale di reazione
ES
k2
k-2
E+P
k1 = cost cinetica reazione di formazione del complesso ES
k-1 = cost cinetica reazione di decomposizione del complesso ES in E + S
k2 = cost cinetica reazione di decomposizione del complesso ES in E + P
S+E
k1
k-1
ES
k2
E+P
Formazione rapida e
reversibile del complesso ES
La velocità di formazione di ES dipende da [E] e da [S] e
dalla cost. cin. k1
S + E → ES
La velocità di demolizione di ES dipende da [ES] e dalle
cost. cin. k-1 e k2
ES → S + E
ES → E + P
Si assume che questo passaggio raggiunga velocemente lo STATO STAZIONARIO: in cui
[ES] rimane costante, la velocità della sua formazione è uguale alla velocità della sua
demolizione.
Se questo è vero il rapporto fra le costanti cinetiche della dissociazione di ES e
quella della sua formazione è uguale alla costante di dissociazione del
complesso ES, chiamata Km (Costante di Micaelis-Menten)
Km =
k-1+ k2
k1
(k2 << k-1 = trascurabile)
Km =
k-1
k1
Km =
k-1
k1
La Km fornisce informazioni sull’affinità che un enzima ha nei confronti
del suo substrato ed è SPECIFICA per ogni diverso enzima nei confronti
di un dato substrato.
Più è grande, minore sarà l’affinità dell’enzima per il substrato
(maggiore sarà la costante di dissociazione, k1 > k-1)
Più è piccola maggiore sarà l’affinità (minore la costante di
dissociazione, k1 < k-1)
Considerazioni valide per reazioni enzimatiche semplici a due
tappe e in cui k2 << k-1
non per tutti gli enzimi, molte reazioni enzimatiche sono a più
tappe e la Km diventa una funzione più complessa che dipende
da varie costanti cinetiche.
S+E
k1
k-1
ES
k2
E + P Passaggio lento: la v0 della
reazione globale dipende da
questo passaggio e quindi da [ES]
v0 = k2 [ES]
Da questa relazione se ne può dedurre un’altra che consente di determinare la
velocità massima di reazione.
Infatti, esiste un momento della reazione in cui tutto l’enzima che ho messo a reagire
è complessato col substrato e quindi è in forma ES: ossia quando è raggiunta la
VELOCITA’ MASSIMA di reazione (Vmax)
Se [ES] = [E]TOT ⟹ la v0 = Vmax
Possiamo raggiungere questa condizione quando utilizziamo concentrazioni
saturanti di substrato. La velocità di reazione non dipende più dalla concentrazione
di substrato, ma solo dalla concentrazione totale dell’enzima:
Vmax = k2 [E]TOT
Stabilite queste condizioni, il comportamento degli enzimi che
seguono la cinetica di Micaelis-Menten è giustificato dalla
seguente EQUAZIONE DI MICHAELIS-MENTEN
La velocità iniziale della reazione
enzimatica dipende dalla [S] in modo
iperbolico ed è correlata alla
Vmax (= k2[E]tot) e alla Km
Km
S+E
k1
k-1
ES
k2
E+P
v0 (μM/min)
Equazione di Michaelis-Menten
Vmax [S]
v0 =
Km + [S]
Costante di Michaelis
Corrisponde alla [S] alla quale raggiungo
la metà della Vmax.
Ha le unità di misura di una concentrazione
Vmax [S]
v0 = ½ Vmax
1
[S]
=
=
[S] + Km
2
[S] + Km
[S] (mM)
Km + [S] = 2 [S]
Km = [S]
v0 (μM/min)
1 enzima
2 substrati simili A e B
medesime condizioni di reazione
Verso quale dei due l’enzima è più affine?
A
B
½ Vmax
KmA
KmB
[S] mM
A
Costante catalitica o n° di Turnover
S+E
k1
k-1
ES
k2
E+P
Vmax = k2 [ES] = k2 [E]TOT
k2 =
Vmax
[E]TOT
k2 per una reazione semplice ad uno
stadio corrisponde alla kcat
Indica il numero di eventi catalitici che avvengono nel sito attivo dell’enzima
nell’unità di tempo (le sue unità di misura sono s-1 o min-1).
Misura quanto velocemente un dato enzima può catalizzare una data reazione.
E’ SPECIFICA per ogni enzima.
Se lavoro con una miscela di reazione enzimatica in cui utilizzo una
[S] saturante e voglio raddoppiare la velocità di reazione cosa devo
modificare nel mio sistema? In che modo?
[S] saturante = la v0 raggiunge il suo valore massimo (Vmax), non può più variare in
funzione della concentrazione di substrato perché tutto l’enzima presente è
saturato. Se voglio aumentare la Velocità di reazione devo aggiungere altro enzima
alla miscela di reazione.
Vmax = k2 [E]tot
v0 (μM/sec)
per raddoppiare la velocità di reazione (Vmax) devo
raddoppiare la concentrazione dell’enzima
VmaxB = k2 [E]B
[E]B = 2 [E]A
Vmax A = k2 [E]A
LA Km RIMANE INVARIATA
Km
[S] mM
Determinazione sperimentale di Km e Vmax per una reazione enzimatica:
GRAFICO DEI DOPPI RECIPROCI (Eq. di Lineweaver-Burk)
(linearizzazione della curva iperbolica) >>>>
1
v0
=
Km
1
1
+
Vmax [S] Vmax
Trasformo i valori sperimentali di v0 nei loro reciproci: 1/v0
e i valori sperimentali di [S] nei corrispettivi reciproci 1/[S]
↓
1/v0 min/μM
La curva iperbolica del
grafico di MicaelisMenten diventa una retta
che interseca gli assi in
punti precisi consentendo
di determinare con
esattezza Vmax e Km, e
quindi anche kcat
1/Vmax
[S] = 10 mM
-1/Km
0,1
1/[S] mM-1
[S] = 1,0 mM
1,0
v0 (μM/min)
Vmax
½ Vmax
v0 =
2,0 (Km)
[S] mM
Per calcolare la Vmax devo fare il reciproco
del reciproco =
1 = 0,02 min/μM → Vmax =
1
Vmax
0,02 min/ μM
Vmax = 50 μM/min
Vmax [S]
Km + [S]
1
Km
v0 = Vmax
[S] = 1,0 mM
1/Vmax = 0,02
Per calcolare il valore della Km devo fare il
reciproco negativo del reciproco =
-1/Km = -0,5 mM-1 → Km = - 1
= 2mM
-0,5 mM-1
1
1
[S] + Vmax
1/v0 min/μM
50
[S] = 10 mM
-0,5 = -1/Km
0,1
1/[S] mM-1
1,0