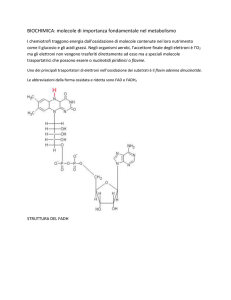
MPT – Capitolo 12
Redox
Le ossidoriduzioni
Obiettivo
In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta
di conoscenze fondamentali sia per la vita comune, sia, per molti di voi, per la vita professionale.
Definizioni di ossidazione e di riduzione
Iniziamo con le definizioni corrette di ossidazione e di riduzione.
Ossidazione: Processo in cui un atomo perde elettroni.
Riduzione: Processo in cui un atomo acquista elettroni.
Come potete osservare non c'è nulla di nuovo sotto il sole. Abbiamo unicamente arricchito il
vocabolario con due nuovi sostantivi che indicano processi che già abbiamo analizzato.
Osserviamo queste due reazioni chimiche.
Na° + 1/2Cl2° --------> NaCl
(Na+ e Cl- , quindi Na ha perso un elettrone e si è ossidato mentre Cl ha acquistato un elettrone e si è
ridotto).
2Ag+ + Cu --------> 2Ag° + Cu2+
(Ag+ acquista un elettrone e si trasforma in Ag° metallico, mentre Cu° metallico perde due elettroni
e diventa uno ione Cu2+).
Possiamo dividere anche il sistema in due semireazioni che ci indicano i due processi singoli:
l'acquisto di elettroni dell'argento e la perdita di elettroni del rame
Ag+ + e- --------> Ag°
Cu --------> Cu2+ + 2eNaturalmente in questo caso per ogni Cu che cede 2 elettroni devono avvenire due reazioni di
riduzione dell'argento.
La scala elettrochimica o di reattività
Osserviamo le due seguenti reazioni
2AgNO3 + Cu -------> 2Ag + Cu(NO3)2
2Ag + Cu(NO3)2 -------> 2AgNO3 + Cu
Se si eseguono le due reazioni si vede che la prima avviene mentre la seconda non avviene. In un
certo senso possiamo dire che il rame si ossida (perde elettroni) più facilmente dell'argento.
Quali sono i metalli che perdono elettroni (si ossidano) più facilmente e viceversa? Per rispondere a
questa domanda si può fare una serie di esperimenti incrociati, determinando alla fine una scala di
reattività dei metalli.
Zn + CuSO4 --------> ZnSO4 + Cu avviene
ZnSO4 + Cu -------> CuSO4 + Zn non avviene
Inoltre immergendo Ag, Cu e Zn in acido cloridrico si osserva che l'unico che viene ossidato è lo
1
MPT – Capitolo 12
Redox
zinco, secondo le due semireazioni qui indicate:
H+ + e- --------> ½ H2
Zn --------> Zn2+ + 2eo in totale
Zn + 2HCl --------> Zn2+ + 2Cl- + H2
Quindi possiamo definire la seguente scala di reattività:
Elementi che si riducono più facilmente: Ag+, Cu2+,H+, Zn2+
Elementi che si ossidano più facilmente: Zn, H2, Cu, Ag
Continuando così, provando tutte le varie possibilità si potrebbe arrivare a definire una scala di
reattività. tuttavia c'èun modo molto più elegante per risolvere il problema, applicando dei semplici
principi di elettrochimica. Ecco che introduciamo allora la pila di Daniell.
La pila di Daniell (la pila più semplice)
Il principio di funzionamento della
pila di Daniell è molto semplice. Le
due semireazioni (quella di
ossidazione e quella di riduzione)
sono separate fisicamente e lo
scambio di elettroni avviene
attraverso un conduttore elettrico.
Su questo conduttore elettrico è
montato un Voltmetro che permette
di misurare la tensione elettrica che
si forma tra le due semireazioni.
Lo zinco si ossida più facilmente
del rame e quindi questo determina
la direzione del flusso di elettroni.
Naturalmente per chiudere il
circuito le cariche elettriche che
passano nel conduttore devono
essere controbilanciate da cariche
ioniche che scorrono all'internodel ponte salino; questo non è altro che un tubo di vetro contenente
una soluzione molto concentrata di un sale (di solito KCl). Nel lato dell'anodo,le cariche positive di
Zn2+ che si formano a causa dell'ossidazionesono neutralizzate da ioni Cl- che escono dal ponte
salino. Dal lato del catodo (il disegno trae in inganno!) sono gli ioni SO42- in eccesso (la quantità di
Cu2+ si riduce a mano a mano che la reazione avanza) che se ne vanno via nel ponte salino (e non
K+ aggiuntivi che entrano nella soluzione!).
Il bello di questa pila è che permette di valutare quanto facilmente , e in quale direzione avviene la
reazione osservando semplicemente la tensione elettrica che si legge sul voltmetro.
Per evitare però di dover provare tutte le coppie di semireazioni (sarebbe un lavoro interminabile) è
stata misurata la tensione elettrica delle semireazioni in esame con una semireazione standard.
Come semireazione standard è stata scelta la reazione dell'idrogenovista prima. L'apparecchiatura
2
MPT – Capitolo 12
Redox
in questo caso assume il
seguente aspetto. Da una parte
si ha ancora la coppia metallo /
ione metallico. Dall'altra c'è
uno speciale elettrodo che
permette di far avvenire la
semireazione tra H+ e H2
descritta prima.
Nella soluzione acquosa si
trova una concentrazione 1M
di [H3O+] (di solito originato
da acido solforico H2SO4) a
pH 0 mentre si satura la
soluzione
con
Idrogeno
gassoso H2 a pressione di 1 bar
(si fa gorgogliare il gas nella soluzione). Sulla superficie del
filamento di platino avviene lo scambio di elettroni.
H+ + e- --------> 1/2 H2
Nell esempio col rame si vede che il potenziale misurato è pari a
0.34 V. Il rame si riduce più facilmente dell’ H+ e quindi il flusso
di elettroni nel circuito va dalla semicella dell'idrogenovero quella
del rame.
Cu2+ + 2e- --------> Cu° (+0.34V)
Se si procedesse nello stesso modo con la coppia Zn // Zn2+ si
troverebbe un potenziale di 0.76 V ma la direzione del flusso di
elettroni sarebbe inversa. Lo Zinco tenderebbe ad ossidarsi mentre
gli ioni H+ si ridurrebbero.
Potenziale standard di riduzione e reazioni
spontanee
È stata scelta una direzione, quella della riduzione, come direzione
standard. Se il valore del Voltmetro è positivo, vuol dire che
avviene la riduzione, se il valore è negativo vuol dire che il flusso
di elettroni va verso una ossidazione della semicella in analisi.
Con questo metodo si sono misurati tutti i potenziali standard di riduzione. Osservate il libro a pag
417. Le reazioni indicate sono tutte riduzioni! Ordinate dalla riduzione più efficiente a quella meno
efficiente. Naturalmente se vi dovesse servire il potenziale di una semicella di ossidazione potete
semplicemente prendere quella di riduzione e invertire il segno.
Esempio:
Cu2+ + 2e- --------> Cu° (+0.34 V)
Zn2+ + 2e- --------> Zn° (-0.76V)
3
MPT – Capitolo 12
Redox
Se combinate queste due semireazioni chiaramente una delle due dovrà avere la direzione opposta a
quella indicata. Ecco che allora si trovano le due reazioni
Cu2+ + Zn° --------> Cu° + Zn2+
(+0.34V -(-0.76V)= +1.1V)
Cu° + Zn2+ --------> Cu2+ + Zn° (-0.34V +(-0.76V)= -1.1V)
Le reazioni spontanee (cioè che avvengono mischiando le due sostanze senza aggiungere energia)
sono solamente quelle con un segno positivo. Nel nostro caso vediamo che gli ioni di Cu2+ rubano
gli elettroni allo zinco, mentre gli ioni Zn2+ non possono fare la stessa cosa con il rame metallico.
Quindi solamente la prima di queste due reazioni può avvenire (vedi scala di reattività vista prima).
Esercizio
Calcola il voltaggio tra le seguenti coppie di reazione e determina in quale direzione avvengono le
reazioni
Ag / Ag+ e Cu / Cu2+
Ag /Ag+ e Zn / Zn2+
Il numero di ossidazione e il bilanciamento delle reazioni redox
Nelle reazioni precedenti è stato facile tenere il conteggio degli elettroni scambiati; tuttavia non è
sempre così semplice. Ad esempio, osservate la reazione tra il rame metallico e l'acidonitrico e
cercate di bilanciarla!
Cu + HNO3 --------> Cu(NO3)2 + NO + H2O
Facile vero?
Per risolvere in modo efficiente questo tipo di problema si è introdotto un concetto astratto che è
chiamato numero di ossidazione.
N.O: N° convenzionale, assegnato a tutti gli atomi presenti nelle molecole; indica la carica elettrica
che ciascun atomo avrebbe se gli elettroni coinvolti nei legami si trovassero interamente sull'atomo
più elettronegativo.
Regole:
1. Il N.O è 0 quando l'atomo non è legato ad altri o quando si parla di un elemento.
2. N.O. è positivo se si tratta di uno ione positivo oppure se l'atomoè attaccato ad un altro più
elettronegativo. (Es Na+ =+ I; Ca2+ = +II, in CCl4 si disegna la molecola e si osserva che gli
elettroni dei quattro legami covalenti devono essere attribuiti tutti ai rispettivi atomi di Cl
(più elettronegativo) e si ha che ciascun Cl ha N.O. = -I, e il C ha N.O. = +IV)
3. N.O. è negativo se si tratta di uno ione negativo oppure se l'atomoè attaccato ad un altro
meno elettronegativo. (Es F- = -I; S-2 = -II, nell'acquaO= -II e H=+I, basta osservare i
legami covalenti).
4. L'ossigeno ha quasi sempre N.O. = -II (occhio al legame O-O nei perossidi, -I, es H
2O2)
5. L'Hha quasi sempre N.O. = I (tranne negli idruri, combinato con dei metalli direttamente,
allora è -I es NaH).
6. La somma algebrica di tutti i N.O. di tutti gli atomi di un composto è pari alla carica totale
del composto!
4
5
MPT – Capitolo 12
Redox
Esercizio: Fare l'esercizio 27 a pag 409 per esercitarsi nel calcolo dei N.O.
Tornando al nostro problemino del rame e dell'acido nitrico
Cu
+
HNO3
-------->
Cu(NO3)2
+
NO
+
H2O
N.O. (Cu): Cu = 0
N.O. (HNO3): H = +I; O = -II; quindi N = +V
N.O. ( Cu(NO3)2 ): Cu = +II (vedi cariche), O = -II, N = +V
N.O. (NO): O = -II; N = +II
N.O. (H2O): O = -II; H = +I
Quindi si osserva che per un atomo di N che da HNO3 si trasforma in NO bisogna aggiungere 3 e-.
Invece per ogni atomo di Cu che si ossida sono ceduti 2 e-. Il minimo comune multiplo è 6. Perciò 3
atomo di Cu ossidandosi formano 2 molecole di NO. Il resto del bilanciamento è facile. Si ottiene
3Cu
+
8 HNO3
-------->
3Cu(NO3)2
+
2NO
+
4 H2O
Esercizio: Fare l'esercizio 27 a pag 409 per esercitarsi nel calcolo dei N.O.