1
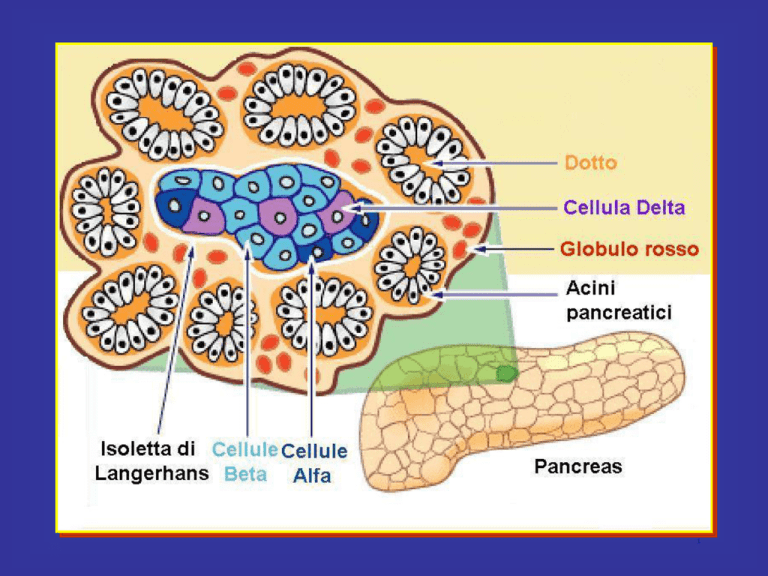
Il pancreas è costituito da due tipi principali di tessuto:
gli Acini che secernono succo digestivo destinato a riversarsi nel
duodeno
gli Isolotti di Langherans che secernono insulina e glucagone
direttamente nel sangue
Il pancreas umano contiene da 1 a 2 milioni di Isole di Langherans,
ciascuna con diametro di 0,3 mm in stretto contatto con i capillari
sanguigni
Contengono 3 tipi principali di cellule: alfa, beta, delta.
2
Alfa sono circa il 25% del totale, secernono glucagone
Beta sono le più numerose, il 60% del totale, secernono insulina
Delta il 10% secernono somatostatina
È presente inoltre almeno un altro tipo di cellule, denominato PP che
secernono un ormone a funzione incerta chiamato peptide pancreatico
Legato probabilmente alla regolazione della secrezione esocrina del pancreas.
3
GLI ORMONI - Classificazione
- Ormoni di derivazione aminoacidica (tirosina)
catecolamine (adrenalina, nor-adrenalina), ormoni tiroidei
- Ormoni peptidici ( 3 - 200 AA)
ormoni dell’ipotalamo e dell’ipofisi, insulina, glucagone,
paratormone, calcitonina
- Ormoni steroidei (derivati del colesterolo)
ormoni della corteccia surrenale, androgeni, estrogeni
- Ormoni eicosanoidi (derivati dall’acido arachidonico)
prostaglandine
pag. 5
IL MECCANISMO D’AZIONE DEGLI ORMONI PEPTIDICI E
CATECOLAMINICI
ormone
Primo messaggero
Recettore proteico
Adenilico ciclasi
ATP
AMPc
PROTEINA
ENZIMATICA
Secondo messaggero
PROTEINA
ENZIMATICA
FOSFORILATA
pag. 6
IL MECCANISMO D’AZIONE DEGLI ORMONI
STEROIDEI
ormone
DNA
trascrizione
ormone
recettore
RNAm
traduzione
Sintesi della proteina enzimatica
pag. 7
OMEOSTASI DEL GLUCOSIO
La concentrazione plasmatica di glucosio riflette l’equilibrio tra: l’assorbimento intestinale,
l’utilizzazione a livello dei tessuti e la produzione endogena
A digiuno un individuo di 70 kg ne utilizza circa 2mg/kg/min ( 200g/24 ore ).
Il fegato produce circa 9 g di glucosio all'ora.
E’ necessario un continuo apporto di glucosio come fonte di energia
L’omeostasi è controllata anzitutto dall’insulina e da ormoni catabolici (glucagone,
catecolammine, GH e cortisolo)
Ipoglicemia
Glicemia normale
Glicemia alterata a digiuno (IFG)
Intolleranza al glucosio (IGT)
Diabete
Glicemia < 60 mg/dl
Glicemia a digiuno: 60-100 mg/dl
Glicemia dopo 2 ore da test da carico di
glucosio: < 140 mg/dl
Glicemia a digiuno: 110-125 mg/dl
Glicemia dopo 2 ore da test da carico di
glucosio: < 140-199 mg/dl
Glicemia a digiuno >= 126 mg/dl**
Glicemia dopo 2 ore da test da carico di
glucosio: >=200 mg/dl
I globuli rossi e le cellule del cervello utilizzano glucosio per il loro metabolismo
consumando ca. l’80% di tutto il glucosio introdotto ogni giorno con la dieta.
Alla conc. ematica di glucosio di 4,7-5 mM GLUT3 (trasportatore di glucosio dei neuroni) è
sempre saturo di glucosio permettendo così un rifornimento costante di glucosio.
Quantitativamente nel plasma e nei fluidi extracellulari sono presenti ca. 10 g di glucosio
che devono essere mantenuti costanti
I trasportatori degli esosi
Gli esosi non possono, come tali attraversare il doppio
strato fosfolipidico dell’orletto a spazzola. Sono
necessari per questo trasporto, proteine carrier che ne
permettano l’ingresso.
I carriers funzionano in modo coordinato per
permettere l’ingresso degli esosi nell’orletto a
spazzola e l’uscita di questi dalla membrana baso
laterale dell’enterocita. In questo modo gli esosi
possono essere riversati nel torrente circolatorio e
raggiungere altri organi.
I trasportatori degli esosi
Si riconoscono diverse isoforme dei trasportatori del
glucosio, questi sono denominati GLUT e le isoforme
1 e 2 sono la più espresse nell’intestino.
La localizzazione di SGLUT 1 è nell’ orletto a spazzola
dei villi intestinali, mentre GLUT 2 si trova nella
membrana baso laterale degli enterociti.
L’affinità di SGLUT 1 è maggiore nei confronti del
glucosio, rispetto a GLUT 2 che permette l’uscita di
glucosio dall’enterocita al sangue per diffusione.
trasportatori del glucosio (GLUT) sono una famiglia di proteine transmembrana
presenti nella maggior parte delle cellule mammifere. La loro azione permette il
trasferimento del glucosio attraverso le membrane plasmatiche; ricordiamo, a tal
proposito, che questo importantissimo substrato energetico - essendo polare - è
incapace di attraversare spontaneamente il doppio strato fosfolipidico
Nell'uomo il il trasporto del glucosio può avvenire secondo gradiente (diffusione
facilitata) o contro gradiente (trasporto attivo).
lL trasporto attivo si verifica nell'intestino e nei tubuli renali e richiede l'utilizzo indiretto
di energia biochimica (Na+/glucosio simporto). La diffusione facilitata non richiede ATP
e coinvolge i trasportatori del glucosio, i cosiddetti GLUT.
Nell'uomo esistono numerose isoforme di GLUT, indicate con numeri crescenti (GLUT1, GLUT-2, GLUT-3, GLUT-n), le quali - sebbene siano piuttosto simili - differiscono
per alcune proprietà.
Il trasportatore del glucosio più conosciuto e studiato è il GLUT-4, a causa della sua
sensibilità diretta all'insulina. In condizioni normali, questo carrier si trova in sede
citoplasmatica e la sua traslocazione sulla membrana cellulare viene stimolata dal
legame dell'insulina con il recettore di membrana. Questo processo favorisce lo
spostamento del glucosio dal liquido interstiziale all'interno della cellula. Quando la
concentrazione ematica di glucosio si normalizza e l'insulina viene eliminata, le
molecole di GLUT 4 vengono lentamente rimosse dalla membrana plasmatica e
sequestrate per endocitosi in vescicole intracellulari.
Il trasportatore del glucosio GLUT-4 è presente soprattutto nel muscolo
scheletrico, nel cuore e nel tessuto adiposo bianco e bruno, non a caso definiti
tessuti insulino-dipendenti. A livello muscolare la traslocazione dei trasportatori
GLUT-4 dai siti intracellulari (vescicole) alla membrana plasmatica è favorita anche
dalla contrazione, dall'aumento del flusso ematico e dai bassi livelli di glicogeno
che caratterizzano l'esercizio fisico di durata. Ciò spiega come mai l'attività
sportiva sia un'utilissima medicina nella prevenzione dell'insulino resistenza e nel
trattamento del diabete mellito.
un trasportatore particolare del glucosio è il GLUT-2, espresso soprattutto
a livello epatico; questa proteina è infatti capace di lavorare in entrambe le
direzioni, favorendo il passaggio dello zucchero dalla cellula al liquido
interstiziale e viceversa. Tale funzione è assai importante perché il fegato è
sede primaria della gluconeogenesi, cioè della sintesi ex-novo di glucosio
(che deve poi essere immesso nel sangue) a partire da aminoacidi,
glicerolo e acido lattico. Il GLUT-2 può trasportatore anche galattosio,
mannosio e fruttosio, capacità - quest'ultima - condivisa con il trasportatore
GLUT-5.
Il GLUT-2 è espresso anche a livello delle cellule B pancreatiche, e si
caratterizza per una bassa affinità associata ad un'elevata capacità (non
viene mai saturato dal glucosio).
Sempre a livello epatico troviamo la proteina di trasporto
GLUT-7, che si comporta come trasportatore intracellulare del
glucosio, importante per favorire l'esportazione della quota
prodotta durante la gluconeogenesi.
MALTOSIO
Glucosio + Glucosio
LATTOSIO
Galattosio + Glucosio
SACCAROSIO
Glucosio + fruttosio
GLUCOSIO
FRUTTOSIO
Meccanismo d’azione per SGLUT 1 e GLUT 2
Glucosio
Glucosio
Galattosio
2 Na+
S
G
L
T
Galattosio
Glut2
2 Na+
1
Na/K ATPasi
Enterocita
Co-trasporto sodio glucosio-galattosio
Capillari
sanguigni
I trasportatori degli esosi
Il terzo principale esoso che necessita di essere
trasportato è il fruttosio, nell’ enterocita è anche
presente GLUT 5 che trasporta questo
monosaccaride con più alta affinità rispetto al
glucosio.
Come per il glucosio e il galattosio anche il
fruttosio esce dall’enterocita attraverso GLUT 2.
Meccanismo d’azione per GLUT 5
Fruttosio
Fruttosio
G
L
U
T
Fruttosio
Glut2
5
Enterocita
Non c’è co-trasporto con il sodio
Capillari
sanguigni
I trasportatori degli esosi
Il sistema di regolazione dei trasportatori degli
esosi è complesso.
Ingerire carboidrati sottoforma di poli o
oligosaccaridi fa aumentare i livelli di mRNA per
entrambi i trasportatori SGLUT 1 e GLUT 2 nell’
enterocita.
Lo stesso succede per il GLUT 5 quando sono
presenti nel lume intestinale saccarosio e fruttosio
I trasportatori degli esosi
Si è visto che l’aumentata espressione di SGLUT 1
e GLUT 5 negli enterociti, aumenta i livelli di AMPc
con la conseguente attivazione di proteine chinasi.
I meccanismi di questa attivazione appaiono
diversi per le due isoforme proteiche.
I trasportatori degli esosi
SGLUT 1
L’aumento dell’AMPc che attiva le PK è
responsabile per SGLUT 1 dell’aumento della
quantità e della capacità di trasporto nei confronti
dell’esoso.
Più SGLUT 1 viene traslocato alla membrana dal
compartimento citoplasmatico
I trasportatori degli esosi
GLUT 5
L’aumento dell’AMPc che attiva le PK è
responsabile per GLUT 5 dell’aumento della
quantità di mRNA e quindi dell’espressione del
trasportatore.
Non c’è maggiore traslocazione di GLUT 5 alla
membrana plasmatica degli enterociti.
Trasportatori di glucosio
Km glucosio
(mmol/L)
Funzione
1÷2
Captazione basale del
glucosio, trasporto
attraverso la barriera
emato-encefailca
GLUT 2
Cellule B pancreatiche,
fegato, rene, intestino
15÷20
Regolazione del rilascio di
insulina, altri aspetti
dell’omeostasi glucidica
GLUT 3
Cervello, rene,
placenta, altri tessuti
<1
Captazione nei neuroni e
in altri tessuti
GLUT 4
Muscolo, adipe
=5
Captazione di glucosio
mediata da insulina
GLUT 5
Intestino, rene
1÷2
Assorbimento intestinale
del fruttosio
Trasportatore
GLUT 1
Tessuti
Tutti i tessuti
specialmente eritrociti, cervello
30
Caratteristiche del trasporto del glucosio in vari tessuti
Alcuni tessuti hanno un sistema di
trasporto del glucosio indipendente
dall’insulina. Per esempio gli
epatociti, gli eritrociti e certe cellule
del tessuto nervoso, della mucosa
intestinale, dei tubuli renali e della
cornea non necessitano
dell’insulina per assumere
glucosio.
Il pancreas secerne due importanti ormoni coinvolti nella regolazione
del metabolismo del glucosio, dei lipidi e delle proteine:
Insulina
Glucagone
Aumento di glucosio nel sangue
Diminuzione di glucosio nel sangue
liberazione di insulina
liberazione di glucagone
Si lega a recettori di
membrana nelle
cellule epatiche
Incrementa l’attività della
glicogeno-sintetasi
Lega recettori di
membrana negli adipociti
e nelle cellule muscolari
Esocitosi e attivazione dei
trasportatori di glucosio
Incrementa la rimozione
del glucosio
Rimozione del glucosio dal sangue
Deposito come glicogeno
Si lega ai recettori di membrana
Attivazione dell’adenilato ciclasi
Aumento di cAMP, attivazione della
chinasi cAMP-dipendente
Attivazione della
glicogeno fosforilasi
Inibizione della
glicogeno sintetasi
Degradazione di glicogeno a glucosio
Rilascio di glucosio nel sangue
32
L’INSULINA
L’insulina è prodotta nel pancreas dalle cellule delle isole del Langerhans e
viene secreta in risposta all’iperglicemia essendo il processo attivato da ioni
calcio. I tessuti bersaglio sono quello epatico, muscolare ed adiposo.
L’effetto dell’insulina è ipoglicemizzante.
Effetti metabolici
-Promuove l’ingresso del glucosio nel (fegato), nel muscolo e nel tessuto
adiposo
- Stimola la glicogenosintesi nel fegato e nel muscolo
- Stimola la glicolisi acetil-CoA sintesi acidi grassi nel fegato e nel
tessuto adiposo
- Favorisce la sintesi di VLDL nel fegato
- Inibisce la glicogenolisi nel fegato e nel muscolo
- Inibisce la gluconeogenesi nel fegato
L’abbassamento della glicemia causa diminuzione di emissione di insulina
con un meccanismo a feed-back.
pag. 33
INSULINA E LE SUE FUNZIONI
Questo ormone, isolato per la prima volta dal pancreas nel 1922, da
Banting e Best, ha mutato radicalmente il destino del diabetico grave
Storicamente la nozione di insulina è associata allo zucchero nel
sangue
Ma sono soprattutto le turbe del metabolismo dei grassi, che sono le
usuali cause di morte tra i diabetici, per aterosclerosi ed acidosi.
Sono gravi anche le alterazioni del metabolismo proteico che portano
il diabetico a grave consunzione
Prima dell’avvento dell’insulina i soggetti con diabete mellito di tipo 1 non
potevano sopravvivere più di qualche giorno o mese (solo raramente la
sopravvivenza era di qualche anno).
34
INSULINA: ORMONE ANABOLIZZANTE
La sua secrezione è associata ad una grande disponibilità di energia
cioè viene secreta quando è abbondante l’apporto di alimenti
energetici con la dieta
È indispensabile per immagazzinare le sostanze energetiche in eccesso
I carboidrati: vengono immagazzinati come glicogeno nel fegato e nel
muscolo
I grassi: l’ormone ne favorisce l’accumulo nel tessuto adiposo converte inoltre in grassi tutti gli zuccheri non depositati come glicogeno
Le proteine: l’insulina favorisce la captazione degli Aa e la sintesi
proteica intracellulare
35
Il meccanismo cellulare che controlla il rilascio di
insulina nelle cellule beta pancreatiche
36
Il recettore dell'insulina è transmembrana e appartiene alla famiglia dei recettori tirosin-chinasici. E’ costituito da due
subunità α extracellulari, legate a due subunità β intracellulari dotate di attività tirosino-chinasica.
Il legame dell'insulina favorisce la fosforilazione delle subunità β.
Il recettore così attivato, determina la propagazione del segnale con un effetto a cascata.
Uno dei primi fattori della cascata del segnale è la proteina IRS-1 (Insuline Receptor Substrate) che attiva a sua volta
l'enzima fosfoinositide 3 chinasi o PI3-K che attiva la via Akt\mTOR.
L’attivazione della PI3-K comporta la fusione delle vescicole citoplasmatiche contenenti il trasportatore del glucosio
GLUT-4 con la membrana plasmatica per favorire l’assorbimento del glucosio.
I RECETTORI INSULINICI
Meccanismo d’azione dell’insulina
3. Gli effetti dell’insulina sulle membrane (trasportatori
del glucosio insulina sensibili GLUT-4) (muscolo
scheletrico e tessuto adiposo).
4. La regolazione dei recettori (down-regulation)
5. I tempi delle risposte all’insulina (induzione, sintesi di
glucochinasi, fosfofruttochinasi e piruvato chinasi).
Azione dell’insulina sui trasportatori del glucosio Glut-4 nei
tessuti bersaglio (muscolo e tessuto adiposo, ma non fegato)
40
Azione dell’insulina sul fegato, trasportatore GLUT-2
41
Un epatocita contiene 1700 recettori circa ed un adipocita ne contiene 10.000 circa; è
tuttavia sufficiente che l’insulina si leghi ad un decimo circa di questi recettori per
evocare nell’adipocita una sensibile risposta metabolica. La elevata affinità
dell’insulina per i suoi recettori è necessaria per la cattura delle poche molecole di
insulina circolanti nel sangue.
Cooperatività negativa : la capacità dei recettori liberi di legare l’insulina è tanto
minore quanti più recettori si sono già legati all’ormone.
Regolazione secrezione insulina
Livello di deposito d’insulina è elevato per cui la regolazione agisce sul suo rilascio piuttosto
che sulla sintesi.
L’insulina viene secreta nella quantità di 1 unità/Kg di peso/die
Principale fattore di regolazione è livello di glucosio nel sangue ed il glucagone.
Variazione d’insulina è parallela a quella del glucosio.
STRUTTURA
2 catene polipetidiche (A e B) di 21 e 30 aa.
Numerosi legami salini ed idrogeno e 2 legami disolfuro legano le 2 catene A e B.
La struttura assunta è quella esamerica (Zn-insulina secreta dal pancreas).
Secreta dalle cellule b-pancreatiche in forma esamerica ma la sua azione sulle cellule
bersaglio è esplicata in forma monomerica.
BIOSINTESI E MATURAZIONE
Il gene è localizzato nel braccio corto del cromosoma 11.
Viene sintetizzata in forma di precursore inattivo (preproinsulina) dalle cellule beta del
pancreas.
Con rimozione del peptide leader abbiamo la proinsulina, unica catena polipeptidica formata
da 78 a 86 aa (secondo la specie animale).
Il segmento intermedio, peptide C o peptide di interconnessione viene distaccato al
momento della conversione proinsulina-insulina.
I segmenti N- e C- terminale andranno a costituire le catene B e A dell’insulina
Nell’uomo la vita media dell’insulina circolante è di 7-15 min
Struttura dell’insulina
Sintesi dell’insulina
Peptide C: è indispensabile per il corretto ripiegamento della proinsulina e poiché
la sua emivita plasmatica è più lunga è un buon indicatore della produzione e
della secrezione dell’insulina nella diagnosi di diabete giovanile. L’insulina è
conservata in granuli citoplasmatici che si liberano per esocitosi se stimolati. E’
degradata dalla insulinasi (fegato e reni). La breve emivita plasmatica (6 minuti
ca.) permette la rapida variazione della concentrazione dell’ormone in circolo.
Regolazione della secrezione dell’insulina
La stimolazione della secrezione
dell’insulina.
La sintesi e la secrezione dell’insulina sono
stimolate da:
a) il glucosio (glucochinasi delle cellule β)
b)gli amminoacidi (arginina)
c)gli ormoni gastrointestinali (secretina) che
provocano un aumento anticipato del livello
dell’insulina nella vena porta, prima che si
verifichi un effettivo aumento del livello
ematico di glucosio.
Insulinemia rappresenta la concentrazione di insulina
presente nel sangue.
Valori Normali:
basale 5 - 25 micr.UI/ml
dopo 30 min. 41 - 125 micr.UI/ml
dopo 60 min. 20 - 120 micr.UI/ml
dopo 90 min. 20 - 90 micr.UI/ml
dopo 120 min. 18 - 56 micr.UI/ml
• Dopo un pasto i valori insulinemici aumentano sensibilmente, per poi ritornare ai livelli
basali nel giro di un paio d'ore
• Il picco raggiunto è tanto più elevato quanto maggiore è la quantità di zuccheri introdotta
• il picco insulinemico raggiunto dopo un pasto completo risulta inferiore a quello registrato
dopo il consumo di un'analoga quantità di zuccheri, scorporata da lipidi e fibre.
CONTROLLO DELLA SECREZIONE
a valori normali di glicemia 80÷90 mg/100ml la secrezione di
insulina è minima 25 ng/min/kg di peso
quando la conc. di glucosio plasmatico sale di 2-3 volte rispetto al valore normale la secrezione dell’ormone aumenta in due fasi distinte
l’aumento della conc. plasmatica di insulina indotta dal glucosio può
arrivare ad essere anche 400÷600 volte superiore rispetto al basale,
quindi un aumento drammatico che ricade altrettanto rapidamente
quando la conc. di glucosio torna ai valori di digiuno
50
L’inibizione della secrezione dell’insulina
La sintesi e la secrezione dell’insulina
diminuiscono quando le sostanze nutrienti della
dieta scarseggiano e nei periodi di stress (febbre
o infezione). Questi effetti sono mediati
principalmente dall’adrenalina secreta dalla
midolla surrenale in risposta allo stress, a un
trauma o a un esercizio fisico molto intenso. In
tali condizioni la liberazione dell’adrenalina è
controllata soprattutto dal sistema nervoso.
Questo ormone ha un effetto diretto sul
metabolismo energetico e provoca una rapida
mobilizzazione delle riserve energetiche, tra cui
il glucosio presente nel fegato (prodotto per
glicogenolisi o per gluconeogenesi) e gli acidi
grassi del tessuto adiposo. L’adrenalina può
talvolta precedere e annullare la normale
liberazione di insulina stimolata dal glucosio.
Nelle situazioni di emergenza, il sistema nervoso
simpatico si sostituisce al livello plasmatico del
glucosio come fattore di controllo della
secrezione da parte delle cellule β.
La secrezione di insulina
Breve periodo di digiuno. La produzione di insulina rimane a valori di base, senza picchi, nel digiuno
notturno. A un certo punto, il calo della glicemia stimola le cellule alfa del pancreas a produrre glucagone,
che provoca la conversione del glicogeno in glucosio e la liberazione di questo nel sangue. La richiesta
minima di glucosio è pertanto assicurata dalle riserve di glicogeno. Il cervello riceve un segnale e lo traduce
in sensazione di fame.
Situazione normale di riposo . Appena la glicemia comincia a diminuire, la secrezione di insulina si riduce
rapidamente, tornando a valori simili a quelli del digiuno dopo 2 o 3 ore dall’assunzione del pasto.
Dopo un pasto ricco di carboidrati. La glicemia aumenta e il pancreas libera rapidamente insulina (picco
insulinemico post-prandiale), che riporta la concentrazione del glucosio a livelli di normalità. Il picco
raggiunto è tanto più consistente quanto maggiore è la quantità di zucchero introdotta e la velocità dell’
assorbimento (carico glicemico), mentre la presenza di fibra alimentare, rallentando l’assimilazione
intestinale dei nutrienti, limita il picco di insulina. Una volta soddisfatta la richiesta energetica delle cellule
dell’organismo, l’incremento di insulina stimola la conversione del glucosio in eccesso in depositi di
glicogeno, in particolare a livello del fegato e dei muscoli.
Digiuno prolungato. Quando il digiuno perdura, le riserve di glicogeno dell’organismo si esauriscono
gradualmente. La secrezione di glucagone è massima e aumentano altri ormoni (adrenalina, cortisolo)
che innescano ulteriori meccanismi di approvvigionamento di glucosio. Esaurite le riserve di glicogeno,
l’organismo attinge energia dai lipidi (attraverso la lipolisi) e utilizza gli aminoacidi ottenuti dalla
degradazione delle proteine per produrre glucosio (gluconeogenesi). Entrambi questi meccanismi sono
a lungo andare deleteri per l’organismo, il primo (lipolisi) perché porta all’accumulo di corpi chetonici e il
secondo (gluconeogenesi) perché, una volta esaurite le proteine introdotte con gli alimenti, l’organismo
arriva a degradare le proprie proteine strutturali (per esempio quelle muscolari).
Sovralimentazione. In risposta all’eccessiva assunzione di cibo, soprattutto di alimenti ad alto contenuto
di zuccheri, la produzione di insulina è intensamente e costantemente stimolata. L’organismo non ha
modo di eliminare il glucosio, può solo utilizzarlo o accumularlo, quindi, una volta soddisfatte le richieste
energetiche e saturate le riserve di glicogeno, il glucosio è convertito in un deposito energetico
alternativo, ossia in acidi grassi, accumulati nel tessuto adiposo (grasso) sotto forma di trigliceridi.
Questo processo conduce nel tempo a un incremento del peso corporeo.
Sovralimentazione prolungata. Se si persiste nell’eccedere con il cibo, la produzione di insulina si
mantiene a livelli costantemente elevati (iperinsulinismo), ma nel tempo le cellule dell’organismo
perdono gradualmente la loro sensibilità all’insulina (insulino-resistenza) e ciò si traduce in un aumento
permanente dei livelli di glucosio nel sangue. Questa condizione si verifica spesso nei soggetti obesi:
anche se non tutti i soggetti obesi sono insulino-resistenti e non tutti quelli insulino-resistenti sono
obesi, è accertato che tra obesità e alti livelli di insulina circolante esiste una stretta correlazione e che
l’eccesso ponderale riduce la sensibilità dei tessuti periferici all’insulina.
Gli effetti metabolici dell’insulina
1) Gli effetti sul metabolismo dei carboidrati (fegato, muscolo e tessuto adiposo).
- Fegato: l’insulina fa diminuire la sintesi di glucosio inibendo la gluconeogenesi e
glicogenolisi.
- Muscolo e fegato: l’insulina fa aumentare la glicogenosintesi.
- Muscolo e tessuto adiposo: l’insulina fa aumentare l’assunzione di glucosio
aumentando il numero dei relativi trasportatori presenti sulla membrana plasmatica.
2) Gli effetti sul metabolismo dei lipidi.
-Diminuzione della degradazione dei triacilgliceroli: l’insulina fa diminuire il
livello degli acidi grassi in circolo inibendo l’attività della lipasi sensibile agli
ormoni nel tessuto adiposo (defosforilazione).
-L’aumento della sintesi dei triacilgliceroli: l’insulina fa aumentare sia il trasporto del
glucosio negli adipociti, che il suo metabolismo per produrre acidi grassi e glicerolo 3fosfato per la sintesi dei triacilgliceroli. Inoltre fa aumentare la sintesi della
lipoproteina lipasi del tessuto adiposo, per cui nelle cellule si accumulano acidi
grassi esterificabili.
3) Gli effetti sulla sintesi delle proteine: nella maggior parte dei tessuti l’insulina
stimola l’ingresso degli amminoacidi nelle cellule e la sintesi delle proteine.
Modifica dell’attività di alcuni enzimi :
attivazione della glicogeno sintasi
attivazione della piruvato deidrogenasi
attivazione della acetil-CoA carbossilasi
inibizione della fosforilasi e della lipasi adipolitica
Promozione della sintesi di alcune proteine: glucochinasi.
AZIONE DELL’INSULINA SUL METABOLISMO GLUCIDICO
Azione sul metabolismo glucidico
Nel muscolo e nel t.adiposo la maggiore utilizzazione del glucosio è primariamente
dovuta ad attivazione della sua diffusione facilitata attraverso la membrana cell.
Nel fegato l’azione di stimolo dell’insulina sulla utilizzazione dei glucidi consegue
innanzitutto ad induzione della sintesi della glucochinasi.
L’aumentato ingresso del glucosio o l’incremento della sua fosforilazione da parte della
glucochinasi comporta una più intensa sintesi di glicogeno.
L’incremento della glicogeno sintesi e la restrizione della glicogenolisi sono causati da
stimolazione della glicogeno sintetasi e da inibizione della glicogeno fosforilasi da parte
dell’insulina, per il tramite di proteine-fosfatasi attivate per azione dell’ormone.
INSULINA E FEGATO
uno degli effetti più importanti dell’ormone è quello di immagazzinare come glicogeno nel fegato la maggior parte del glucosio assorbito
dall’intestino dopo un pasto
il glicogeno immagazzinato viene poi degradato a glucosio e liberato
nel sangue, quando tra un pasto e l’altro la concentrazione dello zucchero diminuisce così da impedire che la glicemia si abbassi troppo
59
INSULINA E FEGATO
Meccanismo d’azione
l’insulina inibisce la fosforilasi epatica che provoca la scissione del
glicogeno in glucosio
aumenta l’attività della glicochinasi, enzima che induce la fosforilazione del glucosio entrato nell’epatocita
aumenta l’attività degli enzimi che inducono la sintesi del
glicogeno, fosfofruttochinasi, glicogenosintetasi
l’effetto è quello di aumentare la quantità di glicogeno nell’organo
fino a 100 gr. circa il 6% della massa epatica
60
Effetti dell’ormone sul cervello
le cellule cerebrali utilizzano solamente glucosio
sono permeabili al glucosio senza l’intervento dell’insulina (GLUT-1)
É essenziale che la glicemia sia mantenuta sopra ad un determinato livello critico.
Se la quantità dello zucchero va al disotto di 20-50 mg/100 ml si ha shock
ipoglicemico che si manifesta con irritabilità, convulsioni, perdita di
coscienza e coma.
61
EFFETTO DELL’INSULINA
SUL METABOLISMO DEI GRASSI
l’insulina induce l’aumento dell’immagazzinamento dei grassi
quando il glucosio nel fegato non può più essere depositato come
glicogeno, viene degradato in Piruvato e convertito in Acetil CoA
l’attivazione dell’acetil Coa carbossilasi converte acetilCoA in
malonilCoA prima tappa della sintesi degli ac. Grassi
gli ac. grassi vengono convertiti in trigliceridi che liberati dagli
epatociti sono trasportati al tessuto adiposo legati a lipoproteine
entrano negli adipociti grazie alla lipoprotein-lipasi che scinde i
trigliceridi in ac. grassi che possono essere così assorbiti
62
Azione sul metabolismo lipidico
L’insulina stimola la sintesi degli acidi grassi (lipogenesi) e la loro esterificazione in trigliceridi.
Entrambe queste azioni sono conseguenza dell’aumentata utilizzazione del glucosio.
L’accelerata trasformazione del glucosio in piruvato e quindi in acetil-CoA e ossaloacetato
spiega l’aumento della lipogenesi.
stimolazione, da parte dell’insulina, della citrato liasi e della acetil-CoA carbossilasi
Accelerata sintesi di Acetil-CoA e Malonil-CoA nel citosol instaura anche l’inibizione del sistema
Carnitina-dipendente di trasporto degli acili nei mitocondri con conseguente arresto della βossidazione.
All’aumento dei trigliceridi concorre anche la potente azione inibitrice dell’insulina sulla lipasi
del tessuto adiposo e quella attivatoria sulla lipoproteina-lipasi, con distacco dai chilomocroni
degli acidi grassi (di origine alimentare) che il tessuto adiposo assume e incorpora nei trigliceridi.
L’effetto antilipolitico dell’insulina si realizza a concentrazione di insulina molto più basse di
quelle richieste per altri effetti metabolici dell’ormone!
l’insulina ha altri due effetti importanti
nell’immagazzinamento dei grassi nelle cellule adipose
inibisce la lipasi ormono-sensibile e questo inibisce la
liberazione degli ac. grassi nel sangue
promuove il trasporto nelle cellule adipose del glucosio
che è utiliz-zato sia per la sintesi di ac. grassi che di aglicerofosfato sostanza che fornisce il glicerolo per la
sintesi dei trigliceridi
64
la mancanza di insulina provoca negli epatociti:
1: la rapida -ossidazione dei grassi nei mitocondri… vengono
prodotte forti quantità di CoA
2: questo eccesso di CoA
viene convertita in Ac. acetace-
tico e liberato nel sangue viene metabolizzato in
ACIDO BETA IDROSSIBUTIRRICO
ACETONE
INDUCENDO CHETOSI
ED ACIDOSI
EFFETTO DELL’INSULINA
SUL METABOLISMO DELLE PROTEINE
-L’insulina promuove il trasporto di molti Aa all’interno delle cellule
(val, leu, isoleu, phe)
**(anche l’ormone della crescita ha lo stesso effetto, ma gli Aa sono
diversi)
-l’insulina agisce sui ribosomi aumentando la trasduzione dell’ mRNA
e aumenta inoltre la trascrizione di porzioni di DNA
-inibisce il catabolismo delle proteine
-deprime la gliconeogenesi epatica
66
INSULINA E MUSCOLO
la membrana del muscolo a riposo è poco permeabile al glucosio
durante la maggior parte della giornata, il muscolo dipende, per le sue
richieste energetiche, dagli ac.grassi non dal glucosio
la permeabilità della membrana muscolare al glucosio aumenta quando è sotto l’effetto dell’insulina
67
Se lo zucchero non viene utilizzato immediatamente dal muscolo per
fini energetici, viene depositato sotto forma di glicogeno
La quantità di glicogeno depositato non supera il 2%, ma essendo la
massa muscolare corporea rilevante, i depositi di glicogeno muscolari
sono ovviamente importanti
Il glicogeno depositato viene utilizzato al bisogno quando cioè il muscolo si contrae in condizioni anaerobiche nelle quali il glicogeno viene degradato ad acido lattico
durante l’esercizio fisico
in questo caso l’utilizzo del glucosio non richiede elevate quantità di
insulina poiché il muscolo in queste condizioni diviene molto permeabile al glucosio, per ragioni non ancora note, anche in assenza
dell’ormone
68
L’INSULINA COME ORMONE DELLA SZIETA’
Nel sistema nervoso centrale, soprattutto nei neuroni che costituiscono il
centro ipotalamico per la sazietà, troviamo i recettori per l'insulina.
Nell'encefalo, infatti, quest'ormone non regola il metabolismo del glucosio, ma
regola l'assunzione di cibo in quanto attenua la sensazione di fame.
glucagone
ormone iperglicemizzante
polipeptide di 29 amminoacidi (PM 3.485)
unica catena lineare che, una volta passata in circolo, si avvolge su se stessa in modo
casuale
la biosintesi avviene in modo analogo all’insulina con formazione di pre-pro-glucagone (PM
18.000) da cui deriva, per distacco di catene polipeptidiche, di pro-glucagone (PM 12.000) di
100 aa già parzialmente attivo, da cui deriva l’ormone attivo
il proglucagone viene sintetizzato anche in certe cellule dell’intestino tenue e dell’encefalo,
ma non viene trasformato in glucagone
si trova accumulato nelle cellule α in granuli secretori dai quali viene liberato per esocitosi
produzione giornaliera di 100-160 g che determina un livello ematico di 100-150 pg/ml
ha un emivita nel sangue circolante di ~ 6 min
il GLUCAGONE
Ormone peptidico di 29 aa
Sintetizzato dalla cellule a
PARASIMPATICO
aumento
gluconeogenesi
epatica
aumento
glicogenolisi
epatica
aumento
GLICEMIA
aumento
lipolisi
72
IL GLUCAGONE
Il glucagone è prodotto nel pancreas dalle cellule a delle isole del Langerhans;
viene secreto in risposta a ipoglicemia; il suo bersaglio principale è il fegato,
ma agisce anche sul tessuto adiposo.
Il suo effetto è iperglicemizzante.
Effetti metabolici
- Attiva la glicogenolisi (fegato)
- Stimola la lipolisi (tessuto adiposo)
- Attiva la gluconeogenesi (fegato)
- Inibisce la glicolisi (fegato, tessuto adiposo)
- Inibisce la glicogenosintesi (fegato)
Il glucagone è in grado di causare aumento della glicemia grazie alla presenza,
esclusivamente nel fegato, dell’enzima glucoso 6-fosfatasi che permette la
defosforilazione del glucoso 6-P e la fuoriuscita nel sangue di glucoso libero.
pag. 73
GLUCAGONE
La secrezione del glucagone (esocitosi) è stimolata da un basso livello di glucosio nel sangue
(ipoglicemia).
Viene anche prodotto dalle cellule L dell’intestino tenue con l’ingresso del bolo alimentare
(enteroglucagone), la sua funzione è quella di produrre un anticipato stato di iperglicemia e
di stimolare la secrezione dell’insulina.
a sua volta la secrezione di enteroglucagone è stimolata da una elevata concentrazione di
glucosio nel lume intestinale
GLUCAGONE E LE SUE FUNZIONI
Glucagone
Diminuzione di glucosio nel sangue
il glucagone, secreto dalle cellule a
ha effetti diametralmente opposti a
quelli dell’insulina
liberazione di glucagone
Si lega ai recettori di membrana
Attivazione dell’adenilato ciclasi
Aumento di cAMP, attivazione della
chinasi cAMP-dipendente
Attivazione della
glicogeno fosforilasi
l’effetto principale è quello di far
aumentare il tasso glicemico
come l’insulina il glucagone è un
grosso polipeptide PM 3490 costituito
da una catena di 29 Aa
Inibizione della
glicogeno sintetasi
Degradazione di glicogeno a glucosio
Rilascio di glucosio nel sangue
per le sue proprietà di aumentare la
glicemia viene indicato come fattore
IPERGLICEMIZZANTE
75
RECETTORE DEL GLUCAGONE
Il recettore del glucagone è un recettore proteico della massa di 62 kDa.
Appartiene alla famiglia dei Recettori accoppiati a proteine G
Quando il glucagone si lega al recettore, si ha una variazione conformazionale del recettore che viene così
attivato. Dalla sua attivazione si ha il distacco della subunità α dalla proteina G. Questa a sua volta
provvede all' attivazione dell'adenilato ciclasi, con aumento dei livelli intracellulari di cAMP
I recettori del glucagone si trovano anche nei reni.
Risposta
endocrina
all’ipoglicemia
77
EFFETTI SUL METABOLISMO DEL
GLUCOSIO
_1_AUMENTO DELLA GLICOGENOLISI
Glycogen
phosphorylase
active
78
Accanto ed in equilibrio con il sistema insulina-glucagone, esiste il sistema cosiddetto
controregolatore o controinsulare, rappresentato dalle ghiandole ipofisi e surrene.
Attraverso la secrezione di ormoni come GH, ACTH, cortisolo e catecolamine (adrenalina e
noradrenalina), questo sistema esercita un effetto iperglicemizzante
LE CATECOLAMINE
Le catecolamine, adrenalina e noradrenalina, sono prodotte nella midollare
delle surrenali ed anche nel cervello e nel tessuto nervoso, dove operano come
neuro-trasmettitori. Lo stimolo nervoso ne provoca l’emissione nel sangue e la
loro concentrazione da 0,06 microgrammi/litro si eleva, in pochi secondi, di
1000 volte. Si possono legare a recettori alfa e beta. La sintesi delle
catecolamine parte da tirosina DOPA Dopamina.
Effetti fisiologici: aumento del battito cardiaco e della pressione sanguigna. Il
bersaglio principale di questi ormoni è il muscolo, ma agiscono anche sul
fegato e sul tessuto adiposo.
Effetti metabolici
- Stimolano la glicogenolisi nel fegato aumento della glicemia
- Stimolano la glicogenolisi muscolare glicolisi (lattato) ATP
- Stimolano la gluconeogenesi nel fegato aumento della glicemia
- Mobilitano gli acidi grassi dal tessuto adiposo
- Stimolano la secrezione di glucagone
- Inibiscono la glicogenosintesi nel fegato e nel muscolo
- Inibiscono la secrezione di insulina
pag. 82
VALORI DI RIFERIMENTO
Plasma
Femmine: Adrenalina < 90 ng/L
Noradrenalina <700 ng/L
Dopamina <87 ng/L
Maschi: Adrenalina < 90 ng/L
Noradrenalina <700 ng/L
Dopamina <87 ng/L
Azione metabolica dell’adrenalina e della noradrenalina
l'adrenalina è un ormone che ha effetti contrari rispetto all'insulina di cui, tra l'altro, inibisce la
secrezione
L’adrenalina induce iperglicemia per stimolazione della glicogenolisi epatica. A differenza del
glucagone che stimola solo la fosforilasi epatica, l’adrenalina stimola anche la fosforilasi
muscolare e determina conseguentemente produzione e accumulo di acido lattico.
L'adrenalina aumenta la glicogenolisi e la gluconeogenesi epatica e muscolare
L’adrenalina stimola inoltre la lipolisi a livello del t.adiposo inducendo un aumento dei NEFA
plasmatici.
Anche la noradrenalina evoca gli effetti ricordati per l’adrenalina a seguito della sua interazione
con irecettori adrenergici: l’azione della noradrenalina è però molto meno efficace di quella
dell’adrenalina.
L'aumento della secrezione di catecolamine prepara il corpo ad un
elevato stress psicofisico:
•
•
•
•
•
•
•
aumentando la glicogenolisi
aumentando la gluconeogenesi
aumentando la lipolisi
inibendo la glicogeno sintesi
diminuendo l'insulina
aumentando la secrezione di glucagone
aumentando la glicolisi
Azione metabolica dell’adrenalina e della noradrenalina
l'adrenalina è un ormone che ha effetti contrari rispetto all'insulina di cui, tra l'altro, inibisce la
secrezione
L’adrenalina induce iperglicemia per stimolazione della glicogenolisi epatica. A differenza del
glucagone che stimola solo la fosforilasi epatica, l’adrenalina stimola anche la fosforilasi
muscolare e determina conseguentemente produzione e accumulo di acido lattico.
L'adrenalina aumenta la glicogenolisi e la gluconeogenesi epatica e muscolare
L’adrenalina stimola inoltre la lipolisi a livello del t.adiposo inducendo un aumento dei NEFA
plasmatici.
Anche la noradrenalina evoca gli effetti ricordati per l’adrenalina a seguito della sua interazione
con irecettori adrenergici: l’azione della noradrenalina è però molto meno efficace di quella
dell’adrenalina.
Specifici centri situati nel SNC controllano i livelli di glucosio plasmatico e reagiscono ad una sua
potenziale carenza aumentando rapidamente l’attività del sistema nervoso adrenergico, con
conseguente rilascio di adrenalina.
Risposte neuroendocrine addizionali comprendono:
Aumento della secrezione di glucagone con riduzione di quella dell’insulina
Aumento della secrezione di ormone della crescita (GH) e di cortisolo.
L’adrenalina ed il glucagone mediano la risposta acuta all’ipoglicemia.
L’aumento della secrezione di adrenalina all’ipoglicemia dura 2-4 h, quella del glucagone è invece fugace
e si esaurisce nel giro di 20 min.
Il GH ed il cortisolo mediano la risposta tardiva all’ipoglicemia. La loro increzione infatti aumenta dopo
3-4h. La durata della risposta tardiva è di 5-12 h.
Gli ormoni controregolatori agiscono essenzialmente:
Stimolando la metabolizzazione del glicogeno epatico a glucosio e la gluconeogenesi epatica
Riducendo l’utilizzazione del glucosio da parte dei tessuti non-nervosi per aumentare la disponibilità
per le cellule cerebrali
Il legame con l'adrenalina modifica la
conformazione del recettore che diviene in grado di
catalizzare la sostituzione del GDP , legato ad una
proteina stimolatrice, Gs, con il GTP.
La proteina stimolatrice, composta da tre unità
monomeriche, può così lasciare le subunità β e γ e,
spostandosi lungo il piano della membrana con la
sola subunità α, raggiungere una proteina integrale
di membrana chiamata adenil ciclasi attivandola.
Il sito attivo della AC è rivolto verso il citosol e
catalizza la conversione dell'ATP in AMPc (AMP
ciclico).
L'AMPc stimola l'azione di una proteina chinasi
AMPc dipendente (PKA) in grado di fosforilare le
proteine cellulari e causare la risposta
all'adrenalina.
Effetti dell’adrenalina sul metabolismo
•
•
•
•
Aumentata glicogenolisi nel fegato e nel muscolo
Aumentata lipolisi nel tessuto adiposo
Diminuita secrezione di insulina
Aumentata secrezione di glucagone
SOMATOTROPINA O GH
ormone peptidico dell'adenoipofisi composto da 191 amminoacidi
•
•
•
E' un ormone prodotto dalla ghiandola pituitaria (ipofisi) su stimolazione del growth hormone-releasing
factor o GHRF, sostanza prodotta dall'ipotalamo.
Lo stimolo essenziale per la liberazione del GHRF è l'ipoglicemia (causata ad es. dal digiuno o da
somministrazione di insulina).
Circola nel sangue in concentrazioni molto basse (circa 10 milionesimi di grammo per litro). La vita media
è di circa 20-30 minuti.
Lo stimolo alla sua produzione è
fondamentalmente legato all'ipoglicemia, ma può
essere aumentato dall'esercizio fisico, dal sonno
profondo, da una dieta proteica, da condizioni
iperpiretiche, da una sana e regolare attività fisica
soprattutto di carattere aerobico.
Viene prodotto per tutto il decorso della propria
vita, ma superati i 30 anni i suoi livelli iniziano a
calare di circa il 15 per cento ogni decennio.
SINTESI PROTEICA
Collabora con gli ormoni tiroidei, con gli ormoni sessuali steroidei e con l'IGF-1 al processo di
sviluppo e accrescimento dell'apparato scheletrico
Garantisce il trofismo muscolare ed osseo nell'adulto
Risparmia le riserve di proteine
TESSUTO ADIPOSO
Il GH favorisce la mobilizzazione dei grassi, stimola la lipolisi.
Aumenta l'ossidazione degli acidi grassi, favorendo il dimagrimento e la sintesi di corpi
chetonici nei tessuti
stimola l'utilizzo dei lipidi e acetil-CoA allo scopo di produrre energia
EFFETTI CONTROINSULARI
La somministrazione cronica di GH ha effetti iperglicemizzanti con ridotta utilizzazione di
glucosio, soprattutto del muscolo e del tessuto adiposo ridotta glicogenosintesi ed insulino
resistenza.
Risparmia le riserve di carboidrati
effetto diabetogeno.
Ilrecettore, presente in tutto l’organismo, appartiene alla famiglia dei
recettori delle citochine.
Una molecola di GH lega dure recettori adiacenti e ne determina la
dimerizzazione, l’interazione e l’attivazione. Il dimero attivato recluta e
attiva proteine dotate di attività tirosin-chinasica intrinseca della famiglia
delle JAK (Janus-chinasi). Queste proteine fosforilano fattori di trascrizione
che, attivano l’espressione genica di alcune proteine, in particolare del
fattore di crescita insulino-simile di tipo 1 (IGF-1)
La pulsatilità dell' ormone della crescita GH determina, in condizioni
fisiologiche, una finestra d’attività durante il sonno notturno.
un aumento della glicemia serale causa un effetto antagonista alla sua
secrezione, riducendo la finestra utile all'azione più rilevante dell' ormone,
ne consegue una degradazione della funzione anabolica
GLUCOCORTICOIDI
ormoni steroidi a 21 atomi di carbonio prodotti dalla corteccia
surrenale
l cortisolo è senza dubbio il glucocorticoide più conosciuto,
nonostante nella stessa famiglia rientrino diversi ormoni, come il
cortisone ed il corticosterone. Tutti questi glucocorticoidi
agiscono per innalzare la glicemia, incrementando la
produzione di glucosio a partire da alcuni amminoacidi e
diminuendo il suo utilizzo periferico; questi ormoni stimolano
inoltre il deposito di glicogeno nel fegato
RECETTORE GLUCORTICOIDI
Il recettore per i glucocorticoidi è un recettore intracellulare
Una volta che il glucocorticoide è entrato nella cellula, a seguito del legame con il recettore GR si
verifica un cambiamento conformazionale tale per cui si determina il distacco della proteina
inibitrice, e la formazione di un dimero.
A seguito di questo evento il complesso citoplasmatico può migrare nel nucleo, dove va a legarsi a
delle specifiche sequenze di riconoscimento in grado di riconoscere tali complessi.
Le sequenze di riconoscimento per i glucocorticoidi prendono il nome di elementi responsivi
glucocorticoidi (GRE, Glucocorticoids Responsive Elements).
C
I
B
O
Effetti del cortisolo sui
flussi energetici
•facilita la mobilizzazione
di nutrienti (catabolico)
•mantiene la produzione
di glucosio dalle proteine
•facilita il metabolismo
dei grassi
STIMOLA
INIBISCE
Effetti dei glucocorticoidi su altri ormoni
Insulina: eccessi cronici di cortisolo portano ad aumentare il rilascio di insulina da
parte del pancreas, riducendo la sensibilità del tessuto muscolare ed adiposo
all'azione della stessa.
L'iperinsulinemia porta a depositare più grasso nonostante il cortisolo sia un
ormone lipolitico.
10-25 µg/dl ore 8
2-14 µg/dl ore 15
ORMONI TIROIDEI
Gli ormoni tiroidei sono prodotti dai tireociti della tiroide. Gli ormoni prodotti sono:
la tetra-iodotironina o tiroxina (T4), circa il 90% del totale e forma inattiva;
la tri-iodotironina (T3), circa il 10%. Nelle loro molecole sono contenuti rispettivamente 4 e
3 atomi di iodio.
La tiroide produce T4 in concentrazioni molto maggiori rispetto a T3.
Quest’ultima è però molto più attiva e può essere a sua volta ottenuta dall’ormone T4 per
una trasformazione enzimatica che avviene nel circolo sanguigno, a seconda delle necessità
dell’organismo.
In condizioni fisiologiche gli ormoni tiroidei stimolano i processi anabolici.
Valori tiroidei normali
Tiroxina (T4) totale (TT4) 60 - 150 nmoli/L
Tiroxina (T4) libera (fT4) 10 - 25 pmoli/L
Triiodotironina (T3) totale (TT3) 1,1 - 2,6 nmoli/L
Triiodotironina (T3) libera (fT3) 3,0 - 8,0 pmoli/L
Ormone tireo-stimolante (o tireotropina) (TSH)
0.15 - 3,5 mU/
inducono la produzione epatica di glucosio
aumentano la glicogenolisi e la gluconeogenesi; promuovono l'utilizzazione del
glucosio
aumentando l'attività di enzimi coinvolti nell'ossidazione del glucosio
stimolano l'attività della lipasi ormono-sensibile → lipolisi
stimolano la sintesi e l'ossidazione del colesterolo e la sua conversione
in acidi bilari
favorita la sintesi di acidi grassi
Aumento delle sintesi proteiche
Stimolano l'ossificazione endocondrale, la crescita lineare mediata
dalla loro azione sulla secrezione di GH e di IGF-1
ORMONI TIROIDEI ED INSULINA
a livelli normali, T3 e T4 migliorano la sensibilità delle cellule all’ insulina favorendo la
glicogenosintesi, agendo sui recettori
livelli elevati di T3 e T4 invece portano a glicogenolisi con conseguente innalzamento della
glicemia
ORMONI TIROIDEI E ADRENALINA
alti livelli di adrenalina innalzano il TSH aumentando la produzione di ormoni iodati.
Allo stesso modo alti livelli di T3 e T4 rendono le cellule più sensibili all'azione delle
catecolamine.
Il risultato netto è un aumento della frequenza cardiaca, della sua contrazione, della
glicogenolisi e lipolisi, del metabolismo in generale.
Allo stato attuale della conoscenza, esistono 4 forme recettoriali per gli ormoni tiroidei, dei
quali solo 3 sono in grado di legare gli ormoni:
Recettore alfa-1: recettore ampiamente espresso e presente particolarmente nel muscolo
cardiaco e scheletrico.
Recettore alfa-2: omologo all'oncogene virale v-erb-A, ma non in grado di legare l'
ormone.
Recettore beta-1. espresso principalmente nel cervello, fegato e reni.
Recettore beta-2: presente in regioni limitate del corpo umano come ipotalamo e
ghiandola pituitaria.
la localizzazione è sempre nucleare e si trovano legati alla cromatina nucleare
Quando arriva l’ormone e lega il recettore viene stabilizzata ancora di più il legame con
la cromatina a livello degli elementi di risposta all’ormone tiroideo TRE. Gli ormoni
tiroidei sono lipofili e attraversano facilmente la membrana plasmatica ed entrano in
contatto con il recettore nucleare che una volta attivato prende contatto con la
sequenza TRE ed in seguito al reclutamento di fattori trascrizionali si attiva la trascrizione
di geni specifici per l’ormone tiroideo.