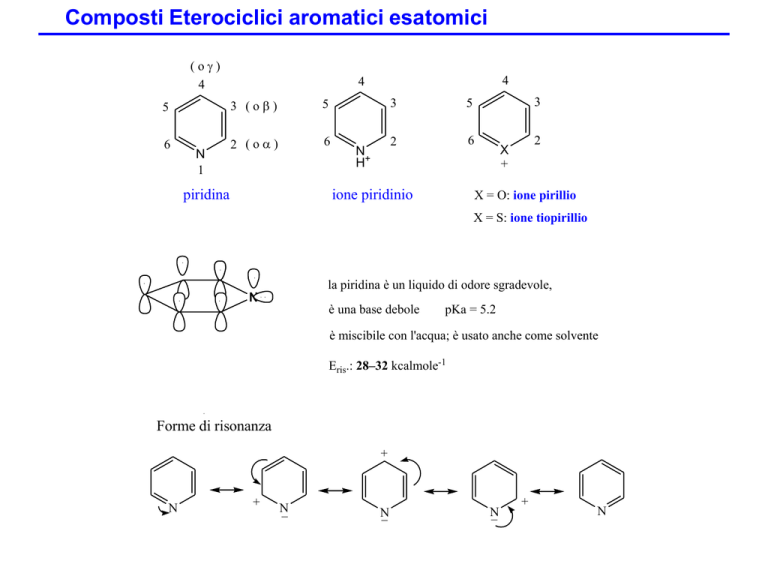
Composti Eterociclici aromatici esatomici
( o )
4
5
3 (o)
5
6
2 (o)
6
N
1
4
4
piridina
N
H+
3
3
5
2
6
ione piridinio
2
X
+
X = O: ione pirillio
X = S: ione tiopirillio
la piridina è un liquido di odore sgradevole,
N
è una base debole
pKa = 5.2
è miscibile con l'acqua; è usato anche come solvente
Eris.: 28–32 kcalmole-1
Forme di risonanza
+
N
+
N
_
N
_
N
_
+
N
Composti Eterociclici aromatici esatomici
Sintesi del nucleo piridinico di Hantzsch
La reazione di formazione della diidropiridina è una reazione one-pot. Il prodotto di reazione
si ottiene per ossidazione dell'intermedio; può essere idrolizzato e decarbossilato.
EtO2C
R
R
RCHO
H
CO2Et
EtO2C
CO2Et
ossid.
+
O
CO2Et
EtO2C
N
N
H
O
NH3
R
EtO2C
RCH=O
R
EtO2C
CH OH
H
OH
-H2O
EtO2C
CO2Et
CH
R
H
CO2Et
EtO2C
+
O
HO
O
O O
NH3
R
R
H
CO2Et
EtO2C
N
H
H
CO2Et
EtO2C
HO
N
H
OH
Composti Eterociclici aromatici esatomici
NH3
N
RNH2
O O
N
R
H+
O
O
O
O
H2SO4
C
+
H2N
BaCO3
NH
N
EtOH
NH2
N
2,4-pentadione
N
OH
OH
2-idrossi-4,6-dimetilpirimidina
OH
O
S
O
N
+
OEt
C
H2N
NH2
N
SH
Composti Eterociclici aromatici esatomici
Reattività all’azoto
1a. py + acido
es. py + HCl
formazione del sale
cloruro di piridinio
Kb = 2.3 10-9 (ammina alifatica Kb ca. 10-4, doppietto in orbitale sp2)
py + CH3I
ioduro di N-metilpiridinio
_
N+
I
CH3
complesso usato per le acetilazioni controllate
py + CH3COCl
_
N+
Cl
COCH3
complesso usato per le solfonazioni controllate
py + SO3
N+
_
SO3
2a. Formazione di N-ossidi
MCPBA
N
CHCl3, 0 °C
MCPBA: acido m-cloroperbenzoico
reattivo sia con elettrofili che con nucleofili
N+
O-
Composti Eterociclici aromatici esatomici
Reattività al carbonio - Reattività con gli elettrofili.
L’anello è fortemente disattivato per la presenza dell’azoto elettronattrattore. La reazione decorre in
basse rese e con condizioni di reazione drastiche. La sostituzione avviene in posizione 3.
Le acilazioni e alchilazioni di FC non avvengono.
NO3
KHNO3, H2SO4, 300 °C
N
5%
SO3H
H2SO4, 350 °C
N
N
Br
Br2, 300 °C
N
+
+
Attacco in 2 o 4
N
+
E
N
N
E
E
N
+
_
H+
E
N
E
instabile
+
H
E+
H
E
E
Attacco in 3
N
H
H
H
N
+
+
N
H
E
E _ H+
N
N
Composti Eterociclici aromatici esatomici
Reattività al carbonio - Reattività con nucleofili.
La piridina è molto attivata verso la sostituzione elettrofila aromatica.
NH3
Cl
RO-
200 °C
N
RO
OR
Cl
Br
N
NH2
N
N
N
La reattività è così elevata che nucleofili forti sono in grado di sostituire anche uno ione idruro. In questo
caso la reazione avviene sempre in posizione 2.
_
_
H
H
N
_
Nu
N
_
N
Nu
_
_
H
H
N
Nu
Nu
Nu
N
più stabile
KOH
N
N
300 °C
OH
H
N
_
OH
O
N
H
2-piridone
_
_
_
H
N
OH
_
H
H2
H2O
N
_
O K+
Composti Eterociclici aromatici esatomici
Reattività al carbonio – Reazione con sodioamide (Reazione di Cicibabin)
NaNH2
–
–
H
N
N
–
–
NH2
H
NH2
N
– H
H
NH2
N
–
– H2
NH2
CH3OH
–
N
+
NH Na
N
NH2
2-amminopiridina
pKa = 7.2
La reazione è condotta in toluene a riflusso (110 °C). Con solventi più altobollenti si
ottengono la 2,6-diamminopiridina e la 2,4,6-triamminopiridina.
Reattività al carbonio – Reazione con nucleofili al carbonio
Li
N
N
Composti Eterociclici aromatici esatomici
Reattività della N-ossipiridina
La piridina N-ossido è reattiva sia con elettrofili (più reattiva della piridina) che con nucleofili.
+
N+
N
O-
O-
+
+
N
O-
N
N+
O-
O-
–
–
–
N+
N+
N+
N+
O
O
O
O-
Reattività con elettrofili
NH2
NO2
+
NO2
N+
O–
100 °C
H2/Pd/C
N+
O–
N
4-amminopiridina
pKa = 9.1
Composti Eterociclici aromatici esatomici
Reattività della N-ossipiridina – Reattività con nucleofili
PhMgBr
Ph
THF, – 20 °C
N+
N
O–
H
N
Ph
2-fenilpiridina
OMgBr
Addizioni nucleofile a ioni piridinio.
Gli ioni alchilpiridinio sono molto attivati verso le sostituzioni nucleofile.
N
N
N
N
R
R
R
R
+ OHN
CH3
H2O
K3Fe( CN)
6
H
N
Cl
CH3
OH
N
O
CH3
N-Metil-piridone
Composti Eterociclici aromatici esatomici
H2, Pt
N
HCl, 25 °C, 3 atm
N
H
piperidina
Alcuni esempi di piridine bioattive
OH
CONHNH2
CONH2
N
nicotinammide
S
HO
OH
N
isoniazide
H3C
N
piridossina
(Vit. B6)
N
N
nicotina
CH3
Composti Eterociclici aromatici esatomici
Benzopiridine
Composti presenti nel catrame di carbone fossile; sono liquidi altobollenti con basicità
paragonabile a quella della piridina
5
4
6
7
8
N
5
3
6
2
7
3
N
8
1
benzo[b]piridina
o
chinolina
Kb = 3 10-10
4
2
1
benzo[c]piridina
o
isochinolina
( piridina Kb = 2.3
10-9)
Kb = 1.110-9
Reattività dell'N e del C
per l'azoto
per il carbonio
come nella piridina
nella chinolina
NO2+
5-NO2- e 8-NO2-chinolina
(circa 50:50 %)
nella isochinolina
NO2
+
5-NO2- > 8-NO2-chinolina
Sono numerosi i composti naturali che contengono i nuclei benzopiridinici
chinino
Composti Eterociclici aromatici esatomici
Composti Eterociclici aromatici esatomici
Composti Eterociclici aromatici esatomici
Sintesi di Bischler-Napieralski della isochinolina.
P2O5
Pd
N
NH
O
CH3
CH3
-feniletilammina acilata
H+
CH3
NH
NH
HC
3
+
OH
H+
B
+
O
CH3
N
NH
H
H3C
OH
B
N
NH
H3C
OH
H3C
OH2
+
N
H
CH3
Composti Eterociclici aromatici esatomici
Composti eteroaromatici esatomici con due o più eteroatomi
N
N
N
N
N
N
1,2-diazina
1,3-diazina
1,4-diazina
o
o
o
piridazina
Eris. = 12.3 Kcalmole-1
pKa = 2.33
pirimidina
Eris. = 26 Kcalmole-1
pKa = 1.30
Il secondo aza gruppo destabilizza l'acido coniugato
pirazina
Eris. = 24 Kcalmole-1
pKa = 0.65
cfr. pKa Py = 5.2
Composti Eterociclici aromatici esatomici
Reattività della pirimidina
-) Puo subire sia alchilazioni all'azoto che formazione di N-ossidi.
-) E' meno reattiva della piridina nella sostitizione elettrofila aromatica. L'attacco avviene in 5.
La reazione è favorita dalla presenza di gruppi elletrondonatori
OH
OH
O2N
HNO3
N
N
HAc
H3C
N
OH
H3C
N
OH
-) E' più reattiva della piridina nella sostitizione nucleofila aromatica.
Cl
OCH3
N
N
CH3O-
OCH3
Cl
N
N
OCH3
Cl
N
N
N
OCH3
Cl
N
N
N
Composti Eterociclici aromatici esatomici
Fra i diversi derivati le basi pirimidiniche sono di particolare importanza:
O
O
H3C
3
NH
NH
O
3
HN
HO
4'
H
H
1N
O
1'
H
3'
2'
H
O
3
HO
O
4'
H
H
1N
1'
H
3'
2'
OH H
uridina
timidina
O
HN
CH3
O
5'
OH OH
esempio di riboside
citosina
HN
O
5'
O
N
H
timina
uracile
3
N
O
N
H
O
N1
H
NH2
H
esempio di 2-deossiriboside
HO
1N
O
4'
H
H
CH3
O
5'
1'
H
3'
N3
2'
H
H
AZT o zidovudina
primo farmaco anti-AIDS
Uridina e timidina sono nucleosidi cioè componenti degli acidi nucleici
Composti Eterociclici aromatici esatomici
Sono note le benzodiazine come pure le bisdiazine. Un esempio di queste ultime:
N
N
diversi coenzimi hanno il nucleo pteridinico funzionalizzato
N
N
pteridina
Ci sono altri biseterocicli. Importantissima la Purina
6
1N
N
3
H
N7
N
9
6
H2O
7
N
1N
N
3
N9
H
allo stato cristallino la forma 7H è più stabile dell'altra; in acqua le due forme si equivalgono
Composti Eterociclici aromatici esatomici
Basi puriniche e derivati
SH
O
NH2
N
N
H2N
N
H
N
N
HN
N
N
N
H
6-mercaptopurina
N
N
N
H
(antitumorale)
9-H-6-amminopurina
o
9-H-2-ammino-6-idrossipurina
o
guanina
adenina
H2N
6
7
5'
N9
O
4'
N
HN
H2N
N
N
1
O
N
N
HO
O
OH
aciclovir (Zovirax)
N
3
(antivirale)
1'
3'
2'
OH OH
adenosina
la guanosina è il riboside che ha come aglicone la guanina
la adenosina e la guanosina sono nucleosidi; i nucleotidi sono nucleosidi
esterificati con l'acido fosforico












