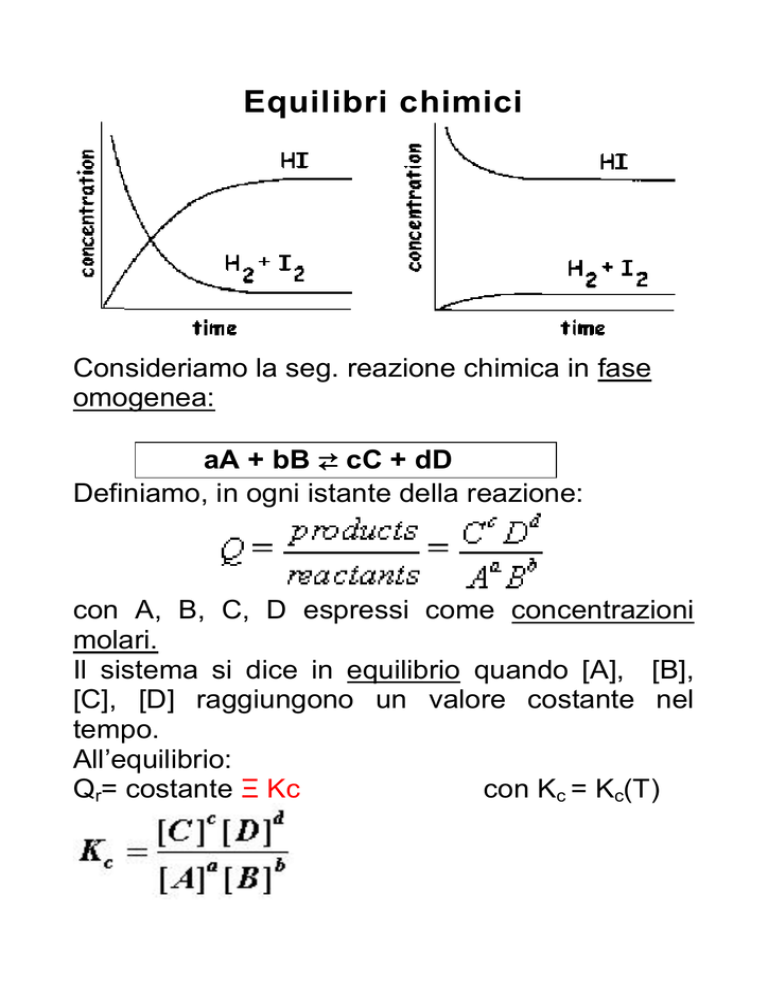
Equilibri chimici
Consideriamo la seg. reazione chimica in fase
omogenea:
aA + bB î cC + dD
Definiamo, in ogni istante della reazione:
con A, B, C, D espressi come concentrazioni
molari.
Il sistema si dice in equilibrio quando [A], [B],
[C], [D] raggiungono un valore costante nel
tempo.
All’equilibrio:
Qr= costante Ξ Kc
con Kc = Kc(T)
Il valore di Kc dipende esclusivamente dalla
temperatura e non dalle concentrazioni iniziali dei
reagenti (o dei prodotti).
K>>1 ⇒reazione spostata a destra
K ≈1 ⇒reazione di equilibrio
K<<1 ⇒reazione spostata a sinistra
Attenzione: l’equilibrio non è statico, ma
dinamico e statistico.
Esempio
CO(g) + 2 H2(g) î CH3OH(g)
1° esperimento (T=500 K, V = 10 litri)
CO
1.00
H2
1.00
CH3OH
0.00
moli
iniziali
moli
0.911 0.822 0.0892
equilibrio
Molarità 0.0911 0.0822 0.00892
equilibrio
[CH3OH]
KC= _____________ = 14.5
[CO][H2]2
2° esperimento (T=500 K, V = 10 litri)
CO
0.00
H2
0.00
CH3OH
1.00
moli
iniziali
moli
0.753 1.506 0.247
equilibrio
Molarità 0.0753 0.1506 0.0247
equilibrio
[CH3OH]
Kc= ______________ = 14.4
[CO][H2]2
Ricordiamo la legge di Dalton
• La pressione totale P esercitata da una miscela
di gas è pari alla somma delle pressioni parziali
dei gas componenti la miscela.
• La pressione parziale di un gas, in una miscela,
è quella che eserciterebbe nelle stesse
condizioni di volume e temperatura, in assenza
degli altri gas.
Per una reazione che avviene in fase gassosa,
l’equilibrio si può esprimere anche mediante la Kp:
( Kp=Kp(T))
pA= pressione parziale di A= XA*P
Altre costanti di equilibrio sono Kn e Kx, ma Kp e Kc
sono le uniche che dipendono solo dalla temperatura.
Importante: il valore di una costante di equilibrio, ad
esempio Kp, dipende dal modo in cui è scritta la
reazione:
N2(g) + 3H2(g) î 2NH3(g)
½ N2(g) + 3/2 H2(g) î NH3(g)
2NH3(g) î N2(g) + 3H2(g)
KIp
KIIp
KIIIp
EQUILIBRI IN FASE ETEROGENEA
C(s) + H2O(g) î CO(g) + H2(g)
Kc=
[CO][H2]
______________
ma [C] è costante!
[C][H2O]
Per le reazioni in fase eterogenea, se sono
presenti specie chimiche la cui concentrazione
resta costante (es. fasi solide), il valore di
concentrazione si può inglobare nella costante di
equilibrio:
K=K’*1/[C]
⇒ K’ =[CO][H2]/[H2O]
La costante di equilibrio riporta allora solo le
specie gassose, purché si sia sempre in
presenza di tutte le specie che partecipano alla
reazione
(In realtà la trattazione più rigorosa considera
non le concentrazioni, ma le attività).
Funzioni di stato e verso di una reazione
chimica
CO(g) + 2 H2 (g) î CH3OH (g)
ΔH, ΔS
ΔH e ΔS sono funzioni di stato
ΔH: variazione di entalpia del sistema.
Corrisponde al calore scambiato quando la
reazione avviene a pressione costante
ΔH<0 reazione esotermica. Avviene con sviluppo
di calore (es. combustione)
ΔH>0 reazione endotermica. Avviene con
assorbimento di calore (es. dissoluzione di
diversi sali).
ΔS: variazione di entropia del sistema.
Indica se un fenomeno (non necessariamente
una reazione chimica) avviene con aumento o
diminuzione del grado di disordine
Queste due grandezze compaiono assieme
nell’espressione:
ΔG = ΔH –TΔS
che indica la direzione verso cui evolve
spontaneamente una reazione chimica.
ΔG(T,P)<0 ⇒reazione spontanea (Qr<Keq)
ΔG(T,P)=0 ⇒sistema all’equilibrio (Qr=Keq)
ΔG(T,P)>0 ⇒è spontanea la reazione opposta
………………..(Qr >Keq)
• Quando il ΔG associato ad una reazione
chimica è negativo, si dice che è
termodinamicamente favorita.
• Alla spontaneità di una reazione chimica
contribuiscono sia ΔH che ΔS.
• Il contributo di ΔS è tanto più importante quanto
più è alta la temperature (termine T*ΔS).
ΔH
<0
<0
>0
>0
ΔS
>0
<0
>0
<0
ΔG
<0 sempre
<0 alle bassa T
<0 alle alte T
>0 sempre
Il ΔG è legato alla costante di equilibrio dalla
relazione:
ΔG°= -RTln Keq
Fattori che
equilibrio
influenzano
la
costante
di
I principali sono concentrazioni (dei reagenti e
dei prodotti), temperatura, pressione
Concentrazioni
una reazione si può spostare verso destra
facendo aumentare la concentrazione dei
reagenti e/o facendo diminuire quella dei prodotti.
Temperatura
d lnKeq
_________
dT
ΔH°
= ______
RT2
Equazione di Van’t Hoff
Reazione esotermica ⇒ΔH<0 ⇒dlnkeq/dT<0
⇒
se T cresce, K decresce
se T decresce, K cresce
Reazione endotermica ⇒ΔH>0 ⇒dlnkeq/dT>0
⇒
se T cresce, K cresce
se T decresce, K decresce
Esempio
2SO2(g) + O2(g) î 2 SO3(g) ΔH°= -180 KJ/mol SO3
Si può spostare l’equilibrio verso destra:
1. abbassando T
2. aggiungendo O2 o SO2
Si può inoltre agire sulla pressione P
Pressione
Quando una reazione avviene con diminuzione
del numero di moli (delle specie gassose), un
aumento della pressione (una diminuzione del
volume) sposta la reazione verso destra
Esempio
2SO2(g) + O2(g)î 2 SO3(g)
ma [SO3]= n(SO3)/V, allora:
(nSO3/V)2
n2(SO3)
KC = __________________ = _____________________* V
(nSO2/V)2(nO2/V)
n2(SO2).n(O2)
KC è costante ⇒ facendo diminuire V aumenta il
valore di Kn ⇒ cresce la resa in SO3
Possiamo scrivere la Kp in funzione delle frazioni
molari, in fase gas, dei componenti:
p(SO2)= P*X(SO2)
p(SO3)= P*X(SO3)
p(O2) = P*X(O2)
p2 (SO3)
x2(SO3)*P2
Kp= _________________ = ____________________________ =
x2(SO2)*P2*x(O2)*P
p2 (SO2)p(O2)
x2(SO3)
= ___________________ .1/P
x2(SO2)*x(O2)
Un aumento della pressione sposta a destra la
reazione.
La formula generale che collega Kp e Kx è:
Kp=Kx.PΔn
con Δn = c+d-(a+b)
(Δn chiamato anche Σν: tiene conto del segno)
Vale anche: Kp=KC.(RT)Δn, che si ricava per mezzo
dell’equazione di stato dei gas ideali.
Principio di Le Chatelier o dell’equilibrio
mobile
Un sistema in equilibrio, sottoposto ad una
sollecitazione esterna, si sposta nella direzione
che tende ad annullare la sollecitazione stessa.
Si raggiunge così un nuovo stato di equilibrio che
compensa parzialmente la variazione
Esempio
SO2(g) + ½ O2(g) î SO3(g) ΔH°= -180 KJ
Aumentando [SO2], [O2]⇒ produzione di SO3
Aumentando [SO3] ⇒ decomposizione di SO3
Aumentando T ⇒ reazione spostata a sn
Abbassando T ⇒ reazione spostata a dx
Aumentando P⇒ produzione SO3 (diminuzione
del numero di moli)
Abbassando P⇒ la reaz. si sposta a sn
(aumento n. moli)
E’ una descrizione qualitativa, e non sempre
corretta, della direzione verso cui evolve
l’equilibrio in seguito a sollecitazioni esterne.