Ossidazione di composti insaturi: formazione di epossidi
•
•
•
•
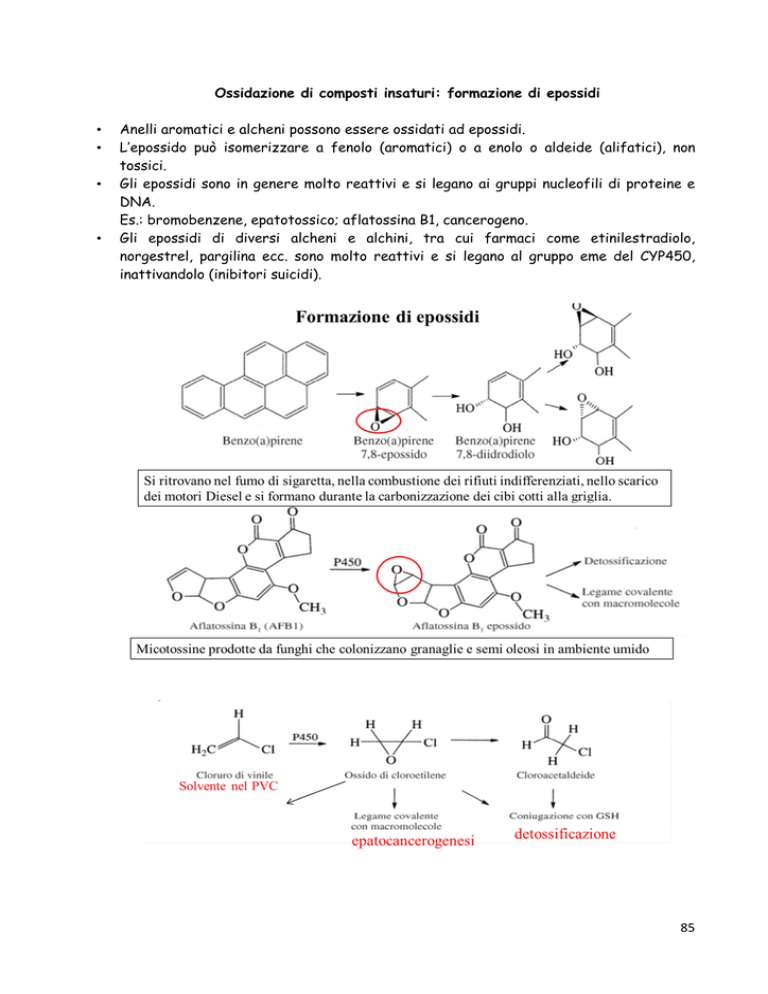
Anelli aromatici e alcheni possono essere ossidati ad epossidi.
L’epossido può isomerizzare a fenolo (aromatici) o a enolo o aldeide (alifatici), non
tossici.
Gli epossidi sono in genere molto reattivi e si legano ai gruppi nucleofili di proteine e
DNA.
Es.: bromobenzene, epatotossico; aflatossina B1, cancerogeno.
Gli epossidi di diversi alcheni e alchini, tra cui farmaci come etinilestradiolo,
norgestrel, pargilina ecc. sono molto reattivi e si legano al gruppo eme del CYP450,
inattivandolo (inibitori suicidi).
85
•
•
Gli epossidi di alcheni alogenati sono instabili e per trasposizione formano aldeidi
alogenate, che possono essere poi ossidate o ridotte.
La tossicità dipende anche dalla velocità di trasposizione; ad es., il tricloroetene
(trielina) forma un’epossido poco tossico perché traspone velocemente, e l’aldeide viene
rapidamente metabolizzata. Tuttavia il tricloroetene è cancerogeno per la formazione
di altri metaboliti tossici.
Ossidazione di idrocarburi policiclici aromatici (IPA)
•
•
•
•
•
Dato l’alto numero di posizioni ossidabili, il metabolismo è molto complesso. E’ stato
molto studiato perché diversi IPA diventano cancerogeni potenti dopo bioattivazione.
L’ossidazione avviene prevalentemente nelle regioni ad alta densità elettronica (regione
L) o in cui si trovano doppi legami con carattere prevalentemente olefinico (regione K).
Sono difficilmente ossidati i legami degli anelli terminali, con carattere
prevalentemente aromatico, ed i legami adiacenti ai punti di fusione tra gli anelli.
Spesso si hanno epossidazioni successive in posizioni diverse.
Gli epossidi che si formano nelle regioni ‘Baia’ (Bay region) non sono attaccabili
dall’epossido idrolasi e dalla glutatione-S-transferasi ⇒ cancerogenesi
(es.,
benzo[a]pirene)
86
Idratazione di epossidi da parte di epossido-idrolasi
In genere, l'idratazione dell'epossido dà luogo alla detossificazione di metaboliti molto
reattivi con formazione di dioli.
87
Ossidazione di eteroatomi da parte di CYP450
Composti solforati (S-ossidazione):
• Mercaptani ⇒ alcoli
• Tioeteri ⇒ solfossidi (⇒ solfoni)
• Solfossidi ⇒ solfoni
Gli intermedi R-S-OH (acidi solfonici) sono reattivi, potenzialmente tossici.
Reazioni catalizzate anche dalle monoossigenasi flaviniche (FMO): comprendono 5 enzimi
microsomiali che richiedono NADPH e O2 e catalizzano ossidazione di eteroatomi (N, S,
P).
88
N-ossidazione
Reazioni catalizzate da CYP450 e/o monossigenasi flaviniche (FMO)
• Formazione di N-ossidi. P450: N ricchi di elettroni (piridine, chinoline); FMO: N poveri
di elettroni (amine terziarie)
• Formazione di N-idrossilamine: amine aromatiche primarie e secondarie. Le Nidrossilamine possono essere O-coniugate con gruppi acetile o solfato ⇒ uscita di di
gruppi acetossi o solfato ⇒ ioni nitrenio reattivi ⇒ metaboliti cancerogeni. Le Nidrossilamine aromatiche possono anche essere ossidate a nitroso- e nitro-composti
89
Reazioni di riduzione di chinoni
La cancerogenità del benzene e degli idrocarburi aromatici in genere (fenoli e
idrochinoni e di tutti gli intermedi di ossidazione a chinone) può almeno in parte essere
attribuita alla formazione di idrochinone radicalico e chinone in seguito a doppia
ossidrilazione da parte del CYP450, successiva formazione del radicale idrochinonico
per opera di perossidasi e infine autossidazione a chinone con produzione di anione
radicale superossido (O2.-).
Altro esempio: effetti tossici del paracetamolo.
90
N-dealchilazione (amine alifatiche primarie e secondarie): catalizzata solo da
CYP450
•
•
•
La dealchilazione di ammine 2° e 3° rispettivamente ad ammine 1° e 2° è una delle più
frequenti ed importanti reazioni metaboliche.
Comporta l’estrazione di un e- dal N o di un protone dal carbonio in a (in tal caso si ha
idrossilazione del C-alfa e quindi dealchilazione con formazione dell’aldeide o chetone.
Si formono così prodotti più polari (facilmente eliminabili).
• N-dealchilazione di nitrosammine
La formazione di nitrosoamine può avvenire in vivo, a partire da amine e nitriti,
catalizzata dal pH acido dello stomaco.
I nitriti si formano già nella saliva dai nitrati presenti negli alimenti come conservanti
(affettati, carne):
91
Ossidazione delle idrazine (NH2-NH2)
L’ossidazione delle idrazine (NH2-NH2) forma composti instabili che decompongono con
formazione di cationi (o radicali) acetili ⇒ cancerogenesi, epatotossicità.
Metaboliti tossici delle reazioni di dealogenazione
•
•
La dealogenazione riduttiva di CCl4 ed altri idrocarburi alogenati ha come intermedio il
radicale CCl3. ⇒ perossidazione lipidica
Si formano inoltre altri metaboliti tossici, come il fosgene ⇒tossicità epatica e renale
Nella terapia dell’avvelenamento da CCl4 si somministra O2 iperbarico per inibirne la
capacità del CYP2E1 di metabolizzare CCl4 a CO2.
92
Metabolismo dell’Alotano
E’ un’anestetico per inalazione eliminato per espirazione (80% della dose) e 20% dal
CYP2E1 e CYP2B4.
• Dealogenazione ossidativa ⇒ formazione di cloruro di trifluoroacetile ⇒ addotti
proteici ⇒ formazione di neoantigeni ⇒ epatite immuno-mediata nell’uomo (e nella
cavia) da autoanticorpi ad un’esposizione successiva.
• Dealogenazione riduttiva ⇒ radicale ⇒ perossidazione ⇒epatotossicità diretta, con
severità specie-dipendente (severa nel ratto, lieve nella cavia)
• Rara, si manifesta dopo esposizione ripetuta. Sensibilizzazione crociata con enflurano
e forse altri anestetici alogenati ⇒ l’enflurano causa epatotossicità in soggetti
precedentemente esposti ad alotano
93
94
Deaminazione ossidativa
•
E’ la stessa reazione catalizzata dalle MAO
•
Nell’uomo, esistono 60 o più enzimi CYP450, che differiscono, parzialmente, per
specificità, induttori, inibitori. Membri della stessa sotto-famiglia possono avere omologia
di sequenza fino al 97%.
95
Nell’uomo la variabilità inter-individuale è molto marcata.
Negli animali da esperimento ci sono anche forti differenze legate al ceppo ⇒ tossicità
ceppo-specifica.
Valutazione delle interazioni farmaco-farmaco: saggi in vitro
Durante le ultime fasi dello sviluppo di un nuovo farmaco, è importante conoscere le
interazioni che esso può avere con altri farmaci visto che la politerapia è comune nella
pratica clinica.
Si procede effettuando saggi in vitro su diversi campioni di microsomi epatici umani (n=50
individui, per avere rappresentazione più corretta della variabilità interindividuale). Si
misura l’attività metabolizzante della nostra nuova molecola di farmaco in presenza di
substrati modello che sono specifici per le varie isoforme del CYP.
Dopo incubazione del nuovo farmaco + microsomi + substrato di riferimento, si misura la
conc. del substrato di riferimento opportunamente marcato mediante spectroscopia di
massa tandem. I risultati ci permettono di stabilire se il nuovo farmaco è un’induttore o
inibitore di quello specifico CYP e se vi sono interazioni tra farmaci.
96
•
Ciascun enzima è caratterizzato dai substrati metabolizzati, dagli induttori ed
inibitori.
•
Tuttavia, data la scarsa specificità dei diversi enzimi,
2 o più enzimi possono
partecipare al metabolismo di un singolo xenobiotico.
•
Isoforme diverse (es. CYP2A1 e CYP3A4) possono metabolizzare lo stesso substrato.
97
In molti casi predomina il metabolismo operato da una forma enzimatica.
Il contributo delle varie isoforme dipende dai valori di Km e Vmax.
CYP e metabolismo dei farmaci
•
Scarsa selettività ⇒ in vitro un farmaco può essere metabolizzato da più CYP
•
Tuttavia, gli studi su individui con fenotipo ‘cattivo metabolizzatore’ per un
determinato CYP hanno mostrato che per molti farmaci in vivo il metabolismo è
catalizzato in modo predominante da un solo enzima, che controlla quindi la velocità di
eliminazione.
•
Ciò è dovuto alle diverse Km e Vmax dei vari enzimi
98
Variabilità del CYP450
99
Farmacogenetica
La farmacogenetica studia le variazioni inter-individuali nella sequenza del DNA in
relazione alla risposta ai farmaci. L'applicazione pratica delle conoscenze, provenienti
dalla ricerca in farmacogenetica, consiste nella possibilità di predire la risposta di un
paziente ad un certo farmaco sulla base di un test genetico di routine, per arrivare ad
un’individualizzazione della terapia, "il farmaco giusto al paziente giusto".
I test del DNA, basati su queste variazioni genetiche, possono predire come un paziente
risponderà a quel particolare farmaco.
I clinici potranno utilizzare questa informazione per decidere la terapia ottimale e per
personalizzare il dosaggio; i benefici consisteranno in una ridotta incidenza di reazioni
avverse, in migliori esiti clinici ed in costi ridotti per il sistema sanitario nazionale. Questi
test rappresentano il primo passo verso terapie paziente-specifiche.
Profilo genetico e variabilita della risposta
Un farmaco, quando entra nell’organismo, si distribuisce al suo interno e a questo punto
può essere metabolizzato, attivato, coniugato (cioè legato ad altre molecole) e infine
escreto.
Si supponga, per esempio, che un certo farmaco, per avere effetto, abbia bisogno di
essere metabolizzato e poi trasportato, tramite un recettore, all’interno della cellula. Si
supponga inoltre che, semplificando un processo molto più complesso, metabolismo e
trasporto siano controllati uno stesso gene che può essere polimorfico. In questo caso la
variabilità di risposta sarà determinata dalle diverse varianti di questo gene.
Si potranno avere individui:
A) con entrambi gli alleli normali (indicati come wt/wt = wild type, selvatico):
metabolizzano rapidamente e hanno una concentrazione media di farmaco nel sangue
piuttosto bassa
B) con un allele mutato e sono quindi eterozigoti (wt/m), metabolizzano più lentamente e
hanno una concentrazione plasmatica di farmaco più alta
C) con entrambi gli alleli mutati (m/m) e hanno concentrazioni elevate di farmaco nel
plasma
D) con copie multiple del gene nella sua forma normale, metabolizzano molto rapidamente
e hanno concentrazioni plasmatiche bassissime del farmaco per cui c’è assenza di effetto
farmacologico.
100
Classificazione dei soggetti
Si possono avere, in generale, 4 fenotipi:
• Metabolizzatori lenti (PMs): soggetti omozigoti per l’allele che codifica per un enzima
inattivo o a bassa attività.
• Metabolizzatori intermedi (IMs): soggetti eterozigoti per un allele che provocano una
ridotta attività dell’enzima; osservabile solo se nessuno dei due alleli è dominante
• Metabolizzatori estensivi (EMs): soggetti omozigoti per l’allele che codifica per
l’enzima con attività normale.
• Metabolizzatori ultrarapidi (UMs): soggetti che presentano copie multiple di un gene
(dominante ereditario)
Fattori genetici possono influenzano l’effetto dei farmaci: enzimi farmaco metabolizzanti,
trasportatori dei farmaci, recettori, canali ionici.
L’alterazione genetica che determina un’alterata risposta al farmaco generalmente rimane
stabile all’interno di un individuo per tutta la vita
Polimorfismi di CYP450 ed effetti avversi ai farmaci
Le forme polimorfiche di CYP450 sono responsabili dello sviluppo di un numero
significativo di reazioni avverse ai farmaci.
Il 59% dei farmaci più citati in studi che esaminavano reazioni avverse erano
metabolizzati da enzimi polimorfici di fase I.
Il 44% dei farmaci che danno reazioni avverse sono metabolizzati da un enzima con una
variante allelica responsabile di dar luogo a metabolismo lento.
Phillips et al. (2001) J. Am. Med. Assoc. 286, 2270–2279
Farmacogenetica CYP e successo farmacoterapeutico
• A causa del polimorfismo il numero dei “non-responders” ad una terapia farmacologica
è alto e sembra rappresenti il 30-60% dei soggetti trattati con farmaci.
• La variabilità individuale nella risposta al trattamento farmacologico costituisce uno
degli aspetti più rilevanti nella pratica clinica essendo responsabile di fallimenti
terapeutici e di reazioni avverse che a loro volta, oltre a danneggiare il paziente,
possono causare ricoveri prolungati e aumento dei costi sanitari.
101
102
Polimorfismo del CYP2D6
(polimorfismo di idrossilazione della debrisochina)
•
•
Il primo indizio derivò dall’osservazione che le concentrazioni plasmatiche di alcuni
antidepressivi triciclici presentavano una variabilità interindividuale di più di 30
volte, a parità di dose/kg somministrata. Inoltre, alcuni pazienti sembravano
appartenere ad una popolazione distinta, dal punto di vista farmacocinetico.
Successivamente, si osservò che una certa percentuale di individui aveva una
deficienza nel metabolismo ossidativo della debrisochina (un anti-ipertensivo simile alla
guanetidina). Queste due reazioni enzimatiche sono catalizzate dal CYP2D6, che
catalizza anche l’ossidazione di alcuni antidepressivi triciclici.
Il CYP2D6 presenta numerose varianti (polimorfismi); attualmente ne sono state
identificate almeno 68, e alcune di queste codificano per enzimi che possiedono una
differente velocità di metabolizzazione dei substrati o addirittura causano una
alterazione nel normale riconoscimento del substrato specifico.
Nel contesto del trattamento, queste variazioni possono influenzare la corretta
determinazione della dose iniziale di molti farmaci.
Per i farmaci con un ristretto profilo terapeutico e con curva dose-risposta ripida, questo
deficit può dare luogo sia ad un’overdosaggio che ad un’incapacità di mantenere l'efficacia
terapeutica.
Possedere entrambi le forme del gene che conferisce scarsa velocità di metabolizzazione
all’enzima fa sì che quell’individuo tenderà ad accumulare o ad eliminare più lentamente i
substrati o i farmaci che sono maggiormente metabolizzati da questo enzima. Questi
metabolizzatori lenti o poveri avranno una maggiore concentrazione a livello ematico del
farmaco e generalmente un maggior effetto, a parità di dosaggio, rispetto ad individui che
possiedono le forme dell’enzima cosiddette normali.
I metabolizzatori lenti sono più frequentemente esposti ad effetti indesiderati se
trattati con dosi standard di questi composti.
Tipici esempi comprendono l’acidosi lattica da fenformina e gli effetti dose-dipendenti da
antidepressivi triciclici e antipsicotici. Tuttavia, l’equazione forma lenta del CYP = effetti
avversi non è sempre applicabile. Diversi farmaci come la fluoxetina, il metoprololo o il
naproxene possono essere metabolizzati da diversi tipi di CYP.
Avendo quindi a disposizione diverse vie metaboliche, cioè diversi CYP, per lo stesso
farmaco non è detto che siano tutte inefficienti e fattori non strettamente metabolici
come altre malattie o interazioni farmaco-farmaco possono spiegare l’insorgenza delle
reazioni avverse ai farmaci (ADR).
103
CYP 2D6
Poiché molti farmaci psicotropi hanno un ristretto profilo terapeutico e le reazioni
avverse sono comuni, il fatto di poter predeterminare i livelli d’attività del 2D6 per i
pazienti trattati con i suddetti agenti può avere un beneficio clinico significativo.
Es. la nortriptilina viene somministrata alla maggior parte dei pazienti in un range di 75150 mg. Ma nei metabolizzatori poveri di CYP2D6, l'effettiva dose tollerabile è 10-20
mg.
Nei metabolizzatori ultrarapidi, la variazione genetica dà origine a copie multiple del
gene. I pazienti con quest’amplificazione genetica metabolizzano il farmaco così
velocemente, che possono richiedere una dose di 500 mg, per ottenere l'effetto
terapeutico.
Si dovrebbe tuttavia tenere presente che molti farmaci che subiscono la
biotrasformazione da parte del 2D6, particolarmente gli antidepressivi, producono
metaboliti attivi, e ciò tende a complicare l'interpretazione della relazione
efficacia/tossicità.
Determinazione del dosaggio per pazienti in trattamento con nortriptilina
•
•
•
La capacità metabolizzante individuale di nortriptilina si misura in base al rapporto tra
le concentrazioni urinarie della debrisochina (non metabolizzato) e della 4idrossidebrisochina (metabolita) dopo somministrazione di una singola dose. Questo
rapporto è detto rapporto metabolico.
In base a questo rapporto, una percentuale di individui pari al 5-10% (nei caucasici) è
composta da ‘cattivi metabolizzatori’.
Il polimorfismo del CYP2D6 presenta notevoli variazioni interetniche. In particolare,
negli asiatici la percentuale di cattivi metabolizzatori è pari all’1%; inoltre, i buoni
metabolizzatori asiatici hanno una capacità metabolica inferiore a quelle dei buoni
metabolizzatori caucasici. Le popolazioni nere differiscono sia dai caucasici sia dagli
asiatici.
104
105
106
I polimorfismi che determinano gli alleli CYP2D6*3, CYP2D6*4, CYP2D6*5, CYP2D6*6 si
riscontrano nel 97% dei metabolizzatori lenti.
L’allele più comune è il CYP2D6*4 (21.5-28.6%), segue il CYP2D6*3 (2.7%) e il CYP2D6*5
(2.6%).
Altri
alleli
(CYP2D6*6,
CYP2D6*7,
CYP2D6*8,
CYP2D6*11,
CYP2D6*12,
CYP2D6*14, CYP2D6*20, CYP2D6*31, CYP2D6*38, CYP2D6*44), sebbene rari, sono
anch’essi associati ad un’assenza di attivita’ enzimatica.
107












