Cenni di nomenclatura dei Composti Inorganici
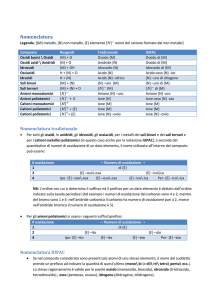
Ioni Positivi (cationi)
Gli ioni monoatomici positivi, prendono il nome del corrispondente metallo da cui derivano, specificando se necessario il
rispettivo stato di ossidazione
o con un numero romano tra parentesi(modo recentemente
proposto; notazione di Stock).
o aggiungendo il suffisso oso (grado di ossidazione più
basso) o ico (grado di ossidazione più alto)
•
•
esempi:
Cu2+
Cu+
Fe3+
Fe2+
Na+
Ca2+
Zn2+
Nuova
Nomenclatura
Ione
Ione
Ione
Ione
Ione
Ione
Ione
Nomenclatura
Tradizionale
rame (II)
rame (I)
ferro (III)
ferro (II)
sodio
calcio
zinco
Ione
Ione
Ione
Ione
Ione
Ione
Ione
rameico
rameoso
ferrico
ferroso
sodio
calcio
zinco
Gli ioni poliatomici, assumono la desinenza onio aggiunta al
nome dell’elemento legato all’idrogeno
fà eccezione
H3O+
PH4+
Ione ossonio
Ione fosfonio
NH4+
Ione ammonio
Ioni Negativi (anioni)
Gli ioni monoatomici negativi, prendono il nome dell’ elemento
da cui derivano, aggiungendo la desinenza uro.
HBrFS2-
Ione
Ione
Ione
Ione
idruro
bromuro
fluoruro
solfuro
La stessa desinenza (uro) é anche utilizzata per alcuni anioni
poliatomici
O3Ione ozonuro
CNIone cianuro
mentre i seguenti ioni vengono chiamati:
OHO2-
Ione idrossido
(vecchia denominazione ossidrile)
Ione perossido
Composti binari
I nomi dei composti binari (formati cioè da due sole specie
atomiche) si formano dando la desinenza uro alla radice del nome
dell’elemento più elettronegativo (con eccezione dell’ossigeno i cui
composti vengono chiamati ossidi anziché ossigenuri). Il nome
dell’elemento “meno elettronegativo” (che compare per 1° nella
formula molecolare) non subisce mutamenti.
NaCl
KI
NaF
LiH
AlN
H2S
SiC
CaO
CO2
GaAs
Cloruro di sodio
Ioduro di potassio
Floruro di sodio
Idruro di litio
Nitruro di alluminio
Solfuro di idrogeno
Carburo di silicio
ossido di calcio
diossido (o biossido) di carbonio
arseniuro di gallio
a volte e se necessario il numero di atomi di ciascuna specie é
precisato dai prefissi: di, tri, tetra, penta, (mono spesso si
omette; inoltre spesso si omettono anche i prefissi quando la
valenza dell’elemento è una sola)
OF2
CaCl2
CS2
Fe2O3
difloruro
dicloruro
disolfuro
triossido
di
di
di
di
ossigeno (floruro di ossigeno)
calcio (cloruro di calcio)
carbonio (solfuro di carbonio)
diferro
Quando è possibile per combinazione di due specie atomiche la
formazione di più composti,un altro modo proposto, è quello di
precisare il grado di ossidazione dell’elemento meno elettronegativo
con un numero romano tra parentesi (notazione di Stock).
esempi:
FeCl2
FeCl3
FeO
Fe2O3
N2O5
cloruro di ferro (II)
cloruro di ferro (III)
ossido di ferro (II)
ossido di ferro (III)
ossido di azoto (V)
Per gli ossidi dei non metalli, è ancora molto diffusa la
vecchia terminologia di anidride. In questo caso si aggiunge al nome
dell’elemento trasformato in aggettivo, la desinenza i c a se è
possibile un solo stato di ossidazione, oppure la desinenza ica o
osa se occorre distinguere tra due possibili stati di ossidazione
(rispettivamente maggiore e minore).
CO2
CO
SO3
SO2
anidride
anidride
anidride
anidride
carbonica
carboniosa
solforica
solforosa
2
Secondo la nomenclatura tradizionale, le stesse desinenze (ico e
oso) vengono anche utilizzate per identificare composti binari in
cui il metallo presenta due possibili stati di ossidazione:
FeCl3
FeCl2
CuCl2
CuCl
cloruro
cloruro
cloruro
cloruro
ferrico
ferroso
rameico
rameoso
Altre regole per la corretta definizione della nomenclatura di
composti inorganici (Commissione per la nomenclatura dei composti
inorganici, IUPAC 1957):
•
Nelle formule, il costituente elettropositivo deve essere posto
per primo, per esempio:
KCl,
CaSO4,
Al(NO3)3
•
Nel caso di composti binari tra non metalli, secondo la pratica
corrente, deve essere posto per primo il costituente che precede
nella serie:
B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F.
H
H
B
C
Si
N
N
NP
N
As
O
N
NS
N
Se
F
NO
N
NCl
NN
N
Br
Sb
Te
I
At
perciò:
NH3
e non H3N
CH4
e non H4C
3
Oltre agli ossidi, particolarmente importanti, tra i composti
binari, sono gli idracidi (composti formati dall’idrogeno con
elementi non metallici del VI e VII gruppo), i quali essendo
caratterizzati da un legame covalente fortemente polarizzato si
comportano in acqua come acidi. Sulla base della nomenclatura
tradizionale, essi sono anche indicati aggiungendo la desinenza
idrico, alla radice del nome dell’elemento non metallico.
Nuova
Nomenclatura
HCl
HBr
HF
H2S
HCN
Nomenclatura
Tradizionale
cloruro di idrogeno
bromuro di idrogeno
fluoruro di idrogeno
sulfuro di idrogeno
cianuro di idrogeno
acido
acido
acido
acido
acido
cloridrico
bromidrico
fluoridrico
solfidrico
cianidrico
Composti ternari
Considereremo per semplicità tre classi di composti:
•
•
•
Idrossidi
Idrossidi
Acidi ossigenati (o ossiacidi)
Sali
Sono composti formati da un catione metallico e da uno
o più gruppi OH- che ne neutralizzano la carica.
Vengono designati con il nome idrossido, a cui è fatto seguire
il nome del catione metallico, specificando se necessario, lo stato
di ossidazione del metallo.
Nuova
Nomenclatura
NaOH
Mg(OH)2
Fe(OH)3
Fe(OH)2
idrossido
idrossido
idrossido
idrossido
di
di
di
di
Nomenclatura
Tradizionale
sodio
magnesio
ferro(III)
ferro(II)
4
idrossido
idrossido
idrossido
idrossido
di sodio
di magnesio
ferrico
ferroso
Ossoacidi
Formati da un atomo di un elemento non metallico
legato con legami covalenti ad uno o più gruppi OH
e ad eventuali atomi di ossigeno.
La nomenclatura degli ossoacidi si costruisce aggiungendo alla
radice dell’elemento non metallico la desinenza ico, e precisando,
se occorre, lo stato di ossidazione del non metallo e il numero
degli atomi di ossigeno (Nuova nomenclatura):
Nuova
Nomenclatura
HNO3
HNO2
H2SO4
H2SO3
acido
acido
acido
acido
Nomenclatura
Tradizionale
triossonitrico(V)
diossonitrico(III)
tetraossosolforico(VI)
triossosolforico(IV)
acido
acido
acido
acido
nitrico
nitroso
solforico
solforoso
Risulta però ancora maggiormente utilizzata la
vecchia
nomenclatura, la quale attribuisce la desinenza ico all’acido in cui
il non metallo ha numero di ossidazione più alto, e la desinenza oso
per l’acido nel quale il non metallo ha numero di ossidazione più
basso. Nel caso in cui il non metallo abbia più di due stati di
ossidazione, si aggiungono inoltre i prefissi p e r (stato di
ossidazione più alto) e ipo (stato di ossidazione più basso).
Nuova
Nomenclatura
HClO4
HClO3
HClO2
HClO
acido
acido
acido
acido
Nomenclatura
Tradizionale
tetraossoclorico(VII)
triossoclorico(V)
diossoclorico(III)
monossoclorico(I)
acido
acido
acido
acido
perclorico
clorico
cloroso
ipocloroso
Ossoanioni e relativi sali
Nuova Nomenclatura
Per indicare il nome dell’ossoanione secondo la nuova
nomenclatura, si sostituisce la desinenza ico (dell’ossiacido) con
la desinenza ato, precisando se occorre, lo stato di ossidazione del
non metallo e il numero di atomi di ossigeno presenti.
Nomenclatura tradizionale
Alla radice dell’elemento non metallico, si aggiunge la
desinenza ato quando il non metallo ha lo stato di ossidazione più
alto, e la desinenza ito per lo stato di ossidazione più basso. Nel
caso in cui il non metallo formi più di due ossoanioni, si
aggiungono inoltre i prefissi per (stato di ossidazione più alto) e
ipo (stato di ossidazione più basso).
SO42SO32-
Nuova
Nomenclatura
Nomenclatura
Tradizionale
ione tetraossosolfato(VI)
ione triossosolfato(IV)
ione solfato
ione solfito
5
altri esempi:
NO3NO2-
ione triossonitrato(V)
ione diossonitrato(III)
ione nitrato
ione nitrito
ClO4ClO3ClO2ClO-
ione
ione
ione
ione
ione
ione
ione
ione
tetraossoclorato(VII)
triossoclorato(V)
diossoclorato(III)
monossoclorato(I)
perclorato
clorato
clorito
ipoclorito
Elenco riassuntivo dei nomi tradizionali degli anioni e dei
rispettivi acidi ammessi dalla IUPAC
Ione
BO33*CO32SiO44*NO2*NO3*PO43*SO32*SO42ClOClO2ClO3ClO4CrO42*Cr2O72MnO42*MnO4-
Acido
Borato
Carbonato
(Orto)silicato
Nitrito
Nitrato
(Orto)fosfato
Solfito
Solfato
Ipoclorito
Clorito
Clorato
Perclorato
Cromato
bicromato
Manganato
Permanganato
H3BO3
H2CO3
H4SiO4
HNO2
HNO3
H3PO4
H2SO3
H2SO4
HClO
HClO2
HClO3
HClO4
H2CrO4
H2Cr2O7
H2MnO4
HMnO4
Borico
Carbonico
(Orto)silicico
Nitroso
Nitrico
(Orto)fosforico
Solforoso
Solforico
Ipocloroso
Cloroso
Clorico
Perclorico
Cromico
bicromico
Manganico
Permanganico
* data l’importanza di questi ioni e acidi, si RACCOMANDA di ricordare almeno
questi
6
Sali degli ossoacidi
La nomenclatura dei sali deriva dal nome del corrispondente
ossoanione seguito dal nome del catione metallico:
Nuova
Nomenclatura
Nomenclatura
Tradizionale
CaSO4
CaSO3
tetraossosolfato di calcio
triossosolfato di calcio
solfato di calcio
solfito di calcio
Na2SO4
tetraossosolfato di sodio
solfato di sodio
NaNO3
NaNO2
triossonitrato di sodio
diossonitrato di sodio
nitrato di sodio
nitrito di sodio
Na2CO3
triossocarbonato di sodio
carbonato di sodio
I sali nella cui formula sono presenti atomi di idrogeno vengono
designati facendo precedere al nome dell’anione il termine idrogeno
(o di-idrogeno o tri-idrogeno ecc. a seconda del numero di atomi di
idrogeno presenti).
NaHCO3
idrogeno carbonato di sodio
idrogeno triossocarbonato di sodio
( bicarbonato di sodio )
KHSO4
idrogeno solfato di potassio
idrogeno tetraossosolfato di potassio
( bisolfato di potassio )
NaH2PO4
di-idrogeno fosfato di sodio
7