Appunti di
chimica
generale e
inorganica
2016
Struttura atomica.
Tavola periodica degli elementi.
Acidi, Basi e Sali.
Reazioni di ossido riduzione.
Proprietà delle soluzioni.
pH e soluzioni tampone.
Cenni di termodinamica chimica (1° e 2° principio della Termodinamica).
Costituenti inorganici: acqua e oligoelementi
APPUNTI DI CHIMICA GENERALE E INORGANICA
Atomo: generalità, proprietà e definizione
L'atomo è la più piccola parte di un elemento chimico che conserva le proprietà chimiche dell'elemento
stesso.
L'atomo è formato da elettroni (particelle cariche negativamente) che si muovono attorno a un nucleo
composto (in uno schema molto semplificato) da protoni (particelle cariche positivamente) e neutroni
(particelle senza carica).
Nel nucleo è quasi del tutto concentrata la massa dell'atomo.
Gli atomi sono particelle piccolissime, il loro diametro si misura in Angstrom Å (1Å=10-10m).
Il numero di protoni di un atomo corrisponde al numero atomico, mentre la somma tra numero di protoni
e numero di neutroni corrisponde al numero di massa.
Gli elettroni esterni al nucleo, sono numericamente uguali al numero di protoni.
Le sostanze semplici, o elementi, sono costituiti da atomi della stessa specie;
le sostanza composte, o composti, da atomi di specie diverse, ma sempre in rapporti numerici ben definiti e
generalmente semplici.
Più atomi legati tra loro formano le molecole.
Il peso atomico (o massa atomica o unità di massa atomica) indica la massa di un atomo di un dato
elemento, mentre il peso molecolare indica la massa della molecola (somma dei pesi atomici degli elementi
che compongono la molecola.)
Gli atomi sono generalmente elettricamente neutri.
Un atomo carico (negativamente o positivamente) è definito ione.
Atomo e modelli atomici
Il primo (1904) fu il modello atomico proposto da J.J. Thomson. Il secondo (1911) è il modello atomico
proposto da E. Rutherford.
N. Bohr nel 1913 formulò il suo modello atomico noto come modello atomico di Bohr. Via via questi modelli
si sono ulteriormente raffinati per tener conto di nuove scoperte, portando all'attuale concezione della
struttura atomica rappresentata dal modello atomico a orbitali.
1
APPUNTI DI CHIMICA GENERALE E INORGANICA
Orbitali
Definizione di orbitale e il modello atomico a orbitali
Il modello ondulatorio dell'elettrone consente di stabilire le zone dello spazio attorno al nucleo di un atomo
ove è massima la densità della carica elettrica negativa dovuta agli elettroni dell'atomo stesso.
Tale conoscenza è possibile grazie alla equazione di E. Schrodinger (premio Nobel nel 1933), che
rappresenta, in tre dimensioni, l'onda stazionaria associata ad un elettrone, dalla cui risoluzione si
ottengono funzioni (funzoni d'onda) rappresentabili graficamente che consentono di conoscere la
distribuzione della densità di carica elettrica negativa nello spazio attorno al nucleo.
Dunque, le soluzioni dell'equazione di Schrodinger, dette funzioni d'onda e indicate con la lettera Ψ (psi),
permettono di conoscere lo stato di un elettrone. Anche se la funzione Ψ, in realtà, non ha significato fisico
diretto, la funzione Ψ2, calcolata per una determinata porzione di spazio, fornisce la probabilità di trovare
l'elettrone in essa.
Mentre il modello atomico di Bohr considerava che gli elettroni si muovessero intorno al nucleo secondo
orbite circolari, il modello atomico di Schrodinger definisce le regioni dello spazio in cui il quadrato della
funzione d'onda raggiunge i valori più alti. Tali regioni furono chiamate orbitali. L'orbitale è quella zona in
cui è massima la probabilità di trovare l'elettrone.
Racchiudendo entro una superficie limitante tutti i punti per i quali l'elettrone ha la massima probabilità di
passare nel suo moto intorno al nucleo, si ottiene una figura geometrica, simmetrica rispetto al nucleo, che
dà un idea della "forma" dell'orbitale.
L'orbitale non è un contenitore all'interno del quale si muove l'elettrone, ma solo la zona in cui è
probabile trovarlo. A definire dimensione, forma e orientamento di un dato orbitale, concorrono i numeri
quantici.
Siccome è dalla ricopertura di queste zone di massima densità elettronica che prendono origine i legami
chimici fra gli atomi, la conoscenza del numero, delle forme e dell'orientamento di tali zone nei vari atomi è
di fondamentale importanza per interpretare e prevedere struttura e proprietà delle specie chimiche.
2
APPUNTI DI CHIMICA GENERALE E INORGANICA
Vedi http://www.ptable.com/
Andamento dell’elettronegatività
3
APPUNTI DI CHIMICA GENERALE E INORGANICA
La tavola periodica degli elementi
In natura esistono 92 elementi, un numero tanto elevato da rendere necessario organizzarli nella tavola
periodica in base al numero atomico Z crescente e in un ordine che permette di riconoscere le proprietà dei
diversi atomi, che sono dette periodiche, perché si ripetono con regolarità a seconda della posizione
occupata.
Se analizziamo, infatti, la tavola periodica, individuiamo:
7 file orizzontali, chiamate periodi
18 colonne verticali, chiamate gruppi
2 file separate per lantanoidi e attinoidi.
Gli elementi di uno stesso gruppo presentano un comportamento chimico simile, che risulta diverso,
invece, tra gli elementi dello stesso periodo.
I non metalli sono disposti in alto a destra della tavola periodica, colorati in verde. Ai non metalli
appartiene anche l’idrogeno. (H, C,N,O, P,S, Se)
i semimetalli (o metalloidi) lungo la linea spezzata di colore nero a destra, colorati in verde (B, Si, As, Te,
At).
Al 17° gruppo appartengono gli alogeni (Cl, F, Br, I)
Al 18° gruppo appartengono i gas nobili
A tutti gli altri gruppi appartengono i metalli, a loro volta suddivisi in diverse sottoclassi.
Consulta anche Tavola periodica dinamica: http://www.ptable.com/
I gruppi che rivestono un’importanza particolare sono i seguenti:
gruppo 1 (I): dei metalli alcalini (escluso l’idrogeno H)
gruppo 2 (II): dei metalli alcalino-terrosi
gruppo 16 (VI): degli elementi calcogeni (comunemente indicato come gruppo dell’Ossigeno)
gruppo 17 (VII): degli alogeni
gruppo 18 (VIII): dei gas rari o gas nobili
I metalli di transizione sono posti nella parte centrale della tavola periodica:
L’importanza della tavola periodica è legata, soprattutto, alla possibilità di raggruppare i diversi elementi
chimici secondo proprietà fi siche e chimiche, che rivelano un andamento periodico.
Le proprietà fisiche sono:
i raggi atomici e i raggi ionici
l’energia di ionizzazione
l’affinità elettronica
l’elettronegatività
il carattere metallico
4
APPUNTI DI CHIMICA GENERALE E INORGANICA
la temperatura di fusione
la temperatura di ebollizione il numero di ossidazione
Le proprietà chimiche sono:
la reattività
la stabilità di composti
il tipo di legame
Valenza e numero di ossidazione
La valenza può essere definita come il numero di elettroni che un atomo di un elemento acquista, cede o
mette in comune quando si lega con atomi di altri elementi.
Nei composti ionici il concetto di valenza coincide con quello di elettrovalenza: a ogni singola carica
elettrica positiva o negativa portata da uno ione corrisponde una effettiva possibilità di realizzare un
legame ionico. Per esempio, lo ione calcio, Ca2+ è bivalente positivo perché, avendo perso due elettroni,
possiede due cariche positive e può formare due legami ionici con altri ioni negativi, per esempio con lo
ione ossido, O2−, bivalente negativo, dando luogo all'ossido di calcio, CaO.
Nei composti covalenti, formati da molecole, la valenza di un elemento, detta in questo caso covalenza, è
data dal numero di elettroni che può mettere in compartecipazione. Per esempio, l'idrogeno H mette in
compartecipazione un elettrone ed è monovalente, l'ossigeno O mette in compartecipazione un elettrone
con ciascun atomo di idrogeno ed è bivalente; tuttavia, non possiamo parlare di cariche positive o negative
come nel caso dei composti ionici.
Per questo motivo si è trovato più comodo introdurre il concetto di numero di ossidazione (n.o.), che
rappresenta la carica formale che si può attribuire a un elemento in un composto, supponendo che tutti i
legami siano di tipo ionico, in modo da assegnare gli elettroni di legame all'atomo più elettronegativo . Il
numero di ossidazione, che nel caso degli ioni corrisponde alla carica ionica, può assumere, a differenza
della valenza, valori positivi e negativi, ma anche il valore zero.
Alcuni elementi possono presentare due o più numeri di ossidazione e in questi casi la nomenclatura segue
opportuni criteri per distinguerli. Per esempio: il ferro può formare gli ioni Fe2+ e Fe3+: Fe2+ è chiamato
nella nomenclatura tradizionale ione ferroso, Fe3+ è chiamato ione ferrico (cambia cioè la desinenza finale
della radice del nome dell'elemento).
Il numero di ossidazione si esprime anche mediante la notazione di Stock usando numeri romani tra
parentesi di seguito al nome dell'elemento; per esempio Fe2+ si indica come ione Fe (II) o ione ferro (II),
Fe3+ si indica come ione Fe (III) o ione ferro (III).
Il numero d’ossidazione viene stabilito in base a criteri fondati sui valori relativi di elettronegatività delle
specie atomiche che entrano nella composizione delle molecole e si può calcolare tenendo conto di 7
regole.
•
Gli atomi nelle sostanze allo stato elementare (cioè non legati con atomi diversi), siano esse mono-,
bi-, o poliatomiche, hanno n.o. zero (per esempio, He, Ca, O2, Cl2, P4).
•
L'ossigeno nei composti ha n.o. = −2. Fanno eccezione i perossidi (per esempio, H2O2) dove
l'ossigeno ha n.o. = −1.
5
APPUNTI DI CHIMICA GENERALE E INORGANICA
•
L'idrogeno nei composti ha n.o. = +1. Fanno eccezione gli idruri metallici (per esempio, LiH, CaH2)
nei quali l'idrogeno assume n.o. = −1.
•
Il fluoro in tutti i composti ha n.o. = −1.
•
Gli ioni degli elementi del sottogruppo I A (metalli alcalini) hanno n.o. = +1, che coincide con la loro
carica effettiva (per esempio, Li+, Na+).
•
Gli ioni degli elementi del sottogruppo II A (metalli alcalinoterrosi) hanno n.o. = +2, che coincide con
la loro carica effettiva (per esempio, Mg2+, Ca2+).
•
Il numero di ossidazione di altri elementi presenti in un composto si calcola ricordando che la
somma algebrica dei n.o. di tutti gli atomi in una molecola deve essere zero, oppure, se si tratta di
uno ione, deve essere uguale alla sua carica.
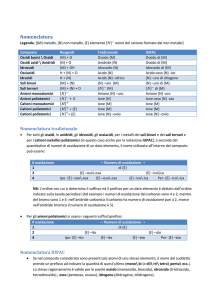
La nomenclatura dei composti chimici
Gli elementi chimici possono essere classificati in due grosse categorie:
- metalli
- non metalli
I metalli danno luogo a una serie basica di composti, mentre i non metalli danno luogo a una serie acida.
Ovvero:
Serie basica:
Metallo + O2 → Ossido (basico);
Ossido (basico) + H2O → Idrossido (base)
Serie acida:
Non metallo + O2 → Anidride (ossido acido);
Anidride + H2O → Acido (ossiacido)
I sali (che possono essere sali binari o sali ternari) sono ottenuti generalmente facendo reagire un
composto della serie acida con un composto della serie basica.
Nomenclatura chimica tradizionale e nomenclatura IUPAC
La nomenclatura tradizionale si basa sull’uso di determinati prefissi e suffissi.
La nomenclatura IUPAC invece utilizza opportuni prefissi moltiplicativi allo scopo di evidenziare il numero
di atomi o raggruppamenti di atomi presenti in una molecola. I prefissi moltiplicativi sono i seguenti:
1 - mono
2 - di
3 - tri
4 - tetra
5 - penta
6 - esa
7 - epta
8 - octa
6
APPUNTI DI CHIMICA GENERALE E INORGANICA
Regole per la costruzione dei composti binari
I composti binari sono composti formati da due soli elementi chimici. Per convenzione, l'elemento con
elettronegatività minore (e quindi con il numero di ossidazione positivo) viene scritto per primo e
l'elemento più elettronegativo (con numero di ossidazione negativo) per secondo. Vi sono comunque
eccezioni a tale regola di cui diremo nei singoli casi.
Il simbolo di ciascun elemento chimico è seguito da un numero a pedice, detto indice, che indica quanti
atomi di quell'elemento sono presenti nel composto. Gli indici sono apposti in modo tale che, sommando i
rispettivi numeri di ossidazione, la molecola risulti neutra.
Per calcolare gli indici in modo semplice è sufficiente utilizzare il numero di ossidazione del primo elemento
come indice del secondo e viceversa. Ad esempio se volessimo scrivere la formula chimica di un composto
binario formato da un elemento A il cui numero di ossidazione sia +2 e da un composto B il cui numero di
ossidazione sia -3, avremo:
Si noti che l'elemento con il numero di ossidazione positivo (il meno elettronegativo) è stato scritto per
primo. Tale metodo di costruzione dei composti binari è detto "Regola dell'incrocio" e garantisce la
neutralità della molecola. Infatti nella molecola sono presenti complessivamente 3 atomi di A (= 6 cariche
positive) e 2 atomi di B (= 6 cariche negative). Se dopo aver calcolato gli indici questi risultino divisibili per
uno stesso numero, gli indici vanno semplificati.
Per esempio da un elemento X con numero di ossidazione +4 e un elemento Y con numero di ossidazione 2, avremo il seguente composto binario:
A questa regola fanno eccezione alcuni composti, come ad esempio l'acqua ossigenata (perossido di
idrogeno, appartenente alla famiglia dei perossidi), H2O2, in cui gli indici non vanno semplificati.
Ossidi e anidridi
Nomenclatura di ossidi (ossidi basici)
Un ossido basico è un composto binario costituito da ossigeno (con numero di ossidazione -2) e da un
metallo.
La reazione di formazione di un ossido può essere pertanto così rappresentata:
Metallo + Ossigeno → Ossido
Applicando la "Regola dell'incrocio" risulta che la formula generale di un ossido è Me2On in cui:
Me = simbolo chimico del metallo;
n = numero di ossidazione del metallo.
La nomenclatura tradizionale prevede:
Se il metallo ha un solo numero di ossidazione il composto si chiamerà “Ossido di” seguito dal nome del
metallo.
7
APPUNTI DI CHIMICA GENERALE E INORGANICA
Se il metallo presenta due numeri di ossidazione forma con l'ossigeno due ossidi diversi. Nell'ossido a
numero di ossidazione maggiore il metallo prende il suffisso -ico, in quello a numero di ossidazione minore
prende il suffisso -oso.
Nomenclatura di anidridi (ossidi acidi)
Una ossido acido è un composto binario costituito da ossigeno (con numero di ossidazione -2) e da un nonmetallo.
Non metallo + O2 → ossido acido
Applicando la "Regola dell'incrocio" risulta che la formula generale di un ossido acido è nMe2On in cui:
nMe = simbolo chimico del non-metallo;
n = numero di ossidazione del non-metallo.
La nomenclatura tradizionale prevede:
Se il non metallo presenta un unico numero di ossidazione il composto si chiamerà “Anidride” seguito dal
nome del non metallo con desinenza -ica.
Se il non metallo presenta due numeri di ossidazione può formare con l'ossigeno due anidridi diverse.
Nel composto a numero di ossidazione maggiore il non metallo prende il suffisso -ica, in quello a numero di
ossidazione minore prende il suffisso -osa.
Se il non metallo presenta quattro numeri di ossidazione può formare con l'ossigeno quattro anidridi
diverse.
Nel composto a numero di ossidazione maggiore il non metallo prende il prefisso per- e il suffisso –ica
Nel composto a numero di ossidazione minore il non-metallo prende il prefisso ipo- e il suffisso -osa.
Nei composti a numero di ossidazione intermedi, per il non-metallo si avranno il suffisso –ica (per il numero
di ossidazione più elevato dei due) ed -osa (per il numero di ossidazione meno elevato dei due).
l'unico non-metallo ad avere quattro numeri di ossidazione è il cloro.
8
APPUNTI DI CHIMICA GENERALE E INORGANICA
Analoga nomenclatura a quella del cloro vale per bromo, iodio e manganese, anche se tali elementi non
hanno quattro numeri di ossidazione.
9
APPUNTI DI CHIMICA GENERALE E INORGANICA
NOTA - Si conoscono anche i seguenti composti binari ossigenati:
N2O (protossido di azoto)
NO (ossido di azoto)
CO (ossido di carbonio)
MnO2 (biossido di manganese)
i quali però, non essendo basici nè acidi, non possono essere attribuiti ad alcuna delle due specie sopra
descritte.
Per l'azoto, esiste anche il composto NO2 (in cui N ha numero di ossidazione +4); tale composto viene
chiamato comunemente biossido di azoto, talvolta ipoazotide, o anche anidride nitrosa-nitrica, perchè, se
messo in acqua, si comporta come se fosse N2O3 (anidride nitrosa) e, insieme, come se fosse
N2O5 (anidride nitrica), infatti si può scrivere:
4NO2 → N2O3 + N2O5
Idruri e idracidi
Idruri sono i composti binari contenenti idrogeno a eccezione dei composti tra idrogeno e gli elementi del
VI o del VII gruppo, che prendono il nome di idracidi, perchè manifestano carattere acido.
Nomenclatura di idruri
In questi composti, l'idrogeno può assumere numero di ossidazione -1 o +1 a seconda dell'elemento a cui è
legato. In paticolare quando è legato con elementi aventi elettronegatività maggiore, assume numero di
ossidazione +1, mentre quando è legato ad atomi meno elettronegativi, assume numero di ossidazione -1.
Applicando la "Regola dell'incrocio" risulta che la formula generale di un idruro è XHn in cui:
10
APPUNTI DI CHIMICA GENERALE E INORGANICA
X = simbolo chimico dell'elemento legato all'idrogeno;
n = numero di ossidazione dell'elemento X.
La nomenclatura tradizionale prevede:
la denominazione "idruro di" seguito dal nome dell’elemento X.
* In realtà, essendo l’azoto più elettronegativo dell’idrogeno, il composto andrebbe scritto H3N (nitruro di
idrogeno), ma l’ammoniaca presenta comunque carattere basico e pertanto risulta opportuno non scrivere
gli idrogeni per primi, come avviene per gli idracidi.
Nomenclatura di idracidi
Gli idracidi sono i composti che l'idrogeno, sempre con numero di ossidazione +1, forma con elementi del VI
o el VII gruppo. L'idrogeno essendo il meno elettronegativo dei due elementi nella formula va scritto per
primo.
Applicando la "Regola dell'incrocio" risulta che la formula generale di un idracido è HnX in cui:
X = simbolo chimico dell'elemento del VI o del VII gruppo;
n = numero di ossidazione dell'elemento X.
La nomenclatura tradizionale prevede:
il termine "acido" seguito dal nome del non metallo terminante con il suffisso -idrico.
11
APPUNTI DI CHIMICA GENERALE E INORGANICA
Altri idracidi sono:
Idrossidi
Gli idrossidi si formano sommando una o più molecole d'acqua ad un ossido:
Ossido + nH2O → Idrossido
e hanno formula generale Me(OH)n in cui:
Me = simbolo chimico del metallo
n = numero di ossidazione del metallo.
In altre parole per la formula chimica di qualsiasi idrossido si ottiene scrivendo il simbolo del metallo Me e,
di seguito, un numero di gruppi OH pari al numero di ossidazione del metallo. Per esempio, dato l'alluminio
Al avente numero di ossidazione 3+, la formula del suo idrossido è: Al(OH)3.
Negli idrossidi è presente il gruppo OH-, che viene chiamato ossidrile e che si può pensare originato da una
molecola di acqua in seguito a perdita di uno ione H+.
Negli idrossidi la carica dello ione OH- viene annullata dalla carica del metallo.
12
APPUNTI DI CHIMICA GENERALE E INORGANICA
La nomenclatura tradizionale degli idrossidi prevede:
Se il metallo ha un solo un numero di ossidazione il composto si chiamerà “idrossido di” seguito dal nome
del metallo.
Se il metallo presenta due numeri di ossidazione può formare due idrossidi diversi. Nell'idrossido a
numero di ossidazione maggiore il metallo prenderà il suffisso -ico, in quello a numero di ossidazione
minore prenderà il suffisso -oso.
Acidi ternari o ossoacidi
Gli ossiacidi sono composti ternari costituiti da idrogeno, un non metallo e Ossigeno.
Se X è il simbolo del non metallo, la formula generale di un ossiacido è:
HaXbOc
in cui gli indici a, b, c sono numeri interi primi tra loro, cioè che non hanno alcun divisore comune. Gli
ossiacidi si formano sommando una o più molecole d'acqua ad un'anidride:
Anidride + nH2O → Ossiacido
Per trovare la formula chimica di un ossiacido si scrivono i due reagenti (anidride + H2O) a sinistra della
freccia e a destra della freccia i simboli chimici senza alcun indice della formula vista in precedenza: HaXbOc
Si contano gli atomi di ciascun elemento presenti nei reagenti, determinando in tal modo i valori degli indici
(a, b, c), che si attribuiscono ai rispettivi simboli chimici.
Per esempio, volendo scrivere la formula dell'ossiacido che si ottiene da anidride solforica SO3 e acqua
inizialmente scriveremo :
SO3 + H2O → HSO4
Ora bisogna contare gli atomi di ciascun elemento presenti nei reagenti, determinando in tal modo i
valorori degli indici (a, b, c), che si attribuiscono ai rispettivi simboli chimici nella formula HaXbOc:
in questo caso risulta:
13
APPUNTI DI CHIMICA GENERALE E INORGANICA
a = 2 (a sinistra della freccia ci sono in totale 2 atomi di idrogeno)
b = 1 (a sinistra della freccia è infatti presente un solo atomo di zolfo)
c = 4 (a sinistra della freccia sono infatti presente quattro atomi di ossigeno: 3 in SO3 e uno in H2O)
quindi risulta che la formula chimica dell'acido corrispondente è H2SO4. La reazione completa risulta
essere:
SO3 + H2O → H2SO4
Volendo invece scrivere la formula chimica dell'acido che si ottiene da anidride nitrica N2O5 e acqua,
scriveremo:
N2O5 + H2O → H2N2O6
i valori degli indici non sono numeri primi tra loro, ma sono tutti divisibili per due; quindi si ha che:
N2O5 + H2O → 2HNO3
da una molecola di anidride nitrica e una di acqua si ottengono due molecole di HNO3.
La nomenclatura tradizionale degli acidi ternari prevede:
il nome degli acidi si ottiene da quello dell'anidride corrispondente, sostituendo il termine "acido" al
termine "anidride".
Ossiacidi meta, piro, orto
Normalmente le anidridi si combinano con una sola molecola di acqua. Le anidridi di alcuni non metalli (P,
B, As, Si) si possono combinare invece con più di una molecola di acqua.
Se il numero di ossidazione del non metallo è dispari l'anidride corrispondente si può legare con 1, 2 o 3
molecole di acqua e può quindi dare luogo a tre diversi acidi, che vengono distinti (nella nomenclatura
tradizionale) mediante i prefissi meta, piro, orto:
anidride + 1 H2O → acido meta......
anidride + 2 H2O → acido piro.......
anidride + 3 H2O → acido orto.......
Se il numero di ossidazione del non metallo è pari (è il caso solo del Silicio) l'anidride corrispondente si può
legare con 1 o 2 molecole di acqua e può quindi dare luogo a due diversi acidi, che vengono distinti (nella
nomenclatura tradizionale) mediante i prefissi meta e orto:
anidride + 1 H2O → acido meta......
anidride + 2 H2O → acido orto........
Per quanto riguarda la nomenclatura IUPAC valgono le regole già viste in precedenza.
14
APPUNTI DI CHIMICA GENERALE E INORGANICA
* a. = acido
Conoscendo la formula dell'acido e volendogli dare il giusto prefisso, basta seguire queste regole:
- piro se vi sono 2 atomi di non metallo ( es. H4P2O7 Acido Pirofosforico)
15
APPUNTI DI CHIMICA GENERALE E INORGANICA
- meta se il numero di atomi di idrogeno è 1 o 2 ( es. HPO3 Acido Metafosforico)
- orto se il numero di atomi di idrogeno è 3 o maggiore di 3 ( es. H3PO4 Acido ortofosforico)
Sali ternari
Quando un acido perde (anche solo formalmente) uno o più ioni H+ forma anioni definiti come "residui
dell'acido".
Formazione di sali ternari
L'acido nitrico HNO3 perdendo uno ione H+, si trasforma in un anione di formula NO3- che è il residuo
dell'acido nitrico HNO3.
HNO3 → H+ + NO3Per l'acido solforico H2SO4 si può avere la formazione di due anioni diversi:
H2SO4 → H+ + HSO4H2SO4 → 2H+ + SO42Per l'acido fosforico H3PO4 si può avere invece la formazione di tre anioni diversi:
H3PO4 → H+ + H2PO4H3PO4 → 2H+ + HPO42H3PO4 → 3H+ + PO43La nomenclatura tradizionale dei residui degli acidi ternari prevede:
i nomi dei residui degli acidi si formano da quelli degli acidi corrispondenti cambiando le desinenze secondo
lo schema seguente:
oso → ito
ico → ato
Inoltre se i residui derivano da acidi che contengono due atomi di idrogeno e soltanto uno dei due viene
perso, si usano gli stessi suffissi, mettendo però la parola acido dopo il nome del residuo dell'acido.
Nel linguaggio comune non si usa la parola acido, ma si aggiunge il prefisso bi- al nome del residuo.
Per esempio l'acido carbonico può formare due anioni diversi:
H2CO3 → H+ + HCO3H2CO3 → 2H+ + CO32HCO3- è lo ione bicarbonato (o ione carbonato acido)
CO32- è lo ione carbonato
Se invece i residui derivano da acidi che contengono tre o quattro atomi di idrogeno, si usano gli stessi
suffissi ma si aggiunge il termina monoacido se al residuo è rimasto un solo atomo di idrogeno; biacido se
al residuo sono rimasti due atomi di idrogeno e triacido se ne sono rimasti tre.
Per esempio l'acido fosforoso H3PO3 può formare tre anioni diversi:
H3PO3 → H+ + H2PO3H3PO3 → 2H+ + HPO32H3PO3 → 3H+ + PO33H2PO3- è lo ione fosfito biacido
HPO32- è lo ione fosfito monoacido
PO33- è lo ione fosfito
16
APPUNTI DI CHIMICA GENERALE E INORGANICA
* Nei residui acidi (cioè contenenti uno o più atomi di idrogeno), il numero degli atomi di ossigeno viene
sempre tralasciato.
Nomenclatura di sali ternari
I sali ternari si ottengono dall'unione tra un residuo di un acido e uno ione metallico. Nella formula chimica
del sale ternario, il simbolo chimico del metallo precede quello del residuo dell'acido.
Applicando la "Regola dell'incrocio" risulta che la formula generale di un sale ternario è MexRey in cui:
Me = simbolo chimico dello ione metallo;
y = numero di ossidazione dello ione metallico;
Re = residuo dell'acido;
x= numero di ossidazione del residuo dell'acido.
In entrambe le nomenclature, tradizionale IUPAC, il nome del sale viene costruito utilizzando il nome
dell'anione (residuo dell'acido) e facendo riferimento al metallo.
(nome dell'anione) di (nome del metallo)
17
APPUNTI DI CHIMICA GENERALE E INORGANICA
Reazioni redox o di ossido-riduzione
Le reazioni di ossidoriduzione sono quelle reazioni in cui si ha uno scambio di elettroni tra due specie
chimiche; una specie subisce una reazione di ossidazione, l'altra subisce una reazione di riduzione.
Reazione di ossidazione
La reazione di ossidazione è una reazione in cui una specie chimica, atomo o ione perde elettroni. Il
suo numero di ossidazione aumenta.
Fe → Fe2+ + 2 e-- (NB e- è il simbolo dell'elettrone che ha carica negativa)
Reazione di riduzione
18
APPUNTI DI CHIMICA GENERALE E INORGANICA
La reazione di riduzione è una reazione in cui una specie chimica, atomo o ione acquista elettroni. Il suo
numero di ossidazione diminuisce.
2H+ + 2 e-- → H2
E' chiaro che se in una reazione chimica un elemento si ossida perdendo elettroni, dovrà esistere un altro
elemento che, acquistando gli elettroni, si riduce. Pertanto le reazioni di ossidazione e di riduzione devono
avvenire contemporaneamente. Si parla quindi di reazioni di ossidoriduzione o di reazioni redox.
Si definisce inoltre ossidante la specie chimica che si riduce e che quindi determina l'ossidazione di un'altra
specie.
Si definisce riducente la specie chimica che si ossida e che quindi determina la riduzione di un'altra specie.
Come si riconoscono le reazioni di ossidoriduzione
Un modo semplice per riconoscere le reazioni redox è quello di osservare se vi è variazione del numero di
ossidazione di due differenti elementi. Infatti, se vi è variazione del numero di ossidazione, la reazione è di
ossidoriduzione.
1° esempio:
Consideriamo la reazione tra ioduro di potassio e bromo:
2 KI + Br2 → 2 KBr + I2
Seguendo le regole per attribuire i numeri di ossidazione, si ha che:
lo iodio I in KI ha numero di ossidazione -1, mentre in I2 ha numero di ossidazione 0.
-1 → 0
Il numero di ossidazione di I passa da -1 a 0, il suo numero di ossidazione aumenta. KI quindi si ossida ed è
una sostanza riducente.
Il bromo in Br2 ha numero di ossidazione 0, mentre in KBr ha numero di ossidazione -1.
0 → -1
Il numero di ossidazione di Br passa da 0 a -1, il suo numero di ossidazione diminuisce. Br2 quindi si riduce
ed è una sostanza ossidante.
In questa reazione vi è variazione del numero di ossidazione di due differenti elementi, si tratta quindi di
una reazione redox.
2° esempio:
Consideriamo la seguente reazione chimica:
2 HNO3 + 3 H2S → 2 NO + 3 S + 4 H2O
Seguendo le regole per attribuire i numeri di ossidazione, si ha che:
L'azoto in HNO3 ha numero di ossidazione +5, mentre in NO ha numero di ossidazione +2.
+5 → +2
Il numero di ossidazione di N passa da +5 a +2, il suo numero di ossidazione diminuisce. HNO3 quindi si
riduce ed è una sostanza ossidante.
Lo zolfo in H2S ha numero di ossidazione -2, mentre a destra ta i prodotti ha numero di ossidazione 0.
-2 → 0
Il numero di ossidazione di S passa da -2 a 0, il suo numero di ossidazione aumenta. H2S quindi si ossida ed
è una sostanza riducente.
In questa reazione vi è variazione del numero di ossidazione di due differenti elementi, si tratta quindi di
una reazione redox.
19
APPUNTI DI CHIMICA GENERALE E INORGANICA
Acidi e basi (schema esemplificativo)
Soluzioni chimiche
Una soluzione è un miscuglio omogeneo di due o più componenti.
Componenti di una soluzione
Una soluzione è formata da un solvente che è la sostanza presente in quantità maggiore, capace di
sciogliere e da un soluto (o soluti) la sostanza (o le sostanze) presente in minor quantità che si sciolgono.
Per esempio, nelle soluzioni acquose il solvente è l'acqua e il soluto qualsiasi sostanza idrosolubile:
zucchero, sale, alcool, CO2, etc.
Le soluzioni più semplice è costituita da un'unica specie chimica come solvente e da un'unica specie chimica
come soluto (ad esempio zucchero disciolto in acqua), ma possono esistere soluzioni in cui il solvente è
costituito da più specie chimiche solubili tra loro, ed i soluti sono più di uno (ad esempio zucchero e cloruro
sodico disciolti in una miscela di acqua ed etanolo). Nella nostra trattazione ci riferiremo soltanto a
soluzioni costituite da un unico solvente e da un unico soluto.
Tipi di soluzione
20
APPUNTI DI CHIMICA GENERALE E INORGANICA
Esistono diversi tipi di soluzione:
Soluzioni gassose costituite da un soluto gassoso disciolto in un solvente gassoso (ossigeno miscelato ad
azoto).
Soluzioni liquide, possono essere costituite da:
•
soluto gassoso disciolto in un solvente liquido (azoto disciolto nell'acqua);
•
soluto liquido disciolto in un solvente liquido (acetone disciolto in acqua);
•
soluto solido disciolto in un solvente liquido (sale disciolto in acqua).
Soluzioni solide, possono essere costituite da:
•
soluto gassoso disciolto in un solvente solido (idrogeno disciolto in palladio);
•
soluto liquido disciolto in un solvente solido (mercurio disciolto in cadmio);
•
soluto solido disciolto in un solvente solido (zinco disciolto in rame).
In una soluzione, le particelle delle sostanze disperse hanno dimensioni dell'ordine di pochi decimi di
nanometro (
) (molecole, ioni, atomi) e non sono distinguibili con mezzi ottici.
Nella comune pratica chimica rivestono grande importanza le soluzioni liquide e in particolare le soluzioni
acquose in cui il solvente è l'acqua. Ci occuperemo unicamente di questi tipi di soluzioni.
Prodotto ionico dell'acqua e acidità delle soluzioni
Se si misura la conducibilità dell'acqua con strumenti sufficientemente sensibili, si osserva che, sia pure in
minima quantità, conduce la corrente elettrica.
Questo significa che nell'acqua sono presenti degli ioni, anche se in concentrazione molto limitata; questi
ioni si formano secondo la seguente reazione:
Si tratta di un normale equilibrio acido-base secondo il quale una molecola d'acqua si comporta da acido e
un'altra molecola di acqua si comporta da base. Questa reazione è detta di autoionizzazione o
di autoprotolisi.
Prodotto ionico dell'acqua e costante di equilibrio (introduzione al concetto di pH)
La costante di equilibrio per questa reazione può essere espressa nel seguente modo:
Per semplificare, possiamo usare [H+] al posto di [H3O+], ricordando che gli ioni H+ in soluzione sono sempre
idrati. Usando questa notazione semplificata, si ha:
Il valore della concentrazione dell'acqua [H2O] è un valore costante e può essere inglobato nella Keq. Il
prodotto tra Keq e [H2O]2 è pertanto un valore costante che viene indicato con il simbolo Kw. La relazione
precedente assume quindi la seguente forma:
21
APPUNTI DI CHIMICA GENERALE E INORGANICA
Il Kw è quindi un valore costante che viene denominato prodotto ionico dell'acqua. Alla temperatura di
25°C, il suo valore determinato sperimentalmente risulta essere pari a 1,0 · 10-14. Pertanto si ha:
Acidita' e basicita' delle soluzioni
Come si vede dall'equilibrio di autoprotolisi, da una molecola di H2O si ottiene uno ione H+ e uno ione OH-.
Possiamo perciò ritenere che la concentrazione degli ioni H+, ovvero degli ioni H3O+, è uguale a quella deglo
ioni OH-, quindi in acqua pura si avrà:
L'acqua pura, avendo una concentrazione di ioni H+ uguale a quella degli ioni OH-, pari a 10-7 mol/L, viene
definita neutra.
La relazione:
vale non soltanto per l'acqua pura, ma per qualsiasi soluzione acquosa. Se in acqua viene messo un acido
che, dissociandosi, fa aumentare la concentrazione degli ioni H+, la concentrazione di quelli OH- diminuisce
e tale soluzione viene detta acida.
Se invece viene aggiunta una sostanza che fa aumentare la concentrazione deglio ioni OH-, la
concentrazione deglio ioni H+ diminuisce e tale soluzione viene detta basica.
Le tre condizioni sopra citate possono essere così riepilogate:
Tutte le volte che si ha un aumento o una diminuzione della concentrazione degli ioni H+ si ha
contemporaneamente una diminuzione o un aumento della concentrazione degli ioni OH-. Conoscendo la
[OH-] è possibile calcolare la [H+] tramite la seguente formula:
e viceversa:
Esercizio
Calcola la concentrazione degli ioni ossidrile [OH-] di una soluzione acquosa che ha una concentrazione di
ioni idrogeno [H+] pari a 10-5.
Svolgimento:
[OH-] = Kw / [H+] = 10-14 / 10-5 = 10-9
La soluzione pertanto risulta acida
22
APPUNTI DI CHIMICA GENERALE E INORGANICA
pH
pH e pOH: teoria e spiegazione
Essendo in soluzioni acquose le concentrazioni degli ioni H+ e degli ioni OH- espresse da valori molto piccoli,
da un punto di vista pratico è conveniente utilizzare un operatore matematico che permette di operare con
numeri più semplici.
Tale operatore è il pH
Definizione di pH
Si definisce pH il logaritmo decimale negativo della concentrazione degli ioni H+:
Definizione di pOH
In modo del tutto analogo si può definire il pOH:
si definisce pOH il logaritmo decimale negativo della concentrazione degli ioni OH-:
A 25°C essendo:
in base alle proprietà dei logaritmi, si ha:
Scala del pH
La scala del pH è compresa tra 0 e 14. In base al valore del pH una soluzione può essere:
Basica
Se il pH è maggiore di 7 (pH basico)
In questo caso [H+] < 10-7 mol/L e [OH-] > 10-7 mol/L
Neutra
Se il pH è uguale a 7 (pH neutro)
In questo caso [H+] = [OH-] = 10-7 mol/L
Acida
Se il pH è minore di 7 (pH acido)
In questo caso [H+] > 10-7 mol/L e [OH-] < 10-7 mol/L
Ma in tutti i casi valgono (a 25°C) le seguenti relazioni:
e
23
APPUNTI DI CHIMICA GENERALE E INORGANICA
Riassumendo:
In realtà il pH può assumere anche valori superiori a 14 o negativi. Si tratta comunque di casi molto rari nei
quali le concentrazioni degli ioni H+ sono eccezionalmente basse o elevate.
24
APPUNTI DI CHIMICA GENERALE E INORGANICA
Soluzioni tampone
Le soluzioni tampone e il calcolo del pH.
Le soluzioni tampone sono soluzioni contenenti miscele di soluti che impediscono significative variazioni di
pH per aggiunta di moderate quantità di acidi e di basi forti.
Esse possono contenere contemporaneamente, in concentrazioni all'incirca uguali:
un acido debole e la sua base coniugata (es. CH3COOH / CH3COONa)
oppure
una base debole e il suo acido coniugato (es. NH3 / NH4Cl).
Effetto tampone
Per vedere a cosa è dovuto l'effetto tampone di queste soluzioni, consideriamo una soluzione formata
da acido acetico CH3COOH e acetato di sodio CH3COONa. L'acido acetico, essendo debole, si dissocia solo
parzialmente:
mentre l'acetato di sodio si dissocia completamente:
Il sale ha lo scopo di aumentare la concentrazione dello ione CH3COO- cioè dello stesso ione che si forma,
però in piccole quantità, per dissociazione dell'acido debole. In questo modo si ottiene una soluzione con
concentrazioni di CH3COOH e CH3COO- molto vicine tra loro; ed è proprio questo che determina l'effetto
tamponante della soluzione. Vediamo in che modo.
Se si aggiunge dell'acido forte alla soluzione tampone, aumenta la concentrazione degli ioni H3O+, ma tale
aumento viene annullato dagli ioni CH3COO- presenti nella soluzione, dato che, per ristabilire l'equilibrio, la
reazione
procede da destra verso sinistra.
Se si aggiunge della base forte alla soluzione tampone, gli ioni OH- della base neutralizzano subito i pochi
ioni H3O+ presenti nella soluzione, però altri se ne formano in continuazione per dissociazione dell'acido. Il
processo ha termine solo quando tutti gli ioni OH- risultano neutralizzati; in questo caso la reazione
precedente procede da sinistra a destra.
In modo del tutto analogo a quello ora descritto agiscono le soluzioni tampone costituite da una base
debole e da un suo sale.
Determinazione della [H+] di una soluzione tampone
Consideriamo una soluzione tampone formata da un acido debole e la sua base coniugata (es. CH3COOH /
CH3COONa). E' possibile determinare la concentrazione degli ioni H+ della soluzione per mezzo della
seguente formula:
in cui:
•
Ka = costante di ionizzazione dell'acido
25
APPUNTI DI CHIMICA GENERALE E INORGANICA
•
Ca = concentrazione dell'acido nella soluzione tampone
•
Cs = concentrazione del sale nella soluzione tampone
La formula precedente può essere semplificata se si considera che l'acido e il sale sono presenti nella stessa
soluzione e che, quindi, il rapporto delle loro concentrazioni è anche il rapporto del loro numero di moli.
Pertanto possiamo anche scrivere:
in cui:
•
na = numero di moli dell'acido
•
ns = numero moli del sale
Consideriamo una soluzione tampone formata da una base debole e dal suo acido coniugato (es. NH3 /
NH4Cl). E' possibile determinare la concentrazione degli ioni OH- della soluzione per mezzo della seguente
formula:
in cui:
•
Kb = costante di ionizzazione della base
•
Cb = concentrazione della base nella soluzione tampone
•
Cs = concentrazione del sale nella soluzione tampone
La formula precedente può essere semplificata se si considera che la base e il sale sono presenti nella stessa
soluzione e che, quindi, il rapporto delle loro concentrazioni è anche il rapporto del loro numero di moli.
Pertanto possiamo anche scrivere:
in cui:
•
nb = numero di moli della base
•
ns = numero moli del sale
Termodinamica
Obiettivi e definizione della termodinamica
Se volessimo rispondere alla domanda "Perché due sostanze reagiscono tra loro?" potremmo
superficialmente rispondere dicendo "Le sostanze reagiscono tra loro perché hanno affinità chimica l'una
per l'altra". La risposta però non ci consentirebbe di prevedere quando due specie chimiche possono
reagire, e tanto meno di comprendere perché da esse si formano determinati prodotti piuttosto che altri.
26
APPUNTI DI CHIMICA GENERALE E INORGANICA
Di qui la necessità di una esatta valutazione dei fenomeni chimici che ci consenta di esprimere con un
numero l'affinità chimica delle sostanze.
Questa naturale esigenza viene pienamente soddisfatta dalla Termodinamica Chimica, il cui obiettivo
principale è appunto l'interpretazione dei fenomeni chimici mediante leggi generali per mezzo delle quali
sia possibile:
•
•
Prevedere se in determinate condizioni sperimentali una reazione chimica può avvenire
spontaneamente;
Avere precise indicazioni sulle condizioni più adatte affinché la resa della reazione sia massima.
Termodinamica classica
In generale, la termodinamica studia gli scambi di energia tra il sistema e l'ambiente con lo scopo di
individuare le condizioni in cui il sistema è in equilibrio oppure quelle in cui tende ad evolvere
spontaneamente.
La situazione di equilibrio corrisponde a un sistema (detto sistema termodinamico) le cui caratteristiche
macroscopiche (temperatura, pressione, volume, concentrazione) sono costanti nel tempo.
La situazione di "evoluzione" si riferisce a un sistema che cambia le sue coordinate per portarsi
all'equilibrio.
La termodinamica poggia essenzialmente su due principi: il primo principio della termodinamica che
esprime l'impossibilità di creare e di distruggere energia, che può invece essere trasformata da una forma
ad un'altra;
il secondo principio della termodinamica che esprime l'impossibilità per il calore di fluire da un corpo
freddo a uno più caldo. Dalla elaborazione di questi due principi è possibile derivare i concetti fondamentali
che consentono di prevedere l'andamento dei fenomeni chimici.
Le trasformazioni spontanee e le condizioni di equilibrio possono essere previste studiando alcune funzioni
di stato termodinamiche, quali l'entalpia (H), l'entropia (S), l'energia libera (G). Queste grandezze
permettono di correlare molte proprietà dei composti chimici.
Le teorie della termodinamica classica non richiedono la conoscenza della struttura intima della materia.
Per tale motivo i concetti fondamentali della termodinamica, che risalgono ad oltre un secolo fa, sono
tutt'ora validi perché sganciati dalle teorie, in continua evoluzione, sulla costituzione della materia; i
principi della termodinamica, inoltre, non derivano da leggi generali ma rappresentano la sintesi di una
quantità enorme di risultati sperimentali conseguiti dall'uomo nel corso del tempo.
La contropartita di questa validità generale dei concetti termodinamici è che essi non consentono di trarre
informazioni né sul meccanismo dei fenomeni ai quali vengono applicati, né sul tempo necessario perché
essi si compiano: la termodinamica consente di prevedere, ad esempio, se una reazione - in determinate
condizioni sperimentali - può avere luogo o meno. Nel caso essa possa avere luogo, non dà alcuna
informazione nè sul meccanismo molecolare nè sulla velocità con cui avviene.
Tali informazioni sono fornite da un'altra branca della chimica: la cinetica chimica.
Primo Principio della Termodinamica
Il primo principio della termodinamica (enunciato da R. Clausius nel 1865) afferma che: l'energia può
essere convertita da una forma in un'altra ma non può essere nè creata nè distrutta.
27
APPUNTI DI CHIMICA GENERALE E INORGANICA
Ogni sistema ha un suo contenuto di energia (energia interna, U) dovuta a tutti i contributi di energia legati
al suo stato: energia dovuta al legame tra nucleo ed elettroni, energia nucleare, energia cinetica, ecc.
Il valore dell'energia U di un sistema non è noto; questo però non costituisce una limitazione in quanto la
termodinamica si occupa soprattutto delle differenze di energia tra due stati diversi e non ai valori assoluti
dell'energia in ciascuno stato.
Quindi, in base al primo principio della termodinamica, affinché si abbia variazione dell'energia interna di
un sistema, questo deve scambiare energia con l'esterno. Ogni scambio di energia fra un sistema e l'esterno
avviene o tramite lavoro o per passaggio di calore.
Quindi: un sistema può variare il proprio contenuto di energia solo attraverso scambi di calore e di lavoro
con l'ambiente. E' questo un modo alternativo di enunciare il primo principio della termodinamica.
Pertanto:
∆U = Q - L
in cui:
•
∆U = variazione di energia interna subita dal sistema durante la trasformazione;
•
Q = quantità di calore scambiata con l'ambiente;
•
L = lavoro in gioco nella trasformazione*.
Secondo una convenzione detta "primo criterio" o "criterio misto" il calore Q è positivo se passa
dall'ambiente al sistema, mentre il lavoro L è positivo se compiuto dal sistema.
Tale convenzione si contrappone a quella nota come "egoistica" secondo cui sia il lavoro che il calore sono
considerati positivi quando vengono forniti al sistema. Utilizzando tale convenzione, l'espressione del primo
principio della termodinamica diventa:
∆U = Q + L
Poichè l'energia non può essere né creata né distrutta ma solo trasferita dal sistema all'ambiente o
viceversa, per il sistema isolato (sistema + ambiente) vale la relazione:
∆U (sistema isolato) = 0
per cui, ad una determinata variazione dell'energia del sistema corrisponde una identica - ma di segno
opposto - variazione di energia dell'ambiente.
Secondo principio della termodinamica
Il secondo principio della termodinamica, noto anche come enunciato di Clausius, afferma che: il calore
non può spontaneamente fluire da un corpo freddo a uno più caldo.
Ai nostri fini, puramente chimici, il secondo principio della termodinamica può essere enunciato in modo
diverso:
qualunque sistema, se abbandonato a se stesso, tenderà a portarsi a una condizione di massima
probabilità.
Poiché la condizione di massima probabilità coincide con quella di massimo disordine, ne segue che:
qualunque sistema evolve spontaneamente verso lo stato di massimo disordine.
Si chiama entropia (S) la grandezza termodinamica che esprime lo stato di disordine di un sistema dato.
Per rendere una idea del concetto di disordine, consideriamo il sistema ghiaccio <==> acqua.
28
APPUNTI DI CHIMICA GENERALE E INORGANICA
A temperatura ambiente, il ghiaccio fonde e si trasforma in acqua liquida. Ora le sue molecole, più libere di
muoversi, assumono spontaneamente una distribuzione casuale molto più disordinata che nel ghiaccio.
Quando poi, l'acqua si trasforma in vapore, le sue molecole si trovano nello stato di massimo disordine.
Costituenti inorganici: Acqua e oligoelementi
Principali proprietà dell'acqua
L'acqua è il composto più diffuso in natura: tre quarti della superficie terrestre sono ricoperti da acqua,
sotto forma di mari, oceani, fiumi, laghi, ghiacciai, etc..
L'acqua inoltre costituisce dal 50% al 95% del peso di ogni sistema vivente: nell'organismo umano ben il 6070% in peso è costituito da acqua. Da un punto di vista alimentare, essa dunque riveste un ruolo
fondamentale non solo qualitativamente, ma anche solo quantitativamente.
La molecola d'acqua è costituita da un atomo di ossigeno legato covalentemente a due atomi di idrogeno
(H2O); la forte differenza di elettronegatività tra le due specie di atomi determina una diseguale
localizzazione delle cariche, ossia gli elettroni messi in comune tra O e H sono maggiormente attratti dall'O
cosicchè la molecola, pur rimanendo complessivamente neutra (n° elettroni = n° protoni), presenta
proprietà polari: la regione vicina al nucleo di idrogeno è debolmente positiva, mentre quella del nucleo di
ossigeno (ove tra l'altro sono presenti altri due doppietti di elettroni non coinvolti nel legame covalente), è
debolmente carica negativamente.
29
APPUNTI DI CHIMICA GENERALE E INORGANICA
Naturalmente ciò influisce su molte caratteristiche microscopiche e macroscopiche dell'acqua, prime fra
tutte la geometria delle molecole e le modalità di aggregazione tra le molecole: la molecola d'acqua, in
termini di polarità, presenta quattro vertici di cui due negativi (doppietti non coinvolti nel legame
covalente) e due positivi (atomi di idrogeno), ma l'angolo tra gli H non è di 109° come avverrebbe in un
tetraedro regolare, bensì di 104.5° per motivi di interazione elettrostatica.
Inoltre i vertici costituiti dagli H di una molecola tendono, sempre per interazione elettrostatica, ad attrarre
i vertici costituiti dall'O delle molecole circostanti cosicchè si forma un legame relativamente forte tra le
molecole: il legame o ponte a idrogeno.
La polarità della molecola e la presenza di numerosi legami a idrogeno determinano le peculiari
caratteristiche chimico-fisiche dell'acqua:
Elevati punto di fusione (0 °C),
punto di ebollizione (100 °C), calore specifico (1 cal/g°C) e calore latente di evaporazione (596 cal/g a 0 °C e
540 cal/g a 100 °C), da cui l'esistenza dell'acqua allo stato liquido in condizioni ambiente e la sua resistenza
ai cambiamenti di temperatura così importanti per la termoregolazione e le funzioni vitali degli organismi
viventi; anche queste proprietà dipendono direttamente dal legame a idrogeno che mantiene assieme le
molecole di acqua e tende ad ostacolare il loro movimento, ossia a contenere la loro energia cinetica
direttamente legata alla temperatura del liquido.
Altre proprietà dell'acqua
Proprietà solventi dell'acqua nei confronti di sostanze polari, ioniche o elettricamente cariche
La polarità delle molecole dell'acqua è responsabile della capacità dell'acqua di comportarsi
come solvente nei confronti di sostanze polari, ioniche o elettricamente cariche, ossia di interagire con le
molecole di una sostanza (il soluto) separandole le une dalle altre, provocando una loro dispersione tra le
proprie molecole e creando con esse legami di tipo elettrostatico.
Le sostanze che possono essere sciolte dall'acqua dunque sono:
•
composti ionici (NaCl, KCl, etc...) ove l'attrazione esercitata dalle molecole d'acqua spezza i legami
ionici e dà luogo agli ioni solvatati della sostanza (Na+, Cl-, K+, etc.),
30
APPUNTI DI CHIMICA GENERALE E INORGANICA
•
gas come l'ossigeno, l'anidride carbonica, l'ammoniaca vi si disciolgono bene;
•
molecole unite da legami covalenti polari che si ionizzano, spesso comportandosi
da acidi (aumentando la concentrazione di ioni H+) o basi (aumentando la concentrazione di ioni
OH-);
•
sostanze organiche dotate di gruppi polari come gli alcooli (-OH), gli acidi carbossilici (-COOH) e gli
zuccheri;
•
molecole complesse dotate di una parte idrofila ed una idrofoba che si disperdono formando
aggregati micellari.
Oligoelementi
Gli oligoelementi non fanno parte delle scoperte recenti, infatti venivano usati, pur empiricamente, fin dal
Medioevo.
L’Oligoterapia nasce nel 1894 con Gabriel Bernard il quale scoprì che gli elementi traccia nel nostro
organismo non erano delle impurità, ma erano essenziali sia pure in minime quantità, alle funzioni
metaboliche del nostro organismo, nel 1920 Sutter utilizzava un preparato a base di Manganese e Rame,
per curare l’eczema e l’asma bronchiale.
La vera sperimentazione scientifica si ebbe alla fine dell’Ottocento con Jacques Ménétrier al quale si deve
l’impostazione base della moderna oligoterapia. Negli anni ’30 Ménétrier introduce in forma regolare l’uso
degli oligoelementi in terapia definendola OLIGOTERAPIA CATALITICA, ed il suo modello biologico prevede
l’inserimento nell’organismo di microquantità in soluzione gluconata, con assorbimento perlinguale o
parenterale, per il trattamento dei DISTURBI FUNZIONALI, in contrapposizione ai disturbi lesionali.
Gli oligoelementi sono presenti in concentrazione uguale o inferiore allo 0,01% del peso secco corporeo,
31
APPUNTI DI CHIMICA GENERALE E INORGANICA
sono presenti in tutti i tessuti sani di tutti gli organismi viventi, hanno una concentrazione tessutale
relativamente costante, la loro carenza induce alterazioni strutturali e fisiologiche, il loro utilizzo, previene
e guarisce le affezioni morbose provocate dallo stato carenziale.
Gli oligoelementi essenziali sono:
Cobalto (Co), Cromo (Cr), Fluoro (Fl), Ferro (Fe), Manganese (Mn), Nichel (Ni), Rame (Cu), Selenio (Se),
Silicio (Si), Zinco (Zi) e Zolfo (S).
Gli oligoelementi sono i catalizzatori delle funzioni biologiche dell’organismo, il termine “Oligos” deriva
dal greco e significa poco, sono presenti in quantità infinitesimali in tutti gli organismi viventi, nelle piante,
negli animali, nell’uomo. Si impiega in dosi infinitesimali, ossia non ponderali, la dose giornaliera varia da
qualche milligrammo a milionesimo di grammo
(l’uso di braccialetti di rame per prevenire le infezioni e
combattere i reumatismi, risale a 6000 anni prima di Cristo, successivamente furono scoperte le proprietà
antinfettive dell’Argento, o quelle sedative del Magnesio).
Sono dei “BIOCATALIZZATORI”, ovvero aiutano, attivano, le reazioni chimiche e metaboliche indispensabili
alla vita. La loro carenza induce alterazioni strutturali e fisiologiche, somministrati a giuste dosi prevengono
e guariscono gli stati di carenza., e il loro impiego aiuta a ripristinare le funzioni deficitarie dell’organismo.
Si integrano, in quanto naturali all’organismo e non sono come i farmaci di sintesi che sostituiscono
parzialmente un funzionamento deficitario, i farmaci vengono abitualmente eliminati attraverso gli organi
emuntori., mentre gli oligoelementi entrano nel tessuto cellulare riportando il corpo allo stato di equilibrio
funzionale.
La CATALISI, deriva dal greco “Katalysis” e significa dissoluzione, consiste nell’accelerazione di una reazione
chimica tramite la presenza di una sostanza che pur partecipando alla reazione stessa, non viene né
consumata, né trasformata nel corso di detta reazione. Sono gli enzimi che fungono da catalizzatori delle
reazioni chimiche necessarie alla vita umana, ed essi per funzionare correttamente, hanno necessità degli
oligoelementi.
Per ATTIVITA’ CATALITICA degli oligoelementi si intende la capacità dei minerali traccia di attivare
importanti enzimi nel nostro organismo, che entrano nelle reazioni chimiche fungendo da catalizzatori,
accelerandone di migliaia di volte la velocità.
Proprio dalla CHELAZIONE “blocco”, degli oligoelementi nel nostro organismo (cosa che comporta la
cessazione totale o parziale delle attività presiedute dagli enzimi) deriverebbe infatti, il blocco di talune
reazioni chimiche, causa di patologie funzionali. L’esempio classico è quello del rame come oligoelemento,
la cui presenza è indispensabile all’assorbimento del Ferro per combattere le anemie.
La dose infinitesimale degli oligoelementi è assolutamente PRIVA DI TOSSICITA’.
32
APPUNTI DI CHIMICA GENERALE E INORGANICA
Gli attuali metodi di coltivazione, e soprattutto i concimi chimici, depauperano i prodotti alimentari di
vitamine e di minerali, ed anche di conseguenza di oligoelementi, i quali agiscono sul “terreno”, non solo
sul sintomo, ma soprattutto sulle cause profonde della malattia, risolvono le cause tessutali e metaboliche,
rinforzano le difese immunitarie, sono un supporto terapeutico sostanziale e indispensabile, come
integrazione totale alla terapia fitoterapica, e ad altre terapie naturali.
Si utilizzano sia per aiutare a superare alcune tendenze patologiche funzionali, squilibri, che caratterizzano
alcuni tipi di persone, ed anche possono essere usati per intervenire sul singolo disturbo che si presenta.
L’uso corretto degli oligoelementi porta a dei cambiamenti reali, ed essendo le DIATESI (predisposizioni)
reversibili si può passare da uno stato di anergia, che è quello più grave, ad uno stadio di salute migliore.
Lo scopo dell’oligoterapia è quello di ristabilire le funzioni metaboliche bloccate, attraverso la
somministrazione di attivatori di pronto impiego e di elevata bio-disponibilità. L’azione è regolatrice ed
equilibratrice e si adatta e si applica all’insieme del caso.
33