Fondamenti di
spettrofotometria
p
Spettroscopia
p
p UV/Vis
Spettroscopia
Definizione: Lo studio della struttura e della dinamica
della materia (in biologia delle molecole) attraverso
l’analisi dell’interazione con la luce
La lunghezza d’onda della luce (quindi la sua
energia) determina il modo in cui questa interagisce
con la materia
Serve per:
Quantificare molecole
Identificare molecole
Analizzare cambiamenti dinamici nella
composizione o nella struttura delle molecole
(cinetica di reazioni …)
………………………
Proprietà della luce
La Radiazione Elettromagnetica
• Secondo la meccanica quantistica la
radiazione elettromagnetica ha una doppia
natura Essa possiede le proprietà di
natura.
un’onda e di un corpuscolo
NATURA ONDULATORIA
lunghezza d’onda (λ)
frequenza (ν)
X
ν= c/λ
λ
Y
A
Z
Parametri di un’onda:
Lunghezza d’onda (λ): distanza tra due massimi
Frequenza (ν): numero di oscillazioni in 1 secondo (Hz = 1 ciclo/s)
nel vuoto c ≅ 3.108 m/s.
F
Frequenza
e lunghezza
l
h
d'onda
d' d sono INVERSAMENTE PROPORZIONALI
PROPORZIONALI:
NATURA CORPUSCOLARE
Una radiazione elettromagnetica consiste in “pacchetti discreti” di energia, chiamati
FOTONI la
FOTONI,
l cuii energia
i dipende
di d dalla
d ll frequenza,
f
secondo
d l'equazione:
l'
i
E=h.ν
dove h indica la costante di Planck: h = 6.63
6 63 . 10-34 J. s
L'energia di un fotone viene a volte espressa anche in elettron-volt (1eV=1.6 . 10-19 J).
Quindi:
ENERGIA
PROPORZIONALI
E
FREQUENZA
SONO
DIRETTAMENTE
Questa relazione ci indica l'energia associata a ciascun fotone per ogni fascio di
frequenza
q
ν;; pper cui un fascio di luce è ppiù o meno intenso a seconda che pporti ppiù o
meno fotoni nell'unità di tempo, ma l'energia di ciascun fotone (il quanto di energia
), è sempre la stessa per una determinata frequenza della radiazione.
Che accade quando una radiazione colpisce un oggetto?
• L’energia da una sorgente luminosa interagisce con le proteine in diversi
modi.
•A
A li
livello
ll dei
d i legami
l
i atomici
i i vediamo
di
la
l promozione
i
di elettroni
l
i a più
iù alti
li
livelli energetici.
•A livello molecolare vediamo assorbimento ed emissione della luce.
•Le transizioni tra livelli energetici non sono limitate agli elettroni; I legami
chimici possono andare incontro a una varietà di livelli energetici vibrazionali
e atomi connessi da legami covalenti possono ruotare l’uno rispetto all’altro.
104
microonde
Infrarosso
103
visibile
102
Transizioni rotazionali
Transizioni
vibrazionali
Transizioni
elettroniche
ultravioletto
T
Transizioni
i i i elettroniche
l tt i h
10
1
Raggi-X
Diffrazione
Aumeento dell’energia
105
•Una
Una transizione avviene quando ll’energia
energia di una molecola cambia da
uno stato all’altro.
e
e
•L’assorbimento avviene
quando la radiazione causa
un aumento di energia nel
sistema con cui interagisce.
T
Transizione
i i
e
e
e
e
e
e
•L’emissione avviene
quando la radiazione è
prodotta da un sistema
durante una transizione
da un alto livello
energetico a uno più
basso
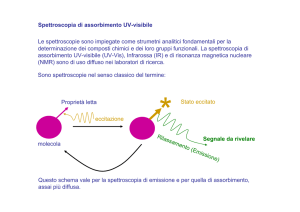
si ottiene uno spettro di emissione quando si analizza un
fascio di luce emesso,
emesso in opportune condizioni,
condizioni da una
sostanza;
si ottiene uno spettro di assorbimento quando si analizza
un fascio di luce dopo che ha attraversato una sostanza.
Per una stessa
P
t
sostanza
t
l spettro
lo
tt
di emissione
i i
e di
assorbimento sono pressappoco come il positivo e il
negativo di una fotografia,
fotografia nel senso che una radiazione
presente nello spettro di emissione sarà mancante in
quello di assorbimento.
q
Q
Quando
una radiazione p
passa attraverso uno strato di sostanza solida,, liquida
q
o g
gassosa,, alcune
frequenze possono essere rimosse selettivamente mediante assorbimento, cioè un processo in cui
l’en. elettromagnetica viene trasferita agli atomi, ioni o molecole che costituiscono il campione.
L’assorbimento di radiazione promuove queste particelle dal loro stato normale (fondamentale) a
temperatura ambiente a uno o più stati eccitati ad energia più alta.
Secondo la teoria quantistica, gli atomi, le molecole o gli ioni
possiedono soltanto un numero limitato di livelli energetici
discreti; perché si abbia assorbimento della radiazione, l’energia
del fotone eccitante deve essere esattamente uguale alla
differenza di energia fra lo stato fondamentale ed uno degli
stati eccitati della specie assorbente. Su questo principio si
basano sia la spettroscopia di assorbimento sia quella di
emissione.
• spettroscopia
tt
i di ASSORBIMENTO:
ASSORBIMENTO quando
d atomi
t i o molecole
l
l
vengono eccitati e passano a stati energetici maggiori
• spettroscopia di EMISSIONE: dagli stati eccitati, ritornando
allo stato fondamentale,
fondamentale le particelle riemettono energia sotto
forma di radiazioni elettromagnetiche (hν)
Stato eccitato (E1)
ΔE = hν
Stato fondamentale (E0)
Spettro di assorbimento
Gli elettroni sono distribuiti su diversi livelli energetici,
ma tendono ad occupare i livelli energetici più bassi (stato
f d
fondamentale)
l )
Quando viene ceduta energia la sistema gli elettroni
possono passare ad un livello energetico superiore (stato eccitato)
Se l’energia
g deriva da una radiazione elettromagnetica,
g
si avrà uno
spettro di assorbimento.
Viene assorbita
Vi
bit solo
l la
l quantità
tità di energia
i equivalente
i l t alla
ll
differenza tra i diversi livelli energetici, in accordo con le
regole della meccanica quantistica.
quantistica La grandezza assoluta di ogni
quanto sarà diversa a seconda dei livelli energetici coinvolti
Stato fondamentale
Lo stato a più bassa energia possibile in un
sistema fisico in termini di particelle elementari.
E’ anche chiamato stato basale. Gli elettroni si
trovano sugli orbitali a più bassa energia
Stato eccitato
Un livello energetico più alto di quello basale. Gli
elettroni passano su orbitali ad energia più alta.
Spettro di assorbimento
• Quando la luce colpisce un campione, le
g
d’onda con energia
g idonea a
le lunghezze
promuovere il salto degli elettroni dallo
stato basale a quello eccitato sono
rimosse dallo spettro trasmesso
Energia
g delle radiazioni
Nella tecnica UV-vis si impiegano radiazioni nell’intervallo 200-800 nm, la cui
energia
g è sufficiente ad attivare transizioni elettroniche,, che causano il p
passaggio
gg
di elettroni degli strati esterni a stati eccitati
UV (Ultravioletto) ⇒ 200-400 nm (lontano UV)
Visibile ⇒ 400-800
400 800 nm
Energia
la radiazione visibile rappresenta solo una piccola parte dello spettro
elettromagnetico:
Alle diverse radiazioni visibili che differiscono per la loro lunghezza d’onda
(quindi per la loro diversa frequenza ed energia) corrispondono i diversi colori.
Colori
Co
o de
della
a luce
uce visibile
sb e
Lunghezza d’onda Assorbita
380 420
380-420
violet
420-440
violet-blue
440 470
440-470
blue
470-500
blue-green
500 520
500-520
green
520-550
yellow-green
550 580
550-580
yellow
ll
580-620
orange
620 680
620-680
red
d
680-780
purple
Osservata
green yellow
green-yellow
yellow
orange
red
purple
l
violet
violet-blue
i l t bl
blue
bl
blue-green
green
Applicazioni degli spettri di assorbimento
•Misure Quantitative –determinazione di concentrazioni.
•Calcoli di velocità di reazioni
• Studi strutturali – folding, assemblaggio, denaturazione,
g
di ligandi
g
cambiamenti di struttura,, legame
•Enzimatici. Ad es. Analisi degli intermedi delle reazioni
•Identificatione di composti (vitamine, ormoni). Utile per
identificare proteine con cromofori particolari
•Studi immunologici.– tramite kit commerciali
I cromofori nelle proteine
The peptide bond
Chromophores in proteins
the important
p
chromophores
p
to remember are:
backbone:
tryptophan:
tyrosine:
phenylalanine:
λmax(nm)
195
220
280
219
274
222
193
257
206
188
ε(M-1cm-1)
5600
47000
1400
8000
48000
200
9300
60000
both these
peaks are
very useful
Emoglobina
He moglobin (lys e d blood)
25
20
He moglobin (lys e d blood)
ua(cm-1))
15
10
5
0
300
350
400
450
500
Wave le ng th (nm)
550
600
650
Cosa determina l’assorbanza di un cromoforo?
•I cromofori sono di solito caratterizzati da doppi legami e sistemi di
risonanza
•Lo spettro di assorbimento di un cromoforo è solo parzialmente
determinato dalla sua natura chimica
•L’ambiente del cromoforo influenza le proprietà dello spettro
pH
• polarità del solvente
• Effetti di orientamento
•I cromofori possono agire da molecole reporter che possono dare informazioni
circa il loro ambiente .
•Effetti di protonazione/deprotonazione dovuti a cambiamenti di pH o effetti di
ossidazione/riduzione influenzano la distribuzione elettronica dei cromofori
• polarità del solvente. Gli spettri cambiano in differenti solventi.
• Effetti di orientamento derivano da molecole di cromofori vicini.. E.g.
hyperchromicity degli acidi nucleici.
nucleici
Un’estesa coniugazione ha un grande
effetto sulla λmax; lo spostamento sarà a
lunghezze d’onda maggiori
H
H
C
H
H
H
C
C
H
1,3-butadiene
C
H
H
C
C
H
λmax 170 nm
λmax 217 nm
H
H
H
C
C
H
H
C
C
H
H
H3C
λmax 217 nm
((diene coniugato)
g )
H
C
C
H
H
C
H
C
H
C
H
C
CH3
λmax 263 nm
triene coniugato
Licopene
È il pigmento
i
t rossorosso-arancio
i d
dell pomodoro
d
λmax 505 nm
•Gli
Gli spettrii di assorbimento
bi
sono misurati
i
i tramite
i spettrofotometri
f
i
Io
Light
i
source
Monochromator
I
Cuvette
containing
Sample
p
Detector
MONOCROMATORE
È noto che q
quando un raggio
gg di luce bianca colpisce
p
un p
prisma di vetro viene scomposto
p
in
diversi colori. Quello che accade è analogo a quanto si osserva nell'arcobaleno o guardando
obliquamente la superficie di un CD.
La scomposizione (dispersione) in diversi colori
tramite un prisma si spiega in quanto:
• la luce “bianca” è in realtà un miscuglio di
radiazioni di diversa frequenza
q
e q
quindi
corrispondenti a tutti i colori;
• quando un raggio di luce passa da un mezzo ad
un altro viene deviato (fenomeno detto
“rifrazione”):
rifrazione ): ll'entità
entità della deviazione dipende dalla
lunghezza d'onda del raggio incidente.
Una radiazione di un solo colore ottenuta tramite dispersione, caratterizzata da una ben
precisa lunghezza d'onda e frequenza, viene detta fascio di luce MONOCROMATICA.
Si parla invece di fascio di luce POLICROMATICA quando esso è costituito da radiazioni di
frequenza e lunghezza d'onda diverse. La luce bianca proveniente dal sole è policromatica.
Per sapere se un fascio di luce è monocromatico o policromatico è sufficiente farlo passare
attraverso un prisma: se il raggio rimane unico si può dire che è monocromatico; se invece
è policromatico, viene scomposto in diversi raggi.
Aspetti sperimentali
Schema di uno spettrofotometro a doppio raggio
Spettrofotometro a doppio raggio
Aspetti sperimentali
MONOCROMATORE
ECCITAZIONE
λEM
EMISSIONE
Schema a blocchi di uno
spettrofluorimetro
MONOCROMA
ATORE
SORGENTE
λEXC
RIVELATORE (TUBO
FOTOMOLTIPLICATORE)
T=I/I0
A=log1/T = log I0/I
A = ελcd
La legge di Lambert-Beer
A = ελcd
Path length / cm
0
0.2
0.4
0.6
0.8
1.0
%T
100
50
25
12.5
6.25
3.125
Absorbance
0
03
0.3
06
0.6
09
0.9
12
1.2
15
1.5
c
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla profondità, d
Assorbimento
0.82
Sorgente di luce
Rivelatore
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla profondità, d
0.62
Sorgente luminosa
b
Rivelatore
Campione
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla profondità, d
Assorbimento
0.42
Sorgente
Rivelatore
campioni
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla profondità, d
Assorbanza
0.22
Sorgente
Rivelatore
Campioni
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla concentrazione, c
Assorbanza
0.82
Sorgente
Rivelatore
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla concentrazione, c
Assorbanza
0.62
Sorgente
b
Rivelatore
Campione
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla concentrazione, c
Assorbanza
0.42
Sorgente
b
Rivelatore
campione
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla lunghezza d’onda, λ
Assorbanza
0.82
Sorgente
Rivelatore
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla lunghezza d’onda, λ
Assorbanza
0.30
Sorgente
b
Rivelatore
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla lunghezza d’onda, λ
Assorbanza
0.80
Sorgente
b
Rivelatore
La legge di Lambert-Beer
A = ελcd
Dipendenza dalla lunghezza d’onda, λ
Assorbanza
0.35
Sorgente
b
Rivelatore
Determinazione dei coefficienti di
ti i
l
estinzione
molare
Ι valori
l i di ε delle
d ll proteine
t i
possono essre stimati
ti ti sulla
ll
base della composizione aminoacidica
ε(280nm)
(280 )
=
# of
f Trp’s
T ’ x 5500 +
# of Tyr’s x 1490 +
# of
f di
disulfides
lfid x 125 ((-S-S-)
S S )
p
predizioni:
http://ca.expasy.org/tools/protparam.html
mental (M-1cm-1)
ε experim
I valori teorici di ε sono accurati
100000
75000
50000
25000
0
0
50000
100000
ε predicted (M-1cm-1)
Però…
Però
• NADH libero o legato ha assorbimenti
(ε) diversi
• Si può “titolare” il sito dell’enzima
misurando
i
d ΔA
Spettri differenziali e perturbazioni del solvente
Cambiamenti nella lunghezza d’onda della banda di assorbimento
possono essere indicativi di cambiamenti nella struttura.
L uso di denaturanti o diversi solventi può essere utile per ottenere
L’uso
informazioni sulla struttura della proteina, e studiare i suoi
cambiamenti conformazionali
Spettroscopia differenziale
A or E
Glycerol
DMSO
Glycerol
sucrose
DMSO
λ
Protein
A292
A or E
nativa
Urea
30
50
temp
60
•Spettri di proteine native o
denaturate possono essere usati per
studiare le cinetiche di
denaturazione/rinaturazione
λ
0.01M
NaCl
A292
0.1M
NaCl
30
40
40
50
temp
60
•La stabilità delle proteine in diversi
tamponi può essere studiata in diversi
tamponi misurando il suo unfolding
in funzione della temperatura
• Se il prodotto di una reazione è un cromoforo
cromoforo, è possibile usare la
spettroscopia di assorbimento elettronico per studiare la cinetica
enzimatica
A
tempo
OH
O-
pH 6
pH 13
A
CH2
CH
250
CH2
NH3+
270
CH
λ
290
• Effetti di protonazione deprotonazione
310
330
NH2
2
1
Cm
N
3
α β
N
β
4
Fe
N
N
5
8
7
6
c
d
O
O
O
O
a
b
Denaturazione del DNA
• È possibile seguire la denaturazione del DNA a 260 nm.
• Basi accoppiate ed impilate assorbono meno nell
nell’UV
UV di quelle
“separate” - effetto ipercromico.
• La
temperatura corrispondente a metà dell
dell’aumento
aumento
osservato nell’A260 è definita come “temperatura di melting”,
p
di fusione del DNA.
Tm o temperatura
• Il valore di Tm varia con il rapporto
GC/AT - un maggior
contenuto di GC conduce ad una Tm p
più alta.
• Una maggior forza ionica fa aumentare Tm, limitando la
p
elettrostatica tra fosfati
repulsione
“Melting”
g del DNA:
Assorbanza relativa a 260 nm
• DNA doppio
pp filamento
1.00
• DNA singolo
g
filamento
1.37
• Basi libere
1.67
Denaturazione del DNA
Lodish
Temperatura di
melting:
dipendenza
dalla
composizione
Caratteristiche dei metodi
analitici
• Intervallo analitico: campo in cui il metodo è
applicabile senza modifiche
• Sensibilità: capacità del metodo di determinare piccole quantità
• Limite di rivelabilità: minima osservazione
distinguibile statisticamente
• Specificità
S
ifi ità (o
( selettività):
l tti ità) capacità
ità di deterd t
minare solamente il componente da misurare.
E’ legata alla accuratezza
• Interferenza: effetto di un componente (che
può non produrre lettura) sulla accuratezza di
misura dell’analita
’
• Precisione: concordanza tra misure ripetute:
esprime la dispersione delle misure attorno
alla media; è correlata alla deviazione
standard
• Accuratezza: concordanza tra il valore trovato
p
da errori sistematici
e il valore “vero”;; dipende
Costruzione di curve di
taratura
• La sensibilità è massima al picco di estinzione del
cromoforo
f
• A volte si preferisce un picco più “specifico”
• Il “bianco” deve contenere tutti i reagenti, tranne la
sostanza da determinare
• Occorrono possibilmente cinque punti, misurati in
doppio
• Non si deve estrapolare la curva oltre il valore più
alto determinato
Sommario
La spettroscopia di assorbimento nel U.V/visibile absorption 210 – 900 nm.
L’energia
g luminosa ppromuove il trasferimento di elettroni dalo stato basale ad uno eccitato.
Questo avviene grazie a gruppi detti cromofori
•I cromofori delle proteine includono gli aminoacidi aromatici (Phe, Tyr, Trp), il legame
peptidico, gruppi prostetici o cofattori (metalli). I cromofori sono caratterizzati da elettrini
delocalizzati.
•Le frequenze a cui la luce è aasorbita sono influenzate dalla struttura e dall’ambiente del
cromoforo.
• La spettroscopia di assorbimento ha diverse applicazioni
Problema n.1
Il citocromo c è caratterizzato dai seguenti
coefficienti di estinzione molore:
ε280= 28500 e ε415= 96300 mol-1cm-1.
l1
1
Una soluzione di citocromo c in una cuvetta
da 1 ml assorbe 0.17 a 280 nm e
0.4 a 415 nm.
Calcolare la concentrazione della proteina
Perchè i valori ottenuti utilizzando i due
coefficienti non sono uguali?
Se il citocromo c pesa 12300 dalton, quanti
mg sono presenti in 1 ml?
Problema n
n.2
2
•
•
•
Trovare la concentrazione di NAD e NADH in
una soluzione miscelata basandosi sui
seguenti dati ottenuti in una cuvetta da 1 cm,
I coefficienti di estinzione molare a 260 nm
sono 1.5 x 10-4 per il NADH e 1.84 x 10-4 per
il NAD. A 340 nm solo il NADH assorbe con ε
di 6.22 x 10-3.
La soluzione miscelata da assorbanze di 1.36
e 0,382 a 260 e 340 nm, rispettivamente.