Le radiazioni elettromagnetiche vanno dai raggi
(a minori lunghezze d’onda ed alta
energia/frequenza) alle onde radio (a maggiori
lunghezze d’onda e bassa energia/frequenza).
La lunghezza d'onda () è la distanza tra 2 creste
o 2 ventri (m,cm,nm); la frequenza () è il
numero di oscillazioni al secondo (Hertz, Hz, sec1
); l’energia si misura in calorie o Joules (1 cal=
4,17 J).
=h
L’interazione delle radiazioni nelle regioni dell’ultravioletto E
(UV,
200-350
nm) e del
-34
h
è
la
costante
di
Planck
(6.6
x
10
Joules
x sec)
visibile (VIS, 350-800 nm) con la materia è la base delle tecniche spettroscopiche
Frequenza
= velocitàe quantitative.
della luce (nel vuoto, 3 x
ampiamente utilizzate in biochimica per
analisi
qualitative
108 m/sec)
Gli elettroni di legame di tipo (presenti
nei / legami
doppi o tripli, negli anelli
aromatici) sono costituiti da coppie di elettroni la cui maggiore densità è situata al di
fuori dell’asse di unione dei nuclei; questi elettroni sono “meno legati” e più
facilmente eccitabili rispetto a quelli di tipo presenti nei legami semplici. Le
molecole che contengono elettroni assorbono la luce passando da stati ad energia
minore a stati ad energia maggiore e si chiamano cromòfori. Lo spettrofotometro è
lo strumento che consente la misura dell’assorbimento di cromofori in soluzione.
I0
La sorgente può essere
una lampada a
tungsteno (VIS) o una
lampada ad idrogeno
o deuterio (UV)
Il monocromatore consente
di ottenere un fascio di luce
ad 1 lunghezza d’onda
partendo da una sorgente di
radiazioni policromatica
It
Il rivelatore produce un
segnale elettrico che
dipende dall’energia
delle radiazioni che lo
investono
La cella contenente il campione si chiama cuvetta. Le cuvette possono differire per
natura del materiale (vetro/plastica per lettura nel VIS, quarzo per lettura nell’UV) e
cammino ottico (la distanza tra il raggio entrante e quello uscente), ma hanno
sempre 2 facce opposte che non possono essere attraversate dalla luce (attenzione al
loro posizionamento nello spettrofotometro !)
I0 (Intensità luce incidente) e It (Intensità luce trasmessa)
It = I0 non c’è assorbimento
It < I0 se c’è assorbimento
Una semplice considerazione che riguarda i cromofori nel VIS ci
consente di capire il fenomeno dell’assorbimento. La luce bianca è
il risultato della mescolanza di 7 colori. Quando la luce bianca
passa attraverso un cromoforo, una porzione caratteristica della
miscela di lunghezza d'onda viene assorbita. La luce restante, non
assorbita, assumerà allora il colore complementare alla lunghezza
d'onda (o di onde), che sono state assorbite. Questa correlazione è
descritta dalla ruota dove i colori complementari sono
diametralmente opposti l'un l'altro. Di conseguenza, l'assorbimento
della luce di 420-430 nm rende una sostanza gialla; un
e uno
a la
oforo
della
zioni
sso
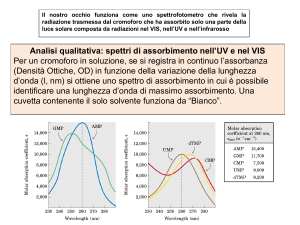
Analisi qualitativa: spettri di assorbimento nell’UV e nel VIS
Per un cromoforo in soluzione, se si registra in continuo l’assorbanza (Densità
Ottiche, OD) in funzione della variazione della lunghezza d’onda (, nm) si ottiene
uno spettro di assorbimento in cui è possibile identificare una lunghezza d’onda di
massimo assorbimento. Una cuvetta contenente il solo solvente funziona da
“Bianco”.
ESERCITAZIONE
Determinazione dello spettro di assorbimento di:
una soluzione in acqua di Albumina di Siero Bovino (BSA) da 240 a 320 nm
una soluzione in acqua di blu destrano da 400 a 800 nm
Analisi quantitativa: determinazione della concentrazione di un cromoforo
La Trasmittanza (T, It /I0) diminuisce in modo esponenziale in rapporto alla
concentrazione del cromoforo, del cammino ottico e di un parametro
(caratteristico del cromoforo) perché aumenta l’Assorbanza (A).
T = 10 - c l
da cui
-log10 T = A (cioè log10 1/T =
A)
quindi, A = c l (Legge di Lambert-Beer)
C rappresenta la concentrazione del cromoforo espressa in moli/litro (M).
l è il cammino ottico (cm)
è il coefficiente di estinzione molare e coincide con l’A (in Densità Ottiche, OD) di
una soluzione 1 M della sostanza in esame quando viene letta in una cuvetta con
cammino ottico uguale ad 1 cm ad una determinata lunghezza d’onda. E’ evidente
che il coefficiente di estinzione molare lo si può calcolare solo se è disponibile il
valore del peso molecolare. Quando, soprattutto nel caso di macromolecole come le
proteine e gli acidi nucleici, non è disponibile il peso molecolare si fa uso di un altro
parametro, il coefficiente di estinzione percentuale che indica l’assorbimento di una
soluzione all’ 1% della sostanza in esame.
La legge di Lambert-Beer è l’equazione di una retta
passante per l’origine degli assi (A sulle y e C sulle x) in cui
l è il coefficiente angolare. La proporzionalità tra A e C
(entro un certo intervallo) consente misure quantitative.
ESERCITAZIONE
Calcolo della concentrazione della soluzione di BSA sapendo che il coefficiente di
estinzione percentuale a 280 nm è di 6,75 O.D.
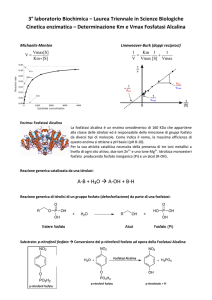
Il dosaggio di un enzima: la fosfatasi alcalina
La concentrazione degli enzimi viene determinata attraverso il dosaggio della loro
attività catalitica e viene espressa in termini di Unità Enzimatiche: 1 Unità è la
quantità di enzima che catalizza la trasformazione di 1 mole di Substrato in
Prodotto, in 1 min, a 25 °C, in condizioni di pH e forza ionica ottimali.
Il calcolo della quantità di Substrato che scompare nel tempo della reazione, o il
calcolo della quantità di Prodotto che si forma nel tempo della reazione consentono
parimenti di dosare un enzima. Se il Substrato o il Prodotto dell’enzima sono
cromofori, la spettrofotometria consente di dosare facilmente l’enzima.
Le fosfatasi (numero EC 3.1.3) sono una classe di idrolasi che catalizzano la
reazione di rimozione di gruppi fosfato (defosforilazione). A seconda del pH
ottimale di reazione, si distinguono la fosfatasi alcalina e la fosfatasi acida. La
fosfatasi alcalina è presente in procarioti ed eucarioti; nei mammiferi, forme
isoenzimatiche tessuto-specifiche hanno importanza diagnostica (si distinguono per
carica netta, sensibilità ad inibitori e al riscaldamento). L’enzima della mucosa
intestinale bovina utilizzato per l’esperienza è un omodimero di 70 kDa.
Per il dosaggio della fosfatasi alcalina si utilizza un Substrato sintetico, il pnitrofenilfosfato (incolore) che l’enzima trasforma in un Prodotto giallo, il pnitrofenolo.
ESERCITAZIONE
Dosaggio dell’attività della fosfatasi alcalina al variare del pH
Allestiamo in cuvette di plastica le miscele di reazione che differiscono per il valore
del pH della soluzione tampone. La concentrazione di Enzima è la stessa in tutte le
miscele e la concentrazione del Substrato è tale da saturare l’enzima: dunque, la
velocità della reazione varia unicamente per il pH.
Subito dopo l’aggiunta dell’enzima si agita con Parafilm e si segue in continuo
l’aumento di assorbanza a 405 nm (lettura contro aria) a temperatura ambiente. Il
A/min diviso per l’ del p-nitrofenolo (18,2 densità ottiche) dà le moli di P
formate per min, cioè le Unità contenute nel volume di campione usato per il
dosaggio.
Tampone
Tris-HCl 0,1 M, pH 7
500 l
Tris-HCl 0,1 M, pH 8
500 l
Glicina-NaOH 0,1 M, pH
9
500 l
Glicina-NaOH 0,1 M, pH
10 500 l
Glicina-NaOH 0,1 M, pH
12 500 l
Substrato 25 Acqua (a
A/min unità
mM
1 ml)
Enzima
470
30 l
5 l
l
30 l
470 l 5 l
30 l
470 l
5 l
30 l
470 l
5 l
30 l
470 l
5 l