Titolo: Studio di processi innovativi per la produzione di fruttosio
Premessa
Grazie alle proprie caratteristiche di dolcificante il fruttosio sta emergendo nel mondo
dei dolcificanti in competizione con un prodotto consolidato come il saccarosio. A
differenza di questo, però, il fruttosio non provoca problemi riguardanti l’obesità, la
carie dentale, l’arterosclerosi e il diabete [1].
Nonostante abbia un elevato potere dolcificante, pari a circa due volte quello del
saccarosio [2], il fruttosio non gode di una vasta espansione commerciale a causa
dell’elevato costo di produzione. Ad oggi esso viene prodotto principalmente
partendo da amido attraverso tre stadi che si concludono con l’isomerizzazione
enzimatica del glucosio [3, 4]. Tuttavia, questo processo soffre di uno sfavorevole
equilibrio termodinamico [5], a causa del quale lo sciroppo ottenuto contiene solo il
42% in fruttosio e il 50% di glucosio. Esistono tecniche di concentrazione per
aumentare il contenuto in fruttosio nello sciroppo, ma gravano pesantemente sui costi
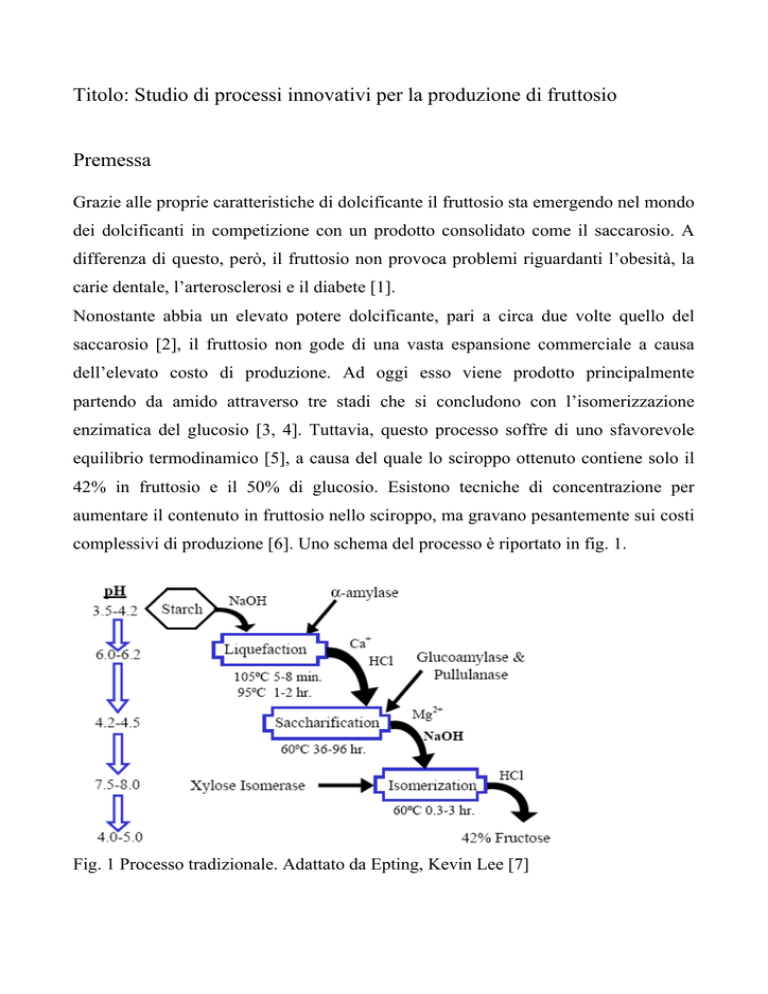
complessivi di produzione [6]. Uno schema del processo è riportato in fig. 1.
Fig. 1 Processo tradizionale. Adattato da Epting, Kevin Lee [7]
Una nuova tecnica è oggetto di ricerca negli ultimi anni: la produzione di fruttosio
per idrolisi dell’inulina da parte dell’enzima inulinasi; l’assenza di limitazioni
termodinamiche e la possibilità di ottenere concentrazioni di fruttosio del 95% [8]
con un solo stadio di reazione e senza successive concentrazioni rendono questo
processo molto promettente.
In questo programma di ricerca si intende indagare gli aspetti che caratterizzano
questo processo allo scopo di potenziarne quelle fasi che risultano cruciali nel
contesto dei costi di produzione. In particolare si condurrà uno studio cinetico della
reazione, uno studio della disattivazione dell’enzima, si metteranno in atto tecniche di
immobilizzazione dell’enzima finalizzate a un più razionale utilizzo delle sue
potenzialità e infine si analizzeranno le prestazioni di reattori enzimatici in cui sarà
condotta la suddetta reazione.
Stato della ricerca internazionale
Un ipotetico processo industriale per la produzione di fruttosio avrebbe come materia
prima grezza un vegetale come la cicoria, la quale è nota per avere un elevato
contenuto di inulina. Partendo dal primo livello, la coltivazione della cicoria, il
processo potrebbe essere suddiviso in diverse fasi, raggruppabili in tre stadi
principali: il primo stadio è quello propriamente agricolo, svolto al di fuori del sito
produttivo e pertanto indicato come “esterno”; il secondo è uno stadio di “pretrattamento” della materia prima; l’ultimo è il cuore del processo, quello in cui si
realizza la trasformazione dell’inulina in fruttosio. Lo schema in fig. 2 mette in
evidenza ciascuna fase.
Coltivazione della cicoria
↓
Esterno
Raccolta cicoria
↓
Trasporto allo stabilimento
↓
Stoccaggio cicoria
↓
Prelavaggio
↓
Dissabbiatura, spietratura
↓
Pre-trattamento
Tagliatura
↓
Estrazione inulina
↓
Filtrazione
↓
Reazione di idrolisi
↓
Trasformazione
Purificazione dei prodotti
↓
Immagazzinamento
Fig. 2 Possibile schema di processo per la produzione di fruttosio
La ricerca internazionale sulla produzione di fruttosio da inulina negli ultimi venti
anni si è sviluppata attorno al punto cardine del processo, quello relativo alla
trasformazione della materia prima in fruttosio. Gli altri stadi infatti sono semplici
trattamenti fisici già consolidati in altre applicazioni dell’industria dei dolcificanti.
In particolare, sono stati pubblicati diversi lavori sullo studio dell’inulina come
reagente del processo, sullla produzione e la caratterizzazione dell’enzima inulinasi
(catalizzatore) e sull’utilizzo dell’enzima nella reazione di idrolisi condotta in reattori
di diverso tipo.
Per quanto riguarda l’inulina, lo stato della ricerca può ritenersi piuttosto avanzato
essendo ben note le fonti vegetali [9] da cui essa può essere estratta e le sue
caratteristiche come substrato per la reazione di idrolisi (grado di polimerizzazione
[9] e di ramificazione [10] della molecola e sua solubilità in acqua [11]).
La complessità delle problematiche riguardanti l’enzima inulinasi fa sì che,
nonostante le molteplici pubblicazioni, sull’argomento ci sia ancora molto da fare.
L’enzima è stato purificato da diversi micro-organismi e una vasta gamma di fonti è
nota [1, 12]; tuttavia la ricerca di un micro-organismo che produca inulinasi con
caratteristiche che la rendano appetibile economicamente è ancora in corso. Per
quanto riguarda la caratterizzazione dell’attività catalitica dell’enzima, si sa che esso
può attaccare in due modi il substrato: alla coda della molecola di inulina (exoinulinasi) oppure in una zona centrale (endo-inulinasi) [6, 13]; inoltre, questo enzima
spesso presenta una attività idrolitica nei confronti del saccarosio [12]. L’effetto della
temperatura e del pH è stato indagato su inulinasi di diversa provenienza microbica
con la determinazione delle condizioni operative ottimali [5, 13, 14, 15], ma sono
isolati i casi in cui tale caratterizzazione è sufficiente per conoscere le performance
dell’enzima su una larga scala temporale; infatti generalmente non si conosce la
cinetica di disattivazione dell’enzima in diverse condizioni di temperatura e pH e ciò
non consente un utilizzo razionale delle potenzialità dello stesso. Anche la
determinazione dei parametri cinetici della reazione non è quasi mai esauriente,
spesso mancando addirittura la proposta di un modello cinetico completo.
L’esistenza di alcuni inibitori dell’attività catalitica dell’inulinasi è nota [16, 17], così
come gli effetti della variazione delle concentrazioni di substrato e delle sue proprietà
fisiche [17].
L’enzima è stato immobilizzato su diversi supporti e la sua attività è stata determinata
in diverse condizioni di temperatura e pH [3, 8, 18, 19], ma restano da ricercare
migliori tecniche di immobilizzazione che siano semplici da eseguire e che diano
buoni risultati in termini di attività dell’enzima. Inoltre la caratterizzazione cinetica
dell’inulinasi immobilizzata è ancora ai primi passi e molto si può fare in questo
ambito.
L’enzima inulinasi è stato impiegato, sia in forma libera sia immobilizzato, in reattori
da laboratorio per l’idrolisi dell’inulina. Sono state condotte sia operazioni batch con
enzima libero [5, 14] e immobilizzato [6, 8] che operazioni continue con enzima
immobilizzato in reattori a letti fisso [18, 19]. Manca una modellazione matematica
dei fenomeni di trasporto che si realizzano in questi dispositivi; ciò non consente di
prevedere le loro prestazioni in diverse condizioni operative e di utilizzare al meglio
l’attività catalitica dell’enzima.
Alla luce dell’attuale stato della ricerca, il presente programma prevede di studiare
più approfonditamente la cinetica della reazione enzimatica e di determinare un
modello cinetico completo che terrà conto degli effetti di disattivazione dell’enzima;
questo sarà lo strumento per una più profonda conoscenza del processo e consentirà
di migliorarlo ottimizzando la prestazione dei dispositivi in cui si condurrà la
reazione.
Obiettivi
L’obiettivo generale del progetto di ricerca è quello di coprire alcuni degli aspetti,
relativi all’enzima e alle sue applicazioni, ancora poco studiati, allo scopo di offrire
alla ricerca in questo ambito gli strumenti per potere usufruire pienamente delle
potenzialità della reazione di idrolisi enzimatica dell’inulina.
Gli obiettivi intermedi sono i seguenti:
- caratterizzazione cinetica dell’enzima libero;
- determinazione della cinetica di disattivazione;
- determinazione della temperatura ottimale di esercizio basata sull’intera “vita” del
catalizzatore;
- immobilizzazione dell’enzima su membrana;
- studio delle cinetiche di reazione e di disattivazione dell’enzima immobilizzato;
- ottimizzazione delle prestazioni di reattori enzimatici a membrana.
Programma di ricerca
Per conoscere o prevedere la risposta in termini di attività enzimatica alle diverse
condizioni in cui l’enzima può essere adottato in un processo industriale, è necessario
costruire un apparato modellistico che tenga conto di tutti i principali fenomeni che si
realizzano all’interno il processo. Il primo passo consiste nel determinare l’equazione
cinetica della reazione di idrolisi dell’inulina catalizzata da un enzima inulinasi
proveniente da un micro-organismo scelto in base a criteri di resa nella produzione
dell’enzima. Come nello studio di qualunque fenomeno reattoristico, la conoscenza
dell’equazione cinetica pone le basi per la previsione e il controllo dell’andamento
della reazione in esame, nonché per la scelta delle condizioni operative ottimali. In
questa prima fase si cercherà la dipendenza della velocità di reazione dalla
concentrazione di substrato, ma anche dalla temperatura e dal pH di esercizio.
L’opportunità di utilizzare in un processo industriale un enzima piuttosto che un altro
è dettata anche dalla durata della “vita” dei diversi enzimi in varie condizioni.
Pertanto si studieranno le modalità con cui avviene la disattivazione e le relative
cause e si cercherà un modello matematico che descriva la caduta dell’attività
enzimatica nel tempo; particolare attenzione sarà dedicata alla disattivazione termica
dell’enzima. La conoscenza della cinetica di disattivazione insieme con l’equazione
cinetica permette di stabilire le migliori condizioni in cui far avvenire la reazione, sia
sotto l’aspetto della velocità di reazione, ma anche dal punto di vista della durata
dell’attività enzimatica. Molto spesso negli studi precedenti vengono determinate le
condizioni operative ottimali tenendo conto dei soli effetti reversibili della
disattivazione, in altre parole osservando il comportamento dell’enzima su brevi
intervalli di tempo. Tuttavia, nell’intenzione di condurre l’idrolisi enzimatica
dell’inulina a fruttosio verso uno sviluppo come processo industriale, non si può
pensare di utilizzare l’enzima solo per “brevi periodi”, ma bisogna sfruttarlo fin tanto
che esso è capace di esercitare una sufficiente attività idrolitica; nel fare ciò gli effetti
irreversibili della disattivazione non possono essere trascurati. L’obiettivo ultimo
della prima parte del presente programma di ricerca è quello di determinare il valore
ottimo di temperatura su più cicli di reazione batch e la durata di ciascun ciclo.
Dati i promettenti risultati che l’immobilizzazione di enzimi sta offrendo in diverse
applicazioni di bio-ingegneria, la seconda parte di questo progetto sarà dedicata
all’applicazione di tecniche di immobilizzazione e allo studio delle caratteristiche
dell’inulinasi immobilizzata. Anche in questo caso, come per l’enzima allo stato
nativo, l’approccio vuole essere esaustivo, in grado di offrire tutti gli strumenti per
condurre al meglio un dispositivo in cui si usi l’enzima immobilizzato come
catalizzatore.
L’enzima inulinasi sarà immobilizzato su membrana e in questa forma saranno
caratterizzate la sua cinetica di reazione e quella di disattivazione; esperimenti batch
analoghi a quelli previsti per l’enzima libero saranno effettuati. Sarà costruito un
apparato sperimentale per studiare le prestazioni di un reattore enzimatico a
membrana. Un modello matematico dei fenomeni di trasporto che si realizzano nel
reattore sarà creato e confrontato con i dati sperimentali; seguirà una ottimizzazione
delle prestazioni del dispositivo.
Per l’acquisizione delle tecniche di immobilizzazione di enzimi su supporti solidi è
previsto un periodo di studio presso una sede specializzata in questo settore.
Il presente programma di ricerca avrà come esito la produzione di almeno due
pubblicazioni scientifiche, uno sulla prima parte del programma concernente gli
enzimi allo stato nativo e l’altro recante i risultati degli studi sugli enzimi
immobilizzati, da proporre all’attenzione di riviste scientifiche e di convegni
internazionali.
La sequenza delle attività che compongono il programma è mostrata in fig. 4 in un
diagramma di Gantt, tipicamente utilizzato per la pianificazione e la valutazione di
programmi di attività complesse.
DIAGRAMMA DI GANTT
Scelta dell’enzima e purificazione
stato nativo
stato nativo
Determinazione cinetica di reazione
stato nativo
Dipendenza della velocità di reazione (v) da T e pH
stato nativo
Studio prestazioni batch su larga scale temporale
e.imm
Scelta e acquisto della membrana
enzima immobilizzato
Immobilizzazione
e.imm.
Dipendenza di v dalla concentrazione di substrato
e.imm.
Dipendenza di v da T e pH
e.imm.
Studio della disattivazione dell' enzima
enzima imm.
Ottimizzazione prestazioni dispositivi a membrana
tempo [mesi]
1
2
3
4
5
6
7
8
9
10
11
12
Fig. 4 Diagramma di Gantt. Bianco: studio dell'enzima allo stato nativo; giallo: enzima immobilizzato.
Riferimenti bibliografici
[1]
Vandamme, E.J. and
D.G. Derycke, 1983. Microbial inulinases: fermentation process, properties and
applications. Adv. Appl. Microbiol., 29: 139-176.
[2]
Fleming, S. E. and GrootWassink, J. W. D.: Preparation of high-fructose syrup from the tubers of the Jerusalem
artichoke (Helianthus tuberosus L.). CRC Crit. Rev. Food Sci. Nutr., 12, l-28 (1979).
[3]
Gupta AK, Kaur M, Kaur N and Singh R, A comparison of properties of inulinases of Fusarium oxysporum
immobilized on various supports. J Chem Technol Biotechnol 53:293.296 (1992).
[4]
Curcio S., Calabrò V., Iorio G., Isomerization of glucose in syrup al high content of fructose with immobilized
enzyme. Presented at the fourth conference ENGINEERING WITH MEMBRANES: Medical and Biological
Applications, Camogli, Italy, 15-18 May 2005.
[5]
Zittan, L.: Enzymatic hydrolysis of inulin-an alternative way to fructose production. Starch, 33, 373-377 (1981).
[6]
Kochhar A., Gupta A.K. and Kaur N. Purification and immobilisation of inulinase from Aspergillus candidus for
producing fructose. Journal of the Science of Food and Agriculture 79:549.554 (1999)
[7]
Epting K. L., Biochemical, Biophysical, and Biotechnological Studies of Class II Xylose Isomerases from
Hyperthermophilic Thermotoga Species. Tesi di dottorato. 2004
[8]
Rhee, S. K., Kim, C. H.: Fructose production from Jerusalem artichoke by inulinase immobilized on chitin.
Biotechnol. Lett., 11, 201-206 (1989).
[9]
Franck A., De Leenheer L., Inulin. Polysaccharides II: Polysaccharides from Eukaryotes, Eds: S. De Baets, E.
Vandamme and A. Steinbüchel in Biopolymers A. Steinbüchel, Wiley-VHC 2004.
[10]
De Leenheer L., Hoebregs H. Progress in the elucidation of the composition of chicory inulin. Starch
1994;46:193-196
[11]
Phelps C. F., The Physical Properties of Inulin Solutions, Biochem. J. (1965) 95, 41.
[12]
Pandey A., Soccol C.R., Selvakumar P., Soccol V.T., Krieger N., Fontana J.D. Recent developments in
microbial inulinases. Appl. Biochem. Biotechnol., 81: 35-52. 1999b
[13]
Ettalibi, M. and J.C. Baratti, 1990. Molecular and kinetic properties of Aspergillus ficuum inulinase. Agric. Biol.
Chem., 54: 61-68.
[14]
Derycke, D.G. and E.J. Vandamme, 1984. Production and properties of Aspergillus niger inulinase. J. Chem.
Tech. Biotechnol., 34B: 45-51.
[15]
Arand M., Golubev A. M. et al. Purification, characterization, gene cloning and preliminary X-ray data of the
exo-inulinase from Aspergillus awamori Biochem. J. (2002) 362, 131-135
[16]
Kaur N, Gupta AK, Singh DP and Singh R, Production purification and immobilisation of inulinase from
Kluyveromyces fragilis. J Chem Technol Biotechnol 59:377.385 (1994).
[17]
Focher B., Marzetti A., Carniiti P., Beltrame P.L., Guardione D., Hydrolysis of inulin: A kinetic study of the
reaction catalyzed by an inulinase from Aspergillus ficuum. Biotechnology and Bioengineering Volume 37, Issue
6, 1991. Pages 575-579
[18]
Ogata Y., T. Nakamura, A. Shitara, A. Nakamura, K. Ohta. Continuous Production of Fructose Syrups from
Inulin by Immobilized Inulinase from Aspergillus niger Mutant 817. Journal of Fermentation and Bioengineering
Vol. 80, No. 2, 164-169. 1995
[19]
Wenling W., Huiying W.W.L., Shiyuan W. Continuous preparation of fructose syrups from Jerusalem artichoke
tuber using immobilized intracellular inulinase from Kluyveromyces sp. Y-85. Process Biochemistry 34 (1999)
643–646.
Firma del Direttore del Dipartimento
di Ingegneria Chimica e dei Materiali
______________________________












