Principi di genetica - Robert J. Brooker
Copyright © 2010 – The McGraw-Hill Companies srl
SOLUZIONI AI PROBLEMI DEL CAPITOLO 22
Domande Concettuali
C1. I caratteri recessivi legati all’X si distinguono dagli altri due per la loro prevalenza nei maschi. I
caratteri dominanti legati all’X (che sono estremamente rari) vengono sempre trasmessi da padre in
figlia e mai da padre in figlio. I caratteri autosomici recessivi e dominanti si distinguono
principalmente grazie alla modalità di trasmissione dai parentali alla progenie. Un individuo con un
carattere dominante possiede di solito un genitore affetto, a meno che questo carattere non sia
dovuto alla presenza di una nuova mutazione o non si abbia penetranza incompleta. Inoltre, due
genitori affetti possono avere dei figli sani, cosa che non è attesa per i caratteri recessivi. Nel caso
dei caratteri recessivi rari, i bambini affetti di solito possiedono genitori sani.
C2. Quando un allele che causa una malattia influisce su un carattere, questo causa una deviazione
dalla normalità, ma il gene coinvolto non è solitamente l’unico gene che governa il carattere. Per
esempio, l’allele che causa l’emofilia impedisce il corretto funzionamento della via normale della
coagulazione del sangue. Questo allele segue la modalità di trasmissione mendeliana semplice in
quanto un singolo gene influisce sul fenotipo. Comunque, è noto che la normale coagulazione del
sangue è dovuta al contributo di molti geni.
C3. L’eterogeneità di locus si riferisce al fenomeno per cui un particolare tipo di malattia può essere
causata da delle mutazioni di geni diversi. L’emofilia e la talassemia ne costituiscono due esempi.
L’eterogeneità di locus può confondere l’analisi del pedigree poiché gli alleli dei diversi geni che
causano la stessa malattia possono essere ereditati con diverse modalità. Per esempio, esistono sia
forme di emofilia autosomiche che legate all’X. Se un pedigree contiene degli individui con
entrambi i tipi di alleli, i dati non sarebbero coerenti né con il modello di ereditarietà autosomico né
con quello legato all’X.
C4. Delle modificazioni nel numero di cromosomi e delle variazioni sbilanciate nella struttura
cromosomica tendono a influire sul fenotipo in quanto creano uno sbilanciamento dell’espressione
genica. Per esempio, nella sindrome di Down, ci sono tre copie del cromosoma 21 e, pertanto, tre
copie di tutti i geni presenti sul cromosoma 21. Questo comporta un relativo aumento
dell’espressione dei geni che sono localizzati sul cromosoma 21 rispetto agli altri cromosomi. Le
traslocazioni bilanciate e le inversioni spesso si manifestano senza conseguenze fenotipiche in
quanto la quantità totale del materiale genetico non viene alterata e il livello dell’espressione genica
non viene modificato significativamente.
C5. A. Falso. Gli alleli dominanti necessitano dell’eredità di una sola copia, mentre gli alleli legati
all’X di una sola copia nei maschi.
B. Vero.
C. Vero.
D. Falso. In molti casi, è difficile valutare i contributi relativi dovuti alla genetica e all’ambiente. In
alcuni casi, tuttavia, l’ambiente sembra essere più importante. Per esempio, nella fenilchetonuria,
una dieta povera di fenilalanina preverrà i sintomi nocivi, anche se l’individuo è omozigote per gli
alleli mutanti.
C6. Vi sono molte risposte possibili; qui ne riportiamo alcune. Il nanismo insorge sia nell’uomo che
nei cani. Razze come il bassotto ed il Basset Hound rappresentano delle tipologie di nanismo nei
cani. Esistono sia persone che topi diabetici. Vi sono forme ereditarie di obesità sia nell’uomo che
nei topi. La displasia dell’anca è presente sia nell’uomo che nei cani.
Principi di genetica - Robert J. Brooker
Copyright © 2010 – The McGraw-Hill Companies srl
C7. L’età di insorgenza di una malattia genetica spesso coincide con una particolare fase dello
sviluppo. Durante tutta la vita di un individuo, da quella embrionale a quella adulta, l’espressione
genica subisce dei cambiamenti. Alcuni geni vengono accesi solo durante le fasi embrionali, altri
vengono accesi durante le fasi fetali, altri alla nascita, altri nell’adolescenza, ecc. Un individuo che
porta un gene mutante può non manifestare alcun disturbo fino al momento della vita in cui si
suppone che il gene venga espresso. Per esempio, molte malattie genetiche si manifestano dopo la
nascita. Prima della nascita, un individuo può svilupparsi correttamente e nascere sano. Dopo la
nascita, il bambino inizia una nuova fase di sviluppo e, a questo punto, possono venire attivati dei
nuovi geni. Se una o entrambe le copie di un gene che viene attivato alla nascita sono mutanti, ciò
potrebbe causare una malattia grave, con un’età di insorgenza legata all’infanzia. Una malattia
infettiva probabilmente non si manifesta con una particolare età di insorgenza, poiché le persone
potrebbero essere esposte all’agente infettivo in qualsiasi momento della loro vita. Pertanto, la
maggioranza delle malattie infettive non è associata a un’età di insorgenza prevedibile, sebbene
alcune di esse siano più comuni nei bambini e nelle persone anziane.
C8. A. Dato che un individuo deve ereditare due copie difettose di questo gene, noto per essere
localizzato sul cromosoma 1, la modalità di trasmissione è autosomica recessiva. Entrambi i
membri di questa coppia devono essere eterozigoti, in quanto possiedono un genitore affetto (che
deve aver trasmesso loro l’allele mutante) e i loro fenotipi sono sani (quindi devono aver ricevuto
l’allele normale dall’altro genitore). Dato che entrambi i genitori sono eterozigoti, vi è ¼ di
probabilità di generare un figlio affetto dalla malattia di Gaucher (un omozigote). Se raffiguriamo
con G l’allele non mutante e con g l’allele mutante:
B. Da questo quadrato di Punnett, possiamo anche osservare che c’è ¼ di probabilità di produrre un
omozigote con entrambe le copie del gene normale.
C. Abbiamo bisogno di applicare l’espansione binomiale per risolvere questo problema (vedi il
Capitolo 2 per la descrizione di questa equazione). In questo problema, n = 5, x = 1, p = 0,25, q =
0,75. La risposta è 0,396 o il 39,6%.
C9. In questo pedigree ogni membro affetto ha un genitore affetto (tranne I-1, la cui genealogia è
sconosciuta). Inoltre, la malattia colpisce sia i maschi che le femmine. Pertanto, questo andamento
suggerisce una modalità di trasmissione autosomica dominante. Non può essere esclusa una
trasmissione di tipo recessivo, ma ciò è improbabile poiché questa è una malattia rara e sarebbe
estremamente improbabile che gli individui non consanguinei presenti in questo pedigree (cioè I-2,
II-1, II-7, III-4 e III-5) fossero tutti dei portatori eterozigoti.
C10. La modalità di trasmissione è autosomica recessiva. Nessun individuo colpito dalla malattia ha
genitori affetti. Inoltre, la malattia è presente sia negli uomini che nelle donne. Se fosse recessiva
legata all’X, l’individuo III-1 avrebbe il padre affetto, cosa che non si osserva.
Principi di genetica - Robert J. Brooker
Copyright © 2010 – The McGraw-Hill Companies srl
C11. Dato che entrambi i membri di questa coppia sono fenotipicamente sani e hanno due figli che
manifestano la malattia, la madre deve essere una portatrice eterozigote, mentre il padre possiede un
allele normale (vedi il seguente quadrato di Punnett).
Normale
Normale
Portatore
Vi è una probabilità del 50% che la loro figlia sia una portatrice, e in tal caso vi è una probabilità
del 50% che essa trasmetta l’allele mutante ai suoi figli. Quindi, se moltiplichiamo 0,5 per 0,5,
questo darà un valore di 0,25 ossia 25%. Ciò significa che vi è una probabilità del 25% che se la
donna avrà un figlio maschio, questo risulterà affetto. Un’altra modalità per interpretare questo
calcolo, tuttavia, è di considerare che questa femmina potrà dare alla luce dei figli maschi o
femmine. Quando partorirà, vi è una probabilità del 25% di dare alla luce un figlio maschio affetto
dalla malattia di Fabry, se è una portatrice. Se facciamo i calcoli sulla base di questa prospettiva, la
probabilità di questa femmina di avere un figlio affetto è di 0,5 per 0,25, pari a 0,125, ossia 12,5%.
In altre parole, vi è una probabilità del 12,5% che questa femmina dia alla luce un figlio maschio
affetto, ogni volta che avrà un figlio.
C12. I 13 bambini hanno acquisito una nuova mutazione. In altre parole, durante la spermatogenesi
o l’oogenesi, o dopo che l’uovo è stato fecondato, è insorta una nuova mutazione nel gene del
fattore di crescita dei fibroblasti. Questi 13 individui hanno la stessa probabilità di trasmettere
l’allele mutante alla loro progenie, come i 18 individui che hanno ereditato l’allele mutante da un
genitore. La probabilità è del 50%.
C13. Sulla base di questo pedigree, sembra essere un carattere recessivo legato all’X (che è ciò che
è noto). Tutti i membri affetti sono maschi che avevano genitori sani. Considerando questo pedigree
da solo, non si poteva escludere una modalità autosomica recessiva, ma questa è meno probabile
poiché non ci sono femmine affette.
C14. Dato che questo è un carattere dominante, la madre deve avere due copie normali del gene ed
il padre (che è affetto) molto probabilmente è eterozigote (nota: il padre potrebbe essere omozigote,
ma questo è estremamente improbabile perché l’allele dominante è molto raro). Se raffiguriamo con
M l’allele mutante di Marfan e con m l’allele normale, può essere costruito il seguente quadrato di
Punnett:
Principi di genetica - Robert J. Brooker
Copyright © 2010 – The McGraw-Hill Companies srl
A. C’è il 50% di probabilità che questa coppia abbia un figlio affetto.
B. Usiamo la regola del prodotto. La probabilità di avere un figlio sano è del 50%. Quindi se
moltiplichiamo 0,5 x 0,5 x 0,5 questo equivale a 0,125, o al 12,5% di probabilità di avere tre figli
non affetti.
C15. A. La modalità di trasmissione è autosomica recessiva. Tutti gli individui colpiti hanno
genitori non affetti. Inoltre, la malattia colpisce sia i maschi che le femmine. Se fosse recessiva
legata all’X, l’individuo III-1 avrebbe dovuto avere un padre affetto, cosa che non si verifica.
B. Se la malattia fosse autosomica recessiva, gli individui II-1, II-2, II-6 e II-7 dovrebbero essere
dei portatori eterozigoti poiché hanno progenie affetta. Dato che gli individui II-2 e II-6 sono
eterozigoti, anche uno dei loro genitori (I-1 o I-2) deve essere un portatore. Dato che questa è una
malattia rara, potremmo assumere che solo uno di essi (I-1 o I-2) sia un portatore. Pertanto, vi è una
probabilità del 50% che II-3, II-4 e II-5 siano anch’essi eterozigoti.
C16. Il prione è una proteina che si comporta come un agente infettivo. La forma infettiva della
proteina prionica ha una conformazione anomala. Questa conformazione viene denominata PrPSc
mentre la conformazione normale viene definita PrPC. Un individuo può essere “infettato” dalla
conformazione anomala della proteina ingerendo delle parti di un altro animale colpito dalla
malattia oppure la proteina prionica può essere convertita spontaneamente a partire dalla
conformazione normale. La proteina prionica nella conformazione PrPSc può legarsi alla proteina
nella conformazione PrPC e convertirla nella forma PrPSc. Un’accumulo dei prioni nella forma PrPSc
è la causa dei sintomi della malattia.
C17. La risposta esatta a questa domanda in realtà non è nota. Tuttavia, possiamo formulare delle
possibili spiegazioni sulla base del meccanismo molecolare della malattia. La proteina prionica può
esistere nella conformazione PrPSc, che è la conformazione anomala che può convertire la proteina
normale (PrPC) nella forma PrPSc. Nelle persone colpite dalla malattia di Gerstmann-StrausslerScheinker, la proteina prionica si trova in modo predominante nella conformazione PrPC, e può
essere convertita nella forma PrPSc con un tasso molto basso. Una possibilità consiste nel fatto che
la conversione alla forma PrPSc non si verifica molto spesso nelle cellule delle persone più giovani.
Questa seconda spiegazione assomiglia al gioco “acchiapparella”, in cui la persona designata
insegue e può “acchiappare” qualcuno, e quindi anche la persona che è stata catturata può inseguire
e “acchiappare”. Inizialmente, potrebbero giocare migliaia di persone e la persona designata che
“acchiappa” potrebbe essere lenta nel raggiungere le altre. Tuttavia, una volta che questa persona
“acchiappa“ qualcuno, vi sono due persone che inseguono e possono “acchiappare” altre due
persone, e in seguito quattro persone che “acchiappano”. Inizialmente il numero di persone che
inseguono sarà basso e aumenterà abbastanza lentamente. Tuttavia, una volta raggiunto un numero
Principi di genetica - Robert J. Brooker
Copyright © 2010 – The McGraw-Hill Companies srl
considerevole di persone che “acchiappano”, diventa difficile per le persone che non sono state
ancora raggiunte sfuggire alla cattura. A questo punto, il numero delle persone che non sono state
“acchiappate” diminuisce rapidamente. Questa stessa analogia può essere applicata alla proteina
prionica. Inizialmente, quando la concentrazione di PrPSc è bassa, la maggior parte delle proteine
con conformazione PrPC può evitare un’interazione con PrPSc. Tuttavia, una volta che la
concentrazione di PrPSc diventa elevata, ciò diventa più difficile, e tutte le proteine PrPC saranno
convertite rapidamente (in maniera esponenziale).
C18.
A. Ricorda che un cambiamento conformazionale è un processo graduale. Questo inizia in una
regione della proteina ed implica una serie di piccole modificazioni nella struttura proteica. L’intero
cambiamento conformazionale da PrPC a PrPSc probabilmente implica molte piccole modificazioni
che insorgono in maniera graduale. Forse il cambiamento conformazionale (da PrPC a PrPSc) inizia
nelle vicinanze della posizione 178 e poi procede lungo il resto della proteina. Se nella posizione
129 è presente una metionina, può avvenire la completa modificazione conformazionale (da PrPC a
PrPSc). Tuttavia, forse la valina in posizione 129 blocca in qualche modo uno dei passaggi necessari
al completo cambiamento conformazionale.
B. Una volta che la modificazione conformazionale PrPSc è completata, la proteina PrPSc può legarsi
a un’altra proteina prionica nella conformazione PrPC. Forse questa inizia a essere convertita (nella
conformazione PrPSc) con l’inizio di un piccolo cambiamento nella struttura proteica nelle vicinanze
della posizione 178. La conversione poi procede in modo graduale fino al raggiungimento della
conformazione PrPSc. Se nella posizione 129 è presente una valina, questo potrebbe in qualche
modo inibire uno dei passaggi necessari al completo cambiamento conformazionale. Se un
individuo possiede la Val-129 nel polipeptide codificato dal secondo gene PrP, la metà delle sue
proteine prioniche saranno meno sensibili alla conversione da parte di PrPSc rispetto agli individui
che hanno la Met-129. Questo spiegherebbe il motivo per cui degli individui con la Val-129
presente in metà delle loro proteine prioniche mostrano i sintomi della malattia, la quale progredisce
più lentamente.
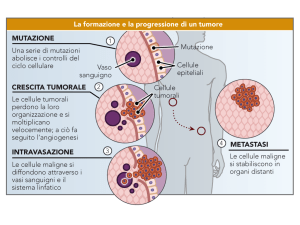
C19. Un oncogene per causare il cancro viene attivato in maniera anormale, mentre un gene
oncosoppressore provoca un tumore se viene inattivato. Ras e src costituiscono degli esempi di
oncogeni, mentre Rb e p53 sono dei geni oncosoppressori.
C20. Un proto-oncogene è un normale gene cellulare che solitamente svolge un ruolo nella
divisione cellulare. Questo può venire alterato da una mutazione che lo rende un oncogene e in
questo modo può causare il cancro. A livello proteico, un proto-oncogene può diventare un
oncogene attraverso la sintesi eccessiva di una proteina oppure sintetizzando la stessa quantità di
proteina, che risulta essere attiva in maniera anomala.
C21. Un oncogene retrovirale è un gene localizzato nel genoma di un retrovirus che causa il cancro.
Questo gene non è necessario per l’infezione virale e la proliferazione. Dei ceppi virali difettosi per
l’oncogene sono in grado di infettare le cellule e di moltiplicarsi normalmente. Si pensa che i
retrovirus abbiano acquisito degli oncogeni a causa del loro ciclo vitale. Può accadere che un
retrovirus si integri accanto a un proto-oncogene cellulare. Successivamente durante il suo ciclo
vitale, esso può trascrivere questo proto-oncogene e in questo modo inserirlo nel proprio genoma
virale. L’elevato numero di copie del virus o delle mutazioni supplementari possono portare alla
sovraespressione del proto-oncogene e in questo modo provocare il cancro.
C22. La predisposizione allo sviluppo del cancro viene trasmessa in maniera dominante poiché
l’eterozigote mostra un predisposizione più elevata. L’allele mutante è effettivamente recessivo a
Principi di genetica - Robert J. Brooker
Copyright © 2010 – The McGraw-Hill Companies srl
livello cellulare. Ma dato che possediamo così tante cellule nel corpo, diventa relativamente poco
probabile che una mutazione difettiva insorga nel singolo gene normale e che porti allo sviluppo di
una cellula tumorale. Alcuni individui eterozigoti possono non sviluppare la malattia per effetto del
caso. Essi possono essere fortunati e non avere acquisito la mutazione difettiva nel gene normale,
oppure il loro sistema immunitario è efficace nel distruggere le cellule tumorali, una volta che
queste insorgono.
C23. La conversione di un proto-oncogene in un oncogene può derivare dalla presenza di mutazioni
di senso, di amplificazioni geniche, di traslocazioni cromosomiche e di un’integrazione virale.
Esempi di ciascuna modificazione sono riportati nella Tabella 22.8. Ci si aspetta che delle
modificazioni genetiche aumentino la quantità della proteina codificata o alterino la sua funzione in
modo tale da renderla più attiva.
C24. Se un oncogene è stato ereditato, questo può causare una crescita cellulare incontrollata nella
fase precoce dello sviluppo e portare in questo modo a una formazione non corretta dell’embrione.
Questo può produrre un aborto spontaneo precoce e così si spiega il motivo per cui non si osservano
individui che hanno ereditato degli oncogeni. Un’altra possibilità è che gli oncogeni ereditati
possano influire in maniera negativa sulla sopravvivenza dei gameti, fatto che rende difficile la
trasmissione dai genitori alla progenie. Una terza possibilità risiede nel fatto che gli oncogeni
possano colpire lo zigote fecondato in modo tale da prevenire il suo corretto impianto nell’utero.
C25.
A. No, poiché E2F è inibita.
B. Si, poiché E2F non è inibita.
C. Si, poiché E2F non è inibita.
D. No, poiché E2F è assente.
C26. Il ruolo di p53 è quello di rilevare un danno nel DNA e di prevenire la proliferazione delle
cellule danneggiate. Probabilmente, prima della nascita, il feto si trova in un ambiente protetto
perciò il danno al DNA risulta essere minimo. In altre parole, il feto può davvero non necessitare di
p53. Dopo la nascita, degli agenti come la luce UV possono causare dei danni al DNA. A questo
punto, p53 diventa importante. Un topo knockout di p53 è più sensibile alla luce UV in quanto non
può riparare il suo DNA correttamente in risposta a questo agente e non può eliminare le cellule che
sono diventate irreversibilmente danneggiate.
C27.
A. Vero.
B. Vero.
C. Falso, la maggior parte delle cellule tumorali sono causate dalla presenza di mutazioni che
derivano da mutageni ambientali.
D. Vero.
C28. La proteina p53 è un fattore di trascrizione regolatorio; si lega al DNA e influenza il tasso di
trascrizione di geni limitrofi. Questo fattore di trascrizione (1) attiva dei geni che promuovono la
riparazione del DNA; (2) attiva una proteina che inibisce i complessi proteici ciclina/CDK che sono
richiesti per la divisione cellulare e (3) attiva dei geni che promuovono l’apoptosi. Se una cellula
subisce un danno al DNA, questa ha un elevato potenziale di diventare maligna. Perciò, un
organismo vuole evitare la proliferazione di tali cellule. Quando viene esposta a una sostanza che
causa danni al DNA, la cellula cercherà di riparare il danno. Tuttavia, se il danno risulta troppo
esteso, la proteina p53 arresterà la divisione cellulare e programmerà la cellula alla morte. Questo
meccanismo aiuta nel prevenire la proliferazione delle cellule tumorali.
Principi di genetica - Robert J. Brooker
Copyright © 2010 – The McGraw-Hill Companies srl
Domande Sperimentali
S1. A. Falso, ciò suggerirebbe la presenza di una malattia infettiva, poiché le persone che vivono
nella stessa regione sarebbero esposte alle stesse tipologie di agenti infettivi. Per una malattia
genetica, gli individui consanguinei che vivono insieme e quelli che vivono separatamente
mostrerebbero la stessa frequenza.
B. Questo potrebbe essere vero, poiché gli individui che vivono in una stessa regione possono
essere maggiormente correlati geneticamente. D’altra parte, un particolare agente infettivo può
essere presente solo nella parte meridionale della Spagna e questo potrebbe spiegare l’alta
frequenza in questa regione.
C. Una specifica età di insorgenza è coerente con la presenza di una malattia genetica.
D. Il rischio maggiore di sviluppare una malattia da parte dei gemelli monozigotici rispetto ai
gemelli dizigotici è coerente con la presenza di una base genetica della malattia poiché i gemelli
monozigotici sono più simili geneticamente tra loro (in effetti essi sono identici) rispetto ai gemelli
dizigotici.
S2. Probabilmente la meno convincente è l’alta incidenza della malattia in popolazioni particolari.
Dato che delle popolazioni che vivono in posizioni geografiche specifiche sono esposte al loro
unico ambiente, è difficile per una particolare malattia distinguere tra le cause genetiche e quelle
ambientali. L’evidenza maggiormente convincente potrebbe essere l’alta incidenza di una malattia
in individui consanguinei e/o la capacità di correlare una malattia con la presenza di un gene
mutante. In generale, tuttavia, la sicurezza del fatto che una malattia ha una componente genetica
dovrebbe essere basata su di un numero maggiore possibile di osservazioni.
S3. Il termine test genetico si riferisce all’utilizzo di un saggio di laboratorio che determina se un
individuo è un portatore o è affetto da una malattia genetica. Effettuare un test a livello della
proteina significa saggiare la quantità o l’attività di una proteina. Effettuare un test a livello del
DNA significa che il ricercatore cerca di rilevare la presenza di un allele mutante a livello
molecolare o cromosomico. Degli esempi riguardo a questi approcci sono descritti nella Tabella
22.4.
S4. Probabilmente concluderai che è meno probabile avere una componente genetica. Se la malattia
fosse basata principalmente sulla genetica, sarebbe probabile riscontrarla nella popolazione
dell’America centrale. Certamente c’è la possibilità che poche tra le persone migrate nell’America
centrale fossero portatrici del gene mutante, cosa alquanto improbabile per un’ampia popolazione
migrante. In confronto, si potrebbe sospettare che un agente ambientale presente in Sud America,
ma assente in America centrale, sia alla base della malattia. I ricercatori potrebbero tentare di
cercare questo agente ambientale (ad esempio un organismo patogeno).
S5. A. Come si può osservare nella corsia 3, il polipeptide dell’α-galattosidasi A è più corto nelle
cellule ottenute da Pete. Questo indica che la malattia di Pete è causata da una mutazione che o
costituisce una delezione nel gene oppure introduce un codone di stop prematuro. Nel caso di Jerry
(corsia 6), non sembra essere presente alcun polipeptide dell’α-galattosidasi A nelle sue cellule.
Questa assenza potrebbe essere causata dalla presenza di una delezione che rimuove l’intero gene,
di una mutazione nel promotore che impedisce l’espressione del gene, di una mutazione che
impedisce la traduzione (per esempio, una mutazione nel codone di inizio) o di una mutazione che
porta alla formazione di un polipeptide molto instabile e che viene degradato rapidamente.
B. Amy sembra possedere due copie normali del gene per l’α-galattosidasi A. Lei non trasmetterà
l’allele mutante alla sua progenie. Nan è eterozigote. Ha il 50% di probabilità di tramandare l’allele
mutante. La metà dei suoi figli sarebbe affetta dalla malattia. Allo stesso modo, anche Aileen
Principi di genetica - Robert J. Brooker
Copyright © 2010 – The McGraw-Hill Companies srl
sembra essere eterozigote poiché la quantità di α-galattosidasi A è circa il 50% del normale. Anche
lei avrebbe il 50% di probabilità di trasmettere l’allele mutante alla sua progenie; metà dei suoi figli
sarebbe affetta.
S6. I maschi I-1, II-1, II-4, II-6, III-3, III-8 e IV-5 possiedono la copia normale del gene. I maschi
II-3, III-2 e IV-4 sono emizigoti per l’allele mutante inattivo. Le femmine III-4, III-6, IV-1, IV-2 e
IV-3 possiedono due copie normali del gene, mentre le femmine I-2, II-2, II-5, III-1, III-5 e III-7
sono portatrici eterozigoti dell’allele mutante.
S7. Non ci si aspetta un numero elevato di focolai maligni. Le mutazioni nei geni oncosoppressori
che causano la malignità sono dovute all’inattivazione del gene oncosoppressore. Le cellule
NIH3T3 devono possedere dei geni oncosoppressori normali (non difettosi), altrimenti sarebbero
maligne. Se un gene oncosoppressore difettoso viene trasformato nelle cellule NIH3T3, questo non
avrebbe alcun effetto poiché le cellule NIH3T3 possiedono dei geni oncosoppressori normali che
impediscono la crescita maligna.
Nota: Nella Figura EG22.1.1 dell’esperimento di Genetica 22.1 sul sito internet, le fonti di DNA
che portano alla formazione di un gran numero di focolai maligni (per esempio, MC5-5-0) devono
contenere degli oncogeni. Gli oncogeni possiedono delle mutazioni che causano la sovraespressione
dei geni che controllano la divisione cellulare. Quando un oncogene viene incorporato nelle cellule
NIH3T3, questo causa una crescita maligna dovuta alla sovraespressione del gene. Le cellule
NIH3T3 non sono in grado di prevenire questa sovraespressione che permette una crescita cellulare
incontrollata. In altre parole, i geni oncosoppressori normali nelle cellule NIH3T3 non sono
sufficientemente forti per superare gli effetti degli oncogeni.
S8. Una cellula trasformata è una cellula che è diventata maligna. In laboratorio, questo può essere
ottenuto in tre modi. In primo luogo, le cellule possono essere trattate con un mutageno che può
convertire un proto-oncogene in un oncogene. In secondo luogo, le cellule potrebbero essere
esposte a del DNA derivante da una linea cellulare maligna. Nelle condizioni appropriate, questo
DNA può essere assunto dalle cellule e integrato nei loro genomi così che diventano maligne. Una
terza modalità per trasformare lle cellule consiste nell’esposizione di queste a virus oncogeni.
S9. Se il campione di DNA fosse stato trattato con RNasi o proteasi, i risultati sarebbero stati gli
stessi. Se fosse stato trattato con DNasi, non si sarebbe verificata alcuna trasformazione.
S10. Confrontando i virus oncogeni con dei ceppi che hanno perso la loro oncogenicità, i ricercatori
sono stati in grado di identificare dei geni particolari che causano il cancro. Questo ha permesso
l’identificazione di molti oncogeni. A partire da questo lavoro, i ricercatori hanno anche appreso
che le cellule normali contengono dei proto-oncogeni che solitamente svolgono un ruolo nella
divisione cellulare. Questo suggerisce che gli oncogeni esercitano i loro effetti perturbando il
processo di divisione cellulare. In particolare, sembra che gli oncogeni siano attivi in maniera
anomala e mantengano il ciclo della divisione cellulare permanentemente acceso.
S11. La maggior parte delle forme ereditabili di cancro vengono trasmesse in maniera dominante.
Questo potrebbe essere identificato attraverso l’analisi del pedigree, poiché è più probabile che gli
individui affetti abbiano una progenie affetta. Dato che il cancro può essere causato da un accumulo
sequenziale di mutazioni, la correlazione tra genitori e figli affetti può risultare relativamente bassa,
poiché la progenie può non accumulare le altre mutazioni post-zigotiche, necessarie affinché il
cancro si manifesti.
Principi di genetica - Robert J. Brooker
Copyright © 2010 – The McGraw-Hill Companies srl
S12. Una possibile categoria di farmaci potrebbe essere quella degli analoghi del GDP (i.e., dei
composti che somigliano alla struttura del GDP). Magari si potrebbe scoprire un analogo del GDP
che si lega alla proteina Ras e la blocca nella conformazione inattiva.
Una modalità per testare l’efficacia di tale composto potrebbe consistere nell’incubare il farmaco
con un tipo di cellule tumorali note per avere una proteina Ras molto attiva, e poi piastrare le cellule
su dei terreni solidi. Se il farmaco blocca Ras nella conformazione inattiva, questo potrebbe inibire
la formazione di una crescita maligna o la comparsa di foci neoplastici.
Vi sono dei possibili effetti collaterali per tali farmaci. In primo luogo, essi possono bloccare la
crescita delle cellule normali, in quanto la proteina Ras svolge un ruolo nella normale proliferazione
cellulare. In secondo luogo (se hai seguito un corso di biologia cellulare), nella cellula sono presenti
molte proteine che legano GTP/GDP ed il farmaco potrebbe in qualche modo inibire la crescita
cellulare e agire interagendo con queste proteine.
S13. Le cellule di mammifero crescono in monostrato sui terreni solidi, mentre le cellule maligne
tendono ad accumularsi le une sulle altre e a formare dei focolai maligni. Un focolaio maligno può
essere formato da una singola cellula tumorale che si è divisa molte volte. E’ anche possibile, ma
non necessario, che più cellule tumorali indipendenti possano formare un focolaio maligno.