CORSO DI LAUREA in
Scienze e tecniche psicologiche
Corso di
Neurofisiologia Clinica
Guido Rodriguez
Andrea Brugnolo
Nicola Girtler
Neurofisiologia Clinica (DiNOG)
Università di Genova
Lo sviluppo
dei
neuroni
nella
maturazione
cerebrale
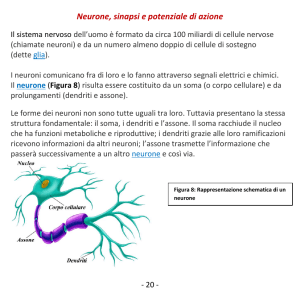
IL Neurone
I dentriti
L’assone
This image is copyright Dennis Kunkel at www.DennisKunkel.com
Neuroni
I neuroni sono di diversa grandezza e
forma; alcuni dei più piccoli hanno un
corpo di soli 4 microns, mentre alcuni dei
più grandi sono di circa 100 microns.
I neuroni sono simil alle altre cellule:
1. Hanno una membrana cellulare.
2. Hanno un nucleo che contiene geni.
3. Contengono citoplasma, mitocondri ed altri
"organelli".
4. Posseggono processi di base quali la sintesi
proteica e la produzione di energia.
Camillo Golgi Fu insignito del
Premio Nobel per la Medicina
(precisamente "Medicina o
Fisiologia") nel 1906 ex aequo
con Santiago Ramón y Cajal,
per gli studi sulla istologia del
sistema nervoso: Golgi per la
messa a punto della Reazione
Nera, Cajal per le scoperte
compiute grazie alla
colorazione di Golgi (Cajal
scoprì che i neuroni sono
separati fisicamente l'uno
dall'altro, ossia che
interagiscono tra di loro non
per continuità, bensì per
contiguità attraverso la
Sinapsi e che non sono uniti a
formare un'unica rete
sinciziale come sosteneva Golgi
Cosa c’è
dentro?
Gli "organelli“ dei neuroni sono
assimilabili a quelli delle altre cellule
del corpo.
•Nucleo - Contiene materiale genetico (cromosomi)
che conserva le informazioni per lo sviluppo
cellulare e la sintesi di proteine necessarie per il
mantenimento delle cellule. Ricoperto da una
membrana.
•Nucleolo – Produce I ribosomi necessari per ola
translazione delle informazioni genetiche in
proteine.
•Corpi di Nissle - gruppi di ribosomi utilizzati per
la sintesi proteica.
•Reticolo endoplasmatico (RE) – sistema di tubi
per il trasporto di materiali nel citoplasma. Può
avere o no ribosomi; se li possiede è importante
per la sinstesi proteica.
•Apparato di Golgi - strutture vicine alla
membrana importanti per impacchettare i peptidi e
le proteine (inclusi i neurotransmettitori) nelle
vescicole.
•Microfilamenti/Neurotubuli – sistema di
trasporto del materiale nel neurone che può essere
utilizzato come supporto strutturale.
•Mitocondri – Producono energia per mantenere le
attività cellulari.
1 Reticolo endoplasmatico rugoso
(corpo di Nissl)
Poliribosomi
3 Ribosomi
4 Apparato Golgi
5 Nucleo
6 Nucleolo
7 Membrana
8 Microtubuli
9 Mitocondrio
10 Reticolo endoplasmatico liscio
11 Cono di emergenza (assone)
12 Nucleo (cellula di Schwann)
13 Sinapsi (assone somatico)
14 Sinapsi (assone dendritico)
15 Dendriti
16 Assone
17 Neurotrasmettitore
18 Recettore
19 Sinapsi
20 Microfilamenti
21 Guaina mielinica (cellula di
Schwann)
22 Nodo di Ranvier
23 Terminale assonale
24 Vescicole assonali
25Sinapsi (assone assone)
26 Distanza sinaptica
Neuroni
I neuroni sono di diversa grandezza e
forma; alcuni dei più piccoli hanno un
corpo di soli 4 microns, mentre alcuni dei
più grandi sono di circa 100 microns.
Si differenziano perchè:
1. Hanno estensioni definite come dendriti e assoni; i
primi portano informazioni i secondi le inviano agli
altri neuroni.
2. Comunicano tra di loro attraveso processi
elettrochimici.
3. Contengono strutture specializzate (sinapsi) e
sostanze chimiche (i neuro trasmettitori).
La membrana cellulare
Struttura e funzioni della membrana
cellulare
La membrana cellulare ha diverse
funzioni:
racchiude
la cellula e la delimita
definendone
i confini
mantiene la separazione fra citosol e
ambiente extracellulare
media
e seleziona il trasporto di
determinate
sostanze
impedendo
ingresso e uscita di altre
Le membrane hanno struttura simile a doppio
strato con due costituenti principali che sono:
Proteine: intriseche ed estrinseche
Lipidi: i più abbondanti sono i fosfolipidi che
sono molecole anfipatiche con una porzione
idrofilica (testa) ed una porzione idrofobica
(coda).
Altri lipidi abbondanti in membrana sono:
glicolipidi e colesterolo
Struttura della membrana cellulare con
fosfolipidi (in viola) e proteine
intrinseche (in azzurro) ed estrinseche
(in verde)
Struttura di un
fosfolipide
Canali ionici
La membrana cellulare è spessa 6-8 nm, e consiste
in un mosaico di lipidi e di proteine. I lipidi sono
idrofobici e non permettono il passaggio di ioni.
Gli ioni sono idratati e, perche’ possano
attraversare il doppio strato idrofobico, le molecole
d’acqua dovrebbero essere staccate dallo ione.
Questo richiede molta energia.
Canali ionici
La soluzione e’ quella di fornire agli ioni dei cammini
privilegiati quali i canali ionici, che permettano loro
di attraversare la membrana con tutte o quasi le
loro molecole d’acqua.
I pori dei canali ionici forniscono quindi agli ioni un
ambiente polare.
I pori dei canali ionici forniscono quindi agli ioni un ambiente polare.
Quando uno ione positivo
entra in contatto con
l'elettrodo negativo (il
catodo in questo caso) è
forzato ad acquisire da
esso elettroni, ossia
subisce una riduzione.
Quando uno ione
negativo entra in
contatto con
l'elettrodo positivo (l'
anodo in questo caso)
cede forzatamente a
questo i suoi elettroni,
cioè subisce un'
ossidazione.
Caratteristiche fondamentali:
1. Apertura e chiusura: i canali possono aprirsi e
chiudersi in base alla variabile conformazione delle
proteine che li costituiscono
2. Selettivita’ dei canali: grazie alle diverse sequenze
di aminoacidi che tappezzano l’interno del canale
viene permesso il passaggio solo di alcuni ioni, quindi
3. Per i vari tipi di ioni esistono canali specifici
Caratteristiche fondamentali:
1. Canali ionici con porta a potenziale
2. Canali ionici a porta chimica
a) canali attivati da ligandi extracellulari
b) canali attivati da ligandi endocellulari
Un canale K+:
Canali ionici con porta a potenziale
Una classe di canali si apre e si chiude per una
differenza di potenziale trans-membrana (voltaggio).
Ci sono molti tipi di canali. Tra questi:
-Canali del Na+
-Canali del K+
-Canali del Ca2+
- Canali del Cl-
Canali ionici con porta a potenziale
CHIUSO
APERTO
Canali ionici con porta a potenziale
Da Purves et al. Zanichelli 2004
Regione responsabile conduzione e
selettività
Org proteine
Canali ionici con porta a potenziale
Sono coinvolti in:
1. Inizio e propagazione del potentiale d’azione
2. Controllo della trasmissione sinaptica
3. Omeostasi intracellulare degli ioni
4. Altri aspetti di funzione intracellulare:
•
Agiscono come attivatori degli enzimi
•
Coordinano i segnali tra la membrana cellulare e
gli organelli interni (es, mitocondri).
Geni e canali
Moltissimi sono i geni che codificano i
canali. Ad oggi si conoscono 6 geni per
il Na+ e per il Ca+ mentre sono 25
quelli per il K+ . Ci sono quindi malattie
genetiche che comportano alterazioni
dei canali ionici a porta a potenziale;
quelle più conosciute sono relative alla
muscolatura scheletrica e portano a
rigidità o a paralisi. Le prime legate a
difetti dei canali del Cl- (produzione
spontanea di PdA) altre portano a
paralisi colpendo i canali del Ca+
(l’intimo meccanismo non è chiarito)
Da Purves et al. Zanichelli 2004
La membrana cellulare permette il passaggio di
sostanze in modo selettivo grazie a meccanismi di
trasporto. Il doppio strato lipidico costituisce
una barriera al passaggio di tutte le molecole
polari (cioè con una carica positiva su una parte
ed una negativa su quella opposta) cariche,
mentre permette il passaggio di piccole molecole
polari prive di carica. Le sostanze idrofobiche
passano invece bene il doppio strato senza
causare problemi (O2, CO2, N2).
Esistono
meccanismi
di
trasporto
che
avvengono
senza
attraversamento
della
membrana cellulare come:
•Fagocitosi (materiale particolato; vedi
macrofagi)
•Pinocitosi (molecole solubili; endocitosi
costitutiva)
•Endocitosi (materiale inglobato in seguito ad
interazione con recettori; per assunzione di
ormoni, fattori di crescita)
•Esocitosi (verso l’esterno. Secrezione di
neurotrasmettitori, zimogeni pancreatici etc.)
pinocitosi
fagocitosi
endocitosi
esocitosi
Esistono meccanismi di trasporto che prevedono
attraversamento della membrana cellulare. Fra
questi ricordiamo:
•Diffusione semplice:
regolata dalla legge
di Fick J=-DA dc/dx
•Diffusione facilitata (elevata specificità
chimica delle proteine trasportatrici)
•Trasporto attivo (primario e secondario)
Il trasporto attivo entra in gioco tutte le volte che
sostanze sono mosse contro un gradiente
concentrazione. Questo tipo di trasporto implica
dispendio energetico che viene fornito dal consumo
ATP. Per questo tipo di trasporto vale l’equazione
Michaelis- Menten:
V=Vmax · [S] / (Km + [S])
le
di
un
di
di
Un esempio tipico di trasporto attivo è la pompa
Na-K ATPasi che sposta 3 ioni Na+ verso
l’esterno e 2 ioni K+ verso l’interno contribuendo
alla negatività della membrana cellulare (pompa
elettrogenica). È fosforilata durante il suo ciclo
di attività e quindi è indicata come ATPasi di
tipo P. È inibita dall’ouabaina che compete per il
sito del potassio.
Risulta costituita da due subunità:
Subunità α detta catalitica di circa 100 kDa
Subunità β glicoproteica di circa 50kDa.
Caratteristiche generali degli
equilibri ionici
Potenziale di Nernst per Na+ e K+
I segnali elettrici
Da Purves et al. Zanichelli 2004
Alla fine del 19esimo secolo si sapeva che il citoplasma cellulare è
ricco di ioni K+ e che il Na+ è poco concentrato e che questa
situazione è opposta nell’ambiente extracellulare. La prima
assunzione fatta è stata quella di considerare la membrana
permeabile al potassio, ma non al sodio e calcolare quindi il
potenziale di riposo trans-membrana come un potenziale di Nernst
per il potassio.
In realtà la membrana è permeabile al Cl- tanto quanto al potassio
e questi due ioni sono fra loro in equilibrio secondo un equilibrio di
Donnan che afferma:
[K+]out · [Cl-]out = [K+]in· [Cl-]in
Ogni volta che due ioni possono attraversare la membrana cellulare,
il prodotto delle loro concentrazioni extracellulari è uguale al
prodotto delle concentrazioni intracellulari
Una differenza di carica elettrica fra interno ed esterno della
superficie della membrana è detta potenziale elettrico.
Tutte le cellule animali e vegetali sono caratterizzate da un
potenziale di membrana di riposo (resting potential) che dipende
dal movimento di tutti gli ioni permeabili attraverso la membrana
cellulare. Il valore del potenziale di riposo è variabile fra cellula
e cellula, ma approssima il potenziale di Nernst dello ione
potassio. Vediamo perché.
Quando una o più specie ioniche si distribuiscono sui due lati
della membrana cellulare, ciascuna tenderà a spostare il valore
del potenziale al valore del suo potenziale di equilibrio
elettrochimico.
Tanto più la membrana è permeabile ad una
specie ionica, tanto maggiore sarà la forza
che tale specie ionica eserciterà nello
spostare il valore del potenziale.
In una membrana permeabile a più ioni il potenziale
trans-membrana dipende da:
I. Carica elettrica di ciascuno ione
II.Permeabilità della membrana a ciascuno
ione
III.Concentrazione interna ed esterna della
specie ionica
La formula che meglio descrive il potenziale di riposo di una
membrana cellulare è l’equazione di Goldman che considera non
soltanto le concentrazioni ioniche delle specie in gioco, ma anche la
permeabilità della membrana.
Il fatto che, anche se in piccola percentuale, la
membrana a riposo sia permeabile anche al Na+, fa sì
che il potenziale di riposo
non sia
esattamente il
potenziale di Nernst del potassio, ma sia un po’ meno
negativo. Questo dipende dal fatto che il Na+ tende a
spostare il potenziale verso il suo potenziale di
equilibrio elettrochimico (potenziale di Nernst).
Vresting=-70 / -80mV
EK=-90mV
Affinché il potenziale di riposo si mantenga dobbiamo
mantenere le differenze di concentrazione fra le specie
ioniche considerate fra ambiente intra- e extracellulare. Per fare questo dobbiamo quindi mantenere i
gradienti
di
concentrazione
controbilanciando
il
movimento passivo degli ioni Na+ verso l’interno della
cellula e degli ioni K+ verso l’esterno della cellula.
Questo è fatto dalla pompa Na-K ATPasi che mantiene i
gradienti ionici spostando ioni sodio e ioni potassio con
dispendio di energia. In questo modo il potenziale di
riposo può essere mantenuto.
Na+ K+
La pompa
sodio-potassio
Il potenziale di
riposo
A riposo, gli ioni potassio (K+)
possono attraversare la
membrana abbastanza
facilmente, mentre gli ioni
cloro (Cl-) e sodio (Na+)
hanno maggiore difficoltà. Le
proteine, caricate
negativamente, che si trovano
dentro il neurone non possono
uscirne. La membrana cellulare
è dotata anche di pompe che
consumano energia per
spostare 3 ioni sodio fuori dal
neurone ogni 2 ioni potassio
che vengono presi dentro. La
differenza di voltaggio, fra
esterno ed interno del
neurone, prende il nome di
potentiale di riposo. Il
potenziale di riposo della
membrana di un neurone è di
circa -70 mV (mV=millivolt) cioè l'interno del neurone è di
70 mV più negativo
Il potenziale d’azione
E’ la risposta ad uno stimolo depolarizzante che possono dare
cellule elettricamente eccitabili, cioè provviste di un corredo di
canali ionici voltaggio-dipendenti per il Na+ e per il K+
Significato funzionale:
Nei neuroni – segnale elettrico che propagandosi lungo la fibra
nervosa consente la trasmissione di messaggi elettrici
Nelle fibrocellule muscolari – innesca il processo della
contrazione
Il potenziale d’azione
Soglia a -55 mV
Quando
raggiunta
parte lo spike
di ampiezza
sempre uguale in
un neurone
FENOMENO del TUTTO o NULLA
Caratteristiche generali del potenziale d’azione
La soglia
Lo stimolo soglia è lo stimolo depolarizzante di intensità minima in
grado di generare un potenziale d’azione in un neurone
La legge del tutto o nulla
In un neurone un potenziale d’azione o è generaro e si sviluppa in tutta
la sua ampiezza, se lo stimolo raggiunge o supera la soglia, oppure non è
generato affatto, se l’ampezza dello stimolo è inferiore alla soglia.
La refrattarietà
Un neurone, una volta generato un potenziale d’azione viene a trovarsi
in uno stato di refrattarietà
- periodo di refrattarietà assoluta: nessuno stimolo per quanto
intenso è in grado di generare un secondo potenziale d’azione
- periodo di refrattarietà relativa: un secondo stimolo, a condizione
che sia sufficientemente più intenso di quello soglia, è in grado di
genrare un secondo potenziale d’azione
Genesi ionica del potenziale d’azione
ancor più canali del
sodio si aprono
i canali del sodio
inattivano
si aprono i
canali del sodio
si aprono i canali
del potassio
i canali del potassio
si chiudono
tempo
Un’altra importante proprietà del potenziale
d’azione è quella di potersi propagare lungo la
fibra nervosa
Dal vivo
I Neuroni
Polarizzazione: la direzione del flusso delle
informazioni.
Assoni & Dendriti:
Alcune differenze tra assoni and dendriti:
Assoni
Dendriti
• Portano le informazioni al di
fuori della cellula
• Portano informazioni alla cellula
• Superferficie non rugosa
• Hanno superfice rugosa (spine
dendritiche)
• Generalmente 1 assone per
cellula
• Usualmente molti dendriti per
singola cellula
• Non presenti i ribosomi
• Hanno ribosomi e mitocondri
• Può essere circondato da
mielina
• Non sono isolati dalla mielina
• Si alontana molto dal corpo
cellulare
• Ramificano vicino al corpo cellulare
Il principio della polarizzazione
dinamica
L’informatione (generalmente) corre in una singola direzione
Neurone pre-sinaptico :
• Generano un potentiale d’azione che arriva al terminale
presinaptico generando il rilascio di neurotrasmettitori.
Neurone post-sinaptico :
• I neurotransmettitori attivano il terminale postsinaptico
sui dendriti, da dove il segnale è trasmesso al corpo
cellulare.
Terminologia:
Efferente = “che si allontana da”
Si riferisce al segnale che va via dal neurone
(esempio, attraverso un assone).
Afferente = “va verso”
Si riferisce al segnale che raggiunge un
neurone (esempio, attraverso un dendrite).
Il sistema efferente: l’assone
La comunicazione tra
neuroni si ottiene
tramite un impulso
elettrico che viaggia
nell’assone fino alle
sinapsi.
Assoni
I diversi tipi di
assoni
La generazione dei segnali elettrici è stata studiata nell’assone del
calamaro gigante
Da Purves et al. Zanichelli 2004
Conduzione
del PdA nell’assone
Da Purves et al. Zanichelli 2004
La velocità di
conduzione
del PdA
nell’assone è
aumentata per
la mielina
Da Purves et al. Zanichelli 2004
Le velocità
dei
potenziali
d’azione
Da Purves et al. Zanichelli 2004
Terminologia:
Efferente = “che si allontana da”
Si riferisce al segnale che va via dal neurone
(esempio, attraverso un assone).
Afferente = “va verso”
Si riferisce al segnale che raggiunge un
neurone (esempio, attraverso un dendrite).
Un sistema afferente:
I dendriti e le loro spine:
• L’entità integrativa del
neurone.
• Contengono la
maggioranza delle
sinapsi.
• Contengono un’alta
concentrazione di
canali ionici e di
recettori di membrana.
Plasticità neuronale
Johansson k.j. Med. 2004
Topo sacrificato a
4 mesi di vita
passata in un
ambiente povero o
arricchito (molte
attività)
Glia
Glia
Astrociti
Microglia
Oligodendroglia
Cellule di Schwann
Cellule Gliali
Differenti funzioni:
nutritive
isolanti elettrici
scavengers (ruolo immunologico)
contenitori di K+
guida per altre cellule
giunzioni strette (Barriera Emato-Encefalica)
Studi recenti rivelano che la glia è
“attiva”
1. La Glia comunica attraverso le “gap junctions”
2. La Glia comunica con i neuroni attraverso le “gap
junctions”
3. Le “Gap junctions” permettono la diffusione degli ioni
calcio ed il rilascio del calcio dai depositi interni.
4. La comunicazione gliale potrebbe sottendere ad un
gran numero di condizioni patologiche.
ASTROCITI
ASTROCITI
“Onde” di Calcio in astrociti
Gli astrociti considerati non interessanti fino ad oggi. Recenti scoperte suggeriscono
inaspettate nuove funzioni per queste cellule che entrano in gioco in molte attività
cerebrali con i neuroni. Gli astrociti entrano nella regolazione dinamica della produzione
neuronale, nella formazione del network sinaptico, nell’attività elettrica ed in specifiche
patologia.
ASTROCITI
Oligodendrocita
Glia riconosciuta come target
dell’eccitotossicità
Le cellule
oligodendrogliali
esprimono sottotipi di
recettori AMPA del
glutamato.
Le cellule
oligodendrogliali sono
quelle tra le cellule della
materia bianca più
suscettibili
all’eccitotossicità negli
insulti anossici.
From:
Li S, Mealing GA, Morley P, Stys PK
J Neurosci 1999 Jul 15;19(14):RC16
La trasmissione sinaptica
L’encefalo umano contiene circa 100 miliardi di neuroni,
ciascuno capace di influenzare molte altre cellule.
Pertanto è necessario un meccanismo dotato di grande
efficienza per rendere possibile la comunicazione fra
questo
numero
enorme
di
elementi.
Questa
comunicazione è resa possibile dalle sinapsi, i contatti
funzionali fra i neuroni.
La prima distinzione fondamentale è fra
Sinapsi elettriche: flusso passivo di corrente elettrica fra
un neurone e l’altro
Sinapsi chimiche: comunicazione possibile grazie alla
secrezione di neurotrasmettitori
Si
definisce
elemento
pre-sinaptico
l’elemento cellulare a monte della sinapsi e
che riceve un segnale da trasmettere.
Si
definisce
elemento
post-sinaptico
l’elemento cellulare a valle della sinapsi
che riceve l’informazione
Sono in minoranza rispetto alle sinapsi chimiche, ma
presenti ovunque, specialmente dove sia necessario
sincronizzare l’attività di un gruppo di cellule in
maniera rapida ed efficiente. Le due membrane sono
molto
vicine
fra
loro unite da
una giunzione
comunicante (gap junction). Queste strutture sono
costituite da canali esattamente allineati fra loro sulle
due membrane (pre- e post-sinaptica) che formano un
poro di diametro molto maggiore del poro dei canali
ionici visti per il potenziale d’azione
Questi pori consentono il passaggio anche di molecole
di relative grosse dimensioni come ATP e alcuni secondi
messaggeri. Gli ioni fluiscono dal neurone pre-sinaptico
al neurone post-sinaptico veicolando corrente.
Questa struttura implica diverse conseguenze che
differenziano profondamente la sinapsi elettrica dalla
sinapsi chimica. Una sinapsi elettrica:
•È bidirezionale: il flusso ionico può avvenire nelle due
direzioni
•Non mostra ritardo sinaptico:
è un flusso ionico
estremamente veloce
•Mostra continuità citoplasmatica fra i due elementi
•Distanza fra elemento pre- e post-sinaptico di 3.5nm
contro i 30-50 nm della sinapsi chimica.
La gap junction è formata
da
una
struttura
detta
connessone costituita da 6
sub-unità dette connessine
che delimitano un poro
attraverso cui passano gli
ioni.
Le sinapsi elettriche sono diffuse in tutti i tessuti in cui
si ha bisogno di ottenere un’azione sincrona con
trasmissione rapida dell’informazione. Questo avviene
per esempio a livello del miocardio, dove si ha bisogno
di una contrazione muscolare contemporanea di tutte
le fibrocellule atriali e ventricolari. Avviene in alcune
aree del SNC (ipotalamo per il controllo della
secrezione ormonale), a livello di epatociti, fibrocellule
lisce dell’intestino, cellule epiteliali del cristallino.
Nelle sinapsi chimiche l’elemento pre- e post-sinaptico
sono separati fra loro da uno spazio di circa 50nm detto
spazio sinaptico (synaptic cleft). Da un punto di vista
microscopico le sinapsi chimiche sono caratterizzate da
vescicole sinaptiche nella terminazione pre-sinaptica.
Queste vescicole contengono il trasmettitore chimico
diverso a seconda della sinapsi considerata.
La sinapsi chimica più studiata è la giunzione neuromuscolare.
La trasmissione sinaptica in una sinapsi chimica segue
una complessa catena di eventi che si innesca quando
un potenziale d’azione invade la terminazione del
neurone pre-sinaptico.
Vediamo qual’è la sequenza di eventi.
Elementi di una
giunzione
neuromuscolare
I recettori si dividono in due classi principali:
Recettori a gating diretto: sono recettori che, oltre a
portare il sito di legame per il trasmettitore sono anche
canali. Ad esempio i recettore colinergico nicotinico, il
recettore GABAergico A, il recettore NMDA per il
glutammato,
recettore
AMPA-kainato,
recettore
serotoninergico 5-HT3.
Recettori a gating indiretto: sono accoppiati ad un canale
attraverso un G-proteina ed eventualmente un sistema di
secondi messaggeri. Ad esempio i recettori α- e βadrenergici, i recettori colinergici muscarinici (M1-M5),
GABA e i recettori per tutti i neuropeptidi.
Recettore a
gating diretto:
recettore
nicotinico
Recettore a gating indiretto: recettore muscarinico M2
Spazio sinaptico
Muscolo
Rivediamo la sequenza completa degli eventi
Sommazione spaziale= è la somma dell’effetto di
input sinaptici multipli in punti diversi del soma e dei
dendriti della cellula. Due stimoli eccitatori sottosoglia
possono,
se
sommati,
dare
una
depolarizzazione che arriva a soglia.
Sommazione
temporale=
è
l’accumulo
di
deplarizzazioni successive dovute all’attività ripetitiva.
Ciascun potenziale si somma al precedente sulla fase
di discesa.