Laboratorio di biologia sperimentale:
GENETICA
Dott.ssa Patrizia Bogani
Trasformazione genetica delle piante
Manipolazione delle cellule vegetali
Colture in vitro
Tecnologia del DNA
ricombinante
Piante
transgeniche
o
trasformate
Colture in vitro
organogenesis
La coltura in vitro di cellule
vegetali consiste di un numero di
tecniche che prevedono
l'utilizzazione di una qualsiasi
parte di una pianta (radice, fusto,
foglia, seme) da cui ottenere
cellule e tessuti od organi, dai
quali, dopo opportune condizioni di
coltura si possono rigenerare, in
poco tempo e poco spazio, nuove
piante mature. Questo è possibile
grazie ad una caratteristica unica
del regno vegetale, la totipotenza
cellulare. Con questo termine
s'intende la capacità di una cellula
vegetale di passare da uno stato
differenziato ad uno
sdifferenziato e viceversa.
Terreni di coltura per cellule vegetali
Costituenti di base:
•MACROELEMENTI (Solfati, fosfati, cloruri; Calcio, Magnesio, Potassio, Sodio,
Ferro).
•MICROELEMENTI (Boro, Zinco, Molibdeno, Iodio, rame, Na2EDTA).
•COMPOSTI ORGANICI (Zuccheri - saccarosio -; Vitamine - tiamina, piridoxina,
acido nicotinico, biotina, ecc.).
•FITOREGOLATORI O ORMONI DELLA CRESCITA.
Il termine "ormone vegetale" viene utilizzato per descrivere 5 classi di composti a
basso peso molecolare: le citochinine adenine modificate in N6, ormoni che
stimolano la citochinesi; le auxine, anelli indolici, che agiscono da sole o di concerto
con gli altri fitoregolatori in diversi processi, da singole reazioni enzimatiche, alla
divisione cellulare, alla formazione di organi; l'etilene, un gas, promotore della
senescenza e della maturazione; l'acido abscissico, un sesquiterpene, induttore
della dormienza nelle piante perenni ed arboree ed anche nei semi; le gibberelline,
acidi diterpenoidi con anello tetraciclico, regolatori della germinazione. I
brassinosteroidi, una classe di molecole considerate ormoni steroidei vegetali che
interagiscono in maniera sinergica con tutti gli altri fitoormoni sullo sviluppo delle
piante.
citochinine
auxine
citochinine
auxine
Tecniche di coltura in vitro
calli
cellule in
sospensione
Protoplasti
protoplasti
Isolamento di protoplasti
Cellule in
sospensione
Foglie
Frammentazione e
rimozione
dell’epidermide
Trattamento con
enzimi che
degradano la
parete
Trattamento con
enzimi che
degradano la
parete
Centrifugazione in
gradienti di
saccarosio
Rimozione della
banda
contenente i
protoplasti
Coltura dei protoplasti in
appropriati mezzi di coltura
che permettono la
rigenerazione della parete
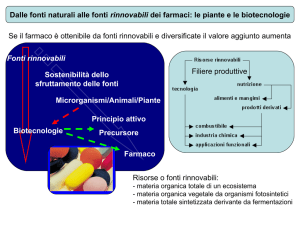
La tecnologia del DNA ricombinante si avvale
delle tecniche di coltura in vitro delle cellule
vegetali per l'ottenimento di piante
geneticamente modificate (PGM).
Le PGM si ottengono mediante diverse tecniche
di TRASFORMAZIONE GENETICA.
TRASFORMAZIONE MEDIATA DA AGROBACTERIUM …. un ingegnere
genetico naturale
Le basi molecolari della
tumorogenesi “crown gall”
Due tipi di
geni sono
importanti per
lo sviluppo
della malattia:
i geni vir o
della virulenza
e gli oncogeni
del T-DNA
che codificano
per ormoni
vegetali,
auxine e
citochinine.
qualsiasi gene clonato
dentro il T-DNA
può essere trasferito
ad una pianta
fino a 15.000 bp
possono essere
contenute
nel T-DNA vettore
vettore cointegrato
Vir region
vettore binario
Vettore binario pBI121
Binary vector
I ceppi di Agrobacterium così
ingegnerizzati possono essere
usati per infettare piante
suscettibili per l'inserimento
di geni d'interesse nelle piante.
Esistono diversi metodi di
trasformazione mediante
l'utilizzazione di vettori
costruiti in Agrobacterium, ma
quello di gran lunga più
sfruttato è l'"infezione del
disco fogliare", messa a punto
da Horsch nel 1985.
Kanamycin resistant
Schema dell’esperimento
Rigenerazione per organogenesi
Rigenerazione per embriogenesi somatica
METODO
La trasformazione del disco fogliare consiste nell'ottenimento di dischi fogliari
della stessa dimensione a partire, in genere, da foglie di piantine axeniche coltivate
in vitro.
Si possono usare, tuttavia frammenti di tessuti diversi, come stelo, radice, picciolo
fogliare, capolini di fiori, etc,.
•Gli espianti, così ottenuti si mettono per almeno 10 minuti, in co-coltura, in
agitazione, con una sospensione di Agrobacterium, fatta crescere tutta la
notte diluita 1:10 in mezzo di coltura per cellule e tessuti vegetali.
•Successivamente gli espianti sono asciugati su carta da filtro sterile e seminati
in piastre Petri contenenti terreno di coltura per cellule vegetali. Le piastre
vengono incubate per 48 ore in una camera di crescita, in condizione di luce,
temperatura ed umidità controllate.
•Gli espianti vengono ora trasferiti in piastre con terreno di coltura fresco
addizionato di un antibiotico per eliminare i batteri, di un antibiotico per la
selezione delle cellule trasformate (ad esempio kanamicina), e di regolatori della
crescita in rapporti ottimali da consentire la rigenerazione di nuove piantine. La
cellula vegetale è infatti totipotente e può essere manipolata in vitro in modo
tale da permettere lo sviluppo di un nuovo organismo a partire da una singola
cellula isolata, o da qualunque tipo di tessuto differenziato.
•I germogli resistenti al marcatore di selezione vengono allevati in fiasche
da coltura, fatti radicare ed infine trasferiti a dimora in serra, e infine, se
permesso, in un campo sperimentale.
Materiali
Ogni gruppo di 2 studenti necessita dei seguenti materiali:
•1 tubo Falcon contenente 50 ml di terreno di Linsmaier e Skoog (LS), liquido
sterile.
•2 piastre Petri contenenti terreno LS solido (0,6% agar) addizionato con NAA
0.1 mg/l e kinetina 1 mg/l.
•2 piastre Petri da 90 mm da usare per la co-coltura
•Bisturi e pinze sterili
•Carta da filtro sterile
•5 ml di una sospensione over-night di cellule di Agrobacterium LBA4404
contenente il vettore binario pBI121
•Pipette monouso da 5 ml e da 25 ml
•2 propipetta
•1 pianta di Nicotiana langsdorffii sterile, allevata in contenitori Magenta
contenenti terreno solido LS a concentrazione dimezzata e privo di
fitoregolatori.
Metodi di trasformazione
alternativi ad Agrobacterium
Particle gun