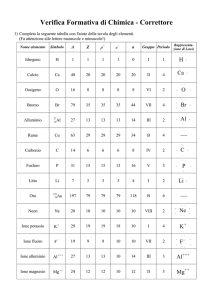
Il legame metallico
Il legame metallico si stabilisce tra gli ioni positivi di un metallo e gli elettroni del livello energetico più esterno
(elettroni di legame) che sono in continuo movimento.
Gli atomi di un metallo (analogamente agli ioni del composto ionico) si dispongono in modo ordinato e regolare a
costituire un reticolo cristallino. L’unità del reticolo che si ripete nelle tre dimensioni dello spazio è la cella
elementare caratterizzata da una struttura molto compatta e da un numero di coordinazione elevato. Le strutture più
comuni sono la cella cubica a corpo centrato (vedi figura a): cristallizzano in questo modo gli elementi litio, sodio,
potassio, cromo, cesio, bario e ferro in cui ogni atomo è circondato da altri otto atomi uguali; la cella cubica a facce
centrate (vedi figura b): cristallizzano in questo modo rame, calcio, argento, stronzio, oro e alluminio dove ogni
atomo è circondato da dodici atomi uguali e la cella esagonale compatta(vedi figura c) che appartiene invece ad
elementi quali magnesio, berillio e cobalto, anch’essi con numero di coordinazione pari a 12.
I metalli sono inoltre caratterizzati da basse energie di ionizzazione per cui tendono facilmente a perdere elettroni
trasformandosi in ioni positivi. Si ipotizza così che, data la facilità con cui gli elettroni esterni sono liberi di
muoversi, una struttura costituita da ioni positivi (nuclei atomici ed elettroni dei livelli energetici interni) immersi
in una nube di elettroni mobili (quelli del livello energetico più esterno) diffusi per tutto il reticolo cristallino.
Si può pensare che ognuno degli elettroni sia attratto contemporaneamente da tutti i cationi circostanti e che,
nonostante la mobilità della nube elettronica, la neutralità del sistema sia comunque garantita.
Questo modello di legame giustifica perfettamente le proprietà tipiche dei metalli che sono:
a) la conducibilità elettrica e termica che vanno attribuite all’alta
mobilità degli ioni, liberi di muoversi in un campo elettrico così come di
accumulare energia termica sotto forma di energia cinetica;
b) la malleabilità e duttilità che dipendono dalla distribuzione uniforme degli elettroni per cui lo slittamento di
piani reticolari lascia inalterate le interazioni di legame tra i cationi e non fa insorgere forze repulsive come
accadeva tra gli ioni di carica opposta dei composti ionici.
Esercizi
1) Qual è la descrizione corretta del tipo di legame presente nei metalli?
a) ioni positivi e negativi trattenuti insieme da un mare di elettroni
b) ioni positivi e negativi che si attirano reciprocamente
c) atomi con deboli cariche che si attirano reciprocamente
d) ioni positivi trattenuti insieme dagli elettroni di valenza delocalizzati cioè liberi di muoversi tra tutti gli ioni
2) Una delle principali proprietà dei metalli, la conducibilità elettrica, si può interpretare sulla base di un modello di
legame. Quale tra i seguenti è il più convincente?
a) gli elettroni di tutti gli atomi sono liberi di muoversi nel reticolo cristallino
b) gli ioni positivi del metallo possono muoversi in una direzione e gli elettroni nell'altra
c) tutti gli elettroni di valenza sono condivisi tra coppie di atomi e costituiscono una catena continua di carica
negativa
d) gli elettroni di valenza sono bloccati in posizioni rigide tra gli ioni del metallo
3) A temperatura ambiente, qual è lo stato di aggregazione dei metalli? [Punt. 0-1]
a) sono quasi tutti solidi
b) sono quasi tutti liquidi
c) sono quasi tutti gassosi
d) possono essere solidi, liquidi o gassosi: dipende dal tipo di reticolo
cristallino
Soluzioni: 1) d 2) a 3) a