SEZIONE SCIENTIFICA - Patologia in pillole
PATOLOGIA IN PILLOLE
Nr. 52
S. Crippa, G. Brancatelli, I. Andreoli-Roth,
L. Bronz
Storia clinica
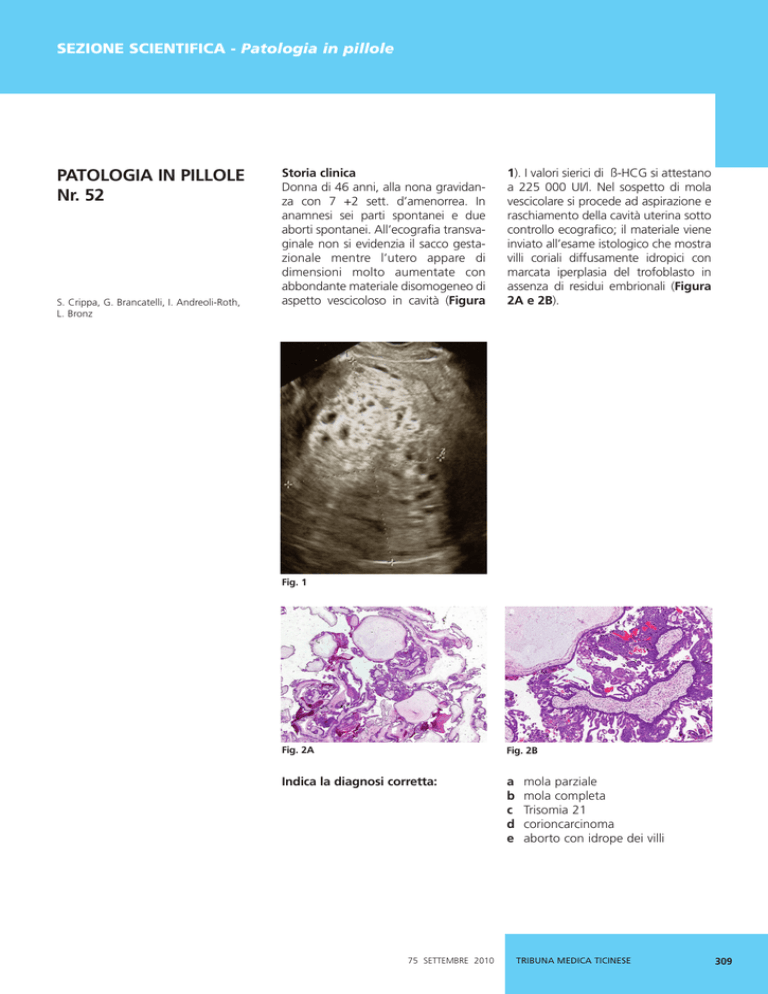
Donna di 46 anni, alla nona gravidanza con 7 +2 sett. d’amenorrea. In
anamnesi sei parti spontanei e due
aborti spontanei. All’ecografia transvaginale non si evidenzia il sacco gestazionale mentre l’utero appare di
dimensioni molto aumentate con
abbondante materiale disomogeneo di
aspetto vescicoloso in cavità (Figura
1). I valori sierici di ß-HCG si attestano
a 225 000 UI/l. Nel sospetto di mola
vescicolare si procede ad aspirazione e
raschiamento della cavità uterina sotto
controllo ecografico; il materiale viene
inviato all’esame istologico che mostra
villi coriali diffusamente idropici con
marcata iperplasia del trofoblasto in
assenza di residui embrionali (Figura
2A e 2B).
Fig. 1
Fig. 2A
Fig. 2B
Indica la diagnosi corretta:
a
b
c
d
e
75 SETTEMBRE 2010
mola parziale
mola completa
Trisomia 21
corioncarcinoma
aborto con idrope dei villi
TRIBUNA MEDICA TICINESE
309
SEZIONE SCIENTIFICA - Patologia in pillole
Diagnosi
Mola completa
Commento
La mola vescicolare comprende due
entità, la mola parziale e la mola completa, che sono distinguibili sulla base
dell’aspetto macroscopico, dell’esame
istologico e del profilo cromosomico.
La mola completa non presenta tessuti embrionali o fetali ed è caratterizzata da villi diffusamente idropici, con
diffusa iperplasia del trofoblasto e marcate atipie del trofoblasto intermedio;
usualmente presenta cariotipo 46,XX.
La mola parziale può presentare residui
embrionali o fetali ed è caratterizzata
da villi di varie dimensioni, focalmente
idropici, con focale iperplasia del trofoblasto, solo lievi atipie del trofoblasto
intermedio e frequenti inclusioni trofoblastiche; inoltre è usualmente associata a un cariotipo triploide a seguito
della fecondazione di un uovo normale da parte di due spermatozoi e ciò
giustifica la co-presenza, nei feti associati a mola parziale, di malformazioni
congenite da trisomia come sindattilia
e “labbro leporino”.
Un tempo i casi di mola completa venivano diagnosticati nel secondo trimestre di gravidanza sulla base di tipici
sintomi e segni clinici come: eccessiva
dimensione dell’utero, anemia, tossiemia, iperemesi, ipertiroidismo ed insufficienza respiratoria. Oggi la diagnosi
viene effettuata quasi sempre nel
primo trimestre grazie a dosaggi accurati di hCG e all’esame ecografico precoce; ciò ha modificato radicalmente
la presentazione clinica e gli aspetti
patologici di questa entità. In particolare l’eccessiva dimensione dell’utero
viene riscontrata solo nel 28% dei casi
contro il 51% del passato, l’anemia nel
5% contro il 54%, la tossiemia nell’1%
contro il 27%, e l’iperemesi nell’8%
contro il 26% mentre eccezionali sono
i casi di ipertiroidismo o insufficienza
respiratoria.
I pazienti con mola parziale si presentano usualmente con segni e sintomi
310
TRIBUNA MEDICA TICINESE
clinici di aborto ritenuto o misconosciuto, quali sanguinamenti vaginali
con utero di normali dimensioni; questi sintomi non si sono modificati nelle
casistiche studiate negli ultimi anni.
Esame ecografico
L’alterazione ecografica più suggestiva
di mola completa è l’aspetto vescicoloso dei villi, dovuto all’edema marcato,
il quale è più manifesto nel secondo
che nel primo trimestre. Questo quadro può essere integrato con i valori di
hCG che, quando elevati al momento
dell’ecografia, permettono di sospettare fortemente una mola completa
piuttosto che semplicemente un aborto ritenuto. La conferma diagnostica è
sempre e comunque istologica.
Anche la mola parziale può essere
sospettata all’ecografia quando si
osservano focali alterazioni cistiche
nella placenta e un rapporto dimensionale alterato del sacco uterino, verosimilmente correlato ad una trisomia.
Dosaggio di hCG
L’hCG è prodotto dalle cellule trofoblastiche ed i suoi livelli aumentano di
fronte a significativa iperplasia trofoblastica. Livelli sierici di hCG maggiori
di 100.000 mIU/ml prima dell’evacuazione sono presenti in circa il 40-45%
dei casi di mola completa e solo in rari
casi di mola parziale.
Diagnosi anatomo-patologica
La valutazione istologica di materiale
abortivo sempre più precoce ha
aumentato la difficoltà per il patologo
nel distinguere una mola completa iniziale da una mola parziale o anche da
un aborto idropico non-molare. Per
questo il referto istologico è spesso di
compatibilità ma il patologo può aiutarsi con indagini di citometria di flusso per determinare la ploidia o con
immunoistochimica per p57 o PHLDA2
(Pleckstrin homology-like domain, family A, member 2). L’associazione della
ploidia e dell’espressione immunoistochimica di questi due marcatori è in
75 SETTEMBRE 2010
grado di distinguere con accuratezza la
maggior parte dei casi di mola completa, mola parziale e aborto non-molare.
Le pazienti che ricevono una diagnosi
di mola dovrebbero essere seguite per
le possibili complicanze come anemia,
tossiemia e ipertiroidismo. In ogni caso
dovranno essere sottoposte ad evacuazione; il metodo ottimale è rappresentato dall’aspirazione/raschiamento poiché, rispetto al trattamento medico
con ossitocina e/o prostaglandine,
garantisce maggiori risultati in riferimento a potenziali sanguinamenti,
infezioni o ritenzione di tessuto molare.
Se la paziente non desidera altre gravidanze può essere sottoposta ad isterectomia al fine di eliminare il rischio
di mola invasiva benché ciò non elimini la possibilità di malattia metastatica. Monitoraggi periodici di hCG
sono indispensabili al fine di verificare
che non si sviluppi una cosiddetta
neoplasia trofoblastica persistente.
Quest’ultima può svilupparsi sia in
una mola completa che in una mola
parziale e può essere legata o meno
alla presenza di metastasi. Si parla di
neoplasia non metastatica quando il
tessuto molare o corioncarcinoma
infiltra la parete uterina in assenza di
evidenza di malattia oltre l’utero; al
contrario si parla di neoplasia metastatica quando sono presenti localizzazioni extrauterine.
I criteri di definizione di una neoplasia persistente dopo mola, recentemente definiti da International Federation of Gynecology and Obstetrics,
includono uno dei seguenti:
- livelli di hCG che non rientrano
nei limiti dopo evacuazione;
- evidenza di metastasi;
- diagnosi istologica di corioncarcinoma
Negli Stati Uniti l’incidenza di neoplasia persistente riportate dopo mola
completa varia da 18% a 29% e non
appare influenzata dalla precocità di
diagnosi e trattamento della mola.
Secondo dati riportati da alcuni centri
SEZIONE SCIENTIFICA - Patologia in pillole
americani di riferimento, dopo evacuazione della mola completa, il 15%
delle pazienti mostrerà segni di invasione uterina locale mentre il 4%
delle pazienti mostrerà metastasi. La
chemioterapia per queste pazienti
rimane il trattamento curativo, il quale
potrà portare a guarigione tra l’80% e
il 100% delle pazienti a seconda dell’estensione della malattia.
Nel casi di mola completa è possibile
stabilire gruppi di pazienti ad alto
rischio di neoplasia persistente sulla
base di elevati livelli di hCG prima dell’evacuazione (>100.000 mIU/ml) e di
dimensioni uterine significativamente
aumentate.
I casi riportati di neoplasia persistente
dopo mola parziale sono ovviamente
molto meno numerosi corrispondendo a circa l’1-5% delle pazienti, le
quali non hanno mostrato segni o sintomi clinici particolari per poter essere classificate ad alto rischio.
Ma come e per quanto tempo devono essere dosati i livelli di hCG?
Non esiste una risposta univoca a
questa domanda tuttavia appare
ragionevole, dopo evacuazione per
mola parziale o completa, il dosaggio
settimanale di hCG fino all’indosabilità (<5 mIU/ml) per tre settimane, e
seguenti dosaggi mensili che attestino l’indosabilità per sei mesi.
A tal fine è importante comunicare
alla paziente la necessità di evitare
nuove gravidanze in questo periodo
che potrebbero interferire con i livelli
di hCG impedendone un monitoraggio attendibile. Dopo l’evacuazione,
sono inoltre raccomandati metodi
contraccettivi, di barriera meccanica
oppure ad assunzione orale.
Si ricordi inoltre che le pazienti
potranno avere in futuro nuove e
normali gravidanze benché il rischio
assoluto di mola sarà di circa 1%
dopo una mola e di circa 15-18%
dopo due mole.
Decorso della paziente dopo
il raschiamento
Nel periodo post-operatorio i valori sierici delle ß-HCG, dopo un’iniziale decisa diminuzione fino a 1053 UI/l, sono
risaliti lievemente per poi stabilizzarsi
intorno a 1500 UI/l. Si è proceduto
pertanto a somministrazione di Methotrexate in seguito alla quale i valori
sierici sono scesi ulteriormente fino a
544 UI/l, benché le ß-HCG non siano
mai state indosabili.
Dopo discussione con la paziente, nel
sospetto clinico di persistenza di tessuto molare a livello uterino, benché
questo non fosse visibile all’ecografia
transvaginale, si è deciso di procedere
ad isterectomia. Non si effettua stadiazione sistemica. L’esame istologico dell’utero ha mostrato gli esiti del raschiamento in corrispondenza della cavità
uterina senza evidenziare residui di tessuto trofoblastico in cavità. I campioni
multipli seriati del miometrio hanno
evidenziato un focolaio di 0,4 cm di
tessuto trofoblastico all’interno di un
vaso di piccolo-medio calibro (Figure
3A e B). Il reperto corrisponde pertanto ad una mola invasiva.
S. Crippa
Istituto Cantonale di Patologia, Locarno
G. Brancatelli
Servizio Ginecologia e Ostetricia
Ospedale S. Giovanni, Bellinzona
I. Andreoli-Roth
FMH Ginecologia e Ostetricia, Bellinzona
L. Bronz
Servizio Ginecologia e Ostetricia,
Ospedale S Giovanni, Bellinzona
Bibliografia
Berkowitz RS, Goldstein DP. Clinical practice.
Molar pregnancy. N Engl J Med. 2009 Apr 16;
360(16):1639-45. Review
Dopo l’isterectomia si è assistito a rapida negativizzazione dei valori sierici di
ß-HCG nell’arco di circa tre settimane
dall’intervento.
Sono previsti regolari dosaggi ormonali sino a raggiungere 6 mesi di indosabilità delle ß-HCG.
A
Fig. 3:
B
A: tessuto trofoblastico nel lume di un vaso della parte uterina.
B: debole espressione di ß-HCG
75 SETTEMBRE 2010
TRIBUNA MEDICA TICINESE
311