UNIVERSITA’ DEGLI STUDI DI UDINE
FACOLTA’ DI MEDICINA E CHIRURGIA
CLINICA DI ANESTESIA E RIANIMAZIONE
Direttore: prof. G. Della Rocca
Tesi di laurea
EFFETTI DELLA NORADRENALINA SULLO STROKE VOLUME
MEDIANTE MONITORAGGIO CON DOPPLER ESOFAGEO
Relatore:
prof. Giorgio DELLA ROCCA
Correlatore:
dott.ssa Livia POMPEI
Laureando:
Fabio ROSA
ANNO ACCADEMICO 2006-2007
INDICE
1
INTRODUZIONE
pag. 3
1.1
Determinanti della gittata cardiaca
pag. 4
1.1.2
Metodiche di misurazione della gittata cardiaca
pag. 21
1.2
Doppler esofageo
pag. 38
1.3
Noradrenalina
pag. 48
2
MATERIALI E METODI
pag. 57
3
RISULTATI
pag. 62
4
DISCUSSIONE
pag. 64
5
CONCLUSIONI
pag. 69
6
ICONOGRAFIA
pag. 70
7
BIBLIOGRAFIA
pag. 95
INTRODUZIONE
Nel periodo perioperatorio è indispensabile assicurare al paziente
un’adeguata perfusione d’organo, preservando la funzionalità cardiaca, la
volemia ed il tono vascolare.
La pressione arteriosa e la diuresi, frequentemente usati come segni clinici
della perfusione d’organo, si sono dimostrati spesso insufficienti nel valutare
lo stato emodinamico del paziente [1-3]. Si rende quindi necessario un
monitoraggio cardiovascolare avanzato che permetta la stima della gittata
cardiaca [4, 5].
La gittata cardiaca (cardiac output, CO) è determinata principalmente da
precarico, postcarico e contrattilità miocardica. E’ proprio il precarico il
fattore su cui si va ad agire attraverso il riempimento volemico [6].
Negli ultimi trent’anni il metodo della termodiluizione si è affermato
come “gold standard” per la misurazione del CO grazie alla sua accuratezza
ed affidabilità [7, 8].
Cateteri moderni consentono il rilevamento del CO in continuo [9, 10].
Il posizionamento del catetere arterioso polmonare (PAC) richiede una
procedura complessa e non esente da complicanze, inoltre un ampio studio
ha dimostrato che l’utilizzo di questo monitoraggio è correlato all'aumento
della mortalità, del tempo e dei costi di degenza [7]. Talvolta i dati ricavati
attraverso il PAC non influiscono effettivamente sulle decisioni cliniche
[11-13].
Tutti questi aspetti hanno portato ad introdurre delle metodiche meno
invasive [14, 15] che comprendono:
-
Doppler esofageo
-
Analisi del contorno del polso
3
-
Principio di Fick
-
Ecografia transesofagea
-
Bioimpedenza toracica
-
Sturazione d’ossigeno venosa mista (SvO2)
-
Tonometria intestinale
La scelta della tecnica di monitoraggio cardiovascolare avanzato deve
essere effettuata valutando il rapporto tra aumento dei rischi ed effettivi
benefici.
Il doppler esofageo è uno strumento non invasivo per il quale non sono
state segnalate complicanze. Viene utilizzato solitamente in pazienti sedati,
ma può essere tollerato da pazienti coscienti se la sonda viene inserita per
via nasale.
In diversi studi si è rivelato una guida efficace nella somministrazione intra e
peri-operatoria dei fluidi ed attendibile nella valutazione delle variazioni di
CO [16-26]. Il doppler soprasternale ha permesso di ricavare importanti
informazioni aggiuntive dall’analisi della forma d’onda, fondamentali nella
gestione del paziente, quali le variazioni di precarico, postcarico ed
inotropismo [27].
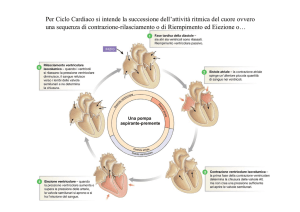
1.1 Determinanti della gittata cardica
La finalità del monitoraggio cardiovascolare avanzato è determinare il
volume di eiezione cardiaca (stroke volume, SV) ed i fattori ad esso
correlati.
Lo SV è definito come la differenza fra il volume di sangue presente nel
4
ventricolo sinistro a fine diastole (volume telediastolico ventricolare, EDV) e
quello che rimane alla chiusura della valvola aortica a fine sistole (volume
telesistolico ventricolare, ESV). Questo corrisponde al cambiamento di
volume generato durante la fase di eiezione del ciclo cardiaco, ossia
coincide con la quantità di sangue che il cuore pompa in aorta ad ogni
sistole.
Volume di eiezione = EDV – ESV
Nell’adulto il volume di eiezione ad ogni battito varia tra i 60 ed i 90 ml [28].
La frazione di eiezione (FE) che normalmente corrisponde a 0.6 - 0.7 è
il rapporto tra il volume di eiezione ed il volume telediastolico.
FE =
EDV − ESV
EDV
Assieme alla frequenza cardiaca (HR) lo SV va a determinare la gittata
cardiaca (CO) secondo la relazione:
CO = SV x HR
La gittata cardiaca è quindi la quantità di sangue che il cuore manda in
circolo in un minuto e si modifica al variare della frequenza cardiaca o del
volume di sangue espulso in ogni singola sistole [1].
In un uomo a riposo la gittata cardiaca è in media 5.6 L/min; per la donna
invece è di circa 4.9 L/min.
Si è visto che il CO aumenta in proporzione alla superficie corporea, per
questo è appropriato esprimere la gittata cardiaca in termini di indice
cardiaco (cardiac index, CI). Questo indice corrisponde alla gittata cardiaca
normalizzata per la superficie corporea in m² (body surface area, BSA)
secondo la relazione:
5
CI = CO / BSA
A sua volta la BSA viene calcolata attraverso la formula:
BSA = Altezza0.725 x Peso0.425 x 0.007184
(L’altezza viene espressa in cm ed il peso kg.)
I valori di CI medi nell’adulto sono di circa 3 L · min-1 [29].
Il ritmo del cuore non è l’unico aspetto che determina la performance
cardiaca, infatti altri fattori agiscono simultaneamente ed interagiscono tra
loro adattando la funzione cardiaca alle diverse condizioni dell’organismo.
Questi fattori sono:
-
Precarico
-
Postcarico
-
Inotropismo
-
Frequenza cardiaca
La frequenza e l’inotropismo sono fattori intrinseci al cuore mentre precarico
e postcarico influenzano la performance cardiaca in modo estrinseco ed
indipendente [28].
Precarico
Le dimensioni raggiunte dal ventricolo a fine diastole coincidono con un
certo grado di stiramento delle fibre miocardiche (precarico) e questa
tensione parietale condiziona la gittata cardiaca secondo la legge che Frank
e Starling hanno elaborato tra la fine del '800 e l’inizio del '900, per la quale
all’aumentare del volume telediastolico aumenta lo SV (fig. 1A).
Nella pratica clinica per stimare il precarico si possono usare dei
6
surrogati rappresentativi del volume ventricolare sinistro, quali la pressione
polmonare incuneata e la pressione venosa centrale; tuttavia si noti che
volume telediastolico e pressione telediastolica non sono sinonimi e non
sono nemmeno variabili correlate in modo lineare. [28]
Gli indici di precarico comunemente utilizzati sono:
-
Left Ventricular End Diastolic Volume (LVEDV)
-
Left Ventricular End Diastolic Pressure (LVEDP)
-
Left Atrial Pressure (LAP)
-
Pulmonary Capillare Wedge Pressure (PCWP)
-
Central Venous Pressure (CVP)
Il volume telediastolico ventricolare sinistro (LVEDV) è l’indice più
fedele, ma è difficile da misurare clinicamente; una misurazione per
approssimazione può essere fornita dall’ecocardiografia transesofagea.
La pressione telediastolica ventricolare sinistra (LVEDP) è un indice
fedele
del
LVEDV,
purché
la
compliance
cardiaca
sia
normale
(cardiomiopatie dilatative ed insufficienza aortica aumentano la compliance
mentre stenosi aortica, ischemia miocardica e farmaci inotropi la riducono).
La pressione atriale sinistra (LAP) è il monitoraggio del precarico più
frequentemente
impiegato
in
cardiochirurgia.
Viene
monitorizzata
introducendo un catetere nella vena polmonare superiore di destra e
spingendolo fino all’atrio sinistro. E’ ben correlato con la LVEDP purché la
valvola mitralica sia integra (valori normali: 1-10 mmHg).
La
pressione
di
incuneamento
capillare
polmonare
(PCWP)
monitorizzata attraverso il cateterismo dell’arteria polmonare con catetere di
Swan-Ganz è ben correlata alla LAP. Tuttavia la PEEP o una misurazione a
fine espirazione danno una PCWP sovrastimata (valori normali: 0-12
mmHg).
La pressione venosa centrale (CVP) è l’indice che più scarsamente si
correla con il precarico o con l’LVEDV, ma è anche quello che viene
7
normalmente
usato. Si presuppone infatti che la funzione ventricolare
destra e sinistra siano uguali e parallele (valori normali variano tra 3 e 8
cmH2O) [28].
Per comprendere secondo quale principio il precarico influenza la
performance miocardica possiamo analizzare quanto succede nel singolo
sarcomero.
All’aumentare dello stiramento migliora l’interazione tra i filamenti di actina e
miosina fino a che il sarcomero raggiunge una lunghezza ottimale di
2.2 µm. L’embricazione più efficace ottenuta grazie alla distensione passiva
(fase diastolica) si traduce in un aumento della forza esercitata durante la
contrazione
(fase
sistolica).
Se
lo
stratching
è
eccessivo,
cioè
sovramassimale, le fibre si disembricano e si riduce la forza sviluppabile
(punto massimo della curva di Frank–Starling).
Negli esperimenti su fibre muscolari isolate, la forza di contrazione veniva
misurata attraverso un trasduttore di tensione; prima di causare la
contrazione si procedeva a variare il peso del carico attaccato al preparato
di muscolo isolato [30, 31] (fig. 2A).
Il carico usato in questo esperimento può essere chiamato “stress” (forza
normalizzata per l’area della sezione trasversale, ossia la forza in una
superficie unitaria della parete). La normalizzazione permette di confrontare
muscoli di dimensioni diverse e può essere trasferita al ventricolo, così
avremo che la tensione di parete (T) è il prodotto dello stress (σ) per lo
spessore di parete (h).
Tensione di parete = σ x h
Applicando quindi queste nozioni al cuore nel suo complesso, possiamo
dire che il precarico è proporzionale alla lunghezza delle fibre miocardiche
un istante prima della contrazione, cioè al volume telediastolico determinato
dal sangue venoso che ritorna al cuore.
8
Quando volumi maggiori di sangue tornano dal circolo periferico si
incrementa la pressione diastolica di riempimento e il ventricolo subisce una
distensione maggiore; a questa tensione corrisponderà una maggior forza
di contrazione, cioè una maggior pressione sistolica, così da riuscire a
pompare verso la periferia la quantità aggiuntiva di sangue. A successivi
incrementi di riempimento corrispondono analoghi aumenti di pressione
sistolica fino al raggiungimento del precarico ottimale, oltre al quale un
ulteriore riempimento non svilupperà aumento di pressione. Per pressioni di
riempimento molto elevate la pressione massima raggiunta durante la
sistole si riduce.
Diversi elementi determinano il volume di fine diastole:
-
Volemia
-
Tono venoso
-
Compliance della parete cardiaca
-
Kick atriale
-
Distribuzione del volume di sangue tra compartimento intra ed
extra-toracico
-
Pressione intratoracica negativa inspiratoria (vis a fronte)
Il precarico può essere aumentato aggiungendo volume alla circolazione o
mediante una venocostrizione acuta. Sebbene la venocostrizione produca
un modesto aumento del tono dei vasi di resistenza (postcarico), una
minima venocostrizione può causare grandi spostamenti di volume di
sangue nel compartimento centrale. Questo è possibile perché i vasi di
capacitanza contengono fino al 60-80% del sangue totale. L’effetto
distributivo centrale delle catecolamine può essere tanto importante quanto
quello inotropo
nell'aumentare la gittata cardiaca in un paziente
ipovolemico [1].
La contrazione dei muscoli degli arti inferiori o il clinostatismo aumentano il
ritorno venoso, e la contrazione atriale contribuisce al riempimento
9
ventricolare per il 15-20% del volume complessivo [28].
Infine, un ventricolo irrigidito (ad esempio nella fibrosi cardiaca) sarà molto
meno distensibile, come mostrano le curve pressione – volume (fig. 3).
Sapendo che la compliance del preparato di muscolo cardiaco è data dalla
variazione della lunghezza al variare del carico, possiamo dire che per la
camera ventricolare:
C =
V
P
(C, compliance; V, volume; P, pressione)
Dalla derivata del volume rispetto alla pressione possiamo ricavare un
indice della distensibilità del ventricolo [32]:
Kp =
dV / dP
P
(Kp, indice di distensibilità; P, pressione; V, volume)
Rispetto al muscolo isolato, quando si considera il ventricolo bisogna
ricordare che anche la curvatura della camera ventricolare influisce sul
rapporto tra stress e pressione. La tensione parietale viene messa in
relazione al raggio di curvatura attraverso la legge di Laplace:
σ =
P × R
2h
(σ, stress; P, pressione; R, raggio interno; h, spessore di parete)
Questa formula si riferisce alla sfera, quindi è direttamente applicabile al
ventricolo in sistole, ma didatticamente viene usata anche per il ventricolo in
telediastole in quanto la legge di Laplace applicata a questo secondo caso
risultata particolarmente complessa. La forma ellissoidale del ventricolo in
10
diastole conferisce comunque minor stress parietale rispetto a quella
sferica [33, 34].
Vediamo quindi che la stessa pressione in un ventricolo di dimensioni
maggiori genera una maggior tensione di parete, mentre un ventricolo con
parete ispessita darà minor stiramento delle fibre.
Lo stress parietale nella pratica medica non è da tenere in
considerazione solo in relazione al precarico e alla gittata cardiaca ma
anche al consumo di ossigeno, del quale è il determinante fondamentale
assieme alla frequenza cardiaca [28].
Postcarico
Il postcarico è la tensione di parete che il miocardio deve affrontare
durante la sistole e coincide con la forza che si oppone all’accorciamento
delle fibre ventricolari [33].
Anche per il precarico si era parlato di tensione di parete; si trattava della
tensione passiva generata dalla pressione di riempimento del ventricolo.
Ora invece valuteremo la tensione attiva della contrazione che genera la
pressione di eiezione. Cambia quindi anche l’approccio alla legge di
Laplace:
σ =
P ×R
2h
→
P =
× 2h
R
Non è più la pressione endoventricolare ad essere convertita in stress
(passivo, diastolico), bensì è la tensione parietale (attiva, sistolica) a
produrre pressione.
Vediamo quindi che un ventricolo dilatato è svantaggiato rispetto ad un
ventricolo di dimensioni normali in quanto deve sviluppare una tensione di
parete più elevata e consumare più ossigeno per ottenere un eguale livello
11
pressorio. L’aumento dello spessore della camera (ipertrofia) può
compensare e controbilanciare l’aumento cronico della pressione di
eiezione (ad esempio nella stenosi aortica) [32].
Alla contrazione isovolumetrica e all’eiezione rapida segue una fase di
eiezione lenta nella quale le fibre muscolari esauriscono progressivamente
la possibilità di accorciarsi ulteriormente. In questa fase in cui la forza di
contrazione si sta riducendo, la pressione di eiezione può essere mantenuta
perché anche il raggio cavitario va diminuendo (vedi legge di Laplace) [35].
Nel preparato di muscolo cardiaco la massima velocità di contrazione
(Vmax) si ottiene a carico zero, e va progressivamente diminuendo
all’aumentare del carico (postcarico). Questo peso viene montato dopo che
si è già applicato il precarico e si è boccata la leva così da non modificare la
lunghezza del sarcomero prima della contrazione, cioè non costituisce un
ulteriore precarico (fig. 2B).
Variando oltre al postcarico anche il precarico si osserva che la velocità di
accorciamento ne viene influenzata ma la Vmax (raggiungibile a postcarico
zero) resta invariata [30] (fig. 4A).
Da questi esperimenti si è potuto verificare che quando il carico imposto alle
fibre muscolari aumenta, diminuiscono sia la velocità di contrazione che
l’entità dell’accorciamento e si incrementano sia la tensione attiva che il
tempo necessario a raggiungere il picco di tensione.
Queste nozioni sono fondamentali per comprendere il comportamento
del cuore in vivo, nel quale l’aumento del postcarico determinerà:
-
la riduzione della velocità di contrazione ventricolare;
-
la diminuzione dell’entità della contrazione ventricolare;
-
l’incremento della tensione attiva della parete ventricolare;
-
l’allungamento del tempo necessario a raggiungere la
massima tensione di parete [36].
Quando il cuore lavora contro un postcarico elevato, ad esempio in caso di
12
ipertensione, il volume di sangue espulso diminuisce perché è minore
l’accorciamento del ventricolo. Se la pressione arteriosa avesse lo stesso
valore della massima pressione sistolica, il ventricolo si contrarrebbe in
condizioni completamente isometriche ed il flusso di sangue durante la
stistole sarebbe nullo. La massima pressione sviluppata in queste
condizioni è la massima forza isometrica di cui il ventricolo è capace per un
dato precarico [30].
In realtà quando aumenta la pressione arteriosa il volume di eiezione
diminuisce solo in modo transitorio, ritornando in pochi battiti al suo valore
originale. L’aumento del volume residuo di sangue nel ventricolo alla fine
della sistole, dovuto al minor accorciamento delle fibre miocardiche,
determina una maggior distensione (precarico) facendo aumentare la forza
di contrazione del cuore e ripristinando il volume di eiezione.
Oltre a questo meccanismo ricordiamo che la stimolazione dei
barocettori deprime il sistema ortosimpatico ed eccita il parasimpatico
riducendo la forza e la frequenza cardiaca.
Tutti questi processi si compensano tra loro minimizzando l’effetto della
pressione arteriosa sulla gittata [37].
I principali fattori che determinano il postcarico sono:
-
raggio del ventricolo (correlato al precarico ed al volume
intracavitario);
-
forma del ventricolo;
-
spessore della parete ventricolare;
-
distensibilità aortica;
-
resistenze vascolari periferiche;
-
viscosità ematica;
-
massa sanguigna in aorta.
Nella pratica clinica le resistenze vascolari sistemiche sono utilizzate
frequentemente come stima del postcarico; esse comunque riflettono
13
soprattutto il tono arteriolare periferico (dove l’impedenza è massima) e non
la tensione di parete del ventricolo durante la sistole [36].
Per comprendere i fattori che determinato le resistenze vascolari
(systemic vascular resistence, SVR) dobbiamo rifarci alla legge di Poiseuille
che descrive il comportamento di un liquido omogeneo che fluisce in un
condotto cilindrico rigido con flusso continuo e moto laminare:
Q =
P1 − P2
R
(Q, flusso; P, pressione; R, resistenza)
Il flusso, cioè il volume che scorre in un condotto nell’unità di tempo, è
direttamente proporzionale al gradiente di pressione tra i capi del circuito ed
inversamente proporzionale alla resistenza.
Quindi nel sistema cardiocircolatorio la gittata cardiaca è proporzionale alla
differenza tra pressione arteriosa media (MAP) e pressione venosa centrale
(CVP), mentre è inversamente proporzionale alle resistenze vascolari
sistemiche che vanno a costituire il postcarico. Essendo un sistema chiuso
ovviamente il volume eiettato e il ritorno venoso (RV) devono coincidere.
CO = RV =
MAP − CVP
SVR
A loro volta le resistenze periferiche aumentano con la viscosità del sangue
(η) e con la lunghezza dei vasi (L), mentre variano con un rapporto
esponenziale inverso rispetto al raggio del vaso (r4):
SVR =
ηL
8
×
4
π
r
(8 / π è una costante di integrazione matematica)
14
E’ il raggio quindi l’elemento determinante in quanto se il raggio raddoppia
le resistenze si riducono di ben 16 volte. Si noti che per mantenere un
flusso costante in vasi di diametro decrescente il gradiente pressorio deve
aumentare alla quarta potenza.
La legge di Poiseuille si riferisce ad un flusso continuo in un condotto rigido,
ma il flusso vascolare è pulsante e quindi le arterie si devono distendere per
accogliere il volume in eccesso, dovuto al mancato sincronismo tra eiezione
cardiaca e ritorno venoso. Il grado di distensione delle arterie dipenderà
dalla loro compliance [6].
Come abbiamo già detto, per stimare il postcarico si usano
frequentemente le resistenze vascolari sistemiche, la cui principale
espressione è la pressione arteriosa.
L’impedenza aortica (pressione aortica divisa per il flusso aortico in
quell’istante) è una stima accettabile del postcarico e può essere ottenuta in
modo non invasivo attraverso l’ecocardiografia, determinando il flusso
aortico al momento del suo picco massimo.
Tuttavia per maggior accuratezza si dovrebbe utilizzare una misura reale,
come ad esempio la tensione parietale ventricolare telesistolica, che però
richiede la determinazione diretta della pressione endocavitaria, oltre alla
valutazione ecocardiografica dello spessore di parete e delle dimensioni
ventricolari [36].
Inotropismo o contrattilità
L’inotropismo si può definire come la forza e la velocità della
contrazione ventricolare quando precarico e postcarico sono mantenuti
costanti. E’ una misura delle prestazioni del cuore indipendenti dal precarico
e dal postcarico [1].
Le variabili che descrivono la contrattilità sono: la velocità di accorciamento,
la forza di contrazione e l’entità dell’accorciamento.
15
Negli esperimenti su muscolo cardiaco isolato variando la contrattilità
con sostanze inotrope possiamo ottenere una famiglia di curve di
Frank-Starling, dette curve di Sarnoff (fig. 1B).
In questi esperimenti la velocità massima di contrazione, la quale viene
ottenuta quando il carico è zero, permette di stimare l'attività contrattile
intrinseca. Variando lo stato inotropo varia anche la Vmax ottenibile
(fig. 4B).
Da
questi
esperimenti
comprendiamo
che
forza
e
velocità
sono
inversamente proporzionali, cosicché in assenza di carico la forza è minima
e la velocità è massima, mentre in una contrazione isometrica, ove non
avviene accorciamento esterno, la forza è massima e la velocità è zero.
Nel cuore intatto non si può avere carico zero e quindi non possiamo
misurare la Vmax. Possiamo stimare la massima velocità dello sviluppo di
forza da parte del ventricolo valutando la massima pendenza raggiunta
dalla curva di pressione endoventricolare (dP/dt max), ma questo parametro
è condizionato anche dal precarico [28] (fig. 5).
Ci sono dei meccanismi compensatori che determinano una miglior
performance
ventricolare
indipendentemente
dai
cambiamenti
nella
lunghezza delle fibre miocardiche e
sono definiti autoregolazione
omeometrica.
esempio
L’effetto
Anrep
è
un
di
autoregolazione
omeometrica, che si verifica quando il postcarico o le resistenze vascolari
sistemiche aumentano bruscamente, provocando un incremento della
pressione telediastolica e diastolica del ventricolo sinistro. Questi valori
elevati sono transitori e ritornano ai valori di base in quanto la funzione
contrattile migliora in risposta al carico pressorio [38].
Un
altro
esempio
di
autoregolazione
omeometrica
è
l’effetto
"treppe" (gradino). Questo fenomeno è stato descritto per la prima volta da
Bowditch il quale notò che l’intervallo di tempo tra gli stimoli (frequenza
cardiaca) era correlato in modo negativo alla tensione miocardica sviluppata
(come misura della funzione contrattile). Si pensa che questo reperto sia
16
dovuto all'aumento della concentrazione intracellulare di ioni calcio [39]. Un
fenomeno correlato in qualche modo e parzialmente contraddittorio è
l’effetto gradino negativo o inverso, per il quale la performance miocardica
migliora in risposta a lunghe pause fra i battiti, come si vede con la pausa
compensatoria che segue le extrasistoli ventricolari [40 ].
La velocità e la forza di contrazione dipendono dalla concentrazione
degli ioni calcio liberi nel citoplasma. Un aumento della contrattilità si può
osservare per azione di alcune sostanze, come la digitale, la noradrenalina
e la dobutamina, e per aumento della frequenza cardiaca, mentre avremo
una riduzione dell’inotropismo a seguito di acidosi o ipotermia.
L’interazione
tra
il
sistema
nervoso
simpatico
(adrenergico)
e
parasimpatico (colinergico) può modulare lo stato contrattile del cuore e la
frequenza cardiaca attraverso il rilascio locale di noradrenalina (NA) e
acetilcolina (ACh).
Il sistema simpatico ha un effetto facilitatorio sulla ritmicità del
pacemaker ed inoltre incrementa la contrattilità atriale e ventricolare. La
noradrenalina liberata dai terminali nervosi e le catecolamine circolanti
interagiscono con i recettori β-adrenergici della membrana delle cellule
cardiache. Questa interazione attiva l’adenilatociclasi che incrementa i livelli
intracellulari di AMPc. Come conseguenza si ha un aumento dell’ingresso
del calcio durante il plateau del potenziale d’azione. Le modificazioni dello
stato inotropo miocardico dovute all’azione del sistema simpatico sono
osservabili in seguito a stimolazione elettrica del ganglio stellato sinistro. In
seguito a questa stimolazione la massima velocità di variazione di
pressione nel tempo (dP/dt max) durante la sistole è notevolmente
aumentata [41].
Il sistema parasimpatico (nervi vaghi) esercita un profondo effetto
depressivo sul pacemaker cardiaco, sul miocardio atriale e sul tessuto di
conduzione atrio-ventricolare. I nervi vaghi deprimono anche la contrattilità
ventricolare, ma gli effetti sono modesti. L’acetilcolina liberata dalle
17
terminazioni vagali interagisce con i recettori muscarinici della membrana
delle
cellule
cardiache.
Questa
interazione
comporta
l’inibizione
dell’adenilatociclasi. La conseguente diminuzione della concentrazione
intracellulare di AMPc, inducendo una riduzione della conduttanza al calcio
della membrana cellulare, provoca anche riduzione della contrattilità del
miocardio. L’ACh rilasciata dai terminali vagali può anche inibire il rilascio di
noradrenalina dai terminali simpatici circostanti.
Analizzando le curve della pressione ventricolare possiamo ottenere un
quadro della contrattilità. Un cuore ipodinamico è caratterizzato da
un’elevata pressione telediastolica, una pressione ventricolare che aumenta
lentamente e che spesso raggiunge una pressione massima meno elevata.
Un ventricolo normale sotto stimolazione adrenergica mostra una ridotta
pressione telediastolica, una pressione ventricolare a rapido aumento e una
fase di eiezione breve.
Comunemente nella pratica clinica come indice della contrattilità viene
usata la frazione di eiezione. L’accorciamento frazionale (accorciamento del
diametro dell’asse minore diviso per il diametro telediastolico dell’asse
minore)
è
calcolato
routinariamente
con
l’ecocardiogramma
ed
è
intercambiabile con la frazione di eiezione, a condizione che non vi siano
anomalie del movimento parietale regionale. Entrambe queste misurazioni
di accorciamento sono sensibili alle alterazioni del precarico e del
postcarico. Esistono numerosi indici di contrattilità cardiaca. Tra questi
abbiamo la velocità di cambiamento della pressione ventricolare nel tempo
(dP/dt), la velocità di accorciamento della lunghezza circonferenziale media
delle fibre durante l’eiezione, le curve di funzione ventricolare e le curve
pressione-volume e forza-velocità nel ciclo cardiaco. La funzione di pompa
può essere stimata clinicamente attraverso la relazione lavoro-pressione
descritta dalla curva di Frank-Starling. La pendenza della fase ascendente
della curva di pressione ventricolare indica la massima velocità dello
sviluppo di forza da parte del ventricolo (massima velocità di variazione di
18
pressione nel tempo; dP/dt max). Questo parametro è molto sensibile ai
cambiamenti della performance contrattile intrinseca ma varia con il
precarico e in modo meno importante con il postcarico. La dP/dt max è utile
soprattutto per quantificare le modificazioni acute. La sua applicazione per
confrontare
diversi
pazienti
è
limitata
dalle
ampie
variazioni
interindividuali [41].
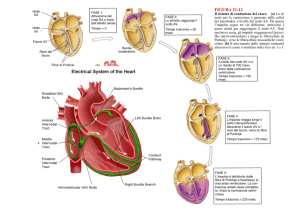
Frequenza cardiaca
Come abbiamo visto la variazione della frequenza ha un effetto
importante sulla gittata cardiaca (CO = HR x SV), per adattarla alle richieste
dell’organismo, al livello metabolico basale, al livello di attività, all’età
dell’individuo e alla superficie corporea.
L’automatismo del nodo del seno che determina la frequenza cardiaca
subisce influenze nervose e umorali. Il sistema nervoso simpatico provoca
un aumento della frequenza cardiaca, agendo sui recettori cardiaci β1;
il sistema nervoso parasimpatico, al contrario, determina una riduzione della
frequenza stimolando i recettori muscarinici. A riposo entrambi i sistemi
sono attivi ma predomina la funzione inibitoria del nervo vago. Le variazioni
di frequenza sono sempre dovute all'attività combinata dei due sistemi.
Anche la temperatura del cuore interviene variando la velocità delle reazioni
enzimatiche, cosicché un accesso febbrile può aumentare la frequenza di
10-20 bpm e si può usare l’ipotermia per ridurre il ritmo cardiaco durante gli
interventi a cuore aperto.
L’aumento della frequenza cardiaca di origine simpatica resta comunque il
meccanismo più importante capace di produrre un aumento della gittata
sotto sforzo [42].
La durata media del ciclo cardiaco nell’uomo a riposo è di circa 800 ms
cioè 75 bpm. Quando la frequenza cardiaca aumenta, ad esempio durante
uno sforzo massimale, il ciclo si riduce in modo non omogeneo e a farne le
19
spese è prevalentemente il tempo di diastole. Ciò significa che aumentando
il ritmo cardiaco il tempo netto di lavoro dei ventricoli (cioè la somma di tutte
le sistoli di un minuto) ed il consumo di ossigeno aumentano
considerevolmente, mentre il tempo utile al riempimento ventricolare si
riduce. La maggior parte del riempimento avviene all’inizio della diastole
(riempimento rapido) e quindi non risente di aumenti di frequenza cardiaca
fino a 150 bpm.
Per frequenze attorno a 180 bpm il tempo di rilassamento diastolico
diventerebbe troppo breve per garantire un riempimento ventricolare
congruo alle esigenze periferiche se non ci fosse l’intervento di una potente
sistole atriale.
Sopra i 120-180 bpm, nonostante il contributo dell’atrio, il riempimento
ventricolare è inadeguato e la gittata cardiaca si riduce drasticamente [35,
36].
Non dobbiamo trascurare che anche lo stiramento della parete dell’atrio
destro influenza direttamente la frequenza cardiaca determinandone un
aumento del 10-20%.
Da ultimo citiamo la relazione forza-frequenza (effetto "treppe"):
l’aumento del ritmo cardiaco produce un incremento della gittata agendo
sulla
contrattilità,
ossia
aumentando
l’ampiezza
e
la
velocità
di
accorciamento delle fibre ed incrementando la velocità di cambiamento
della pressione ventricolare nel tempo (dP/dt). L’aumento del dP/dt è
ancora più marcato se si mantengono adeguate le dimensioni di fine
diastole attraverso l’infusione di volume [28, 36].
20
1.1.2 Metodiche di misurazione della gittata cardiaca
Negli ultimi decenni sono stati validate numerose tecniche di
monitoraggio emodinamico. Valutando i rischi aggiuntivi a cui il paziente è
esposto dalle diverse metodiche possiamo dividerle in invasive, semiinvasive e non invasive [43].
Metodiche invasive
Il catetere arterioso polmonare (PAC) o catetere di Swan-Ganz,
introdotto negli anni ’70, è presto divenuto il “gold standard” per il
monitoraggio emodinamico. Si tratta di un catetere a più lumi, dotato di un
termistore, e con un palloncino gonfiabile all’estremità. Viene inserito nella
giugulare interna o nella vena succlavia e spinto attraverso le camere
cardiache destre fino all’arteria polmonare. Attraverso la termodiluizione
permette di calcolare il CO e da questo ricava lo SV [44].
La termodiluizione si fonda sul principio della conservazione della massa.
Se si immette una quantità nota di un indicatore in un volume sconosciuto di
un'altra sostanza dove questo si distribuisce in modo omogeneo, dalla
concentrazione finale dell’indicatore si risale al volume, secondo la formula:
V =
m
C
dove V è il volume ricercato, m è la massa dell’indicatore e C è la sua
concentrazione [29].
Se invece di volumi statici vogliamo conoscere un flusso, ad esempio il CO,
basta adattare la formula. Il flusso è il volume che scorre nell’unità di tempo
e facendo le opportune sostituzioni avremo:
21
CO =
V
massa dell' indicatore
=
t
concentrazione media × tempo
(CO, gittata cardiaca; V, volume; t, tempo)
Ad esempio se 5 mg di indicatore producono una concentrazione
plasmatica di 2 mg · L-1, il volume di distribuzione sarà di 2.5 L; se questo
volume richiede, per esempio, 30 secondi per passare in un determinato
punto del sistema, il ventricolo deve evidentemente pompare il plasma con
una velocità di 5 L al minuto (2.5 L in 30 secondi).
In condizioni normali, però, la concentrazione dell’indicatore nel punto di
prelievo non rimane costante. In una misurazione reale si vede come la
concentrazione dell’indicatore cresce fino a raggiungere un picco e poi
decade esponenzialmente. Questo andamento è dovuto al fatto che il
ventricolo espelle solo una frazione del suo contenuto e ad ogni sistole
nuovo sangue venoso, privo di indicatore, raggiunge la camera ventricolare
diluendo l’indicatore ivi presente.
Dato che la concentrazione dell’indicatore non è costate, per ricavare la
concentrazione media dovremo misurare l’area sotto la curva calcolandone
l’integrale e poi dovremo dividere per il tempo così come ci dice l’equazione
di Stewart-Hamilton [29].
CO =
massa dell 'indicatore
∫ conc.ind.t dt
Nel caso del PAC l’indicatore è la variazione di temperatura ma il principio è
uguale a quello della concentrazione. Si inietta un volume noto di soluzione
salina fredda attraverso il lume che si trova nell’atrio sinistro. L’indicatore
termico si miscelerà nel ventricolo destro cosicché la temperatura del
sangue diventerà omogenea. Questo volume sarà quindi eiettato nell’arteria
polmonare dove il termistore rileva la variazione di temperatura rispetto a
22
quella basale ed il monitor ci restituisce una curva dove in ascissa abbiamo
la variazione di temperatura ed in ordinata abbiamo il tempo. Viene
utilizzata l’equazione di Stewart-Hamilton modificata per la termodiluizione:
CO =
T b − Ti × Vi × K
∫ Tb t dt
dove Tb è la temperatura basale del sangue, Ti è la temperatura
dell’indicatore, Vi è il volume dell’indicatore, K è una costante di integrazione
matematica [45].
Sono stati sviluppati cateteri modificati che permettono la misurazione
semi-continua nella gittata cardiaca (CCO) attraverso un filamento che
produce calore sfruttando l’effetto Joule. L’indicatore termico sarà l’aumento
di temperatura del sangue e non la riduzione come era per il metodo a boli.
Un’opzione prevede che a livello dell’atrio destro il filamento termico innalzi
la temperatura di 4°C dal valore basale in modo intermittente; il rilevamento
viene effettuato nell’arteria polmonare. Un altro sistema utilizza un
termistore all’interno di un filamento termico spiraliforme e misura l’energia
necessaria a mantenere la superficie della spirale ad 1°C di differenza
rispetto la temperatura del sangue [24].
Dalla gittata cardiaca vengono poi derivati la gittata sistolica, lo "stroke
volume index" (SVI), le resistenze vascolari sistemiche e polmonari (SVR e
PVR) il lavoro sistolico del ventricolo sinistro e destro (LVSW e RVSW).
Questa tecnica consente inoltre il controllo continuo della pressione
polmonare (PAP) e della pressione venosa centrale (PVC). La pressione
capillare polmonare di occlusione (pressione incuneata, PCWP) viene
misurata mediante l'espansione del palloncino all’estremità del catetere e
costituisce un indice del precarico del ventricolo sinistro. E’ possibile anche
il calcolo dei valori di disponibilità e consumo di ossigeno (DO2 e VO2) [46].
I cateteri modificati di recente introduzione consentono il monitoraggio in
23
continuo della saturazione di ossigeno venosa mista (SVO2) ed il calcolo del
volume ematico di fine diastole del ventricolo destro (EDV) derivato dalla
frazione di eiezione destra (REF) e dalla gittata cardiaca semi-continua [44].
Questa metodica può avere complicanze gravi quali aritmie, danni valvolari,
rottura dell’arteria polmonare ed embolie [47].
Metodiche semi invasive
Il COLD System (Circulation-Oxigenation-Lung water and Liver
function-Diagnosi) (Pulsion Medical System, Munich, Germany) è stata una
delle prime, tra le metodiche di tipo volumetrico, ad essere proposta.
Questo
monitoraggio
utilizza
la
tecnica
del
doppio
indicatore
(termodiluizione + verde di indocianina) [48]. Necessita di un catetere in una
vena centrale ed uno in arteria femorale. La concentrazione dell'indicatore
iniettati a livello dell’accesso venoso centrale, viene misurata tramite una
fibra ottica posizionata nel catetere inserito in arteria femorale.
Anche in questo caso si applica l’equazione di Stewart-Hamilton ma il
rilevamento degli indicatori viene eseguito nell’arteria femorale. Durante la
diluizione trans-polmonare gli indicatori si distribuiscono in modo diverso nel
compartimento intravascolare e negli spazi extravascolari.
Vengono misurati i tempi che gli indicatori impiegano a raggiungere il
catetere arterioso (Mean Transit Time, MTt) così da calcolare lo spazio
accessibile a ciascuno.
Termodiluizione: CO x MTt = ITTV
Verde indocianato: CO x MTt = ITBV
EVLW = ITTV – ITBV
Il “freddo” diffonde negli spazi intravascolari e nel liquido polmonare
extravascolare (Intra Thoracic Thermal Volume, ITTV) mentre il verde di
24
indocianina resta nel compartimento intravascolare (Intra Thoracic Blood
Volume, ITBV) costituito da camere cardiache, letto vascolare polmonare
ed aorta fino al tratto addominale [49].
L’ITBV offre una stima del precarico. Vari studi hanno analizzato questo
indice comparandolo con l’area telediastolica del ventricolo sinistro ottenuta
mediante ecocardiografia o con la pressione di incuneamento capillare
polmonare [50, 51].
L’Extra Vascular Lung Water (EVLW) corrisponde alla parte di liquido che
fuoriesce dal letto vascolare polmonare e viene ricavato dalla differenza tra
l'ITTV e l'ITBV. Questo parametro si è dimostrato utile per rilevare i
cambiamenti del contenuto idrico polmonare ed è abbastanza sensibile da
consentire il riconoscimento precoce dell’edema polmonare [49].
Il sistema PiCCO (Pulse Contour Cardiac Output) (Pulsion Medical
System, Munich, Germany) merita un discorso a parte in quanto questa
metodica integra la tecnica della termodiluizione con quella dell’analisi del
contorno del polso [14]. Il PiCCO infatti è in grado di fornire un monitoraggio
continuo della CO, valutata mediante analisi del contorno del polso senza
necessità di posizionamento di un PAC ed effettuata battito per battito.
Mediante termodiluizione arteriosa inoltre permette di determinare i
principali volumi ematici (ITBV ed EVLW), con il bolo freddo come unico
indicatore [52-54]. Al monitor dello strumento sono collegati sia un catetere
venoso centrale (CVC) provvisto di un sensore di temperatura nel punto di
iniezione dei fluidi, sia un catetere arterioso femorale: quest'ultimo è dotato
di un termistore e di un trasduttore di pressione, per rilevare la
termodiluizione e per determinare la forma dell'onda pressoria [55].
Il primo algoritmo applicato al contorno del polso, introdotto nel 1983 da
Wesseling et al. prevedeva la misurazione dell’area sotto la curva della
pressione nella fase sistolica (Asys) cioè dalla fine della diastole fino al
termine della fase di eiezione (fig. 6):
25
SV =
A sys
Z AO
(Asys, area sotto la curva sistolica; ZAO, impedenza aortica)
La stima dello “stroke volume” è influenzata dall’impedenza aortica (ZAO),
che è un fattore del tutto individuale dipendente dalle caratteristiche
elastiche e meccaniche dell’aorta. Per identificare la particolare compliance
di ciascun paziente, è quindi necessario calibrare il sistema attraverso la
rilevazione
contemporanea
della
gittata
cardiaca,
ottenuta
tramite
termodiluizione polmonare o tramite termodiluizione transpolmonare con
indicatore freddo (soluzione salina ad una temperatura inferiore a 10° C) dal
catetere venoso centrale, utilizzando il principio di Stewart-Hamilton [56].
Avremo quindi che:
ZAO = SVPC / SVtd
(SVPC, stroke volume non calibrato basato sul contorno del polso; SVtd, stroke volume dato
dalla termodiluizione)
Da cui si ricava:
CO =
HR × Asys
SV PC / SV td
Nel 2002, Gödje e colleghi, hanno introdotto un nuovo algoritmo per
l’analisi della gittata cardiaca tramite contorno del polso. L’algoritmo di
Wesseling, infatti, non era affidabile durante i rapidi cambiamenti delle
condizioni emodinamiche a causa dell’insufficiente considerazione delle
caratteristiche dinamiche e fisiche dell’aorta [57, 58]. Il nuovo algoritmo
analizza sia l’area sotto la curva che la forma della curva stessa [55]:
26
CO = cal × HR ×∫
P t
dP
Cp ×
dt
SVR
dt
dove cal è un fattore di calibrazione specifico per ogni paziente, ottenuto
mediante la termodiluizione; C(p) è la compliance aortica;
sotto la curva di pressione e
dP
dt
P t
SVR
è l'area
è la forma della curva.
Si sono tenuti in considerazione questi ulteriori parametri dal momento che
durante la sistole il ventricolo sinistro eietta più sangue di quello che
effettivamente defluisce dall'aorta; durante la seguente diastole, il volume
rimasto in aorta raggiunge la rete arteriosa con una velocità determinata
dalla compliance aortica, dalle SVR e dalla pressione sanguigna (effetto
Windkessel). La forma della curva di pressione dopo l'incisura dicrota è
rappresentativa di questo svuotamento passivo dell'aorta [55].
Numerosi studi che hanno comparato il metodo della termodiluizione
con quello dell’analisi del contorno del polso hanno dimostrato una decisa
concordanza tra i valori ottenuti utilizzando le due tecniche [59-61].
Altri parametri ottenibili con questa metodica sono il volume telediastolico
globale (GEDV), l’acqua extravascolare polmonare (EVLW), il "pulse
pressure variation" (PPV) e lo “stroke volume variation” (SVV).
Anche il sistema LiDCOTMplus (Lithium Diluition Cardiac Output)
(LiDCO, London, U.K.) è tra le metodiche che utilizzano l’analisi del
contorno del polso. Questo sistema permette la determinazione in continuo,
battito per battito, della gittata cardiaca e di tutta una serie di variabili
emodinamiche derivate, basandosi fondamentalmente sull’analisi del
contorno del polso, dopo una iniziale calibrazione ottenuta con la diluizione
transpolmonare dell’indicatore (litio). Il principale vantaggio è che possono
essere usate arterie (per esempio l'arteria radiale) e vene periferiche senza
perdita di accuratezza e senza l’inserimento di un catetere aggiuntivo
specifico [62].
27
Il litio è uno ione non tossico in piccole dosi e facile da misurare tramite un
elettrodo. Poiché normalmente il litio non è presente nel corpo, sono
sufficienti minimi dosaggi per ottenere una modificazione del voltaggio a
livello del sensore posto in arteria. Il litio viene iniettato in bolo, alla dose di
0.002-0.004 mmol · Kg-1 (dalle 0.15 alle 0.3 mmol), in una vena centrale o
periferica e la sua concentrazione viene rilevata in una linea arteriosa.
Attraverso la curva di diluizione è quindi possibile calcolare la gittata
cardiaca per la calibrazione del sistema [63].
La curva di diluizione dell'indicatore è costituita da due curve: la prima è
dovuta al primo circolo del litio e la seconda al suo ricircolo. Il litio si
distribuisce nel plasma ed è necessaria una correzione. La gittata cardiaca
viene quindi calcolata come segue:
CO =
LiCl dose × 60
A × 1 − PVC
dove LiCl è la dose di litio espressa in mmol, A è l'integrale dell'area della
prima curva e PVC è il volume di cellule stipate, calcolato come
concentrazione emoglobinica diviso per 33.
La gittata cardiaca in continuo viene ottenuta dall'analisi del contorno del
polso che deve tener conto del rapporto tra pressione e flusso nell'aorta, del
flusso stesso, delle resistenze vascolari sistemiche e della compliance dei
vasi al variare del volume e della pressione. L'algoritmo che ne consegue è
il seguente:
CO = PRA × {
CO fl AO PAO
×
×
}
flAO PAO PRA
(PRA, pressione radiale; PAO, pressione aortica; flAO, flusso aortico)
Il rapporto tra la gittata cardiaca ed il flusso aortico viene così approssimato:
28
CO Li
durata eiezione 2
= A × [0.5 0.4 ×
]
flAO
durata ciclo
(COLi, gittata ottenuta tramite diluizione; A, area di sezione aortica calcolata secondo la
relazione di Langewouters) [68]
La trasmissione della pressione dall'aorta all'arteria radiale si avvale di
un'ulteriore approssimazione [56]:
PRA
f2
=1
P AO
8.5
(f, frequenza dell'onda aortica)
Basandosi sugli indici di performance cardiaca e di precarico così
ottenuti, i clinici hanno guidato il trattamento fluidico e farmacologico del
paziente ad alto rischio e del paziente critico in terapia intensiva [63].
Metodiche non invasive
Il Vigileo (Edwards Lifescience, Irvine, CA) è un ulteriore monitoraggio
della gittata cardiaca basato sul contorno del polso pressorio. Questo
strumento non richiede alcuna calibrazione; il CO viene calcolato utilizzando
le caratteristiche della forma d'onda arteriosa ed i dati demografici del
paziente. Il sistema si avvale di un monitor a cui viene connesso un sensore
di flusso (FloTrac) che rileva la pressione arteriosa attraverso un catetere
da 20-G posizionato nell'arteria radiale [64].
Il principio su cui si fonda questa metodica è che la variazione di
pressione arteriosa generata da una pulsazione è proporzionale allo "stroke
volume" e inversamente proporzionale alla compliance aortica [65].
L'onda pressoria viene analizzata ad un frequenza di 100 Hz in un periodo
di 20 secondi, fornendo così pacchetti di circa 2000 dati. Sono prese in
considerazione 8 differenti caratteristiche (come l'upstroke ed il downslope),
29
e ogni curva viene analizzata separatamente e comparata con le precedenti
e le successive. Attraverso questi dati ogni 20 secondi il Vigileo aggiorna la
gittata cardiaca calcolandola secondo l'algoritmo:
CO = HR x σAP x χ
dove σAP è la pulsatilità, cioè la deviazione standard della pressione
arteriosa usata come stima dello "stroke volume" e χ è una funzione che
raccoglie e approssima le seguenti variabili: HR, σAP, BSA, MAP, C(P), μ3AP,
μ4AP. Gli indici μ3AP e μ4AP (skewness e kurtosis) rappresentano la dispersione
dei valori di pressione arteriosa rispetto al valore medio, confrontando i dati
reali con la loro distribuzione gaussiana [66]. C(P) è la compliance arteriosa
ottenuta secondo il metodo di Langewouters, usando sesso, età, peso e
altezza [67, 68].
L'accuratezza del Vigileo risente dell'intensità del segnale, delle
variazioni del tono vascolare e delle alterazioni della morfologia
dell'onda [64-66, 69].
Il monitor NICO (Novametrix Medical System INC., Wellingford,
Connecticut) applica la tecnica del “rebreathing” parziale dell’anidride
carbonica. Gli studi iniziali (clinici e sperimentali) per la validazione di
questa metodica, hanno riportato una relativamente ampia correlazione con
il metodo della termodiluizione nel calcolo della gittata cardiaca [70-72]. Un
altro studio più recente, condotto da Botero, in cui si confrontavano quattro
metodiche diverse per la misurazione della gittata cardiaca, ha confermato
l’affidabilità di questo metodo [73].
Le misurazioni vengono eseguite utilizzando il metodo di Fick il quale
affermò che la velocità con cui il sangue capta ossigeno dai polmoni doveva
essere uguale all’incremento della concentrazione ematica dell’ossigeno
durante il transito nel circolo polmonare. Questo enunciato può essere
30
espresso in termini più generali in quanto è la mera applicazione della legge
di conservazione della massa è può riguardare qualsiasi sostanza che
venga aggiunta o eliminata dal sangue in un punto qualsiasi del circolo. Il
flusso ematico può pertanto essere stimato conoscendo la concentrazione
della sostanza a monte e a valle della zona di iniezione (o di dispersione) e
la quantità assoluta della sostanza iniettata (o rimossa) nell’unità di tempo.
Partendo dal presupposto che il sangue si ossigena a livello polmonare (sito
di iniezione o di dispersione), si deve misurare la concentrazione di
ossigeno a monte e a valle di questo punto [29].
La quantità di ossigeno che dal cuore destro giunge ai polmoni si ricava
moltiplicando la concentrazione dell’ossigeno nel sangue venoso per il
flusso ematico polmonare:
O2 venoso / min = Q x [O2]VEN
dove Q rappresenta il flusso ematico polmonare mentre [O2] è la
concentrazione di ossigeno.
Analogamente, la quantità di ossigeno che lascia il polmone per il circolo
sistemico è calcolata moltiplicando la concentrazione d’ossigeno nel sangue
arterioso per il flusso ematico polmonare:
O2 arterioso / min = Q x [O2]ART
E’ necessario a questo punto conoscere la quantità assoluta di ossigeno
aggiunta nel torrente circolatorio nell’unità di tempo. Questo parametro,
detto consumo di ossigeno (VO2), viene usualmente misurato con uno
spirometro. Poiché il volume d’ossigeno assunto dal sangue arterioso in un
minuto deve essere uguale al consumo di ossigeno, si ha:
VO2 = (Q x [O2]ART) - (Q x [O2]ven)
31
e dato che i flussi nella vena e nell’arteria polmonare sono identici:
VO2 = Q x ([O2]ART - [O2]VEN)
Questa equazione, detta espressione di Fick, dimostra che la velocità di
captazione dell’ossigeno dall’aria alveolare (mL · min-1) è uguale al flusso
ematico polmonare (L · min-1) moltiplicato per la differenza arterovenosa
della concentrazione di ossigeno (mL · L-1). Visto che la gittata del cuore di
destra è identica alla gittata del cuore di sinistra, la medesima espressione
può essere riscritta come segue:
VO2 = CO x ([O2]ART - [O2]VEN)
ovvero
CO =
VO 2
[O 2 ]ART − [O2 ]VEN
dove CO rappresenta la gittata cardiaca espressa in L · min-1, VO2 il
consumo di ossigeno espresso in mL · min -1 e [O2]ART – [O2]VEN la differenza
arterovenosa della concentrazione di ossigeno espressa in (mL · min-1) [29].
Il principio di Fick può essere applicato a tutti i gas che diffondono a
livello polmonare, in particolare all’anidride carbonica (CO2) [74]. I monitor
più recenti quali il NICO applicano infatti questo principio all’anidride
carbonica [14]. Inizialmente si utilizzava la tecnica del “rebreathing” totale di
CO2 che poi è stata abbandonata perché troppo rischiosa per il paziente a
causa del notevole incremento della PaCO2; si è così passati ad un nuovo
sistema, meno pericoloso in quanto prevede che si torni a respirare solo
una parte dei gas esalati (“rebreathing” parziale di CO2) riducendo il rischio
32
di aumentare eccessivamente la PaCO2. In queste tecniche, utilizzando il
polmone come tonometro per determinare la pressione parziale della CO2
nel sangue arterioso e analizzando contemporaneamente i gas alveolari per
misurare la CO2 eliminata, l’equazione di Fick può essere rappresentata
dalla seguente espressione:
Q =
V CO
2
CvCO − CaCO
2
2
dove Q è il flusso ematico capillare polmonare non corretto per lo shunt
polmonare, Vco2 è la quota di eliminazione della CO2 e (Cvco2 – Caco2) è la
differenza artero-venosa in CO2 [75, 76] .
L’ecocardiografia transesofagea (TEE) è una metodica non invasiva
che permette una valutazione in tempo reale, beat-to-beat, sia morfologica
che funzionale del cuore nelle sue componenti anatomiche e dinamiche,
fornendo una diagnosi eziologica del problema emodinamico [56].
L’ecocardiografia transesofagea permette non solo di ottenere informazioni
sui determinanti della funzione ventricolare, quali inotropismo, precarico e
postcarico, ma anche riguardo la cinetica (insorgenza di ischemia
miocardica), la funzione diastolica e la gittata cardiaca [77].
L’impiego in anestesia non richiede l’esecuzione routinaria di tutte e 20 le
scansioni codificate dal American Society of Echocardiography / Society of
Cardiovascular Anesthhesiologists (ASE/SCA); infatti è possibile eseguire
una serie più limitata di scansioni che consentono informazioni utili in
procedure non cardiochirurgiche [78].
La TEE permette di misurare la gittata cardiaca in diversi modi che
possono essere divisi in un metodo di tipo volumetrico ed in uno basato
sull’effetto Doppler. La gittata sistolica (e quindi la gittata cardiaca) può
essere misurata effettuando misurazioni alla fine della sistole ed alla fine
33
della diastole. Utilizzando la metodica Doppler la gittata cardiaca viene
stimata moltiplicando l’integrale del tempo della velocità del flusso a livello
del tratto di efflusso del ventricolo sinistro, della valvola aortica, mitrale o
polmonare, per l’area della valvola e la frequenza cardiaca. In genere, la
misurazione della velocità di flusso attraverso la valvola aortica è quella
preferita per determinare la gittata cardiaca. Diversi studi hanno dimostrato
una buona correlazione tra la stima della gittata cardiaca attraverso
l’ecocardiografia e la metodica standard della termodiluizione soprattutto se
l’area
della
valvola
aortica
è
stimata
attraverso
un
modello
triangolare [79, 80].
Il metodo volumetrico, invece, è sufficiente per determinare dei trends della
gittata cardiaca. La correlazione, infatti, con i risultati ottenuti attraverso la
termodiluizione è scarsa [81-83].
La determinazione della gittata cardiaca in continuo non è comunque
ancora disponibile attraverso l’ecocardiografia transesofagea.
Anche
il
precarico
può
essere
stimato
quantitativamente
e
qualitativamente attraverso l’ecocardiografia transesofagea. Questa stima
può essere effettuata sia in pazienti con funzione ventricolare normale che
in pazienti con alterazioni di vario genere. Infatti, in pazienti critici, sedati
adeguatamente, la presenza di un ventricolo iperdinamico può essere
indice di ipovolemia, in assenza di farmaci inotropi positivi. Inoltre, la
presenza di obliterazione telediastolica della cavità ventricolare (“kissing
walls”) è suggestivo di uno stato ipovolemico [84]. La misura dell’area
telediastolica del ventricolo sinistro (LVEDA, left ventricular end-diastolic
area) è un indice strettamente correlato con i cambiamenti del volume
telediastolico del ventricolo sinistro (LVEDV) che è l’unica vera misura del
precarico [85]. Un valore di LVEDA indicizzato inferiore a 5.5 cm2 · m-2 di
superficie corporea è estremamente suggestivo di una condizione di scarso
riempimento del ventricolo sinistro [86]. Tuttavia la presenza di anormalità
della cinetica parietale della cavità in esame può limitare il corretto utilizzo
34
dell’LVEDA come indice di precarico.
La TEE può inoltre fornire indicazioni riguardo la pressione venosa
centrale. Va ricordato comunque che i valori forniti da questa metodica sono
stime e non misurazioni dirette. La curvatura del setto interatriale riflette la
relazione tra la pressione atriale destra e la pressione atriale sinistra (LAP,
left atrial pressure). Questa valutazione non è però applicabile a pazienti
con valvulopatie come l’insufficienza tricuspidale [87]. Anche il pattern del
flusso transmitrale studiato con il Doppler pulsato può dare informazioni
riguardo le pressioni di riempimento delle sezioni sinistre del cuore. Inoltre,
quando presente, anche il rigurgito mitrale può essere utilizzato per stimare
la LAP applicando la legge di Bernoulli:
LAP = SAP - (V2 x 4)
dove SAP è la pressione sistolica in aorta e V2 è la “peak velocity” del flusso
transmitrale rigurgitante. Analogamente, anche il flusso attraverso una
valvola aortica insufficiente, può darci informazioni sulla pressione
telediastolica ventricolare sinistra:
LVEDP = DBP - 4 x (ARED)2
dove DBP è la pressione sanguigna diastolica mentre ARED è la velocità del
flusso rigurgitante telediastolico [77]. Infine la pressione nelle sezioni
sinistre del cuore può essere stimata dallo studio del pattern del flusso
venoso polmonare [88]. La misurazione, invece, del diametro della vena
cava e delle sue variazioni durante il ciclo respiratorio permette di stimare la
pressione atriale destra (RAP). Un diametro maggiore di 2 centimetri senza
variazioni respiratorie consistenti (< 50%) è indicativo di una pressione
maggiore a 15 mmHg [89].
La valutazione della frazione di accorciamento circonferenziale (FAC) e la
35
frazione di eiezione (FE) sono utili per valutare la frazione sistolica del
ventricolo sinistro.
Infine lo stress parietale telediastolico del ventricolo sinistro, misurato
dall'ecocardiografia transesofagea, è un indice migliore del postcarico
rispetto alle resistenze vascolari sistemiche (SVR):
=
1,35 × P × ESD
1 h
4 × h ×
ESD
dove σ è lo stress di parete, P è la pressione telesistolica del ventricolo
sinistro, ESD è il diametro telesistolico del ventricolo sinistro e h è lo
spessore telesistolico della parete ventricolare sinistra [90].
La pletismografia ad impedenza è una metodica che si basa sulla
determinazione dei cambiamenti della resistenze elettriche transtoraciche
che avvengono durante l’eiezione ventricolare. La base fondamentale di
questa tecnica è espressa dalla legge di Ohm con la seguente espressione:
Z =
V
= R
I
dove Z è l’impedenza (quando è applicata una corrente alternata), V è il
voltaggio, I è la corrente e R è la resistenza (quando è applicata una
corrente continua).
La corrente elettrica si propaga prevalentemente lungo le vie a minor
resistenza ed in modo proporzionale alla loro conduttività elettrica[91]. Nel
torace l'elevata conduttività del sangue contrasta con la bassa conduttività
dell'aria e dei tessuti solidi, e la variazione dell'impedenza risulta essere
conseguente e proporzionale al flusso aortico [56]. L'impedenzometria
misura la differenza di conduttività generata dal flusso aortico sistolico per
36
stimare il volume di eiezione ed il tempo di eiezione ventricolare, e da questi
ricava la gittata cardiaca [92].
La bioimpedenza toracica (Z) viene rilevata attaccando due elettrodi al collo
del paziente e due alla parte inferiore del torace. Viene applicata una
corrente alternata di 3-6 mA ad una frequenza di 50-100 kHz e la
bioimpedenza risulta come una funzione del cambiamento di potenziale tra i
due sets di elettrodi (dZ/dt). La prima equazione per derivare lo "stroke
volume" dai segnali di bioimpedenza è stata descritta da Kubicek:
SV = ρ x
L
x ΔZ
Z0
(ρ, reistività del sangue (ohm·cm-1); L, distanza tra gli elettrodi (cm); Z0, impedenza media
tra gli elettrodi (ohm); ΔZ, variazione di impedenza (ohm) dovuta al flusso aortico)
La variazione di impedenza viene calcolata come:
ΔZ = VET x
dZ
dt
MAX
dove VET è il tempo di eiezione ventricolare in secondi e (dZ/dt)MAX è la
massima pendenza negativa della curva delsegnale di bioimpedenza [93].
Sramek e Bernstein hanno modificato l'equazione di Kubicek per adattarla
alla forma del torace umano ed hanno introdotto un fattore di calibrazione
per sesso e grado di obesità [94].
Wang et al. hanno convalidato questa metodica attraverso confronto
con la termodiluizione [95], tuttavia permangono molti dubbi sulla sua
affidabilità [96].
37
1.2 Doppler esofageo
Il Doppler esofageo è una metodica non invasiva che permette di
misurare la velocità istantaneo del flusso ematico nell'aorta discendente e di
ricavare l’eiezione sistolica e la gittata cardiaca.
Introdotto negli anni ’70 [97, 98] fin dagli anni ’80 è stato utilizzato per la
misurazione del CO nei pazienti sottoposti a chirurgia [99]. Negli ultimi
vent’anni la sua efficacia è stata comprovata da diversi studi [19, 26, 27,
100-104].
Questa tecnica utilizza l’effetto Doppler per rilevare la velocità di
spostamento del sangue e quindi la distanza percorsa dalla colonna di
sangue durante la sistole (distanza sistolica, SD). Moltiplicando questa
distanza per l’area della sezione aortica (AAO) otterremo lo "stroke
volume" [100]:
SV = SD x AAO
La sezione aorticaviene considerata circolare e quindi la sua area sarà:
raggio2 x π.
L’apparecchiatura per il Doppler esofageo è costituita da un monitor
dove sono collocati anche i dispositivi per l’interfaccia-utente, e da una
sonda intercambiabile del diametro di pochi millimetri, all’estremità della
quale troviamo il cristallo piezoelettrico per l’emissione e la ricezione delle
onde ultrasonore (fig. 7A).
Il dispositivo può essere tollerato da pazienti coscienti se introdotto per via
nasale ma generalmente viene utilizzato per via orale in pazienti
anestetizzati e ventilati meccanicamente. L’aria nel mediastino o l’utilizzo di
sondini naso-gastrici non interferiscono con il funzionamento del dispositivo.
Il trasduttore viene fatto scendere nell’esofago fino a 30-40cm,
38
utilizzando le tacche poste sulla sonda per valutare la profondità corretta.
La posizione ideale è tra la quinta e la sesta vertebra toracica dato che a
questo livello l’aorta è adiacente e parallela all’esofago e l’area crosssezionale sistolica varia meno [105]. Una volta inserita, la sonda viene
ruotata, in modo che il trasduttore sia rivolto verso l’aorta e si ottenga la
caratteristica onda della velocità del flusso (fig. 8).
La posizione della sonda viene ottimizzata attraverso leggere rotazioni
lungo il suo asse e da alterazioni della profondità dell’inserzione fino a
generare un chiaro segnale con la “peak velocity” più alta possibile.
Si può regolare il guadagno d’amplificazione per migliorare la qualità del
segnale, tuttavia questo aumenterà il rumore di fondo. La valvola aortica o il
movimento della parete cardiaca possono generare un disturbo a bassa
frequenza che si può eliminare tagliando questa parte di banda attraverso
un filtro software.
Controindicazioni all’utilizzo della sonda esofagea includono alterazioni
dell’anatomia dell’esofago come malformazioni, tumori, stenosi o varici,
chirurgia recente dell’esofago o delle alte vie aeree o esofagite acuta, grave
coartazione aortica, diatesi emorragica. In oltre potrebbe non essere
affidabile durante il clampaggio aortico. Il Doppler Esofageo si è dimostrato
essere associato a pochissime complicanze [106, 107].
Apprendere
questa
tecnica
richiede
una
pratica
inferiore
rispetto
all’ecocardiografia o alla cateterizzazione dell’arteria polmonare [76]. Dopo
10-12 esecuzioni l’operatore acquisisce sufficiente efficacia ed accuratezza
[108, 109] tanto che la riproducibilità intra ed inter-operatore risulta
superiore a quella della termo diluizione con tecnica a boli [99, 100].
Per capire il funzionamento del Doppler esofageo dobbiamo prima
chiarire che cos’è l’effetto Doppler. Nell’ecografia convenzionale gli
ultrasuoni emessi dal piezoelettrico vengono in parte riflessi dalla superficie
di passaggio tra tessuti di densità diversa, e dalla captazione di queste
onde di ritorno viene costruita l’immagine ecografica. In questo caso la
39
frequenza dell’onda riflessa è la stessa dell’onda incidente, ma se l’onda
incontra una struttura in movimento, la frequenza dell’onda riflessa subisce
una variazione di entità direttamente proporzionale alla velocità del
movimento stesso, in aumento se la struttura si muove avvicinandosi al
trasduttore, in diminuzione se la struttura si allontana dal trasduttore.
Questa modificazione costituisce l’effetto Doppler.
Le apparecchiature ecografiche in grado di evidenziare l’effetto Doppler
confrontano fra loro, istante per istante, le frequenza dell’onda incidente (fi)
e dell’onda riflessa (fr), e ne calcolano la differenza (Doppler shift).
Il Doppler shift dipende dalla velocità della struttura bersaglio secondo la
relazione:
Δf =
2 f i V cos
c
dove Δf è il Doppler shift; fi è la frequenza dell’onda incidente; V la velocità
di movimento della struttura bersaglio; α l’angolo di incidenza del fascio di
ultrasuoni rispetto alla direzione di movimento della struttura bersaglio; c la
velocità di propagazione degli ultrasuoni nei tessuti molli, pari a 1540 m · s-1
(fig. 9).
Nella pratica clinica la struttura in movimento è costituita dal sangue e il
Doppler shift è prodotto dalla diffusione del fascio di ultrasuoni a seguito
dell’interazione con i globuli rossi. Mentre fi ed fr risiedono nel campo
ultrasonoro (MHz) e non sono quindi udibili, il Doppler shift risiede nel
campo sonoro (kHz) e può quindi essere amplificato sì da divenire udibile.
Durante l’indagine, quindi, l’operatore ascolta dei suoni le cui frequenze
variabili nel tempo sono direttamente correlate alla velocità del sangue. La
necessità di schematizzare, oggettivare e registrare questi suoni ha indotto
allo sviluppo di strumenti analizzatori di spettro che permettono di riportare
all’interno di un sistema di assi cartesiani un tracciato spettrale nel quale
40
sono rappresentate simultaneamente tutte le frequenze rilevate, l’intensità e
la fase di ciascuna di esse, e le variazioni nel tempo. Una volta noti l’angolo
α e la fi, determinando il Doppler shift è possibile risalire alla velocità del
flusso ematico [110].
Sono disponibili, nella pratica, tecniche Doppler non selettive di profondità
(Doppler continuo) e tecniche Doppler selettive di profondità (Doppler
pulsato). Nel Doppler continuo sono utilizzati due cristalli piezoelettrici
indipendenti montati sullo stesso supporto: uno emette un fascio continuo di
ultrasuoni di frequenza definita, l’altro riceve il fascio riflesso. Questa
tecnica non ha limite di velocità misurabile ma non rende possibile la
differenziazione di segnali provenienti da vasi diversi situati lungo l’asse del
fascio; in altri termini, non consente risoluzione di profondità. Nel Doppler
pulsato sono utilizzate sonde convenzionali per ecotomografia in cui il
cristallo (unico o multiplo) è alternativamente posto in fase di emissione e di
ricezione cosicché il procedimento, misurando il tempo intercorso, consenta
la risoluzione di profondità [110].
Nel caso specifico del Doppler esofageo si utilizza un onda continua a
4 Mhz in quanto si presuppone che esofago e aorta discendente siano
adiacenti nel tratto in cui si esegue il rilevamento, oppure un onda pulsata a
5 Mhz. La velocità del flusso (V) dei globuli rossi a livello aortico quindi
viene determinata dallo spostamento Doppler nella frequenza delle onde
riflesse; possiamo quindi riscrivere nel modo seguente l’equazione che
mette in relazione velocità e Doppler shift:
V = (2fi x cos α)-1 x cΔf
dove c è la velocità dell’ultrasuono nei tessuti, Δf è il cambiamento di
frequenza (Doppler shift), fi è la frequenza dell’ultrasuono emesso e α è
l’angolo di incidenza [111].
La misurazione dello "stroke volume" attraverso il Doppler esofageo
41
deriva dal principio della misurazione dello “stroke volume” nel tratto di
efflusso del ventricolo sinistro per mezzo dell’ecocardiografia Doppler
transtoracica della aorta ascendente [112]. Tuttavia per trasporre ciò che è
già stato convalidato nel tratto di efflusso del ventricolo sinistro al tratto
discendente dell’aorta:
-
un buon allineamento tra esofago e aorta discendente;
-
un flusso “flat” attraverso l’aorta discendente;
-
una sezione aortica stimata il più possibile vicina al valore
medio misurato durante la sistole;
-
un flusso diastolico irrilevante;
-
una suddivisione costante del flusso sanguigno tra l’aorta
discendente (70 %), e le arterie coronarie e brachiocefalica
( 30 %).
L’accuratezza della misurazione della velocità necessita di un buon
allineamento tra la sonda Doppler e la direzione del flusso sanguigno.
L’allineamento può essere valutato e migliorato ottimizzando la qualità del
segnale ottenuto e visualizzabile sul display del monitor attraverso l’onda
della velocità e dal suono del Doppler.
L’angolo tra il fascio degli ultrasuoni del Doppler e il flusso sanguigno è
approssimativamente simile a quello tra il trasduttore e la sonda (45 gradi),
poiché, di solito l’esofago e l’aorta corrono paralleli nel torace. Questo può
essere considerato vero nei giovani e nei pazienti sani ma può essere
erroneo in pazienti anziani affetti da scoliosi. Ogni discrepanza tra gli angoli
stimati e gli angoli reali esita in errori nel calcolo della velocità del sangue
dal momento che nell’equazione di Doppler il coseno dell’angolo risulterà
errato.
Un profilo di velocità “flat” implica che tutti i globuli rossi si muovano alla
stessa velocità attraverso il vaso. Nella realtà il profilo della velocità del
flusso nell’aorta discendente è più di tipo parabolico (flusso laminare; i
42
globuli rossi al centro del vaso hanno una velocità maggiore rispetto a quelli
a ridosso delle pareti del vaso) che “flat”. Perciò, l’utilizzo della massima
velocità misurata per calcolare la “stroke distance”, può esitare in una
soprastima dello “stroke volume” [113].
Il rapporto assegnato di suddivisione del flusso (70 % aorta e 30 % arterie
coronarie e brachiocefaliche) può essere inaccurato in riferimento a varie
condizioni fisiopatologiche [100, 114].
La misurazione dell’area di sezione dell’aorta discendente può essere
effettuata utilizzando l’ecocardiografia transeofagea. Questa tecnica,
tuttavia, è operatore dipendente e non è disponibile ovunque. I costruttori
del Doppler esofageo hanno ovviato a questo problema o incorporando un
trasduttore M-mode nella sonda per misurare istantaneamente il diametro
aortico (HemoSonic; Arrow International, Reading, PA) o fornendo un
nomogramma che stimi l’area di sezione dell’aorta discendente in base
all’età, al peso e all’altezza del paziente (CardioQ, Deltex Medical,
Chichester, United Kingdom) [99, 115], ma in questo secondo caso i risultati
ottenuti sono quelli per un paziente “tipico” con la stessa altezza, peso, ed
età, e non devono essere considerati come valori assoluti [116].
La velocità di flusso rilevata dal Doppler esofageo viene visualizzata a
monitor in un sistema di assi cartesiani dove abbiamo la velocità in ascissa
e il tempo in ordinata (fig. 7B). Il flusso prodotto da ogni sistole sarà quindi
rappresentato da un onda con la forma approssimativa di un triangolo; dalle
sue caratteristiche possiamo ottenere diverse informazioni riguardo alla
situazione emodinamica del paziente (fig. 10) (tab. 1).
I valori forniti dallo strumento sono la media di quelli misurati in un
determinato intervallo di tempo. Il numero di cicli da considerare può essere
impostato dall'operatore. E' consigliabile integrare un periodo di almeno
5 cicli per minimizzare il bias dovuto alla variazione della gittata sistolica
determinato dalla ventilazione a pressione positiva, soprattutto in pazienti
ipovolemici [135].
43
I parametri misurati direttamente sono i seguenti:
-
Peak velocity (PV) è la velocità massima (di picco) misurata
durante la fase sistolica (in cm·s-1) e corrisponde all’altezza
della curva.
-
Flow time (FT) è la durata del flusso sistolico in aorta (in
millisecondi) e corrisponde alla base della curva.
-
Flow time to peak (FTp) è il tempo che intercorre dall’inizio
della fase sistolica al punto in cui viene rilevato il PV (in
millisecondi), corrisponde alla prima parte della base della
curva fino al punto dove si proietta l’altezza del “triangolo”.
-
Cycle time è il tempo che intercorre tra l’inizio di un onda e
l’inizio di quella successiva (in secondi).
Atri parametri vengono derivati dall’onda nel modo seguente:
-
Frequenza cardiaca (HR) è il numero di onde (battiti) al
minuto misurate nel modo seguente:
HR = 60 / tempo di ciclo (min-1)
-
Stroke distance (SD) distanza percorsa dalla colonna di
sangue attraverso la aorta durante la fase sistolica di ciascun
battito. Viene calcolata misurando l’area sotto la curva
attraverso l’integrale della velocità nel tempo di flusso (FT).
-
Minute distance (MD) è la distanza percorsa dalla colonna di
sangue attraverso l’aorta ed è un indice lineare della gittata
cardiaca. Questo valore è calcolato come:
MD = SD x HR (cm)
-
Stroke volume (SV) è calcolato come:
44
SV = SD x AAO (ml)
dove AAO è l’area della sezione aortica ottenuta dal
nomogramma oppure misurando il diametro aortico (2r)
attraverso il trasduttore M-mode (AAO = π 2r2/4).
-
Cardiac output (CO) viene calcolato come
CO = SV x HR (L · min-1)
-
Corrected
flow time (FTc): dal momento che il tempo di
flusso sistolico (FT) fisiologicamente si riduce all’aumentare
della
frequenza
cardiaca,
per
avere
dati
comparabili
dobbiamo correggerlo per il tempo di ciclo usando l’equazione
di Bazett.
FTc = FT / √cicle time (ms)
-
Mean acceleration (MA) è l’accelerazione media del sangue
tra l’inizio della fase sistolica e il momento in cui viene rilevata
la velocità di picco. Corrisponde alla pendenza della fase
ascendente dell’onda e può essere calcolato come segue:
MA = PV / FTp (cm · s-2)
-
Systemic vascular resistence (SVR) è una misura della
resistenza effettiva del sistema vascolare al flusso del sangue
e corrisponde alla differenza di pressione diviso il flusso.
Viene calcolata come:
45
RSV = (PAM – PVC) / CO x 79.9 (dyne · s · cm-5)
-
Systemic
vascular
resistence
index
(SVRI)
è
l’RSV
normalizzata per l’area della superficie corporea:
IRVS = RSV x BSA (dyne · s · cm-5 · m2)
Perché il monitor esegua il calcolo di RSV e IRSV, i valori di
pressione sanguigna devono essere immessi manualmente
dall’utente.
Ulteriori parametri sono ottenuti per indicizzazione:
-
Cardiac index (CI) è la gittata cardiaca normalizzata per l’area
di superficie corporea (BSA)
CI = CO / BSA (L · min-1 · m-2)
-
Stroke volume index (SVI) è la gittata sistolica normalizzata
per l’area di superficie corporea [27]:
SVI = SV / BSA (ml · m-2)
Singer ha mostrato come con il Doppler si possano ottenere importanti
informazioni sulle condizioni emodinamiche del paziente clinico. In
particolare le varizioni di precarico, postcarico e inotropismo sono legate a
modificazioni di specifici parametri misurati ed ai cambiamenti delle
corrispettive caratteristiche della forma d’onda. L’FTc è un indicatore del
precarico e quando si accorcia suggerisce un tempo di riempimento
diastolico diminuito, ovvero una diminuzione del precarico. La contrattilità
miocardica, invece, può essere descritta dalla “peak velocity”. Maggiore è la
46
contrattilità del miocardio, più veloce sarà l’espulsione del sangue fuori dal
ventricolo il quale corrisponde ad una “peak velocity” più elevata. Il
postcarico viene stimato dall’analisi della forma d’onda. Un incremento delle
resistenze vascolari sistemiche si riflette in un decremento della “peak
velocity” e in un FTc minore. Al contrario, una diminuzione delle resistenze
vascolari sistemiche dovrebbe corrispondere in un incremento della “peak
velocity” e in un FTc più lungo [27] (fig. 11).
Per giungere a queste conclusioni Singer ha modificato la volemia o ha
sottoposto i pazienti studiati a farmaci che alterassero il più selettivamente
possibile un solo fattore determinante la gittata cardiaca. Così si è potuto
constatare che la somministrazione di farmaci inotropi positivi come la
dobutamina, causa un aumento della “minute distance” attraverso
l’incremento della frequenza cardiaca e della “stroke distance”,in quanto
determina un incremento significativo della “peak velocity” e della “mean
acceleration” ed una diminuzione dell’indice delle resistenze vascolari
sistemiche; non ci sono invece modificazioni del “flow time corretto” [27].
Aumenti
del
postcarico,
ottenuti
grazie
alla
somministrazione
di
metossamina, provocano una caduta della “stroke distance” e della “minute
distance”. Questo farmaco infatti causa un importante incremento dell’indice
delle resistenze vascolari sistemiche e della pressione arteriosa media, con
bradicardia riflessa e decremento del “flow time corretto”; c’è anche un lieve
riduzione della “peak velocity”.
Riduzioni delle resistenze vascolari sistemiche, attraverso l’uso di
vasodilatatori quali la fentolamina, determinano un incremento della “minute
distance” attraverso cambiamenti della frequenza cardiaca e della “stroke
distance”; in oltre si sono registrati incrementi anche nel “flow time
corretto” [27].
La correzione dell’ipovolemia attraverso la somministrazione di fluidi
aumenta la “stroke distance” principalmente attraverso l’incremento del FTc.
Le alterazioni opposte sono invece visibili in caso di riduzione del
47
riempimento ventricolare sinistro (riduzione del precarico). La rimozione di
plasma (1000 mL) causa una significativa diminuzione della “stroke
distance”, mentre la frequenza cardiaca non presenta alcuna alterazione.
Ciò è probabilmente dovuto ai meccanismi compensatori con un notevole
incremento dell’indice delle resistenze vascolari sistemiche che mantiene
normali livelli di pressione arteriosa sistemica. Decrementi significativi si
sono invece osservati nel “flow time corretto”, nella “peak velocity” e nella
“mean acceleration” dopo la rimozione di plasma [27].
Oltre che dalle modificazioni dei parametri registrati, i cambiamenti della
situazione
emodinamica
sono
ovviamente
seguiti
dai
corrispettivi
cambiamenti della forma dell’onda, la quale esprime gli effetti del
cambiamento del riempimento del ventricolo sinistro, delle resistenze
vascolari sistemiche e della contrattilità cardiaca. L’ipovolemia, ad esempio,
è prontamente individuabile grazie alla presenza di onde con una base
stretta che corrispondono a una diminuzione del “flow time”. Quando sono
state rilevate onde a base stretta, nonostante valori normali di PCWP, i
pazienti mostrano spesso buone risposte emodinamiche al carico di
liquidi [101].
1.3 Noradrenalina
All'inizio del secolo scorso l'adrenalina era già nota, mentre la
noradrenalina (NA) non era ancora stata identificata.
Nel 1905 T.R. Elliot ipotizzò che gli impulsi dei nervi simpatici rilasciassero
piccole quantità di una sostanza simile all’adrenalina surrenale in immediata
prossimità delle cellule effettrici. Egli ritenne che questa sostanza
costituisse il passaggio chimico del processo di trasmissione [117].
48
Nel 1921 Cannon e Uridil riportarono che la stimolazione dei nervi simpatici
epatici comportava il rilascio di una sostanza simili all’adrenalina che
aumentava la pressione arteriosa e la frequenza cardiaca. La possibilità che
l’adrenalina demetilata (noradrenalina) potesse essere la sostanza in
questione era già stata ripetutamente ipotizzata ma la prova definitiva che
essa fosse il mediatore dei nervi simpatici non venne ottenuta finché non fu
disponibile un saggio specifico per la
determinazione delle amine
simpaticomimmetiche in estratti di tessuti e liquidi corporei [117]
La noradrenalina è la sostanza simpatico mimetica predominante nei
nervi simpatici post-gangliari ed è il mediatore adrenergico liberato dalla
loro stimolazione. La possiamo trovare anche nella sostanza midollare
surrenale, dove rappresenta il 15-20% delle catecolamine, mentre
l'adrenalina costituisce l'80% [118] (fig. 12).
Le catecolamine circolanti non attraversano la barriera emato-encefalica
quindi la NA che agisce come neurotrasmettitore nel cervello viene
sintetizzata in sede [1].
Nel caso dei neuroni adrenergici la sintesi della NA avviene in
corrispondenza dei terminali nervosi post gangliari. La tirosina nel
citoplasma viene trasformata in dopa dall'enzima tirosina-idrossilasi, e
quindi in dopamina. La dopamina viene poi attivamente trasportata nelle
vescicole citoplasmatihe di accumulo del neurotrasmettitore, le uniche a
contenere l'enzima dopamina β-idrossilasi che permette la conversione
della dopamina in noradrenalina.
Nella midollare del surrene esistono delle cellule, dette cellule A, che
possiedono un ulteriore enzima di questa via, che aggiunge un metile alla
noradrenalina trasformandola in adrenalina [117].
La NA è immagazzinata in vescicole per assicurare la regolazione del suo
rilascio. In questo modo si diminuisce il metabolismo intraneuronale del
trasmettitore, così come il suo rilascio passivo al di fuori della cellula.
L'impulso nervoso trasmesso attraverso le fibre pre-gangliari determina il
49
rilascio di NA dalle fibre adrenergiche post-gangliari. La midollare del
surrene si comporta come un ganglio nervoso simpatico: anche qui l'evento
scatenante è la liberazione di acetilcolina dalle fibre pre-gangliari.
Il flusso di Ca2+ ha molto probabilmente un ruolo essenziale nell'accoppiare
l’impulso nervoso, la depolarizzazione della membrana, e l’apertura dei
canali del Ca2+ voltaggio-dipendenti con il rilascio di noradrenalina. Questo
rilascio è inibito dalla colchicina e dalla prostaglandina E2. Il blocco della
sintesi di prostaglandine incrementa il rilascio di NA [119], inoltre la NA
inibisce il suo stesso rilascio attraverso la stimolazione presinaptica dei
recettori α2 [1].
L’idrossilazione della tirosina e la sua trasformazione in dopa è in
genere considerato il passaggio limitante della via biosintetica delle
catecolamine [120], e l’enzima tirosina-idrossilasi è attivato per la
stimolazione dei nervi adrenergici della midollare del surrene garantendo un
rapido aumento della sintesi di catecolamine in seguito ad uno stimolo
nervoso. In oltre, è osservabile anche un aumento tardivo dell’espressione
del gene per la tirosina idrossilasi dopo stimolazione nervosa.
Questi meccanismi servono a mantenere il contenuto di catecolamine in
risposta ad un aumento del rilascio delle stesse. In oltre, la tirosina
idrossilasi è soggetta ad un meccanismo di inibizione retrograda da parte
della
NA,
quindi
ad
una
modulazione
allosterica
dell’attività
enzimatica [121].
In aggiunta ai meccanismi di neosintesi sopra descritti, vi è un secondo
sistema
di
ricostruzione
delle
scorte
nelle
terminazioni
nervose
adrenergiche e cioè la ricaptazione per trasporto attivo della noradrenalina
rilasciata precedentemente nel liquido extracellulare. Questo processo è
anche responsabile della terminazione dell’effetto degli impulsi adrenergici
di molti organi. Il processo di captazione neuronale è stato nominato
uptake-1 [122].
Certi farmaci simpaticomimmetici (per es. l’efedrina e la tiramina)
50
producono i loro effetti in modo indiretto, principalmente dislocando la
noradrenalina dai siti di legame delle terminazioni nervose al fluido
extracellulare dove il trasmettitore può agire sui siti recettoriali delle cellule
effettrici. Tutte queste sostanze sono substrato per il meccanismo di
uptake-1. Come risultato del loro trasporto attraverso la membrana
neuronale e il rilascio nell’assoplasma, essi rendono disponibile il
trasportatore alla superficie interna della membrana per il trasporto in uscita
della noradrenalina (scambio per diffusione facilitata). In oltre queste amine
sono in grado di mobilizzare noradrenalina dalle vescicole competendo con
il processo di captazione neuronale [123].
Esiste anche un sistema di trasporto di amine extraneuronale, denominato
uptake-2 con bassa affinità per la noradrenalina e una relativamente elevata
affinità per l’adrenalina e ancora una più alta affinità per l’isoproterenolo. L'
uptake-2 assume maggiore importanza nel eliminazione di catecolamine
circolanti che non nella rimozione di NA rilasciata da terminazioni nervose
adrenergiche [122, 124].
In sintesi l'azione della noradrenalina cessa attraverso:
-
la ricaptazione nelle terminazioni nervose;
-
la diluizione per diffusione dallo spazio sinaptico e la
captazione nei siti extraneuronali;
-
la trasformazione metabolica.
Due enzimi sono importanti nelle tappe iniziali della trasformazione
metabolica delle catecolamine: le mono-amino-ossidasi (MAO) e le catecolO-metiltransferasi (COMT). Inoltre le catecolamine sono metabolizzate dalle
sulfotransferasi [117].
51
Effetti della noradrenalina
Per comprendere gli effetti della NA sui diversi organi è cruciale la
conoscenza della classificazione e delle proprietà dei vari tipi di recettori
adrenergici.
I recettori che rispondono con un ordine di potenza NA ≥ A > isoproterenolo
sono chiamati α e a loro volta suddivisi in α1 e α2, mentre quelli che
rispondono con un ordine di potenza isoproterenolo > A ≥ NA sono i
recettori β1 e β2.
I recettori α1 servono come attivatori post-sinaptici sia dei muscoli lisci dei
vasi e dell'intestino, sia delle ghiandole endocrine. La risposta dei vasi di
capacitanza e di resistenza è la costrizione mentre nel tratto intestinale
causano rilassamento. Esiste ormai una documentata evidenza circa la
presenza dei recettori α1 adrenergici nel cuore con effetto inotropo positivo.
I recettori α2 danno vasocostrizione arteriosa e venosa, aggregazione
piastrinica, inibizione della mobilità intestinale, inibizione del rilascio di
insulina ed ADH. Agendo sui recettori α2 pre-sinaptici, la NA inibisce il suo
stesso rilascio.
I recettori β1 mediano gli effetti delle catecolamine sul miocardio, mentre i
recettori β2 si trovano nella muscolatura liscia dei vasi sanguigni della cute,
dei muscoli scheletrici, del mesentere e nella muscolatura dei bronchi [1].
La NA ha maggior affinità per i recettori α, minore per i recettori β1 ed
effetto quasi nullo sui recettori β2.
La NA causa effetti emodinamici diretti attraverso i recettori α e β in maniera
dose-correlata quando somministrata in infusione. Causa un aumento di
CO e di pressione ematica quando somministrata a basse dosi.
L’incremento iniziale di CO, è dovuto più al aumentato precarico che ad un
effetto diretto arteriolare o cardiaco. Dosi più alte riducono il flusso poiché la
costrizione arteriolare α supera gli effetti β. Si può verificare una bradicardia
riflessa barocettoriale dopo stimolazione β [1].
Osservando specificamente l'azione dei mediatori dell’ortosimpatico sul
52
cuore vediamo che adrenalina e noradrenalina hanno l’effetto di aumentare
la corrente depolarizzante di base. Il risultato è quello di contrastare
l’efficacia della corrente di refrattarietà postuma. Ciò serve ad accelerare il
raggiungimento della soglia e a ridurre di conseguenza l’intervallo tra un
potenziale d’azione e l’altro (effetto cronotropo).
Le catecolamine agiscono anche sul nodo atrioventricolare, aumentandone
la velocità di conduzione (effetto dromotropo), e sul miocardio comune,
riducendo la durata della fase di plateau (accorciamento della sistole) e
aumentando la forza di contrazione (azione inotropa). Per esempio, la
noradrenalina liberata dalle terminazioni simpatiche agisce aumentando la
conduttanza al calcio nelle cellule del miocardio comune incrementando
così la forza di contrazione [30].
Un attività β1 eccessiva può aumentare la contrattilità ma causare anche un
aumento di FC e di consumo miocardico di ossigeno. Sono frequenti aritmie
severe in associazione ad un eccesso di attività β 1 come risultato di un
aumento della velocità di conduzione, automaticità e ischemia.
In alcuni organi come il cuore lo stimolo più efficace nell’aumentare il
diametro vasale è la variazione della pressione parziale dell’ossigeno.
Le arterie e le arteriole miocardiche sono innervate da fibre simpatiche
vasocostrittrici (α1 e α2 adrenergiche), che presentano una scarica tonica a
riposo. Durante l’esercizio fisico, l’effetto vasocostrittore prodotto dalle fibre
efferenti simpatiche è cancellato in maniera graduale dalla vasodilatazione
metabolica. In alcuni organi come il cuore infatti lo stimolo più efficace
nell’aumentare il diametro vasale è la variazione della pressione parziale
dell’ossigeno: l’aumento della frequenza cardiaca e la forza di contrazione
aumentando il consumo di ossigeno fanno si che la vasodilatazione
metabolica sia più spiccata dell’effetto vasocostrittore sulle coronarie. La
muscolatura liscia dei vasi coronarici possiede anche recettori β, che
mediano la vasodilatazione, scarsamente sensibili alla NA o all’attivazione
simpatica. L’adrenalina, secreta in situazioni di stress, rinforza l’iperemia
53
coronarica attivando questi recettori [125].
Brown ha dimostrato le risposte dei vasi di capacitanza e resistenza
nell’uomo durante by-pass cardiopolmonare. Questo rappresenta un
metodo unico di esaminare la risposta emodinamica al farmaco poiché il
flusso è mantenuto costante eliminando l’effetto miocardico del farmaco
[126]. Piccole varizioni di capacitanza venosa esitano in grandi variazioni di
ritorno venoso dal momento che il 60-70% del volume ematico circolante è
contenuto nel compartimento venoso. L’effetto delle amine simpatico
mimetiche sulla circolazione venosa appare essere distributivo nel senso
che una costrizione venosa aumenta il volume di sangue centrale
(precarico), mentre una dilatazione riduce il ritorno venoso. L’effetto
distributivo delle catecolamine può essere importante quanto l’effetto
inotropo e più importante dell’effetto arteriolare [127].
Quindi una marcata costrizione venosa α1 può migliorare la CO aumentando
il precarico ma può anche scatenare uno scompenso se il precarico eccede
i limiti contrattili del miocardio.
I farmaci con prominente effetto agonista α1 come la NA possono
determinare un aumento di pressione arteriosa ma riducono il flusso totale
in quanto aumentano le resistenze arteriolari (postcarico).
La NA può essere usata per i suoi effetti inotropi a basse dosi e titolandone
gli effetti mentre si monitorizza la gittata cardiaca in modo invasivo, infatti il
monitoraggio della sola pressione arteriosa è spesso dannoso per la gittata
cardiaca. Dosi anche moderate di NA possono avere un effetto dannoso
sulla perfusione terminale degli organi, fatto che ha dato al farmaco una
cattiva reputazione quando usata per regolare la pressione piuttosto che il
flusso. Gli effetti collaterali comprendono la costrizione dell’arteriola renale
con oliguria, inoltre, la terapia prolungata può causare riduzione del volume
plasmatico per trasudazione di fluidi [1].
L’uso prolungato di agonisti adrenergici con forti caratteristiche α
solitamente esita in tachifilassi. Questo fenomeno è probabilmente dovuto
54
alle down-regulations dei recettori adrenergici. Gli sfinteri precapillari sono
sotto controllo miogenico locale e si rilasciano in condizioni di ipossia e
acidosi, indipendentemente da una forte stimolazione α. Gli sfinteri postcapillari sono più funzionali in un ambiente ipossico e acidotico ma sono
sottoposti ad un più forte controllo neurogenico centrale. Un prolungato
aumento del tono post-capillare causa aumento della pressione idrostatica
con una perdita netta di volume intravascolare. Questi eventi sono solo una
delle spiegazioni del cosiddetto e ancora misterioso “levophed shock” in cui
i pazienti non possono essere svezzati dall’infusione di NA [1].
Negli anni passati la NA ha guadagnato una reputazione immeritata poichè
veniva impiegata in dosi di diversi ordini di grandezza superiori a quanto
necessario per ottenere la risposta ottimale nel migliorare la CO piuttosto
che la pressione ematica [1]. Complicanze come insufficienza renale e
necrosi tissutale (dovrebbe essere somministrata solo in un catetere venoso
centrale per evitare la necrosi tissutale da stravaso ematico) sono la norma
e devono essere attese quando si impiega NA
Se la NA viene usata semplicemente per migliorare la pressione piuttosto
che il flusso ematico, la quantità di NA infusa è 5-10 volte maggiore di
quella necessaria per ottenere l’ottimizzazione del trasporto e consumo di
ossigeno [128]. La NA è ritornata clinicamente utile a causa dei sui effetti
prevedibili, rapidi, e potenti nel trattamento farmacologico degli stati a bassa
portata. Il rinnovato interesse verso le catecolamine è correlato alla loro
farmacodinamica chiara ed al loro favorevole profilo farmacocinetico; gli
effetti risultano linearmente correlati al livello plasmatico che è direttamente
dipendente dalla velocità di infusione. L’emivita risulta generalmente breve
nel range dei 2-3 minuti, anche gli effetti sistemici indesiderati scompaiono
in pochi minuti dalla sospensione dell’infusione[133].
55
Lo scopo della tesi è valutare gli effetti dell’infusione continua di
noradrenalina sullo “stroke volume” registrato al Doppler esofageo durante
anestesia generale in pazienti appartenenti alle classi ASA I e II.
Inoltre, obiettivo secondario è verificare l’efficacia del Doppler esofageo nel
rilevare le modificazioni della gittata cardiaca e dei suoi determinanti
attraverso l’utilizzo di un farmaco α-adrenergico in pazienti non affetti da
patologie cardiovascolari.
56
MATERIALI E METODI
Sono stati reclutati 22 pazienti appartenenti alle classi I o II della
classificazione dello stato fisico dell’American Society of Anestesiology
(ASA), candidati ad intervento di chirurgia generale minore (mastectomia,
quadrantectomia + LNS, colecistectomia in VLS).
Il protocollo di studio è stato approvato dalla Commissione Etica
Ospedaliera e da parte di ogni paziente è stato ottenuto il consenso
informato.
La presenza di uno o più dei seguenti criteri di inclusione è stata
indispensabile per arruolare i pazienti nello studio:
-
età maggiore ai 18 anni;
-
appartenenza alle classi ASA I o II;
-
intervento di chirurgia minore;
-
consenso informato.
Non hanno partecipato allo studio invece i pazienti che presentavano
almeno uno dei seguenti criteri di esclusione:
-
presenza di valvulopatie;
-
insufficienza cardiaca congestizia;
-
pregressi episodi di angor o infarto acuto del miocardio (IMA);
-
esofagopatie (flogosi, malformazione);
-
coagulopatie;
-
interventi in urgenza.
57
Anestesia
I pazienti sono stati premedicati con 0.02 mg · Kg-1 di midazolam
somministrati e.v. 15 minuti prima dell’induzione dell’anestesia.
Prima
dell’induzione
dell’anestesia
generale
è
stato
effettuato
un
riempimento volemico con 5 mL · Kg-1 di cristalloidi in bolo. L’infusione
continua di cristalloidi è stata poi mantenuta a 5 mL · Kg -1 durante
l’intervento.
I pazienti sono stati monitorizzati con ECG a 3 derivazioni, pulsossimetria,
pressione arteriosa non invasiva (Nihon Kohden, BSM – 5105K, Shinjuku –
ku – Tokyo, Japan), BIS (BIS, Spacelabs Healthcare, Isaaquah, WA), TOF
(TOF WATCH, Organon, Dublin, Ireland), Cardio Q (FTc, Cardiac Output,
Cardiac Index, Peak Velocity, Mean acceleration).
Dopo adeguata preossigenazione in maschera (3 minuti) si è proceduto con
l’induzione dell’anestesia generale con tecnica endovenosa utilizzando
propofol (2 mg · Kg-1, ridotto del 30% se età > 60 anni), alfentanil
(15 mcg · Kg-1)
antiemetica.
e
deidrobenzoperidolo
L’intubazione
(0.625
orotracheale
è
mg)
stata
come
profilassi
facilitata
dalla
somministrazione di miorilassante (cisatracurio 0.15 mg · Kg-1 o rocuronio
0.6 mg · Kg-1).
La ventilazione meccanica (ventilatore DRÄGER PRIMUS, Dräger Medical,
Lübeck, Germany) è stata adeguata in modo tale da ottenere valori di
anidride carbonica di fine espirazione (EtCO2) compresi fra 35-40 mmHg;
sono stati inoltre monitorizzati i gas sia inspirati che espirati (DRÄGER
PRIMUS).
Il mantenimento dell’anestesia generale è stato effettuato con un anestetico
inalatorio quale sevoflurane conservando un valore di espirato del vapore
(Et Sevo) compreso fra 1.5-2 %, e con l’infusione continua di remifentanil ad
un dosaggio modulabile, sulla base della stimolazione chirurgica e della
risposta del paziente, fra 0.05 e 0.5 mcg · Kg-1 · min-1.
Durante
il
periodo
intraoperatorio
è
stato
eseguito
monitoraggio
58
neuromuscolare con la tecnica dell’accelerometria (TOF WATCH), sulla
base del quale al riscontro del valore di T1 pari al 10 % sono stati eseguiti
boli di richiamo di miorilassante (cisatracurio 0.03 mg · Kg-1 o rocuronio
0.15 mg · Kg-1).
Dopo l’induzione dell’anestesia e l’intubazione orotracheale è stata
posizionata una sonda faringea per la misurazione della temperatura
corporea, il cui mantenimento ad una temperatura superiore a 35 oC è stato
ottenuto con mezzi di riscaldamento ad aria (WarmTouch, Mallinckrodt
medical Athlon, Ireland) ed infusione di liquidi caldi (Hot lineTM Rockland,
MA, USA).
Si è provveduto inoltre al posizionamento del catetere vescicale per il
monitoraggio della diuresi oraria.
Durante
l’intervento
si
è
proceduto
all’inserimento
della
sonda
endoesofagea per la misurazione dei vari parametri (FTc, SV, CI, PV, CO,
MA). Sono state eseguite due misurazioni a tempi predefiniti. La sonda
endoesofagea (Ref: 9050 - 7201, Deltex medical, Chichester, UK),
lubrificata con pomata di Lidocaina cloridrato all’ 1 % (Luan®), è stata
inserita, attraverso la bocca, nell’esofago ad una profondità di circa 35
centimetri dagli incisivi, dove veniva registrato un flusso sanguigno ottimale
dall’aorta discendente. Al fine di ottenere il miglior segnale Doppler
possibile (onda con velocità maggiore possibile), si è proceduto alla
manipolazione della sonda attraverso piccole rotazioni lungo il proprio asse,
leggeri avanzamenti o arretramenti. Il monitor CardioQ è stato utilizzato per
stimare lo “stroke volume” attraverso la misurazione della velocità del flusso
nell’aorta discendente.
Si è proceduto alle misurazioni a fine intervento una volta cessato lo stimolo
chirurgico. Si è riusciti ad evitare il problema dello stimolo del dolore con
infusione continua di remifentanil 0.05 mcg · Kg-1 · min-1, Et Sevo 1% e
valori di BIS inferiori a 50 e ad effettuare le misurazioni con il CardioQ nelle
condizioni di massima stabilità del paziente.
59
Durante la seduta è stata effettuata la somministrazione di paracetamolo (1
grammo), ondansetron (4 mg) per il controllo del dolore e della nausea e
vomito post-operatori.
Al termine dell’intervento, quando al monitoraggio della trasmissione
neuromuscolare il T1 era pari al 25 %, è stata somministrata la miscela
decurarizzante preparata con 1 mg di atropina e 2.5 mg di prostigmina.
Si è proceduto all’estubazione solamente in presenza di un adeguato
recupero dei riflessi protettivi (TOF ratio > 90%), di un’attività respiratoria
spontanea, di stabilità emodinamica e di normotermia.
L’analgesia post-operatoria è stata effettuata tramite somministrazione e.v.
in bolo di tramadolo (100 mg) e ketorolac (30 mg) ogni 8 ore.
Durante il periodo intraoperatorio abbiamo registrato i dati del paziente
(età, peso, altezza, presenza di eventuali patologie, classe ASA, tipo di
intervento chirurgico effettuato).
Sono stati annotati a tempi predefiniti (T0 - basale, T1 - dopo 15 min di
infusione di noradrenalina 0.1 mcg · Kg-1 · min-1) i seguenti parametri:
-
Pressione arteriosa media (MAP)
-
Frequenza cardiaca (HR)
-
Pulsossimetria (SpO2)
-
Cardiac Output (CO)
-
Cardiac Index (CI)
-
Stroke Volume (SV)
-
Flow Time corretto (FTc)
-
Peak velocity (PV)
-
Mean Acceleration (MA)
60
Valutazione statistica
Tutti i dati sono riportati come media e deviazione standard. Le variabili
in studio (HR, CI, MAP, SV, FTc, PV e MA) sono state analizzate con il
Paired T test di Student. Sono state considerate statisticamente significative
differenze con P < 0.05.
L’analisi statistica è stata effettuata per mezzo del software Prism 5 per
Windows (versione 5.01, 2007, GraphPad Software Inc., San Diego CA,
USA).
61
RISULTATI
I dati demografici, fisiologici, clinici e i diversi valori registrati durante la
seduta sono rappresentati nella tabella 2. Il gruppo di pazienti era costituito
da 23 donne con età media di 56.1 anni. La durata media dell’intervento è
stata di 149 ± 42.3 minuti.
In due di queste pazienti era stata riscontrata un'ipercolesterolemia
famigliare, tre presentavano ipotiroidismo, una era affetta da β-talassemia
minor ed una soffriva di coliche renali non calcolosiche. Infine una paziente
presentava un’infezione da HBV.
La sonda è stata mantenuta i sede per l’intera seduta operatoria senza
effetti collaterali; è stata sfilata solo a fine intervento prima di risvegliare il
paziente.
La gittata cardiaca ha risentito dell’infusione di noradrenalina
(p=0.0002) passando dal valore basale di 4.57 ± 1.29 L·min-1 a 3.58 ±
1.25 L·min-1. Si sono registrate modificazioni statisticamente significative
anche per quanto riguarda la gittata sistolica (P=0.0002) con SV basale di
80.4 ± 21.8 mL e SV finale di 67.6 ± 20.7 mL.
Dopo la somministrazione del farmaco la pressione arteriosa media che era
inizialmente di 71 ± 7 mmHg è arrivata a 98 ± 17 mmHg (p<0.0001) e la
frequenza cardiaca si è ridotta da 58 ± 6 a 52 ± 7 bpm (p=0.0016).
Gli indici di inotropismo cardiaco (PV e MA) si sono comportati in modo non
uniforme. Mentre la “peak velocity” ha subito modificazioni significative
(p<0.0001) dal T0 basale al T1 passando da 68.5 ± 21.7 a 58.5 ± 17.8
cm·s-1, così non è stato per la “mean acceleration” che è passata da valori
basali di 8.3 ± 3.3 cm·s-2 a valori finali di 8 ± 3 cm·s-2 (p=0.48).
Il “flow time” corretto, interessato direttamente dall'aumento della pressione
arteriosa, partendo da 346 ± 36 ms, dopo l'infusione di noradrenalina è
62
arrivato a valori di 315 ± 47 ms, mostrando una variazione statisticamente
significativa (p=0.01) (fig. 13-19) (tab. 3).
In nessun paziente si è resa necessaria la sospensione dell’infusione
continua di noradrenalina.
63
DISCUSSIONE
I dati raccolti nel nostro studio mostrano come aumentando la
pressione arteriosa attraverso un farmaco vasocostrittore quale la
noradrenalina si causa una modificazione del flusso aortico, che è
prontamente rilevata attraverso il Doppler esofageo. Si è verificata infatti la
diminuzione dello "stroke volume" (media 15%) e della gittata cardiaca
(media 20%). La riduzione dello "stroke volume" si è manifestata anche con
il decremento della "peak velocity" (media 14%) e del "flow time" corretto
(media 8%). Queste modificazioni corrispondono visivamente alla riduzione
della base e dell'altezza dell'onda mostrata dal monitor.
Le nostre misurazioni di "peak velocity" e "flow time" corretto concordano
con l'analisi della forma d'onda effettuata da Singer et al. [101]. Egli associa
all'aumento del postcarico la riduzione del PV e del rapporto tra FT e CT
(FT:CT). Alla riduzione delle resistenze vascolari sistemiche associa
l'aumento di PV e di FT mentre all'effetto inotropo positivo corrisponde
l'aumento della sola velocità di picco. Infine, alla correzione dell'ipovolemia
associa l'incremento del solo FT:CT [101] (fig. 11).
In un altro studio, utilizzando il Doppler con approccio soprasternale, Singer
et al. hanno verificato anche la correlazione tra le variazioni di precarico,
postcarico ed inotropismo e le corrispettive modificazioni dei valori di
frequenza cardiaca, "stroke distance", "minute distance" e "mean
acceleration" [27].
Nella nostra esperienza l'azione della noradrenalina ha ridotto lo
"stroke volume" modificando "peak velocity" e "flow time" corretto, ma non
ha modificato la "mean acceleration" (p = 0.48). Abbiamo rilevato inoltre
una riduzione della frequenza cardiaca come risposta vagale riflessa
all'ipertensione.
64
Dato il meccanismo d'azione della noradrenalina ci saremmo potuti
aspettare una variazione della "mean acceleration" analoga a quella della
"peak velocity" come riscontrato da Singer [27].
L'aumento della "mean acceleration" è stato riscontrato in 9 pazienti,
mentre negli altri 13 si è ridotta (fig. 20).
Nello studio di Singer il campione era ristretto (5 soggetti) ed il farmaco
vasocostrittore utilizzato era la
metossamina; questa sostanza agisce
unicamente sui recettori α1-adrenergici, mentre la noradrenalina ha anche
azione β1-agonista [133].
Forse le differenze farmacodinamiche tra noradrenalina e metossamina
possono spiegare perchè abbiamo riscontrato risultati differenti rispetto a
quanto rilevato da Singer.
I dubbi insorti negli ultimi 10-15 anni riguardo all’utilizzo del PAC, dovuti
ai rischi aggiuntivi a cui viene sottoposto il paziente, hanno fatto crescere
l’interesse per i metodi alternativi di monitoraggio emodinamico. Si è
accelerato il perfezionamento di tecniche meno invasive, tra cui il Doppler
esofageo.
Questo strumento è stato valutato in numerosi articoli che lo hanno
confrontato con la termodiluizione. Nel 2002 Laupland et al. in una review
hanno analizzato 24 studi pubblicati tra il 1985 ed il 2000 riguardanti
l’affidabilità del Doppler esofageo durante il monitoraggio perioperatorio e
nelle unità di terapia intensiva. Si è dimostrata una buona correlazione tra
Doppler esofageo e termodiluizione, tuttavia Laupland fa notare che molti di
questi studi hanno coinvolto un numero esiguo di pazienti, che il
procedimento non era “cieco” e che non è stata usata l’analisi dei dati
secondo il metodo di Bland e Altman [106].
In un’analisi di 21 studi effettuata da Dark e Singer nel 2004, il Doppler
esofageo sembra risultare più affidabile nello studio del trend della gittata
cardiaca che nella stima del valore assoluto di CO in un determinato
momento [26]. Da un lato questo non è uno svantaggio del Doppler
65
esofageo, poiché le modificazioni della gittata cardiaca sono molto più utili
nella gestione del paziente critico rispetto al valore assoluto. D’altro canto
sono anche necessari ulteriori analisi per approfondire questo aspetto,
infatti Dark e Singer ammettono che le pubblicazioni da loro raccolte non
erano esaustive. Gli autori della review danno delle indicazioni precise per
giungere alla definitiva validazione di questa metodica. In particolare
raccomandano per gli studi futuri: che siano “in cieco”, che si adotti il
metodo di Bland-Altman per l’analisi dei dati e che il Doppler esofageo sia
confrontato con la termodiluizione in continuo e non con quella intermittente
(con boli di soluzione salina).
Da ultimo suggeriscono di utilizzare l’eco-Doppler esofageo che attraverso
l’opzione M-mode permette di misurare il diametro aortico invece di
approssimarlo con un nomogramma [26].
E’ da notare che alcuni autori anglosassoni usano il termine “precisione”
come sinonimo di “accuratezza” mentre nel linguaggio scientifico italiano
questa parola implica il concetto di esattezza nella riproducibilità. Dark e
Singer sostengono che il metodo della termodiluizione con boli di soluzione
salina è accurata nella stima del CO ma può risentire di una variabilità
superiore al 15% in 3 misurazioni consecutive, cioè non è precisa [9, 10,
26, 101]; diventa quindi fuorviante utilizzare questa tecnica come termine di
paragone per valutare l’accuratezza di una metodica più precisa, quale
appunto il Doppler esofageo [26, 101].
Tra il 2003 ed il 2007 alcuni autori hanno utilizzato il metodo di BlandAltman per comparare Doppler esofageo e termodiluizione, tuttavia non
hanno utilizzato PACs che consentissero il rilevamento in continuo del CO
[129-132].
Bein et al. nel 2007 hanno comparato l'eco-Doppler esofageo con il
rilevamento della gittata cardiaca attraverso termodiluizione in continuo.
Hanno analizzato i dati raccolti su 10 pazienti sottoposti a by-pass
coronarico attraverso il metodo di Bland e Altman. Sono giunti alla
66
conclusione che la correlazione tra i due metodi di determinazione della
gittata cardiaca è accettabile [24].
Monnet et al. nel 2007 hanno valutato la risposta emodinamica al
carico fluidico in 76 pazienti, attraverso eco-Doppler esofageo. Hanno
calcolato il CO prima e dopo la somministrazione di liquidi misurando il
diametro aortico con ecografia M-mode. Dopo "fluid challenge" la gittata
cardiaca è stata calcolata anche considerando la sezione aortica invariata,
utilizzando il diametro misurato prima della somministrazione di liquidi. Gli
autori sono giunti alla conclusione che se non si misura la variazione della
sezione aortica nei soggetti giovani, si sottostima la risposta al riempimento
volemico; nei giovani infatti l'elasticità della parete aortica è maggiore
rispetto a quella dei soggetti anziani ed il diametro del vaso si modifica
maggiormente al variare della volemia [116].
Sarebbe stato interessante calcolare il "cardiac output" anche sulla base di
valori di diametro aortico forniti dal nomogramma utilizzato da altre
apparecchiature per il Doppler esofageo attualmente in commercio, per
comparare i diversi tipi di approccio di questi strumenti.
In diversi studi si è utilizzato il Doppler esofageo per
guidare
l’ottimizzazione peri-operatoria della gittata sistolica attraverso carichi di
fluidi, ed hanno dimostrato un effetto positivo sull’outcome dopo chirurgia
[16 - 22]. I criteri utilizzati per gestire il "fluid challenge" si sono basati su
"stroke volume" e "flow time" corretto. Singer e Bennet hanno studiato l'FTc
come misura del riempimento ventricolare inserendo un Doppler esofageo
e un catetere arterioso polmonare in 43 pazienti ventilati meccanicamente
in un’Unità di Terapia intensiva e sottoposti a cardiochirurgia. In questi
pazienti il riempimento ventricolare veniva modificato attraverso carichi di
fluidi oppure attraverso l’utilizzo di nitrati. E’ stato osservato un incremento
parallelo dell’FTc e della pressione di incuneamento capillare polmonare in
seguito ad un carico di fluidi. Questo studio dimostra come il "flow time"
corretto sia utile per misurare direttamente il precarico [104].
67
Sinclair e Singer hanno sviluppato un algoritmo per la titolazione dei liquidi
che prevedeva di mantenere l'FTc a valori superiori a 350 ms. Questo
algoritmo è stato poi modificanto ed utilizzzato negli studi su terapia fluidica
e tempi di degenza [103].
Altri autori come DiCorte e Madan hanno dimostrato attraverso ulteriori
studi questa correlazione tra "flow time" corretto e precarico. In particolare
nello studio condotto da Madan è stato dimostrato come il “flow time”
corretto sia un indice di precarico migliore della pressione di incuneamento
capillare
polmonare
(PCWP)
e
della
pressione
venosa
centrale
(CVP) [23, 134].
Sebbene valori di FTc inferiori a 330-360 ms siano causati
frequentemente dall’ipovolemia , anche altri fattori (come i cambiamenti
delle
resistenze vascolari sistemiche e una funzione ventricolare
compromessa) li possono determinare [19, 20] e Bundgaard-Nielsen ha
dimostrato che lo "stroke volume" è un parametro migliore su cui basare la
fluidoterapia [135]. In questo caso la somministrazione di una quantità
prestabilita di liquidi viene ripetuta ad intervalli di 5-15 minuti finché riesce a
garantire un incremento dello SV maggiore al 10% [16, 17, 20, 21, 135]. La
mancata risposta al carico di fluidi attesta che il paziente sta operando sulla
porzione piatta della curva della funzionalità cardiaca e che ulteriori
implementi potrebbero risultare in una congestione venosa e non in un
miglioramento della perfusione (fig. 21). Il Doppler esofageo può perciò
essere utile anche nel determinare il limite superiore per il riempimento
volemico in ogni paziente in modo da evitare il rischio di edema polmonare
post-operatorio [100].
68
CONCLUSIONI
Dai risultati ottenuti si può concludere che il rialzo pressorio
conseguente all'utilizzo della noradrenalina si manifesta, al rilevamento
Doppler esofageo, con una riduzione significativa dello "stroke volume" e
delle sue componenti indirette ("peak velocity" e "flow time" corretto). La
"mean acceleration" non risente delle modificazioni emodinamiche causate
dalla noradrenalina; l'aumento del postcarico non modifica l'accelerazione
media del flusso aortico durante la sistole.
Gli
effetti
α-adrenergici
di
questa
catecolamina
prevalgono
sui
β-adrenergici che incrementando la contrattilità cardiaca tenderebbero ad
aumentare la "peak velocity", la "mean acceleration" e quindi lo "stroke
volume", nonché la frequenza del cuore.
La gestione del paziente critico durante il periodo perioperatorio
richiede un monitoraggio affidabile degli indici emodinamici. Il rilevamento
in tempo reale delle variazioni dei parametri cardiocircolatori è cruciale per
il tempestivo adeguamento della terapia alle condizioni cliniche del
paziente.
L'assenza di complicanze significative e l’attendibilità fanno del Doppler
esofageo un monitoraggio indicato quando tecniche più invasive risultano
inappropriate o non praticabili.
La rapida responsività alle variazioni emodinamiche e le informazioni
aggiuntive sugli elementi determinanti la performance cardiaca lo rendono
un utile complemento ad altri monitoraggi emodinamici.
69
ICONOGRAFIA
70
Parametri
Display Simbolo
Valori di
normalità
Heart Rate (bpm)
misurato
HR
60 - 100
Stroke Distance (cm)
misurato
SD
Minute Distance (cm)
misurato
MD
Flow Time Corrected (ms)
misurato
FTc
330 - 360
Peak Velocity (cm · s-1)
misurato
PV
70 - 120
Mean Acceleration (cm · s-2)
misurato
MA
Cardiac Output (L · min-1)
calcolato
CO
4-7
Cardiac Index (L · min-1 · m-2)
calcolato
CI
2.5 - 4
Stroke Volume (mL)
calcolato
SV
60 - 90
Stroke Volume Index (mL · m-2)
calcolato
SVI
40 - 60
Body Surface Area (m2)
Systemic Vascular Resistance
(dyne · s · cm-5)
calcolato
BSA
calcolato
SVR
1200 - 1500
Tabella 1. Parametri emodinamici disponibili con monitor CardioQTM
71
Età Sesso
Peso Altezza
Patologia di
ASA
(Kg)
(cm)
base
IR
PI
FL
KU
DGG
LL
TN
CM
79
62
67
56
57
58
47
56
F
F
F
F
F
F
F
F
68
65
74
75
64
65
57
73
165
160
170
170
161
160
166
169
II
II
II
II
II
II
II
II
ME
47
F
60
170
II
SN
60
F
60
166
II
DPA 64
F
60
160
II
CN
BM
49
68
F
F
65
72
155
160
I
II
HTN
FH
FH
Ipo
tiroidismo
Ipo
tiroidismo
-
MD
53
F
55
160
II
-
DAD 42
F
58
160
I
-
BL
64
F
53
158
II
SN
46
F
50
161
I
DG
ZS
PC
PM
50
65
58
51
F
F
F
F
63
80
57
58
167
160
156
159
II
II
I
I
SS
35
F
90
165
II
β-talassemia
minor
Calcolosi
renale
Intervento
Quad + LNS
Quad + LNS
Mastectomia
Quad + LNS
Quad + LNS
Mastectomia + LNS
Mastectomia + LNS
Mastectomia
Colecistectomia VLS
Quad + LNS
Quad + LNS
Colecistectomia VLS
Allargamento quad
Quad + LNS +
linfanedectomia
Quad
Colecistectomia
laparotomica
Quad + LNS
Quad + LNS
Mastectomia
Quad + LNS
Quad + LNS
Mastectomia +
conizzazione uterina
Tabella 2. Caratteristiche demografiche dei pazienti sottoposti allo studio.
HTN, ipertensione; FH, ipercolesterolemia familiare; quad, quadrantectomia;
LNS, linfonodo sentinella.
72
HR (bpm)
MAP (mmHg)
-1
CO ( L · min )
CI (L · min-1 · m-2)
SV (mL)
FTc (ms)
Basale
T1
58 ± 6
52 ± 7
71 ± 7
98 ± 17
4.57 ± 1.29
3.58 ± 1.25
2.7 ± 0.7
2.1 ± 0.7
80.4 ± 21.8
67.6 ± 20.7
346 ± 36
315 ± 47
-1
68.5 ± 21.7
58.5 ± 17.8
-2
8.3 ± 3.3
8±3
PV (cm · s )
MA (cm · s )
Tabella 3. Media e deviazione standard dei parametri raccolti nei due tempi
intraoperatori: frequenza cardiaca (HR), pressione arteriosa media (MAP),
gittata cardiaca (CO), indice cardiaco (CI), stroke volume (SV), flow time
corretto (FTc), peak velocity (PV), mean acceleration (MA).
73
A
B
Figura 1. A) Curva di Frank-Starling. B) Curve di Sarnoff.
Effetti del cambiamento del precarico e dell'inotropismo sulla gittata
cardiaca.
74
A
B
Figura 2. Modelli sperimentali per valutare l'effetto del carico sull'attività
delle fibre miocardiche isolate.
75
Figura 3. Curve pressione - volume del ventricolo sinistro.
76
A
B
Figura 4. Effetti del precarico, del postcarico e dell'inotropismo sulla
velocità di accorciamento delle fibre miocardiche.
77
Δt
ΔP
Figura 5. Variazione della pressione ventricolare sinistra per diversi
precarichi. Successivi aumenti del volume diastolico ventricolare (quadratini
bianchi) provocano progressivi aumenti della pressione sistolica (quadratini
neri).
78
Figura 6. Analisi del contorno del polso per la gittata cardiaca in continuo.
79
A
B
Figura 7. Forma d'onda e parametri misurabili con Doppler esofageo.
80
Figura 8. Corretto posizionamento della sonda per Doppler transesofageo.
81
Figura 9.
Rappresentazione del flusso sanguigno rilevato attraverso
l'effetto Doppler.
fi, onda incidente; fr, onda riflessa; α, angolo di incidenza degli ultrasuoni
rispetto alla direzione della struttura bersaglio; V, velocità di movimento
della struttura bersaglio.
82
Figura 10. Rappresentazione stilizzata dell'onda di velocità del sangue in
aorta, rilevata con Doppler esofageo.
Stroke distance: l'area sotto la curva corrisponde alla distanza percorsa
dalla colonna di sangue durante la sistole. Mean acceleration: la pendenza
della curva corrisponde all'accelerazione media del sangue in aorta durante
il tempo che intercorre tra l'inizio del flusso aortico ed il raggiungimento
della massima velocità. Peak velocity: massima velocità raggiunta. Flow
time: durata del flusso aortico sistolico. Flow time to peak: tempo che
intercorre tra l'inizio del flusso aortico ed il raggiungimento della massima
velocità. Cycle time: tempo tra l'inizio di un onda e l'inizio di quella
successiva.
83
Figura 11. Alterazioni della forma d'onda per variazioni emodinamiche.
84
Figura 12. Formula di struttura della noradrenalina.
85
Figura 13. Gittata sistolica prima e dopo la somministrazione di
noradrenalina. Sono rappresentati il valore medio, i valori minimo e
massimo, e la deviazione standard.
* p < 0.001.
86
Figura 14. Gittata cardiaca prima e dopo la somministrazione di
noradrenalina. Sono rappresentati il valore medio, i valori minimo e
massimo, e la deviazione standard.
* p < 0.001
87
Figura 15. Pressione arteriosa media prima e dopo la somministrazione di
noradrenalina. Sono rappresentati il valore medio, i valori minimo e
massimo, e la deviazione standard.
* p < 0.0001
88
Figura 16. Frequenza cardiaca prima e dopo la somministrazione di
noradrenalina. Sono rappresentati il valore medio, i valori minimo e
massimo, e la deviazione standard.
* p < 0.01
89
Figura 17. "Flow time" corretto, prima e dopo la somministrazione di
noradrenalina. Sono rappresentati il valore medio, i valori minimo e
massimo, e la deviazione standard.
* p < 0.01
90
Figura 18. "Peak velocity" prima e dopo la somministrazione di
noradrenalina. Sono rappresentati il valore medio, i valori minimo e
massimo, e la deviazione standard.
* p < 0.0001
91
Mean acceleration
20
cm ⋅ sec-2
15
10
5
N
or
ad
re
na
lin
a
B
as
a
le
0
Figura 19. "Mean acceleration" prima e dopo la somministrazione di
noradrenalina. Sono rappresentati il valore medio, i valori minimo e
massimo, e la deviazione standard.
92
Mean acceleration
20
cm ⋅ sec-2
15
10
5
0
Basale
Noradrenalina
Figura 20. Variazione della "mean acceleration" a seguito dell'infusione di
noradrenalina.
93
Figura 21. Effetto di successivi carichi di fluidi (A, B, C, D) sulla gittata
cardiaca. Nella porzione "Δ" della curva di Frank-Starling l'incremento del
precarico produce l'aumento della gittata. La somministrazione di fluidi
nella porzione "δ" (B, C, D) porta ad incrementi di gittata minimi o nulli.
94
BIBLIOGRAFIA
1. Lawson NW, Johnson JO. Sistema nervoso autonomo: fisiologia e
farmacologia. Anestesia clinica, V edizione. Antonio Delfino editore,
Barash PG, Cullen BF, Stoelting RK, 2007; Cap. 12: 307-374
2. Connors AF, MCCaffree DR, Gray BA. Evaluation of right-heart
catheterization in the critically ill patient without acute myocardial
infarction. N Engl J Med 1983; 308: 263-267
3. Fein AM, Goldberg SK, Walkenstein MD, et al. Is pulmonary artery
catheterization necessary for the diagnosis of pulmonary edema? Am
Rev Respir Dis 1984; 129: 1006-1009
4. Marik PE, Varon J. The hemodynamic derangements in sepsis:
implications for treatment strategies. Chest 1998; 114: 854-860
5. Rodriguez R, Lum-Lung M, Dixon K, Nothmann A. A prospective study
on esophageal Doppler hemodynamic assessment in the ED. Am J
Emerg Med 2006; 24: 658-663
6. Cavallari P. Biofisica del sistema circolatorio. Fisiologia e biofisica
medica, II edizione. Poletto editore, Baldissera F, Milano, 2000; Cap 44:
490-505
7. Connors AF, Speroff T, Dawson NV, et al. The effectiveness of right
heart catheterization in the initial care of critically ill patients. JAMA
1996; 276: 889-897
8. Marik PE. Pulmonary Artery Catheterization and Esophageal Doppler
Monitoring in the ICU. Chest 1999; 116: 1085-1091
9. Le Tulzo Y, Belghith M, Seguin P, Dall’ava J, Monchi M, Thoma R,
95
Dhainaut
JF.
Reproducibility
of
thermodilution
cardiac
output
determination in critically ill patients: comparison between bolus and
continuous method. J Clin Monit 1996; 12: 379-385
10. Zollner C, Goetz AE, Weis M, Morstedt K, Pichler B, Lamm P, Kilger E,
Haller M. Continuous cardiac output measurements do not agree with
conventional bolus thermodilution cardiac output determination. Can J
Anesth 2001; 48: 1143-1147
11. The National Heart, Lung and Blood Institute Acute Respiratory Distress
Syndrome (ARDS) Clinical Trials Network. Pulmonary-artery versus
central venous catheter to guide treatment of acute lung injury. N Engl J
Med 2006; 354: 2213-2224
12. Pinsky MR, Vincent JL. Let us use the pulmonary artery catheter
correctly and only when we need it. Crit Care Med 2005; 33: 1119-1122
13. Ramsey SD, Saint S, Sullivan SD, et al: Clinical and economic effects of
pulmonary artery catheterization in nonemergent coronay artery bypass
graft surgery. J Cardiothorac Vasc Anesth 2000; 14: 113-118
14. Cholley BP and Payen D. Nonivasive techniques for measurements of
cardiac output. Curr Opin Crit Care 2005; 11: 424-429
15. Arrowsmith JE, Dawson AJ. Advanced cardiovascular monitoring.
Surgery 2006; 10: 333-336
16. Noblett SE, Snowden CP, Shenton BK, Horgan AF. Randomized clinical
trial assessing the effect of Doppler-optimized fluid management on
outcome after elective colorectal resection. Br J Surg 2006; 93:
1069-1076
17. Wakeling HG, McFall MR, Jenkins CS, et al: Intraoperative oesophageal
Doppler guided fluid management shortens postoperative hospital stay
after major bowel surgery. Br J Anaesth 2005; 95: 634-642
18. Mythen MG, Webb AR, Perioperative plasma volume expansion reduces
the incidence of gut mucosal hypoperfusion during cardiac surgery. Arch
96
Surg 1995; 130: 423-429
19. Sinclair S, James S, Singer M. Intraoperative intravascular volume
optimization and length of hospital stay after repair of proximal femoral
fracture: randomized controlled trial. BMJ 1997; 315: 909-912
20. Gan TJ, Soppitt A, Maroof M, El-Moalem H, et al. Goal-directed
intraoperative fluid administration reduces length of hospital stay after
major surgery. Anesthesiology 2002; 97: 820-826
21. Conway DH, Mayall R, Abdul-Latif MS, et al. Randomised controlled trial
investigating
the
influence
of
intravenous
fluid
titration
using
oesophageal Doppler monitoring during bowel surgery. Anaesthesia
2002; 57: 845-849
22. Venn R, Steele A, Richardson P, et al. Randomized controlled trial to
investigate influence of the fluid challenge on duration of hospital stay
and perioperative morbidity in patients with hip fractures. Br J Anaesth
2002; 88: 65-71
23. Madan AK, UyBarreta VV, Aliabadi-Wahle S, et al. Esophageal doppler
ultrasound
monitor
versus
pulmonary
artery
catheter
in
the
hemodynamic management of critically ill surgical patients. J Trauma
1999; 46: 607-611
24. Bein B, Worthmann F, Tonner PH, et al. Comparison of esophageal
Doppler, pulse contour analysis, and real-time pulmonary artery
thermodilution for the continuous measurement of cardiac output. J
Cardiothorac Vasc Anesth 2004; 18: 185-189
25. Seoudi HM, Perkal MF, Hanrahan A, Angood PB. The esophageal
Doppler monitor in mechanically ventilated surgical patients: does il
work? J Trauma 2003; 55: 720-725
26. Dark PM, Singer M. The validity of trans-esophageal Doppler
ultrasonography as a measure of cardiac output in critically ill adults.
Intensive Care Med 2004; 30: 2060-2066
97
27. Singer M, Allen MJ, Webb AR, Bennet ED. Effects of alterations in left
ventricular filling, contractility, and systemic vascular resistance on the
ascending aortic blood velocity waveform of normal subjects. Crit Care
Med 1991; 19: 1138-1145
28. Black TJJ, Lee DL. Fisiologia cardiaca. Trattato di Anestesia, IV
edizione. Antonio Delfino editore, Miller RD, New York, 2000; Cap. 18:
621-647
29. Cavallari P. Gittata cardiaca. Fisiologia e biofisica medica, II edizione.
Poletto editore, Baldissera F, Milano, 2000; Cap 48: 542-547
30. Cavallari P. Eccitazione e contrazione del cuore. Fisiologia e biofisica
medica, II edizione. Poletto editore, Baldissera F, Milano, 2000; Cap. 45:
506-518
31. Guyton AC, Hall JE. Heart Muscle; The Heart as a Pump and Function
of the Heart Valves. Textbook of Medical Physiology, XI edition. Elsevier
Saunders edition, Guyton AC, Hall JE, Philadelphia, 2006; Cap. 9:
103-115
32. Borsa F, Scannicchio D. Fisica, con applicazioni in biologia e in
medicina, editore Unicopli, Milano 1992; Cap. 6: 171-203
33. Fung YC. Heart muscle. Biomechanics: Mechanical Properties of Living
Tissues, 2nd edition. Springer-Verlag, New York, 1993; Cap.10: 427-462
34. Sun LS, Schwarzenberger J. Cardiac physiology. Miller's Anesthesia, VI
edition. Elsevier Churchill Livingston, Miller RD, Philadelphia, 2005; Cap.
18: 724-742
35. Cavallari P. Meccanica cardiaca. Fisiologia e biofisica medica, II
edizione. Poletto editore, Baldissera F, Milano, 2000; Cap. 47: 533-541
36. Lake CL. Anatomia e fisiologia cardiovascolare. Anestesia clinica,
V edizione. Antonio Delfino editore, Barash PG, Cullen BF, Stoelting RK,
2007; Cap. 30: 971-1005
37. Cavallari P. Regolazione della gittata cardiaca e del ritorno venoso.
98
Fisiologia e biofisica medica. Poletto editore, Baldissera F, Milano, 1996;
Cap. 72: 896-907
38. Sarnoff SJ, Gilmore JP, Mitchell JH, Remensnyder JP. Potassium
changes in the heart during homeometric autoregulation and acetyl
strophantidin. Am J Med 1963; 34: 434-440
39. Koch-Weser J, Blinks JR. The influence of the interval between beats on
myocardial contractility. Pharamcol Rev 1963; 15: 601-607
40. Woodworth RS. Maximal contraction, “staircase” contraction, refractory
period, and compensatory pause of the heart. Am J Physiol 1902; 8:
213-220
41. Leewinter MM. Fisiologia normale del sistema cardiovascolare. Il Cuore,
XI edizione. McGraw-Hill editore, Hurst, Milano, 2004; Cap. 4: 99-132
42. Antoni H. Funzioni del cuore. Fisiologia Umana, III edizione. Idelson
Liviana editore, Schmidt RF, Thews G, Springer – Verlag Berlin
Heidelberg, 1992; Cap. 19: 447-489
43. Arrowsmith JE, Dawson AJ. Advance cardiovascular monitoring.
Surgery 2006; 24: 333-336
44. Della Rocca G, Coccia C, Tripi G. Monitoraggio emodinamicovolumetrico in anestesia. Emodinamica ed emodinamica-volumetrica in
anestesia e rianimazione, I edizione. Arianna editrice, Della Rocca G,
Pietropaoli P, Bologna, 2007; Cap. 6: 197-238
45. Mathews L, Singh RKK. Swan-Ganz catheter in hemodynamic
monitoring. J Anaesth Clin Pharmacol 2006; 22: 335-345
46. Headley JM, Diethorn ML. Right ventricular volumetric monitoring.
AACN Clinical Issues in Critical Care Nursing 1993; 4: 120-133.
47. Tsagaropoulou AT, Vasiliadis K, Fessatidis Ipapavasi-Liou E, Spyron P.
Beware
Swan-Ganz
complication.
Perioperative
management.
J
Cardiovasc Surg 2002; 42:1643-1652
48. Pfeiffer UJ, Backus G, Blumel G et al. A fiberoptics based system for
99
integrated monitoring of cardiac output, intrathoracic blood volume,
extravascular lung water, O2 saturation, and a-v differences. In: Lewis F,
Pfeiffer UJ, editors. Practical applications of fiberoptics in critical care
monitoring. Berlin: Springer - Verlag; 1990, p. 114-125
49. Della Rocca G, Covello DR, Costa MG. L'edema polmonare e la EVLW.
Emodinamica ed emodinamica-volumetrica in anestesia e rianimazione,
I edizione. Arianna editrice, Della Rocca G, Pietropaoli P, Bologna,
2007; Cap. 8: 265-328
50. Hofer CK, Furrer L, Matter-Ensners S, et al. Volumetric preload
measurement by thermodiluition: a comparison with transoesophageal
echocardiography. Br J Anaesth 2005; 94: 748-755
51. Della Rocca G, Costa GM, Coccia C, et al. Preload index: pulmonary
artery occlusion pressure versus intrathoracic blood volume monitoring
during lung transplantation. Anesth Analg 2002; 95: 835-853
52. Specht M, Apenburg C, Wichmann K, Reinhart K. The accuracy of the
continuous cardiac output measurement by the pulse contour method
under changes in systemic vascular resistance. Anesthesiology 1991; 75
(3A): A457
53. Godje O, Hoke L, Fischlein T, Vetter H, Reichart B. Less invasive,
continuous cardiac output measurement through pulse contour analysis
versus conventional thermal diluition. Int Care Med 1996; 22 (suppl 1):
S58
54. Della Rocca G, Costa MG. Volumetric monitoring. Minerva Anestesiol
2005; 71: 303-306
55. Godje O, Hoke K, Goetz AE, Felbinger TW, Reuter DA et al. Reliability
of a new algorithm for continuous cardiac output determination by pulsecontour analysis during hemodynamic instability. Crit Care Med 2002;
30: 52-58
56. Della Rocca G, Cecchini V, Costa MG. Gittata cardiaca in continuo.
100
Emodinamica ed emodinamica-volumetrica in anestesia e rianimazione,
I edizione. Arianna editrice, Della Rocca G, Pietropaoli P, Bologna,
2007; Cap. 3: 67-111
57. Rödig G, Prasser C, Keyl C, Liebold A, Hobbhahn J. Continuous cardiac
output
measurement:
pulse
contour
analysis
vs
thermodiluition
technique in cardiac surgical patients. Br J Anaesth 1999; 83: 525-530
58. Van Lieshout JJ, Wesseling KH. Continuous cardiac output by pulse
contour analysis? Br J Anaesth 2001; 86: 467-469
59. Goedje O, Hoeke K, Lichtwarck-Aschoff M, et al. Continuous cardiac
output by femoral arterial thermodiluition calibrated pulse contour
analysis: comparison with pulmonary arterial thermodiluition. Crit Care
Med 1999; 27: 2407-2412
60. Zollner C, Haller M, Weis M, et al. Beat-to-beat measurement of cardiac
output by intravascular pulse contour analysis: a prospective criterion
standard study in patients after cardiac surgery. J Cardiothorac Vasc
Anesth 2000; 14: 125-129
61. Della Rocca G, Costa MG, Pompei L, et al. Continuous and intermittent
cardiac output measurement: pulmonary artery catheter versus aortic
transpulmonary technique. Br J Anaesth 2002; 88: 350-356
62. Linton R, Band DM, Haire KM. A new method of measuring cardiac
output in man using lithium dilution. Br J Anaesth 1993; 71: 262-266
63. Rhodes A, Sunderland R. Arterial Pulse Pressure Analysis: The
LiDCOplus System. Update in Intensive Care and Emergency Medicine
2004; 42
64. Lorsomradee S,
Uncalibrated
Lorsomradee S, Cromheecke S e De Hert SG.
arterial
pulse
contour
analysis
versus
continuous
thermodilution technique: effects of alterations in arterial waveform.
J Cardiothorac Vasc Anesth 2007; 21: 636-643
65. Manecke GR, Auger WR. Cardiac output determination from the arterial
101
pressure wave: clinical testing of a novel algorithm that does not require
calibrtaion. J Cardiothorac Vasc Anesth 2007; 21: 3-7
66. Brewkers RM, Sepehrkhouy S, Spiegelenberg SR, Groeneveld ABJ.
Cardiac output measured by a new arterial pressure waveform analysis
method without calibration compared with thermodilution after cardiac
surgery. J Cardiothorac Vasc Anesth 2007; 21: 632-635
67. Langewouters GJ, Wesseling KH, Gohedard WJ. The pressuredependent dynamic elasticity of 35 thoracic and 16 abdominal human
aortas in vitro described by a five-component model. J Biomech. 1985;
18: 613-620
68. Langewouters GJ, Wesseling KH, Gohedard WJ. The static elastic
properties of 45 human thoracic and 20 abdominal aortas in vitro and the
parameters of a new model. J Biomech. 1984; 17: 425-435
69. de Waal EEC, Kalkman CJ, Rex S, Buhre WF. Validation of a new
arterial pulse contour-based cardiac output device. Crit Care Med 2007;
35: 1904-1909
70. van Heerden PV, Baker S, Lim SI, et al. Clinical evaluation of the noninvasive cardiac output (NICO) monitor in the intensive care unit.
Anaesth Intensive Care 2000; 28: 427-430
71. Nilsson LB, Eldrup N, Berthelsen PG. Lack of agreement between
thermodiluition and carbon dioxide-rebreathing cardiac output. Acta
Anaesthesiol Scand 2001; 45: 680-685
72. Maxwell RA, Gibson JB, Slade JB, et al. Noninvasive cardiac output by
partial CO2 rebreathing after severe chest trauma. J Trauma 2001; 51:
849-853
73. Botero M, Kirby D, Lobato EB, et al. Measurement of cardiac output
before and after cardiopulmonary bypass: comparison among aortic
transit-time ultrasound, thermodiluition, and noninvasive partial CO2
rebreathing. J Cardiothorac Vasc Anesth 2004; 18: 563-572
102
74. Gedeon A, Forslund L, Hedenstierna G, Romano E. A new method for
noninvasive
bedside
determination
of
pulmonary
blood
flow.
Med Biol Eng Comput 1980; 18: 411-418
75. de Abreu MG, Geiger S, Winkler T, et al. Evaluation of a new device for
noninvasive measurement of nonshunted pulmonary capillary blood flow
in patients with acute lung injury. Intensive Care Med 2002; 28: 318-323
76. de Abreu MG, Winkler T, Pahlitzsch T, et al. Performance of the partial
CO2
rebreathing
technique
under
different
hemodynamic
and
ventilation/perfusion matching conditions. Crit Care Med 2003; 31:
543-551
77. Hüttemann E. Transoesophageal echocardiography in critical care.
Minerva Anestesiol 2006; 72: 891-913
78. Practice guidelines for perioperative transesophageal echocardiography.
A report by the American Society of Anesthesiologists and the Society of
Cardiovascular Anesthesiologists Task Force on Transesophageal
Echocardiography. Anesthesiology 1996; 84: 986-1006
79. Darmon PL, Hillel Z, Mogtader A, Mindich B, Thys D. Cardiac output by
transesophageal echocardiography using continuous-wave Doppler
across the aortic valve. Anesthesiology 1994; 80: 796-805
80. Perrino AC Jr, Harris SN, Luther MA. Intraoperative determination of
cardiac output using multiplane transesophageal echocardiography: a
comparison to thermodiluition. Anesthesiology 1998; 89: 350-357
81. Pinto FJ, Siegel LC, Chenzbraun A, Schnittger I. On-line estimation of
cardiac output with a new automated border detection system using
transesophageal echocardiography: a preliminary comparison with
thermodiluition. J Cardiothorac Vasc Anesth 1994; 8: 625-630
82. Thys DM, Hillel Z, Goldman ME, Mindich BP, Kaplan JA. A comparison
of hemodynamic indices derived by invasive monitoring and twodimensional echocardiography. Anesthesiology 1987; 67: 630-634
103
83. Greim CA, Roewer N, Laux G, Schulte am Esch J. On-line estimation of
left ventricular stroke volume using transoesophageal echocardiography
and acoustic quantification. Br J Anaesth 1996; 77: 365-369
84. Leung JM, Levine EH. Left ventricular end-dyastolic cavity obliteration as
an estimate of intraoperative hypovolemia. Anesthesiology 1994; 81:
1102-1109
85. Appleyard RF, Glantz SA. Two dimensions describe left ventricular
volume change during hemodynamic transients. Am J Physiol 1990;
258: H277-284
86. Skarvan K, Lambert A, Filipovic M, Seeberger M. Reference values for
left ventricular function in subjects under general anaesthesia and
controlled ventilation assessed by two dimensional transoesophageal
echocardiography. Eur J Anaesthesiol 2001; 18: 713-722
87. Kusumoto FM, Muhiudeen IA, Kuecherer HF, Cahalan MK, Schiller NB.
Response of the interatrial septum to transatrial pressure gradients and
its potential for predicting pulmonary capillary wedge pressure: an
intraoperative study using transesophageal echocardiography in patients
during mechanical ventilation. J Am Coll Cardiol 1993; 21: 721-728
88. Nishimura RA, Abel MD, Hatle LK, Tajik AJ. Relation of pulmonary vein
to mitral flow velocities by transesophageal Doppler echocardiography.
Effect of different loading conditions. Circulation 1990; 81: 1488-1497
89. Kircher BJ, Himelman RB, Schiller NB. Noninvasive estimation of right
atrial pressure from the inspiratory collapse of the inferior vena cava.
Am J Cardiol 1990; 66: 493-496
90. Lang RM, Borow KM, Neumann A, Janzen D. Systemic vascular
resistance: an unreliable index of left ventricular afterload. Circulation
1986; 74: 1114-1123
91. Murphy GS, Vender JS, Monitoraggio del paziente anestetizzato.
Anestesia clinica, V edizione. Antonio Delfino editore, Barash PG, Cullen
104
BF, Stoelting RK, 2007; Cap. 24: 755-777
92. Young JD, McQuillan P. Comparison of thoracic electrical bioimpedance
and thermodiluition for the measurement of cardiac index in patients
with severe sepsis. Br J Anaesth 1993; 70: 58
93. Haryadi DG, Westenskow DR, Critchley LAH, Schookin SI, et al.
Evaluation of a new advanced thoracic bioimpedence device for
estimation of cardiac output. J Clin Monit 1999; 15:131-138
94. Fortin J, Habenbacher W, Heller A, Hacker A, et al. Non-invasive beatto-beat cardiac output monitoring
by an
improved
method of
transthoracic bioimpedance measurement. Computers in biology and
medicine 2006; 36: 1185-1203
95. Wang X, Van De Water JM, Sun HH. Hemodynamic monitoring by
impedance cardiography with an improved signal processing technique.
Proc IEEE Eng Med Biol 1993; 15: 699-700
96. de Waal EEC, Konings MK, Kalkman MK e Buhre WF. Assessment of
stroke volume index with three different bioimpedance algorithms: lack
of agreement compared to thermodiluition. Int Care Med Pubblicato
on-line: 8 gennaio 2008
97. Daigle RE, Miller CW, Histand MB, et al. Nontraumatic aortic blood flow
sensing by use of an ultrasonic esophageal probe. J Appl Physiol 1975;
38: 1153-1160
98. Side CD, Gosling RG. Non-surgical assessment of cardiac function.
Nature 1971; 232: 335-336
99. Mark JB, Steinbrook RA, Gugino LD, et al. Continuous noninvasive
monitoring of cardiac output with esophageal Doppler ultrasound during
cardiac surgery. Anesth Analg 1986; 65: 1013-1020
100.Cholley BP, Singer M. Esophageal Doppler: Noninvasive Cardiac
Output Monitor. Echocardiography 2003; (20)8 : 763-769
101.Singer M, Clarke J, Bennet D. Continuous hemodynamic monitoring by
105
esophageal Doppler. Crit Care Med 1989; 17: 447-452
102.Singer M. Esophageal Doppler monitoring of aortic blood flow: beat-bybeat cardiac output monitoring. Int Anesth Clin 1993; 99-125
103.Sinclair S, Singer M. Perioperative haemodynamic monitoring and fluid
management-NCEPOD revisited. National
Confidential Enquiry into
Perioperative Deaths. Br J Hosp Med 1995; 53: 166-168
104.Singer M, Bennet ED. “Non invasive optimization of left ventricular filling
using esophageal Doppler. Crit Care Med 1991; 19: 1132-1137
105.Histand MB, Wells MK, Reeves JT, Sodal IE, Adamson HP, Wilson JT.
Ultrasonic pulsed Doppler transesophageal measurement of aortic
heamodynamics in humans. Ultrasonics 1979; 17: 215-218
106.Laupland KB, Bands CJ. Utility of esophageal Doppler as a minimally
invasive hemodynamic monitor: a review. Can J Anesth 2002; (49)4:
393-401
107.Lafanechère A, Albaladejo P, Raux M, Geeraerts T, et al. Cardiac
output measurement during infrarenal aortic surgery: echo-esophageal
Doppler versus thermodilution catheter. J Cardiothorac Vasc Anesth
2006; 20:26-30
108.Lefrant JY, Brulle P, Aya AGM, et al. Training is required to improve the
reliability of esophageal Doppler to measure cardiac output in critically ill
patients. Intensive Care Med 1998; 24: 347-352
109.Freund PR. Transesophageal Doppler scanning versus thermodiluition
during general anesthesia. An initial comparison of cardiac output
techniques. Am J Surg 1987; 153: 490-494
110.Cittadini G, Derchi LE. L’ecografia. Diagnostica per immagini e
radioterapia, IV edizione. ECIG editore, Cittadini G, 2002; Cap. 9:
103-122
111.Morgan TJ. Monitoraggio Emodinamico. “OH” Manuale di Terapia
Intensiva, V edizione. Elsevier editore, Bersten AD, Soni N, Milano,
106
2006; Cap. 10: 79-94
112.Huntsman LL, Stewart DK, Barness SR, et al. Noninvasive Doppler
determination of cardiac output in man: clinical validation. Circulation
1983; 67: 593-602
113.Farthing S, Peronneau P. Flow in the thoracic aorta. Cardiovasc Res
1979: 13: 607-620
114.Cariou A, Monchi M, Joly LM, et al. Noninvasive cardiac output
monitoring by aortic blood flow determination: evaluation of the Sometec
Dynemo-3000 system. Crit Care Med 1989; 17: 447-452
115.Perrino AC, Fleming J, LaMantia KR. Transesophageal Doppler cardiac
output monitoring: Performance during aortic reconstructive surgery.
Anesth Analg 1991; 73: 705-710
116.Monnet X, Chemla D, Osman D, Anguel N, et al. Measuring aortic
diameter improves accuracy of esophageal Doppler in assessing fluid
responsiveness. Crit Care Med 2007; 35: 477-482
117.Hoffman BB, Taylor P. Neurotrasmissione. Il sistema nervoso autonomo
e il sistema nervoso motorio somatico. Le basi farmacologiche della
terapia. 10a edizione, Mc Graw Hill. Hardman JG, Limbird LE, Goodman
Gilman A. Milano 2003; Cap. 6: 115-150
118.von Euler US. Synthesis, uptake and storage of catecholamines in
adrenergic nerves. The effects of drugs. Catecholamines. Handbuch
der Experimentellen Pharmakologie. Springer-Verlag. Blaschko H.,
Muscholl E. Berlin, 1972, Vol 33: 186-230
119.Bowersox SS, Singh T, Nadasdi L, Zukowska-Grojec Z. Cardiovascular
effect of omega-conopeptides in conscious rats: mechanisms of action.
J Cardiovasc Pharmacol 1992, 20: 756-764
120.Zigomond RE, Schwarzschild MA, Rittenhouse AR. Acute regulation of
tyrosine hydroxylase by nerve activity and by neurotransmitters via
phosphorylation. Annu Rev Neurosci, 1989 12: 415-461
107
121.Wevers RA, de Rijk-van Andel JF, Brautigam C, Geurtz B, et al. A
review of biochemical and molecular genetic aspects of tyrosine
hydroxylase deficiency including a novel mutation . J Inherit Metab Dis
1999, 22: 364-373
122.Iversen LL. Uptake processes for biogenic amines. Handbook of
Psychopharmacology. Plenum Press. Iversen LL, Iversen SD, Snyder
SH. New York, 1975, Vol. 3: 381-442
123.Bonisch H., Trendelenburg U. The mechanism of action of indirectly
acting
sympathomimetic
amines.
Catecholamines.
Handbook
of
Experimental Pharmacology. Springer-Verlag. Trendelenburg U, Weiner
N. Berlin, 1988; Vol 90: 247-277
124.Trendelenburg U. A kinetic analysis of the extraneuronal uptake and
metabilism of catecholamines. Rev Physiol Biochem Pharmacol, 1980,
87: 33-115
125.Cavallari P. Circoli distrettuali. Fisiologia e biofisica medica. Poletto
editore, Baldissera F, Milano, 1996; Cap. 50: 579-603
126.Brown BR Jr. Selective venoconstriction by dopamine in comparison
with isoproterenol and phenylephrine. Anesthesiology 1975, 43:570
127.Pearl RG, Maze M, Rosenthal MH. Pulmonary and systemic
hemodynamic effects of central venous and left atrial sympathomimetic
druf administration in the dog. J Cardiothorac Anesth 1987, 1: 29
128.Flacke WE, Flacke JW. Cholinergic and anticholinergic agents. Drug
Interaction in Anesthesia, Lea & Febiger. Smith NT, Corbascio AN.
Philadelphia, 1986; 160
129.Hullet B, Gibbs N, Weightman W, Thackray M, Newman M. A
comparison of cardioQ and thermodilution cardiac output during offpump coronary artery surgery. J. Cardiothorac. Anesth 2003, 17: 28-732
130.Kim KM, Kwok IS, Chang HM, Han TH. Comparison of cardiac outputs
of major burn patients undergoing extensive early escharectomy:
108
esophageal Doppler monitor versus thermodilution pulmonary artery
catheter. J Trauma 2004, 57: 1013-1017
131.Sharma J, Bhise M, Singh A, Mehta Y, Trahan N. Hemodynamic
measurements after cardiac surgery: transesophageal Doppler versus
pulmonary artery catheter. J Cardiothorac Anesth 2005, 19: 746-750
132.Lafanechère A, Albaladejo P, Raux M, Geeraerts T, et al. Cardiac
output measurement during infrarenal aortic surgery echo-eosphageal
Doppler versus thermodilution catheter. J Cardiothorac Anesth 2006, 20:
26-30
133.Hoffman BB. Catecolamine, simpaticomimetici e antagonisti dei
recettori adrenergici. Le basi farmacologiche della terapia. 10a edizione,
Mc Graw Hill. Hardman JG, Limbird LE, Goodman Gilman A. Milano
2003; Cap. 10: 205-258
134.DiCorte CJ, Latham P, Greilich PE, Cooley MV, Grayburn PA, Jessen
ME. Esophageal Doppler monitor determinations of cardiac output and
preload during cardiac operations. Ann Thorac Surg 2000; 69:
1782-1786
135.Bundgaard-Nielsen M, Ruhnau B, Secher NH, Kehlet H. Flow related
techniques
for
preoperative
goal-directed
fluid
optimization.
Br J Anaesth 2007; 98: 38-44
109