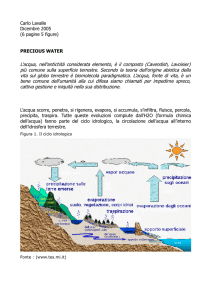
Fonte: Wikipedia, l’enciclopedia libera
Idrogeno
L'idrogeno (dal greco ὕδωρ, hýdor, «acqua»; la radice γεν-, ghen-, significa «generare»[2], quindi
«generatore d'acqua») è il primo elemento chimico della tavola periodica, è il più leggero, ha
numero atomico 1 e simbolo H. Il suo isotopo più comune, il prozio, consiste di un protone e di un
elettrone ed essendo il più semplice isotopo è stato studiato dalla meccanica quantistica in
maniera approfondita.[3]
L'idrogeno è l'elemento più abbondante dell'universo osservabile. È presente nell'acqua (11,19%)
e in tutti i composti organici e organismi viventi. Forma composti con la maggior parte degli
elementi, spesso anche per sintesi diretta.
A pressione atmosferica e a temperatura ambiente (298 K), l'idrogeno si trova sotto forma di un
gas biatomico avente formula H2. Tale gas è incolore, inodore, insapore ed altamente
infiammabile,[4][5] con un punto di ebollizione di soli 20,27 K e un punto di fusione di 14,02 K.
Le stelle sono principalmente composte di idrogeno nello stato di plasma di cui rappresenta il
combustibile delle reazioni termonucleari, mentre sulla Terra è scarsamente presente allo stato
libero e molecolare e deve quindi essere prodotto per i suoi vari usi. In particolare è usato nella
produzione di ammoniaca, nell'idrogenazione degli oli vegetali, in aeronautica (in passato nei
dirigibili), come combustibile alternativo e, di recente, come riserva di energia nelle pile a
combustibile.[6] Inoltre è occluso in alcune rocce, come il granito.
l’Idrogeno
1
H
idrogeno → elio
Aspetto
Linea spettrale
Generalità
Nome, simbolo, numero atomico
idrogeno, H, 1
Serie
non metalli
Gruppo, periodo, blocco
1 (IA), 1, s
Densità
0,0899 kg/m³
Configurazione elettronica
Proprietà atomiche
Peso atomico
1,00794
Raggio atomico (calc.)
53 pm
Raggio covalente
37 pm
Raggio di van der Waals
120 pm
Configurazione elettronica
1s1
e− per livello energetico
1
Stati di ossidazione
1 (anfotero)
Struttura cristallina
esagonale
Proprietà fisiche
Stato della materia
gassoso
Punto di fusione
14,025 K (−259,13 °C)
Punto di ebollizione
20,268 K, (−252,88 °C)
Punto critico
−241,14 °C a 1,293 MPa
Volume molare
11,42 × 10−3 m³/mol
Entalpia di vaporizzazione
0,44936 kJ/mol
Calore di fusione
0,05868 kJ/mol
Tensione di vapore
209 Pa a 23 K
Velocità del suono
1 270 m/s a 298,15 K
Altre proprietà
Numero CAS
1333-74-0
Elettronegatività
2,2 (Scala di Pauling)
Calore specifico
14 304 J/(kg·K)
Conducibilità termica
0,1815 W/(m·K)
Energia di prima ionizzazione
1312,06 kJ/mol
Isotopi più stabili
Per approfondire vedi la voce Isotopi dell'idrogeno.
iso
NA
TD
DM
DE
DP
1
H[1]
99,985%
È stabile con 0 neutroni
2
H
0,015%
È stabile con 1 neutrone
3
H
sintetico
12,33 anni
β−
0,019
3
He
4
H
sintetico
(1,39 ± 0,10) × 10−22 s
n
2,910
3
H
He + raggi
4
gamma
iso: isotopo
NA: abbondanza in natura
TD: tempo di dimezzamento
DM: modalità di decadimento
DE: energia di decadimento in MeV
DP: prodotto del decadimento
Cenni storici
L'idrogeno biatomico gassoso H2 fu descritto formalmente per la prima volta da Theophrastus Von
Hohenheim (conosciuto con il nome di Paracelso, 1493-1541), che lo ottenne artificialmente
mescolando metalli con acidi forti. Paracelso non si rese conto che il gas infiammabile ottenuto in
queste reazioni chimiche era costituito da un nuovo elemento chimico, chiamato in seguito
idrogeno.
Nel 1671, Robert Boyle riscoprì e descrisse la reazione che avveniva quando si mescolavano
limatura di ferro ed acidi diluiti, e che generava H2.
Apparato ideato da Cavendish per la produzione di diidrogeno in laboratorio (Philosophical
Transactions, 1766).
Nel 1766, Henry Cavendish fu il primo a riconoscere l'idrogeno molecolare gassoso H 2 come una
sostanza discreta, identificando il gas prodotto nella reazione metallo-acido come "aria
infiammabile" e scoprendo che la combustione del gas generava acqua. Cavendish utilizzava in
questi esperimenti acidi e mercurio e giunse erroneamente alla conclusione che il diidrogeno era
un componente liberato dal mercurio e non dall'acido, ma fu capace di descrivere con precisione
molte proprietà fondamentali dell'idrogeno e della sua molecola biatomica diidrogeno.
Tradizionalmente,
si
considera
Cavendish
come
lo
scopritore
dell'idrogeno.
Nel 1783, Antoine Lavoisier assegnò all'elemento il nome di idrogeno (in francese Hydrogène, in
greco ὕδωρ, ὕδᾰτος, "acqua" e γένος-ου, "generatore") quando provò (insieme a Laplace) la
scoperta di Cavendish che la combustione del diidrogeno generava acqua.
Primi utilizzi
Il diidrogeno è altamente infiammabile all'aria. Il disastro dell'Hindenburg, il 6 maggio del 1937, fu
dovuto anche a questa sua caratteristica.
Uno dei primi usi che si fece dell'idrogeno fu come gas di riempimento per aerostato e,
successivamente, per altri tipi di aeronavi. Famosa è la tragedia del dirigibile Hindenburg, anche se
gli ingegneri avevano rivestito la struttura dell'aeronave in modo da non causare scintille, dato che
si conosceva l'infiammabilità del gas. Quello fu un caso particolare di impiego, dato che non era
disponibile l'elio, gas quasi altrettanto leggero, ma inerte. Al tempo l'idrogeno molecolare si
otteneva per la reazione dell'acido solforico con il ferro metallico.
Isotopi
Il più comune isotopo dell'idrogeno (prozio) non ha neutroni, ne esistono però altri due: il deuterio,
con un neutrone, e il trizio (radioattivo), con due. I due isotopi stabili sono il prozio (1H) e il deuterio
(2H, D). L'idrogeno è l'unico elemento a cui si attribuiscono nomi differenti per alcuni dei suoi
isotopi.
Sono stati osservati anche gli isotopi 4H, 5H e 6H, ma sono tanto instabili che, al momento, non si è
neppure riusciti a stimare l'ordine di grandezza dei loro tempi di dimezzamento.
Gli isotopi dell'idrogeno più diffusi; da sinistra a destra: prozio, deuterio e trizio.
Diidrogeno
Idrogeno
Nome IUPAC
diidrogeno
Nomi alternativi
o-idrogeno
p-idrogeno
idrogeno molecolare
UN 1049
UN 1966
Caratteristiche generali
Formula bruta o
molecolare
H2
Massa molecolare
(u)
2,01588
Aspetto
gas incolore
Numero CAS
1333-74-0
Numero EINECS
215-605-7
Proprietà chimico-fisiche
Solubilità in acqua
1,96 mg/L
Punto critico
−239,96 °C a
1 315 kPa abs
Tensione di vapore
(Pa) a K
0,07
Proprietà termochimiche
C0p,m(J·K−1mol−1)
14.266
Indicazioni di sicurezza
Limiti di esplosione
4%-76%
Temperatura di
autoignizione
773,15844,15 (500571 °C)
Simboli di rischio chimico
pericolo
Frasi H
220 - 280
Consigli P
210 - 377 381 - 403 [7]
Il diidrogeno ha formula H2. La sua molecola è quindi costituita da due atomi di idrogeno. In
condizioni normali si presenta come un gas infiammabile, incolore ed inodore. Nell'uso comune
viene chiamato anch'esso semplicemente ed erroneamente idrogeno. Per non generare confusione
e fraintendimenti, le corrette nomenclature di H2 sono: idrogeno molecolare, idrogeno biatomico,
idrogeno diatomico e diidrogeno.
Si ottiene in laboratorio mediante reazione di acidi con metalli come lo zinco e, industrialmente,
mediante l'elettrolisi dell'acqua, il reforming del gas naturale, la gassificazione di residui della
raffinazione del petrolio. Il diidrogeno è impiegato per la produzione dell'ammoniaca, per la
desolforazione dei derivati del petrolio, come combustibile alternativo e, di recente, come fonte di
energia per le pile a combustibile.
Ortoidrogeno e paraidrogeno
Rappresentazione dell'ortoidrogeno (a sinistra) e del paraidrogeno (a destra).
In condizioni normali il diidrogeno è una miscela di due diversi tipi di molecole, che differiscono a
seconda che gli spin dei due nuclei atomici siano tra loro paralleli o antiparalleli. Queste due forme
sono rispettivamente conosciute come orto-idrogeno e para-idrogeno. In condizioni standard, il
rapporto tra orto e para è di circa 3 a 1 e la conversione di una forma nell'altra è talmente lenta da
non avvenire in assenza di un catalizzatore. Le due forme differiscono a livello energetico, il che
provoca piccole differenze nelle loro proprietà fisiche. Ad esempio, i punti di fusione ed ebollizione
del paraidrogeno sono all'incirca 0,1 K più bassi dell'ortoidrogeno.
L'esistenza di queste due forme pone un inconveniente nella produzione industriale di diidrogeno
liquido: quando viene liquefatto, il diidrogeno è generalmente una miscela para:orto circa 25:75;
lasciato a sé, nell'arco di un mese la miscela si arricchisce della forma para, che diventa il 90%;
questa conversione libera calore che fa evaporare gran parte del diidrogeno, che viene perso. Per
ovviare a ciò, la liquefazione del diidrogeno viene condotta in presenza di un catalizzatore a base di
ossido di ferro; in questo modo il diidrogeno liquido ottenuto è composto per oltre il 99% dalla
forma para.
Disponibilità
La regione R136 nella NGC 2070. Le dispersioni di colore rosso sono le molecole di idrogeno.
L'idrogeno è l'elemento più abbondante dell'universo, forma fino al 75% della materia, in base alla
massa, e più del 90%, in base al numero di atomi. Questo elemento si trova principalmente nelle
stelle e nei giganti gassosi. Relativamente alla sua abbondanza generale, l'idrogeno è molto raro
nell'atmosfera terrestre (1 ppm) e praticamente inesistente come H2 sulla superficie e nel
sottosuolo. Giove e Saturno sono composti da circa l'80 % di idrogeno, il Sole dal 90%.
Questo elemento gioca un ruolo vitale nel fornire energia all'universo, attraverso processi di
fusione nucleare. Enormi quantità di energia vengono rilasciate sotto forma di radiazioni
elettromagnetiche nel momento in cui avviene la combinazione di due nuclei di idrogeno (deuterio
oppure prozio e trizio) in uno di elio.
Sottoposte a pressioni eccezionalmente alte, come quelle che si trovano al centro dei giganti
gassosi (Giove ad esempio), le molecole perdono la loro identità e l'idrogeno diventa un metallo
liquido (idrogeno metallico). Al contrario, in condizioni di pressione estremamente bassa, le
molecole H2 possono subire dissociazione e se sottoposte a radiazione di opportuna frequenza, gli
atomi individuali possono sopravvivere per un tempo sufficiente per esser rilevati. Nubi di H2 si
formano e sono associate con la nascita delle stelle.
Sulla Terra solo l'1 % dei gas è idrogeno. La fonte più comune di questo elemento è l'acqua, che è
composta da due atomi di idrogeno e uno di ossigeno (H2O). Altre fonti sono: la maggior parte della
materia organica (che comprende tutte le forme di vita conosciute), i combustibili fossili e il gas
naturale. Il metano (CH4), che è un sottoprodotto della decomposizione organica, sta diventando
una fonte di idrogeno sempre più importante.
Produzione
L'H2 si ottiene in laboratori di chimica e di biologia, spesso come sottoprodotto di altre reazioni;
nell'industria si ottiene per deidrogenazione di substrati saturi; in natura è utilizzato come mezzo
per espellere equivalenti riduttivi nelle reazioni biochimiche.
Applicazioni
Impiego come reagente
Nell'industria chimica e petrolchimica si richiedono grandi quantità di H2. L'applicazione principale
dell'H2 avviene nel processo di raffinazione dei combustibili fossili e nella sintesi dell'ammoniaca
(processo Haber-Bosch). I processi fondamentali che consumano H2 in un impianto petrolchimico
sono l'idrodealchilazione, l'idrodesolforazione e l'idrocraking[8].
L'H2 è utilizzato anche come agente idrogenante, particolarmente per aumentare il grado di
saturazione dei grassi e degli oli insaturi (per ottenere prodotti come la margarina), e per la
produzione del metanolo. Viene utilizzato anche nella sintesi dell'acido cloridrico e per realizzare
l'idrogenolisi.
Composti dell'idrogeno
L'idrogeno si combina con la maggior parte degli elementi. Con un'elettronegatività pari a 2,1,
forma composti dove può essere la componente più non-metallica o più metallica. I primi vengono
chiamati idruri, nei quali l'idrogeno esiste o come ione H− o insinuandosi nel reticolo cristallino dei
metalli dando luogo a quelli che vengono chiamati idruri interstiziali (come nell'idruro di palladio).
Nel secondo caso l'idrogeno tende a essere covalente, in quanto lo ione H + non è altro che un
semplice nucleo e ha una forte tendenza ad attirare elettroni.
Il diidrogeno H2 si combina con il diossigeno O2 formando acqua (H2O) liberando molta energia in
questo processo (si ha un calore di reazione pari a circa 572,4 kJ).[4] L'ossido di deuterio è meglio
noto come acqua pesante. L'idrogeno forma un vasto numero di composti con il carbonio. A causa
della loro associazione con gli esseri viventi, questi composti sono chiamati "organici", e gli studi
relativi alle loro proprietà formano la chimica organica.
L'idrogeno come vettore energetico
Dall'immagine si nota la differenza tra la fiamma del diidrogeno premescolato al diossigeno in
rapporto stechiometrico (gas di brown, quasi invisibile nei motori della navetta) e la fiamma dovuta
alla combustione di perclorato d'ammonio e nanoparticelle d'alluminio (boosters laterali).
Prototipo di veicolo alimentato ad idrogeno.
Si parla molto dell'idrogeno come possibile fonte di energia per l'autotrazione. L'uso del H 2 avrebbe
il vantaggio di utilizzare le fonti fossili per ottenere direttamente il gas (a partire dal metano, per
esempio). L'H2 usato poi come combustibile nei mezzi di trasporto, reagendo con O2, produrrebbe
come unico prodotto di scarto l'acqua, eliminando completamente le emissioni di CO2 ed i problemi
climatico-ambientali ad esse associate.
Utilizzare il diidrogeno come combustibile presenta diversi vantaggi. Brucia all'aria quando la sua
concentrazione è compresa tra il 4 ed il 75% del suo volume, mentre il gas naturale brucia a
concentrazioni comprese tra il 5,4 ed il 15%. La temperatura di combustione spontanea è di 585 °C,
mentre quella del gas naturale è di 540 °C. Il gas naturale esplode a concentrazioni comprese tra il
6,3 ed il 14%, mentre il diidrogeno richiede concentrazioni dal 13 al 64%. L'unico svantaggio
sarebbe nella densità di energia del diidrogeno liquido o gassoso (a pressione utilizzabile) che è
significativamente inferiore rispetto ai tradizionali combustibili e quindi necessita di essere
compresso a pressioni più elevate in fase di stoccaggio.
Stante l'attuale sviluppo tecnologico, l'idrogeno può essere effettivamente utilizzato a fini
energetici come combustibile nei motori a combustione interna utilizzati su alcuni prototipi di auto.
Le pile a combustibile, attualmente in via di sviluppo, sono poi un modo alternativo per ottenere
energia sotto forma di elettricità dall'ossidazione dell'idrogeno senza passare dalla combustione
diretta ottenendo una maggiore efficienza in un futuro in cui la produzione di idrogeno potrebbe
avvenire da fonti rinnovabili e non più combustibili fossili. Secondo i sostenitori della cosiddetta
economia all'idrogeno queste due tecnologie ad idrogeno, oltre a risolvere il problema energetico,
sarebbero quindi anche in grado di offrire un'alternativa pulita agli attuali motori a combustione
interna alimentati da fonti fossili.
Il problema vero, sollevato da più parti, è però a monte: l'idrogeno atomico e molecolare è assai
scarso in natura ovvero l'elemento in sé si trova combinato assieme ad altri elementi in vari
composti sulla crosta terrestre; esso dunque non è una fonte primaria di energia come lo sono gas
naturale, petrolio e carbone, in quanto deve essere prodotto artificialmente spendendo energia a
partire da fonti energetiche primarie. Esso sarebbe quindi impiegabile unicamente come vettore
energetico cioè come mezzo per immagazzinare e trasportare l'energia disponibile ove occorra,
mentre il ciclo di produzione/utilizzo sarebbe comunque inefficiente dal punto di vista
termodinamico poiché la sua produzione richiederebbe in genere un'energia maggiore di quella che
poi si renderebbe disponibile attraverso la sua 'combustione'. La molecola d'acqua è infatti più
stabile e quindi meno energetica del diossigeno O2 e del diidrogeno H2 separati e segue la legge
secondo la quale i processi "naturali" portano un sistema da un'energia più alta ad una più bassa
tramite una trasformazione. Per le leggi della termodinamica l'estrazione di idrogeno dall'acqua
non può avvenire dunque come reazione inversa a costo zero, cioè senza spendere lavoro. Qualsiasi
metodo di estrazione comporta quindi un costo che è pari all'energia liberata successivamente
dalla combustione dell'idrogeno sotto forma di diidrogeno se a tal fine si utilizza l'esatto processo
inverso, ed in realtà in tal caso anche maggiore perché non esiste alcuna macchina con rendimento
pari al 100% durante il processo di estrazione. In altri termini la produzione di idrogeno sotto forma
di diidrogeno attraverso il metodo più semplice, ovvero l'elettrolisi dell'acqua, e il successivo
utilizzo dell'idrogeno sotto forma di diidrogeno nella reazione inversa con O 2 nelle pile a
combustibile non solo non porta ad alcun guadagno energetico, ma anzi, per quanto detto sopra, il
guadagno netto energetico sarebbe negativo cioè ci sarebbe una perdita dovuta alle dissipazioni in
calore. L'unico modo di usare in maniera efficiente l'idrogeno come fonte di energia sarebbe
ottenerlo come bioidrogeno a spese di alghe e batteri.
Attualmente il diidrogeno ottenuto da fonti solari, biologiche o elettriche ha un costo di
produzione, in termini energetici, molto più elevato di quello della sua combustione per ottenere
energia. H2 può essere ottenuto con un guadagno netto di energia a partire da fonti fossili, come il
metano (le reazioni di sintesi sono infatti diverse da quelle di combustione), però si tratta di fonti
energetiche non rinnovabili cioè destinate comunque ad esaurirsi nel tempo ed in più con emissioni
dirette di CO2.
Infine i costi per la realizzazione delle infrastrutture necessarie per effettuare una completa
conversione ad un'economia dell'idrogeno sarebbero sostanzialmente elevati [9].
Un altro modo in cui l'idrogeno potrebbe venire utilizzato efficacemente come fonte di energia, a
prescindere da qualunque processo di produzione, è quello della fusione nucleare ovvero in un
impianto termonucleare con un ipotetico reattore nucleare a fusione alimentato da deuterio o
trizio, una tecnologia che attualmente è ancora in via di sviluppo nel reattore sperimentale ITER e
che potenzialmente potrebbe risolvere i problemi energetici mondiali poiché in tale reazione
nucleare piccole quantità di idrogeno producono enormi quantità di energia: l'energia del Sole
proviene infatti dalla fusione nucleare dell'idrogeno; si tratta tuttavia di un processo
tecnologicamente complicato da gestire sulla Terra e tuttora oggetto di intensa ricerca.
Attualmente, ricapitolando, esistono quattro forme di utilizzazione dell'idrogeno per la produzione
di energia:
Combinando chimicamente H2 con O2 dell'aria attraverso bruciatori convenzionali e con processi
catalitici, come avviene nei motori a combustione interna, permettendo anche un'ampia
applicazione nell'ambito domestico.
Combinando elettrochimicamente H2 con O2 senza la generazione di fiamme per produrre
direttamente elettricità in un reattore conosciuto con il nome di cella (o pila) a combustibile.
Unendo i nuclei di idrogeno in un reattore denominato Tokamak, durante il processo conosciuto
con il nome di fusione nucleare.
Combinando chimicamente H2 con O2 in un mezzo acquoso in una caldaia non convenzionale per
produrre vapore motrice, nel ciclo conosciuto come Chan K'iin.[10]
Altri problemi rilevanti che si hanno con H 2 sono il suo stoccaggio ed il trasporto. Il trasporto può
avvenire in bombole di gas compresso, liquefatto oppure attraverso reti dedicate come avviene
attualmente per il metano. Si può avere stoccaggio sotto pressione in bombole da 200 bar fino a
700 bar (ancora in via di omologazione) in forma liquida richiede invece temperature di −253 °C in
bombole perfettamente isolate. Un'altra forma di stoccaggio consiste nella reazione chimica
reversibile con diverse sostanze formando idruri metallici, oppure allo stato liquido sotto forma di
ammoniaca NH3 alla temperatura di −33,4 °C.
Altri impieghi
Sonda meteorologica riempita con diidrogeno.
Nelle saldature e come agente riducente dei minerali metallici.
Nella propulsione aeronautica e spaziale come combustibile per razzi e vettori spaziali (allo stato
liquido).
Come refrigerante nei generatori delle centrali elettriche, visto che è il gas che ha la maggiore
conduttività termica.
L'idrogeno liquido è usato nella ricerca criogenica, che comprende gli studi sulla superconduttività.
La temperatura di equilibrio del punto triplo dell'idrogeno è un punto fisso definito nella scala delle
temperature ITS-90.
Lo spin della molecola di idrogeno può essere allineato omogeneamente mediante onde di
radiofrequenza. Questa proprietà è la base per la risonanza magnetica nucleare, attraverso un
dispositivo radiografico in grado di ottenere immagini e di raccogliere informazioni in funzione della
differente velocità di recupero dello spin originale delle molecole di idrogeno (presenti nell'acqua)
nei tessuti di un essere vivente.
Il deuterio è usato nelle applicazioni nucleari come moderatore per rallentare i neutroni; i composti
di deuterio sono usati in chimica e biologia, soprattutto nelle ricerche nel campo degli effetti
isotopici.
Il trizio (3H) viene prodotto nei reattori nucleari ed è impiegato nella produzione delle bombe a
idrogeno, come radiomarcatore nelle scienze biologiche e in cinetica chimica, e come fonte di
radiazioni nelle vernici luminescenti.
Una conseguenza di solito negativa, ma a volte desiderata, dell'idrogeno è la sua azione
infragilizzante sui metalli. Esso, a causa delle sue dimensioni atomiche ridotte, si fissa sugli atomi di
ferro all'interno degli spazi interstiziali del reticolo molecolare e contribuisce a ridurre di molto il
valore di γs (energia di creazione di un'interfaccia), favorendo la rottura di un pezzo per fatica
statica.
Essendo quasi quindici volte più leggero dell'aria, venne impiegato come agente per sollevare
palloni aerostatici e dirigibili. Dopo il disastro del 6 maggio 1937 del dirigibile LZ 129 Hindenburg
(riempito di idrogeno), che provocò la morte di 35 passeggeri, l'opinione pubblica si convinse che il
gas fosse troppo pericoloso per continuare a usarlo in questo campo. Si preferisce utilizzare elio per
il riempimento dei dirigibili (anche se è più pesante dell'idrogeno e quindi fornisce una minore
spinta ascensionale), in quanto, a differenza dell'idrogeno, l'elio è un gas inerte e quindi non brucia.
L'idrogeno viene comunque ancora usato nei palloni aerostatici e nelle sonde meteorologiche.
Nel 1930 a Verrès in Valle d'Aosta, con l'energia prodotta in eccesso dall'impianto della Società
Castel Verrès si realizzò un reparto elettrochimico utilizzando dei convertitori rotanti ed una griglia
in platino molto resistente alla corrosione, da questo procedimento con la tecnica dell'elettrolisi si
otteneva l'idrogeno in uno stato di purezza elevatissima il quale veniva convogliato in un
idrogenodotto, attraversava l'intero paese e veniva quindi portato allo stabilimento La Chimica di
Verrès, una delle particolarità dell'impianto era proprio l'idrogenodotto, il primo in Italia a
trasportare l'idrogeno con una tubazione sotterranea, la produzione era elevatissima 42 000 m³ al
giorno, questa avveniristica operazione permetteva la realizzazione di concimi speciali, sorpassando
in alcuni anni la produzione della Montecatini. Tutte queste aziende facevano parte del grande
gruppo industriale con sede a Milano Costruzioni Brambilla, a capo del gruppo vi era l'illustre
architetto Cav Enrico Brambilla.[11][12]
Le caratteristiche di solubilità e adsorbimento dell'idrogeno con vari metalli sono molto importanti
nella metallurgia (alcuni metalli possono essere indeboliti dall'idrogeno) e nello sviluppo di forme
sicure di immagazzinamento per un utilizzo come combustibile. L'idrogeno è altamente solubile in
molti composti formati da lantanoidi e metalli del blocco d[13], e può sciogliersi nei metalli cristallini
ed in quelli amorfi[14]. La solubilità dell'idrogeno nei metalli è influenzata dalle distorsioni locali e
dalle impurezze del reticolo cristallino del metallo.[15].
Precauzioni
Combustione
Il diidrogeno è un gas altamente infiammabile e brucia in aria, con la quale forma miscele esplosive
a concentrazioni dal 4 al 74,5% (parti di diidrogeno su 100 parti d'aria, a pressione atmosferica) e in
atmosfera di cloro dal 5 al 95%. Reagisce inoltre violentemente con il cloro e il fluoro. Basta liberare
una fuga di H2 a contatto con O2 per innescare una violenta esplosione oppure una fiamma
invisibile e pericolosa che produce acqua in gas.
Le miscele di diidrogeno detonano molto facilmente a seguito di semplici scintille o, se in alta
concentrazione di reagenti, anche solo per mezzo della luce solare in quanto il gas reagisce
violentemente
e
spontaneamente
con
qualsiasi
sostanza
La temperatura di autoignizione del diidrogeno in aria (21% di O2) è di 500 °C circa.
ossidante.
L'entalpia della combustione del diidrogeno è –286 kJ/mol e la reazione di combustione in aria è la
seguente:
2 H2(g) + O2(g) → 2 H2O(l) + 572 kJ/mol
Quando si mescola con il diossigeno in un ampio intervallo di proporzioni, il diidrogeno esplode.
All'aria il diidrogeno arde violentemente. Le fiamme di diossigeno e diidrogeno puro sono invisibili
all'occhio umano; per questo motivo, è difficile identificare visivamente se una fuga di diidrogeno
sta bruciando. Le fiamme visibili nella fotografia dell'incidente al dirigibile Hindenburg sono dovute
alla combustione del diidrogeno insieme ai materiali di rivestimento dell'aeronave, che
contenevano carbonio e polveri piroforiche di alluminio, così come altri materiali infiammabili[16].
Indipendentemente dalle cause di questo incendio, è chiaro che si produsse l'innesco del
diidrogeno, dal momento che in assenza di questo gas il rivestimento di copertura del dirigibile
avrebbe impiegato delle ore a bruciare[17]. Altra caratteristica dei fuochi alimentati dal diidrogeno è
che le fiamme tendono a salire rapidamente con il gas attraverso l'aria (come si può vedere nella
fotografia dell'incidente all'Hindeburg), causando danni minori dei fuochi alimentati da idrocarburi.
Infatti i due terzi dei passeggeri del dirigibile sopravvissero all'incendio, e molti morirono per la
caduta dall'alto o per l'incendio della benzina[18].
L'H2 reagisce direttamente con altri elementi ossidanti. Può produrre una reazione spontanea e
violenta a temperatura ambiente in presenza di cloro o fluoro, con la formazione dei corrispondenti
alogenuri di idrogeno: cloruro di idrogeno e fluoruro di idrogeno.
Tossicità dell'acqua pesante
L'acqua pesante (o ossido di deuterio) D2O è tossica per molte specie. La quantità necessaria a
uccidere un uomo comunque è notevole.
Fonte: Wikipedia, l’enciclopedia libera