N. 3/2014
REPORT
CORSO CRS
Direttore del corso
Prof. Domenico Cuda
MILANO
23-24 ottobre 2014
APPARECCHI ACUSTICI
E DISPOSITIVI IMPIANTABILI:
INDICAZIONI E FLOW CHARTS
REPORT C
APPARECCHI ACUSTICI E DISPOSITIVI IMPIANTABILI:
INDICAZIONI E FLOW CHARTS
MILANO, 23-24 ottobre 2014
NOTA DELL’EDITORE
Il presente volume riprende i principali contenuti di questo evento formativo, con l’obiettivo di renderli disponibili a un pubblico più ampio e
di offrire informazioni e indicazioni condivise per un miglioramento della pratica clinica.
In particolare, i testi che seguono sono una rielaborazione originale, a cura della redazione di Sintesi InfoMedica, delle relazioni presentate
durante l’evento da A. De Caria (apparecchi acustici, acufeni), P. Mochi (dispositivi semi-impiantabili, sordità post-flogistiche), R. Albera
(dispositivo Soundbridge, ipoacusia otosclerotica), S. Berrettini (dispositivo Carina, sordità grave nell’adulto), M. Barbara (dispositivo Envoy
Esteem, presbiacusia), A. Murri (impianti cocleari, sordità infantili lievi, sordità asimmetriche), S. Burdo (sordità infantili gravi), D. Cuda (sordità
ski slope), N. Tinelli (sordità monolaterali, sordità improvvisa), R. Tyler (acufene monolaterale, iperacusia) e della tavola rotonda conclusiva. I
testi, rivisti dai rispettivi relatori, sono stati riassunti e integrati con le opinioni emerse dalle discussioni tenutesi nel corso dei lavori.
INDICE
Presentazione del corso
3
DISPOSITIVI DI BASE
Apparecchi acustici 3
Dispositivi semi-impiantabili per via ossea 4
Il dispositivo Vibrant Soundbridge 5
Il dispositivo totalmente impiantabile Carina 6
Il dispositivo totalmente impiantabile Envoy Esteem 7
Quest’opera è protetta dalla legge sul diritto d’autore. Tutti i diritti,
in particolare quelli relativi alla traduzione, alla ristampa, all’utilizzo
di illustrazioni e tabelle, alla registrazione su microfilm o in database,
o alla riproduzione in qualsiasi altra forma (stampata o elettronica)
rimangono riservati anche nel caso di utilizzo parziale. La riproduzione di quest’opera, anche se parziale, è ammessa solo ed esclusivamente nei limiti stabiliti dalla legge sul diritto d’autore ed è soggetta
all’autorizzazione dell’editore. La violazione delle norme comporta le
sanzioni previste dalla legge.
Impianti cocleari 8
© Sintesi InfoMedica S.r.l.
Sebbene le informazioni contenute nella presente opera siano state
accuratamente vagliate al momento della stampa, l’editore non può
garantire l’esattezza delle indicazioni sui dosaggi e sull’impiego dei
prodotti menzionati e non si assume pertanto alcuna responsabilità
sui dati riportati, che dovranno essere verificati dal lettore consultando la bibliografia di pertinenza.
Copyright © 2014 by Sintesi InfoMedica S.r.l.
Via Ripamonti, 89 - 20141 Milano (MI)
Tel. +39 02 56665.1 - Fax +39 02 97374301
INDICAZIONI E FLOW CHART
Flow chart nella gestione dell’ipoacusia otosclerotica 9
Flow chart nella gestione della presbiacusia 10
Flow chart nella gestione delle sordità gravi dell’adulto 11
Flow chart nella gestione delle sordità infantili gravi 12
Flow chart nella gestione delle sordità infantili lievi 13
Flow chart nella gestione delle sordità ski slope 15
Flow chart nella gestione delle sordità monolaterali 16
Flow chart nella gestione delle sordità asimmetriche 17
Flow chart nella gestione degli acufeni 18
Flow chart nella gestione dell’acufene monolaterale 19
Flow chart nella gestione dell’iperacusia 21
Flow chart nella gestione degli esiti di sordità improvvisa 22
Realizzato con il contributo incondizionato di
2
Flow chart nella gestione delle sordità post-flogistiche
23
T CORSO CRS
PRESENTAZIONE DEL CORSO
A cura del direttore, Domenico Cuda
U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto - Piacenza
La tecnologia su cui si basano gli apparecchi acustici e i dispositivi impiantabili è in continua e rapida evoluzione: è
essenziale, dunque, rimanere costantemente aggiornati. Oltre a riesaminare i dispositivi di base, questo corso approfondisce il tema delle indicazioni terapeutiche, attraverso l’impiego delle flow charts. I relatori hanno analizzato i
diagrammi di flusso in base alla competenza personale, ma soprattutto in base all’evidenza scientifica, per consentire
di orientarsi tra le diverse opportunità disponibili e garantire al paziente la soluzione più appropriata al suo caso.
APPARECCHI ACUSTICI
Antonio De Caria
Centro per lo Studio e la Cura degli Acufeni U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto
Piacenza
Nel tempo, gli apparecchi acustici hanno acquisito una regolazione sempre più fine, un migliore settaggio, la possibilità di escludere alcune bande di frequenza e la capacità
di interfacciarsi via wireless con numerosi dispositivi (televisione, telefoni cellulari ecc.), adattandosi sempre meglio
alle reali necessità comunicative dell’utente. Uno dei progressi più significativi è rappresentato dalla tecnologia open,
che ha consentito di superare i problemi correlati all’utilizzo
della chiocciola. L’esclusione del ricevitore dall’apparecchio
ha permesso anche di ridurne ulteriormente le dimensioni.
Il nucleo degli apparecchi moderni è il processore digitale,
che presiede a tutte le fasi di elaborazione del segnale in
uscita. È costituito da canali indipendenti, in cui il segnale
elettrico viene frammentato ed elaborato. Utilizzando dei filtri
passa-banda, insieme a un sistema di compressione e a un
amplificatore, è possibile scomporre il segnale in bande di
frequenza prestabilite, evitando quelle fastidiose per il paziente.
I nuovi apparecchi acustici hanno la possibilità di connettersi
via wireless a 2.4 GHz con diverse apparecchiature. La tecnologia wireless fornisce un’ottima qualità di suono, a costi
decisamente inferiori rispetto alla modulazione di frequenza
(FM). Inoltre, la tecnologia a 2,4 GHz consente di avere un
miglior rapporto segnale/rumore (S/R), oltre a un’eccellente
qualità audio, con un segnale senza ritardi. Ulteriore miglioramento nella comprensione della voce parlata si è avuto
con la compressione del campo dinamico (EDRC) e la trasposizione frequenziale. La trasposizione frequenziale consiste nello spostare le frequenze da quelle non udibili a quelle udibili e permette, in caso di perdite uditive importanti sulle
alte frequenze, un migliore riconoscimento delle consonanti
fricative. L’introduzione del doppio ricevitore, che gestisce
separatamente le alte e le basse frequenze, ha ulteriormente
migliorato la capacità uditiva.
Il vento, i sussurri, la distanza e la posizione di chi parla, il
rumore e il riverbero sono i principali fattori che disturbano
l’intelligibilità del parlato. La comunicazione tra apparecchi e
l’inserimento di più microfoni ha permesso di superare queste problematiche, migliorando notevolmente la comprensione della voce parlata in ambienti rumorosi. Per esempio
per superare il disturbo causato dal vento sull’ascolto della
voce, è nata una tecnologia che è in grado di identificare il
lato con la maggiore intensità di vento, enfatizzando l’attività
dell’apparecchio collocato sul lato meno disturbato. L’auto
StereoZoom e l’auto ZoomControl, invece, aiutano a comprendere la voce di un interlocutore in diverse situazioni ru-
3
REPORT C
morose, focalizzandosi sulla sorgente sonora che interessa.
Per superare il disagio estetico, è stato realizzato un apparecchio completamente invisibile, di soli 12 mm, wireless
e programmabile digitalmente: inserito nel condotto uditivo esterno, vi rimane per 3-4 mesi, garantendo un’ottima
qualità sonora. Non richiede manutenzione, impermeabile
all’acqua, si utilizza anche di notte, sotto la doccia o durante
qualsiasi attività sportiva (Figura 1).
Le nuove applicazioni per smartphone consentono di regolare varie funzioni dell’apparecchio acustico tramite il telefonino che addirittura può cercarli in caso di smarrimento. La
novità più recente è rappresentata, però, da una nuova tecnologia (e2e wireless 3.0), che permette di superare diversi
problemi (rimbombo, voci nel rumore ecc.) grazie a quattro
diffusori, due per ogni apparecchio, che interagiscono tra
loro, costituendo una rete di otto microfoni virtuali.
Figura 1. Apparecchio acustico invisibile
DISPOSITIVI SEMI-IMPIANTABILI PER VIA OSSEA
Paolo Mochi
U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto - Piacenza
Con l’avvento dei primi dispositivi acustici ancorabili all’osso temporale, la protesizzazione è diventata indipendente
dalla soglia uditiva per via aerea. Questo tipo di protesi è
indicato per ipoacusie trasmissive imputabili a diverse cause
(otite cronica suppurativa, esiti sfavorevoli d’interventi chirurgici dell’orecchio medio, otosclerosi, otite cronica esterna
stenosante, atresia auris congenita), generalmente non gestibili con apparecchi acustici tradizionali. Più recentemente
l’indicazione è stata estesa anche alla sordità monolaterale
(Single Sided Deafness, SSD), legata alla comparsa di un’ipoacusia improvvisa, agli esiti dell’asportazione di un neurinoma dell’acustico, alla sindrome di Ménière, a traumi, o a
una forma di sordità congenita.1
Costituite da una componente esterna (microfono, processore, pile) e da una parte interna, queste protesi possono
essere connesse per via percutanea o transcutanea. Nella
via percutanea si attraversa la cute per unire il processore
con il sistema di fissaggio alla squama dell’osso temporale. I dispositivi di tipo percutaneo attualmente in uso sono il
BAHA (Cochlear) e il Ponto (Oticon), mentre il BAHA Attract,
il Sophono e il Bonebridge sono gli impianti transcutanei disponibili.
Le protesi percutanee sono costituite da una vite, posizionata chirurgicamente nell’osso temporale, da un pilastro, che
attraversa la cute e si fissa alla vite, permettendo l’applicazione del processore esterno.
Il suono viene trasformato dal processore in vibrazione. Questa viene trasferita, tramite il pilastro, alla vite e all’osso temporale. Nei casi d’ipoacusia trasmissiva, questi apparecchi
4
sono indicati in presenza di un PTA osseo <45 dB o <60 dB
a seconda dei processori (soglia media a 0,5, 1, 2, 3 kHz), e
di un riconoscimento vocale superiore al 60%. Le indicazioni
nei casi di SSD prevedono, invece, nell’orecchio leso un PTA
osseo >90 dB e un riconoscimento vocale inferiore al 20%,
e nell’orecchio sano un PTA osseo <20 dB.
Col tempo le tecniche chirurgiche si sono evolute, diventando più semplici, meno invasive e con minori complicanze post-operatorie. L’intervento viene eseguito in anestesia
locale nell’adulto, e in anestesia generale nel bambino o nel
paziente non collaborante. In alcuni casi la vite e il pilastro
vengono installati in un unico intervento, in altri si applica
il pilastro anche dopo sei mesi dall’applicazione della vite.
Per una corretta inserzione della vite è importante che lo
spessore osseo sia adeguato. Lo spessore osseo è generalmente misurato al momento dell’applicazione della vite,
o, in alternativa, con una TC pre-operatoria, particolarmente
utile nei bambini.
Le complicanze osservate più frequentemente sono le reazioni cutanee al sito di applicazione dell’impianto. Importanti, poi, sono i tempi di osteointegrazione, cui sono correlati i
tempi di applicazione del processore: generalmente oggi si
ritengono necessarie sei settimane.2
Nei dispositivi transcutanei la vite è applicata chirurgicamente insieme a un magnete. I due componenti rimangono sotto
la cute integra, mentre sopra di loro si applica il processore collegato a un magnete esterno. La vibrazione generata
dal processore è trasmessa al magnete sottocutaneo, che,
tramite la vite, la trasmette al cranio. Questo tipo di protesi
T CORSO CRS
è indicato per i pazienti con ipoacusia trasmissiva con PTA
osseo <35 dB, fino a un massimo di 45 dB. Parzialmente
diverso è il Bonebridge, che trasforma il suono in impulso
elettromagnetico, trasmesso attraverso la cute integra a
un’antenna sottocutanea. Da qui l’impulso passa a un processore, che lo elabora e lo invia a un trasduttore a massa
flottante che, collegato all’osso, trasmette a quest’ultimo la
vibrazione. Quest’apparecchio è indicato nei casi d’ipoacusia trasmissiva con PTA osseo pari o inferiore a 45 dB.
Un limite di questa protesi sono le dimensioni della massa
flottante (diametro: 15,8 mm; spessore: 8,7 mm), poiché il
punto di applicazione ideale è nell’angolo seno-durale o, in
alternativa, nella regione retrosigmoidea. Per questo, prima
dell’applicazione, è opportuno eseguire una TC e una simulazione dell’applicazione.
Bibliografia
1) Wazen JJ, et al.Trascranial contralateral cochlear stimulation in unilateral deafness. Otolaryngol Head Neck Surg 2003; 129: 248-54
2) Wazen JJ, et al. Osseointegration timing for BAHA system loading.
Laryngoscope 2007; 117: 794-6
IL DISPOSITIVO VIBRANT SOUNDBRIDGE
Roberto Albera
Dipartimento di Scienze Chirurgiche, Università degli Studi di Torino
Il Vibrant Soundbridge è un dispositivo semi-impiantabile
che applica la vibrazione direttamente alla catena ossiculare.
La porzione esterna del dispositivo comprende due microfoni, un microprocessore, un vano per la batteria, un magnete,
per far aderire il dispositivo alla porzione interna, e un’antenna che trasferisce il segnale elettrico alla parte interna per
induzione elettromagnetica. La porzione interna del device
è costituita da un contromagnete, da un’antenna che riceve
il segnale trasdotto dall’esterno, un sistema d’invio per trasferire il segnale al cuore del dispositivo, ovvero il trasduttore
a massa flottante (FMT), analogo a quello del Bonebridge,
ma di dimensioni più ridotte per essere inserito nella cavità
dell’orecchio medio (Figura 1).
Cavo d’oro
ricoperto di silicone
Magnete
Demodulatore
Antenna ricevente
FMT - Floating Mass Transducer
Figura 1. Vibrant Soundbridge: Parte interna e trasduttore a massa
flottante (FMT)
Nell’FMT i segnali elettrici generano un campo magnetico,
che mette in movimento il magnete all’interno del cilindro.
In base alla frequenza e all’intensità della vibrazione, l’FMT
riproduce i segnali acustici: s’incrementa, così, la vibrazione fisiologica del sistema di trasmissione del suono. Sperimentando l’applicazione di questo dispositivo alle finestre
è nato il concetto di vibroplastica, ovvero l’applicazione di
un trasduttore vibrante all’orecchio medio, per amplificare la
stimolazione dell’orecchio interno. La vibroplastica si definisce di tipo C, se la massa flottante è ancorata alla catena:
questo tipo è indicato per l’ipoacusia neurosensoriale, nei
pazienti non idonei agli apparecchi convenzionali. La vibroplastica è di tipo O se l’FMT è appoggiato sulla finestra ovale: ancorato alla staffa o appoggiato alla platina, simula la
normale trasmissione dell’onda acustica, dall’orecchio medio all’interno. Infine, nel tipo R, l’FMT è appoggiato sulla
finestra rotonda.
Il Vibrant è particolarmente indicato nelle condizioni di compromesso funzionamento della via ossea: il criterio di scelta
tra questo device e una protesi a conduzione ossea, dovrebbe essere la soglia per via ossea. L’applicazione di un
tipo C è indicata per i pazienti con ipoacusia neurosensoriale, con un riconoscimento verbale superiore al 50% e un’impedenzometria nella norma. I tipi O e R sono maggiormente
indicati per le ipoacusie miste, determinate da insuccessi
funzionali di diversi interventi chirurgici. La vibroplastica di
tipo R produce un buon guadagno funzionale (circa 40 dB
alle frequenze medie), ma la piccola dimensione dell’FMT
riduce il guadagno alle frequenze più basse. Si osserva, inoltre, un netto miglioramento della soglia di riconoscimento.1
L’utilizzo di questo dispositivo non è esente da complicanze
(infezioni, dislocazione dell’FMT, sordità improvvisa), ma la
loro incidenza è in graduale diminuzione. L’applicazione del
tipo O ricostruisce un sistema normale, ma, dato l’appoggio
5
REPORT C
sulla platina, può provocare una sensazione di minore stabilità dell’FMT. Per risolvere questo problema si sono proposti diversi sistemi di accoppiamento, agganciabili alla staffa
o da appoggiare alla platina. Il Vibrant produce un effetto
ombra sulla risonanza magnetica; in alcuni casi, inoltre, si è
osservato uno spostamento dell’FMT.2
Eseguito l’intervento, si verifica il funzionamento del dispositivo attraverso una valutazione visuo-meccanica o elettrofisiologica, con lo studio dei potenziali evocati. L’équipe
torinese, a fine intervento, esegue sul paziente cosciente ma
sedato, un vibrogramma, usando l’FMT come stimolatore. Il
paziente dichiara cosa riesce a percepire: se la soglia rilevata è identica a quella per via ossea, registrata in precedenza,
il dispositivo è stato posizionato correttamente.3
Il Vibrant Soundbridge rappresenta, dunque, una valida
terapia protesica in caso d’ipoacusia mista di entità medio-grave, con difficoltà nell’utilizzo di apparecchi acustici
convenzionali.
Bibliografia
1) Boheim K, et al. Round window vibroplasty: long-term results. Acta
Otolaryngol 2012; 132 (10): 1042-8
2) Todt I, et al. MRI scanning in patients implanted with a Vibrant Soundbridge. Laryngoscope 2011; 121 (7): 1532-5
3) Canale A, et al. Monitored anesthesia care with target-controlled infusion in vibroplasty. Ann Otol Rhinol Laryngol 2009; 118 (9): 625-9
IL DISPOSITIVO TOTALMENTE IMPIANTABILE CARINA
Stefano Berrettini
UO Otorinolaringoiatria, Audiologia e Foniatria Universitaria, A.O. Universitaria Pisana - Pisa
Il dispositivo totalmente impiantabile Carina trasforma i segnali elettrici in movimenti meccanici, stimolando direttamente la catena ossiculare. È costituito da un processore
digitale, dotato di batteria ricaricabile, un magnete, un’antenna, un trasduttore e un microfono che rappresenta sia il
punto di forza, sia il punto critico di questo tipo di protesi.
Le ridotte dimensioni del trasduttore ne agevolano il posizionamento, direttamente a contatto con l’incudine. Il
trasduttore si caratterizza per un’alta intensità di uscita e
una bassa distorsione. Sono disponibili diversi manipoli,
utilizzabili per ipoacusie miste, negli esiti di cavità aperta e,
soprattutto, negli esiti senza successo di timpanoplastica
chiusa, con la possibilità di essere applicati sulla staffa, sulla finestra rotonda o sulla platina. Il guadagno massimo per
questa protesi, descritto in letteratura, è di circa 40 dB, per
le frequenze principali (0,5-4000 Hz). Il processore è dotato
di 9 bande di regolazione del guadagno (500 Hz-6000 Hz)
e 7 canali di compressione; è in grado di ridurre automaticamente il rumore e, soprattutto, possiede un sistema di
riduzione del feedback.
Il microfono viene inserito in una tasca sottocutanea, in
corrispondenza dell’apofisi mastoidea: data la sua localizzazione, amplifica i suoni esterni, ma anche quelli endogeni, che possono risultare fastidiosi. Per ovviare a questo
problema, si applicano un microfono esterno, che raccoglie i suoni nell’ambiente, e uno interno, che capta e annulla i suoni endogeni. Il sistema è dotato di una batteria
ricaricabile in 30-40 minuti, con un’autonomia di 16 ore,
che si stima possa avere una vita media di circa 10 anni.
Il dispositivo è fornito di un sistema telemetrico (Transducer
Loading Assistant, TLA) che permette di valutare diretta-
6
mente, durante l’intervento, il corretto accoppiamento tra il
trasduttore e l’incudine, la finestra rotonda, la finestra ovale
o altre parti della catena ossiculare. Questa protesi è indicata solo nell’età adulta, per i casi d’ipoacusia bilaterale
neurosensoriale stabile, preferibilmente di tipo pantonale,
di grado moderato-grave (60-80 dB), con un limite massimo di perdita a 1 kHz di 80 dB e una discriminazione
vocale superiore al 50%. Viene adottata in particolare per i
pazienti che non tollerano le protesi convenzionali, mentre
è controindicata in presenza di particolari condizioni anatomiche, patologie infiammatorie attive dell’orecchio medio
o ipoacusia progressiva. Il dispositivo Carina è applicabile
anche nei pazienti con ipoacusia mista, che non hanno ottenuto beneficio con gli apparecchi tradizionali, purché la
via ossea sia migliore di 60-65 dB.
Nella casistica ottenuta dalla combinazione dei pazienti
dell’A.O. Universitaria di Pisa con quelli dell’équipe di Piacenza (32 orecchi impiantati, 20 monolaterali, 6 bilaterali),
la soglia uditiva per via aerea pre-operatoria non è risultata
significativamente differente dalla post-operatoria, mentre
il guadagno uditivo per orecchio ha evidenziato un incremento medio di 22,4 dB (range 5-40 dB) (Figura 1).
Miglioramenti si sono rilevati anche con l’audiometria vocale in campo libero e con i test delle abilità uditive, nel
silenzio e nel rumore.
Le esperienze di utilizzo del Carina nell’ipoacusia mista
sono molto limitate: nei 5 pazienti in cura a Pisa e Piacenza
si sono ottenuti buoni risultati, con percentuali di riconoscimento di parole e frasi in alcuni casi prossime al 100%. Il
dispositivo Carina è reversibile, non peggiora la via aerea,
né la ossea, è invisibile ed utilizzabile anche in ambienti
T CORSO CRS
umidi. A giudizio dei pazienti, inoltre, produce un segnale più chiaro e con minor distorsione, rispetto alle protesi
tradizionali. Per contro, ha un costo elevato, va applicato
in anestesia generale, non è compatibile con la risonanza
magnetica e nelle forme progressive, col tempo, può non
essere più sufficiente. Inoltre, non si hanno ancora dati certi sulla reale durata della batteria.
0
20
40
60
65,52
80
100
Pre-intervento
68,33
Post-intervento
Figura 1. Soglia media per via aerea pre e post intervento
IL DISPOSITIVO TOTALMENTE IMPIANTABILE ENVOY
ESTEEM
Maurizio Barbara
UOC Otorinolaringoiatria, A.O. Sant’Andrea, Università La Sapienza - Roma
L’Envoy Esteem è l’unico dispositivo totalmente impiantabile
approvato dalla FDA. La sua principale peculiarità è di essere
sprovvisto di microfono: è il timpano stesso a compiere questa funzione. La membrana timpanica è solidale col manico
del martello e l’incudine, sul corpo della quale viene posizionato il sensore. L’onda sonora invia l’input al timpano, che lo
trasmette al processore sonoro; questo, a sua volta, lo rinvia
come stimolo elettrico al trasduttore che stimolerà la staffa,
facendola vibrare. La stimolazione cocleare è, dunque, fisiologica, di tipo piezoelettrico, e richiede molta meno energia, a
parità di efficacia: per questo nei sistemi totalmente impiantabili questa stimolazione è preferita a quella elettromagnetica.
Poiché la vibrazione prodotta è più vicina a quella naturale,
con i sistemi attivi di orecchio medio è meno probabile che
vi sia distorsione, rispetto alle protesi che stimolano meccanicamente la catena ossiculare o le finestre rotonda e ovale.
Queste proprietà sono ancora più accentuate nell’Esteem,
che non utilizza un microfono. Grazie a questa caratteristica,
inoltre, l’Esteem non capta suoni endogeni e non è necessario spegnerlo di notte. Questo impianto è dotato di una batteria non ricaricabile, un aspetto apprezzato dai pazienti che
spesso non gradiscono l’incombenza della ricarica.
Il dispositivo viene alloggiato in sede retroauricolare. Durante
l’intervento si valuta la motilità ossiculare, ovvero l’efficacia del
microfono del sistema: se questa non è adeguata non si procede con l’intervento. L’applicazione del dispositivo richiede
il sacrificio della chorda tympani e l’interruzione della catena
ossiculare. L’Esteem è in grado di riabilitare forme d’ipoacusia
severe e profonde. È fondamentale, però, che l’orecchio me-
dio funzioni normalmente: per questo viene valutato con un
timpanogramma di tipo A. Inoltre, date le dimensioni dei due
trasduttori, è necessario che la distanza tra il corpo dell’incudine e l’angolo seno-durale sia superiore a 16 mm, o quella
tra la testa della staffa e la faccia anteriore di un seno laterale
sia inferiore a 21 mm.
La casistica dell’Ospedale Sant’Andrea comprende 34 interventi di chirurgia primaria e 16 sostituzioni della batteria. La
valutazione della via ossea, durante la sostituzione della batteria, ne ha evidenziato un lieve deterioramento, che non ha
inficiato, però, il risultato funzionale. Nella casistica osservata,
infatti, più dell’80% dei pazienti ha riscontrato un miglioramento della soglia uditiva, rispetto al livello pre-operatorio, con il
guadagno più significativo riscontrato a 2000 Hz (Figura 1).
0
10
20
30
40
50
60
70
80
90
100
110
120
125
250
500 1000 2000 4000 8000
Basale
Fitting
più recente
Figura 1. Variazione della soglia pre e post intervento
7
REPORT C
Il confronto tra baseline, protesi acustica ed Esteem, effettuato in 17 pazienti, ha evidenziato con il dispositivo impiantabile
una significativa riduzione della soglia di percezione del parlato e un incremento del riconoscimento vocale, anche rispetto
alla protesi.
L’azienda produttrice consiglia di sostituire la batteria ogni 3-5
anni; nella pratica clinica, però, si sono riscontrati casi in cui la
batteria ha avuto una durata inferiore ai tre anni.
L’intervento con cui si applica questo dispositivo non è esente
da complicanze: alcune sono volontarie, correlate alla tecnica
utilizzata (ipoacusia trasmissiva per l’interruzione della catena ossiculare, sacrificio della chorda tympani). In caso di
espianto, inoltre, è necessario effettuare una ricostruzione
ossiculare. Le complicanze propriamente dette includono
la deiscenza del processore sonoro, gli acufeni, le fibrosi
post-operatorie. Si possono verificare delle paralisi facciali
temporanee o ritardate, probabilmente associate alla riattivazione di un herpes virus, che tendono a risolversi spontaneamente.
Il sistema Esteem può essere dunque una valida alternativa
agli apparecchi acustici convenzionali in casi ben selezionati: per questo si effettua un approfondito counselling pre-operatorio. L’invisibilità dell’impianto rappresenta un aspetto
fondamentale della sua accettabilità, mentre pochi sono gli
aspetti che destano preoccupazione: il lieve deterioramento
della via ossea, e la probabilità di doversi sottoporre a numerose sostituzioni della batteria, in particolare per i soggetti
che vengono impiantati in giovane età.
IMPIANTI COCLEARI
Alessandra Murri
U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto - Piacenza
L’impianto cocleare è costituito da un ricevitore stimolatore,
applicato chirurgicamente, e da un elaboratore del suono
esterno, costituito da un magnete, un’antenna, un microfono
e un processore del suono. I segnali sonori sono raccolti dalla
componente esterna, rielaborati e trasferiti alla porzione interna che, a sua volta, stimola degli elettrodi posizionati dentro
la scala timpanica. Il suono è, quindi, convertito in un segnale
elettrico che bypassa le cellule ciliate e stimola direttamente le
terminazioni del nervo acustico. Gli impianti cocleari consentono la risonanza magnetica fino a 1,5 tesla.
Negli anni si sono prodotti elettrodi sempre più sottili, con diametri inferiori al millimetro, che, oltre a garantire l’atraumaticità
e la preservazione uditiva, producono migliori risultati funzionali sul paziente. Questi elettrodi consentono di proteggere le
strutture dell’orecchio interno, di mantenere l’elettrodo correttamente nella scala timpanica, impedendone la penetrazione
nella scala vestibolare, e di preservare i potenziali endococleari.
Le principali aziende del settore propongono elettrodi sottili di
tipo mid-scale, perimodiolari, non perimodiolari, o più corti per
la preservazione uditiva, nel caso di stimolazione elettroacustica.
Per l’intervento chirurgico oggi si preferiscono tecniche mini-invasive, con un approccio retroauricolare. Si visualizza la finestra rotonda, attraverso cui si posiziona l’elettrodo, mediante un’incisione della membrana secondaria: in questo modo
si minimizza il trauma endococleare, mantenendo integra la
membrana, e si posiziona l’elettrodo con la direzione corretta.
Generalmente i dispositivi sono dotati di microfoni direzionali, che migliorano notevolmente l’ascolto, soprattutto in situazioni rumorose. I nuovi processori riducono il rumore del
8
vento, controllano automaticamente il volume, sono resistenti
all’acqua, sono adattabili alle stimolazioni elettroacustiche, e
hanno la possibilità del data logging, per consentire al clinico
di correlare il risultato funzionale con l’utilizzo del dispositivo
nella vita quotidiana. Tutti i device sono dotati di una connettività wireless. Dopo l’intervento, il dispositivo viene regolato, in
base alle risposte del paziente, tramite un computer collegato
al processore esterno: in seguito tutte le misure soggettive e
oggettive devono essere integrate da un’osservazione comportamentale, in particolare nei bambini. La mappa creata viene scaricata sul processore e gradualmente affinata, nel corso
di vari incontri col paziente.
Oggi le indicazioni all’impianto cocleare sono più ampie di un
tempo. Per gli adulti ci si basa sui punteggi di riconoscimento
verbale, che devono essere pari al 50%-40%, a seconda delle
linee guida: in particolare si valuta il riconoscimento del parlato
in ambiente rumoroso. Se il riconoscimento verbale è superiore al 50%, ma è associato a una scadente percezione in
ambiente rumoroso, si ha comunque l’indicazione all’impianto. Il dispositivo viene applicato anche agli adulti con sordità
pre-verbale, che ottengono buoni risultati, anche in termini di
qualità di vita. Dal 2013 l’Europa ha approvato una nuova indicazione, riguardante la sordità monolaterale. In questi pazienti
l’impianto cocleare consente di recuperare un vero udito binaurale, a differenza di quanto avviene, per esempio, con i dispositivi per via ossea. Anche la sordità parziale e la neuropatia
uditiva rappresentano delle indicazioni per l’impianto cocleare.
In età pediatrica la soglia uditiva deve essere pari o superiore
a 90 dB e i bambini devono aver avuto un’amplificazione acustica non inferiore a 3-6 mesi. L’FDA ha approvato l’intervento
T CORSO CRS
non prima dei dodici mesi, ma la pratica clinica suggerisce
che una precoce applicazione dell’impianto produce migliori
risultati, sia uditivi che linguistici. L’équipe di Piacenza ha valutato bambini impiantati tra gli otto e i diciassette mesi.1 A tre
anni, i bambini impiantati più precocemente producevano un
maggior numero di parole e formulavano frasi più complesse e più lunghe. Sotto il primo anno di vita si può, dunque,
applicare un impianto cocleare quando la sordità è diagnosticata nell’ambito dei programmi di screening, con immediata
protesizzazione. È importante, poi, che questi bambini siano
stati seguiti sistematicamente e prima di procedere all’impianto non mostrino un’adeguata progressione delle abilità percettivo-uditive. L’impianto non è indicato, invece, in presenza di
fattori di rischio associati, in bambini provenienti dalle terapie
intensive neonatali, nei prematuri, nei casi d’infezione da citomegalovirus, o di altre patologie perinatali.
Bibliografia
1) Cuda D, et al. Pre-school children have better spoken language when
early implanted. Int J Pediatr Otorhinolaryngol 2014; 78(8):1327-31
FLOW CHART NELLA GESTIONE DELL’IPOACUSIA
OTOSCLEROTICA
Roberto Albera
Dipartimento di Scienze Chirurgiche, Università degli Studi di Torino
L’otosclerosi non è una patologia pericolosa per il paziente:
l’ipoacusia che ne deriva può essere affrontata soltanto con
controlli periodici per valutare eventuali peggioramenti, approccio consigliabile in caso di deficit trasmissivo modesto o
se il paziente rifiuta di sottoporsi all’intervento chirurgico.
La chirurgia dell’otosclerosi produce risultati soddisfacenti;
tuttavia, essendo praticata per scopi funzionali e potendo causare problemi rilevanti in caso d’insuccesso, è necessario porre l’indicazione nei casi in cui il margine di rischio sia il più basso possibile. L’intervento chirurgico viene svolto in anestesia
locale, anche per verificare rapidamente l’esito dell’intervento
chirurgico ed eventuali danni sull’orecchio interno. L’intervento prevede l’asportazione della parte superiore della staffa e
il posizionamento della protesi, e dura circa 40 minuti. I pazienti otosclerotici mediamente presentano un’ipoacusia con
A
-10
0
10
20
30
40
50
60
70
80
90
100
110
120
un’importante connotazione trasmissiva e iniziale sofferenza
della via ossea. È consigliabile l’intervento quando la soglia
per via aerea si aggira attorno ai 60 dB. Nella casistica studiata
dall’équipe torinese, la maggioranza dei pazienti evidenziava
un air bone gap (ABG) medio superiore a 20 dB, sulle frequenze 0,5-1-2-4 kHz. Nella stessa casistica la stapedotomia
ha garantito un miglioramento nel 95% circa dei casi, mentre
la situazione è rimasta invariata nel 4% e si è rilevato un peggioramento nello 0,5-2% dei pazienti operati. Il peggioramento
provoca un’ipoacusia neurosensoriale di difficile gestione, con
problemi di distorsione nell’amplificazione.
Nei numerosi casi in cui ha avuto successo, l’intervento
ha migliorato significativamente la soglia audiometrica della
via aerea, pur non risolvendo completamente il problema
(Figura 1).
B
>
125
250
>
>
> >
>
500 750 1500 3000
6000 11000
1000 2000 4000
8000
-10
0
10
20
30
40
50
60
70
80
90
100
110
120
>
125
250
>
>
> >
>
500 750 1500 3000
6000 11000
1000 2000 4000
8000
Figura 1. Stapedotomia: soglie audiometriche pre-operatorie (A) e post-operatorie (B)
9
REPORT C
Raramente (0,1%) si possono verificare paralisi facciale,
quasi sempre transitoria, o una perforazione timpanica
permanente. Complicanze più frequenti sono la lesione
della corda del timpano (6%), le vertigini (10%) e gli acufeni,
che solitamente migliorano, ma possono comparire anche
dopo un intervento con buon esito funzionale. L’aspetto
della membrana timpanica, le dimensioni del condotto uditivo esterno, l’età, la mono- o la bilateralità e l’entità dell’ipoacusia sono i fattori che possono condizionare il risultato
dell’intervento. L’aspetto della membrana timpanica incide, in realtà, in misura minore. La presenza di un condotto
uditivo esterno di diametro inferiore alla media (che è pari
a 6,5-7 mm), non ha prodotto risultati significativamente
differenti, in termini di esito funzionale, né ha incrementato il rischio di coclearizzazione. Nella casistica torinese, gli
esiti funzionali dell’intervento si sono rivelati simili nelle tre
fasce d’età considerate (<60 anni, 60-70 anni, >70 anni),
con variazioni della soglia per via aerea pari a circa 15 dB,
e modificazioni non significative della via ossea.
Il 71% dei pazienti otosclerotici presenta un’ipoacusia bilaterale, spesso con una forte asimmetria tra di due orecchi.
Nell’otosclerosi bilaterale il primo intervento viene eseguito
generalmente sul lato peggiore, per creare meno disagio
possibile al paziente, in caso di sofferenza labirintica. L’entità dell’ipoacusia trasmissiva è correlata al grado di fissità
platinare. Con un gap VA/VO modesto, è più elevato il rischio di mobilizzazione platinare, evento che può favorire
una sofferenza cocleare e che dimezza il recupero uditivo.
Per questo si preferisce non intervenire precocemente sul
paziente: un sistema con una maggiore rigidità agevola
l’intervento, limitando il rischio di danno cocleare. Se l’intervento non produce i risultati sperati, si può effettuare
una revisione, indicata nei casi in cui non si sono rilevate
differenze significative né nella soglia audiometrica, né nel
gap VA/VO. Nel caso l’otosclerosi riguardi l’unico orecchio udente, l’intervento è controindicato. In alternativa
all’intervento, si può utilizzare un apparecchio acustico
convenzionale o uno impiantabile a conduzione ossea. Se
l’ipoacusia è mista e coinvolge anche la via ossea, possono essere più indicati una protesi semi-impiantabile con
massa vibrante o altri dispositivi impiantabili nell’orecchio
medio. Si ricorre all’impianto cocleare dopo un intervento fallimentare o in presenza di una gravissima compromissione cocleare. Dopo un’adeguata presentazione dei
diversi approcci terapeutici, la scelta finale spetta al paziente.
FLOW CHART NELLA GESTIONE DELLA
PRESBIACUSIA
Maurizio Barbara
UOC Otorinolaringoiatria, A.O. Sant’Andrea, Università La Sapienza, Roma
La presbiacusia è un’ipoacusia neurosensoriale, in genere bilaterale e progressiva, che s’instaura con l’avanzare
dell’età. È la prima causa d’ipoacusia neurosensoriale
nell’adulto: ne soffre oltre il 40% della popolazione con
più di 65 anni di età e, di questi, solo il 16% dei pazienti è protesizzato. La sordità riguarda in particolare le alte
frequenze e ha un’eziologia estremamente varia. Fattori
molecolari o vascolari possono danneggiare l’organo del
Corti, ma intervengono anche fattori genetici e ambientali. Inoltre, alcune condizioni possono rivelarsi più nocive in
presenza di una predisposizione ereditaria, come l’esposizione al rumore e l’utilizzo di farmaci ototossici. Possono
incidere sulla presbiacusia anche i traumi cranici, le patologie metaboliche o cardiovascolari, le immunodepressioni, l’insufficienza renale, le demenze senili, l’osteoporosi,
oltre a concomitanti patologie otologiche. Schuknecht ha
individuato quattro tipi di presbiacusia: la sensoriale, che
interessa l’organo del Corti, la neurale, che riguarda le
10
fibre neurali, la striale o metabolica, e la presbiacusia di
conduzione, relativa alla trasmissione dell’onda sonora al
liquido endolinfatico. Questa classificazione è stata in parte
superata dall’individuazione di forme miste e presbiacusie
idiopatiche. Nella presbiacusia sensoriale si perdono le cellule sensoriali del giro basale della coclea, con un danno
sulle frequenze acute (4000-8000 Hz): il paziente fatica a
comprendere il parlato in situazioni rumorose. Con la presbiacusia neuronale, che riguarda la perdita delle cellule del
ganglio spirale, il paziente ha una pessima discriminazione
della parola, anche in quiete, nonostante una buona soglia
uditiva. Nella forma striale o metabolica, la protesi produce
un’ottima amplificazione, con una distorsione minima. Nella presbiacusia di conduzione l’audiogramma ha una classica forma in discesa: in questa tipologia la protesizzazione
apporta un elevato beneficio.
La presbiacusia limita la comprensione delle parole in ambiente rumoroso, rallenta i processi centrali d’integrazione
T CORSO CRS
dell’informazione acustica, ostacola la localizzazione dei
suoni. Altri sintomi sono l’ovattamento e gli acufeni, che
creano un pesante disagio al paziente. Dopo aver eseguito
i necessari test diagnostici, si sceglie il programma riabilitativo più adatto al paziente. La presbiacusia sensoriale ha
buone possibilità di protesizzazione, con qualche problema
di distorsione, mentre quella neurale comporta problematiche che limitano le potenzialità degli apparecchi acustici.
La metabolica-striale probabilmente è la forma che ottiene
il massimo beneficio dalle protesi, senza avere eccessivi
disturbi; buone possibilità di riabilitazione si hanno anche
per la conduttiva. La protesi tradizionale può avere un’efficacia limitata nelle forme neurali, in particolare nella com-
prensione del parlato nel rumore. Possono essere indicate
anche le protesi impiantabili, in particolare nei soggetti con
condotto ristretto, frequenti otiti esterne, dermatiti, o che
abbiano particolari esigenze socio-lavorative, che richiedano di avere il condotto uditivo libero, o per motivi estetici.
Unica eccezione potrebbero essere i dispositivi Vibrant,
che non amplificano le frequenze gravi. Le protesi impiantabili possono essere utilizzate anche nei casi di presbiacusia striale. In conclusione, il corretto approccio riabilitativo
della presbiacusia con protesizzazione acustica può ridurre
la disabilità e migliorare la funzione uditiva. Le protesi impiantabili possono rappresentare una valida alternativa agli
apparecchi acustici convenzionali.
FLOW CHART NELLA GESTIONE DELLE SORDITÀ
GRAVI DELL’ADULTO
Stefano Berrettini
UO Otorinolaringoiatria, Audiologia e Foniatria Universitaria, A.O. Universitaria Pisana - Pisa
L’ipoacusia è definita grave quando è superiore a 70 dB
sulle frequenze di 500, 1000, 2000 Hz: in questi casi la
percezione del parlato è inesistente. Diverse sono le possibilità di trattamento per i pazienti con ipoacusie severe e
profonde, in particolare di tipo misto, dalla revisione della timpanoplastica, alle protesi per via ossea, ai dispositivi semi- o totalmente impiantabili, ma per questi pazienti
la questione fondamentale è scegliere quando ricorrere
all’impianto cocleare.
In alcuni pazienti con ipoacusia mista può essere indicato
l’apparecchio acustico per via aerea, ma in caso di mancato beneficio si può ricorrere a un dispositivo semi-impiantabile. La protesi per via ossea può essere indicata se
il paziente presenta una via ossea compresa tra i 35 e i 45
dB, specialmente se esiste un buon gap con la via aerea.
Quando la via ossea è deteriorata, l’indicazione è più difficile e diventa molto importante la fase di counselling. Un
caso limite è quello di una paziente di 84 anni con un’ipoacusia mista, in cui l’applicazione di un dispositivo BAHA
non aveva dato esiti soddisfacenti.
Vista l’età avanzata, è stata esclusa la possibilità di un impianto. La paziente ha preferito nuove protesi acustiche di
potenza, ottenendo un discreto beneficio. In un caso simile
si sono conseguiti risultati migliori applicando un dispositivo Carina, intervento reso possibile dalla più giovane età
del paziente (66 anni). I casi più gravi d’ipoacusia mista
possono essere trattati combinando tecniche chirurgiche,
protesi impiantabili di vario tipo e soluzioni protesiche tra-
dizionali.
Le difficoltà maggiori s’incontrano, però, con le ipoacusie
neurosensoriali gravi o profonde e con la scelta di ricorrere
o meno all’impianto cocleare. Secondo le linee guida HTA,
l’impianto cocleare è indicato in un paziente adulto con
una perdita uditiva superiore ai 75 dB (media di 500-10002000 Hz), e con un riconoscimento di parole bisillabiche a
bocca schermata inferiore al 50% nell’orecchio migliore o
una percentuale di riconoscimento verbale inferiore al 50%
in condizioni di rumore.1 Per circa la metà dei pazienti con
questo tipo d’ipoacusia è sufficiente migliorare la protesizzazione, per ottenere un beneficio. Un numero molto limitato di pazienti, inoltre, può trarre giovamento dai dispositivi
totalmente impiantabili.
Un paziente con un’ipoacusia neurosensoriale bilaterale
grave da meningoencefalite, non aveva ottenuto beneficio
dalla protesi acustica a sinistra, mentre aveva rilevato lievi
miglioramenti con la protesi sull’orecchio destro. L’utilizzo
di un impianto cocleare, abbinato alla protesi acustica, in
questo paziente ha incrementato le abilità percettive nel
silenzio fino quasi al 100% (Figura 1).
Particolarmente difficili da trattare sono i menierici bilaterali,
che generalmente non riescono a portare le protesi e hanno
ipoacusie fluttuanti, con un riconoscimento verbale assolutamente insoddisfacente: l’impianto cocleare rappresenta
la soluzione migliore. Anche le ipoacusie neurosensoriali
gravi e profonde, bilaterali e asimmetriche, possono rappresentare un’indicazione all’impianto cocleare.
11
REPORT C
100
Bibliografia
1) Berrettini S, et al. Analysis of the impact of professional involvement in evidence generation for
the HTA Process, subproject “cochlear implants”:
methodology, results and recommendations. Acta
Otorhinolaryngol Ital 2011 Oct;31(5):273-80
Abilità percettive nel SILENZIO dopo 4 anni
80
60
40
20
0
100
IC+HA
IC
HA
Abilità percettive nel RUMORE dopo 4 anni
80
60
40
IC = impianto cocleare. HA= protesi acustica
20
0
parole
IC+HA
frasi
IC
HA
Figura 1. Abilità percettive in paziente con ipoacusia neurosensoriale, nel rumore e nella quiete,
con protesi acustica, impianto cocleare o entrambi.
comprensione
FLOW CHART NELLA GESTIONE DELLE SORDITÀ
INFANTILI GRAVI
Sandro Burdo
Ospedale di Circolo, Varese e Ospedale Pediatrico V. Buzzi - Milano
Nelle sordità gravi e profonde periferiche del bambino, i
questionari diagnostici o di controllo e l’audiometria tonale in campo libero, con le tre modalità di esecuzione, a
seconda dell’età del paziente (BOA: primi sei mesi; VRA:
tra i sei e i dieci mesi; COR: fino ai diciotto mesi), sono
i principali strumenti disponibili. Altri test utilizzabili sono
quelli di audiometria oggettiva (impedenzometria, otoemissioni), ma l’esame che spesso risulta determinante sono i
potenziali evocati con stimoli frequenziali, che permettono
di ricostruire tutto il campo tonale del paziente. La sola
12
esecuzione dell’audiometria a potenziali evocati (ABR) non
permette di formulare una corretta diagnosi di sordità profonda, poiché l’ABR studia la sincronizzazione di scarica
delle fibre nervose. La mancanza dei potenziali evocati può
essere dovuta a sordità o a un’alterata sincronizzazione
di scarica, come si osserva nei prematuri: in questi casi il
soggetto è perfettamente udente. Inizialmente s’identifica
il grado di perdita pantonale, poi la sede della lesione e, in
base a quanto riscontrato, si procede con una programmazione terapeutica. Si valutano poi con altri test anche
T CORSO CRS
le abilità e modalità comunicative del paziente. Si arriva
così a una diagnosi non definitiva, da confermare dopo la
prima protesizzazione. Solo a questo punto si ottiene una
diagnosi funzionale conclusiva, cui faranno seguito accertamenti morfologici (TC, RM), valutazioni genetiche, altre
valutazioni cliniche e la programmazione terapeutica.
Il paziente pediatrico può arrivare al centro di terzo livello
a pochi mesi, provenendo dai programmi di screening, o
tra i sei e i diciotto mesi, di solito su segnalazione dei genitori. Infine vi sono bambini sordi congeniti, non identificati
dai genitori, che pervengono al centro solo dopo i diciotto
mesi.
Nei bambini provenienti dallo screening è importante valutare il tono muscolare cervicale, la tolleranza alle protesi acustiche e il comportamento; questi aspetti vanno
poi confermati dal guadagno funzionale protesico e dallo
studio del comportamento comunicativo. In un bambino
portatore di protesi, un’ipotonia cervicale è segno d’ipoamplificazione, causata da una non adeguata regolazione
della protesi, o da una sordità grave, per la quale la protesi è insufficiente. Il bambino può rivelarsi intollerante alle
protesi, per una chiocciola mal costruita, ma anche per
un’iperamplificazione. L’ultima valutazione riguarda il comportamento: un bambino ben protesizzato solitamente si
tranquillizza dopo pochi giorni. Si valuta poi se la soglia
protesica è compresa tra 30 e 50 dB, valori che si rilevano
nel sordo grave o profondo, portatore di protesi. Con questa soglia il bambino sente la voce, ma non la discrimina:
se non si riscontrano questi valori, va applicato al bambino un vibratore sternale, strumento che serve ad attivare
i basic skill uditivi.
Una volta formulata la diagnosi, le tappe successive richiedono personale competente nella riabilitazione pre-chirurgica di un bambino molto piccolo. Se queste professionali-
tà non sono disponibili, spesso si procede con un impianto
cocleare molto precoce. Se il paziente è stato costretto a
usare il vibratore, si ricorre comunque a un impianto precoce. Se, invece, la risposta comunicativa del paziente è
stata adeguata, è possibile applicare l’impianto entro i diciotto mesi, ma non oltre. Dopo quest’età, infatti, i risultati
sono meno soddisfacenti.
Esistono due modalità riabilitative pre-chirurgiche: la prima
è orientata all’intervento, è molto breve, e serve a confermare la diagnosi, mentre la seconda è orientata alla riabilitazione e introduce il bambino alla comunicazione. Con la
prima strategia, l’impianto cocleare deve essere necessariamente applicato molto precocemente, perché serve anche ad attivare le abilità uditive di base. La strategia orientata alla riabilitazione, invece, ha come obiettivo il cervello,
non l’orecchio sordo.
Perché nasca la comprensione sono necessari la consapevolezza dell’esistenza del suono, l’attivazione dell’attenzione comunicativa, l’identificazione o il riconoscimento
delle cose sentite. Se nessuno di questi passaggi viene
bloccato si giunge alla comprensione: se si blocca l’identificazione, si ha una sordità centrale, se il blocco riguarda la
detezione, si ha una sordità periferica. Vibratore e protesi
attivano la consapevolezza, l’attenzione comunicativa e la
detezione. Il bambino arriva poi alla comprensione, grazie
alla lettura labiale. Ottenuti i risultati comunicativi desiderati, si passa all’applicazione dell’impianto cocleare. I bambini sottoposti a una riabilitazione orientata alla chirurgia
affrontano tutti questi passaggi solo dopo l’applicazione
dell’impianto. La prognosi di questi bambini con sordità
profonda dipende dal paziente, dalla sua memoria uditiva,
dalla sua plasticità, dall’età e dal coinvolgimento della figura materna. Dopo l’intervento, va comunque effettuata
una fase riabilitativa.
FLOW CHART NELLA GESTIONE DELLE SORDITÀ
INFANTILI LIEVI
Alessandra Murri
U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto - Piacenza
Le sordità lievi nei bambini possono essere distinte in tre
categorie:
•sordità neurosensoriali bilaterali, con una soglia media
per via aerea compresa tra i 20 e i 40 dB,
•sordità neurosensoriali concentrate solo sulle alte frequenze, con una soglia media per via aerea superiore a
25 dB, a due o più frequenze oltre i 2 kHz,
•sordità neurosensoriali monolaterali, trattate specificamente in una relazione successiva.
L’incidenza delle sordità lievi è aumentata con l’avvento
dei programmi di screening neonatale. Sui nati a termine
l’incidenza delle forme bilaterali è di 0,5/1000, mentre nei
bambini provenienti dalle terapie intensive neonatali l’incidenza sale a 4,8/1000. Per le forme monolaterali l’inci-
13
REPORT C
denza è rispettivamente pari a 0,41/1000 e a 3,2/1000.
L’incidenza delle sordità infantili in età scolare è molto più
elevata ed è stata stimata pari all’11-15% nelle popolazioni
anglosassoni.1,2
Il percorso diagnostico e terapeutico per i bambini provenienti dagli screening è diverso da quello dei pazienti in età
scolare. Se un bambino di 0-3 mesi presenta una sordità
lieve, con otoemissioni refer e un ABR a 35 dB, si verifica
innanzitutto se si tratta di una forma mono- o bilaterale. Se
è monolaterale, con timpanogramma di tipo A, il bambino
sarà seguito nei mesi successivi, quando si eseguirà una
valutazione più completa, con una visual reinforcement audiometry (VRA), e una valutazione logopedica delle abilità
comunicative e linguistiche. Se, a sei mesi, l’ABR non si
è normalizzato e la VRA non è nella norma, si conferma
la diagnosi d’ipoacusia lieve monolaterale. Il bambino sarà
seguito nel tempo per valutare la stabilità della soglia uditiva, e si eseguirà un inquadramento genetico e radiologico, per verificare la presenza di malformazioni dell’orecchio
interno. Se inizialmente il timpanogramma è di tipo B, si
procede con la terapia. Se il timpanogramma diventa di
tipo A, si rientra nell’iter descritto sopra; in caso contrario,
il bambino va rivalutato nell’ambito di un follow up audiologico più stringente. Se a una nuova rivalutazione il quadro
non si è normalizzato, si conferma l’ipoacusia monolaterale
e il bambino continuerà a essere seguito.
In presenza di una forma bilaterale, con timpanogramma di
tipo A, il bambino viene inserito nel programma di follow up
e rivalutato a sei mesi. Se il quadro clinico non si è normalizzato, si conferma l’ipoacusia lieve bilaterale e il bambino
proseguirà con il follow up. Con un timpanogramma di tipo
B, si seguono i passaggi sopra descritti (terapia/normalizzazione del timpanogramma/percorso di follow up). Se
persiste il tipo B, il bambino viene sottoposto a un controllo
più stretto e, se a sei mesi non si rileva una normalizzazione dei parametri, si conferma la diagnosi d’ipoacusia lieve
bilaterale e il proseguimento del follow up.
Prima dei sei mesi le tecniche comportamentali non sono
utilizzabili; successivamente si può ricorrere alla VRA, per
ottenere una soglia monoaurale su tutte le frequenze. Sottoponendo alla VRA un bambino con ipoacusia bilaterale e
timpanogramma A, si può osservare una situazione pantonale (40 dB per le frequenze 250-500-1000-2000-4000
Hz), trattabile precocemente con l’apparecchio acustico e
conseguente follow up. Si possono riscontrare, però, anche soglie di 25 dB per le frequenze fino a 1000 Hz, e di
40 dB per le frequenze più alte. In questo caso il bambino
viene seguito nel tempo, per valutare se lo sviluppo delle
abilità è in linea con l’età cronologica. Se questo non accade, s’interviene con l’applicazione dell’apparecchio acustico, concentrando il guadagno solo sulle alte frequenze
(Figura 1).
Valutazione a 6 mesi
Ipoacusia lieve bilaterale
ABR 40dB
Timpanogramma A
VRA
25 dB per le frequenze
250-500-1000 Hz
40 dB per le frequenze
2000-4000 Hz
40 dB per le frequenze
250-500-1000-2000-4000 Hz
Apparecchi acustici
Follow up audiologico e delle abilità
comunicative e linguistiche
Inquadramento genetico e radiologico
Follow up audiologico e delle abilità
comunicative e linguistiche
Inquadramento genetico e radiologico
Sviluppo delle abilità
uditive e linguistiche
NON in linea con l’età cronologica
Figura 1. Flow chart della gestione dell’ipoacusia lieve infantile, bilaterale. Valutazione a 6 mesi
14
Sviluppo delle abilità
uditive e linguistiche
in linea con l’età cronologica
Follow up
T CORSO CRS
Diverso l’iter per i bambini in età scolare. Con un’ipoacusia monolaterale e timpanogramma di tipo A, il bambino è
valutato con l’esame audiometrico tonale, cui fanno seguito un’audiometria vocale, anche in presenza di rumore, e
una valutazione logopedica. Se si riscontra un ritardo delle
abilità, si può ricorrere a un sistema FM o a un CROS. In
caso contrario, il bambino continuerà a essere seguito, anche per un inquadramento radiologico e genetico. Con un
timpanogramma iniziale di tipo B, non modificato dopo la
terapia, se si osserva una cronicizzazione dell’otite effusiva,
si utilizzano i drenaggi trans-timpanici (DTT). In seguito, si
potrà confermare l’ipoacusia lieve monolaterale, con il rientro nel percorso già descritto. Se, con una soglia normale,
si evidenzia un ritardo delle abilità, il bambino può essere
aiutato con dispositivi FM.
Con una forma bilaterale, associata a un ritardo e a difficoltà in ambiente rumoroso, s’interviene direttamente con
gli apparecchi acustici. In caso contrario, il bambino viene
seguito per valutare la sua evoluzione. Con un timpano-
gramma di tipo B, se permane l’otite effusiva, si esegue il
drenaggio. In seguito, se si conferma l’ipoacusia bilaterale,
si procede all’applicazione degli apparecchi acustici e alla
valutazione di tutte le abilità del bambino. Se, invece, la
soglia si normalizza, e si rileva un ritardo, il bambino viene
inserito nel follow up e aiutato con un sistema FM.
Se la soglia bilaterale (40 dB, ABR) è pantonale, s’interviene con gli apparecchi acustici. Se si rileva solo nelle alte
frequenze, e il bambino non ha ritardi nelle abilità linguistiche, si consiglia un sistema FM; in presenza di ritardi
s’interviene tempestivamente con gli apparecchi acustici.
Bibliografia
1) Niskar AS, et al. Prevalence of hearing loss among children 6 to 19 years of age: the Third National Health and Nutrition Examination Survey.
JAMA 1998 Apr 8;279(14):1071-5
2) Bess FH, et al. Children with minimal sensorineural hearing loss: prevalence, educational performance, and functional status. Ear Hear 1998
Oct;19(5):339-54
FLOW CHART NELLA GESTIONE DELLE SORDITÀ
SKI SLOPE
Domenico Cuda
U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto - Piacenza
Le sordità ski slope sono caratterizzate da un’accentuata
pendenza audiometrica e impediscono di udire alcuni elementi dello spettro verbale. Non esiste un’eziologia specifica,
ma concorrono all’insorgenza di queste forme i traumi acustici acuti o cronici, l’ototossicità, infezioni virali, alcune forme
d’ipoacusia associata all’età, fattori genetici. Nelle forme più
gravi si verifica una perdita delle cellule ciliate esterne e interne. Gli effetti di questa ipoacusia si manifestano con un’ampia
variabilità soggettiva, che dipende dall’udibilità del segnale,
dall’età di esordio dell’ipoacusia, dalla sua durata, ma anche
da numerosi altri fattori non ancora noti. Da qui la necessità di
valutare individualmente ogni paziente.
Questa ipoacusia si caratterizza per la presenza di una soglia uditiva normale alle basse frequenze e una perdita uditiva
quasi totale sui toni acuti. Tipicamente la zona di transizione
si colloca tra i 500 e i 3000 Hz: per definire un’autentica ski
slope la differenza tra la zona a bassa frequenza e quella ad
alta frequenza dovrebbe essere superiore a 50 dB. I pazienti
sentono ma non comprendono, e percepiscono il suono con
fastidio: procedendo con l’amplificazione, si può verificare un
ulteriore degrado della qualità sonora. Questa ipoacusia può
insorgere anche nei bambini: generalmente diagnosticata in
età scolare, può determinare difficoltà nell’apprendimento e
dislalia.
In molti casi le protesi acustiche tradizionali non sono efficaci,
per il limitato guadagno alle alte frequenze, l’amplificazione
non necessaria delle frequenze gravi, l’occlusione del condotto uditivo. Le possibili alternative sono rappresentate da
protesi con accoppiamento classico e ventilazione, con accoppiamento aperto o con trasposizione frequenziale. Per gli
adulti sono indicati anche i dispositivi impiantabili o, in casi
selezionati, gli impianti cocleari, che stimolano aree di coclea
morta, preservando la soglia alle basse frequenze. Per ottenere la preservazione uditiva si utilizzano solitamente elettrodi
più sottili e corti (16-20 mm), con una copertura maggiore del
giro basale della coclea. Prima e dopo l’intervento vengono
somministrati corticosteroidi; durante l’intervento si applica
anche localmente del triamcinolone in soluzione cristallina,
per ridurre la fibrosi attorno all’elettrodo.
Per pazienti con una soglia alle alte frequenze inferiore ai 60
dB lo standard è rappresentato dagli apparecchi con ricevitore nel canale (RITE). Più problematici sono i pazienti con soglie sugli acuti comprese tra i 60 e i 90 dB. In assenza di aree
di coclea morta, sono indicati gli apparecchi acustici; in caso
contrario, bisogna abbassare le frequenze con la compressione o la trasposizione frequenziale, o amplificando selettivamente le frequenze medie. Con soglie superiori ai 90 dB alle
alte frequenze, in mancanza di beneficio da un apparecchio
acustico nelle forme non progressive, è necessario ricorrere a
un impianto cocleare (Figura 1).
15
REPORT C
Soglia alte frequenze:
<60 dB
Soglia alte frequenze:
60-90 dB
Aree di
coclea “morta”?
NO
Soglia alte frequenze:
>90 dB
SÌ
Retroauricolare “open”
(LF norm, HF <70 dB)
Retroauricolare
“frequency lowering” o
RITE con amplificazione
“selettiva” sui medi
Endoauricolare
(LF <40, HF <70 dB)
Retroauricolare RITE o
accoppiamento classico
(HF >70 dB)
NO
Buon
beneficio?
Impianto orecchio medio
NO
SÌ
Buon
beneficio?
Stimolazione elettro-acustica
(impianto cocleare ibrido)
Solo in forme non progressive
Stop
Il beneficio apportato da ogni
approccio riabilitativo deve
essere valutato per trovare
eventualmente un trattamento più adeguato. L’analisi della percezione uditiva in condizioni sfavorevoli di rapporto
segnale/rumore è sicuramente il metodo di valutazione più
efficace.
SÌ
Stop
Figura 1. Flow chart della gestione dell’ipoacusia ski slope
FLOW CHART NELLA GESTIONE DELLE SORDITÀ
MONOLATERALI
Nicoletta Tinelli
U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto - Piacenza
La sordità è definita monolaterale quando il paziente presenta un orecchio normoudente, mentre nel controlaterale si
rileva una perdita maggiore o uguale a 20 dB. Con una prevalenza pari a 1-3/1000, questo tipo di sordità rappresenta
un problema frequente, assimilabile, nelle sue manifestazioni
cliniche, alla sordità bilaterale lieve.1 Oggi lo screening neonatale consente di diagnosticare precocemente questa ipoacusia, che, in precedenza, era individuata solo in età scolare. La prematurità rappresenta una delle cause principali,
insieme a quelle genetiche (gene della connessina 26), e alle
malformazioni. La più comune causa di sordità congenita è
l’infezione da citomegalovirus. Si osservano anche sordità
improvvise o causate da meningiti, soprattutto di tipo batterico. L’ipoacusico monolaterale non beneficia dei vantaggi
dell’udito binaurale (effetto ombra della testa, localizzazione
dei suoni, effetto somma, effetto squelch) e questo incide in
particolare sulla vita dei bambini, che sviluppano il linguaggio con maggiore ritardo e difficoltà.
Le ipoacusie monolaterali possono essere gestite con l’utilizzo di sistemi FM, di protesi acustiche tradizionali, di protesi
CROS, BAHA, Bonebridge, TransEar, a conduzione ossea.
16
Il sistema FM può essere integrato in una protesi acustica,
accoppiato con un open fitting, o essere applicato all’orecchio normoudente. Particolarmente utile per la discriminazione del parlato nel rumore, può essere utilizzato in bambini
con sordità monolaterale o bilaterale lieve. Il sistema CROS
migliora la localizzazione. Il paziente identifica questo miglioramento con una diversa percezione della qualità del suono:
gli stimoli uditi dall’orecchio ipoacusico appaiono più metallici, rispetto a quelli percepiti dall’orecchio normoudente, e
questo favorisce la localizzazione. Il CROS non è indicato
per bambini molto piccoli. Il dispositivo BAHA è impiegato
nelle sordità monolaterali in bambini con più di cinque anni;
per i bambini di età inferiore si utilizza la versione Softband.
È accettato con facilità dai pazienti e discrimina bene il rumore, ma non migliora la localizzazione. La maggiore criticità si osserva quando segnale e rumore giungono al lato
protesizzato. Il quasi transcranial CROS è un apparecchio di
potenza che va applicato all’orecchio patologico, per trarre
vantaggio dalla trasmissione attraverso le coclee, e superare
l’attenuazione interaurale. Non utilizzato in Italia, il TransEar
è dotato di un vibratore osseo, posto nel condotto uditivo
T CORSO CRS
esterno: disponibile in diverse configurazioni, è in grado di
migliorare la localizzazione.
Generalmente i bambini sono individuati con lo screening
neonatale. Con un’otoemissione assente da un lato, si esegue l’ABR. Se l’esito è patologico, si procede con la valutazione audiologica, l’inquadramento genetico e quello radiologico, per accertare la presenza di malformazioni. Una volta
giunti a una diagnosi definitiva, s’individua il trattamento più
adeguato: se la perdita è protesizzabile, ci si orienta su una
delle soluzioni precedentemente descritte, in base alle caratteristiche del paziente.
Il trattamento dell’adulto segue uno schema simile a quello
descritto per il bambino, con le indagini audiologiche e ra-
diologiche, per individuare malformazioni o eventuali patologie neoplastiche. Si differenziano le ipoacusie trasmissive
miste da quelle neurosensoriali, gestibili, in alcuni casi, con
l’intervento chirurgico. La perdita può essere trattata con le
protesi acustiche tradizionali; se queste non sono indicate,
si può ricorrere alle protesi semi- o totalmente impiantabili,
o all’impianto cocleare, in casi selezionati. Un attento follow
up è fondamentale per verificare l’adeguatezza della protesi
adottata e l’eventuale progressione della patologia.
Bibliografia
1) Garland R, Ruder C. Understanding unilateral hearing loss in infants
and children and evidence based practice. OSHLA 2009
FLOW CHART NELLA GESTIONE DELLE SORDITÀ
ASIMMETRICHE
Alessandra Murri
U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto - Piacenza
Sono definite asimmetriche le ipoacusie in cui si evidenzia una
differenza binaurale nella soglia di conduzione ossea superiore a 10 dB a due frequenze consecutive, o superiore a 15
dB a una sola frequenza (0,25-8 kHz), oppure una differenza
superiore al 15% nella discriminazione del parlato. Le ipoacusie asimmetriche possono insorgere come risultato di vari
tipi di perdita uditiva, o possono rappresentare l’unica manifestazione di un neurinoma del nervo acustico, o di altre patologie, autoimmuni o demielinizzanti. Si possono osservare
forme asimmetriche anche nelle ipoacusie improvvise o nella
malattia di Ménière. È importante accertare con attenzione
le caratteristiche della perdita uditiva, la storia del paziente,
la presenza di familiarità, l’uso di farmaci, come gli antibiotici.
L’incidenza delle forme asimmetriche si attesta intorno al
55%.1 Secondo uno studio del 2011, il 94% dei medici sottopone a risonanza magnetica (RM) i pazienti con ipoacusia
asimmetrica, ma l’84% prende questa decisione solo per preoccupazioni di natura medico-legale.2 Lo stesso studio ha riscontrato, però, come solo il 48% delle RM eseguite su forme
asimmetriche abbia un esito anomalo. L’uso routinario della
RM in queste ipoacusie, dunque, non sembra essere supportato da solide evidenze scientifiche. Le ipoacusie asimmetriche comprendono forme trasmissive, miste e neurosensoriali:
in mancanza di un trattamento, si evidenzia una deprivazione
uditiva, per una riorganizzazione della neuroplasticità.
Le forme neurosensoriali vanno indagate approfonditamente,
anche con una valutazione genetica e uno studio neuroradiologico. Si possono avere forme stabili nel tempo o progressive:
in entrambi i casi, se indicato, si può applicare l’apparecchio
acustico tradizionale, mono- o bilaterale, il dispositivo semi- o
totalmente impiantabile, o il sistema Bi-cros, in conformità al
quadro clinico del paziente. È importante valutare il beneficio, in particolare in condizioni di rumore, integrando eventualmente con sistemi FM. Se nelle forme progressive non si
rileva un beneficio, o si riscontrano fluttuazioni della perdita
uditiva, acufeni, o una progressione verso le forme profonde,
può essere opportuno passare all’impianto cocleare.
Nella sordità asimmetrica trasmissiva o mista va inizialmente considerata l’opportunità di un intervento chirurgico. Se
il paziente lo rifiuta o non sussistono le indicazioni, si passa
alla protesizzazione acustica, con apparecchi tradizionali, dispositivi semi- o totalmente impiantabili, sistemi Bi-cros. Se
l’intervento non risolve l’ipoacusia, s’interviene con la protesizzazione, valutandone in seguito il beneficio in condizioni di
rumore, ed eventualmente ricorrendo a un dispositivo FM.
Anche per queste forme va comunque eseguito uno studio
neuroradiologico.
Nelle ipoacusie asimmetriche non è raro incontrare casi
con forme medie da un lato, e una sordità grave-profonda
nell’orecchio controlaterale. Si tratta generalmente di forme
fluttuanti, o progressive, determinate da malformazioni dell’orecchio interno o di origine autoimmune, con una pessima
capacità di ascolto in ambiente rumoroso, per le quali è probabilmente indicata una strategia terapeutica più aggressiva,
con l’utilizzo di un impianto cocleare.
Bibliografia
1) Margolis RH, et al. Asymmetric hearing loss: definition, validation, and
prevalence. Otol Neurotol 2008; 29(4): 422-31
2) Jiang ZJ, et al. Medicolegal concerns among neurotologists in ordering
MRIs for idiopathic sensorineural hearing loss and asymmetric sensorineural hearing loss. Otol & Neurotol 2011; 32:403-5
17
REPORT C
FLOW CHART NELLA GESTIONE DEGLI ACUFENI
Antonio De Caria
Centro per lo Studio e la Cura degli Acufeni U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto - Piacenza
In Italia il 5-7% della popolazione soffre di acufene cronico:
per la maggioranza di questi soggetti l’acufene non rappresenta un problema fastidioso, mentre nel 30% provoca un
evidente disagio, in particolare durante il sonno, ed è addirittura invalidante per il 10% dei pazienti. Inoltre, il 10% circa
dei casi risulta resistente a qualsiasi terapia. L’acufene incide sulla vita di relazione, sul riposo, sulla concentrazione e
l’attenzione, spesso determina una sensazione di distorsione dei suoni ed è associato a iperacusia, compromettendo
ancora di più la qualità di vita del paziente. La riabilitazione
riguarda, quindi, le problematiche audiologiche, neurologiche e psicologiche, senza trascurare nessun aspetto della
vita del paziente.
Il Centro per lo Studio e la Cura degli Acufeni (CeSCA), operativo dal 2004 presso il presidio Ospedaliero di Piacenza,
propone al paziente un training formativo, un percorso riabilitativo e diverse opzioni terapeutiche. Il protocollo prevede
un incontro preliminare di gruppo nel contesto del quale il
paziente compila una serie di questionari (Tinnitus Handicap
Inventory, Questionario di valutazione soggettiva dell’acufene, SCL-90R) e test (Scale analogico-visive).1
La valutazione complessiva dei risultati dei test e dei questionari determina l’attribuzione di un codice colore (verde-giallo-rosso) al paziente, in base alla gravità del quadro clinico:
si stabilisce così anche un ordine di priorità per l’accesso ai
trattamenti. Alla prima visita, si valuta la necessità di ulteriori
indagini diagnostiche (TC, RM) per escludere fattori organici
che possano aver causato l’acufene, si discute il risultato dei
test e dei questionari e si propone il percorso terapeutico
personalizzato (Figura 1).2
Visita specialistica
Test audiometrici
Test acufenometrici
Tinnitus Handicap Test
Controllo dei risultati
Imaging
Diagnosi finale
Protocollo riabilitativo
Codice verde
Counselling
Inform/Supp
Counselling
Inform/Supp
Codice giallo
Counselling
Inform/Supp
Sound Therapy
& Devices
Sound Therapy
& Devices
Emotional
control
Figura 1. Flow chart del protocollo CeSCA per la gestione e il trattamento dell’acufene2
18
Codice rosso
Emotional
control
Colloqui
psicologici
Visita
psichiatrica?
T CORSO CRS
Alcuni test strumentali cui sono sottoposti i pazienti forniscono indicazioni indispensabili per orientare nella terapia
(il pitch matching, valuta la frequenza dell’acufene, il loudness-match ne misura l’intensità), il minimum masking level
(MML) definisce il suono necessario per mascherare l’acufene del paziente. Se il valore dell’MML è compreso tra 0 e
3 dB, è molto alta la probabilità che il mascheramento sia
efficace. Con l’aumentare dell’MML, tale probabilità si riduce: per valori superiori a 10 dB il fallimento terapeutico del
mascheramento è praticamente certo. Questo incide anche
sull’inibizione residua, non utilizzabile con valori alti di MML.
Non va dimenticato il Loudness Discomfort Level, che rileva
l’intensità di un segnale acustico che risulta fastidioso.
Il Tinnitus Handicap Inventory (THI) rileva la severità del tinnitus, le tre Scale Analogico-Visive misurano la percezione
soggettiva dell’acufene, l’ansia e lo stato d’animo del paziente. Il Symptom Checklist 90 (SCL-90) valuta la presenza
di fobie, depressione, idee di morte, disturbi dell’alimentazione e altre problematiche relazionali in relazione o meno
con la percezione dell’acufene.
Dopo l’inquadramento inizia il ciclo riabilitativo che, generalmente, prevede da 2 a un massimo di 10 sedute, di almeno
30 minuti ciascuna e follow up ogni tre mesi.
Caposaldo del percorso terapeutico è il counselling proposto
a tutti i pazienti a prescindere dal codice di appartenenza.
La terapia del suono si diversifica a seconda che il paziente
sia normoacusico, ipoacusico e trattabile con gli apparecchi
acustici, o ipoacusico con la necessità di un impianto cocleare o di altri dispositivi. Nel paziente normoacusico con
la sound therapy si cerca di riorganizzare la mappa tonotopica, attraverso la nuova strategia della neuromodulazione
acustica condizionata, basata su esercizi di discriminazione
sonora che il paziente deve eseguire giornalmente. Se il paziente è ipoacusico, ove indicato, si consiglia l’applicazione
dell’apparecchio acustico, necessariamente di tipo open,
per evitare l’occlusione e per la maggiore efficacia sulle alte
frequenze, le stesse dove sono presenti la maggior parte
degli acufeni. Per i casi di sordità più grave può essere indicato l’impianto cocleare, che va applicato, se possibile,
sull’orecchio che percepisce l’acufene.
Per il controllo emozionale si ricorre a terapie utilizzate anche
in psicologia e psichiatria (Eye Movement Desensitization
And Reprocessing, mindfulness, terapia cognitivo-comportamentale, ipnosi), insieme a tecniche di rilassamento (rilassamento muscolare progressivo di Jacobson, distensione
immaginativa).
Negli anni si sono utilizzati molti tipi di farmaci (ansiolitici,
antidepressivi, diuretici, inibitori del glutammato, integratori), senza risultati risolutivi: nuovi agenti sono attualmente in
sperimentazione.
I pazienti con codice rosso oltre al counselling, alla sound
therapy e alla terapie per il controllo emozionale, effettuano
delle sedute psicoterapeutiche ed eventualmente una valutazione psichiatrica.
Alla fine della terapia i pazienti compilano questionari di valutazione finale e sono rivalutati dopo tre mesi.
Bibliografia
1) Newman CW, et al. Development of the Tinnitus Handicap Inventory.
Arch Otolaryngol Head Neck Surg 1996; 122(2):143-8
2) Cuda D, De Caria A, Frontera P, Mariani V. 2011
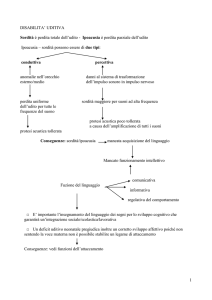
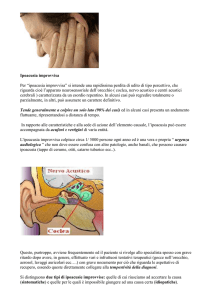
FLOW CHART NELLA GESTIONE DELL’ACUFENE
MONOLATERALE
Richard Tyler
Otolaryngology-Head and Neck Surgery Department, University of Iowa, Iowa City
L’acufene monolaterale desta preoccupazione se è associato a un caso di schwannoma vestibolare o a un tumore
vascolare. Allarmante, pur se a un livello diverso, è anche
la presenza di un acufene pulsante, una sordità improvvisa
o di sintomi vestibolari. Con un acufene pulsante si deve
considerare la possibilità di una anomalia vascolare o di
una patologia cardiovascolare sistemica, mentre i problemi
di equilibrio possono essere sintomo di una sottostante
sindrome di Ménière, di una deiscenza del canale semicircolare superiore, di uno schwannoma vestibolare, o di nu-
merose altre problematiche. Anche una sordità improvvisa
asimmetrica o monolaterale potrebbe essere associata a
uno schwannoma vestibolare. In alcuni pazienti la sordità
monolaterale è conseguente a un’esposizione al rumore:
in questi casi si eseguono ulteriori valutazioni cliniche, e
si verifica se l’acufene è problematico. Nel caso l’acufene crei disagio al paziente, si procede con il counselling
e la terapia del suono. Le tecniche d’imaging (TC, RM,
angiografia) possono definire meglio le problematiche, evidenziando le anomalie neurologiche. Se non sussistono
19
REPORT C
problemi di natura medica, si valuta se il paziente ha la necessità di un apparecchio acustico. Si procede allora con
una valutazione audiologica, verificando anche la presenza
di un’eventuale iperacusia.
In assenza di aspetti clinicamente rilevanti, occorre stabilire
se l’acufene monolaterale rappresenta un problema per il
paziente. Se il soggetto non è disturbato, basterà proseguire con dei controlli periodici; in caso contrario, si ricorre
al counselling e alla terapia del suono. I pazienti reagiscono all’acufene con comportamenti diversi: alcuni ne sono
incuriositi e richiedono solo informazioni di base, altri sono
preoccupati, altri ancora appaiono stressati. Nei casi meno
gravi può essere sufficiente il counselling, altrimenti si può
indirizzare il paziente da uno psicologo o uno psichiatra.
Con una prima valutazione si verificano alcuni aspetti della
personalità e dello stile di vita del paziente, e se ha già fatto
uso di terapie per l’acufene. Alcuni soggetti, col tempo, imparano a convivere con l’acufene, concentrandosi su altri
aspetti della loro vita. Altri pazienti non riescono ad adattarsi né a distogliere la loro attenzione dal disturbo: questo
crea ansia, depressione, stanchezza, che in un circolo vi-
4,2
13,7
14,1
52,4
15,7
20
zioso peggiorano ulteriormente l’acufene. Si illustrano poi
al paziente le possibili alternative terapeutiche, più adatte
al suo caso. Se necessario, s’indirizza il paziente ad altri
specialisti. Un utile strumento di valutazione sono i questionari aperti, con cui si può chiedere al paziente di elencare le difficoltà sperimentate con l’acufene. Esistono poi
questionari specifici, come il Tinnitus Handicap Questionnaire, per stabilire la gravità del disturbo e l’efficacia del
trattamento.1 Molto recente è il Tinnitus Primary Functions
Questionnaire, che riguarda i quattro principali aspetti colpiti dall’acufene (emozioni, udito, sonno, concentrazione).2
Il paziente può essere aiutato a controllare l’acufene anche
con i dispositivi di mascheramento. Se il tinnitus non è problematico, si valuta se il paziente è candidabile all’apparecchio acustico, con o senza il supporto di un mascheratore.
L’apparecchio acustico può mitigare gli effetti dell’acufene perché aiuta nella comunicazione, limitando lo stress
dell’ascolto, e amplifica il rumore di fondo, mascherando
almeno parzialmente il disturbo (Figura 1).3
È necessario che il fitting sia il migliore possibile e che i rumori di fondo siano amplificati a basso livello. Solitamente
si preferiscono apparecchi open ear, senza microfoni direzionali altamente focalizzati, e con guadagni elevati a basso livello.
I pazienti possono anche ricorrere alle terapie sonore, che si differenziano per il livello e la qualità del
suono utilizzato, la filosofia di base e i meccanismi
impiegati. Il suono può mascherare completamente o parzialmente l’acufene: nel secondo caso, se
il suono ha un livello inferiore e non interferisce con
la capacità uditiva, dovrebbe ridurre la prominenza
e l’intensità sonora dell’acufene, limitandone l’invadenza.
Peggioramento
Riduzione lieve
Nessun effetto
Riduzione moderata
Bibliografia
1) Kuk FK, et al. The psychometric properties of a tinnitus handicap questionnaire. Ear Hear 1990; 11(6): 434-45
2) Tyler R, et al. Development and validation of the Tinnitus Primary Function Questionnaire. American Journal of Audiology
2014; 23: 260-72.
3) Kochkin S, Tyler R, Born J. MarkeTrak VIII: Prevalence of Tinnitus and Efficacy of Treatments. The Hearing Review 2011;
18 (12): 10-26
Riduzione significativa
Figura 1. Efficacia degli apparecchi acustici
nell’attenuazione dell’acufene3
T CORSO CRS
FLOW CHART NELLA GESTIONE DELL’IPERACUSIA
Richard Tyler
Otolaryngology-Head and Neck Surgery Department, University of Iowa, Iowa City
Il paziente con iperacusia percepisce come molto intensi
suoni che in realtà non lo sono.
Esiste anche una forma di iperacusia in cui alcuni suoni
particolari risultano molto fastidiosi. Alcuni pazienti manifestano, invece, una paura nei confronti dei suoni, intensi o
meno, mentre in certe persone i suoni provocano addirittura
sensazioni di dolore fisico. Casi d’iperacusia si riscontrano
nella popolazione adulta e in quella pediatrica: nei bambini,
a volte, è associata alla sindrome di Williams o all’autismo.
Diverse problematiche mediche associate all’iperacusia
possono essere correlate all’autofonia, a una disfunzione
del riflesso stapediale o a una deiscenza del canale semicircolare superiore.
Le cause dell’iperacusia sono molte e in gran parte ancora
sconosciute: una delle principali è l’esposizione al rumore
(Figura 1).1
40
Numero di pazienti
30
20
10
0
Esposiz.
Esposiz.
Sordità
continua occasionale improvvisa
al rumore al rumore
Ansia
Terapie
farmacol.
Sordità
a lungo
termine
Sindrome Infezioni Invecchia- Traumi
di
dell’orecchio mento della testa
Ménière
e del collo
Infezioni/ Depressione Emicrania
virus
Altro
Figura 1. Cause dell’iperacusia1
Le condizioni cliniche associate all’iperacusia sono numerose e comprendono patologie otologiche, neurologiche, endocrine, congenite o di natura genetica, di origine infettiva,
correlate all’assunzione di farmaci o a carenze nutrizionali
(malattia di Lyme, malattia di Addison, depressione, fibromialgia, solo per citarne alcune). L’anomala percezione dei
suoni può essere associata anche a una reazione eccessiva
da parte degli altri organi di senso (fotofobia, osmofobia,
ipergeusia).
L’anamnesi del paziente può fornire indicazioni sull’eziologia
e indicare quali esami eseguire. La visita medica deve includere l’otoscopia tradizionale e pneumatica; si valuta, inoltre,
la presenza di vertigini e di un’eventuale disfunzione temporo-mandibolare. Se i pazienti provano dolore, potrebbe trattarsi di allodinia, di sindrome da dolore regionale complesso, di fibromialgia o di emicrania. Con l’esame del sangue
(emocromo completo, sodio, potassio, ormone tireotropo
e tiroxina libera) si possono individuare infezioni e patologie
endocrinologiche. Importanti sono anche le carenze di magnesio e vitamina B6, causa di sindromi correlate all’iperattività neurale, e i test sierologici. Con le tecniche d’imaging
si può valutare la deiscenza del canale semicircolare o la
paralisi facciale (TC), una malformazione vascolare durale
(angiografia) o un aneurisma della carotide (RM).2-4
Dopo aver escluso problemi di tipo medico, occorre verificare se il paziente è anche ipoacusico e se soffre di acufene: nel primo caso si valuta la necessità di un dispositivo
acustico, nel secondo occorre capire se si tratta di un acufene problematico. Nella maggioranza dei casi l’iperacusia
è associata a una lieve perdita uditiva. Non in tutti i casi
acufene e iperacusia sono concomitanti: si ritiene però che
i due fenomeni si basino su meccanismi comuni. Il paziente
21
REPORT C
iperacusico non è in grado di apprezzare la musica, tende a
isolarsi, evita i luoghi rumorosi; in presenza di acufene, non
riesce a beneficiare dei dispositivi di mascheramento, mentre se è ipoacusico, l’amplificazione dell’apparecchio può
peggiorare l’iperacusia.
Dopo una serie di domande a carattere generale e la somministrazione di un questionario aperto e di questionari specifici per l’iperacusia, si procede con la valutazione audiologica. L’apparecchio destinato a un iperacusico deve essere
regolato in modo specifico, abbassando l’uscita massima
eventualmente troppo elevata. Il paziente viene supportato
anche con il counselling, il sostegno psicologico, la terapia
del suono e forme di protezione uditiva. Il trattamento dell’iperacusia elaborato dal prof. Tyler prevede simulazioni dei
suoni che disturbano specificamente il paziente. Il suono
viene registrato, per essere riascoltato a casa, in una situa-
zione controllata e tranquilla; col tempo si aumenta l’intensità e la durata del suono, fino a poterlo risentire in una situazione reale.5
Bibliografia
1) Tyler RS. Hyperacusis Intake Questionnaire, The University of Iowa,
2007
2) Minor LB, et al. Symptoms and signs in superior canal dehiscence syndrome. Ann N Y Acad Sci 2001; 942: 259-73
3) Byl FM, et al. Auditory symptoms associated with herpes zoster or
idiopathic facial paralysis. Laryngoscope 1977; 87(3): 372-9
4) Weissman JL, Hirsch BE. Imaging of tinnitus: a review. Radiology 2000;
216(2): 342-9
5) Tyler RS, et al. (2009) Tinnitus and Hyperacusis In Katz J, Burkard R,
Medwetsky L, Hood L (Eds.) Handbook of Clinical Audiology, Sixth Edition. (2009) Baltimore: Lippincott Williams and Wilkins
FLOW CHART NELLA GESTIONE DEGLI ESITI DI
SORDITÀ IMPROVVISA
Nicoletta Tinelli
U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto - Piacenza
La sordità si definisce improvvisa se insorge entro un tempo
massimo di 72 ore, con una perdita di almeno 30 dB su
tre frequenze contigue. È un problema diffuso, idiopatico
nel 90% dei casi, frequentemente monolaterale. Alla sordità improvvisa spesso si associano acufene, ovattamento
e, in misura minore, vertigini, che rappresentano un fattore
prognostico negativo. Nel 50-60% dei casi l’ipoacusia si risolve spontaneamente, ma una sordità improvvisa può anche essere la prima avvisaglia di una neoplasia (neurinomi
del nervo VIII, tumori dell’angolo ponto-cerebellare): in questi casi la risonanza magnetica è fondamentale per evitare
diagnosi sbagliate. Data la natura idiopatica dell’ipoacusia
improvvisa, la terapia è sostanzialmente empirica. A oggi,
gli unici farmaci di cui è stata evidenziata l’efficacia sono i
cortisonici: uno studio recente ha proposto una terapia a
base di prednisone per via orale, a dosi piuttosto elevate
(1 mg/kg, fino a un massimo di 60 mg, per 10-14 gg).1 Si
è rivelata vantaggiosa anche la somministrazione intratimpanica di steroidi: per l’importante azione locale e i ridotti
effetti collaterali, è utilizzata come terapia di prima o seconda linea. Le diverse opzioni di trattamento comprendono
anche vasodilatatori, antivirali, diuretici, terapia iperbarica,
ma sono pochissimi gli studi che hanno adeguatamente evidenziato quali siano i trattamenti più validi. L’ossigenotera-
22
pia iperbarica è una strategia di trattamento non approvata
dalla FDA, ma che è sempre più diffusa in Europa, anche se
nessuno studio ha fornito dati solidi sulla sua reale efficacia.
Per questo l’Ospedale Guglielmo da Saliceto di Piacenza si
è reso promotore di uno studio multicentrico, randomizzato,
controllato, con l’obiettivo di valutare l’efficacia dell’ossigenoterapia iperbarica abbinata alla terapia cortisonica.
Dopo aver escluso la presenza di otiti o tappi di cerume, si
valuta se l’ipoacusia improvvisa sia fluttuante: se è così, altri
accertamenti permettono di escludere la malattia di Ménière
o patologie autoimmuni. In caso contrario, è probabile che
si tratti di una forma idiopatica: dopo aver eseguito una risonanza, per escludere altre patologie, il paziente viene trattato con una terapia steroidea. Ossigenoterapia iperbarica,
steroidi intratimpanici e plasmaferesi, rappresentano una
possibile alternativa. Al termine del trattamento, è necessario valutare nel tempo l’eventuale recupero: se il paziente
non evidenzia un miglioramento, inizia l’iter della protesizzazione.
Bibliografia
1) Stachler RJ, et al. Clinical practice guideline: sudden hearing loss. Otolaryngol Head Neck Surg 2012; 146(3 Suppl):S1-35
T CORSO CRS
FLOW CHART NELLA GESTIONE DELLE SORDITÀ
POST-FLOGISTICHE
Paolo Mochi
U.O. di Otorinolaringoiatria - Ospedale Guglielmo da Saliceto - Piacenza
Otite effusiva acuta e cronica, otite cronica semplice, timpanosclerosi a timpano aperto e chiuso, e otite cronica
colesteatomatosa sono le patologie associate alle sordità
post-flogistiche.
L’otite media effusiva colpisce il 90% circa dei bambini in
età prescolare e nel 90% dei casi determina un’ipoacusia,
trasmissiva o neurosensoriale. Nelle forme trasmissive si
osservano un essudato endotimpanico, un ridotto volume
aereo dell’orecchio medio, o variazioni patologiche delle
proprietà meccaniche del timpano. Le forme neurosensoriali si caratterizzano per il passaggio di agenti infiammatori
attraverso la membrana della finestra rotonda e per l’inibizione delle caratteristiche inerziali delle finestre ovale e
rotonda. Se l’otite media secretiva persiste da più di 4-6
mesi e si osserva un’ipoacusia superiore a 40 dB, se insorge in pazienti a rischio (sindrome di Down, malformazioni
cranio-facciali, palatoschisi) o se sono presenti alterazioni
strutturali del timpano (tasche di retrazione), è indicato il
drenaggio trans-timpanico.
Se la perdita uditiva è invece compresa tra i 21 e i 39 dB,
si valuta l’evoluzione nel tempo. Nei pazienti con sindrome
di Down, a fronte di una recidiva dopo il drenaggio, con la
compresenza di altri fattori (stenosi del condotto uditivo,
tappi di cerume, difficoltà di accesso alla membrana timpanica), può essere necessario valutare l’opportunità di una
protesi per via ossea.
Le patologie flogistiche croniche e le loro conseguenze
sulle strutture dell’orecchio possono essere trattate per via
chirurgica mediante la miringoplastica, la timpanoplastica
chiusa e le tecniche aperte (timpanoplastica aperta, radicale mastoidea classica e radicale mastoidea conservativa).
La riabilitazione uditiva può essere ottenuta con protesi
acustiche tradizionali o con dispositivi semi- o totalmente impiantabili. La protesizzazione tradizionale può essere
ostacolata da diversi fattori, alcuni dei quali sono una conseguenza degli interventi chirurgici (ampia meatoplastica,
flogosi del condotto uditivo, perforazione timpanica, otorrea, alterazioni del sistema di trasmissione).
Con esiti di miringoplastica sfavorevoli il paziente può accusare un’otite cronica semplice asciutta o secernente, con
una concomitante ipoacusia mista o trasmissiva. In questo
caso, sono indicate le protesi tradizionali per via aerea di
tipo open ear, ma in assenza di beneficio si può ricorrere
a dispositivi tradizionali o semi-impiantabili, per via ossea.
Se la miringoplastica ha esiti favorevoli, invece, il paziente può risultare normoacusico o manifestare un’ipoacusia
neurosensoriale, trasmissiva o mista. Per l’ipoacusia neurosensoriale è indicata una protesi tradizionale per via aerea,
o, in assenza di beneficio, si può passare a un dispositivo
semi- o totalmente impiantabile. La protesi per via aerea
può essere indicata anche per l’ipoacusia trasmissiva o mista: in mancanza di beneficio si può applicare una protesi
tradizionale o un dispositivo semi-impiantabile, entrambi
per via ossea.
Nei casi di otite cronica colesteatomatosa si può intervenire
chirurgicamente con tecniche chiuse o aperte: queste ultime possono esitare in cavità secche o umide. Con la tecnica chiusa si può manifestare un’ipoacusia neurosensoriale,
trasmissiva o mista. Data l’integrità del timpano, per queste
forme si può ricorrere alla protesi per via aerea o, in assenza di beneficio, a dispositivi semi- o totalmente impiantabili.
Dopo una tecnica aperta, con cavità asciutta, in presenza
di un’ipoacusia trasmissiva o mista, se l’apparecchio tradizionale per via aerea risulta inefficace, le possibili alternative
sono l’apparecchio per via ossea, il dispositivo semi-impiantabile per via ossea, o la protesi acustica semi- o totalmente impiantabile. Lo stesso iter può essere seguito se
l’ipoacusia è di tipo neurosensoriale: a fronte, però, di un
mancato beneficio dei dispositivi impiantabili, si può ricorrere all’impianto cocleare.
In caso di cavità umida, si può proporre una revisione chirurgica: se l’intervento ha effetto, si ripercorre il percorso
sopra descritto. In caso contrario o se l’intervento è rifiutato
dal paziente, permane una cavità umida. Con un’ipoacusia
neurosensoriale, è indicata una protesi acustica per via aerea di tipo open ear, con ampio foro di ventilazione, o con
protocollo d’uso. In assenza di beneficio, si può proporre
una protesi semi- o totalmente impiantabile, seguita da un
impianto cocleare in caso d’insuccesso. L’impianto cocleare può essere indicato anche dopo revisione chirurgica di
dispositivi impiantabili non adeguatamente utilizzati.
Anche in caso d’ipoacusia trasmissiva o mista, si può utilizzare una protesi acustica per via aerea di tipo open ear, con
ampio foro di ventilazione, o con protocollo d’uso. In alternativa possono essere indicati un apparecchio acustico per
via ossea, un dispositivo semi-impiantabile per via ossea,
o la revisione chirurgica per applicare una protesi acustica
semi- o completamente impiantabile.
23