Lab di organica 3 ocb
IPSIA PONTI Gallarate
a.s. 2010/11
ALCHENI
INTRODUZIONE TEORICA:
Gli alcheni ( oleofine ) sono composti nei quali il carbonio è ibridato sp2. Ogni orbitale
forma con quelli vicini angoli di 120°. Tra due atomi di carbonio è presente un doppio legame
formato da un legame di tipo e da una nube elettronica ad esso perpendicolare che corrisponde
al legame ; questo è, perciò, formato dall'orbitale p non ibridato che si sovrappone ad un altro
orbitale p non ibridato dell'atomo di carbonio vicino. La formula generale è CnH2n. Hanno
comportamento apolare. Gli alcheni da C2 a C4 sono gassosi; quelli da C5 a C16 liquidi e solidi i
termini superiori.
Le reazioni degli alcheni comportano, in genere, la rottura del legame, addizionando ioni o
radicali. Sono possibili reazioni di ossidazione con ossidanti forti.
In queste note sono trattate, in generale, le reazioni facilmente eseguibili in laboratorio, ovvero le
reazioni di ossidazione a glicoli e di addizione di alogeni.
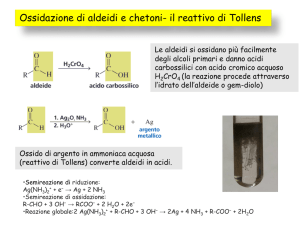
SAGGIO DI BAYER (OSSIDAZIONE)
ossidazione a glicol dell' 1-ottene :
In una provetta porre 3 o 4 mL di permanganato di potassio sol. 0.001 M ed alcalinizzare con 2 o 3
gocce di idrossido di sodio sol, 1 M; si aggiunge, infine, 1 mL di 1-ottene (in alternativa si può
usae della benzina super) ed agitare.
In breve si osserva la scomparsa della colorazione viola, con comparsa di un colore bruno tenue;
ciò indica l'avvenuta riduzione del Mn7+ a Mn4+ con contemporanea ossidazione dell'1-ottene a
glicol ottilenico
( 1,2-ottandiolo ) con la reazione:
H2C
CH3
CH3
oct-1-ene
+ KMnO4
OH OH
octane-1,2-diol
Se la reazione venisse condotta a pH acido, il permanganato ossiderebbe ulteriormente i dioli e la
reazione proseguirebbe con la rottura del legame carbonio-carbonio e la formazione di acidi
carbossilici
Nota: la comparsa di una colorazione verdastra indica che non è avvenuta una completa riduzione del
Mn7+ a Mn4+ ma, una parziale riduzione a Mn6+. Questo può essere dovuto o ad una concentrazione
molare di KMnO4 troppo elevata o ad una basicità troppo accentuata. Quest'ultima situazione provoca,
infatti, uno stabilizzarsi del Mn6+.
Per ovviare a quanto sopra conviene ripetere l'esperienza con soluzione di permanganato più diluita ed
alcalinizzando meno. Al limite, può favorire la reazione un blando riscaldamento al bunsen.
Mauro Sabella
www.smauro.it
[email protected]
Lab di organica 3 ocb
IPSIA PONTI Gallarate
a.s. 2010/11
SAGGIO DEL BROMO
Inserire in una provetta da saggio 0,5 mL di 1 ottene, aggiungere 1 mL di diclorometano (va anche bene in
tetraclorometano),.
Mescolare il tutto e successivamente aggiungere, goccia a goccia, una soluzione di bromo in diclorometano.
La soluzione di bromo è colorata di rosso/marrone, dopo aver reagito con un alchene formerà un alogenuro
alchilico incolore.
CH2=CH-(CH2)5-CH3 + Br2 CH2-CH-(CH2)5-CH3
1ottene
1,2 dibromoottano
Br Br
SPETTRI IR DEGLI ALCHENI
Mauro Sabella
www.smauro.it
[email protected]
Lab di organica 3 ocb
IPSIA PONTI Gallarate
a.s. 2010/11
Realizzare lo spettro IR del 1,2 ottandiolo, del 1 ottene e del 1,2 dibromoottano.
Confrontare le differenze.
Mauro Sabella
www.smauro.it
[email protected]