1
Idrocarburi
policiclici
aromatici
CAP.III
Arilammine
Riduzione mediata
da batteri intestinali
Ossidazione
mediata dal
citocromo P450
Derivati
elettrofili
arilanti
Arilazione di
acidi nucleici e
proteine
Nitrati
Nitriti
Radicali
liberi
Composti
nitrosi
Alchilazione
di DNA e/o
proteine
Metaemoglobina
Mutagenesi, carcinogenesi,
teratogenesi, effetti
immulogici, morte cellulare
Anossia dei
tessuti e
morte
PRINCIPI
GENERALI DI
TOSSICOLOGIA
AMBIENTE/UOMO
Il presente capitolo si avvale del materiale scientifico sviluppato
e messo cortesemente a disposizione dal Prof.Renato Baudo
dell’Istituto del CNR di Pallanza
2
3.0.0.0.- TORs – Termini di riferimento
Effetto ed esposizione
Si definisce:
VELENO: qualsiasi sostanza che, tramite interazioni fisico-chimiche con
tessuti viventi, può causare danni e/o morte dell’organismo
Ne consegue che:
Tutte le sostanze sono veleni potenziali, perché tutte possono produrre
danni agli organismi in conseguenza di una esposizione eccessiva.
Già Paracelso, infatti, riconosceva che: Dosis sola facit veleno
Ad esempio, è risaputo che 1-2 cucchiaini di arsenico possono essere letali
per un uomo. Ma anche 300 g del comune sale da cucina, o meno di 1 kg di
zucchero, ingeriti tutti in una volta, sono sufficienti a determinarne la morte.
D’altra parte:
tutte le sostanze sono sicure, se l’esposizione è contenuta entro limiti
tollerabili.
Il concetto chiave è quindi quello di esposizione.
ESPOSIZIONE: funzione della quantità (o concentrazione) della sostanza,
della sua forma, del tipo di somministrazione e del tempo di interazione con
l’organismo
Più precisamente, una esposizione eccessiva produce un effetto avverso,
mentre una esposizione tollerabile non produce alcun effetto avverso.
Tuttavia, per la stessa sostanza, e a parità di esposizione, l’effetto può
essere diverso per organismi diversi.
In particolare, un effetto avverso è rappresentato da qualsiasi cambiamento
anormale, indesiderabile, o dannoso, in un organismo esposto ad una sostanza
potenzialmente
tossica.
L’effetto
avverso
estremo
comporta
la
morte
dell’organismo, mentre effetti avversi meno severi comprendono una alterazione
3
del consumo di cibo, del peso corporeo o di alcuni organi, cambiamenti patologici
visibili, od anche una alterazione dei livelli enzimatici.
Un cambiamento statisticamente significativo dallo stato “normale” non
configura però necessariamente un effetto avverso; per diventare tale, l’effetto
deve alterare una proprietà importante ed essere posto in relazione allo stato
complessivo di salute dell’organismo esposto.
Effetti
Si può dunque definire, più in generale, l’effetto dannoso:
Effetto dannoso: causa danni funzionali o anatomici, cambiamenti
irreversibili dell’omeostasi, o aumenta la suscettibilità ad altre sostanze o allo
stress biologico, comprese malattie infettive (l’entità del danno è influenzata dallo
stato di salute dell’organismo)
La figura 1 rappresenta graficamente importanti differenze degli effetti indotti
da sostanze dannose. Innanzi tutto, la sostanza dannosa può produrre effetti
reversibili (l’effetto non si manifesta più quando cessa l’esposizione), oppure
irreversibili (l’effetto dell’esposizione causa danni permanenti anche quando
l’esposizione è cessata).
In alcuni casi (Fig. 1), l’effetto può essere diverso durante una prima
esposizione e nelle esposizioni successive dell’organismo alla stessa sostanza. È
quanto si verifica se l’organismo è in grado di sviluppare meccanismi adattativi
(l’effetto è molto più marcato con la prima esposizione, mente in seguito è
necessaria una esposizione superiore per determinare lo stesso effetto), oppure
nei fenomeni di sensibilizzazione (un organismo, esposto per la prima volta ad una
sostanza,
sopporta
l’esposizione
senza
mostrare
effetti
significativi,
ma
successivamente gli effetti sono molto più marcati già ad esposizioni ridotte; è il
caso ad esempio delle sostanze allergizzanti).
4
Irreversibile
Esposizione
Esposizione
Reversibile
Adattamento
Effetto
Esposizione
Esposizione
Effetto
Sensibilizzazione
Effetto
Effetto
Fig. 1 – Diversi tipi di risposta (effetto) in funzione dell’esposizione.
Un caso particolare è rappresentato dagli elementi essenziali: un elemento X
è considerato essenziale se un organismo non può crescere o completare il suo
ciclo vitale in sua assenza; non può essere sostituito da un altro elemento; ha una
influenza diretta ed è coinvolto nel metabolismo dell’organismo (Bowen, 1979).
In questo caso(Fig. 2), si hanno effetti dannosi se l’esposizione non
raggiunge almeno un livello minimo, ma l’organismo funziona “normalmente” per
esposizioni superiori a questo minimo. In alcuni casi, tuttavia, superata una
determinata esposizione massima tollerabile, si ripresentano effetti dannosi
(eventualmente diversi da quelli in condizioni di carenza).
Esposizione
5
Effetto
Fig. 2 – Risposte per elementi essenziali
Tra gli elementi essenziali si contano ovviamente C, H, N, O, P e S,
costituenti fondamentali della materia viventi; inoltre, sono probabilmente
essenziali per tutte le piante Ca, Cl, Co, Cu, Fe, K, Mg, Mn, Na, Se e Zn; per alcuni
organismi, anche se non necessariamente per tutti: B, I, Si; ancora da verificare:
As, Br, Cr, F, Ni, Sn, V (Bowen, 1979)
Relazioni di causa ed effetto
Avendo stabilito che una causa, l’esposizione, può determinare un effetto, è
necessario precisare come la causa determina un effetto. È necessario cioè
definire in termini quantitativi questa relazione. Va innanzi tutto precisato che una
associazione statisticamente significativa tra esposizione (causa) e risultato
(effetto) non stabilisce necessariamente una relazione causa – effetto.
Ad esempio, in estate ci può essere una correlazione tra vendita di gelati e
scottature solari, ma in questo caso evidentemente l’effetto (= scottatura) non
dipende dal consumo di gelati !
L’associazione può essere casuale (fortuita: evento improbabile ma
comunque possibile), oppure essere spiegata da un elemento confondente, cioè
un elemento associato indipendentemente tanto all’esposizione che all’effetto (il
tempo assolato causa indipendentemente il consumo di gelati e le scottature
solari).
Bisogna inoltre tener conto del possibile errore sistematico: bias di
selezione, quando il campione non è rappresentativo, e bias di osservazione,
quando i dati raccolti hanno un vizio di fondo (bias dell’osservatore = osservatore
non obiettivo, esempio indagine solo in agosto; bias di ricordo = soggetti che
rispondono in maniera viziata alle condizioni di esposizione, esempio albini golosi).
6
Alcuni criteri guida possono essere utili nell’impostare l’esperimento,
soprattutto per escludere che l’associazione osservata sia dovuta a fattori casuali:
Forza dell’associazione
(nei soggetti osservati l’effetto deve essere
abbastanza forte da poter essere distinto dalla risposta del gruppo di controllo)
Consistenza
(esperimenti diversi portano agli stessi risultati)
Specificità (l’effetto si manifesta solo in seguito all’esposizione)
Temporaneità
(la causa deve precedere l’effetto)
Gradiente biologico
(effetto proporzionale dose - risposta)
Plausibilità biologica
(l’esperimento è plausibile se è ipotizzabile un
meccanismo di azione della causa)
Coerenza (il risultato non deve essere in contrasto con informazioni
pregresse)
Esperimento
Analogia
(la rimozione della causa elimina l’effetto)
(altre cause, simili a quella investigata, determinano lo stesso
effetto)
Assumendo che il test programmato sia realizzato opportunamente, si
incontra qui per la prima volta una differenza sostanziale tra Tossicologia ed
Ecotossicologia.
Nella prima, basata essenzialmente su animali, e sull’uomo solo in casi
particolari (esposizioni accidentali, ricerche su volontari ma, purtroppo, in qualche
caso anche su soggetti inconsapevoli), la causa viene quantizzata con la dose:
Dose: quantità della sostanza (fornita con l’esposizione) per unità di massa
corporea (mg/kg) Ö LDn
In Ecotossicologia, è invece forse più utilizzata la concentrazione:
Concentrazione: quantità della sostanza (fornita con l’esposizione) per
unità di massa del veicolo (mg/L, mg/kg) Ö LCn
Tradizionalmente, i primi studi hanno preso in considerazione solitamente gli
effetti estremi, in grado cioè di provocare la morte di soggetti esposti. Il piano
sperimentale prevede in questo caso di sottoporre alcuni soggetti a dosi crescenti
di una sostanza e di contare, per ogni dose e per controlli non esposti, il numero
dei morti.
7
La relazione causa – effetto assume allora la forma rappresentata in figura
3, dove si può distinguere, in particolare, la dose mediana letale. Sulla base di un
campione finito di soggetti, Questo tipo di rappresentazione permette di interpolare
la dose in grado di provocare la morte del 50 % degli organismi esposti; per
inferenza, si assume che questa dose sarebbe in grado di provocare la stessa
% Risposta (Mortalità)
100
Sostanza B
Sostanza A
50
LDn: Dose
della sostanza
che determina
la morte per n %
degli organismi
esposti
0
LD50
Dose
LD50: dose mediana letale. Singola dose, statisticamente
calcolata, che si prevede determini la morte del 50 % degli
organismi esposti in definite condizioni sperimentali
percentuale di morti nella popolazione di soggetti.
Fig. 3 – Relazione dose – mortalità.
Il grafico indica anche che due sostanze diverse possono (ma non
necessariamente) avere la stessa LD50, ma la relazione causa – effetto indica che
una sostanza (A) ha effetti letali anche quando l’altra sostanza (B) non ha un
effetto misurabile. Al contrario, la sostanza B ha un effetto letale superiore della
sostanza A a dosi più elevate (naturalmente, questa è una rappresentazione molto
semplificata, intesa a mettere in evidenza che la LD50, da sola, non è sufficiente a
caratterizzare completamente la relazione causa – effetto. Sostanze diverse
possono ovviamente avere curve simili, ma ampiamente sfasate).
8
In Ecotossicologia, si ottengono curve dello stesso tipo (Fig. 4), ma
sostanzialmente diverse in quanto descrivono la relazione causa – effetto in
funzione
della
concentrazione
dell’esposizione
al
mezzo
di
Threshold
(soglia):
100
% Risposta (Mortalità)
(riferita
concentrazione (o
dose) minima
necessaria per
indurre un effetto
rilevabile
(impossibile da
misurare con
certezza)
50
0
Threshold
LCn LC50
LOEL: livello al quale è stato osservato il più piccolo effetto
(differenza dal controllo statisticamente significativa)
NOEL: livello al quale non è stato osservato un effetto
(differenza dal controllo non statisticamente significativa)
somministrazione), invece che alla dose (riferita al soggetto che la riceve).
Fig. 4 – Relazione concentrazione – mortalità.
In questo caso, sulla base del confronto statistico tra esposti e controlli, è
possibile identificare una “soglia” (threshold) minima, al di sotto della quale non si
osserva una mortalità statisticamente significativa, alla quale corrisponde una
concentrazione NOEL (livello al quale non si osserva un effetto). La
concentrazione LOEL è invece il livello minimo per il quale viene osservato un
effetto statisticamente significativo.
Entrambi questi valori sono però ampiamente criticati, perché legati al piano
sperimentale: le concentrazioni LOEL e NOEL sono semplicemente identificate
con le concentrazioni sperimentalmente utilizzate e non con punti reali della
relazione causa – effetto. Ad esempio, se la sperimentazione prevedeva
concentrazioni (unità arbitrarie) pari a 1000, 500, 250, 125, 62,5 e 0 (controllo) e
se l’analisi statistica indica che la concentrazione 62,5 non è distinguibile dal
controllo, ma la concentrazione 125 dà un effetto statisticamente significativo, si
avrebbe LOEL = 125 e NOEL = 62,5. Non si ha però nessuna indicazione nel
9
campo compreso tra 62,5 e 125. Una successiva sperimentazione, con
concentrazioni 100 – 75 – 50, 25, 0, potrebbe, infatti, produrre una NOEL di 25 ed
una LOEL di 75, e così via cambiando il piano sperimentale.
Per lo stesso motivo, anche il valore soglia è impossibile da determinare
sperimentalmente.
Questo tipo di rappresentazione ha comunque il vantaggio di poter
confrontare la tossicità di sostanze diverse (Fig. 5).
7000
3000
1500
1000
100
100
60
10
1
0,1
0,02
Tetrodotossina
Nicotina
DDT
CuSO4
NaCl
Etanolo
0,01
0,02
Diossina
mg/kg peso corporeo
10000
Fig. 5 – Confronto tra LD50 per l’uomo di diverse sostanze.
In effetti, è stata utilizzata per cercare almeno di stabilire una scala relativa
di tossicità per le varie sostanze. Nella Direttiva Comunitaria su Classificazione,
Imballaggio ed Etichettatura dei prodotti chimici, recepita in Italia con il Decreto
Legislativo 3 febbraio 1997 N° 52, ad esempio, vengono indicati dei valori (Tab. 1)
che consentono di classificare le diverse sostanze in 3 categorie, in funzione della
loro LD50 quando somministrate oralmente a ratti (dose espressa in mg kg-1 di
peso corporeo).
Questa categorizzazione è abbastanza arbitraria e non completamente
soddisfacente: ad esempio, una sostanza con LD50 = 200 è classificabile come
tossica, mentre un’altra con LD50 = 199 è “solo” dannosa.
10
In effetti, per un’applicazione concreta che dia garanzie di salvaguardia, è
necessario introdurre un altro concetto, quello di rischio:
Rischio: frequenza prevista o osservata (probabilità) con la quale una
sostanza può indurre danni o effetti inaccettabili quale risultato di una esposizione
di organismi o ecosistemi suscettibili
Non è sufficiente che una sostanza dimostri di poter produrre un effetto;
questa sostanza deve avere una probabilità (misurabile) di raggiungere
l’organismo bersaglio nelle dosi che determinano gli effetti avversi.
Il caso tipico è quello di sostanze che manifestano un effetto avverso solo a
concentrazioni superiori al loro prodotto di solubilità: è praticamente impossibile
che, in un’acqua potabile, raggiungano dunque concentrazioni tanto elevate da
danneggiare l’organismo che la beve.
Pertanto:
Una sostanza può essere ritenuta “sicura” quando c’è una elevata
probabilità che l’esposizione non provochi danni
La misura del valore di LD50 non è certamente sufficiente per garantire che
una sostanza sia sicura. È necessario almeno stimare la dose corrispondente ad
una mortalità “accettabile”, alla quale non corrisponde un “danno”. Ad esempio, un
agricoltore può ritenere accettabile che, trattando con un diserbante il suo campo,
ottenga una germinazione soltanto dell’80 % dei semi utilizzati (rispetto ad un
campo non trattato), perché comunque la resa del raccolto risulterà superiore che
in un campo infestato da altre erbe. È cioè preparato ad accettare una LD20 (il 20
% dei semi non germina).
In generale, è dunque necessario definire il:
Rischio accettabile: Probabilità che il danno possa essere tollerato da un
individuo, un gruppo, o dalla società. La valutazione dipende dai dati scientifici, ma
la sua accettabilità è influenzata da fattori sociali, economici e politici
Se invece di un agricoltore ed il suo portafoglio è necessario proteggere
invece la salute umana, non solo non è sufficiente garantire una dose il più vicina
possibile a LD0 (non siamo disposti ad accettare nemmeno 1 morto su 1 milione),
ma dobbiamo anche cercare di evitare altri possibili danni non letali. Viene dunque
superata la verifica della mortalità, ritenuta non sufficiente in quanto non dà
indicazioni su eventuali effetti sub-letali, per investigare invece il maggior numero
possibile di relazioni causa – effetto che possono determinare effetti avversi.
Nel caso dell’acqua potabile, il Safe Drinking Water Committee della U.S.
National Academy of Sciences nel 1977, dovendo fissare una soglia di rischio ha
deciso di adottare questi criteri:
11
Quando il pericolo non può essere valutato con precisione, per stimare una
concentrazione “sicura” si divide la NOEL (no observed effect level) per un fattore
di incertezza pari a:
•10, quando non esistono validi dati di esposizione cronica per umani;
•100, quando i dati sugli umani non sono conclusivi (ad esempio, limitati
esposizioni acute), ma esistono dati attendibili per una o più specie animali;
•1000, quando non esistono dati a lungo termine, non sono disponibili dati
su umani e sono scarsi anche quelli su animali
Tipi di effetto
Il tipo di effetto dipende non solo dall’esposizione, ma anche dal tipo di
esposizione: questa può essere singola (quando l’organismo è esposto una sola
volta alla sostanza potenzialmente tossica); ripetuta (più esposizioni in tempi
successivi), o cronica (l’organismo è costantemente sottoposto alla sostanza).
Bisogna poi distinguere tra effetti locali (dove vengono applicate le sostanze)
ed effetti sistemici (l’organo bersaglio, nel quale cioè si manifesta l’effetto avverso,
può essere diverso da quello di assorbimento): le sostanze corrosive, ad esempio,
hanno sempre effetto locale; le sostanze irritanti hanno spesso effetto locale, ma in
qualche caso possono aver un effetto sistemico su organi o tessuti bersaglio
diversi dal sito di assorbimento; altre sostanze, infine, come il Pb tetraetile, hanno
sia un effetto locale (per contatto sulla pelle) che un effetto sul sistema nervoso
centrale, dopo assorbimento e trasporto.
Per alcune sostanze, per le quali l’assorbimento supera l’escrezione, si
osserva un bioaccumulo, nell’intero corpo o in particolari parti. Di per sé, questo
non può essere considerato un effetto avverso: i tessuti adiposi possono
accumulare grandi quantità di pesticidi organoclorurati, senza riceverne un danno.
L’effetto avverso si manifesta invece nel caso in cui l’accumulo comporti il
raggiungimento, in una determinata componente, di una concentrazione
sufficientemente elevata da alterare una funzione essenziale di tale componente.
Al contrario, gli effetti di una sostanza possono essere cumulativi, anche
quando la sostanza stessa non viene accumulata (esempio: effetto dei pesticidi
organofosforati sul sistema nervoso).
Gli effetti di una sostanza possono anche non essere immediati, ma ritardati:
è il caso (già citato) della sensibilizzazione ad un allergene (effetto: allergia), o più
in generale delle sostanze mutagene, teratogene, carcinogene (esempio: cancro
12
vaginale in giovani donne le cui madri sono state esposte al dietilstilbestrolo
durante la gravidanza).
Come si è visto per le modalità di azione, si distinguono poi effetti reversibili
ed irreversibili: molti effetti sul fegato sono reversibili, perché ha una grande
capacità di rigenerazione, mentre per il sistema nervoso centrale, che ha una
limitata capacità di rigenerazione, la maggior parte degli effetti che comportano
cambiamenti morfologici sono irreversibili ed il recupero, anche nel migliore dei
casi, è limitato (per alcuni effetti irreversibili, ad esempio carcinogenesi e
teratogenesi, un opportuno trattamento può però limitare la severità dell’effetto).
L’interpretazione dei risultati è poi particolarmente complicata quando si ha
una esposizione multipla, dando luogo ad interazioni di tipo additivo, sinergico,
potenziante o antagonista.
In pratica, l’esposizione contemporanea a due o più sostanze produce un
effetto complessivo pari, superiore, o inferiore alla somma degli effetti che
produrrebbero indipendententemente le due o più sostanze Il primo caso è quello
dell’effetto della sostanza A (pari a 1) che si somma all’effetto della sostanza B
(pari a 5), producendo un effetto complessivo pari a 6 (effetto additivo): pesticidi
organofosforati.
Altri casi possibili sono:
1 + 5 = 10 (effetto sinergico): fibre di asbesto + fumo di sigarette aumenta di
40 volte il rischio di cancro)
0 + 5 = 20 (effetto di potenziamento): isopropanolo (a concentrazioni non
dannose) aumenta i danni al fegato prodotti dal tetracloruro di carbonio
1 + 5 = 2 (effetto antagonista): il selenio aumenta la tolleranza al mercurio
In sostanza, la manifestazione di un effetto dipende da un complesso
bilancio tra assorbimento ed escrezione, danno esercitato e eventuali processi
metabolici di riparazione o alleviamento del danno.
Per questo, non sempre da esperimenti semplici è possibile predire con
certezza l’effetto finale. Da questo bilancio può, infatti, talvolta risultare una:
Tolleranza: diminuita sensibilità ad una sostanza a seguito di una
esposizione a tale sostanza o ad altre sostanze con una struttura simile
Od anche una:
13
Resistenza: quasi completa insensibilità ad una sostanza (solitamente
riflette una capacità metabolica di inattivare ed eliminare rapidamente la sostanza
ed i suoi metaboliti)
Vie di esposizione
Particolarmente importante risulta essere la via di esposizione alla sostanza
potenzialmente tossica, che dipende soprattutto dalla sua forma. Come è risaputo,
possono causare danni i solidi (una tegola in testa), i liquidi (annegamento) i gas
(gas asfissianti possono causare la morte semplicemente perché manca
l’ossigeno). Ma la tossicologia si occupa “solo” di “veleni”: trascurando i casi di
danneggiamento fisico, va ricordato allora che:
una sostanza può causare danni solo se raggiunge una parte sensibile
di un organismo con una concentrazione sufficientemente elevata e per un
sufficiente tempo di esposizione.
I veleni possono ancora essere distinti in liquidi, gas, vapori, aerosol, polveri,
fumi, …, perché in ciascuna di queste forme può esistere un’esposizione in grado
di causare effetti avversi:
-
per inalazione (vie respiratorie: gas, vapori, polveri, nell’uomo tra 0,5 - 10
-
per ingestione (tratto gastro-intestinale: solidi e liquidi)
-
topica (superficie di contatto: anilina, HCN, steroidi, Hg organico,
µm)
nitrobenzene, composti organici fosforati, fenolo, ...)
Poiché la forma di un veleno dipende dalle condizioni ambientali, in
particolare temperatura e pressione, anche i suoi effetti tossici possono variare con
le condizioni ambientali (mercurio liquido o gassoso; amianto solido o in particelle
respirabili, ecc.), che devono quindi essere specificate quando si presentano dati
di tossicità.
Il tipo di esposizione condiziona in particolare il destino della sostanza nel
corpo dell’organismo esposto (Fig. 6), perché diversi possono essere i meccanismi
di assorbimento, distribuzione ed escrezione.
Dopo l’assorbimento, il metabolismo delle diverse sostanze dipende invece
dalle loro proprietà chimicofisiche, ad esempio dal loro carattere idrofilo o polare
(Fig. 7): sostanze solubili in acqua, o dissociate in composti polari, entrano
direttamente nella circolazione sanguigna e, se facilmente vaporizzabili, possono
essere espirate attraverso i polmoni, oppure escrete nell’urina o in altri fluidi
(lacrime, saliva, latte, sudore, ecc.)
14
Le sostanze lipofile (Fig. 8) e metabolicamente stabili, in genere tendono
invece ad essere accumulate nel grasso corporeo: ma, in condizioni di stress,
possono essere rimesse in circolo e provocare intossicazioni acute e/o dar luogo,
nel fegato e altri organi, a due tipi di reazioni:
Inalazione
Ingestione
Topico
Naso o
Bocca
Bocca
Tratto gastrointestinale
Polmoni
Circolazione
enteroepatica
Fegato
Reni
Polmoni
Vescica
Aria espirata
Fluidi
extracellulari
Capelli
Unghie
Sangue e
linfa
Bile
Feci
Grasso
Organi
Pelle
Tessuti
molli
Ossa
Ghiandole
secretive
Sudore, latte,
saliva, lacrime
Urina
Fig. 6 – Assorbimento, distribuzione ed escrezione di una sostanza.
Sostanze
idrofile
Sostanze
polari
Dissociate
Circolazione
sangue
Proprietà
lipofile
Polmoni
Reni
Aria
espirata
Indissociate
Urine
lacrime
saliva
sudore
latte
capelli
pelle
Fig. 7 – Metabolismo di sostanze idrofile e polari.
Linfatico
Tessuto
Adiposo
15
Reazioni Fase 1: sono catalizzate dalla famiglia del citocromo P450 e da
altri enzimi del reticolo endoplasmatico liscio (ossidazioni, riduzioni, idrolisi,
dealchilazioni, deaminazioni, dealogenazioni, formazioni e rottura di anelli)
Reazioni Fase 2: reazioni di coniugazione - formazione di legami covalenti
delle sostanze assorbite o dei loro prodotti nelle reazioni di Fase 1 con composti
quali glutatione, acido glucuronico o aminoacidi. I coniugati, solitamente più solubili
in acqua delle sostanze di partenza, sono più facilmente escreti nella bile. Alcuni
possono essere separati nei loro componenti dai batteri nell’intestino ed essere
riassorbiti.
In alcuni casi, la biotrasformazione delle sostanze può ridurre la loro
tossicità: un caso di detossificazione è rappresentato dal cadmio, che induce la
sintesi di metallotioneine (proteine che legano i metalli), aumentando la tolleranza
a questo tossico (ma, a lungo andare, l’accumulo nei reni causa comunque una
nefrotossicità).
Sostanze
lipofile
Sostanze
altamente lipofile
Legame con cellule del sangue,
albumina, lipoproteine, cellule
linfatiche, proteine linfatiche
Reazioni Fase 1
Reazioni Fase 2
Prodotti solubili in acqua
Circolazione sangue
Escrezione renale
Localizzazione fisica,
accumulo nei tessuti adiposi
Circolazione
sangue
Escrezione
nella bile
Latte
Riassorbimento
intestinale
Passaggio
attraverso
intestino
Idrolisi
Escrezione
fecale
Fig. 8 – Metabolismo di sostanze lipofile.
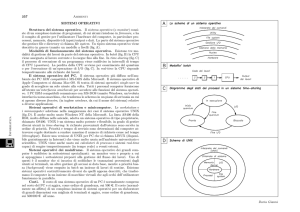
In altri casi (ad esempio agenti arilanti, alchilanti, o metalli) la
biotrasformazione può invece portare ad alterazioni strutturali o delle proteine (Fig.
9) che aumentano la tossicità, fino a vere e proprie biotossificazioni (Fig. 10): gli
idrocarburi policiclici aromatici vengono convertiti in derivati arilanti, che
interagiscono con DNA e proteine, causando mutazioni, cancro, teratogenesi,
sensibilizzazione del sistema immunitario, morte cellulare; le arilammine,
16
trasformate in arilidrossilammine, convertono l’emoglobina in metaemoglobina,
incapace di trasportare l’ossigeno; i nitrati, assunti tramite la dieta, nell’intestino
vengono ridotti (da batteri) in nitriti e in presenza di sostanze contenti
amminogruppi, in nitrosammine; gli stessi nitriti possono anche convertire
l’emoglobina in metaemoglobina (questa reazione spiega la cosiddetta “sindrome
del bambino blu”: mescolando latte in polvere con acqua troppo ricca in nitrati, si
formano nitriti e metaemoglobina ed i tessuti vengono privati dell’ossigeno).
Fig. 9 – Biotrasformazioni possibili.
Agenti arilanti
o alchilanti
Metalli
Radicali liberi
Escrezione
Legame
covalente con
acidi nucleici e
proteine
Chelazione e
legame covalente
con acidi nucleici
e proteine
Riparazione
DNA
Alterazioni struttura
producono alterate
funzioni
Alterazione DNA
produce mutazioni
Alterazione RNA
funzioni anormali
Accumulo nelle
ossa, se
chimicamente
simile al calcio
Rilascio per
stress, malattia o
vecchiaia
Alterazione proteine
funzioni anormali,
antigeni
Un caso speciale è quello delle “sintesi letali”, esemplificato da un comune
ratticida, l’acido fluoroacetico: attraverso la trasformazione in acido fluorocitrico e
all’inibizione
dell’aconitasi,
provoca
determinando la morte dei ratti.
il
blocco
del
ciclo
dell’acido
citrico,
17
Fig. 10 – Biotossificazione.
Idrocarburi
policiclici
aromatici
Arilammine
Riduzione mediata
da batteri intestinali
Ossidazione
mediata dal
citocromo P450
Nitriti
Radicali
liberi
Derivati
elettrofili
arilanti
Arilazione di
acidi nucleici e
proteine
Nitrati
Composti
nitrosi
Alchilazione
di DNA e/o
proteine
Mutagenesi, carcinogenesi,
teratogenesi, effetti
immulogici, morte cellulare
Metaemoglobina
Anossia dei
tessuti e
morte
Riassumendo, la produzione di un effetto tossico passa attraverso tre fasi
(Fig. 11): una fase chimica, o di esposizione; una fase tossicocinetica, di
trasformazione, e una fase tossicodinamica.
Fase chimica
(esposizione)
Fase tossicocinetica
Sostanza
potenzialmente
tossica
Biotrasformazioni
Assorbimento
Formulato
o derivati
Fase tossicodinamica
Iniziatore della
tossicità
Reazione in
siti chiave
Circolazione
Tossicità
Legame ai
tessuti
Circolazione
Escrezione
18
Fig. 11 – Fasi nella produzione di tossicità
Nella fase tossicodinamica gli iniziatori della tossicità (che possono essere i
tossici di partenza o i loro metaboliti) interagiscono in siti chiave e danno inizio ai
processi che si manifestano con gli effetti tossici veri e propri.
Se il sito chiave è:
-
un particolare organo, si può avere una alterazione della funzionalità,
potenzialmente culminante con la morte;
-
il DNA, una mutazione in una cellula somatica può degenerare in un
tumore; in una cellula germinale produrre effetti teratogeni;
-
il sistema immunitario, la riduzione delle difese può portare a asma, riniti,
congiuntiviti, anemia emolitica, dermatiti da contatto, …