Esercitazioni di Elementi di Chimica
Modulo 3 Trasformazioni della Materia
Esempi di quiz a risposta multipla e questionari a completamento
L’esame finale sarà composto da problemi simili
Quale/i dei seguenti è/sono processi chimici?
1. arrugginimento di un chiodo
2. congelamento dell'acqua
3. decomposizione dell'acqua nei gas idrogeno e ossigeno
4. compressione del gas ossigeno
A) 2, 3, 4
B) 1, 3, 4
C) 1, 3
D) 1, 2
E) 1, 4
Risposta: C
Nel seguente elenco, solo __________ non è un esempio di una reazione chimica.
A) la combustione di una bottiglia di plastica
B) la produzione di gas idrogeno dall'acqua
C) l'ossidazione di un centesimo di rame
D) il taglio di un tronco in segatura
E) la ricarica di un telefono cellulare
Risposta: D
La frase "il simile dissolve il simile" si riferisce al fatto che __________.
A) I gas possono sciogliere solo altri gas
B) solventi polari dissolvono soluti polari e solventi non polari dissolvono soluti non polari
C) i solventi possono dissolvere solo soluti di massa molare simile
D) fasi condensate possono dissolvere solo altre fasi condensate
E) solventi polari dissolvono soluti non polari e viceversa
Risposta: B
Una soluzione satura __________.
A) contiene più solvente di quanto potrebbe contenere
B) non contiene doppi legami
C) contiene soluto disciolto in equilibrio con soluto indisciolto
D) si formerà rapidamente un precipitato se viene aggiunto un seme cristallino
E) non può essere ottenuta
Risposta: C
1
In una soluzione satura di un sale in acqua, __________.
A) la velocità di cristallizzazione > la velocità di dissoluzione
B) la velocità di dissoluzione > la velocità di cristallizzazione
C) l’aggiunta di un seme cristallino può causare una massiccia cristallizzazione
D) la velocità di cristallizzazione = la velocità di dissoluzione
E) l’aggiunta di altra acqua provoca una massiccia cristallizzazione
Risposta: D
Una soluzione insatura è una soluzione che __________.
A) non ha doppi legami
B) contiene la massima concentrazione possibile di soluto, ed è in equilibrio con il soluto indisciolto
C) ha una concentrazione del soluto inferiore alla sua solubilità
D) contiene più soluto disciolto rispetto alla solubilità permessa
E) non contiene soluto
Risposta: C
Una soluzione con una concentrazione superiore alla solubilità __________.
A) non è possibile
B) è insatura
C) è supercritica
D) è satura
E) è super-satura
Risposta: E
All'equilibrio __________.
A) tutte le reazioni chimiche sono cessate
B) le velocità delle reazioni diretta ed inversa sono uguali
C) le costanti di velocità delle reazioni diretta ed inversa sono uguali
D) il valore della costante di equilibrio è 1
E) il reagente limitante è stato consumato
Risposta: B
Quale delle seguenti perturbazioni cambierà il valore di una costante di equilibrio?
A) la variazione della temperatura
B) l'aggiunta di altre sostanze che non reagiscono con una qualsiasi delle specie coinvolte nell'equilibrio
C) la variazione delle concentrazioni iniziali di reagenti
D) la variazione delle concentrazioni iniziali di prodotti
E) la variazione del volume del recipiente di reazione
Risposta: A
Quale delle seguenti affermazioni non descrive lo stato di equilibrio?
A) L'equilibrio è dinamico e non esiste alcuna conversione netta di reagenti e prodotti.
B) La concentrazione dei reagenti è uguale alla concentrazione dei prodotti.
C) La concentrazione dei reagenti e dei prodotti si mantiene ad un valore costante.
D) La velocità della reazione diretta è uguale alla velocità della reazione inversa.
Risposta: B
2
I seguenti diagrammi rappresentano la reazione di A2 (sfere ombreggiate) con B2 (sfere bianche). Identificare il
reagente limitante e scrivere una equazione bilanciata per la reazione.
A) A2 è il reagente limitante; A + B → 3 AB3.
B) A2 è il reagente limitante; A2 + 3 B2 → 2 AB3.
C) B2 è il reagente limitante; A + B → 3 AB3.
D) B2 è il reagente limitante; A2 + 3 B2 → 2 AB3.
Risposta: D
Lo schema seguente rappresenta la reazione di A2 (sfere bianche) con B (sfere ombreggiate). Qual è l'equazione
chimica bilanciata per questa reazione, e chi è il reagente limitante?
A) 2 A2 + B → A4B; A2 è il reagente limitante.
B) 2 A2 + B → A4B, B è il reagente limitante.
C) 4 A2 + 6 B → 2 A4B, A2 è il reagente limitante.
D) 4 A2 + 6 B → 2 A4B, B è il reagente limitante.
Risposta: A
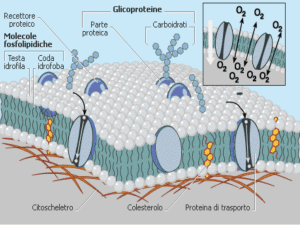
In una soluzione, il solvente:
A) è un liquido
B) può essere un liquido o un gas
C) può essere un liquido, un solido o un gas
D) non è mai un solido
Risposta: C
In una soluzione che si ottiene per diluizione di una soluzione più concentrata:
A) il volume della soluzione non cambia
B) la concentrazione della soluzione non cambia
C) la massa del solvente non cambia
D) il numero di particelle del soluto non cambia
Risposta: D
L’acqua si decompone in idrogeno e ossigeno per:
A) riscaldamento
B) riscaldamento prolungato
C) elettrolisi
D) separazione su colonna cromatografica
Risposta: C
3
Quando le concentrazioni dei reagenti diminuiscono, la velocità di reazione si abbassa perché:
A) le particelle si muovono troppo lentamente per dare luogo d urti efficaci
B) l’energia di attivazione aumenta
C) diminuisce la frequenza degli urti non efficaci
D) diminuisce la frequenza degli urti efficaci
Risposta: D
Un acido secondo Bronsted-Lowry è definita come una sostanza che può:
A) accettare uno ione idrossido
B) donare uno ione idrossido
C) accettare un protone
D) donare un protone
Risposta: D
Quando si forma una generica soluzione acquosa, l’acqua:
A) si comporta da sostanza neutra
B) si comporta da sostanza acida
C) si comporta da sostanza basica
D) si comporta da sostanza neutra, acida o basica a seconda del tipo di sostanza con cui viene formata la soluzione
Risposta: D
Una cella elettrochimica:
A) permette la separazione dei composti nei propri elementi
B) sfrutta reazioni acido-base per produrre elettricità
C) sfrutta l’elettricità per produrre reazioni di ossidoriduzione
D) sfrutta reazioni di precipitazione per produrre elettricità
Risposta: C
Se una reazione raggiunge l’equilibrio:
A) si interrompe tutta la reazione
B) la reazione non è più reversibile
C) le concentrazioni dei reagenti e dei prodotti rimangono costanti
D) le concentrazioni dei reagenti e dei prodotti rimangono uguali
Risposta: C
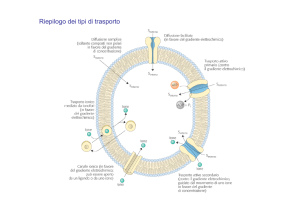
Indica l’affermazione corretta:
A) osmosi e pressione osmotica sono la stessa cosa
B) la pressione osmotica è una proprietà colligativa
C) l’osmosi è una proprietà colligativa
D) nell’osmosi la membrana è permeabile alle particelle di soluto
Risposta: B
Una base secondo Bronsted-Lowry è definita come una sostanza che può:
A) accettare uno ione idrossido
B) donare uno ione idrossido
C) accettare un protone
D) donare un protone
Risposta: C
4
Quale delle seguenti affermazioni è vera?
A) la solubilità di un gas non dipende dalla temperatura o dalla pressione.
B) la solubilità di un gas è fortemente dipendente dalla pressione.
C) la solubilità di un gas è altamente dipendente da pressione e temperatura.
D) la solubilità di un gas è altamente dipendente dalla temperatura.
Risposta: C
Una soluzione è formata a temperatura ambiente sciogliendo vigorosamente abbastanza soluto solido in modo che
rimanga indisciolto del solido nella parte inferiore della soluzione. Quale affermazione di seguito è corretta?
A) la soluzione è insatura.
B) la soluzione è sovrassatura.
C) la soluzione è satura.
D) nessuna delle precedenti.
Risposta: C
Quale delle seguenti affermazioni è corretta?
A) un equilibrio dinamico indica che la quantità di reagenti e prodotti sono uguali.
B) la costante di equilibrio per la reazione diretta è uguale alla costante di equilibrio della reazione inversa.
C) un equilibrio dinamico si verifica quando la velocità delle reazioni diretta ed inversa sono uguali.
D) tutte le precedenti sono vere.
Risposta: C
Scegliere quale tra le seguenti affermazioni è corretta.
A) una soluzione si forma tra due sostanze se le interazioni soluto-solvente sono di forza comparabile alle interazioni
soluto-soluto e solvente-solvente.
B) una soluzione si forma tra due sostanze, se le interazioni soluto-solvente sono abbastanza piccole da essere
superate dalle interazioni soluto-soluto e solvente-solvente.
C) una soluzione si forma tra due sostanze se le interazioni soluto-soluto sono abbastanza forti da superare le
interazioni solvente-solvente.
D) una soluzione si forma tra due sostanze solo se le interazioni solvente-solvente sono abbastanza deboli da essere
superate dalle interazioni soluto-solvente.
Risposta: A
Individuare la proprietà colligativa.
A) tensione superficiale.
B) punto di congelamento.
C) punto di ebollizione.
D) pressione osmotica.
E) viscosità.
Risposta: D
5