Microrganismi
• I microrganismi sono organismi viventi
estremamente piccoli, microscopici,
unicellulari
• I microrganismi si trovano in quasi tutti gli
ambienti naturali
I batteri si suddividono in:
Gram-positivi
Gram-negativi
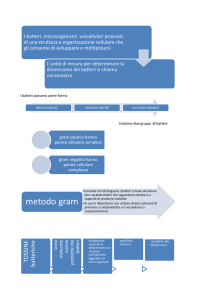
Colorazione di Gram
• La colorazione di Gram è un esame di laboratorio che
permette la classificazione dei batteri in Gram-positivi e
Gram-negativi.
• Fu messo a punto dal medico danese Hans Joachim
Christian Gram (1884), e mette in evidenza alcune proprietà
fondamentali della parete cellulare dei BATTERI.
STRUTTURA DELLA PARETE CELLULARE BATTERICA
STRUTTURA DELLA PARETE CELLULARE BATTERICA
Step 1
Versa 1-2 gocce di campione su
un vetrino. Spargilo uniformemente
sul vetrino per formare una pellicola
sottile. Lascialo asciugare all'aria.
Step 2
Con il caldo puoi fissare la
pellicola, facendo passare
velocemente il vetrino due o tre
volte su una fiamma. Non
scaldarlo troppo, per evitare la
distorsione del campione
Step 3
Bagna il campione con del
cristalvioletto. Attendi 30 secondi. In
soluzioni acquose il cristalvioletto si
dissocia in CV+ e ioni di cloro (Cl-).
Questi ioni penetrano le pareti e le
membrane delle cellule Gram-positive
e Gram-negative. Lo ione CV+
interagisce con le componenti cariche
negativamente delle cellule batteriche
per tingerle di viola.
Step 4
Lava via delicatamente il
cristalvioletto con dell'acqua
del rubinetto. Non usare troppa
acqua, o rischierai di rimuovere
le macchie dei batteri grampositivi.
Step 5
Bagna il campione con dello
iodio. Lascialo riposare per almeno
3 secondi. Lo iodio, in forma di ioni
caricati negativamente, interagisce
con il CV+ per formare grandi
complessi di cristalvioletto e iodio
(complessi CV-I) negli strati interni
ed esterni delle cellule. Lo iodio
agisce come agente fissante per il
colore viola delle cellule.
Step 6
Lava via delicatamente lo iodio
con dell'acqua del rubinetto
Step 6
Decolora il campione aggiungendo alcol tenendo il
vetrino inclinato, in modo da far defluire subito il
liquido. Interrompi l'operazione quando il liquido
residuo è trasparente. Il passaggio di decolorazione è
fondamentale e deve essere eseguito nei tempi giusti.
Se lascerai l'agente decolorante troppo a lungo sul
campione rimuoverai le macchie viola sia dalle cellule
gram positive che da quelle gram negative. Il
decolorante, interagisce con i lipidi della membrana
cellulare batterica. Un batterio gram-negativo perderà
la sua membrana esterna, permettendo la fuoriuscita
dei complessi CV-I. Al contrario, una cellula grampositiva diventerà disidratata in seguito al trattamento
con etanolo, intrappolando i complessi CV-I all'interno
della parete cellulare peptidoglicolica multistrato del
batterio. Dopo la decolorazione, le cellule grampositive rimarranno viola e quelle gram-negative
perderanno il colore.
Step 7
Lava delicatamente via il
decolorante con dell'acqua del
rubinetto
Step 8
Bagna il campione con della
safranina di contrasto. Attendi 30
secondi. Il liquido di contrasto viene
applicato per ultimo per macchiare
con un colore rosso o rosa i batteri
gram-negativi decolorati. E'
possibile sostituire alla safranina
della fucsina basica, che macchia in
modo più intenso i batteri
anaerobici, ma si tratta di una
soluzione meno usata.
Step 9
Lava via delicatamente la
safranina in eccesso con
dell'acqua del rubinetto
Step 10
Lascia asciugare all'aria il vetrino
dopo aver scolato l'acqua . La
colorazione è terminata.
Step 11
Esamina il vetrino sotto la luce
del microscopio. I batteri grampositivi saranno viola, perché
macchiati dal cristalvioletto, che è
intrappolato all'interno delle loro
spesse pareti cellulari. I batteri
gram-negativi saranno rosa, perché
macchiati dalla safranina di
contrasto, dal momento che le loro
sottili pareti cellulari non sono state
in grado di trattenere i cristalvioletti
durante la decolorazione.
RISPOSTA DELLA PARETE BATTERICA ALLA
COLORAZIONE DI GRAM
I batteri si suddividono in:
Gram-positivi
Gram-negativi
•
•
•
•
•
•
I batteri possono essere ulteriormente classificati sulla base della loro forma al
microscopio, più comunemente come cocchi (sferici) o bastoncelli (cilindrici).
Le specie di batteri più comuni in ognuno dei quattro gruppi individuati da questa analisi
sono le seguenti:
I cocchi gram-positivi sono generalmente Stafilococchi (che significa cocchi in gruppi)
o Streptococchi (che significa cocchi in catene).
I bastoncelli gram-positivi includono Bacillus, Clostridium, Corynebacterium, e Listeria.
I cocchi gram-negativi sono più comunemente Neisseria.
I bastoncelli gram-negativi sono suddivisi ulteriormente come segue:
– Bastoncelli gram-negativi coccoidi (o coccobacilli) che includono
Bordetella, Brucella, Haemophilus, Pasteurella.
– Gli altri bastoncelli gram-negativi includono E. coli, Enterobacter,
Klebsiella, Citrobacter, Serratia, Proteus, Salmonella, Shigella, Pseudomonas, e molti
altri
Cinetica della divisione cellulare
La curva di crescita
• Osservata quando i microrganismi vengono coltivati in terreno liquido (brodo)
• Misura la variazione della “quantità” (massa totale o concentrazione) di batteri
nel tempo:
• rappresentazione grafica di tipo “semilogaritmica”
• Log (concentrazione cellulare espressa come Log10 CFU/ml, dove CFU=
unità formanti colonie) vs tempo
• Generalmente, si articola in 4 fasi (periodi) distinte e sequenziali
Fase di latenza (lag phase)
•
Fase di adattamento metabolico:
• Sintesi di nuovi enzimi per il metabolismo cellulare
• Sintesi di nuovi componenti strutturali cellulari
•
•
Numero cellulare costante; lieve aumento volumetrico
Durata variabile (specie-specifica):
• in alcuni casi può essere di breve durata od assente
Fase esponenziale (log phase)
• Tutti i microrganismi sono in fase di riproduzione attiva
•
•
Gli eventi riproduttivi (di ciascuna cellula della popolazione) non avvengono nello
stesso tempo (coltura non sincronizzata)
Velocità di crescita costante nel tempo:
•
•
Aumento del numero cellulare
Aumento della massa cellulare totale
• Popolazione uniforme per proprietà chimico-fisiche
• Chiamata anche fase logaritmica
Fase stazionaria
• Numero totale di cellulare vitali rimane costante:
•
•
Arresto della riproduzione
Tasso riproduttivo controbilanciato dal tasso di mortalità
• Possibili cause:
•
•
•
•
Raggiungimento di una densità critica di popolazione
Accumulo dei cataboliti (azione tossica)
Limitazione dei nutrienti
Limitata disponibilità di O2
Fase di morte (declino)
• Morte cellulare a velocità esponenziale
• Morte: perdita irreversibile della capacità di riprodursi
• In alcuni casi, il tasso di mortalità rallenta e causa un
accumulo di cellule resistenti
PREPARAZIONE DEI TERRENI PER LA
COLTIVAZIONE DEI BATTERI
I terreni sono dei particolari substrati
utilizzati per l'allestimento delle
colture batteriche.
I batteri sono dei microorganismi
presenti ovunque suolo, aria, cibi e
su tutte le superfici.
TERRENI DI COLTURA
I terreni di coltura si dividono in due grandi categorie:
• Liquidi in presenza di germi possono dar luogo a intorbidimento,
sedimentazione, pellicola superficiale o sviluppo di gas.
• Solidi si ottengono per opportuna aggiunta di agar in terreni liquidi.
Questi terreni non consentono movimento al microorganismo che di
conseguenza è costretto a crescere nel punto ove è stato seminato. Le
singole colonie possono essere catalogate in base alla loro forma, colore,
superficie, margine, aspetto e grandezza
A sua volta i terreni si possono dividere in:
• Generici che vengono utilizzati per la crescita di una vasta gamma di
mocroorganismi
• Specifici che vengono utilizzati per il riconoscimento e l'isolamento di
determinati batteri
Semina su piastre di agar
CHEMIOTERAPIA (definizione)
Paul Ehrlich, 1910
Disciplina farmacologica volta alla ricerca
di sostanze chimiche artificiali e naturali dotate di
tossicità selettiva nei confronti degli agenti
responsabili di infezioni, infestioni, neoplasie o
disordini immunologici
SI DISTINGUONO, IN FUNZIONE DEI DIVERSI BERSAGLI, TRE
SETTORI DELLA CHEMIOTERAPIA:
1) ANTIMICROBICA
2) ANTIBLASTICA
3) IMMUNOMODULANTE
La scoperta della penicillina
La storia degli antibiotici ha inizio nel 1928,
quando Fleming, studiando varianti dello
stafilococco, osservò che una muffa che
contaminava una delle sue culture aveva
inibito intorno a sé la crescita dello
stafilococco.
Alexander Fleming
6 August 1881 – 11 March 1955
Inoltre, Fleming potè osservare che il
brodo di coltura in cui erano cresciuti
i funghi possedeva un potente effetto
inibitorio nei confronti di molti
microrganismi.
Poiché la muffa apparteneva al genere
Penicillum, Fleming chiamò questa
sostanza antibatterica PENICILLINA
Penicillium notatum
Cos’è un farmaco antibatterico
AGENTE ANTIBATTERICO
Composto in grado di interferire con la crescita e la
moltiplicazione
batterica;
contrariamente
al
disinfettante,
è
attivo
solo
verso
batteri
metabolicamente attivi
ANTIBIOTICO
Molecola naturale a basso P.M., prodotta dal
metabolismo
di
un
microrganismo:
Actinomiceti
(Streptomyces),
Miceti
(Penicillium, Cephalosporium), in grado di
inibire la crescita di altri microrganismi e/o
causarne la distruzione
CHEMIOTERAPICO
Farmaco ad attività antibatterica prodotto per
sintesi chimica (analogo strutturale di un
antibiotico)
Caratteristiche ideali di un agente antimicrobico
• Adeguata attività antimicrobica
• Scarsa o nulla attività sulla flora commensale e sui
meccanismi di difesa dell’ospite
• Tossicità selettiva
• Attivo a basse concentrazioni
• Stabile, economico, facilmente somministrabile
• Raggiunge adeguate concentrazioni tissutali
• Assenza di effetti collaterali e/o sistemici
• Assenza di resistenze nella popolazione microbica
Numero di nuovi farmaci antibatterici
Numero di nuovi farmaci antibatterici approvati dalla
“Food and Drug Administration” dal 1983 ad oggi
18
16
14
12
10
8
6
4
2
0
1983-1987
1988-1992
1993-1997
1998-2002
Anni
Spellberg B et al., Clin Infect Dis, 2004; Fox JL, Nature Biotechnology, 2006
2003-2007
Meccanismo di azione degli antibiotici
Inibitori della DNA Topoisomerasi
Chinoloni
2-Piridoni
Antibiotici attivi a
livello della membrana
cellulare
Polimixine
Defensine
Magainine
Membrana cellulare
Inibitori della sintesi dell’RNA
Rifamicine
DNA
DHFA
RNA
THFA
30S —
50S —
Ribosomi
Inibitori del metabolismo
folico dipendente
Sulfonilamide
Trimetoprim
Chu DTW e coll., 1996
Parete
cellulare
Inibitori della sintesi della
parete batterica
Penicilline
Bacitracina
Cefalosporine
Vancomicina
Monobattami
Teicoplanina
Carbapenemi
Cicloserina
Ramoplanina
Fosfomicina
Sintesi proteica
inibitori della subunità 30S
Tetracicline
Glicilcicline
Aminoglucosidi
inibitori della subunità 50S
Macrolidi
Cloramfenicolo
Lincosamidi
Streptogramina B
Altri inibitori
Oxazolidinoni
GE-2270A (EF-Tu)
Everninomicina
Antibiotico-resistenza
Uno stipite batterico è resistente ad un farmaco quando:
• è in grado di moltiplicarsi in presenza di concentrazioni di farmaco che
risultano inibitorie per la massima parte degli stipiti della stessa specie
• è in grado di moltiplicarsi in presenza di concentrazioni del farmaco pari
a quelle massime raggiungibili nel corso dell’impiego terapeutico
• L’antibiotico resistenza è una proprietà geneticamente trasmissibile del
microrganismo.
Significato “clinico” della resistenza
I ceppi resistenti sopravvivono in presenza di concentrazioni raggiunte in
vivo a livello sierico dall’antibiotico in seguito a somministrazione di
normali dosi terapeutiche.
La resistenza predice il possibile fallimento della terapia antibiotica
Misura della sensibilità batterica ad un antibiotico:
MIC e MBC
Il metodo più corretto per determinare l’efficacia di un
antibiotico nei confronti di un microrganismo consiste nello
stabilire, per ogni farmaco antibatterico:
• la concentrazione minima inibente (MIC)
• la concentrazione minima battericida (MBC).
Questo metodo permette di stabilire una scala di attività
dell’antibiotico per diverse specie batteriche.
Test di antibiotico-sensibilità
Definizioni
MIC
Minimal Inhibitory Concentration: è una misura quantitativa
dell’attività di un antibiotico verso un determinato batterio.
Definita come la più bassa concentrazione di antibiotico in
grado di inibire la crescita batterica visibile.
MBC
Minimal Bactericidal Concentration: è definita come la più
bassa concentrazione di antibiotico in grado di inibire la
crescita batterica di almeno il 99,9% (1 germe su 1.000 elude
l’azione antibiotica) della popolazione iniziale.
CLSI
Clinical and Laboratory Standard Institut: pubblica i criteri per
l’interpretazione dei risultati dei tests di sensibilità (categorie
interpretative).
Preparazione della MIC
Preparare una serie di provette contenenti terreno con diverse
concentrazioni di antibiotico, ed inocularle con quantità convenzionali
(5 x 105 cfu/ml) dell’organismo da testare.
Incubare le provette (37°C, 18-24h).
La MIC è data dalla concentrazione più bassa di antibiotico che porta
ad assenza di crescita dopo 18-24 ore di incubazione
Preparazione della MBC
E’ invece possibile calcolare la MBC se le provette che non presentano
crescita sono sottoposte a subcultura in terreno fresco privo di antibiotico:
la concentrazione più bassa di antibiotico alla quale il microrganismo non
è in grado di crescere quando viene trasferito in terreno fresco equivale
alla MBC
Test di antibiotico-sensibilità
Categorie interpretative
• Le categorie interpretative
– Sensibilità,
– Sensibilità Intermedia
– Resistenza
sono individuate da valori di MIC detti BREAKPOINTS (soglia,
limite)
• I valori standard di sensibilità variano per ciascun
microrganismo e sono basati sulla concentrazione plasmatica
di farmaco che può essere raggiunta senza la comparsa di
effetti tossici.
Breakpoint
• I breakpoints per la categorizzazione (S, I, R)
vengono individuati dalla CLSI e determinati sulla
base della:
– FARMACOCINETICA e FARMACODINAMICA degli
ANTIBIOTICI (livelli raggiunti in vivo nel sangue e tessuti
dall’antibiotico)
– ATTIVITA’ CLINICA mediante correlazione tra risultati in
vitro (MIC) e risultati in vivo (risoluzione del caso clinico).
Diffusione in agar
Antibiogramma
Vanno allestite piastre con idoneo terreno solido sulle
quali viene successivamente inoculata una quantità di
batteri sufficiente a dare uno sviluppo confluente
generando una patina uniforme sul terreno
Diffusione in agar
Antibiogramma
Deporre sulla superficie della piastra, con l’aiuto di una pinzetta
sterile, una serie di dischetti di carta assorbente imbevuti con
adatte concentrazioni degli antibiotici che si desidera testare.
Incubare le piastre a 37°C per 18-24 ore.
Diffusione in agar
Antibiogramma
Misurare il diametro degli aloni di inibizione
formatisi per ogni antibiotico
Interpretazione dei risultati
MICRORGANISMO
SENSIBILE
MICRORGANISMO
con RESISTENZA